Пухлини гепатопанкреатодуоденальної зони
Содержание
КОРОТКИЙ АНАТОМО-ФІЗІОЛОГІЧНИЙ НАРИС
Печінка — найбільший орган людини. Маса її 1200–1500 г, що становить ¹/₅₀ маси тіла. Печінка розміщена у правому верхньому квадранті живота й прикрита ребрами. ЇЇ верхня межа розташована на рівні сосків. Анатомічно в печінці виділяють праву та ліву частку, а також хвостову частку на задній поверхні та квадратну частку на нижній поверхні. Печінка отримує кров з двох джерел: ворітна вена (80% крові) несе кров із кишечнику та селезінки, а печінкова артерія (20% крові) забезпечує надходження артеріальної крові у печінку. У середньому хвилинний об’єм крові, що проходить через ворітну вену, становить 1,0–1,5 л. Ворітна вена та печінкова артерія входять у печінку через ворота печінки, де кожна з них поділяється на праву та ліву часткові гілки, а права та ліва жовчні протоки об’єднуються та утворюють загальну жовчну протоку.
Більша частина печінки вкрита очеревиною. Серпоподібна зв’язка — місце переходу парієтальної очеревини на діафрагмальну поверхню печінки (рис. 11.1).
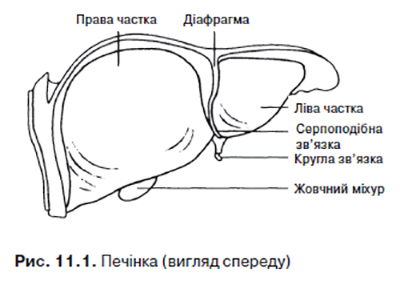
Венозна зв’язка — тонкий залишок венозної (Аранцієвої) протоки плода, що відходить від лівої гілки ворітної вени та зливається з нижньою порожнистою веною. Кругла зв’язка — рудимент пупкової вени плода, проходить по вільному краю серпоподібної зв’язки від пупка до нижнього краю печінки та зливається з лівою гілкою ворітної вени. У структурі круглої зв’язки проходять дрібні вени, що з’єднують ворітну вену з венами пупкової ділянки. Останні розширюються та стають видимими (голова медузи) при внутрішньопечінковій обструкції системи ворітної вени при цирозі печінки. Венозний відтік від печінки здійснюється через печінкові вени, які відходять від задньої поверхні печінки та впадають у нижню порожнисту вену поблизу місця її входження у праве передсердя. Лімфатичні судини закінчуються у лімфатичних вузлах воріт печінки та розміщених уздовж черевного стовбура, у середостінні та вздовж грудного відділу нижньої порожнистої вени.
Функціональна анатомія: сектори та сегменти
Зважаючи на зовнішній вигляд печінки, можна припустити, що межа між правою та лівою частками печінки проходить уздовж серпоподібної зв’язки. Однак такий поділ печінки не відповідає кровопостачанню та шляхам відтоку жовчі. Ворітна вена ділиться на праву та ліву гілки, кожна з яких у свою чергу поділяється на дві гілки, що кровопостачають різні секції печінки: зліва — латеральну та медіальну, справа — передню та задню (рис. 11.2). При такому поділі межа між лівою та правою частками печінки проходить уздовж косої лінії, умовно проведеної між порожнистою веною зверху вниз до ложа жовчного міхура. Зони ворітного й артеріального кровопостачання, а також шляхи відтоку жовчі з правої та лівої частки не перекриваються. Чотири сектори печінки поділені трьома площинами, в яких проходять три основні гілки печінкових вен: права, серединна й ліва.
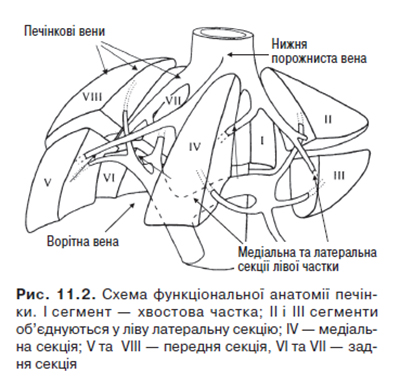
Наведена функціонально-анатомічна класифікація дозволяє правильно інтерпретувати дані рентгенологічного обстеження та має важливе значення для хірурга, який планує резекцію печінки.
Функції печінки
Кров ворітної вени омиває поверхню кишечнику, через яку відбувається всмоктування поживних речовин з їжі. Через це більша частина цих речовин проходить через печінку. Печінка підтримує гомеостаз, виконує екскреторну, білковосинтезувальну, дезінтоксикаційну функції, бере участь в обміні амінокислот, жирів, вуглеводів, метаболізмі лікарських препаратів та ін.
Не існує універсального аналізу, що дозволив би оцінити функцію печінки. Однак можна обмежитися наведеними нижче простими дослідженнями, що мають високу діагностичну цінність (табл. 11.1).
Таблиця 11.1
Основні показники функції печінки
|
Показник |
Діагностична цінність |
|
Білірубін |
|
|
загальний |
Підвищується при жовтяниці |
|
вільний, непрямий |
Підвищується при хворобі Жильбера, гемолізі |
|
Лужна фосфатаза |
Підвищується за наявності холестазу |
|
АсАТ |
Рання діагностика печінково-клітинного ураження |
|
АлАТ |
При алкоголізмі активність АлАТ нижча, ніж АсАТ |
|
ГГТП |
Діагностика алкогольного ураження печінки, біліарного холестазу |
|
Альбумін |
Знижується при тяжкому ураженні печінки |
|
g-Глобулін |
Діагностика хронічного гепатиту та цирозу |
|
Протромбіновий час |
Збільшується при ураженні печінки |
Обмін жовчного пігменту білірубіну
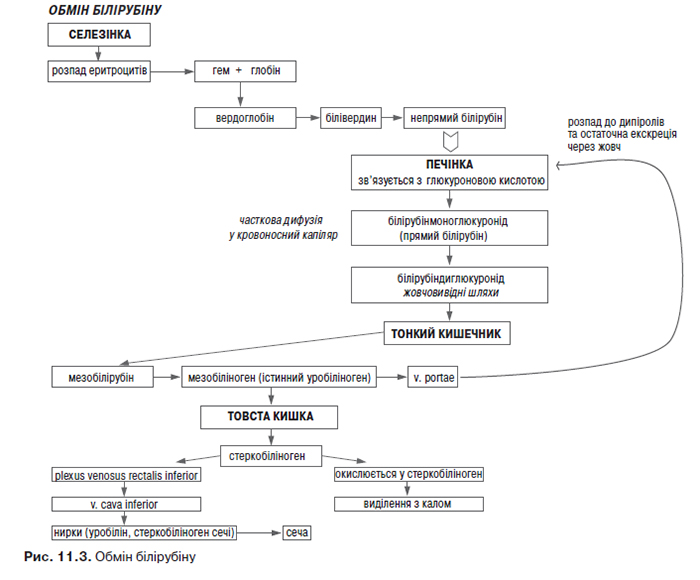
Білірубін являє собою кінцевий продукт розпаду гему. 85% білірубіну утворюється з гемоглобіну, і лише невелика його частина — з інших гемовмісних білків, наприклад міоглобіну та цитохрому Р450. Утворення білірубіну відбувається у клітинах ретикуло-ендотеліальної системи. Під дією гемоксигенази утворюється білівердин, який у подальшому перетворюється на непрямий білірубін (вільний, некон’югований), який є жиророзчинною сполукою. Останній надходить у кровоносне русло, де адсорбується на альбуміні та через нирковий фільтр не проходить.
У печінці білірубін відділяється від альбуміну та шляхом дифузії потрапляє до гепатоциту, де відбувається кон’югація білірубіну з глюкуроновою кислотою за допомогою ферменту глюкуронілтрансферази. Надалі відбувається екскреція кон’югованого (зв’язаного, прямого) білірубіну в жовчні канальці. Незначна частина кон’югованого білірубіну за градієнтом концентрації потрапляє у кровоносний капіляр і повертається у кровотік (становить до 25% від загального вмісту білірубіну в плазмі). У жовчовивідних протоках і тонкій кишці кон’югований білірубін перетворюється на мезобіліноген (інша назва — уробіліноген). Частина уробіліногену реабсорбується в тонкому кишечнику, потрапляє по системі ворітної вени в печінку, руйнується в ній до пірольних сполук і надалі в кровотік (і відповідно, сечу) не надходить. Поява мезобіліногену (уробіліногену) в крові й сечі свідчить про порушення детоксикаційної функції печінки, яка виявляється нездатною його руйнувати. У товстій кишці мезобіліноген під дією бактерій підлягає гідролізу з утворенням стеркобіліногену, основна частина якого виводиться з калом і перетворюється у зовнішньому середовищі на стеркобілін, надаючи випорожненням коричневого кольору. У прямій кишці стеркобіліноген частково всмоктується в нижнє прямокишкове венозне сплетіння (plexus venosus rectalis inferior), потрапляє в систему нижньої порожнистої вени та виділяється нирками з сечею. Зауважимо, що цей продукт обміну білірубіну має назву стеркобіліноген сечі, є природною складовою сечі й зумовлює її жовтий колір (на відміну від уробіліногену, який в нормі в сечі не визначається) (рис. 11.3).
Диференційна діагностика жовтяниць
Жовтяницею називають забарвлення шкіри та видимих слизових оболонок у жовтий колір внаслідок підвищення рівня загального білірубіну в плазмі крові. Клінічно жовтяниця проявляється при підвищенні рівня білірубіну >40 мкмоль/л (табл. 11.2).
Таблиця 11.2
Характеристика жовтяниці
|
Ознаки |
Паренхіматозна |
Надпечінкова |
Підпечінкова |
|
| пухлинна | калькульозна | |||
|
Вік, стать |
До 40 років |
До 50 років, часто діти |
Після 40 років, частіше чоловіки |
Жінки старшого віку |
|
Розвиток жовтяниці |
Швидкий |
Повільний |
Постійно прогресуючий |
Гострий, на висоті больового нападу або після нього |
|
Свербіння шкіри |
Нетривале |
Відсутнє |
Постійне, передує жовтяниці, інтенсивне |
Неінтенсивне, непостійне |
|
Біль |
Важкість у правому підребер’ї |
Немає |
Помірний або немає |
Печінкові кольки |
|
Температура тіла |
Субфебрильна. Рідше фебрильна |
Нормальна або фебрильна |
Нормальна |
Висока |
|
Колір шкіри |
Жовто-лимонний |
Світло-жовтий |
Жовто-зелений, бурий |
Помаранчево-жовтий |
|
Жовчний міхур |
– |
– |
Симптом Курвуазьє |
– |
|
Селезінка |
Збільшена |
Збільшена |
– |
– |
|
Асцит |
– |
– |
Може бути |
– |
|
Гіпербілірубінемія |
Переважно за рахунок непрямої фракції |
Переважно за рахунок прямої та/або непрямої фракції |
За рахунок прямої фракції |
За рахунок прямої фракції |
|
Амінотрансфераза |
Різко підвищена |
Норма |
Помірно підвищена |
Помірно підвищена |
|
Лужна фосфатаза |
Норма, незначно підвищена |
Норма, незначно підвищена |
Активність у крові висока |
Активність у крові висока |
|
Сеча |
Позитивна реакція на уробіліноген, сеча темна, білірубінурія |
Негативна реакція на уробіліноген, білірубінурія незначна |
Темна, білірубінурія, уробіліноген не визначається |
Темна, білірубінурія, уробіліноген не визначається |
|
Кал |
Гіпохолічний |
Гіперхолічний |
Ахолічний |
Ахолічний |
Періампулярна ділянка включає голівку підшлункової залози, сосочок (або ампулу), жовчну протоку і дванадцятипалу кишку. Права і ліва часткові жовчні протоки у воротах печінки зливаються з утворенням загальної печінкової протоки, в яку впадає протока жовчного міхура, — формується загальна жовчна протока. Остання має 4 відділи: супрадуоденальний, ретродуоденальний, інтрапанкреатичний та інтрамуральний (трансдуоденальний). Саме тому що частина жовчної протоки локалізується у голівці підшлункової залози, при розвитку раку голівки жовчна протока здавлюється з розвитком біліарної обструкції та механічної жовтяниці. Перед впадінням в дванадцятипалу кишку жовчна протока зливається з головним панкреатичним (вірсунговим) протоком підшлункової залози з утворенням фатерової ампули (рис. 11.4).
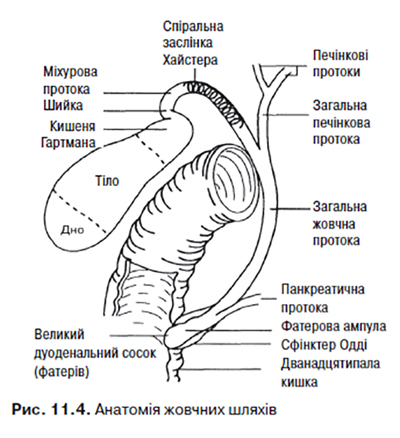
Підшлункова залоза є складною альвеолярно-трубчастою залозою з ендокринною та екзокринною функціями. Залоза розміщується позаочеревинно у верхньому поверсі черевної порожнини. Анатомічно у підшлунковій залозі виділяють голівку, відділену перешийком від тіла, та хвіст. Голівка тісно прилягає до дванадцятипалої кишки, яка охоплює її підковоподібно.
Сік підшлункової залози містить основні травні ферменти: ліпазу, амілазу та пептидазу. Ферменти активуються у просвіті дванадцятипалої кишки за допомогою ферменту ентерокінази, що виробляється ентероцитами. Ендокринна функція підшлункової залози належить острівцям Лангерганса, які виробляють гормони інсулін та глюкагон, регулюючи рівень глюкози крові.
ПЕРВИННИЙ РАК ПЕЧІНКИ
Гепатоцелюлярна карцинома (ГЦК) — первинний рак печінки — злоякісна пухлина, що походить із гепатоцитів.
Епідеміологія. Щорічно у світі реєструють від 500 тис. до 1 млн нових випадків ГЦК. ГЦК становить близько 6% усіх ЗН в світі, займаючи 6-те місце серед онкологічних захворювань. Ця онкопатологія є 5-ю за частотою у чоловіків і 8-ю у жінок. Щорічно у світі від ГЦК помирають більше 600 тис. осіб. Серед причин смерті від злоякісних неоплазм вона займає 3-тє місце, поступаючись раку легені та шлунка.
ГЦК є найрозповсюдженішим онкологічним захворюванням у деяких районах Африки та Азії. Зокрема, 300 тис. із 600 тис. смертей у світі припадають лише на Китай.
ГЦК вважають захворюванням осіб старшого віку, з піком у віці 65–69 років.
Співвідношення первинного раку печінки та її метастатичного ураження становить 1:20.
ЕТІОЛОГІЯ І ПАТОГЕНЕЗ
Факторами ризику розвитку ГЦК є: цироз печінки, гепатити В і С, алкогольна хвороба печінки, генетичний гемохроматоз, аутоімунний гепатит, неалкогольний стеатогепатит, дефіцит альфа-1-антитрипсину, контакт з афлатоксином.
Цироз печінки, незалежно від етіології, є головним клінічним і гістопатологічним фактором ризику розвитку ГЦК. У 5% пацієнтів із цирозом виникає ГЦК. Вузлова гіперплазія при цьому прогресує в рак. Великоклітинну дисплазію виявляють у 60% хворих на ГЦК на тлі цирозу і лише у 10% — без цирозу (табл. 11.3).
Таблиця 11.3
Класифікація цирозу печінки за Child-Pugh
|
Показник |
Бали |
||
| 1 | 2 | 3 | |
|
Енцефалопатія (стадія) |
Немає |
1–2 |
3–4 |
|
Асцит |
Немає |
Невеликий |
Значний |
|
Альбумін (г/л) |
>35 |
28–35 |
<28 |
|
Протромбіновий час (с) |
1–4 |
4–6 |
>6 |
|
Білірубін (мг/дл) Для первинного біліарного цирозу |
1–2 1–4 |
2–3 4–10 |
>3 >10 |
Примітка: клас цирозу А = 5–6 балів; клас В = 7–9 балів; клас С = 10–15 балів.
При вірусному ураженні печінки ГЦК розвивається на фоні хронічного гепатиту та цирозу. Некроз і посилена мітотична активність гепатоцитів сприяють утворенню вузлів регенерації, що призводить до дисплазії гепатоцитів і розвитку раку. За відсутності цирозу головними факторами виникнення раку стають некроз і запалення.
Найбільшу частоту розвитку ГЦК відзначають у регіонах світу з найбільшою кількістю носіїв вірусу гепатиту В (HBV). У тканині ГЦК виявляють HBV-ДНК. HBV призводить до розвитку раку шляхом інтеграції, трансактивації, мутації генів супресії пухлин і підвищення рівня трансформуючого фактора росту пухлини α.
При гепатиті В вірус інтегрується в хромосомну ДНК хазяїна, однак молекулярний механізм канцерогенного ефекту HBV лишається нез’ясованим. Інтеграція супроводжується хромосомними делеціями та транслокаціями, які впливають на ріст і диференціювання клітин (інсерційний мутагенез). Характер інтеграції в геном клітин непостійний.
Інтеграція HBV-ДНК призводить до транслокації генів-супресорів пухлини на хромосомі 17. Таким чином, гени супресії пухлини, наприклад онкоген р53 на хромосомі 17, можуть відігравати важливу роль у HBV-залежному гепатоканцерогенезі.
Існує пряма залежність між частотою інфікування вірусом гепатиту С (HCV) та розповсюдженням ГЦК. Частота ГЦК серед хворих з HCV в 4 разів вища, ніж у носіїв HBsAg. Розвиток ГЦК при HCV-інфекції не залежить від генотипу вірусу.
ГЦК розвивається лише через 10–29 років після інфікування. На відміну від HBV, HCV є РНК-вмісним вірусом, що не має ферменту зворотної транскриптази та не здатен інтегруватися в геном клітин хазяїна. Процес розвитку ГЦК невідомий; вірогідно, відбувається циротична трансформація печінки.
У пацієнтів похилого віку, які зловживають алкоголем, завжди виявляють ознаки цирозу, але алкоголь не є печінковим канцерогеном. Алкоголь може бути коканцерогеном HBV. Індукція ферментів, яка стимулюється алкоголем, може посилювати перетворення коканцерогенів у канцерогени. Алкоголь уповільнює алкілування ДНК, яке опосередковується канцерогенами.
Потужний гепатоканцерогенний ефект має афлатоксин, що виробляється грибком Aspergillus flavis. Афлатоксин та інші токсичні речовини, що містяться в плісняві, легко можуть потрапити у продукти харчування, зокрема в арахіс та зернові культури. Виявлено мутації гена р53, які пов’язують із підвищенням вмісту афлатоксину в харчових продуктах.
В осіб з генетичним гемохроматозом, аутоімунним гепатитом, неалкогольним стеатогепатитом і дефіцитом альфа-1-антитрипсину реєструють високий ризик розвитку ГЦК протягом життя, що пов’язане з виникненням цирозу печінки.
КЛІНІЧНА КАРТИНА
На ранніх стадіях захворювання симптоми можуть бути відсутні.
Загальні симптоми:
- слабкість;
- відсутність апетиту;
- втрата маси тіла.
Локорегіонарні симптоми:
- біль у правому верхньому квадранті черевної порожнини;
- пальпаторно визначається утворення у верхній частині черевної порожнини або щільна, нерівна поверхня печінки;
- симптоми та ознаки цирозу печінки;
- збільшення розмірів живота;
- неспецифічні шлунково-кишкові симптоми;
- жовтяниця.
Симптоми наявного цирозу печінки включають спленомегалію, симптоми портальної гіпертензії — асцит, варикозне розширення вен стравоходу, кардіального відділу шлунка, підшкірних припупкових вен (голова медузи). Шкірний свербіж, зумовлений накопиченням в тканинах жовчних кислот, супроводжує жовтяницю. При огляді хворого виявляють характерні для цирозу «печінкові знаки»: телеангіектазії на шкірі верхньої частини тулуба, еритему долоней, «лакований язик». Відзначають ксантоми, у чоловіків — гінекомастію.
Симптоми, що можуть супроводжувати розвиток ГЦК у пацієнтів із попередньо компенсованим цирозом печінки: швидке погіршення функції печінки; поява або рефрактерність асциту; гостра внутрішньочеревна кровотеча; посилення жовтяниці; втрата маси тіла і лихоманка; поява енцефалопатії; кровотеча з варикозно-розширених вен стравоходу.
Класифікація ГЦК за системою TNM
Т — первинна пухлина
Тх — недостатньо даних для оцінки первинного новоутворення
T0 — первинне новоутворення не визначається
T1 — солітарна пухлина <2 см у найбільшому вимірі без проростання судин
T2 — солітарна пухлина <2 см у найбільшому вимірі з проростанням судин або множинні пухлини <2 см без проростання судин, обмежені однією часткою, або — солітарна пухлина >2 см в найбільшому вимірі без проростання судин
T3 — солітарна пухлина >2 см із проростанням судин або множинні пухлини <2 см з проростанням судин, обмежені однією часткою, або обмежені однією часткою множинні пухлини, кожна з яких >2 см з/без проростання судин
T4 — множинні пухлини в обох частках печінки або пухлина, що уражає головну гілку портальної або печінкової вени, або пухлина з розповсюдженням на сусідні органи, крім жовчного міхура, або пухлина, що проростає вісцеральну очеревину.
N — регіонарні лімфатичні вузли (вузли воріт печінки або гепатодуоденальної зв’язки)
Nx — недостатньо даних для оцінки регіонарних лімфатичних вузлів
N0 — немає ураження регіонарних лімфатичних вузлів
N1 — є метастатичне ураження лімфатичних вузлів воріт печінки або гепатодуоденальної зв’язки.
М — віддалені метастази
Мх — недостатньо даних для визначення віддалених метастазів
M0 — немає даних про наявність віддалених метастазів
M1 — є віддалені метастази
Стадії ГЦК:
- Стадія I: T1N0M0
- Стадія II: T2N0M0
- Стадія IIIA: T3N0M0
- Стадія IIIB: T1N1M0, T2N1M0, T3N1M0
- Стадія IVA: T4N(будь-яке)M0
- Стадія IVB: T(будь-яке)N(будь-яке)M1
Класифікація TNM має суттєві недоліки, оскільки не враховує функцію залишкової паренхіми печінки, наявність або відсутність цирозу, загальний соматичний стан пацієнта, не передбачає лікувального алгоритму для різних стадій. Цю класифікацію не можна вважати прогностичною для ГЦК.
Виділяють 4 головні прогностичні фактори при ГЦК: стадію, агресивність та швидкість росту пухлини; загальний стан здоров’я пацієнта; функцію печінки; вибране лікування ГЦК. Розроблено багато систем стадіювання для пацієнтів із ГЦК. Кожна з них включає варіанти, що оцінюють один або більше з перших трьох факторів, зазначених вище. Наприклад, оцінки за Child-Pugh та MELD (Model for End-Stage Liver Disease) визначаються як системи встановлення стадії, які враховують лише функцію печінки. Система TNM Американського об’єднаного комітету з раку (American Joint Commitee on Cancer — AJCC) включає дані лише за характеристикою пухлини, а система Okuda поєднує аспекти функції печінки та характеристики пухлини. Французька класифікація (GRETCH) об’єднує оцінку за шкалою Карновського, а також визначення функції печінки та рівня АФП. BCLC (Barcelona Clinic Liver Cancer) класифікація поєднує систему Okudа, а також інші характеристики пухлини, визначення функції печінки і загального стану пацієнта.
На практиці для планування лікувальної тактики у світі частіше використовують клінічну класифікацію ВСLC, що виділяє 4 стадії. Рання стадія А включає пацієнтів із безсимптомними маленькими пухлинами, що підлягають радикальному лікуванню. До проміжної стадії (B) належать пацієнти із безсимптомною багатовузловою ГЦК. Пізню стадію ГЦК (C) констатують у пацієнтів із симптомами захворювання, позапечінковим розповсюдженням пухлини. Стадії В і С передбачають паліативне лікування. Кінцева стадія (D) включає пацієнтів із несприятливим прогнозом, які отримують лише симптоматичну терапію.
Паталогоанатомічно виділено 3 клінічні форми ГЦК:
- експансивну (нодулярну);
- масивну (інфільтративну);
- мультифокальну (дифузну).
ДІАГНОСТИКА
1. Збір анамнестичних даних (причини больового синдрому та умови його виникнення, давність жовтяниці, збільшення розмірів живота, захворювання на вірусні гепатити В і С, зловживання алкоголем).
2. Стандартне фізикальне обстеження.
3. Рентгенографія органів грудної клітки у 2 проекціях.
4. УЗД органів черевної порожнини та заочеревинного простору.
5. Трьохфазова (із внутрішньовенним контрастуванням) спіральна КТ або МРТ органів черевної порожнини, органів грудної порожнини та малого таза.
6. Пункційна біопсія новоутворення печінки під контролем УЗД або КТ.
7. Езофагофіброгастродуоденоскопія та ФКС.
8. Лабораторне дослідження крові (загальний аналіз крові з визначенням швидкості осідання еритроцитів, біохімічний аналіз із визначенням рівня загального білка, альбуміну, глюкози, креатиніну та сечовини, електролітів сироватки, АлАТ, АсАТ, лужної фосфатази, коагулограма).
9. Визначення АФП крові.
10. Поверхневий антиген гепатиту В HBsAg та антитіла IgM та IgG до HCV. При позитивному HBsAg визначають анти-HBe та HBc IgM. За наявності антитіл до НСV проводять полімеразну ланцюгову реакцію на НСV РНК.
Діагностичні критерії ГЦК:
- при розмірах вогнища 1–2 см: класичне зображення, отримане двома технологіями візуалізації (КТ-ангіографія, УЗД або МРТ) — високе контрастування в артеріальну фазу з вимиванням контрасту у венозну фазу;
- при розмірах вогнища >2 см: класичне зображення, отримане однією технологією візуалізації, або АФП >200 нг/мл;
- цитологічна верифікація ГЦК, отримана за допомогою біопсії.
Диференційну діагностику проводять із метастатичним ураженням печінки при інших онкологічних захворюваннях, з абсцесами печінки, паразитарними ураженнями печінки (ехінококоз), доброякісними пухлинами печінки — аденомою, гемангіомою, мезенхімальною гамартомою, з іншими злоякісними пухлинами печінки — холангіокарциномою, гепатобластомою, ангіосаркомою.
ЛІКУВАННЯ ТА ПРОФІЛАКТИКА
Лікування ГЦК слід проводити лише у спеціалізованих лікувально-профілактичних закладах. У загальнолікарняних мережах можливе застосування симптоматичної терапії у хворих на ГЦК у пізніх стадіях.
Хірургічне лікування полягає у резекції сегментів печінки, включаючи проведення право- та лівобічної гемігепатектомії, а також трансплантації печінки. До локорегіонарного лікування належать радіочастотна абляція, кріодеструкція, черезшкірна алкоголізація, хемоемболізація, радіоемболізація.
Резекція печінки є потенційно ефективним методом лікування пацієнтів із ГЦК у ранній стадії. Резекція печінки у хворих на ГЦК може бути проведена з малою операційною травмою та низькою летальністю (на рівні ≤5%). Результати ретроспективних досліджень продемонстрували рівень 5-річної виживаності >50% для пацієнтів, у яких виконана резекція печінки з приводу ГЦК. Вважають, що цей показник може досягти 70% у хворих зі збереженою функцією печінки і ранньою стадією ГЦК. Однак є повідомлення, що рецидиви пухлини протягом 5 років після резекції печінки досягають 70%.
Оскільки ризики резекції печінки у пацієнтів з ГЦК включають хірургічне видалення функціональної паренхіми печінки на тлі фонового захворювання печінки, надзвичайно важливим є ретельний відбір пацієнтів, заснований на характеристиці стану пацієнта, функції печінки та розповсюдженості пухлинного процесу. Необхідно проводити оцінку загального стану пацієнта з виявленням супутніх захворювань, наявність яких є незалежним фактором ризику періопераційної летальності. Крім того, оцінку загальної функції печінки та розміру й функції ймовірної залишкової паренхіми, як і технічні аспекти щодо видалення пухлинного вузла та печінкової анатомії слід враховувати перед вирішенням питання віднесення пацієнта до групи резектабельних хворих.
Резекція рекомендується лише при збереженій функції печінки. Класифікація Child-Pugh впроваджує оцінку функції печінки, хоча її нещодавно вважали інструментом для виключення пацієнтів з кандидатів на резекцію печінки (є посередником для визначення пацієнтів із декомпенсованим захворюванням печінки). Виявлення наявності вираженої портальної гіпертензії є важливою частиною доопераційного обстеження. Загалом, ознакою оптимальної функції печінки для резекції вважають Child-Pugh класу А без ознак портальної гіпертензії.
Для планування хірургічного лікування вкрай потрібною є передопераційна візуалізація. КТ/МРТ використовуються для характеристики кількості й розмірів вогнищ ГЦК, визначення наявності сателітних вузлів, позапечінкових метастазів та пухлинної інвазії у ворітну вену і нижню порожнисту вену, їх тромбозу, а також допомагають визначити розміщення пухлин відносно судинних та жовчних структур.
Оптимальними характеристиками пухлин для резекції є одиничні пухлини без судинної інвазії. Хоча обмежень щодо розмірів пухлинного вузла для резекції печінки немає, ризик судинної інвазії та дисемінації зростає зі збільшенням розмірів новоутворення. Однак в одному дослідженні показана відсутність судинної інвазії у третини пацієнтів з одиничним вузлом ГЦК розміром ≥10 см. Усе ж наявність макро- або мікросудинної інвазії вважається значним фактором ризику рецидивування ГЦК. Роль резекції печінки у пацієнтів із мультифокальним ураженням та/або ознаками великої судинної інвазії сумнівна. Результати ретроспективного аналізу показали загальну 5-річну виживаність на рівні 81% у окремих пацієнтів з однією пухлиною розміром ≤5 см чи трьома або менше пухлинами розміром ≤3 см, у яких виконано резекцію печінки. Наявність позапечінкових метастазів є протипоказанням до проведення резекції.
Інше клінічне передопераційне обстеження включає оцінку залишкової тканини печінки після майбутньої операції як індикатора функції печінки у післяопераційний період. КТ використовують для прямого вимірювання залишкової тканини печінки та обчислення загального об’єму печінки. Можна визначити відношення майбутнього залишку печінкової тканини до загального об’єму печінки. Рекомендовано, щоб це співвідношення становило не менше 20% у пацієнтів без цирозу та 30–40% — у хворих з цирозом класу А за Child-Pugh. Для пацієнтів із меншим співвідношенням, у яких інші параметри відповідають таким кандидатів для резекції, необхідно проведення передопераційної емболізації ворітної вени. Емболізація ворітної вени є безпечною та ефективною процедурою для перенаправлення току крові до частини печінки, яка залишиться після операції. У цих сегментах печінки розвивається гіпертрофія, у той час як емболізована частина піддається атрофії. Таким чином, збільшується відсоток залишкової тканини печінки, що знижує рівень післяопераційних ускладнень, пов’язаних з печінковою недостатністю.
Трансплантація печінки є важливим варіантом лікування пацієнтів з ранньою ГЦК. Вона передбачає видалення видимих та невидимих пухлинних вогнищ, усуває фоновий цироз печінки та дозволяє уникнути хірургічних ускладнень, пов’язаних з малою залишковою тканиною печінки. У ключовому дослідженні, опублікованому у 1996 р., Mazzaferro та співавтори продемонстрували досягнення 85 і 92% 4-річної загальної та безрецидивної виживаності відповідно ретроспективно у групі пацієнтів з ГЦК, відібраній згідно зі спеціальними критеріями (Міланські критерії). Ці результати були підтверджені більш пізніми дослідженнями, у яких пацієнтів для трансплантації печінки відбирали відповідно до цих критеріїв. Критерії відбору (включають радіологічні ознаки одиничної пухлини ≤5 см у діаметрі або 2–3 пухлини ≤3 см, без ознак макросудинної інвазії та позапечінкового розповсюдження захворювання) було названо критеріями UNOS (United Network for Organ Sharing), оскільки вони охоплюють підгрупу пацієнтів з ГЦК, для якої трансплантація печінки подібна до трансплантації у хворих з термінальною стадією цирозу без ГЦК.
Критерії UNOS також передбачають, що пацієнти, які підлягають проведенню трансплантації печінки, не повинні бути кандидатами для резекції. Тому трансплантацію вважають терапією вибору для хворих з ранньою стадією ГЦК і прийнятною для вираженого цирозу (класи В та С за Child-Pugh), тоді як часткова гепатектомія є найкращою альтернативою для першої лінії лікування пацієнтів з ранньою стадією ГЦК та класом А за Child-Pugh при доступній для резекції пухлинній локалізації. Не існує досліджень, що порівнювали б ефективність резекції та трансплантації печінки у останній групі пацієнтів, тому оптимальна стратегія для цієї популяції неоднозначна. Домовленість комітету NCCN (National Comprehensive Cancer Network) полягає у початковому лікуванні або частковій гепатектомії, або трансплантації печінки для пацієнтів з печінковою функцією класу А за Child-Pugh, які відповідають критеріям UNOS. Крім того, пацієнти повинні мати операбельне захворювання відповідно до загального стану та супутньої патології.
Рак печінки не відзначається високою чутливістю до хіміотерапії та ПТ. Дослідження ведуться у напрямі застосування фторпіримідинів і доксорубіцину у режимах системної моно- та ПХТ, з можливою комбінацією з високодозовою стереотаксичною ПТ та локорегіонарними втручаннями.
Таргетна терапія. Сорафеніб є мультикіназним інгібітором, що пригнічує численні внутрішньоклітинні кінази (с-CRAF, BRAF і мутантна BRAF) та кінази, розміщені на поверхні клітини (KIT, FLT-3, RET, VEGFR-1, VEGFR-2, VEGFR-3 і PDGFR-β). Вважається, що деякі з них задіяні в процесах ангіогенезу та апоптозу. Сорафеніб пригнічує ріст пухлини при ГЦК та нирково-клітинному раку. Однією зі схем хіміотерапії у лікуванні ГЦК є поєднання флуороурацилу 750 мг/м2 з 1-го по 5-й день з інтерфероном альфа 5 млн ОД/добу на 1; 3-й та 5-й день з інтервалом 14 днів. Також можуть застосовувати доцетаксел 100 мг/м2 кожний 21-й день.
Первинна профілактика ГЦК, спрямована на усунення факторів ризику розвитку захворювання:
- неонатальна вакцинація проти гепатиту В. Лікування дітей, народжених від HBVeAg-позитивних жінок;
- вакцинація проти гепатиту В осіб, що входять до групи ризику інфікування вірусом гепатиту В (медичні працівники);
- лікування пацієнтів з гепатитом В і С;
- санітарно-просвітницька робота щодо шляхів передачі вірусних гепатитів В та С;
- санітарно-просвітницька робота щодо зловживання алкоголем;
- правильне зберігання продуктів харчування, запобігання зараженню афлатоксином.
Вторинна профілактика — щорічне проведення УЗД органів черевної порожнини та визначення АФП в осіб групи ризику розвитку ГЦК.
Диспансерне спостереження:
1-й рік — 1 раз на 3–6 міс; 2-й рік — 1 раз на 3–6 міс; з 3-го року — 1 раз на рік.
1. Лабораторні дослідження: розгорнутий аналіз крові, біохімічний аналіз крові (альбумін, білірубін, АлАТ, АсАТ, лужна фосфатаза), коагулограма.
2. АФП крові.
3. УЗД, МРТ та/або КТ.
4. Обстеження у обсязі щорічного онкопрофогляду.
Реабілітація включає раціональне харчування, помірну фізичну активність, охоронний режим праці, санаторно-курортне лікування.
ПЕРІАМПУЛЯРНИЙ РАК
Термін «періампулярний рак» об’єднує чотири типи анатомічно не пов’язаних між собою злоякісних пухлин:
- рак дистального відділу загальної жовчної протоки;
- рак фатерова соска;
- рак дванадцятипалої кишки;
- рак голівки підшлункової залози.
Найбільш часто пухлинне ураження локалізується у голівці підшлункової залози; цей вид пухлини становить 40–60% всіх випадків. Рідше розвиваються рак фатерова соска (20–40%), карцинома дистального (нижнього) відділу жовчної протоки (10%) і рак дванадцятипалої кишки (10%).
Фактори ризику розвитку раку періампулярної зони:
- тютюнопаління;
- прийом їжі, багатої тваринними жирами;
- шкідливе виробництво, пов’язане з дією різних хімікатів, включають нафтиламін і бензидин;
- надмірне вживання кофеїну;
- зловживання алкоголем.
Клінічні прояви:
- прогресуюча жовтяниця без больового синдрому;
- знебарвлення калу і потемніння сечі;
- інтенсивний свербіж шкіри (інтенсивність залежить від тяжкості та тривалості жовтяниці);
- втрата маси тіла й апетиту;
- тупий ниючий біль в епігастральній та правій підреберній ділянці.
Діагностика раку періампулярної зони заснована на результатах лабораторних і рентгенологічних методів дослідження.
- УЗД
- КТ
- МРТ
- Ангіографія — на сучасному етапі пряму ангіографію замінює КТ-ангіографія.
- ЕРХПГ (ендоскопічна ретроградна холангіопанкреатографія) полягає у використанні ендоскопа для огляду, біопсії і введення рентгеноконтрастної речовини у фатерову ампулу. Під час ЕРХПГ можна встановити стент (пластикову чи металеву трубку) у загальну жовчну протоку для ліквідації жовтяниці.
Радикальна операція залишається методом вибору при лікуванні операбельних пухлин.
ХОЛАНГІОЦЕЛЮЛЯРНИЙ РАК
Холангіоцелюлярний рак (ХЦР) — це злоякісна пухлина, що походить з епітелію жовчних проток. Синонімами цього поняття є холангіокарцинома, холангіогенний рак, у деяких роботах — пухлина Клацкіна. Спочатку до цього поняття було віднесено лише первинні пухлини внутрішньопечінкових жовчних проток. Потім, враховуючи спільність процесів, термін став охоплювати внутрішньопечінкові, ворітні та дистальні позапечінкові пухлини жовчних проток. В основу класифікаційних ознак перш за все мають бути покладені морфологічні характеристики, а вже потім — анатомічні, оскільки саме гістологічне походження неоплазми визначає вибір хіміотерапії та ПТ. Хірургічне лікування зумовлюється локалізацією і поширеністю процесу та практично не залежить від його морфологічної основи. ХЦР — відносно рідкісне захворювання, частота якого становить <2% усіх злоякісних пухлин. Частота виявлення холангіокарциноми — 1–2 особи на 100 тис. населення. У країнах Південно-Східної Азії вона значно вища, що пов’язано з хронічною ендемічною паразитарною інфекцією печінки. У Японії та Ізраїлі частота виникнення холангіокарциноми становить 5,5 і 7,3 на 100 тис. населення. За останні 30 років відмічено значне зростання частоти виникнення ХЦР у пацієнтів у віці >45 років, що пояснюється покращанням діагностики та істотним збільшенням кількості хворих. Велика частина пацієнтів надходить у лікувальні заклади із занедбаними стадіями захворювання, які не підлягають радикальному хірургічному лікуванню. Середня виживаність при внутрішньопечінковій холангіокарциномі становить 18–30 міс, при ворітному ХЦР — 12–24 міс. Більшість хворих помирають протягом року після встановлення діагнозу.
КЛАСИФІКАЦІЯ ТА ФАКТОРИ РИЗИКУ
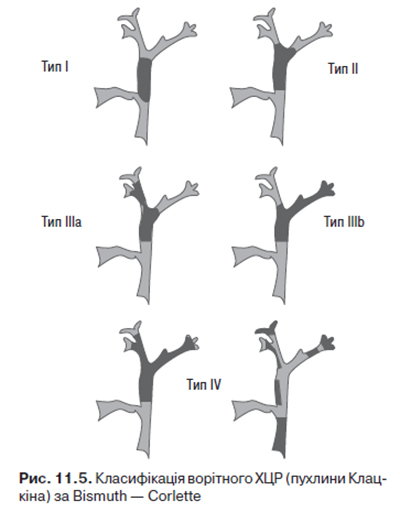
ХЦР за локалізацією поділяють на внутрішньо- та позапечінковий. Внутрішньопечінкове ураження трапляється в 10–25% випадків. Вважається, що периферична (внутрішньопечінкова) ХЦР походить із внутрішньопечінкових жовчних проток. Позапечінкові ураження поділяють на ворітні, розташовані в ділянці конфлюенса (пухлина Клацкіна, описана в 1965 р.), і дистальні позапечінкові пухлини, розміщені між біфуркацією і верхньою межею підшлункової залози. Частота ураження правої або лівої печінкових проток становить 10%, ділянки біфуркації — 20%, проксимальної частини загальної жовчної протоки — 30%, дистальних відділів загальної жовчної протоки — також 20–25%. У 5% випадків реєструють мультифокальний тип росту пухлини. Для характеристики ворітного ХЦР застосовують класифікацію Bismuth — Corlette, що диференціює локалізацію пухлини в печінкових протоках (рис. 11.5).
Відповідно до міжнародної класифікації TNM AJCC запропоновано класифікацію для цієї патології (табл. 11.4).
Таблиця 11.4
Стадіювання ХЦР (AJCC)
|
0 |
Tis |
N0 |
M0 |
|
I |
T1 |
N0 |
M0 |
|
II |
T2 |
N0 |
M0 |
|
III |
T1 або T2 |
N1 або N2 |
M0 |
|
IVA |
T3 |
Будь-яке N |
M0 |
|
IVB |
Будь-яке T |
Будь-яке N |
М1 |
За характером росту, незалежно від місця розташування залучених проток, ХЦР розподіляють на типи: інфільтративний, поліпоподібний, екзофітний і змішаний. У 90–95% випадків холангіогенний рак представлений аденокарциномою з різним ступенем диференціювання (в основному високодиференційовані аденокарциноми). Рідше виявляють аденосквамозні, плоскоклітинні, перснеподібноклітинні, муцинозні й анапластичні типи раку. До факторів ризику розвитку ХЦР відносять первинний склерозуючий холангіт, холедохо- і гепатолітіаз, біліодигестивні анастомози, неспецифічний виразковий коліт, аденоми гепатикохоледоха, множинний папіломатоз, вроджені кісти загальної жовчної протоки, хворобу Каролі, хворобу Крона, контакт із радіоактивним діоксидом торію, паразитарну інвазію Clonorchis sinensis та Opisthorchis viverrini, паління. Потенційними факторами ризику для внутрішньопечінкової форми ХЦР є гепатит C, вірус імунодефіциту людини, цироз печінки, цукровий діабет.
КЛІНІЧНА КАРТИНА
Клінічна картина холангіогенного раку зумовлена обструкцією жовчних проток, що проявляється синдромом механічної жовтяниці. Характерною особливості є залежність проявів цього синдрому від локалізації пухлинного процесу, тобто чим вище розташована пухлина, тим більші її розміри і пізніші терміни її проявів. Виражений больовий синдром не вважається характерним для ХЦР, однак при приєднанні вторинної інфекції і локалізації пухлинного процесу в дистальних відділах гепатикохоледоха може розвинутися клінічна картина гострого холангіту, що характеризується вираженим ознобом, лихоманкою, болем у правій підреберній ділянці. Занедбані форми захворювання проявляються ознаками ракової інтоксикації у вигляді болю, втоми, нездужання і втрати маси тіла. Синдром Курвуазьє характерний для дистальних уражень, при інтактній протоці жовчного міхура.
ДІАГНОСТИКА
Лабораторна діагностика холангіокарциноми базується на визначенні показників, характерних для холестазу та цитолізу: помірне підвищення АсАТ, АлАТ, ГГТП; значна гіпербілірубінемія, в основному за рахунок прямої фракції; виразне підвищення рівня лужної фосфатази. Тривала обструкція загальної печінкової або загальної жовчної протоки може призвести до дефіциту жиророзчинних вітамінів, гіпокоагуляції, гіпо- і диспротеїнемії. Для діагностики ХЦР найбільш доцільним видається використання декількох онкомаркерів; так, при поєднанні CА19–9 з РEA точність дослідження досягає 86%. Визначення цих онкомаркерів у післяопераційний період дозволяє оцінити ефективність лікування та діагностувати рецидив захворювання. Інструментальній діагностиці ХЦР надають вирішального значення, при цьому основними завданнями є визначення локалізації пухлинного процесу і проведення диференційної діагностики між злоякісною і доброякісною стриктурою жовчних проток. Як правило, обстеження хворих починається з УЗД. Дослідження більш інформативне в розпізнаванні внутрішньопечінкових форм ХЦР, що проявляються однорідними або різнорідними пухлинними масами, які не мають специфічних УЗ-ознак. Ворітні та дистальні ураження часто не діагностують за допомогою УЗД через їх малі розміри. Лише в 45% випадків УЗД дозволяє виявити екзофітну форму ХЦР. Разом з тим наявність обструкції жовчних проток встановлюється на підставі непрямих УЗ-ознак. Найголовнішим з них є дилатація проток тих сегментів печінки, з яких утруднений відтік жовчі. При наростанні гіпертензії протоки прогресивно розширюються і поступово за діаметром перевищують відповідні гілки ворітної вени. Відбувається формування картини «жовчних озер» — значного нерівномірного розширення внутрішньопечінкових проток. Застосування допплерографії дозволяє діагностувати оклюзію печінкової артерії, так само як і стиснення пухлиною ворітної вени, у тому числі її тромбоз. Впровадження внутрішньопротокового УЗД значно розширило можливості стадіювання процесу. Без сумніву, найважливішим методом діагностики холангіокарцином та оцінки їх резектабельності є прямі методи контрастування жовчних проток: ЕРХПГ, черезшкірна черезпечінкова холангіографія (ЧЧХ), холецистохолангіографія. Вибір методу холангіографії залежить від локалізації пухлини, її розмірів та способу лікування. Для ворітних пухлин бажане виконання ЧЧХ, для дистальних — ЕРХПГ.
При планованому дренуванні (стентуванні) жовчних проток і нерезектабельній пухлині за наявності дистальної холангіокарциноми доцільно виконувати холецистохолангіографію і ЕРХПГ, в інших випадках — ЧЧХ. Порівняно з іншими методами, ЕРХПГ є більш повним дослідженням, тому що дозволяє характеризувати періампулярні пухлини. КТ в 74% випадків здатна розпізнати внутрішньопечінковий ХЦР. Краще визначаються пухлини вузлового типу, гірше — дифузного склерозуючого характеру. Позапечінковий холангіогенний рак у цілому діагностують лише в 40% випадків.
Імовірність виявлення екзофітних пухлин при тонких зрізах наближається до 100%. Пухлини з інфільтративним типом росту і поліпоподібні внутрішньопросвітні форми ХЦР виявляють при КТ тільки в 22 та 25% випадків.
Болюсне посилення покращує візуалізацію ворітних пухлин або пухлин, які залучають у процес портальну венозну або артеріальну систему. Ізольована дилатація внутрішньопечінкових жовчних проток у зменшеній печінковій частці з гіпертрофією контралатеральної частки допускає наявність пухлини, що стискує систему ворітної вени. КТ дозволяє розпізнати збільшені лімфовузли при внутрішньопечінковій ХЦР у 15% випадків. Впровадження магнітно-резонансної холангіопанкреатографіі (МРХПГ) розширило можливості неінвазивної діагностики ХЦР. МРХПГ передбачає чудове відображення паренхіматозних змін у печінці, так само як і візуалізацію судинних структур, жовчного дерева, причини його оклюзії.
Враховуючи атравматичність МРХПГ, відсутність променевого навантаження, зазначене дослідження може замінити КТ і ангіографію на етапі доопераційного обстеження хворих зі злоякісними пухлинами біліарного тракту. Точність МРХПГ в оцінці рівня і морфології обструкції жовчної протоки зіставна з прямою холангіографією у вигляді ЕРХПГ або ЧЧХ. Чутливість і специфічність МРХПГ при виявленні стриктур становить 93,3 і 98,5% відповідно. ПЕТ як функціональна методика, що швидко розвивається, дозволяє провести доопераційне стадіювання багатьох злоякісних пухлин. У низці досліджень продемонстровано чутливість і специфічність ПЕТ більше 90% у діагностиці холангіокарцином. Чутливість ПЕТ при вузлових пухлинах вища, ніж при інфільтративних, — 85 і 18% відповідно. Специфічність при позапечінкових формах ХЦР коливається від 80 до 33%. Ефективність ПЕТ КТ у діагностиці холангіогенного раку недостатньо вивчена. При діагностиці рецидиву пухлини та її віддалених метастазів доведено 94% чутливість і 100% специфічність.
ЛІКУВАННЯ ТА ПРОФІЛАКТИКА
Лікування холангіокарциноми на даному етапі розвитку медицини малоефективне. Менше 20% хворих на ХЦР операбельні. На резектабельність пухлини впливають безліч факторів: локалізація; інвазія в систему ворітної вени і печінкової артерії; стадійність і мультифокальність пухлини; ускладнення холестазу в вигляді біліарного цирозу, гнійного холангіту, біліарного сепсису; стан контралатеральної частки печінки та ін. Обсяг радикальної операції залежить від локалізації пухлини. При внутрішньопечінковому її розташуванні проводять гемігепатектомію або трансплантацію печінки. При ворітній локалізації — супрадуоденальну резекцію гепатикохоледоха, з каудальною лобектомією (резекція 1 сегмента печінки), лімфаденектомію, холецистектомію, резекцію 4 та 5 сегментів печінки, біліодигестивний анастомоз. Панкреатодуоденальну резекцію виконують при дистальному ХЦР. При вивченні віддалених результатів встановлено, що після виконання радикальних операцій приблизно в 50% випадків розвивається місцевий рецидив, у 30–40% — віддалені метастази. Поєднання трансплантації печінки з доопераційною радіохіміотерапією та післяопераційною ПТ забезпечує 80% 5-річну виживаність. Симптоматичні обхідні біліодигестивні анастомози є найбільш часто виконуваними хірургічними втручаннями при позапечінковому ХЦР. Широке впровадження методів стентування і пункційного дренування жовчних проток використовуються для того, щоб підтримати адекватний відтік жовчі та зменшити симптоми інтоксикації.
Променева і хіміотерапія можуть використовуватися при комбінованому лікуванні пацієнтів з ХЦР. Доопераційна або післяопераційна хіміотерапія не приводить до значного поліпшення виживаності та якості життя хворих на ХЦР. При проведенні різних схем хіміотерапії із застосуванням флуороурацилу, мітоміцину, метотрексату, доксорубіцину, цисплатину не відзначено істотного ефекту. Перспективним вважається використання комбінації гемцитабіну з цисплатином або оксаліплатину. Регіонарна хіміотерапія дозволяє досягти більшої концентрації лікарських засобів і поліпшення результатів лікування. У цілому, середня тривалість життя при застосуванні хіміотерапії збільшувалася не більше ніж на 3–6 міс, а середні терміни виживаності становлять не більше 11 міс. Таким чином, поліпшення результатів терапії хворих на ХЦР буде залежати від профілактики, ранньої діагностики, більш агресивних і передових методів хірургічного лікування.
Універсальність припинення паління і зменшення маси тіла у профілактиці онкологічних захворювань очевидна. Необхідно максимальне усунення факторів, що підвищують ризик розвитку ХЦР. У майбутньому можлива розробка молекулярних методів діагностики, що визначають спадкову групу ризику.
РАК ПІДШЛУНКОВОЇ ЗАЛОЗИ
Рак підшлункової залози (РПЗ) займає 9-те місце в структурі онкологічних захворювань та 5-е місце в структурі смертності від раку. Щороку в Україні реєструють близько 5 тис. первинних хворих на РПЗ (Щепотін І.Б., Федоренко З.П., 2010). У світі РПЗ становить актуальну проблему, оскільки мізерність клінічних проявів захворювання у ранніх стадіях, коли можливе проведення радикального лікування, призводить до пізньої діагностики захворювання, а отже, незадовільних результатів виживаності пацієнтів. Медіана тривалості життя хворих на РПЗ при застосуванні лише методів консервативного лікування (хіміотерапія, ПТ або їх поєднання) становить в середньому 6–7 міс з моменту встановлення діагнозу. Радикальне хірургічне втручання — єдиний метод лікування, який дозволяє майже втричі подовжити медіану тривалості життя при місцево-поширених пухлинах (III стадія) та отримати 20% 5-річну виживаність у хворих із I–II стадією РПЗ.
Фактори ризику розвитку РПЗ:
- перенесені оперативні втручання з приводу пептичних виразок з видаленням частини шлунка;
- супутній хронічний панкреатит та цукровий діабет, ризик особливо високий серед осіб у віці >40 років;
- спадкові форми хронічного панкреатиту;
- деякі спадкові синдроми, пов’язані з наявністю поліпозу товстої кишки, судинних пухлин (синдром Гіппеля — Ліндау) і телеангіектазій.
У більшості випадків (60%) РПЗ локалізується в голівці підшлункової залози, причому основним проявом захворювання є механічна жовтяниця. Тривала жовтяниця асоціюється з підвищенням післяопераційних ускладнень та летальності при виконанні радикального втручання — гастропанкреатодуоденальної резекції — на висоті жовтяниці. При значному підвищенні показників загального білірубіну оптимальні результати очікуються в разі двоетапного лікування: перший етап — дренуюча операція, спрямована на ліквідацію жовтяниці, другий етап — радикальне оперативне втручання.
Існують багато оперативних способів ліквідації механічної жовтяниці. В Україні застосовують основні групи втручань:
- малоінвазивні:
- зовнішнє дренування;
- зовнішньо-внутрішнє дренування;
- антеградне дренування (стентування);
- оперативні:
- гепатикоєюностомія;
- холецистоєюностомія;
- гепатикодуоденостомія;
- зовнішня холецистостома.
Через особливості анатомічного взаємозв’язку органів гепатопанреатодуоденальної зони механічна жовтяниця є частим симптомом таких пухлин, як рак розвилки жовчної протоки (пухлина Клацкіна), рак дистального відділу загальної жовчної протоки, рак фатерова соска, рак голівки підшлункової залози. Рак тіла або хвоста підшлункової залози виявляють рідше і на пізніх стадіях, оскільки пухлини такої локалізації викликають механічну жовтяницю тільки в 10% випадків. Розвиток цукрового діабету може бути важливим симптомом захворювання також в 10% випадків. Панкреатит у осіб похилого віку, що раніше не зловживали алкоголем, може стати першим симптомом неоплазії цієї локалізації. Іншим важливим, але неспецифічним симптомом є втрата маси тіла.
Обстеження та підготовка хворих на РПЗ, ускладнений механічною жовтяницею, до радикального оперативного втручання
При обстеженні хворого із механічною жовтяницею і підозрою на РПЗ особливу увагу слід приділити виконанню спіральної КТ із контрастуванням — чутливість методу 93% або МРТ — чутливість 88%. Описані діагностичні технології дозволяють підтвердити обструктивну етіологію жовтяниці, визначити рівень блоку відтоку жовчі, а також візуалізувати пухлинний компонент у голівці підшлункової залози. Крім того, спіральна КТ або МРТ дозволяють виключити наявність віддалених метастазів пухлини. Наступна задача дослідження — визначення місцевої резектабельності пухлини (показання до виконання лікування в радикальному обсязі).
Пункційна біопсія пухлини під контролем УЗД або спіральної КТ є одним з ключових етапів дослідження.
ФГДС — також ключове дослідженням для діагностики і біопсії пухлин періампулярної зони.
Визначення біохімічних показників функцій печінки (підвищення рівня загального білірубіну >100 мкмоль/л є показанням до двохетапного лікування хворого).
Визначення показників гемограми (гематокрит, кількість лейкоцитів/тромбоцитів) та системи згортання крові (протромбіновий час, активований частковий тромбопластиновий час та час згортання) для необхідної корекції.
ЛІКУВАННЯ
Єдиною радикальною операцією при раку голівки підшлункової залози є панкреатодуоденальна резекція (oперація Whipple). Сутність операції полягає у моноблочному видаленні голівки підшлункової залози з дванадцятипалою кишкою, дистальною частиною загальної жовчної протоки, жовчного міхура, нижніми двома третинами шлунка та регіонарними лімфатичними вузлами із подальшою реконструкцією.
На реконструктивному етапі використовуються різноманітні методики відновлення пасажу їжі та травних соків з накладанням гастроентероанастомозу, гепатикоентероанастомозу та панкреатоентероанастомозу. При раку тіла та хвоста підшлункової залози виконують дистальну резекцію, дистальну субтотальну резекцію залози або тотальну панкреатектомію. Пацієнти з резектабельними утвореннями становлять менше 20% серед усіх хворих на РПЗ. Пухлина вважається резектабельною за відсутності розповсюдження процесу за межі підшлункової залози та залучення магістральних судин. За останнє десятиліття з’явилися дані про можливість виконання резекцій судин та їх реконструкції у пацієнтів з пухлинною інвазією РПЗ у ворітну вену та/або печінкову артерію.
ЗН біліопанкреатодуоденальної зони високорезистентні до хіміопроменевого впливу. Основна увага спрямована на отримання не лише об’єктивного ефекту у вигляді регресії пухлини, але головним чином на поліпшення якості життя та його подовження. Протягом багатьох десятиліть для лікування РПЗ використовували флуороурацил або його комбінації з іншими цитостатиками. Проте ефективність монотерапії флуороурацилом і різних комбінацій була вкрай низькою. З інших цитостатиків, які проявили протипухлинну активність при клінічних випробуваннях, слід відзначити цисплатин, епірубіцин, мітоміцин, стрептозоцин, тегафур. Найчастіше застосовують хіміотерапію за загальноприйнятими схемами і при стандартних шляхах введення препаратів, але пропонується і ад’ювантна інтраартеріальна хіміотерапія. Стандартна схема включає флуороурацил 500 мг/м2/добу протягом 5 днів у комбінації з фолієвою кислотою. Перерва між циклами становить 28 днів, кількість циклів — 6 для ад’ювантного лікування, 4–6 — для паліативної терапії.
Гемцитабін є протипухлинним препаратом, що має невелику кількість побічних ефектів і клінічно сприятливу дію. Незабаром після впровадження у клінічну практику гемцитабіну на початку 90-х років ХХ ст. було показано, що він є не тільки новим протипухлинним препаратом, але й профіль та ступінь вираженості побічних ефектів при його застосуванні значно відрізняються від таких для звичайних цитостатичних препаратів.
Це сприяло широкому використанню гемцитабіну в якості паліативної системної хіміотерапії при РПЗ. Гемцитабін вводять у дозі 1000 мг/м2 щотижня протягом 7 тиж або на 1; 8-му та 15-ту добу з інтервалом між циклами 28 днів. Лікування проводять до прогресування захворювання або до розвитку гематологічної токсичності. На жаль, ефект хіміотерапії при паліативному лікуванні проявляється лише у 30% пацієнтів і триває менше року. У середньому флуороурацил і гемцитабін подовжують медіану життя на 3–6 міс. При ад’ювантному застосуванні хіміотерапії після адекватного обсягу радикальних оперативних втручань на ранніх стадіях захворювання (І, ІІ) вдається досягти 5-річної виживаності 25%.
ПТ займає важливе місце в арсеналі лікування раку панкреатодуоденальної зони. Оптимальним з топометричної позицій є поздовжнє опромінення пухлин панкреатодуоденальної ділянки та регіонарних лімфатичних шляхів (по осі підшлункової залози), проте така методика лікування реалізується лише на лінійних прискорювачах з енергією 15–20 МеВ.
Таким чином, ад’ювантна терапія є значущим компонентом лікування пацієнтів із РПЗ, хоча її використання обмежено тим, що менше 20% хворих операбельні на момент первинної діагностики. Тому максимальний результат від ад’ювантного лікування може бути отриманий лише у 4% хворих із загальної кількості.
ПРОФІЛАКТИКА
Специфічної профілактики не розроблено. Було визначено, що через 10–15 років після відмови від тютюнопаління підвищений ризик виникнення РПЗ нівелюється. Лікування захворювань, що є факторами ризику РПЗ, можуть слугувати профілактикою.
ТЕСТОВІ ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Який метод використовується при проведенні УЗД печінки?
A. А-метод
B. В-метод
C. М-метод
D. Ехографія
2. Пацієнт віком 56 років, що тривалий час одержував лікування з приводу хронічного гепатиту С, госпіталізований з клінічною картиною кровотечі з верхніх відділів шлунково-кишкового тракту. Кровотечу зупинено. При обстеженні виявлено варикозне розширення вен стравоходу, асцит; вогнищевих змін в печінці не виявлено. Лабораторні дані: гіпоальбумінемія, гіпокоагуляція, висока активність АлАТ, АсАТ. Найбільш імовірна причина кровотечі:
A. Цироз печінки, портальна гіпертензія
B. Гепатоцелюлярна карцинома
C. Холангіоцелюлярна карцинома
D. Гострий гепатит С
E. Хвороба Клацкіна
3. Пацієнт віком 56 років, що тривалий час одержував лікування з приводу хронічного гепатиту С, госпіталізований з клінічною картиною кровотечі з верхніх відділів шлунково-кишкового тракту. Кровотечу зупинено. При обстеженні виявлено варикозне розширення вен стравоходу, асцит; вогнищевих змін в печінці не виявлено. Лабораторні дані: гіпоальбумінемія, гіпокоагуляція, висока активність АлАТ, АсАТ. Що необхідно зробити для підтвердження діагнозу?
A. Біопсію печінки
B. Аналіз крові на маркери вірусних гепатитів
C. МРТ малого таза
D. Цитологічне дослідження асцитичної рідини
E. Гастродуоденографію
4. В анамнезі вагітної віком 25 років вірусний гепатит А. На момент обстеження маркерів вірусного гепатиту в сироватці крові не виявлено. Чи є ризик трансплацентарної передачі вірусу плоду?
A. 50%
B. 100%
C. Немає
D. Залежить від проведення імунопрофілактики матері
E. Залежить від постнатальної вакцинації дитини
5. При обстеженні жінки віком 48 років зі скаргами на ниючий біль у правому підребер’ї, гіркоту в роті, вечірнє підвищення температури тіла до субфебрильних значень, зниження апетиту та втрату маси тіла виявлено три вузлових утворення в печінці. За даними пункційної біопсії отримано елементи гепатоцелюлярного раку. Яке лікування показано хворій?
A. Інтерферонотерапія
B. Симптоматичне лікування
C. Хіміотерапія
D. Хіміопроменева терапія
E. Резекція або трансплантація печінки
6. При обстеженні жінки віком 48 років зі скаргами на ниючий біль у правому підребер’ї, гіркоту в роті, вечірнє підвищення температури тіла до субфебрильних значень, зниження апетиту та втрату маси тіла виявлено три вузлових утворення в печінці. Також діагностовано хронічний вірусний гепатит В у стадії реплікації. Чи показане хворій противірусне лікування?
A. Так, поєднане з резекцією або трансплантацією печінки
B. Тільки при резекції печінки
C. Ні
D. Так, поєднане з хіміотерапією
7. Жінка віком 52 роки звернулася до клініки зі скаргами на жовтяничність шкіри, ахолічний кал, темну сечу. Больовий синдром відсутній. Захворіла поступово, близько 2 тиж до звернення. Обстежена в інфекційній лікарні, даних на підтвердження вірусного гепатиту не виявлено. Визначається позитивний симптом Курвуазьє. Загальний білірубін крові 289 мкмоль/л, прямий — 242 мкмоль/л. При проведенні КТ виявлено розширення внутрішньопечінкових жовчних проток, загальної жовчної протоки, блок відтоку жовчі на рівні інтрапанкреатичної частини жовчної протоки. У голівці підшлункової залози та печінці пухлинних утворень не виявлено. Конкрементів у жовчному міхурі та протоці також не виявлено. При проведенні дуоденоскопії патології слизової оболонки дванадцятипалої кишки та фатерова соска не відзначено. Який найбільш ймовірний діагноз?
A. Рак жовчного міхура
B. Рак голівки підшлункової залози
C. Рак фатерова соска
D. Пухлина дистального відділу загальної жовчної протоки
E. Жовчнокам’яна хвороба, холедохолітіаз
8. Жінка віком 52 роки звернулася до клініки зі скаргами на жовтяничність шкіри, ахолічний кал, темну сечу. Больовий синдром відсутній. Захворіла поступово, близько 2 тиж до звернення. Обстежена в інфекційній лікарні, даних на підтвердження вірусного гепатиту не виявлено. Визначається позитивний симптом Курвуазьє. Загальний білірубін крові 289 мкмоль/л, прямий — 242 мкмоль/л. При проведенні КТ виявлено розширення внутрішньопечінкових жовчних проток, загальної жовчної протоки, блок відтоку жовчі на рівні інтрапанкреатичної частини жовчної протоки. У голівці підшлункової залози та печінці пухлинних утворень не виявлено. Конкрементів у жовчному міхурі та протоці також не виявлено. При проведенні дуоденоскопії патології слизової оболонки дванадцятипалої кишки та фатерова соска не відзначено. Який перший етап лікування?
A. Холецистектомія
B. Панкреатодуоденальна резекція
C. Дистальна резекція підшлункової залози
D. Дренування загальної жовчної протоки для ліквідації жовтяниці
E. Каудальна лобектомія
9. Жінка віком 52 роки звернулася до клініки зі скаргами на жовтяничність шкіри, ахолічний кал, темну сечу. Больовий синдром відсутній. Захворіла поступово, близько 2 тиж до звернення. Обстежена в інфекційній лікарні, даних на підтвердження вірусного гепатиту не виявлено. Визначається позитивний симптом Курвуазьє. Загальний білірубін крові 289 мкмоль/л, прямий — 242 мкмоль/л. При проведенні КТ виявлено розширення внутрішньопечінкових жовчних проток, загальної жовчної протоки, блок відтоку жовчі на рівні інтрапанкреатичної частини жовчної протоки. У голівці підшлункової залози та печінці пухлинних утворень не виявлено. Конкрементів у жовчному міхурі та протоці також не виявлено. При проведенні дуоденоскопії патології слизової оболонки дванадцятипалої кишки та фатерова соска не відзначено. Яка радикальна операція показана пацієнтці?
A. Дренування загальної жовчної протоки для ліквідації жовтяниці
B. Панкреатодуоденальна резекція
C. Дистальна резекція підшлункової залози
D. Холецистектомія
E. Каудальна лобектомія
10. У чоловіка віком 67 років діагностовано рак голівки підшлункової залози, метастатичне ураження печінки, змішану механічно-паренхіматозну жовтяницю. Яке лікування показане пацієнту?
A. Паліативне або симптоматичне
B. Радикальна операція
C. Трансплантація печінки
D. Операція Applebe
11. У чоловіка віком 67 років діагностовано рак голівки підшлункової залози, метастатичне ураження печінки, змішану механічно-паренхіматозну жовтяницю. До якої клінічної групи при диспансеризації слід віднести пацієнта?
A. IB
B. II
C. III
D. IV
E. ІІА
Шаблон відповідей
|
1 |
B |
7 |
D |
|
2 |
A |
8 |
D |
|
3 |
A |
9 |
B |
|
4 |
C |
10 |
A |
|
5 |
E |
11 |
D |
|
6 |
A |
РАК ЖОВЧНОГО МІХУРА
У країнах Європейського Союзу захворюваність на рак жовчного міхура (РЖМ) становить близько 4 на 100 тис. осіб на рік. Фактори ризику розвитку РЖМ, серед яких переважає холелітіаз, асоціюються з наявністю хронічного запалення. Порцеляновий жовчний міхур (кальцинація стінки міхура як результат хронічного запалення) також пов’язаний з підвищенням ризику розвитку РЖМ.
ДІАГНОСТИКА ТА КЛІНІЧНА КАРТИНА
Діагностика включає збір анамнезу, фізикальне обстеження, загальний та біохімічний аналіз крові, рентгенографію органів грудної порожнини, УЗД черевної порожнини, КТ або МРТ черевної порожнини, ендоскопічну ретроградну холангіографію або ЧЧХ та за можливості ендоскопічну ультрасонографію, холангіоскопію та лапароскопію. Патоморфологічне підтвердження діагнозу за результатами тонкоголкової аспіраційної або браш-біопсії.
РЖМ найчастіше виявляють у пізній стадії, що пояснюється агресивною природою пухлини, яка швидко метастазує. Іншою причиною пізньої діагностики є неспецифічна клінічна картина, подібна до жовчної кольки чи хронічного холециститу. Однак нерідко РЖМ може бути випадковою інтраопераційною знахідкою або виявлятися при патологоанатомічному дослідженні після холецистектомії з приводу симптомного холелітіазу.
Інші можливі клінічні прояви захворювання включають вогнищеве утворення печінки, що визначається на УЗД, та жовтяницю. Початкове обстеження пацієнтів має включати визначення функції печінки та оцінку її резерву. Такі онкомаркери, як РЕА та СА 19–9, можуть визначатися, хоча вони і не є специфічним для РЖМ. Для виявлення проростання пухлини поза стінку жовчного міхура, визначення інвазії інших органів, жовчовивідних шляхів, великих судин, наявності збільшених лімфатичних вузлів та віддалених метастазів рекомендується застосування високоякісних технологій візуалізації, таких як спіральна КТ або МРТ. Рішення про проведення діагностичної лапароскопії приймають за відсутності віддалених метастазів на КТ та при високому ризику перитонеальної дисемінації. Для пацієнтів з жовтяницею додаткове обстеження має включати холангіографію для визначення пухлинної інвазії в жовчовивідні шляхи. Використовується неінвазивна магнітно-резонансна холангіографія, яка має переваги над ЕРХПГ або ЧЧХ. Роль ПЕТ у діагностиці РЖМ не доведена, однак деякі дослідження показали її ефективність при виявленні віддалених метастазів у пацієнтів з потенційно резектабельним РЖМ.
Майже 80% випадків РЖМ представлені аденокарциномою, яка рано метастазує лімфогенним та гематогенним шляхами.
Стадіювання TNM AJCC
Первинна пухлина (Т)
Тх — первинна пухлина не може бути оцінена
Т0 — первинна пухлина не визначається
Тіs — рак in situ
Т1а — пухлина проростає власну пластинку стінки жовчного міхура
Т1b — пухлина проростає м’язовий шар стінки жовчного міхура
Т2 — пухлина розповсюджується на навколишню сполучну тканину, але не виходить за межі серозної оболонки або у паренхіму печінки
Т3 — пухлина проростає серозну оболонку (вісцеральну очеревину) або/та один із прилеглих органів, розповсюджується не глибше ніж на 2 см у паренхіму печінки
Т4 — пухлина розповсюджується глибше ніж на 2 см у паренхіму печінки і/або два чи більше суміжних органів (шлунок, дванадцятипала кишка, підшлункова залоза, великий сальник та ін.).
Регіонарні лімфатичні вузли (N)
Nх — регіонарні лімфатичні вузли не можуть бути оцінені
N0 — метастазів у регіонарні лімфатичні вузли немає
N1 — метастази в лімфатичні вузли гепатодуоденальної зв’язки
N2 — метастази в перипанкреатичні, перидуоденальні, перипортальні, черевні або верхньобрижові лімфатичні вузли.
Віддалені метастази (М)
Мх — неможливо оцінити наявність віддалених метастазів
М0 — віддалених метастазів немає
М1 — віддалені метастази є
Групування за стадіями:
- Стадія 0: ТіsN0М0
- Стадія 1А: Т1N0М0
- Стадія 1В: Т2N0М0
- Стадія ІІА: Т3N0М0
- Стадія ІІВ: Т1N1М0; Т2N1М0; Т3 N1 М0
- Стадія ІІІ: Т4N(будь-яке)М0
- Стадія ІV: Т(будь-яке)N(будь-яке)М1
5-річна виживаність пов’язана зі стадією: для 0–ІV стадії вона становить відповідно 60; 39; 15; 5 та 1%. Медіана загальної виживаності для хворих на РЖМ — 10,3 міс.
ЛІКУВАННЯ
При випадковому виявленні у процесі гістологічного дослідження РЖМ рекомендується виконання повторної радикальної операції у всіх пацієнтів з резектабельними пухлинами при Т1b та більше. У пацієнтів з Т1a стадією, яким було виконано холецистектомію, показане динамічне спостереження. При випадковому інтраопераційному виявленні РЖМ необхідно провести стадіювання захворювання з виконанням розширеної холецистектомії, що включає резекцію печінки (сегменти IV та V) та лімфодисекцію моноблочно.
Стандартом лікування РЖМ є виконання розширеної холецистектомії з резекцією печінки та лімфодисекцією воріт печінки, з/без резекції загальної жовчної протоки. Однак навіть при агресивному хірургічному втручанні показники 5-річної виживаності при РЖМ становлять 5–10%. Призначення хіміотерапії із застосуванням флуороурацилу або гемцитабіну сприяє незначному поліпшенню виживаності пацієнтів, у яких операція була виконана не в радикальному обсязі. Гемцитабін вводять у дозі 1000 мг/м2 щотижня протягом 7 тиж або на 1; 8-му та 15-ту добу з інтервалом між циклами 28 днів, або в 1-шу та 8-му добу з перервою між циклами 1 тиж. У рандомізованих дослідженнях ефект паліативної хіміотерапії не доведений, у середньому тривалість життя подовжується на 1–2 міс.
ПРОФІЛАКТИКА
Усунення холестазу знижує ризик виникнення РЖМ. Захворюваність на РЖМ є нижчою у популяції з вищим рівнем холецистектомій, тому проведення профілактичної холецистектомії рекомендовано в осіб групи високого ризику виникнення РЖМ.
ТЕСТОВІ ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Чоловік віком 65 років звернувся до лікаря поліклініки зі скаргами на жовтяничність шкірних покриві, відчуття важкості у правому підребер’ї. При обстеженні виявлено множинне двобічне вогнищеве ураження печінки, при аспіраційній біопсії — аденокарциному. В анамнезі лапароскопічна холецистектомія з приводу жовчнокам’яної хвороби 4 міс до звернення. Гістологічного дослідження жовчного міхура не проводили. За даними інших інструментальних обстежень особливостей не виявлено. Який найбільш імовірний діагноз?
A. Внутрішньопечінкова холангіокарцинома
B. Гепатоцелюлярна карцинома
C. Хвороба Клацкіна
D. Метастази анонімної пухлини в печінку
E. РЖМ, продовження хвороби
2. У чоловіка віком 54 роки після холецистектомії виявлено РЖМ, що проростає м’язову оболонку стінки міхура (Т1b). На момент обстеження патології органів черевної порожнини не виявлено. Яка лікувальна тактика?
A. Повторна операція у радикальному обсязі
B. Динамічне спостереження
C. Хіміотерапія флуороурацилом
D. ПТ на ложе пухлини
E. Хіміоемболізація ворітної вени
3. У чоловіка віком 54 роки після лапароскопічної холецистектомії виявлено РЖМ, що проростає м’язову оболонку стінки міхура (Т1b). Від повторної операції відмовився. Через 6 міс пацієнт звернувся до онкодиспансера для профілактичного огляду. Виявлено вогнищеве ураження V сегмента печінки розміром до 3 см, без інвазії судин. Яка тактика?
A. Резекція V сегмента
B. Діагностична лапароскопія
C. Резекція IV, V сегментів, лімфодисекція
D. Хіміотерапія флуороурацилом
E. Хіміоемболізація ворітної вени
4. У жінки віком 47 років при проведенні лапароскопічної холецистектомії у жовчному міхурі виявлено щільну білу пухлину, що проростає у тканину печінки. Термінове гістологічне дослідження — рак. Яка тактика?
A. Конверція операції на лапаротомію та проведення резекції печінки та лімфаденектомії
B. Внутрішньоартеріальна хіміотерапія
C. Закінчення лапароскопічної операції. Повторна операція через 1 міс
D. Закінчення лапароскопічної операції. Динамічне спостереження
5. У чоловіка віком 57 років після лапароскопічної холецистектомії виявлено РЖМ. Через 6 міс з’явилося резектабельне вогнище в печінці. При діагностичній лапароскопії виявлено множинні метастази по очеревині. Яке лікування показане пацієнту?
A. ПТ
B. Паліативна хіміотерапія
C. Радикальна операція
D. Перитонектомія
E. Хіміоемболізація ворітної вени
Шаблон відповідей
|
1 |
E |
|
2 |
A |
|
3 |
B |
|
4 |
A |
|
5 |
B |
ПУХЛИНИ ТОНКОГО КИШЕЧНИКУ
Пухлини тонкого кишечнику — достатньо рідкісна патологія, серед усіх новоутворень шлунково-кишкового тракту становить 1–2%. Як і для інших пухлин травного тракту, основним методом лікування є хірургічний, і тактика лікування здебільшого визначається тим, чи резектабельна пухлина. Загальна виживаність при резектабельній аденокарциномі тонкого кишечнику становить усього 20%, при саркомі — 50%.
ЕТІОЛОГІЯ
Етіологія захворювання є невідомою. Деякі фактори навколишнього середовища та спадкові захворювання підвищують можливість виникнення злоякісних пухлин тонкого кишечнику:
- сімейний аденоматозний поліпоз;
- сімейний неполіпозний рак товстого кишечнику;
- хвороба Крона;
- хвороба Пейтца — Джегерса;
- синдром Гарднера;
- целіакія;
- нейрофіброматоз;
- онкологічні захворювання в анамнезі.
Гістологічна класифікація
1. Аденокарцинома (найбільш часто).
2. Лімфома (зазвичай неходжкінська).
3. Саркома (найчастіше лейоміосаркома, рідше — ангіо- та ліпосаркома).
4. Карциноїд (карциноїдні пухлини тонкого кишечнику виділені в групу нейроендокринних пухлин і розглядаються окремо).
5. Гастроінтестинальні стромальні пухлини (GIST — gastrointestinal stromal tumors) є групою мезенхімальних (стромальних, сполучнотканинних) пухлин, що експресують антиген поверхневих мембран клітин CD117, відомий також як білок с-Кіт. Останній — це тирозинкіназа рецепторного типу, лігандом якої є фактор росту, що називається стовбуровим клітинним фактором (SCF). Мутації гена с-Kіт призводять до лігандзалежної активації рецептора SCF. Необхідність у виділенні GIST в окрему нозологічну форму ініційована появою специфічного патогенетичного лікарського засобу іматинібу — c-Kit-селективного інгібітору тирозинкінази.
Більшість ЗН тонкого кишечнику — це аденокарциноми (>50%), що найбільш часто локалізуються у дванадцятипалій кишці та jejunum. Цей вид раку може мати первинно-множинний характер. Лейоміосаркоми найчастіше виникають у клубовій кишці. Близько 20% пухлин тонкого кишечнику становлять карциноїди, що локалізуються частіше у термінальних відділах кишки.
5-річна виживаність при пухлинах тонкого кишечнику не перевищує 20%, що пов’язано з труднощами ранньої діагностики.
Захворювання, з якими необхідно проводити диференційну діагностику пухлин тонкого кишечнику: тонкокишкова непрохідність непухлинної етіології, грижа, заворот кишок, спайкова хвороба, мезентеріальна ішемія або тромбоз, стороннє тіло або безоар, інвагінація, карциноматоз і/або метастази.
Класифікація TNM
Первинна пухлина (Т)
Tх — первинна пухлина не визначається
T0 — немає проявів первинної пухлини
Tis — carcinoma in situ
T1 — пухлинна інвазія у lamina propria або підслизовий шар
T2 — пухлинна інвазія у м’язову пластинку
T3 — пухлина проростає через м’язовий шар у субсерозний або у неперитонізовані ділянки навколом’язових тканин* на ділянці 2 см і менше
T4 — пухлина проростає вісцеральну очеревину або безпосередньо проростає у навколишні органи або структури (включаючи петлі тонкої кишки, брижу, заочеревинний простір) більше ніж на 2 см, стінку живота, дванадцятипалу кишку, підшлункову залозу (тільки для пухлин дванадцятипалої кишки).
Примітка: *неперитонізовані навколом’язові тканини — для тонкої або клубової кишки — це ділянки брижі, для дванадцятипалої кишки — у ділянках, в яких відсутня сероза — частина заочеревинного простору.
Регіонарні лімфовузли (N)
Nх — стан регіонарних лімфовузлів не можливо оцінити
N0 — немає метастазів у регіонарних лімфовузлах
N1 — метастази у регіонарних лімфовузлах.
Віддалені метастази (M)
Mх — наявність віддалених метастазів неможливо встановити
М0 — немає віддалених метастазів
М1 — наявні віддалені метастази.
Групування за стадіями:
- Стадія 0: TisN0M0
- Стадія I: T1N0M0 або T2N0M0
- Стадія II: T3N0M0 або T4N0M0
- Стадія III: T(будь-яке)N1M0
- Стадія IV: T(будь-яке)N(будь-яке)M1
КЛІНІЧНА КАРТИНА
У клінічній картині розрізняють 3 періоди:
- тривалий період малих симптомів (біль, порушення функції кишки);
- період часткової кишкової непрохідності;
- період ускладнень (висока кишкова непрохідність, кишкова кровотеча, перфорація пухлини).
ДІАГНОСТИКА
Використовують такі діагностичні методи:
- ФГДС з біопсією;
- рентгеноконтрастне дослідження тонкої кишки;
- МРТ.
ЛІКУВАННЯ
Стандартні підходи
При резектабельних пухлинах — хірургічне лікування — резекція кишки.
При нерезектабельних первинних пухлинах — обхідний анастомоз, паліативна ПТ.
При метастатичній лейоміосакромі — паліативне хірургічне, променеве та хіміотерапевтичне лікування.
Методи, що перебувають на стадії вивчення
При резектабельних пухлинах — доповнення хірургічного лікування ПТ із застосуванням радіосенсибілізаторів і/або системної хіміотерапії.
При нерезектабельних первинних та рецидивних пухлин — системна хіміотерапія.
При стромальних пухлинах ефективне застосування іматинібу (інгібітор тирозинкінази ІІІ).
ПРОФІЛАКТИКА
На сьогодні не існує профілактики раку тонкого кишечнику.