Стандарти діагностики та лікування захворювань серцево-судинної системи
Содержание
- Стандарти надання медичної допомоги хворим із ГКС без елевації сегмента ST (IМ без зубця Q i нестабільна стенокардія)
- Стандарти надання медичної допомоги хворим із ГКС з елевацією сегмента SТ (IМ із зубцем Q)
- Стандарти надання медичної допомоги хворим із хронічною ІХС
- Інтервенційні та хірургічні методи лікування
- Стандарти надання медичної допомоги хворим із дисліпідеміями
- Стандарти надання медичної допомоги пацієнтам із гіпертонічною хворобою (есенціальною АГ)
- Уніфікований клінічний протокол первинної, екстреної та вторинної (спеціалізованої) медичної допомоги. Артеріальна гіпертензія
- Стандарти надання медичної допомоги хворим з легеневою гіпертензією (у дорослих)
- Стандарти надання медичної допомоги хворим із ДКМП
- Стандарти надання медичної допомоги хворим із ГКМП
- Стандарти надання медичної допомоги хворим із міокардитом
- Стандарти надання медичної допомоги хворим із гострим перикардитом, хронічним констриктивним перикардитом
- Стандарти надання медичної допомоги хворим з інфекційним ендокардитом
- Стандарти надання медичної допомоги хворим із набутими вадами серця
- Стандарти надання медичної допомоги хворим із порушеннями ритму та провідності серця
- Стандарти надання медичної допомоги хворим із хронічною серцевою недостатністю
- Стандарти надання медичної допомоги хворим із серцево-судинними ускладненнями внаслідок дії протипухлинних препаратів та променевої терапії
Стандарти надання медичної допомоги хворим із ГКС без елевації сегмента ST (IМ без зубця Q i нестабільна стенокардія)
(О.М. Пархоменко, О.І. Іркін, Я.М. Лутай, М.Ю. Соколов, О.В. Шумаков)
Рубрика за МКХ-10: I20–I22.
Стандарти діагностики
Ознаки та критерії діагностики захворювання
ГКС — група симптомів та ознак, які дозволяють запідозрити гострий ІМ або нестабільну стенокардію. Термін «ГКС» використовують при першому контакті з хворими як попередній діагноз. Виділяють ГКС зі стійкою елевацією сегмента SТ на ЕКГ та без такої. Перший у більшості випадків трансформується в гострий IМ із зубцем Q на ЕКГ, другий — у гострий IМ без зубця Q або нестабільну стенокардію (заключні клінічні діагнози).
Гострий IМ — це некроз будь-якої маси міокарда внаслідок гострої тривалої ішемії. Нестабільна стенокардія — гостра ішемія міокарда, вираженість і тривалість якої недостатні для розвитку некрозу міокарда.
Гострий IМ без підйому сегмента ST/без зубця Q відрізняється від нестабільної стенокардії підвищенням рівня біохімічних маркерів некрозу міокарда в крові. Клінічними діагностичними критеріями ГКС без елевації сегмента ST слід вважати:
- затяжний (>10 хв) ангінозний біль у спокої;
- стенокардію не менше ніж III ФК (за класифікацією Канадської асоціації кардіологів, 1976), що виникла вперше (протягом попередніх 28 днів);
- прогресуючу стенокардію мінімум III ФК.
ЕКГ-критеріями ГКС без елевації сегмента ST є горизонтальна депресія сегмента ST та/або «коронарний» негативний зубець Т. Можлива також відсутність цих змін на ЕКГ. Біохімічним критерієм розвитку ІМ на тлі ГКС є підвищення з наступним зниженням у динаміці рівня кардіоспецифічних ферментів (креатинфосфокінази (КФК), МВ-фракції КФК, тропонінів Т і І) у плазмі крові. У суперечливих випадках цей критерій є визначальним для діагностики.
Умови надання медичної допомоги
Хворих з ГКС слід терміново госпіталізувати до спеціалізованого інфарктного (або за відсутності — до кардіологічного) відділення, бажано в блок інтенсивного спостереження, лікування і реанімації. Після стабілізації стану хворим призначають амбулаторне лікування під спостереженням кардіолога. При госпіталізації перевагу слід надавати стаціонарам з можливістю проведення перкутанних коронарних втручань.
Програма діагностики
Обов’язкові медичні дослідження
1. Визначення скарг та анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ (на обох руках).
4. ЕКГ в 12 відведеннях у динаміці.
5. Лабораторне обстеження (загальні аналізи крові і сечі, КФК у динаміці 3 рази, бажане визначення МВ-фракції КФК, тропонінів Т або І за необхідності в динаміці 2 рази, аланінамінотрансферази (АлАТ), калію, натрію, білірубіну, креатиніну, ХС загального, ХС високої та низької щільності, ТГ, глюкози в крові).
6. ЕхоКГ.
7. Навантажувальний тест (велоергометрія або бігова доріжка (тредміл)) після стабілізації стану і за відсутності протипоказань.
8. КВГ залежно від рівня ризику та за відсутності стабілізації стану хворого на фоні адекватної медикаментозної терапії протягом 48 год або наявності протипоказань до проведення навантажувальних тестів.
Додаткові дослідження
1. Активований частковий тромбопластиновий час (АЧТЧ) при лікуванні нефракціонованим гепарином.
2. Рентгенографія органів грудної клітки.
Стратифікація серцево-судинного ризику і показання для проведення інтервенційних втручань
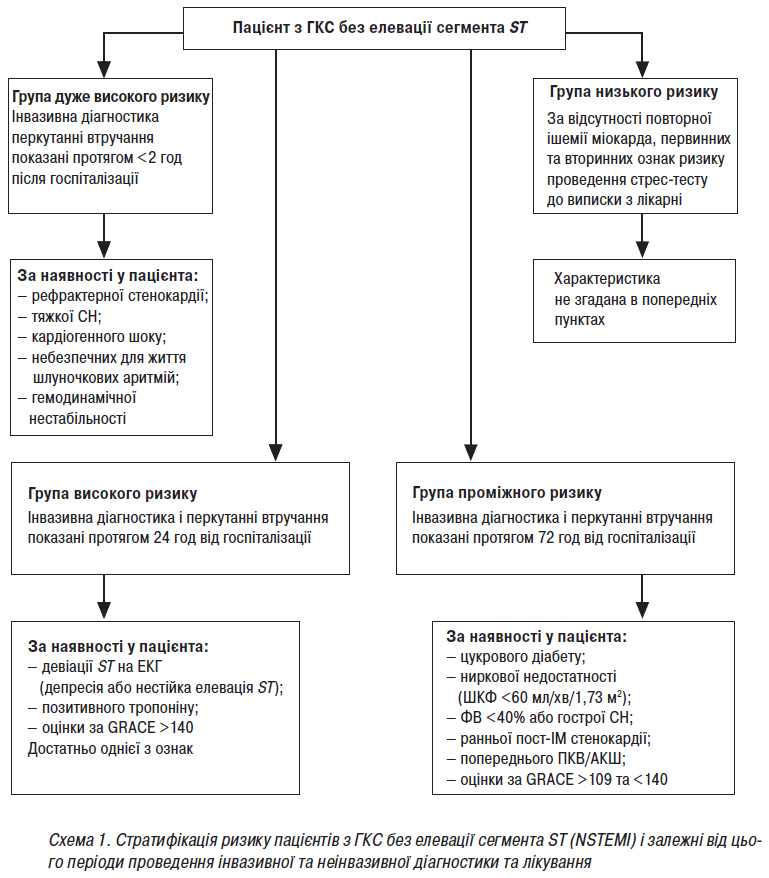
Залежно від наявності чи відсутності у хворого певного переліку клініко-анамнестичних факторів (рефрактерна стенокардія, тяжка СН зі зниженням ФВ ЛШ та кардіогенний шок, життєзагрожувальні шлуночкові аритмії, зміни на ЕКГ, підвищення рівня тропоніну Т в крові, високий показник за шкалою GRACE, цукровий діабет, ниркова недостатність, рання післяінфарктна стенокардія, попереднє черезшкірне або хірургічне втручання на коронарних артеріях) хворого треба віднести до однієї з 4 груп ризику (схема 1). Від цього залежать у першу чергу строки надання допомоги шляхом інвазивних втручань на коронарних артеріях.
Зокрема, дуже важливе значення для подальших дій має визначення у хворого ризику смерті та розвитку гострого ІМ за шкалою GRACE (табл. 8).
Таблиця 8. Алгоритм оцінки прогнозу смерті/гострого ІМ у пацієнта із ГКС без елевації сегмента ST (GRACE)
|
Параметри |
Показник |
Бал |
Параметри |
Показник |
Бал |
|
Вік, років |
<40 |
0 |
Креатинін, мг/дл |
0–0,39 |
2 |
|
40–49 |
18 |
0,04–0,79 |
5 |
||
|
50–59 |
36 |
0,8–1,19 |
8 |
||
|
60–69 |
55 |
1,2–1,59 |
11 |
||
|
70–79 |
73 |
1,6–1,99 |
14 |
||
|
>80 |
91 |
2–3,99 |
23 |
||
|
Частота серцевих скорочень (ЧСС), уд./хв |
<70 |
0 |
>4,01 |
31 |
|
|
70–89 |
7 |
Клас за Killip |
I |
0 |
|
|
90–109 |
13 |
II |
21 |
||
|
110–149 |
23 |
III |
43 |
||
|
150–199 |
36 |
IV |
64 |
||
|
>200 |
46 |
||||
|
АТ (систолічний) |
<80 |
63 |
Зупинка кровообігу |
43 |
|
|
80–99 |
58 |
Підвищення біомаркерів |
15 |
||
|
100–119 |
47 |
Відхилення сегменту ST |
30 |
||
|
120–139 |
37 |
||||
|
140–159 |
26 |
||||
|
160–199 |
11 |
||||
|
>200 |
0 |
||||
А) Група дуже високого ризику (КВГ, з подальшим стентуванням у разі анатомічної можливості проведення перкутанної реваскуляризації, повинні бути виконані протягом <2 год після госпіталізації) за наявності:
- рефрактерної стенокардії;
- тяжкої СН;
- кардіогенного шоку;
- небезпечних для життя шлуночкових аритмій;
- гемодинамічної нестабільності.
Пацієнтам дуже високого ризику КВГ з подальшим стентуванням у разі анатомічної можливості проведення перкутанної терапії мають бути виконані протягом до 2 год після госпіталізації незалежно від ЕКГ-картини та результатів тесту на біомаркери. У цьому випадку тактика ведення пацієнтів високого ризику не відрізняється від тактики лікування хворих з ГКС з елевацією сегмента ST.
Б) Група високого ризику (інвазивна діагностика і перкутанні втручання показані протягом 24 год після госпіталізації) за наявності хоча б одного з перерахованих первинних критеріїв ризику (див. додаток 1):
- позитивний тропонін;
- зміни сегмента ST або зубця Т;
- оцінка за шкалою GRACE ≥140 балів.
В) Група проміжного ризику (інвазивне втручання можна відкласти, але його необхідно здійснити протягом періоду перебування в лікарні, бажано у межах 72 год з моменту госпіталізації) за наявності хоча б одного з перерахованих вторинних критеріїв ризику (див. схему 1):
- цукровий діабет;
- ниркова недостатність (ШКФ <60 мл/хв/1,73 м2);
- знижена функція ЛШ (ФВ <40%);
- рання постінфарктна стенокардія;
- недавнє перкутанне коронарне втручання (ПКВ)/АКШ;
- помірні або високі оцінки ризику за шкалою GRACE (>109 та <140 балів, www.gracescore.org).
Г) Група низького ризику, тобто пацієнти без наявності повторення симптомів, у яких не виявлено ні первинних, ні вторинних критеріїв ризику: слід провести неінвазивну оцінку індукованої ішемії до виписки з лікарні.
Програма лікування
Перелік і обсяг обов’язкових медичних послуг
1. Ацетилсаліцилова кислота (АСК).
2. Тікагрелор (у разі неможливості призначення тікагрелору призначають клопідогрель).
3. Низькомолекулярний гепарин еноксапарин або фондапаринукс підшкірно усім хворим (до 8 діб, при збереженні ознак ішемії і більше). У разі неможливості їх застосування — нефракціонований гепарин (внутрішньовенно крапельно протягом мінімум 2 діб з наступним підшкірним введенням). Після проведення черезшкірного ПКВ (ЧПКВ) та стентування рутинне призначення антикоагулянтів не рекомендовано, окрім пацієнтів з іншими показаннями до повнодозової (механічні клапани, тромбоутворення у ЛШ, супутня фібриляція передсердь (ФП), відсутність повної реваскуляризації) або профілактичної (профілактика венозних тромбоемболій) антикоагулянтної терапії.
4. Блокатори бета-адренорецепторів без внутрішньої симпатоміметичної активності.
5. Статини показані всім хворим за відсутності протипоказань (надавати перевагу аторвастатину у дозах 40–80 мг/добу або розувастатину 20–40 мг/добу). Початок терапії якомога раніше, бажано до реваскуляризації міокарда.
6. Інгібітори ангіотензинперетворювального ферменту (АПФ) усім хворим, у разі їх непереносимості — БРА.
7. Нітрати за наявності стенокардії та/або ознак ішемії міокарда, набряку легень. Як альтернативу можна використовувати сидноніміни.
8. Блокатори кальцієвих каналів. Дилтіазем і верапаміл доцільні при лікуванні хворих, які мають протипоказання до застосування блокаторів бета-адренорецепторів, і у хворих з варіантною стенокардією (за відсутності СН із систолічною дисфункцією ЛШ). Дигідропіридини тривалої дії можна застосовувати з метою антигіпертензивного й додаткового антиангінального ефектів тільки разом з блокаторами бета-адренорецепторів. Дигідропіридинові похідні короткої дії протипоказані.
Перелік і обсяг медичних послуг додаткового вибору
1. Для знеболювання при недостатньому ефекті нітратів і блокаторів адренорецепторів — наркотичні анальгетики (у першу чергу опіоїди). Для заспокоювання хворого можливе призначення транквілізаторів.
2. При підвищенні АТ — антигіпертензивна терапія.
3. При рецидивуванні ішемії міокарда — реваскуляризація міокарда. Показання і вибір методу реваскуляризації визначаються характером ураження коронарних артерій за даними КВГ.
4. Лікування основних ускладнень:
4.1. Гостра лівошлуночкова недостатність (класифікація за Т. Кillip, J. Кіmball, 1969):
4.1.1. початкова й помірно виражена (Кillip II): нітрати (внутрішньовенно або перорально), блокатори рецепторів альдостерону (еплеренон, верошпірон), фуросемід на тлі лікування інгібітором АПФ, корвітином та блокатором бета-адренорецепторів;
4.1.2. тяжка (Кillip III): фуросемід (внутрішньовенно), нітрати (внутрішньовенно), левосимендан (внутрішньовенно), корвітин, штучна вентиляція легень (ШВЛ); у разі розвитку альвеолярного набряку легень: піногасники, морфін, кровопускання;
4.1.3. кардіогенний шок:
4.1.3.1. рефлекторний — наркотичні анальгетики, симпатоміметики;
4.1.3.2. аритмічний: ЕІТ або електрокардіостимуляція;
4.1.3.3. справжній: допамін, добутамін, норадреналін, адреналін, левосидеміндан, реваскуляризація міокарда (ПКВ, АКШ), внутрішньоаортальна балонна контрапульсація (за можливості), прилади допоміжного кровообігу (ECMO, Impala та ін.);
4.2. Тяжкі шлуночкові порушення ритму: блокатори бета-адренорецепторів, аміодарон (за необхідності подальшої профілактики), лідокаїн.
4.3. АV-блокади: профілактичне встановлення ендокардіального електрода в ПШ (АV-блокада II ступеня Мобітц І при задньому IМ, АV-блокада II ступеня Мобітц II, АV-блокада III ступеня), при порушенні гемодинаміки — електрокардіостимуляція.
4.4. За наявності тромбоутворення в порожнині ЛШ або ФП показана тривала пероральна антикоагулянтна терапія.
5. При виявленні гіперглікемії (≥11,1 ммоль/л) розпочати терапію інсуліном та підтримувати рівень глюкози у межах 6,1–10,0 ммоль/л, уникаючи гіпоглікемії (<3,9 ммоль/л). Проводити моніторинг рівня глюкози до стабілізації стану.
Характеристика очікуваного кінцевого результату лікування
Зникнення стенокардії, запобігання розвитку ІМ і стабілізація гемодинаміки.
Тривалість лікування
Обов’язкове стаціонарне лікування тривалістю 5–10 днів. Подовження строків лікування можливе за наявності ускладнень: рефрактерної нестабільної стенокардії, СН, тяжких аритмій і блокад.
Критерії якості лікування
Відсутність клінічних та ЕКГ-ознак ішемії міокарда. Відсутність ознак високого ризику за даними навантажувальних тестів (ішемічна депресія сегмента SТ >0,2 мВ, толерантність до фізичного навантаження <5 МЕТS (metabolic equivalents) — 75 Вт або при загальній роботі <22 кДж, зниження САТ під час навантаження). Відсутність ознак гострого ушкодження серця за лабораторними даними (МВ-КФК або тести з тропонінами).
Можливі побічні реакції терапії та ускладнення захворювання
Можливі побічні ефекти препаратів відповідно до їх фармакологічних властивостей. Наприклад, проведення адекватної антитромботичної терапії у хворих з високим геморагічним ризиком може спровокувати кровотечу. До ускладнень захворювання також можна віднести розвиток або прогресування ІМ, усі можливі його ускладнення.
Рекомендації щодо амбулаторного спостереження
Хворі мають перебувати на диспансерному спостереженні за місцем проживання протягом усього життя. Необхідне щорічне обов’язкове обстеження, за необхідності — обстеження і корекція терапії.
Освітні заходи щодо способу життя
Вимоги до дієтичних призначень і обмежень
Хворі повинні дотримуватися дієти з обмеженням солі до 6 г/добу, тваринних жирів і продуктів, що містять ХС. Рекомендується дієта, збагачена омега-3 поліненасиченими жирними кислотами (морська риба). При надмірній масі тіла обмежується калорійність їжі. За наявності шкідливих звичок — відмова від тютюнопаління, обмеження вживання алкоголю.
Реабілітаційні заходи
Вимоги до режиму праці, відпочинку, реабілітації
Рекомендовано тимчасові обмежені дозовані фізичні навантаження (ДФН) і лікувальну фізкультуру під контролем фахівців. Не рекомендуються перебування під прямими сонячними променями, переохолодження і перегрівання. Показана реабілітація в амбулаторних умовах або приміських спеціалізованих санаторіях (за відсутності протипоказань).
Відновлювальному лікуванню в реабілітаційних кардіологічних відділеннях місцевих санаторіїв підлягають хворі відповідно до встановленого порядку направлення (наказ МОЗ від 30.12.1992 р. № 206). Переведення хворих у спеціалізоване відділення санаторіїв здійснюється після виконання наступного рівня фізичної активності — дозована ходьба на 1000 м в 1–2 прийоми та підйом на 17–22 сходинки.
При переведенні на санаторний етап реабілітації варто керуватися функціональною підготовкою хворого до виконання зазначеного рівня рухової активності, а не часом виникнення ІМ або нестабільної стенокардії. При неадекватному виконанні рухового режиму необхідний тест з фізичним навантаженням на велоергометрі або коронароангіографія, після чого вирішується питання про необхідність хірургічного втручання.
Показання до санаторного етапу реабілітації
1. Хворі з первинним або повторним IМ при задовільному виконанні необхідного рівня фізичного навантаження.
2. Хворі, які перенесли нестабільну стенокардію, за умови адекватного виконання необхідного рівня фізичної активності.
3. Після операції АКШ, резекції аневризми, стентування коронарних судин або хірургічних втручань з приводу порушень серцевого ритму не раніше ніж через 15–18 днів після операції (без післяопераційних ускладнень).
4. Допускається наявність у хворих таких ускладнень і супутніх захворювань на момент направлення їх до санаторію:
- СН не вище IIА стадії;
- нормо- або брадіаритмічна форма постійної миготливої аритмії;
- одинична або часта (не політопна, не групова і не рання (R на Т) екстрасистолія;
- АV-блокада не вище І ступеня;
- аневризма серця при недостатності кровообігу не вище І ступеня;
- АГ з контрольованим АТ і безкризовим перебігом;
- цукровий діабет 2-го типу (компенсований або субкомпенсований).
Протипоказання до проведення санаторного етапу лікування
1. Загальні протипоказання, які виключають направлення хворих у санаторій (гострі інфекційні, венеричні, психічні захворювання, захворювання крові в гострій стадії і фазі загострення, злоякісні новоутворення, що супроводжують захворювання в стадії декомпенсації або загострення та ін.).
2. СН вище IIА стадії.
3. Стенокардія IV ФК.
4. Тяжкі порушення серцевого ритму і провідності (пароксизми фібриляції і ТП або пароксизмальна тахікардія з частотою нападів >2 разів на місяць, політопна, рання і групова екстрасистолія, АV-блокада II–III ступеня, трипучкова блокада).
5. АГ III стадії з некоригованим АТ, кризовим перебігом і значними порушеннями функції нирок.
6. Рецидивуючі тромбоемболічні ускладнення.
7. Цукровий діабет декомпенсований або з тяжким перебігом.
8. Неможливість подальшого розширення рухового режиму внаслідок інших причин.
Етапність надання медичної допомоги
Основні компоненти медичної допомоги пацієнтам з ГКС без елевації сегмента ST надаються в спеціалізованому відділенні з можливістю проведення ПКВ. Пацієнти з підозрою на ГКС без елевації сегмента ST потрапляють у спеціалізоване відділення з каретою швидкої допомоги згідно із системою надання невідкладної медичної допомоги МОЗ України з місця розвитку ГКС або транспортуються з іншого закладу охорони здоров’я, або за самозверненням.
Первинний етап
Надання першої медичної або екстреної медичної допомоги на догоспітальному етапі здійснюється:
- диспетчером центру прийому викликів швидкої допомоги (первинна консультативно-діагностична допомога та організація подальших дій бригади швидкої допомоги);
- бригадами екстреної (швидкої) медичної допомоги центрів екстреної медичної допомоги та медицини катастроф, станцій екстреної (швидкої) медичної допомоги, лікарями відділень екстреної (невідкладної) медичної допомоги багатопрофільних лікарень, які входять у систему екстреної медичної допомоги;
- бригадами пунктів невідкладної медичної допомоги для дорослого/дитячого населення;
- лікарями загальної практики — сімейними лікарями, лікарями інших спеціальностей (у разі виявлення такого пацієнта у помешканні або на прийомі).
На догоспітальному етапі (диспетчер швидкої медичної допомоги):
1. Первинна верифікація діагнозу ГКС.
2. Запропонувати до приїзду спеціалізованої бригади прийняти:
- АСК (розжувати) 150–325 мг;
- нітрогліцерин (під язик).
3. Скерувати на виклик звичайну чи спеціалізовану бригаду.
4. Поінформувати спеціалізований стаціонар про наявність хворого з ГКС.
На догоспітальному етапі (бригада швидкої медичної допомоги):
1. Верифікація діагнозу ГКС без елевації сегмента ST.
2. Застосувати АСК 150–325 мг (якщо ще не прийнято), або 250–500 мг внутрішньовенно, тікагрелор 180 мг (за його відсутності — клопідогрель 300 мг).
3. Посиндромна терапія.
4. Можливо визначення тропоніну Т або І, міоглобіну (експрес-тест).
5. Вирішення питання про необхідність проведення реваскуляризації міокарда. Пріоритетними завданнями є стратифікація ризику і транспортування хворого у стаціонар з можливістю проведення ангіографії та ПКВ.
Вторинний етап
На етапі кардіологічного стаціонару без лабораторії (відділення) інтервенційної кардіології — районна, обласна лікарня.
Госпіталізація хворого з ГКС проводиться виключно у відділення кардіологічного профілю з наявністю блоку реанімації інтенсивної терапії або реанімаційного відділення.
Проведення адекватної протиішемічної та протитромботичної терапії згідно з клінічним протоколом — планове призначення антитромбоцитарних препаратів (АСК + тікагрелор або за відсутності останнього — клопідогрель), антикоагулянтів (еноксапарин або фондапаринукс, при неможливості — нефракціонований гепарин), блокаторів бета-адренорецепторів, інгібіторів АПФ/БРА, статинів.
Здійснення діагностичних процедур відносно стратифікації ризику і вирішення питання залежно від ступеня ризику про необхідність транспортування у стаціонар з можливостями ПКВ.
Симптоматичне лікування можливих ускладнень.
Третинний етап
Кардіологічний стаціонар з лабораторією (відділенням) інтервенційної кардіології.
Проведення ПКВ у хворих з наявністю показань до реваскуляризації має проводитися у терміни відповідно до стратифікації ризику.
Забезпечення стандартної терапії антитромбоцитарними препаратами (АСК і тікагрелор, за відсутності останнього можливе призначення клопідогрелю), антикоагулянтами (стандартний гепарин або еноксапарин, або фондапаринукс), блокаторами бета-адренорецепторів, інгібіторами АПФ/БРА, статинами.
Симптоматичне лікування можливих ускладнень.
Перелік фармакологічних препаратів для лікування ГКС без елевації сегмента ST та його можливих ускладнень
- Нітрати: нітрогліцерин; ізосорбіду динітрат.
- Антитромбоцитарні препарати: препарати АСК, тікагрелор; клопідогрель.
- Антикоагулянти: гепарин, еноксапарин, фондапаринукс, варфарин, ривароксабан, дабігатран, апіксабан.
- Блокатори бета-адренорецепторів: бісопролол, есмолол, метопролол, пропранолол, карведилол.
- Адреноміметичні лікарські засоби: допамін, добутамін, адреналін, норадреналін.
- БРА: валсартан, лозартан.
- Інгібітори АПФ: каптоприл; лізиноприл, раміприл, периндоприл, зофеноприл.
- Антиаритмічні лікарські засоби: атропін; лідокаїн, аміодарон, соталол.
- Антагоністи кальцію: дилтіазем, верапаміл, амлодипін, ніфедипін.
- Неглікозидні кардіотонічні засоби: левосимендан.
- Блокатори альдостерону: спіронолактон, еплеренон.
- Діуретики: фуросемід, торасемід.
- Статини: розувастатин, аторвастатин.
- Наркотичні анальгетики: морфін.
- Анксіолітики: діазепам.
- Ненаркотичні анальгетики: метамізол натрію.
- Кровозамінники та перфузійні розчини: натрію хлорид, глюкоза.
- Інгібітори протонної помпи: пантопразол, рабепразол.
Інтервенційні та хірургічні методи лікування хворих на ГКС без елевації сегмента ST
Ці методи проводяться у спеціалізованих відділеннях згідно з порядком, що описаний вище.
Технічні аспекти ПКВ у пацієнтів із ГКС без елевації сегмента ST. Тромботична оклюзія або критичне звуження інфарктзалежної коронарної артерії має лікуватися з використанням перкутанних втручань (ангіопластика, стентування). За наявності необхідного обладнання та матеріалів прохідність інфарктзалежної коронарної артерії має відновлюватися стентуванням (яке має переваги над балонною ангіопластикою при проведенні первинного ПКВ).
Невідкладне ПКВ (група дуже високого та високого ризику): можливе проведення ПКВ тільки в інфарктзалежній судині, за винятком кардіогенного шоку та випадків, коли після ПКВ інфарктзалежної артерії активна ішемія виникає в зоні кровопостачання артерій, не пов’язаних з ІМ. У разі якщо з анатомічних, технічних або клінічних причин проведення перкутанного втручання неможливе, пацієнту показано проведення прямого хірургічного втручання (АКШ).
Інтервенційні втручання у більш стабільних або вже стабілізованих пацієнтів (група проміжного ризику) може проводитися не тільки в артерії, яка забезпечує кровопостачання в зону ішемії, а й в інших судинних регіонах міокарда, у разі наявності переконливих ознак ішемії міокарда (отриманих у тому числі за допомогою внутрішньосудинних методів дослідження FFR, IVUS).
У разі виявлення складного багатосудинного ураження коронарних артерій кардіолог, інтервенційний кардіолог та кардіохірург мають вибрати оптимальну для кожного пацієнта стратегію реваскуляризації (ПКВ/АКШ), враховуючи клінічний стан пацієнта, вираженість та поширеність коронарного атеросклерозу, характеристики уражень. Шкала оцінювання SYNTAX представляє доволі точне прогнозування смерті, ІМ та реваскуляризації ураженої судини (табл. 9). Необхідно пам’ятати, що шкала SYNTAX розрахована у разі використання стентів з лікарським покриттям.
Таблиця 9. Шкала оцінювання SYNTAX
|
Кроки |
Оцінювана змінна |
Опис показника за шкалою SYNTAX |
|
Крок 1 |
Домінування |
Показник окремих коронарних сегментів залежить від домінування коронарної артерії (правої чи лівої). Змішане домінування у шкалі SYNTAX не допускається |
|
Крок 2 |
Коронарний сегмент |
Уражений коронарний сегмент безпосередньо впливає на оцінку, оскільки кожен коронарний сегмент отримує оцінку залежно від місця положення від 0,5 (наприклад задньобокова гілка) до 6 балів (наприклад головний стовбур ЛКА при лівобічному домінуванні). Правобічне домінування. Лівобічне домінування. Фактор оцінювання |
|
Крок 3 |
Діаметр стенозу |
Оцінка кожного ураженого коронарного сегмента множиться на 2 у разі 50–99% стенозу і на 5 — у разі повної оклюзії. У разі повної оклюзії будуть нараховані додаткові бали: вік >3 міс або невідомий: + 1; оклюзія з «тупим кінцем»: + 1; наявність мостовидних колатералей: + 1; перший сегмент видимий дистально: + 1 за невидимий сегмент. Бокова гілка при оклюзії: + 1, якщо діаметр <1,5 мм; + 1, якщо діаметр <1,5 та ≥1,5 мм; + 0, якщо діаметр ≥1,5 мм (біфуркаційне ураження) |
|
Крок 4 |
Трифуркаційне ураження |
Наявність трифуркаційного ураження додає додаткові бали залежно від кількості уражених сегментів: 1 сегмент: + 3; 2 сегменти: + 4; 3 сегменти: + 5; 4 сегменти: + 6 |
|
Крок 5 |
Біфуркаційне ураження |
Наявність біфуркаційного ураження додає додаткові бали залежно від типу біфуркації відповідно до класифікації Медіна: 29 Медіна 1,0,0 або 0,1,0: +1; Медіна 1,1,1 або 0,0,1 або 1,0,1 або 0,1,1: +2. Крім того, наявність кута біфуркації <70° додає 1 бал |
|
Крок 6 |
Аортогирлове ураження |
Наявність аортоостіального ураження: +1 |
|
Крок 7 |
Тяжкий ступінь завитості судин |
Наявність тяжкого ступеня завитості судин поблизу ураженого сегмента: +2 |
|
Крок 8 |
Довжина ураження |
Довжина ураження >20 мм: +1 |
|
Крок 9 |
Кальцифікація |
Наявність тяжкого ступеня кальцифікації: +2 |
|
Крок 10 |
Тромби |
Наявність тромбів: +1 |
|
Крок 11 |
Дифузні захворювання/малі судини |
Наявність сегментів з дифузним захворюванням або звужених сегментів дистальніше ураження (наприклад, коли щонайменше 75% довжини сегмента дистальніше ураження мають діаметр <2 мм): +1 додатковий бал за кожен сегмент |
Стандарти надання медичної допомоги хворим із ГКС з елевацією сегмента SТ (IМ із зубцем Q)
(О.М. Пархоменко, О.І. Іркін, М.Ю. Соколов, Я.М. Лутай, О.В. Шумаков, В.О. Шумаков)
Рубрика за МКХ-10: I21–I22.
Ознаки та критерії діагностики захворювання
ГКС зі стійкою елевацією SТ у більшості випадків передує гострому IМ із зубцем Q. Гострий IМ — це некроз будь-якої маси міокарда внаслідок гострої тривалої ішемії. Клінічними діагностичними критеріями слід вважати:
- затяжний (>20 хв) ангінозний біль у спокої;
- наявність типових змін на ЕКГ (елевація SТ >0,1 мВ у стандартних відведеннях та/або >0,2 мВ у прекардіальних відведеннях із характерною динамікою, поява патологічного зубця Q, блокада лівої або правої ніжки пучка Гіса, що гостро виникла, депресія сегмента ST ≥0,1 мВ у восьми відведеннях ЕКГ та елевація сегмета ST у відведеннях aVR та/або V1);
- підвищення рівня біохімічних маркерів некрозу міокарда (критерій верифікації в суперечливих випадках);
- у складних діагностичних випадках допоміжним методом верифікації діагнозу може слугувати ехоКГ.
Умови надання медичної допомоги
Хворих з ГКС зі стійкою елевацією SТ слід обов’язково терміново госпіталізувати у відділення реанімації й інтенсивної терапії кардіологічного профілю або у спеціалізоване інфарктне (кардіологічне) відділення стаціонару з блоком інтенсивного спостереження, лікування і реанімації. При госпіталізації хворих у перші 24 год від розвитку захворювання перевагу слід надавати відділенням з можливістю проведення ПКВ.
Після стабілізації стану хворих переводять на амбулаторне лікування.
Алгоритм ведення пацієнта з ГКС з елевацією сегмента ST при надходженні в стаціонар
Коронарна ангіографія
ЕКГ; невідкладна медична допомога; ПКВ; ГКС з елевацією ST — ІМ з елевацією сегмента ST.
Програма діагностики
Догоспітальний етап
Обов’язкові дослідження:
1. Визначення скарг і анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ.
4. ЕКГ у 12 відведеннях (час від першого медичного контакту до реєстрації ЕКГ не повинен перевищувати 10 хв).
5. Моніторування ЕКГ з можливістю проведення дефібриляції.
Додаткові дослідження:
1. Пульсоксиметрія.
Госпітальний етап
Обов’язкові дослідження:
1. Визначення скарг і анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ.
4. ЕКГ у 12 відведеннях у динаміці.
5. Моніторування ЕКГ.
6. Пульсоксиметрія.
7. Лабораторне обстеження (загальні аналізи крові й сечі, КФК у динаміці 3 рази, визначення МВ-фракції КФК або тропоніну Т або І за необхідності в динаміці 2 рази, АлАТ, калій, натрій, білірубін, креатинін, ХС загальний, ХС ЛПНЩ, ХС ЛПВЩ, ТГ, глюкоза в крові).
8. ЕхоКГ у динаміці.
9. КВГ — обов’язково за давності ГКС до 12 год і можливості виконання процедури протягом 120 хв після першого звернення за медичною допомогою.
Додаткові дослідження:
1. КВГ — рекомендовано за давності ГКС від 12 до 24 год.
2. АЧТЧ (при лікуванні нефракціонованим гепарином) або міжнародне нормалізоване відношення (МНВ) у разі застосування пероральних антикоагулянтів.
3. Навантажувальний тест (велоергометрія або тредміл) при стабілізації стану і за відсутності протипоказань.
4. Рентгенографія органів грудної клітки.
Стратифікація серцево-судинного ризику
У гострий період усі пацієнти з ГКС з елевацією сегмента ST вважаються пацієнтами високого ризику і потребують проведення невідкладної реперфузійної та адекватної медикаментозної терапії.
На етапі відновлювального лікування ступінь ризику і потреба в подальшому інвазивному/хірургічному лікуванні визначається за результатами навантажувального тестування та оцінки систолічної функції ЛШ (табл. 10).
Таблиця 10. Визначення ступеня ризику і потреби в подальшому інвазивному/хірургічному лікуванні на етапі реабілітації
|
Рівень ризику |
Показники |
|
Низький |
Рівень функціональної здатності ≥7 МЕТ Від’ємні ознаки виявлення ішемії міокарда при проведенні навантажувального тесту (об’єм виконаної роботи >22 кДж) Нормальна функція ЛШ (ФВ ≥50% за відсутності АГ) |
|
Середній |
Рівень функціональної здатності >5 МЕТ, <7 МЕТ; виявлення ознак ішемії міокарда при проведенні навантажувального тестування (обсяг виконаної роботи 22 кДж) Зміни геометрії ЛШ, ФВ ЛШ 35–49% Значні коливання АТ при фізичному навантаженні |
|
Високий |
Стенокардія, що погано піддається лікуванню, функціональна здатність ≤5 МЕТ Ознаки ішемії міокарда при проведенні ДФН (об’єм виконаної роботи <22 кДж) Застійна СН, ФВ ЛШ ≤35% Значна кількість шлуночкових екстрасистол високих градацій |
Програма лікування
Перелік і обсяг обов’язкових медичних послуг
1. Знеболення — препарати вибору опіоїди (морфін). Для заспокоювання хворого можливе призначення транквілізаторів.
2. Оксигенотерапія — проводиться при SрO2 ≤90%.
3. Реперфузійна терапія має проводитися всім хворим з ГКС з елевацією ST у перші 12–24 год від початку захворювання. У пацієнтів, які мають ознаки активної ішемії, реперфузійна терапія (бажано ПКВ) може проводитися, навіть коли симптоми тривають більше 12 год або зміни на ЕКГ були переривчастими. Проведення ПКВ у стабільних пацієнтів, які потрапили до лікарні через 12–24 год від розвитку симптомів, може розглядатися в індивідуальному порядку.
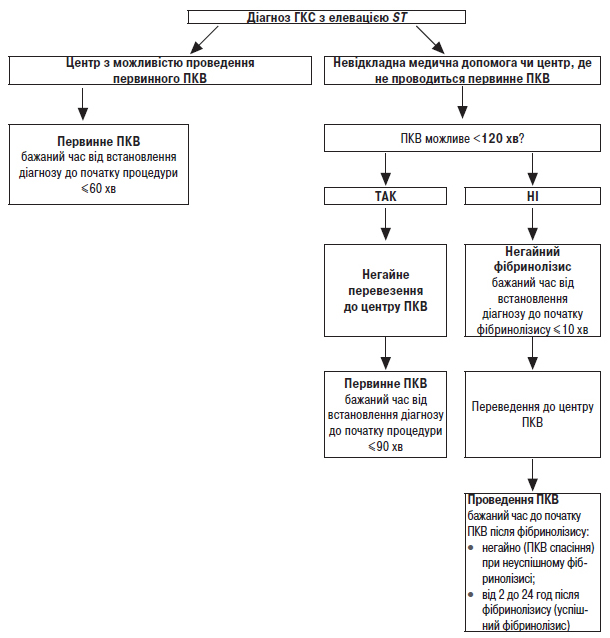
А. Методом вибору реперфузійної терапії є ПКВ (за можливості виконання процедури протягом 120 хв після першого звернення за медичною допомогою).
Б. Тромболітична терапія стрептокіназою, альтеплазою або тенектеплазою повинна проводитися за відсутності протипоказань і за неможливості проведення ПКВ у рекомендований термін. Тромболітичну терапію слід починати якнайшвидше (протягом 10 хв після встановлення діагнозу) після діагностики ГКС. Повинна надаватися перевага догоспітальному проведенню тромболітичної терапії (бажано тенектеплазою). У пацієнтів віком ≥75 років треба використовувати половинну дозу тенектеплази.
4. АСК 75–100 мг/добу.
5. Тікагрелор (у хворих, яким планується проведення ПКВ) або клопідогрель (хворі без проведення реперфузійної терапії або хворі, які отримували тромболітичну терапію, або хворі, яким проводилося ПКВ, але є показання до тривалої антикоагулянтної терапії). Хворі, яким після фібринолізису проведено ПКВ, можуть також бути переведені на подальший прийом тікагрелору через 6–8 год після фібринолізису до проведення (у разі можливості) інтервенційного втручання. Прийом клопідогрелю на попередніх етапах медичної допомоги не є протипоказанням для переведення хворого на тікагрелор (за необхідності).
6. Внутрішньовенна форма інгібітора ліпоксигеназ кверцетину застосовується до проведення реперфузії міокарда і протягом 5 діб лікування за схемою.
7. Нефракціонований гепарин (70–100 МО/кг маси тіла) або низькомолекулярний гепарин еноксапарин (0,5 мг/кг маси тіла) внутрішньовенно болюсно під час ПКВ. Після втручання рутинне призначення антикоагулянтів не рекомендовано, окрім пацієнтів з іншими показаннями для повнодозової (механічні клапани, тромбоутворення у ЛШ, супутня ФП, неповна реваскуляризація та персистуюча ішемія міокарда) або профілактичної (профілактика венозних тромбоемболій) антикоагулянтної терапії. У пацієнтів, яким проводили фібринолізис, рекомендована повнодозова антикоагулянтна терапія, при цьому пріоритетним препаратом є еноксапарин (30 мг внутрішньовенно болюсно, через 15 хв 1 мг/кг маси тіла підшкірно, потім ця ж доза кожні 12 год). У пацієнтів віком ≥75 років внутрішньовенний болюс еноксапарину не проводиться, а підшкірна доза препарату становить 0,75 мг/кг маси тіла. Може використовуватися також внутрішньовенна інфузія нефракціонованого гепарину під контролем АЧТЧ. Можливо призначення фондапаринуксу (2,5 мг внутрішньовенно болюсно, потім 2,5 мг підшкірно кожні 24 год). Фондапаринукс є також препаратом вибору для пацієнтів, яким не проводили реваскуляризацію. Тривалість антикоагулянтної терапії після фібринолізису та у нереваскуляризованих пацієнтів — до проведення ПКВ або протягом стаціонарного лікування (до 8 діб, при збереженні ознак ішемії — і більше).
8. Інтенсивна (аторвастатин 40–80 мг, розувастатин 20–40 мг) терапія статинами показана всім хворим за відсутності протипоказань. Початок терапії якомога раніше, бажано до реваскуляризації міокарда.
9. Блокатори бета-адренорецепторів без внутрішньої симпатоміметичної активності. У пацієнтів без протипоказань (набряк легень, кардіогений шок, атріовентрикулярні блокади) краще починати з внутрішньовенного введення блокаторів бета-адренорецепторів.
10. Блокатори кальцієвих каналів. Дилтіазем і верапаміл доцільні при лікуванні хворих, які мають протипоказання до застосування блокаторів бета-адренорецепторів за відсутності СН із систолічною дисфункцією. Дигідропіридини тривалої дії можна застосовувати з метою антигіпертензивного і додаткового антиангінального ефектів тільки з блокаторами бета-адренорецепторів. Дигідропіридинові похідні короткої дії протипоказані.
11. Нітрати за наявності стенокардії та/або ознак ішемії міокарда, гострої СН або значної дилатації ЛШ для зменшення переднавантаження. Як альтернативу можна застосовувати сидноніміни.
12. Інгібітори АПФ, за їх непереносимості — блокатори АТ1-рецепторів до ангіотензину II.
Перелік і обсяг додаткових медичних послуг
1. Для знеболювання при недостатньому ефекті нітратів і блокаторів бета-адренорецепторів — наркотичні анальгетики (у першу чергу морфін).
2. При підвищенні АТ — антигіпертензивна терапія, насамперед інгібітори АПФ, урапідил, нітрати.
3. При рецидивуванні ішемії міокарда — реваскуляризація міокарда. Показання і вибір методу реваскуляризації визначаються характером ураження коронарних артерій за даними КВГ.
4. Лікування основних ускладнень:
4.1. Гостра лівошлуночкова недостатність (класифікація за Т. Кillip, J. Кіmball, 1969):
4.1.1. початкова й помірно виражена (Кillip II): нітрати (внутрішньовенно або перорально), блокатори рецепторів альдостерону (еплеренон, верошпірон), фуросемід на тлі лікування інгібітором АПФ, корвітином та блокатором бета-адренорецепторів;
4.1.2. тяжка (Кillip III): фуросемід (внутрішньовенно), нітрати (внутрішньовенно), левосимендан (внутрішньовенно), корвітин, штучна вентиляція легень (ШВЛ); у разі розвитку альвеолярного набряку легень: піногасники, морфін, кровопускання;
4.1.3. кардіогенний шок:
4.1.3.1. рефлекторний — наркотичні анальгетики, симпатоміметики;
4.1.3.2. аритмічний: ЕІТ або електрокардіостимуляція;
4.1.3.3. справжній: допамін, добутамін, норадреналін, адреналін, левосимендан, реваскуляризація міокарда (ПКВ, АКШ), внутрішньоаортальна балонна контрапульсація (за можливості), прилади допоміжного кровообігу (ECMO, Impala та ін.);
4.2. Тяжкі шлуночкові порушення ритму: блокатори бета-адренорецепторів, аміодарон (за необхідності подальшої профілактики), лідокаїн.
4.3. АV-блокади: профілактичне встановлення ендокардіального електрода в ПШ (АV-блокада II ступеня Мобітц І при задньому IМ, АV-блокада II ступеня Мобітц II, АV-блокада III ступеня), при порушенні гемодинаміки — електрокардіостимуляція.
4.4. За наявності тромбоутворення в порожнині ЛШ або ФП показана тривала пероральна антикоагулянтна терапія.
5. При виявленні гіперглікемії (≥11,1 ммоль/л) розпочати терапію інсуліном та підтримувати рівень глюкози у межах 6,1–10,0 ммоль/л , уникаючи гіпоглікемії(<3,9 ммоль/л). Проводити частий моніторинг рівня глюкози до стабілізації стану.
Характеристика очікуваного кінцевого результату лікування
Відсутність або зменшення кількості ускладнень.
Тривалість лікування
Обов’язкове стаціонарне лікування тривалістю 10–14 днів. Подовження строків лікування можливе за наявності ускладнень, насамперед СН, післяінфарктної стенокардії, тяжких порушень ритму та АV-блокад.
Критерії якості лікування
Відсутність клінічних та ЕКГ-ознак гострої ішемії міокарда та СН.
Відсутність ознак високого ризику за даними навантажувальних тестів (ішемічна депресія сегмента SТ >0,2 мВ, толерантність до фізичного навантаження <5 МЕТS — 75 Вт або роботи <22 кДж, зниження САТ під час навантаження). Відсутність СН вище І стадії, рецидивування потенційно фатальних аритмій, АV-блокад високого ступеня.
Можливі побічні дії та ускладнення
Можливі побічні дії препаратів відповідно до їх фармакологічних властивостей. Проведення адекватної тромболітичної, антитромботичної терапії, ПКВ може спровокувати кровотечу.
Рекомендації щодо амбулаторного спостереження
Хворі мають перебувати на диспансерному обліку за місцем проживання протягом усього життя. Слід проводити щорічне обов’язкове обстеження, за необхідності — обстеження і корекцію терапії.
Освітні заходи щодо способу життя
Вимоги до дієтичних призначень і обмежень
Хворі повинні дотримуватися дієти з обмеженням солі до 6 г/добу, тваринних жирів і продуктів, що містять ХС. Рекомендується дієта, збагачена омега-3 поліненасиченими жирними кислотами (морська риба). При надмірній масі тіла обмежується калорійність їжі. За наявності шкідливих звичок — відмова від тютюнопаління, обмеження вживання алкоголю.
Реабілітаційні заходи
Рекомендуються обмежені ДФН під контролем фахівців. Не рекомендуються перебування під прямими сонячними променями, переохолодження і перегрівання. Показана реабілітація в амбулаторних умовах або приміських спеціалізованих санаторіях (за відсутності протипоказань).
Відновному лікуванню в реабілітаційних кардіологічних відділеннях місцевих санаторіїв підлягають хворі відповідно до встановленого порядку направлення. Переведення хворих у спеціалізоване відділення санаторіїв здійснюється після досягнення адекватного вимогам ВООЗ (за даними клінічного й ЕКГ-контролю) такого рівня фізичної активності: дозована ходьба на 1000 м в 1–2 прийоми й підйом на 17–22 сходинки.
При направленні на санаторний етап реабілітації слід керуватися функціональною підготовкою хворого до виконання зазначеного рівня рухової активності, а не часом виникнення IМ або нестабільної стенокардії. При неадекватному виконанні рухового режиму — тест з фізичним навантаженням або коронароангіографія для вирішення питання про необхідність хірургічного втручання.
Показання до санаторного етапу
1. Хворі з первинним або повторним Q (великовогнищевим, трансмуральним) або без зубця Q (дрібновогнищевим), при задовільному виконанні необхідного рівня фізичного режиму.
2. Після операції АКШ, резекції аневризми, стентування коронарних судин або хірургічних втручань з приводу порушень серцевого ритму не раніше ніж через 15–18 днів після операції (без післяопераційних ускладнень).
3. Допускається наявність у хворих таких ускладнень і супутніх захворювань на момент направлення їх до санаторію:
- СН не вище IIА стадії;
- нормо- або брадиаритмічна форма постійної форми ФП;
- одинична або часта (не політопна, не групова і не рання (R на Т)) екстрасистолія;
- АV-блокада не вище І ступеня;
- аневризма серця при недостатності кровообігу не вище IIА стадії;
- АГ з коригованим АТ та безкризовим перебігом;
- цукровий діабет 2-го типу (компенсований або субкомпенсований).
Протипоказання до проведення санаторного етапу лікування
1. Загальні протипоказання, які виключають направлення хворих у санаторій (гострі інфекційні, венеричні, психічні захворювання, захворювання крові в гострій стадії та стадії загострення, злоякісні новоутворення, супутні захворювання в стадії декомпенсації або загострення та ін.).
2. СН вище IIА стадії.
3. Стенокардія IV ФК.
4. Тяжкі порушення серцевого ритму і провідності (часті пароксизми фібриляції й або пароксизмальна тахікардія, політопна, рання і групова екстрасистолія, АV-блокада II–III ступеня, трипучкова блокада).
5. АГ III ступеня з некоригованим АТ, кризовим перебігом і значними порушеннями функції нирок.
6. Рецидивні тромбоемболічні ускладнення.
7. Цукровий діабет декомпенсований та/або тяжкого перебігу.
8. Неможливість виконувати подальше розширення рухового режиму внаслідок інших причин.
Етапність надання медичної допомоги
Основні компоненти медичної допомоги пацієнтам з ГКС з елевацією сегмента ST надаються в спеціалізованому відділенні з можливістю проведення ПКВ. Пацієнти з підозрою на ГКС з елевацією сегмента ST потрапляють у спеціалізоване відділення за допомогою карети швидкої медичної допомоги згідно із системою надання невідкладної медичної допомоги МОЗ України з місця розвитку ГКС або транспортуються з іншого закладу охорони здоров’я, що не має можливості проведення невідкладних коронарних втручань.
Первинний етап
Догоспітальний етап включає координацію надання першої медичної та екстреної медичної допомоги пацієнтам з гострим ІМ з моменту виявлення хворого або звернення такого пацієнта (родичів або свідків) за медичною допомогою до моменту госпіталізації.
Надання першої медичної або екстреної медичної допомоги на догоспітальному етапі здійснюється:
- диспетчером центру прийому викликів швидкої допомоги (первинна консультативно-діагностична допомога та організація подальших дій бригади швидкої допомоги);
- бригадами екстреної (швидкої) медичної допомоги центрів екстреної медичної допомоги та медицини катастроф, станцій екстреної (швидкої) медичної допомоги, лікарями відділень екстреної (невідкладної) медичної допомоги багатопрофільних лікарень, які входять у систему екстреної медичної допомоги;
- бригадами пунктів невідкладної медичної допомоги для дорослого/дитячого населення;
- лікарями загальної практики — сімейними лікарями, лікарями інших спеціальностей (у разі виявлення такого пацієнта у помешканні або на прийомі).
На догоспітальному етапі (диспетчер швидкої медичної допомоги):
1. Первинна верифікація діагнозу ГКС.
2. Запропонувати до приїзду спеціалізованої бригади прийняти:
- АСК (розжувати) 150–325 мг;
- нітрогліцерин (під язик).
3. Скерувати на виклик звичайну чи спеціалізовану бригаду.
4. Поінформувати спеціалізований стаціонар про наявність хворого з ГКС.
На догоспітальному етапі (бригада швидкої допомоги):
1. Верифікація діагнозу ГКС.
2. Застосувати таблетовану форму АСК 150–325 мг (якщо ще не прийнято) або 250–500 мг внутрішньовенно, тікагрелор 180 мг (якщо планується транспортування хворого для проведення первинного ЧПКВ) або клопідогрель 300 мг.
3. Посиндромна терапія.
4. Вирішення питання про необхідність проведення ургентної реперфузії міокарда. Пріоритетним завданням є транспортування хворого у стаціонар з можливістю проведення ангіографії та первинного ПКВ (ЧПКВ, тобто ангіопластики/стентування інфарктзалежної коронарної артерії), якщо це можливо зробити протягом 120 хв від першого медичного контакту з хворим, при неможливості — проведення догоспітального тромболізису (згідно з протоколом) або транспортування в стаціонар для проведення госпітального тромболізису (у разі якщо спеціалізована бригада не може провести догоспітальний тромболізис на етапі транспортування хворого).
Вторинний етап
На етапі стаціонару без лабораторії (відділення) інтервенційної кардіології — районна лікарня (за відсутності умов транспортування хворого для проведення первинного ЧПКВ у найближчі 120 хв).
1. Госпіталізація хворого з ГКС проводиться виключно у відділення кардіологічного профілю з наявністю блоку реанімації інтенсивної терапії або реанімаційного відділення.
2. Проведення тромболітичної терапії за наявності показань і відсутності протипоказань згідно з протоколом тромболітичної терапії. Час від потрапляння хворого в стаціонар до початку тромболітичної терапії не має перевищувати 30 хв («двері — голка»).
3. Вирішення питання про транспортування хворого до стаціонару з наявністю ангіографічного обладнання та умов для ЧПКВ. У разі клінічно успішного тромболізису також є доцільним проведення діагностичної ангіографії у перші 24 год від початку захворювання (але не раніше ніж через 2 год після закінчення тромболітичної терапії, якщо немає показань для негайного проведення ангіографії — посилення болю, ознаки лівошлуночкової недостатності, негативна динаміка на ЕКГ тощо).
4. Планове призначення антитромбоцитарних препаратів (АСК + клопідогрель), антикоагулянтів (стандартний гепарин або еноксапарин, або фондапаринукс), корвітину, блокаторів бета-адренорецепторів, інгібіторів АПФ/БРА, статинів.
Третинний етап
Стаціонар з лабораторією (відділенням) інтервенційної кардіології.
1. Проведення ПКВ у хворих з наявністю показань (з персистуючою елевацією сегмента ST, больовим синдромом) необхідне якомога раніше від моменту госпіталізації, але протягом перших 24 год захворювання.
2. Час від потрапляння хворого в стаціонар до відкриття інфарктзалежної судини не повинен перевищувати 60–90 хв («двері — балон»).
3. Якщо хворий транспортований зі стаціонару без ангіографічної підтримки, загальний час від першого лікарського огляду пацієнта до відкриття інфарктзалежної судини не повинен перевищувати 120 хв («КШД — балон»).
4. Забезпечення своєчасного проведення «ЧПКВ порятунку» у хворих з неефективним тромболізисом, який проводився на етапах госпіталізації (або в лікарні, з якої пацієнт переведений для проведення «ЧПКВ порятунку»).
5. У разі неінвазивних ознак ефективної фібринолітичної терапії у стабільних пацієнтів необхідно визначати час проведення діагностичної коронарографії з метою вирішення питання про подальшу реваскуляризацію міокарда (бажано протягом перших 24 год).
6. Забезпечення стандартної терапії антитромбоцитарними препаратами (АСК + тікагрелор або АСК + клопідогрель), антикоагулянтами (еноксапарин або фондапаринукс), корвітином, блокаторами бета-адренорецепторів, інгібіторами АПФ/БРА, статинами.
Перелік фармакологічних препаратів для лікування ГКС з елевацією сегмента ST та його можливих ускладнень
Для закладів, які надають екстрену медичну допомогу
1. Нітрати: нітрогліцерин.
2. Антиагреганти: АСК, ацелізин, тікагрелор, клопідогрель.
3. Антикоагулянти: гепарин, еноксапарин.
4. Блокатори бета-адренорецепторів: есмолол, метопролол, бісопролол, пропранолол; карведилол.
5. Адреноміметичні лікарські засоби: добутамін, дофамін, норадреналін, адреналін.
6. Наркотичні анальгетики: морфін, тримеперидин.
7. Анксіолітики: діазепам.
8. Ненаркотичні анальгетики: метамізол натрію.
9. Кровозамінники та перфузійні розчини: натрію хлорид, глюкоза.
Для закладів, які надають первинну медичну допомогу
1. Нітрати: нітрогліцерин.
2. Антиагреганти: АСК, ацелізин, тікагрелор, клопідогрель.
3. Антикоагулянти: гепарин, еноксапарин.
4. Блокатори бета-адренорецепторів: пропранолол, бісопролол, есмолол, метопролол, карведилол.
5. Наркотичні анальгетики: тримеперидин.
6. Анксіолітики: діазепам.
7. Ненаркотичні анальгетики: метамізол натрію.
8. Кровозамінники та перфузійні розчини: натрію хлорид, глюкоза.
Для закладів, які надають вторинну (і третинну) медичну допомогу
1. Нітрати: нітрогліцерин, ізосорбіду динітрат.
2. Препарати АСК: АСК.
3. Антиагреганти: тікагрелор, клопідогрель, ептифібатид.
4. Антикоагулянти: гепарин, еноксапарин, фондапаринукс, варфарин, ривароксабан, дабігатран, апіксабан.
5. Фібринолітики: альтеплаза, стрептокіназа, тенектеплаза.
6. Блокатори бета-адренорецепторів: есмолол, бісопролол, метопролол, пропранолол, карведилол.
7. Адреноміметичні лікарські засоби: допамін, добутамін, норадреналін, адреналін.
8. Внутрішньовенна форма блокатора ліпоксигенази кверцетину — корвітин.
9. БРА: валсартан; лозартан.
10. Інгібітори АПФ: каптоприл, лізиноприл, раміприл, периндоприл, зофенаприл.
11. Антиаритмічні лікарські засоби: атропін, лідокаїн, аміодарон.
12. Антагоністи кальцію: дилтіазем, верапаміл, амлодипін.
13. Неглікозидні кардіотонічні засоби: левосимендан.
14. Блокатори альдостерону: спіронолактон, еплеренон.
15. Діуретики: фуросемід, торасемід.
16. Інгібітори редуктази 3-гідрокси-метилглутарил-коензим-А (ГМГ-КоА) або статини: аторвастатин, розувастатин.
17. Наркотичні анальгетики: морфін.
18. Анксіолітики: діазепам.
19. Ненаркотичні анальгетики: метамізол натрію.
20. Кровозамінники та перфузійні розчини: натрію хлорид, глюкоза.
21. Інгібітори протонної помпи: пантопразол, рабепразол.
Інтервенційні та хірургічні методи лікування
Ці методи проводяться у спеціалізованих відділеннях згідно з порядком, що описаний вище. Технічні аспекти ПКВ у пацієнтів з ГКС з елевацією сегмента ST: тромботична оклюзія або критичне звуження інфарктзалежної коронарної артерії має лікуватися з використанням перкутанних втручань (ангіопластика, стентування). За наявності необхідного обладнання та матеріалів прохідність інфарктзалежної коронарної артерії має відновлюватися стентуванням (яке має переваги над балонною ангіопластикою при проведенні первинного ПКВ).
Невідкладне ПКВ: можливе проведення ПКВ тільки в інфарктзалежній судині, за винятком кардіогенного шоку та випадків, коли після ПКВ інфарктзалежної артерії активна ішемія виникає в зоні кровопостачання артерій, не пов’язаних з інфарктом міокарда. У разі якщо з анатомічних, технічних або клінічних причин проведення перкутанного втручання неможливе, пацієнту показане проведення прямого хірургічного втручання (АКШ).
У разі виявлення складного багатосудинного ураження коронарних артерій необхідно своєчасно обрати оптимальну для кожного пацієнта стратегію реваскуляризації (ПКВ/АКШ), враховуючи клінічний стан хворого, вираженість та поширеність коронарного атеросклерозу, характеристики уражень. Шкала оцінювання SYNTAX представляє доволі точне прогнозування смерті, ІМ та реваскуляризації ураженої судини. Необхідно пам’ятати, що шкала SYNTAX розрахована у разі використання стентів з лікарським покриттям (див. табл. 10).
Стандарти надання медичної допомоги хворим із хронічною ІХС
(М.І. Лутай, М.Ю. Соколов, Г.Ф. Лисенко, І.П. Голікова)
Рубрика за МКХ-10: І20.8.
Хронічна ІХС характеризується розвитком епізодів ішемії за рахунок дисбалансу між потребою у кисні та кровопостачанням міокарда на фоні атеросклеротичного ураження коронарних артерій серця. Як правило, такі епізоди провокуються фізичними або емоційними навантаженнями, у деяких випадках — іншими стресовими ситуаціями, а також можуть з’являтися спонтанно. Класичним клінічним проявом ішемії міокарда є напад стенокардії напруження. ФК стенокардії напруження (за класифікацією Канадської асоціації кардіологів — табл. 11) визначається за мінімальним рівнем фізичного навантаження, який викликає ішемію.
Таблиця 11. Визначення ФК стабільної стенокардії напруження за класифікацією Канадської асоціації кардіологів
|
ФК І |
Звичайна фізична активність (ходьба, підйом сходами) не провокує стенокардію. Стенокардія виникає при значних, раптових чи тривалих навантаженнях |
|
ФК ІІ |
Незначні обмеження звичайної фізичної активності. Стенокардія провокується швидкою ходою чи підйомом сходами, фізичними навантаженнями після прийому їжі, у холодну, вітряну погоду, після емоційних стресів чи тільки в перші години після пробудження. Рівень толерантності до фізичного навантаження — ходьба більше 2 кварталів*/підйом сходами вище 1-го поверху у звичайному темпі і за нормальних умов |
|
ФК ІІІ |
Суттєві обмеження звичайної фізичної активності. Стенокардія виникає при подоланні відстані 1–2 квартали* по рівній поверхні чи підйомі на 1-й поверх у звичайному темпі і за нормальних умов |
|
ФК ІV |
Неможливість виконувати будь-які фізичні навантаження без дискомфорту — синдром стенокардії може виникати у стані спокою |
*Еквівалент 100–200 м.
ІХС певний час може мати безсимптомний перебіг і дебютувати ГКС чи ІМ, а також — довготривалий доклінічний період на фоні підтвердженого коронарного атеросклерозу. Вазоспастична, мікроваскулярна та рефрактерна стенокардія розглядаються як особливі форми хронічної ІХС.
Умови надання медичної допомоги
Для пацієнтів з підтвердженим діагнозом ІХС, незалежно від перенесеної реваскуляризації чи ГКС/ІМ, показане щорічне обстеження (кардіологом чи лікарем загальної практики), навіть за відсутності симптомів.
Хворі зі стабільною стенокардією напруження І–ІІ ФК підлягають амбулаторному обстеженню та лікуванню за місцем проживання. Регулярність диспансерних візитів до сімейного лікаря/кардіолога — 1 раз на рік за умови стабільного перебігу захворювання. За необхідності додаткових обстежень пацієнту можуть бути рекомендовані консультації/стаціонарне лікування у районних/міських/обласних спеціалізованих кардіологічних відділеннях, диспансерах, діагностичних центрах тощо. Хворим зі стенокардією напруження ІІІ–ІV ФК, а також при появі стенокардії у стані спокою показане стаціонарне лікування у відповідних кардіологічних закладах. За наявності стенокардії напруження ІІІ–ІV ФК пацієнтам рекомендоване проведення інвазивної коронароангіографії (ІКАГ) для вибору подальшої тактики лікування. Підтверджений діагноз ІХС є підставою для обговорення з хворим можливості проведення ІКАГ з подальшою реваскуляризацією міокарда, незалежно від ФК стенокардії.
Протягом першого року після реваскуляризації та/або ГКС/ІМ пацієнтам рекомендовані не менше 2 візитів до кардіолога, оскільки у них існує вищий ризик кардіоваскулярних ускладнень та суттєво змінюється фармакотерапія, що потребує ретельного контролю.
Програма діагностики
1. Збір анамнезу, визначення скарг і факторів серцево-судинного ризику.
2. У пацієнтів, які потребують встановлення діагнозу, — оцінка претестової ймовірності ІХС (табл. 12).
3. Клінічний огляд.
4. Вимірювання АТ.
5. Лабораторне обстеження.
Первинне:
- загальний аналіз крові (обов’язкове визначення гемоглобіну, загальної кількості лейкоцитів, швидкість осідання еритроцитів (ШОЕ)), загальний аналіз сечі, біохімічні показники (глюкоза у сироватці крові, загальний ХС, ТГ, ХС ЛПНЩ, ХС ЛПВЩ, калій, натрій, креатинін, ШКФ);
- при підозрі на клінічну нестабільність/ГКС — визначення тропоніну.
Щорічний диспансерний огляд: гемоглобін, показники ліпідного та вуглеводного обміну, креатинін, ШКФ.
Додатково за показаннями:
- контроль печінкових ферментів (АлАТ) — для пацієнтів, які приймають статини (перед початком терапії, при появі відповідних симптомів, зміні препаратів чи їх дозування);
- контроль креатинкінази/КФК — для пацієнтів з ризиком або симптомами можливої міопатії на фоні прийому статинів;
- глікозильований гемоглобін при підозрі на цукровий діабет;
- за необхідності (наявність миготливої аритмії, клінічні симптоми патології щитоподібної залози) — тиреотропний гормон (ТТГ);
- натрійуретичний пептид (НУП) типу В при підозрі на СН.
6. ЕКГ у 12 відведеннях — під час кожного планового візиту до лікаря.
7. ЕхоКГ — під час щорічного диспансерного обстеження. Безсимптомним стабільним хворим — кожні 2–5 років. Хворим, які мали систолічну дисфункцію ЛШ до реваскуляризації чи під час ГКС, показана ехоКГ для оцінки функції ЛШ через 8–12 тиж після втручання/виписки зі стаціонару.
8. Тест із ДФН: велоергометрія або тредміл. Для визначення залишкової ішемії — одразу після процедури реваскуляризації. Кожні 2 роки у стабільних симптомних пацієнтів за умови ефективної антиангінальної терапії. Кожні 2–5 років — у суб’єктивно безсимптомних пацієнтів.
9. Неінвазивні тести з візуалізацією міокарда (за наявності відповідних можливостей та за умови неінформативності проб з ДФН):
- стрес-ехоКГ з ДФН чи добутаміном;
- сцинтиграфія міокарда (однофотонна емісійна комп’ютерна томографія (ОФЕКТ)/позитронна емісійна томографія (ПЕТ)). У якості радіонуклідного маркера найчастіше використовується технецій-99m, надається перевага тестам з фізичним навантаженням. Якість зображення дещо вища при використанні ПЕТ;
- стрес-тести з використанням МРТ. Метод використовується у поєднанні з фармакологічними засобами.
10. Неінвазивні методи дослідження анатомії коронарних артерій: зазвичай рекомендована комп’ютерно-томографічна коронарографія (КТ-коронарографія); коронарографія з використанням МРТ (МРТ-коронарографія) здебільшого використовується з дослідницькою метою. Окрім випадків рутинної діагностики, КТ-коронарографія показана пацієнтам з підтвердженим діагнозом ІХС та незрозумілим зниженням ФВ ЛШ.
11. ІКАГ:
- рекомендована хворим із симптомами ІХС, у яких очікується безсумнівна користь від проведення реваскуляризації міокарда (стентування, АКШ) або визначається високий ризик кардіоваскулярних ускладнень (див. Стратифікація кардіоваскулярного ризику). Пацієнтам з тяжкою/резистентною стенокардією і клінічним профілем високого кардіоваскулярного ризику ІКАГ показана без додаткових неінвазивних досліджень;
- показана для підтвердження/встановлення діагнозу ІХС пацієнтам, які неспроможні пройти стрес-тести з ДФН/візуалізацією міокарда, мають неінформативні результати щодо зазначених тестів, а також знижену ФВ ЛШ <40% у поєднанні з типовою стенокардією;
- рекомендована представникам особливих професій, пов’язаних із громадською безпекою (водії громадського транспорту, військові, авіапілоти тощо).
Таблиця 12. Претестова імовірність ІХС* у пацієнтів з больовим синдромом у грудній клітці (%)
|
Типова стенокардія |
Атипова стенокардія |
Неангінальний біль |
||||
|
Вік, років |
Чоловіки |
Жінки |
Чоловіки |
Жінки |
Чоловіки |
Жінки |
|
30–39 |
59 |
28 |
29 |
10 |
18 |
5 |
|
40–49 |
69 |
37 |
38 |
14 |
25 |
8 |
|
50–59 |
77 |
47 |
49 |
20 |
34 |
12 |
|
60–69 |
84 |
58 |
59 |
28 |
44 |
17 |
|
70–79 |
89 |
68 |
69 |
37 |
54 |
24 |
|
>80 |
93 |
76 |
78 |
47 |
65 |
32 |
*Імовірність обструктивної ІХС обчислювалася для пацієнтів віком 35, 45, 55, 65, 75 і 85 років (для визначення претестової ймовірності захворювання, враховуючи поширеність хронічної ІХС в Україні, використані дані відповідних європейських рекомендацій 2013 р.).
- Білі клітинки у таблиці відповідають низькій претестовій імовірності ІХС <15%, хворі з такими показниками не потребують подальшого тестування на ІХС.
- Світло-сірі клітинки відповідають середній низькій претестовій імовірності ІХС 15–65%, у таких випадках для первинної діагностики може бути використаний тест з ДФН. Проте більшу діагностичну інформативність для виявлення ішемії мають неінвазивні тести з візуалізацією міокарда. У молодих пацієнтів можуть розглядатися радіологічні методи діагностики.
- Середньо-сірі клітинки — відповідають середній високій претестовій імовірності ІХС 66–85%, для підтвердження діагнозу ІХС рекомендовані неінвазивні функціональні тести з візуалізацією.
- Темно-сірі клітинки — висока претестова імовірність ІХС — >85%, передбачається, що у таких пацієнтів наявна хронічна ІХС. Вони потребують виключно стратифікації ризику.
Додаткові дослідження
Рентгенівське дослідження грудної клітки — за наявності атипової симптоматики, при підозрі на СН чи захворювання дихальної системи.
Амбулаторне моніторування ЕКГ за Холтером — при підозрі на вазоспастичну стенокардію чи за наявності симптомів, обумовлених порушеннями серцевого ритму, а також за необхідності — для оцінки ефективності терапії.
Визначення претестової ймовірності ІХС для встановлення діагнозу захворювання
Визначення показника претестової ймовірності (див. табл. 12) базується на дослідженнях щодо поширеності ІХС у популяції. Цей показник пропонується як стартовий крок для діагностики захворювання.
Таблиця 13. Клінічна класифікація больового синдрому у грудній клітці
|
Типова стенокардія (напевно) |
За наявності усіх трьох з наступних характеристик:
|
|
Атипова стенокардія (можливо) |
За наявності двох з вищеназваних характеристик |
|
Неангінозний біль |
За наявності однієї чи відсутності вищеназваних характеристик |
З практичної точки зору, може бути корисним визначення вірогідності ІХС з обструктивними ураженнями коронарних артерій, враховуючи наявність факторів ризику та результатів стартових діагностичних досліджень — дані представлені в табл. 14.
Таблиця 14. Клінічна вірогідність ІХС з обструктивними ураженнями коронарних артерій*
|
Підвищена ймовірність ІХС |
|
Фактори кардіоваскулярного ризику (куріння, дисліпідемія, АГ, цукровий діабет, сімейний анамнез) |
|
Зміни на ЕКГ у стані спокою (патологічний зубець Q, зміни сегмента ST чи зубця T) |
|
Регіональна дисфункція ЛШ за даними ехоКГ |
|
Патологічні зміни на ЕКГ під час проведення проби з ДФН |
|
Наявність кальцію у коронарних артеріях за даними КТ (визначення індексу Агатстона) |
*Модифіковано за ESC Guidelines for the diagnosis and management of chronic coronary syndromes, 2019.
Стратифікація кардіоваскулярного ризику
Довготривалий прогноз пацієнтів із хронічною ІХС залежить від ряду факторів, до яких належать клінічні та демографічні параметри, функція ЛШ, результати стрес-тестування і анатомія коронарних артерій. Найбільш точним щодо прогнозу пацієнтів вважається показник загальної смертності (від усіх причин), і саме він був використаний у чинних міжнародних та вітчизняних рекомендаціях щодо стратифікації кардіоваскулярного ризику. Тобто кардіоваскулярний ризик хворих на хронічну ІХС визначається як показник щорічної смертності у популяції хворих на хронічну ІХС, обчислений у відсотках (табл. 15).
Таблиця 15. Оцінка кардіоваскулярного ризику пацієнтів із хронічною ІХС
|
Кардіоваскулярний ризик |
Показник щорічної смертності серед хворих зі стабільною ІХС, % |
|
Високий |
>3 |
|
Середній |
>1 – <3 |
|
Низький |
<1 |
Стратифікацію кардіоваскулярного ризику необхідно проводити у всіх пацієнтів із хронічною ІХС. Для оцінки кардіоваскулярного ризику використовують клінічні дані та результати неінвазивних тестів із визначенням толерантності до фізичних навантажень (ТФН), площі ішемії міокарда чи анатомії коронарних артерій. Надзвичайно важливим предиктором щодо довготривалого прогнозу є показник глобальної скоротливої функції ЛШ. Пацієнти зі зниженою ФВ ЛШ <40% належать до категорії високого ризику (щорічна смертність >3%) незалежно від інших факторів, результатів клінічних та інструментальних досліджень, супутніх захворювань тощо.
Європейські та вітчизняні рекомендації передбачають можливість розрахунку кардіоваскулярного ризику за допомогою електронного калькулятора Duke за результатами проби з ДФН на тредмілі (www.cardiology.org/tools/medcalc/duke).
Визначення кардіоваскулярного ризику залежно від результатів інших методів досліджень представлене у табл. 16.
Таблиця 16. Оцінка кардіоваскулярного ризику залежно від методу дослідження
|
ЕКГ проби з ДФН (індекс Duke) |
Високий ризик Середній ризик Низький ризик |
Смертність >3% Смертність >1 — <3% Смертність <1% |
|
Методи візуалізації ішемії |
Високий ризик Середній ризик Низький ризик |
Ділянка ішемії >10% (ОФЕКТ >10%; МРТ >2/16 сегментів з новими дефектами перфузії; >3 добутамін-індукованих сегментів; >3/16 сегментів ЛШ на стрес-ехоКГ) Ділянка ішемії 1–10% чи будь-яка ішемія меншого обсягу, ніж при високому ризику (МРТ, стрес-ехоКГ) Ішемія відсутня |
|
КТ-коронарографія чи ІКАГ |
Високий ризик Середній ризик Низький ризик |
Значні ушкодження категорії високого ризику (3-судинне ураження з проксимальними стенозами, стенозом стовбура ЛКА, проксимальним стенозом передньої нисхідної міжшлуночкової артерії) Інвазивні функціональні тести: FFR <0,8 iwFR <0,89 Значні ушкодження в проксимальних сегментах головних артерій (за винятком тих, які входять у категорію високого ризику) Нормальні чи мало змінені коронарні артерії |
Пацієнтам з недіагностичними результатами проби з ДФН для стратифікації ризику показані стрес-тести з візуалізацією міокарда. Якщо вподовж диспансерного нагляду оцінка за шкалою ризику вказує на погіршення прогнозу хворого, доцільно розглянути можливості більш інтенсивної терапії чи додаткових діагностичних заходів. За наявності резистентної стенокардії, а також у тих випадках, які свідчать про високий кардіоваскулярний ризик, хворим показана інвазивна коронарографія з подальшим вирішенням питання щодо реваскуляризації міокарда. Особам з високою претестовою ймовірністю ІХС, які не потребують подальших діагностичних заходів, доцільно пройти стрес-тестування з метою стратифікації ризику (табл. 17).
Таблиця 17. Визначення кардіоваскулярного ризику під час диспансерного спостереження пацієнтів із хронічною ІХС*
|
Рекомендації |
Клас рекомендацій |
Рівень доказовості |
|
Повторне проведення проб з ДФН для стратифікації ризику показане пацієнтам зі стабільною ІХС при змінах клінічної симптоматики |
І |
В |
|
Стрес-тести з візуалізацією міокарда рекомендовані для стратифікації ризику при погіршенні симптоматики у пацієнтів з підтвердженою ІХС за наявності відповідних методологічних можливостей, а також за умови, що параметри поширеності ішемії можуть вплинути на вибір терапії |
І |
В |
|
Фармакологічні стрес-тести з ехоКГ чи ОФЕКТ доцільні у хворих із блокадою лівої ніжки пучка Гіса |
ІІа |
В |
|
Стрес-ехоКГ чи ОФЕКТ доцільні у пацієнтів із ШВРС |
ІІа |
В |
|
ЕхоКГ оцінка глобальної поздовжньої деформації показана пацієнтам з ФВЛШ <35% для отримання додаткових даних щодо функції ЛШ |
ІІв |
В |
|
ІКАГ (за потреби з визначенням FFR/iwFR) рекомендована симптомним пацієнтам з високим кардіоваскулярним ризиком, у яких неефективна фармакотерапія, у випадках, коли для покращення прогнозу та якості життя розглядається питання про реваскуляризацію міокарда |
І |
А |
|
ІКАГ (за потреби з визначенням FFR) може проводитися для стратифікації ризиків у пацієнтів з неінформативними чи суперечливими результатами неінвазивних методів обстеження |
ІІа |
В |
|
Внутрішньосудинне УЗД — для стратифікації ризику у пацієнтів з проміжними стенозами стовбуру ЛКА |
ІІв |
В |
*Модифіковано за ESC Guidelines 2013, 2019.
Програма лікування
Перелік та обсяг обов’язкових медичних послуг
Рекомендації щодо модифікації способу життя і контролю факторів ризику представлені у табл. 18. Вони стосуються відмови від куріння, дотримання здорового харчування (табл. 19), адекватної фізичної активності (аеробні вправи по 30–60 хв щодня, інтенсивність залежить від індивідуальної ТФН), корекції маси тіла (індекс маси тіла (ІМТ) — 18,5–24,9 кг/м2, окружність талії <94 см у чоловіків і <80 см у жінок), за показаннями — терапії АГ (цільовий рівень АТ <140/90 мм рт. ст., оптимальний — 120–139/70–80 мм рт. ст.) та цукрового діабету (показником контролю глікемії є рівень глікозильованого гемоглобіну (HbA1c) <7,0%).
Таблиця 18. Рекомендації щодо здорового способу життя для пацієнтів із хронічною ІХС*
|
Характеристики здорового способу життя |
Рекомендації |
|
Відмова від куріння |
Використання фармакологічних та поведінкових стратегій, щоб допомогти пацієнтам кинути палити. Уникати пасивного куріння |
|
Здорова дієта (див. табл. 19) |
Дієта з високим вмістом овочів, фруктів та цільнозернових продуктів. Обмеження насичених жирів до <10% у загальному раціоні. Обмеження вживання алкоголю до <100 г/тиж або 15 г/добу |
|
Фізична активність |
Щодня — 30–60 хв помірних фізичних навантажень. Якщо це неможливо, то слід пам’ятати, що навіть нерегулярні фізичні вправи є корисними |
|
Нормалізація маси тіла |
Досягнути та підтримувати здорову масу тіла (<25 кг/м2). За потреби зменшити масу тіла за рахунок контролю калорійності харчування та оптимізації фізичної активності |
|
Інші |
Прийом ліків за призначенням
Статева активність становить низький ризик для стабільних пацієнтів з ІХС, у яких симптоматика не провокується невеликими чи помірними фізичними навантаженнями |
*Модифіковано за ESC Guidelines for the diagnosis and management of chronic coronary syndromes, 2019.
Таблиця 19. Дієтичні рекомендації*
|
Рекомендовано: |
|
Збільшення фруктів та овочів у раціоні (≥200 г окремо для овочів та фруктів на добу) |
|
35–45 г клітковини на добу, бажано з цільних злаків |
|
Помірне споживання горіхів (30 г/добу не підсолених) |
|
1–2 порції риби на тиждень (одна зі страв має бути з маслянистої риби) |
|
Обмежене вживання нежирного м’яса, молочних продуктів зі зниженим вмістом жирів та рослинних олій |
|
Насичені жири мають становити <10% загальної калорійності; їх доцільно замінити поліненасиченими жирами |
|
Вживати якомога менше трансжирів (<1% загальної калорійності), бажано не використовувати їх після термічної обробки |
|
≤5–6 г солі на добу |
|
Обмежене вживання алкоголю (до ≤100 г/тиж чи <15 г/добу) |
|
Уникати висококалорійних продуктів, наприклад безалкогольних напоїв з цукром |
*Модифіковано за ESC Guidelines for the diagnosis and management of chronic coronary syndromes, 2019.
Фармакотерапія пацієнтів із хронічною ІХС
Рекомендації щодо фармакотерапії пацієнтів з хронічною ІХС представлені у табл. 20, 21, 22, 23.
Таблиця 20. Рекомендації для пацієнтів із хронічною ІХС щодо призначення антиангінальних/анти-ішемічних препаратів (модифіковано за ESC Guidelines for the diagnosis and management of chronic coronary syndromes, 2019)
|
Рекомендації |
Клас |
Рівень |
|
Загальні рекомендації
|
І |
С |
|
Антиангінальна/антиішемічна терапія |
||
|
Швидкодіючі нітрати — для купірування нападів стенокардії |
І |
В |
|
1 лінія: блокатори бета-рецепторів та/чи блокатори кальцієвих каналів для контролю ЧСС і симптомів захворювання |
І |
А |
|
Якщо симптоми не контролюються — рекомендована комбінація блокаторів бета-адренорецепторів + дигідропіридиновий блокатор кальцієвих каналів |
ІІа |
С |
|
Стартова терапія 1-ї лінії: може розглядатися блокатор бета-адренорецепторів + дигідропіридиновий блокатор кальцієвих каналів |
ІІа |
В |
|
Нітрати тривалої дії — 2-га лінія терапії, якщо стартова терапія з блокаторами бета-адренорецепторів та/або блокаторами кальцієвих каналів протипоказана, погано переноситься чи недостатньо ефективна |
ІІа |
В |
|
У разі призначення нітратів тривалої дії рекомендовано забезпечити безнітратний період протягом доби для запобігання розвитку толерантності |
ІІа |
В |
|
Нікорандил, ранолазин, івабрадин, триметазидин — 2-га лінія терапії для зниження частоти нападів стенокардії та покращення толерантності до фізичних навантажень у пацієнтів, які погано переносять, мають протипоказання чи недостатньо контролюють симптоми при застосуванні блокаторів бета-адренорецепторів, блокаторів кальцієвих каналів, нітратів тривалої дії |
ІІа |
В |
|
У пацієнтів з низькими ЧСС та АТ — ранолазин чи триметазидин можуть розглядатися як 1-ша лінія антиангінальної терапії |
ІІв |
С |
|
У деяких пацієнтів може розглядатися комбінація блокаторів бета-адренорецепторів чи блокаторів кальцієвих каналів з препаратами 2-ї лінії (ранолазин, нікорандил, івабрадин, триметазидин), враховуючи ЧСС, АТ і переносимість терапії |
ІІв |
В |
|
Нітрати не рекомендовані пацієнтам з гіпертрофічною обструктивною кардіоміопатією чи одночасно з інгібіторами фосфодіестерази та ріоцигуатом |
ІІІ |
В |
Таблиця 21. Рекомендації для пацієнтів із хронічною ІХС стосовно засобів профілактики кардіоваскулярних ускладнень: антитромботична терапія (модифіковано за ESC Guidelines for the diagnosis and management of chronic coronary syndromes, 2019)
|
Рекомендації |
Клас |
Рівень |
|
Антитромботична терапія у пацієнтів із хронічною ІХС та синусовим ритмом |
||
|
АСК у дозі 75–100 мг/добу рекомендується пацієнтам з перенесеним ІМ чи після реваскуляризації |
I |
А |
|
Клопідогрель у дозі 75 мг рекомендується в якості альтернативи пацієнтам з непереносимістю АСК |
I |
B |
|
Клопідогрель у дозі 75 мг може розглядатися замість АСК у симптомних чи безсимптомних пацієнтів із ЗПА, ішемічним інсультом або ТІА в анамнезі |
IIb |
B |
|
АСК у дозі 75–100 мг/добу показана всім пацієнтам з підтвердженим діагнозом ІХС |
IIb |
С |
|
Приєднання другого антитромботичного препарату до АСК для довготривалої вторинної профілактики варто розглядати у пацієнтів з високим ризиком кардіоваскулярних ускладнень*, але без високого ризику кровотечі** |
IIа |
А |
|
Антитромботична терапія у пацієнтів з ІХС та синусовим ритмом після ЧКВ |
||
|
АСК у дозі 75–100 мг/добу рекомендується усім пацієнтам після стентування |
I |
А |
|
Клопідогрель у дозі 75 мг/добу (після навантажувальної дози 600 мг чи >5 днів підтримувальної терапії) рекомендується додатково до АСК протягом 6 міс після стентування коронарних судин, незалежно від типу стента, за винятком випадків, коли показана менша тривалість ПАТТ (1–3 міс) через ризик життєво небезпечних геморагій |
I |
А |
|
Клопідогрель у дозі 75 мг/добу (після навантажувальної дози 600 мг чи >5 днів підтримувальної терапії) варто розглянути додатково до АСК на період 3 міс у пацієнтів після ЧКВ з підвищеним ризиком життєво небезпечних кровотеч |
IIа |
А |
|
Клопідогрель у дозі 75 мг/добу (після навантажувальної дози 600 мг чи >5 днів підтримувальної терапії) варто розглянути додатково до АСК на період 1 міс у пацієнтів після ЧКВ з дуже високим ризиком життєво небезпечних кровотеч |
IIb |
С |
|
Прасугрель чи тікагрелор можуть розглядатися принаймні як початкова терапія у специфічних ситуаціях з потенційно високим ризиком тромбозу після планового стентування (наприклад субоптимальне встановлення стента, складність анатомії головного стовбура лівої вінцевої артерії, полісудинне стентування тощо) чи якщо ПАТТ не можна використовувати через непереносимість АСК |
IIb |
С |
|
Антитромботична терапія у пацієнтів з ІХС та ФП |
||
|
Пацієнтам з ФП, за можливості, рекомендовано надавати перевагу НПА перед АВК |
I |
А |
|
Довготривала терапія антикоагулянтами (НПА чи АВК з часом у терапевтичному діапазоні >70%) рекомендована пацієнтам з ФП та показниками за шкалою CHA2DS2-VASc ≥2 у чоловіків та ≥3 у жінок |
I |
А |
|
Питання про довготривалу терапію НПА чи АВК (з часом у терапевтичному діапазоні >70%) доцільно розглянути у пацієнтів з ФП та показниками за шкалою CHA2DS2-VASc 1 у чоловіків та 2 у жінок |
IIа |
B |
|
АСК у дозі 75–100 мг/добу (чи клопідогрель у дозі 75 мг/добу) може розглядатися додатково до довготривалої терапії антикоагулянтами у пацієнтів з ФП, які перенесли ІМ та мають високий ризик рецидиву кардіоваскулярних ускладнень, але без високого ризику кровотеч |
IIb |
B |
|
Антитромботична терапія у пацієнтів після ЧКВ з ФП чи іншим показаннями до застосування антикоагулянтів |
||
|
Пацієнтам, які потребують стентування коронарних артерій, перед процедурою показані АСК і клопідогрель |
I |
С |
|
За можливості у комбінованій антитромбоцитарній терапії рекомендовано надавати перевагу НПА*** (апіксабан 5 мг двічі на добу, дабігатран 150 мг двічі на добу, едоксабан 60 мг один раз на добу чи ривароксабан 20 мг один раз на добу) перед АВК |
I |
А |
|
Якщо ризик кровотечі переважає ризик тромбозу стента чи ішемічного інсульту, на період супутньої моно- або ПАТТ рекомендована доза ривароксабану становить 15 мг один раз на добу |
IIа |
B |
|
Якщо ризик кровотечі переважає ризик тромбозу стента чи ішемічного інсульту, на період супутньої моно- або ПАТТ рекомендована доза дабігатрану становить 110 мг двічі на добу |
IIа |
B |
|
Якщо ризик кровотечі високий, а ризик тромбозу незалежно від типу стента низький, після неускладненої процедури ЧКВ варто розглянути питання про раннє припинення (≤1 тиж) прийому АСК |
IIа |
B |
|
Якщо ризик тромбозу стента**** переважає ризик кровотечі, варто розглянути можливість потрійної терапії АСК, клопідогрелем та НПА протягом 1–6 міс, що має бути визначено згідно з оцінкою цих ризиків та чітко зазначено під час виписки зі стаціонару |
IIа |
С |
|
У пацієнтів з показаннями до застосування АВК у комбінації з АСК та/або клопідогрелем, необхідно ретельно контролювати дозування АВК (варфарину) з цільовим рівнем МНВ 2,0–2,5 та часом у терапевтичному діапазоні >70% |
IIа |
B |
|
Подвійна терапія НПА з тікагрелором чи прасугрелем у якості альтернативи потрійній терапії (НПА з АСК та клопідогрелем) може бути розглянута у пацієнтів з помірним чи високим ризиком тромбозу стента, незалежно від його типу |
IIb |
С |
|
Застосування тікагрелору чи прасугрелю не рекомендується як частина потрійної антитромбоцитарної терапії з АСК та НПА |
III |
С |
|
Застосування інгібіторів протонної помпи |
||
|
Пацієнтам, які отримують монотерапію АСК, ПАТТ чи монотерапію НПА та мають високий ризик шлунково-кишкової кровотечі, рекомендоване застосування інгібіторів протонної помпи |
I |
А |
CHA2DS2-VASc = серцева недостатність, артеріальна гіпертензія, вік ≥75 років [2 бали], цукровий діабет, інсульт/ТІА [2 бали] — захворювання судин, вік 65–74 роки та стать [жіноча]; ХХН — хронічна хвороба нирок; ПАТТ — подвійна антитромбоцитарна терапія; ШКФ — розрахункова швидкість клубочкової фільтрації; НПА — нові пероральні антикоагулянти; ЗПА — захворювання периферичних артерій; ЧКВ — черезшкірне коронарне втручання; АВК — антагоніст вітаміну К.
*Дифузна полісудинна ІХС принаймні з однією з таких характеристик: цукровий діабет, що потребує прийому препаратів, рецидивуючий ІМ, ЗПА чи ХХН із ШКФ 15–59 мл/хв/1,73 м2.
**Внутрішньочерепний крововилив чи ішемічний інсульт в анамнезі, інша внутрішньочерепна патологія в анамнезі, нещодавня шлунково-кишкова кровотеча чи анемія через можливу шлунково-кишкову крововтрату, інша патологія ШКТ, пов’язана з підвищеним ризиком кровотечі, печінкова недостатність, ниркова недостатність з показником ШКФ <15 мл/хв/1,73 м2 за потреби діалізу, геморагічний діатез чи коагулопатія, старечий вік чи тяжкий клінічний стан.
***Див. інструкцію для кожного НПА для отримання інформації про дозування, протипоказання до застосування (наприклад у пацієнтів з ХХН, масою тіла <60 кг, віком >75–80 років) та/або щодо лікарських взаємодій.
****Ризик тромбозу стента пов’язують з анатомічними, процедурними та клінічними характеристиками. Факторами ризику виступають стентування стовбура лівої вінцевої артерії, проксимального відділу ПМШГ ЛКА чи єдиної магістральної прохідної артерії; субоптимальне встановлення стента; довжина стента >60 мм; цукровий діабет; ХХН; імплантація двох стентів у місці біфуркації; лікування хронічної тотальної оклюзії; попередній тромбоз стента за належної антитромботичної терапії.
Таблиця 22. Тривала подвійна антитромбоцитарна терапія з АСК (75–100 мг/добу) у пацієнтів з хронічною ІХС з високимa чи помірнимb ризиком кардіоваскулярних ускладнень, без високого ризику кровотечc, які переносять ПАТТ протягом 1 року (модифіковано за ESC Guidelines for the diagnosis and management of chronic coronary syndromes, 2019)
|
Препарат |
Доза |
Показання |
З особливою обережністю |
|
Клопідогрель |
75 мг 1 раз/добу |
Після перенесеного ІМ у пацієнтів, яким проводять ПАТТ протягом 1 року |
|
|
Прасугрель |
10 мг 1 раз/добу або 5 мг 1 раз/добу, якщо маса тіла <60 кг чи вік >75 років |
Після процедури ЧКВ з приводу ІМ у пацієнтів, яким проводять ПАТТ протягом 1 року |
Вік >75 років |
|
Ривароксабан |
2,5 мг 2 рази/добу |
Після ІМ, перенесеного >1 року тому, або за наявності полісудинної ІХС |
Кліренс креатиніну 15–29 мл/хв |
|
Тікагрелор |
60 мг 2 рази/добу |
Після перенесеного ІМ у пацієнтів, яким проводять ПАТТ протягом 1 року |
аВисокий ризик кардіоваскулярних ускладнень визначається як дифузна полісудинна ІХС принаймні з однією з таких характеристик: цукровий діабет, що потребує прийому препаратів, рецидивуючий ІM, ЗПА чи ХНН із ШКФ 15–59 мл/хв/1,73 м2.
bПомірно підвищений ризик кардіоваскулярних ускладнень визначається як принаймні одне з переліченого: полісудинна/дифузна ІХС, цукровий діабет, що потребує прийому препаратів, рецидивуючий ІM, ЗПА, СН чи ХНН із ШКФ 15–59 мл/хв/1,73 м2.
сВисокий ризик кровотечі визначається як внутрішньочерепний крововилив чи ішемічний інсульт в анамнезі, інша внутрішньочерепна патологія в анамнезі, нещодавня шлунково-кишкова кровотеча чи анемія через можливу шлунково-кишкову крововтрату, інша патологія ШКТ, пов’язана з підвищеним ризиком кровотечі, печінкова недостатність, геморагічний діатез чи коагулопатія, старечий вік чи тяжкий клінічний стан, та ниркова недостатність із ШКФ <15 мл/хв/1,73 м2/потреба в діалізі.
Таблиця 23. Рекомендації для пацієнтів із хронічною ІХС стосовно засобів профілактики кардіоваскулярних ускладнень: статини, інгібітори АПФ, блокатори бета-адренорецепторів (модифіковано за ESC Guidelines for the diagnosis and management of chronic coronary syndromes, 2019)
|
Гіполіпідемічні препарати |
Клас |
Рівень |
|
Статини рекомендуються всім пацієнтам із хронічною ІХС |
I |
А |
|
Якщо цільові значення ХС ЛПНЩ не були досягнуті за допомогою максимально переносимої дози статину, рекомендується комбінація статину з езетимібом |
I |
B |
|
Для пацієнтів дуже високого ризику, які не досягли цільових значень ХС ЛПНЩ з максимальною переносимою дозою статину та езетимібу, рекомендується комбінація статину з інгібітором PCSK9* |
I |
А |
|
Інгібітори РАС |
||
|
Інгібітори АПФ (чи БРА, якщо інгібітори АПФ протипоказані) рекомендуються пацієнтам з ІХС за наявності супутньої патології (СН, АГ чи цукровий діабет) |
I |
А |
|
Пацієнтам з ІХС, які мають дуже високий ризик кардіоваскулярних ускладнень, варто розглянути питання щодо застосування інгібіторів АПФ (раміприл, периндоприл) |
Ila |
А |
|
Інші препарати |
||
|
Блокатори бета-адренорецепторів рекомендуються усім пацієнтам з СН зі зниженою ФВ ЛШ (<40%) за відсутності протипоказань |
I |
А |
|
Після ІМ/STEMI** варто розглянути довготривалу терапію блокаторами бета-адренорецепторів |
IIа |
B |
PCSK9 — пропротеїн конвертаза субтилізин-кексин 9-го типу; РАС — ренін-ангіотензинова система; STEMI — ІМ з елевацією сегмента ST; ПАТТ — подвійна антитромбоцитарна терапія.
Наявність симптомів та підвищення рівнів біомаркерів (тропоніни), що вказують на ГКС, потребує негайної госпіталізації хворого у спеціалізований заклад для надання відповідної допомоги.
Перелік та обсяг додаткових медичних послуг
1. Оцінка психосоціального статусу/визначення депресивних розладів — за необхідності їх корекція.
2. Залучення пацієнтів до реабілітаційних програм (ДФН, освітні заходи тощо).
3. Вакцинація проти грипу, особливо пацієнтів з тяжким перебігом захворювання, осіб похилого віку.
4. За показаннями для корекції дисліпідемії — додаткові призначення: фібрати, секвестранти жовчних кислот, препарати нікотинової кислоти (зазначені засоби призводять до додаткового зниження ХС ЛПНЩ, але не впливають на прогноз пацієнтів).
5. Реваскуляризація міокарда — визначають обсяг і необхідність втручання за даними коронароангіографії.
Характеристика очікуваних кінцевих результатів лікування
Зменшення вираженості симптомів (ФК стенокардії або повне усунення нападів), попередження розвитку ГКС, ІМ, смерті.
Тривалість лікування
Хворі потребують постійної корекції факторів ризику, дотримання здорового способу життя та щоденного прийому рекомендованих лікарських препаратів.
Критерії якості лікування
Зниження частоти нападів стенокардії, відсутність ЕКГ-ознак ішемії міокарда, підвищення толерантності до фізичних навантажень. Відсутність прогресування захворювання та кардіоваскулярних ускладнень (ІМ, ГКС, кардіоваскулярна смерть).
Можливі побічні реакції та ускладнення
Можливі побічні реакції, які пов’язані з фармакологічною дією лікарських засобів. Наприклад, застосування блокаторів бета-адренорецепторів може супроводжуватися брадикардією та артеріальною гіпотензією. Проведення антитромботичної терапії може провокувати кровотечі, особливо у хворих з ураженням травного тракту та за наявності інших факторів ризику. Терапія статинами потребує контролю щодо функції печінки (визначення рівнів АлАТ) та ризику міопатії (визначення креатинкінази/КФК). Призначення інгібіторів фосфодіестерази 5-го типу та стимуляторів розчинної гуанілатциклази (ріоцигуат) категорично протипоказане при прийомі нітратів через ризик розвитку неконтрольованої гіпотензії з непередбачуваними наслідками.
Рекомендації щодо амбулаторного нагляду
Хворі з підтвердженим діагнозом хронічної ІХС повинні перебувати під диспансерним наглядом за місцем проживання. Рекомендації щодо повторних обстежень таких пацієнтів представлені у табл. 24.
Таблиця 24. Диспансеризація хворих із хронічною ІХС
|
Рекомендації |
|
Диспансеризація пацієнтів має проводитися кожні 4–6 міс (не менше 2 разів) протягом першого року після встановлення діагнозу ІХС, перенесеного ГКС/ІМ та процедур реваскуляризації, а надалі один раз на рік за умови стабільного перебігу захворювання. Медикаментозна терапія може призначатися без змін протягом тривалого періоду (до 2 років) за умови її ефективності. Диспансеризацію хворих з ІХС проводить сімейний лікар, щодо пацієнтів високого кардіоваскулярного ризику (див. розділ щодо стратифікації ризику) та за необхідності (недостатня ефективність терапії, погіршення клінічного стану, поява нових симптомів тощо) до обстеження долучається кардіолог. Протокол диспансерного візиту має включати детальний збір анамнезу, клінічний огляд та лабораторні дослідження |
|
ЕКГ у стані спокою показана всім пацієнтам на кожному плановому візиті до лікаря. Позапланова реєстрація ЕКГ показана:
|
|
Проби з ДФН або стрес-тести з візуалізацією міокарда рекомендовані:
|
|
ЕхоКГ
|
Освітні заходи для пацієнта із хронічною ІХС
Інформування щодо модифікації способу життя та контролю факторів кардіоваскулярного ризику, які впливають на прогноз і перебіг захворювання: раціональна дієта, контроль маси тіла, фізична активність, відмова від паління й уникнення впливу пасивного паління, контроль показників ліпідного обміну; контроль АТ; а також терапія та контроль глікемії у хворих із цукровим діабетом.
Індивідуальні роз’яснення щодо характеру захворювання, можливих методів лікування, необхідності постійного прийому рекомендованих препаратів у відповідних дозах, значення фактора «прихильності до лікування» для ефективності терапевтичних заходів та покращення прогнозу.
Навчання щодо вміння розпізнавати напади стенокардії та застосовувати засоби невідкладної допомоги (швидкодіючі нітрати, нітрогліцерин), а також чіткі інструкції, у яких випадках необхідно негайно звертатися за медичною допомогою.
Інформування про симптоми і вплив стресу та депресії на клінічні прояви і перебіг захворювання, а також рекомендації щодо відповідних методів їх корекції.
За необхідності — направлення хворих до інших спеціалістів (дієтологів, психотерапевтів тощо).
Інформація може надаватися під час планових візитів у вигляді співбесід, друкованих матеріалів, наочної агітації, а також з використанням відповідних програм у ЗМІ тощо.
Реабілітаційні заходи
Програма реабілітації, як правило, призначається пацієнтам після ГКС, перенесеного ІМ та проведеного коронарного втручання, проте застосування таких заходів є доцільним для всіх хворих з ІХС, у тому числі зі стабільною стенокардією. Основою реабілітаційних програм є залучення пацієнтів до регулярної дозованої фізичної активності, що чинить сприятливий вплив на зниження загальної і серцево-судинної смертності та частоти госпіталізацій. В окремих групах хворих реабілітаційні заходи можуть ефективно проводитися не лише у спеціалізованих медичних центрах, але після відповідного навчання — у домашніх умовах. У реабілітаційних програмах за участю спеціалістів можуть використовуватися фізіотерапевтичні процедури, спеціальні тренінги щодо корекції поведінкових реакцій, усунення впливу стресових факторів тощо.
Показання та протипоказання щодо санаторного етапу лікування
Показання:
- санаторний етап лікування показаний як частина реабілітаційної програми пацієнтам із хронічною ІХС після ГКС, перенесеного ІМ, ендоваскулярної реваскуляризації міокарда чи АКШ (див. також відповідні протоколи);
- санаторне лікування показане хворим зі стабільним перебігом ІХС, стенокардією напруження І–ІІІ ФК.
Протипоказання:
- стенокардія ІV ФК;
- підтверджені діагнози або підозра на ГКС чи гострий ІМ;
- тяжкі порушення серцевого ритму (АV-блокада ІІ–ІІІ ст., 3-пучкова блокада, шлуночкові екстрасистолії — політропна, рання, групова, пароксизми ФП або пароксизмальна тахікардія з частотою нападів >2 разів на місяць);
- АГ ІІІ ст., АГ з неконтрольованим АТ та/або кризовим перебігом;
- СН ≥ІІА ст.;
- цукровий діабет декомпенсований, з тяжким перебігом;
- підтверджений діагноз чи підозра на гостре порушення мозкового кровообігу;
- наявність супутніх захворювань та інших патологічних станів, які виключають можливість проведення санаторного лікування (гострі інфекційні, онкологічні, психічні хвороби тощо).
Етапність надання медичної допомоги
Первинна медична допомога
1. Виявлення та корекція факторів кардіоваскулярного ризику.
2. Діагностика ІХС: збір анамнезу, клінічний огляд, визначення претестової ймовірності ІХС, реєстрація ЕКГ, лабораторне обстеження (загальний аналіз крові, сечі, ліпіди, глюкоза в крові, креатинін/ШКФ); за показаннями — додаткові лабораторні дослідження (див. вище); за наявності відповідного обладнання і спеціалістів — ехоКГ, УЗД сонних артерій.
3. Визначення супутньої патології, яка може обумовлювати відповідну симптоматику або впливати на перебіг захворювання.
4. У хворих із вірогідним діагнозом стабільної стенокардії — оцінка її ФК (класифікація Канадської асоціації кардіологів).
5. Навчання пацієнта — див. вище.
6. Фармакотерапія хворих на хронічну ІХС — призначення антиангінальних препаратів за відсутності протипоказань (нітрогліцерин для купірування нападів стенокардії + блокатор бета-адренорецепторів (або блокатор кальцієвих каналів) + АСК + статин + за показаннями — інгібітор АПФ, інші засоби) — див. табл. 20–23. Контрольний візит для оцінки ефективності терапії — протягом перших 14 днів після її призначення.
7. Скринінг пацієнтів, які потребують направлення до закладу/спеціаліста вторинного рівня для підтвердження діагнозу та вибору методів лікування.
8. Виявлення ознак ГКС, ІМ та направлення таких хворих у відповідні медичні заклади для надання високоспеціалізованої допомоги (третинного рівня).
9. Диспансерний нагляд — див. табл. 24, 25.
10. Скринінг ознак/симптомів депресії у пацієнтів з встановленим діагнозом ІХС та відповідна корекція зазначеного патологічного стану.
Таблиця 25. План диспансерного нагляду за пацієнтами із хронічною ІХС на етапі первинної медичної допомоги
|
Назва обстеження |
Кратність візитів, досліджень |
|
Клінічний огляд |
Протягом першого року після встановлення діагнозу, перенесеного ІМ та реваскуляризації міокарда — 1 раз на 4–6 міс (але не менше 2 разів на рік). Надалі — 1 раз на рік/додатково — за показаннями |
|
Загальний аналіз крові |
1 раз на рік/додатково — за показаннями |
|
Загальний аналіз сечі |
1 раз на рік/додатково — за показаннями |
|
Глікемія натще/глікозильований гемоглобін |
1 раз на рік/додатково — за показаннями |
|
Загальний ХС, ХС ЛПНЩ |
1 раз на рік/додатково — за показаннями |
|
Креатинін, ШКФ |
1 раз на рік/додатково — за показаннями |
|
ЕКГ |
1 раз на рік/додатково — за показаннями |
|
Консультація кардіолога |
Пацієнти високого кардіоваскулярного ризику, після перенесеного ІМ та реваскуляризації міокарда — 2 рази на рік обов’язково/додатково — за показаннями |
Вторинна медична допомога
1. Оцінка щодо попереднього виявлення та корекції факторів кардіоваскулярного ризику.
2. Діагностика ІХС: збір анамнезу, клінічний огляд, визначення претестової ймовірності ІХС, оцінка даних ЕКГ (за показаннями — повторна реєстрація), оцінка результатів лабораторного обстеження; за показаннями — додаткові лабораторні та інструментальні дослідження.
3. ЕхоКГ, УЗД сонних артерій, якщо їх не було проведено раніше.
4. Для верифікації діагнозу та подальшої стратифікації ризику — проби з ДФН (тредміл-тест, велоергометрія).
5. Стратифікація ризику за клінічними показниками та результатами проб з ДФН (індекс Duke).
6. Фармакотерапія пацієнтів із хронічною ІХС — оцінка ефективності попередньо призначеної терапії, її корекція. Контрольний візит для оцінки ефективності лікування — протягом перших 14 днів після його призначення.
7. Скринінг пацієнтів, які потребують направлення до закладу третинного рівня:
- для підтвердження діагнозу ІХС (за умови недостатньої інформативності чи протипоказань до проведення проб з ДФН);
- для відбору хворих з ІХС високого/середнього ризику, які потребують проведення ІКАГ з подальшим вирішенням питання про можливість реваскуляризації міокарда (див. також інформацію щодо стратифікації ризику);
- виявлення ознак нестабільного перебігу захворювання та забезпечення відповідного лікування.
8. Навчання пацієнта — див. вище.
9. Диспансерний нагляд — див. табл. 23.
10. Скринінг ознак/симптомів депресії у пацієнтів із встановленим діагнозом ІХС та відповідна корекція зазначеного патологічного стану, якщо це не було проведено на попередньому етапі.
11. Направлення пацієнтів до інших спеціалістів для лікування супутньої патології — за показаннями.
Третинна (високоспеціалізована) медична допомога
1. Оцінка щодо виявлення та корекції факторів кардіоваскулярного ризику на попередніх етапах. Додаткові заходи щодо модифікації способу життя, контролю ліпідних показників, АТ, глікемії — за показаннями.
2. Діагностика ІХС: збір анамнезу, клінічний огляд, визначення претестової ймовірності ІХС, оцінка даних ЕКГ (за показаннями — повторна реєстрація), оцінка результатів лабораторного обстеження; за показаннями — додаткові лабораторні дослідження.
3. ЕхоКГ, УЗД сонних артерій, якщо їх не було проведено раніше або потрібні уточнення.
4. Оцінка результатів попередніх проб з ДФН (тредміл-тест, велоергометрія). У разі якщо зазначені проби неінформативні чи не могли бути проведені з відповідних причин — рекомендовані навантажувальні/фармакологічні тести з візуалізацією міокарда. Для визначення ступеня ураження коронарного русла проводяться КТ-коронарографія, ІКАГ.
5. Діагностика особливих форм хронічної ІХС (вазоспастичної, мікроваскулярної, рефрактерної стенокардії).
6. Стратифікація ризику за клінічними показниками та результатами діагностичних досліджень (див. табл. 16, 17).
7. Фармакотерапія пацієнтів із хронічною ІХС — оцінка ефективності попередньо призначеної терапії, за необхідності її корекція . Контрольний візит для оцінки ефективності медикаментозного лікування — протягом перших 14 днів після його призначення.
8. Вибір методу лікування для хворих ІХС високого ризику (за показаннями — середнього ризику): після ІКАГ визначення можливості та способу реваскуляризації міокарда.
9. Виявлення ознак ГКС та ІМ; забезпечення таким хворим відповідного лікування.
10. Навчання пацієнта — див. вище.
11. Диспансерний нагляд — див. вище.
12.Скринінг ознак/симптомів депресії у пацієнтів із встановленим діагнозом ІХС та відповідна корекція зазначеного патологічного стану, якщо це не було проведено на попередньому етапі.
13. Направлення пацієнтів до інших спеціалістів для лікування супутньої патології — за показаннями.
Перелік фармакологічних препаратів, які показані для лікування пацієнтів із хронічною ІХС
Таблиця 26. Перелік лікарських засобів, які показані для терапії хронічної ІХС
|
Назва фармакологічної групи |
Міжнародна непатентована назва препаратів |
Рекомендовані терапевтичні дози |
|
Периферичні вазодилататори для лікування хвороб серця Органічні нітрати |
Нітрогліцерин Ізосорбіду динітрат Ізосорбіду мононітрат |
0,3–0,5 мг в 1 дозі 1,25 мг в 1 дозі (спрей) 5 мг в 1 дозі (таблетки сублінгвальні) 20–120 мг/добу (таблетки per os, пролонгованої дії) 40–160 мг/добу |
|
Блокатори бета-адренорецепторів: селективні неселективні Комбіновані блокатори альфа- і бета-адренорецепторів |
Атенолол Бетаксолол Бісопролол Метопролол Пропранолол Карведилол |
50–100 мг/добу (максимальна добова доза — 200 мг) 10–20 мг/добу (максимальна добова доза — 40 мг) 5–10 мг/добу (максимальна добова доза — 20 мг) 50–200 мг/добу 80–320 мг/добу 25–50 мг/добу |
|
Блокатори кальцієвих каналів: недигідропіридинові похідні фінілалкіламіну похідні бензодіазепіну похідні дигідропіридину |
Верапаміл Дилтіазем Амлодипін Ніфедипін Фелодипін |
80–480 мг/добу 120–480 мг/добу 5–10 мг/добу 40–120 мг/добу 5–10 мг/добу |
|
Інгібітори АПФ |
Периндоприл: — периндоприлу аргінін — периндоприлу тертбутиламін Раміприл |
5–10 мг/добу 4–8 мг/добу 2,5–10 мг/добу |
|
Антитромбоцитарні препарати Препарати АСК Антагоністи P2Y12-рецепторів Похідні тієнопіридину Прямі інгібітори фактора Ха |
АСК Клопідогрель Прасугрель Тікагрелор Ривароксабан |
75–150 мг/добу 75 мг/добу 10 мг х 1 раз/добу чи 5 мг х 1 раз/добу, якщо маса тіла <60 кг чи вік >75 років 90/60 мг х 2 рази/добу 2,5 мг х 2 рази/добу |
|
Гіполіпідемічні засоби Інгібітори 3-гідрокси-3-метилглутарил-КоАредуктази (статини) |
Аторвастатин Пітавастатин Розувастатин Симвастатин |
10–80 мг/добу 2–4 мг/добу 10–40 мг/добу 20–40 мг/добу |
|
Гіполіпідемічні засоби Селективний інгібітор абсорбції холестерину в кишечнику Інгібітори PCSK9 Похідні фібрової кислоти |
Езетиміб Алірокумаб Евалокумаб Фенофібрат |
10 мг/добу 75 мг підшкірно х 1 раз на 2 тиж (у шприц-ручці) 420 мг х 1 раз на 1 міс чи на 2 тиж (у шприц-ручках по 140 мг в 1 мл) 145 мг/добу 200 мг/добу |
|
Селективні блокатори Іf-каналів |
Івабрадин |
10 мг/добу |
|
Інші кардіологічні засоби (інгібітор пізнього потоку іонів натрію в кардіоміоцити) |
Ранолазин |
1000–2000 мг/добу |
|
Антигіпоксанти і антиоксиданти |
Триметазидин |
60/70 мг/добу |
Інтервенційні та хірургічні методи лікування
(Ю.М. Соколов, М.Ю. Соколов, В.Г. Терентьєв)
Показання для реваскуляризації для хворих із хронічною ІХС
У більшості пацієнтів із хронічною ІХС оптимальна фармакотерапія відіграє ключову роль у зменшенні вираженості симптомів, призупиненні прогресування атеросклерозу та профілактиці атеротромботичних ускладнень. Реваскуляризація міокарда рекомендована у якості доповнення до фармакотерапії, а не замість неї. Показаннями до проведення реваскуляризації міокарда у хворих із хронічною ІХС є значний обструктивний стеноз коронарних артерій, кількісні характеристики обумовленої ним ішемії, а також очікуваний сприятливий вплив ендоваскулярного чи хірургічного втручання на прогноз пацієнта і наявну клінічну симптоматику.
Як терапія першої лінії реваскуляризація міокарда може розглядатися у наступних ситуаціях: постінфарктна/тяжка рефрактерна стенокардія, недостатність ЛШ, зумовлена ішемією міокарда, багатосудинне ураження та/або велика зона ішемії (>10% площі міокарда ЛШ), стеноз стовбура ЛКА (табл. 27).
Таблиця 27. Реваскуляризація пацієнтів із хронічною ІХС на фоні оптимальної медикаментозної терапії
|
Показання |
Для покращення прогнозу |
Для зменшення вираженості симптомів |
||
|
Клас |
Рівень |
Клас |
Рівень |
|
|
Кардіологічний консиліум (за участю відповідних спеціалістів) для вирішення питання щодо реваскуляризації за такої умови:
|
I |
C |
I |
C |
|
Стовбур ЛКА з діаметром стенозу >50%* |
I |
A |
I |
A |
|
Стеноз у проксимальному відділі ПМШГ ЛКА >50%* |
I |
A |
I |
A |
|
2–3-судинне ураження з порушеною функцією ЛШ/застійною СН |
I |
B |
IIa |
B |
|
Єдина прохідна артерія (з діаметром стенозу >50%*) |
I |
C |
I |
A |
|
Велика зона ішемії (>10% ЛШ**) |
I |
B |
I |
B |
|
Значущий стеноз, що супроводжується клінічною симптоматикою, незважаючи на ОМТ |
ДВ |
ДВ |
I |
A |
|
Застійна СН, площа ішемії >10% ЛШ/ наявність гібернованого міокарда — якщо артерія, яка здійснює відповідне кровопостачання, має стеноз >50% |
IIb |
B |
IIa |
B |
ДВ — дані відсутні, ОМТ — оптимальна медикаментозна терапія.
*З підтвердженою ішемією чи фракційним резервом кровотоку (FFR) ≤0,80 при стенозі 50–90%.
**Підтверджена неінвазивними тестами (ОФЕКТ, МРТ, стрес-ехоКГ).
Ведення хворих із хронічною ІХС після реваскуляризації міокарда
Після процедури реваскуляризації міокарда терапію та заходи щодо вторинної профілактики кардіоваскулярних ускладнень необхідно розпочинати під час стаціонарного етапу лікування хворого. Усім пацієнтам рекомендовані корекція факторів ризику, призначення статинів, відповідної антитромбоцитарної терапії (див. табл. 20), за потреби — антиангінальних препаратів, кардіореабілітаційні заходи (включаючи санаторний етап) та диспансерний нагляд (табл. 24, 25). Перед поверненням до трудової діяльності та звичної фізичної активності хворі, а часто і їх найближче оточення, потребують відповідного інструктажу. При появі/поверненні симптоматики необхідна відповідна медична допомога.
Стандарти надання медичної допомоги хворим із дисліпідеміями
(О.І. Мітченко, В.Ю. Романов)
Умови надання медичної допомоги
Усі пацієнти з виявленими дисліпідеміями, у тому числі хворі з ІХС та еквівалентами ІХС (з периферичним атеросклерозом, атеросклерозом мозкових артерій, аневризмою аорти, цукровим діабетом), а також безсимптомні хворі з дисліпідеміями підлягають обстеженню та лікуванню за місцем проживання. Обстеження може проводитися в районних поліклініках, а в разі необхідності додаткових обстежень — за допомогою міських кардіологічних диспансерів та діагностичних центрів. Пацієнти з сімейними гіперхолестеринеміями, а особливо з гомозиготними сімейними гіперхолестеринеміями, як хворі з орфанними захворюваннями, повинні перебувати на обліку в спеціалізованих обласних ліпідних центрах, а за відсутності останніх – в Центрі сімейних дисліпідемій при ДУ ННЦ «Інститут кардіології ім. М.Д. Стражеска НАМН України».
Програма діагностики
Обов’язкові дослідження:
1. Кожному пацієнту при зверненні в медичний заклад необхідно визначити рівні ХС і ТГ.
2. Провести збір скарг та анамнезу.
3. При підвищенні рівнів ХС та/або ТГ — визначити розгорнутий ліпідний профіль плазми: ХС, ХС ЛПВЩ, ТГ, обчислити за формулою Friedewald прогностично значимий ХС ЛПНЩ.
4. Визначити наявність факторів ризику: паління, АГ, ожиріння, цукрового діабету, гіпотиреозу.
5. У пацієнтів без клінічних ознак ІХС й атеросклерозу іншої локалізації оцінити згідно зі шкалою SCORE фатальний 10-річний ризик серцево-судинних захворювань.
Додаткові дослідження:
1. У разі підозри на наявність сімейної дисліпідемії — додатково провести обстеження ліпідного профілю близьких родичів та генетичне дослідження.
2. За неможливості обчислення ХС ЛПНЩ відповідно до формули Friedewald (при концентрації ТГ >4,5 ммоль/дл або 400 мг/дл) — провести визначення ліпідного профілю методом електрофорезу або ультрацентрифугування.
3. При діагностуванні ІХС, еквівалентів ІХС або АГ — подальше обстеження проводити відповідно до нозологічної форми.
Стратифікація серцево-судинного ризику
Серцево-судинним ризиком слід вважати індивідуальний ризик розвитку атеросклеротичних серцево-судинних подій протягом певного часу.
Індивідуальний 10-річний ризик серцево-судинної смертності визначається за таблицями SCORE відповідно до статі пацієнта, статусу курця, віку, АТ та рівня загального ХС (рис. 1).

Рівні загального серцево-судинного ризику
Дуже високий ризик встановлюється у пацієнтів, що мають:
- будь-яке атеросклеротичне серцево-судинне захворювання (АССЗ), документоване як ГКС (ІМ або нестабільна стенокардія), стабільну стенокардію, коронарну реваскуляризацію, ішемічний інсульт, ТІА та периферичний атеросклероз або візуально підтверджене за даними коронарографії, КТ, УЗД сонних артерій;
- цукровий діабет 2-го типу з ураженням органів-мішеней або з щонайменше трьома основними факторами ризику або цукровий діабет 1-го типу при ранній маніфестації та тривалості >20 років;
- тяжку ХХН (eGFR <30 мл/хв/1,73 м2);
- розрахунковий SCORE ≥10% для 10-річного ризику фатального серцево-судинного захворювання;
- сімейну гіперхолестеринемію з АССЗ або іншим головним фактором ризику.
Високий ризик встановлюється у пацієнтів, що мають:
- суттєво підвищені поодинокі фактори ризику, зокрема ХС >8 ммоль/л (>310 мг/дл), ХС ЛПНЩ >4,9 ммоль/л (>190 мг/дл), або АТ >180/110 мм рт. ст.; сімейну гіперхолестеринемію без інших основних факторів ризику;
- цукровий діабет без ураження органів-мішеней, тривалістю ≥10 років або інший додатковий фактор ризику;
- помірну ХХН (eGFR 30–59 мл/хв/1,73 м2);
- розрахунковий SCORE ≥5% та <10% для 10-річного ризику фатального серцево-судинного захворювання.
Помірний ризик мають:
- молоді пацієнти з цукровим діабетом 1-го типу віком <35 років та 2-го типу віком <50 років тривалістю <10 років та без інших факторів ризику;
- розрахунковий SCORE ≥1% та <5% для 10-річного ризику фатального серцево-судинного захворювання.
Низький ризик встановлюється у пацієнтів, які мають розрахований на 10 років ризик SCORE <1%.
У виданих у 2019 р. спільних рекомендаціях Європейського товариства кардіологів та Європейського товариства з атеросклерозу, присвячених дисліпідеміям, для визначення індивідуального серцево-судинного ризику у пацієнтів запропоновано також розраховувати SCORE залежно від рівня ХС ЛПВЩ — 0,8 ммоль/л; 1,0 ммоль/л; 1,4 ммоль/л та 1,8 ммоль/л.
Програма лікування
Перелік обов’язкових медичних послуг
Хворі з дисліпідеміями повинні отримувати комплексне лікування:
Немедикаментозна терапія (дієта, корекція маси тіла, підвищення фізичної активності, припинення паління) для досягнення оптимальних характеристик ліпідного профілю.
Медикаментозне лікування відповідно до різних варіантів дисліпідемій:
а) гіперхолестеринемія: перший крок — статини; другий крок (при недосягненні цільових рівнів ХС ЛПНЩ на тлі максимально переносимої дози статинів) — статини + езетиміб; третій крок (особливо при сімейній гіперхолестеринемії) — статини + езетиміб + інгібітори PCSK9;
б) комбінована дисліпідемія — статини, можна рекомендувати комбінацію статинів і фібратів; другий крок (при недосягненні цільових рівнів ХС ЛПНЩ на тлі максимально переносимої дози статинів) — статини + езетиміб; третій крок — статини + езетиміб + інгібітори PCSK9;
в) гіпертригліцеридемія — статини, фібрати, омега-3 поліненасичені жирні кислоти.
У безсимптомних пацієнтів: якщо шляхом модифікації способу життя протягом 8–12 тиж не вдається досягти встановленої мети, розпочати медикаментозне гіполіпідемічне лікування відповідно до варіанту дисліпідемій.
У хворих із встановленою ІХС або її еквівалентами терапію статинами необхідно розпочати одночасно із заходами щодо немедикаментозної профілактики.
Перелік додаткових медичних послуг
1. При супутній АГ — антигіпертензивна терапія.
2. При супутньому цукровому діабеті — цукрознижувальна терапія.
3. При гіпотиреозі – гормонзамісна терапія.
4. При вторинних дисліпідеміях — максимальна стабілізація коморбідного стану (гепатит, панкреатит та ін.).
5. При тяжких формах сімейних дисліпідемій — можлива корекція ліпідного профілю методом аферезу.
Характеристика очікуваних кінцевих результатів лікування
Вибір цілі для лікування дисліпідемії ґрунтується на результатах доказової медицини. Практично у всіх дослідженнях, спрямованих на вивчення методів зниження рівня ліпідів, ХС ЛПНЩ використовувався як індикатор відповіді на лікування. Таким чином, рівень ХС ЛПНЩ залишається основною мішенню терапії дисліпідемій (табл. 28).
Таблиця 28. Рекомендації щодо аналізу ліпідного профілю для оцінки серцево-судинного ризику
|
Рекомендації |
Клас |
Рівень |
|
Рекомендується визначення рівня загального ХС для оцінки загального серцево-судинного ризику за допомогою шкали SCORE |
I |
C |
|
Рекомендується визначення рівня ХС ЛПВЩ для подальшого уточнення рівня ризику, використовуючи шкалу SCORE онлайн |
І |
С |
|
Рекомендується визначення рівня ХС ЛПНЩ в якості основного критерію аналізу ліпідів для скринінгу, діагностики та лікування |
І |
С |
|
Рекомендується визначення рівня ТГ як частини рутинного обстеження ліпідного профілю |
І |
С |
|
Рекомендується визначення рівня ХС не-ЛПВЩ для оцінки ризику, особливо в осіб з високим рівнем ТГ, цукровим діабетом, ожирінням чи з дуже низьким рівнем ХС ЛПНЩ |
І |
С |
|
Рекомендується визначення рівня Аpo-В для оцінки ризику особливо в осіб з високим рівнем ТГ, цукровим діабетом, ожирінням чи метаболічним синдромом, або з дуже низьким рівнем ХС ЛПНЩ. Він може використовуватися як альтернатива ХС ЛПНЩ у якості первинного вимірювання для скринінгу, діагностики та лікування та може мати перевагу над ХС не-ЛПВЩ в осіб з високим рівнем ТГ, цукровим діабетом, ожирінням чи з дуже низьким рівнем ХС ЛПНЩ |
І |
С |
|
Варто визначати рівень Lp(a) мінімум один раз у житті для виявлення випадків дуже високого рівня Lp(a) >180 мг/дл (>430 нмоль/л) у дорослих пацієнтів, які можуть мати ризик розвитку атеросклеротичних серцево-судинних захворювань, еквівалентний ризику для гетерозиготної сімейної гіперхолестеринемії |
ІІа |
С |
|
Варто розглядати визначення рівня Lp(a) в окремих випадках із сімейним анамнезом раннього розвитку серцево-судинних захворювань та для рекласифікаціїї у осіб, що знаходяться між помірним та високим ризиком |
ІІа |
С |
Apo – аполіпопротеїн; Lp(a) — ліпопротеїн(а).
Тривалість лікування
Хворі з дисліпідеміями потребують пожиттєвого немедикаментозного й медикаментозного лікування.
Критерії якості лікування
Критерієм якості лікування дисліпідемії є досягнення цільових рівнів терапії (табл. 29).
Таблиця 29. Цільові рівні терапії для пацієнтів
|
Рекомендації |
Клас |
Рівень |
|
Для вторинної профілактики в осіб дуже високого ризику рекомендується зниження рівня ХС ЛПНЩ на ≥50% від початкового та цільовий рівень ХС ЛПНЩ <1,8 ммоль/л (<70 мг/дл) |
І |
A |
|
Для первинної профілактики в осіб дуже високого ризику, але без сімейної гіперхолестеринемії, рекомендується зниження рівня ХС ЛПНЩ на ≥50% від початкового та цільовий рівень ХС ЛПНЩ <1,8 ммоль/л (<70 мг/дл) |
І |
C |
|
Для первинної профілактики в осіб із сімейною гіперхолестеринемією та дуже високим ризиком цільовий рівень ХС ЛПНЩ <1,8 ммоль/л (<70 мг/дл) |
ІІа |
C |
|
Для пацієнтів з високим ризиком рекомендується зниження рівня ХС ЛПНЩ на ≥50% від початкового та цільовий рівень ХС ЛПНЩ <2,6 ммоль/л (<100 мг/дл) |
I |
A |
|
Для пацієнтів з помірним ризиком слід розглянути зниження рівня ХС ЛПНЩ на ≥50% від початкового та цільовий рівень ХС ЛПНЩ <3,0 ммоль/л (<116 мг/дл) |
IIa |
A |
|
Для пацієнтів з низьким ризиком може бути розглянуте зниження рівня ХС ЛПНЩ на ≥50% від початкового та цільовий рівень ХС ЛПНЩ <3,0 ммоль/л (<116 мг/дл) |
IIb |
A |
Можливі побічні дії та ускладнення
Статини. Статини в цілому добре переносяться, серйозні небажані явища розвиваються рідко. Хоча застосування статинів у цілому є ефективним для профілактики серцево-судинних захворювань, відповідь на лікування, як і частота розвитку небажаних явищ, відрізняються в окремих пацієнтів.
Скелетні м’язи. Імовірність розвитку небажаних явищ підвищується у пацієнтів літнього віку, при низькій масі тіла, у жінок, за наявності порушень функції нирок і печінки, у післяопераційний період, при гіпотиреозі, поліорганних захворюваннях і зловживанні алкоголем. Найбільш серйозним небажаним явищем, пов’язаним з прийомом статинів, є міопатія, яка може прогресувати до розвитку рабдоміолізу, ниркової недостатності та смерті в особливо тяжких випадках. Основним маркером руйнування і загибелі клітин скелетних м’язів є підвищення в крові рівня КФК. Підвищення рівня КФК є кращим, хоч і не зовсім однозначним індикатором розвитку міопатії, індукованої статинами.
Печінка. Підвищення рівня печінкових трансаміназ (АсАТ, АлАТ) відзначають у 0,5–2,0% пацієнтів, що приймають статини, воно має дозозалежний характер. Загальним визначенням значного підвищення рівня печінкових ферментів є перевищення верхньої межі норми в 3 рази, що зберігається при двох послідовних вимірюваннях, які зазвичай проводяться з коротким інтервалом часу між ними (від кількох днів до кількох тижнів). Прогресування ушкоджень з розвитком печінкової недостатності відмічають дуже рідко.
Езетиміб. Немає даних про наявність клінічно значущого впливу віку, статі або раси пацієнта на фармакокінетику езетимібу. Пацієнти з помірними порушеннями печінкової функції та помірними або вираженими порушеннями функції нирок не потребують зміни дози препарату. Його можна призначати в комбінації з будь-яким статином у будь-якій дозі. Не повідомлялося про розвиток серйозних небажаних явищ; найбільш частими небажаними явищами є помірне підвищення рівня печінкових ферментів та біль у м’язах.
Інгібітори PCSK9 (еволокумаб, алірокумаб). Дані про ефективність і безпеку нового класу ліпідознижувальних препаратів інгібіторів PCSK9 (інгібіторів пропротеїнової конвертази субтилізин-кексин 9-го типу) є обнадійливими. Результати метааналізу не виявили жодної різниці в частоті виникнення серйозних побічних ефектів, опорно-рухових порушень, нейрокогнітивних порушень або в частоті виникнення інсульту у пацієнтів на тлі терапії інгібіторами PCSK9.
Фібрати. Загалом добре переносяться і викликають помірні побічні ефекти. Розлади функції органів шлунково-кишкового тракту відзначали у 5% пацієнтів, шкірний висип — у 2%. Найбільш відомими небажаними явищами, пов’язаними з дією фібратів, є міопатія, підвищення рівня печінкових ферментів і холелітіаз.
Омега-3 поліненасичені жирні кислоти. Цей клас є безпечним і позбавлений будь-якої клінічно значущої взаємодії. Проте антитромботичну дію препарату може підвищувати схильність до кровотеч, насамперед при застосуванні в поєднанні з ацетилсаліциловою кислотою/клопідогрелем.
Рекомендації щодо амбулаторного нагляду
Хворі повинні постійно знаходитися на диспансерному спостереженні за місцем проживання. Контролювати ліпідні параметри слід перед лікуванням, через 8 (±4) тиж після початку лікування та/або після корекції терапії до досягнення цільового рівня. Рівень ХС або ліпідів після досягнення цільових або оптимальних рівнів необхідно визначати щорічно (якщо немає проблеми з комплаєнсом або іншої конкретної причини для частішого тестування).
Рівень печінкових ферментів (АлАТ) у пацієнтів, що отримують ліпідознижувальну терапію, слід контролювати перед лікуванням, через 8 тиж після його початку або після підвищення дози препарату. Потім щорічно, якщо рівень печінкових ферментів не підвищився більше ніж у 3 рази. Якщо рівень печінкових ферментів починає зростати менше ніж у 3 рази, рекомендовано продовжити терапію, повторити аналізи на печінкові ферменти через 4–6 тиж. Якщо зростання більше ніж у 3 рази, слід припинити прийом статинів або знизити дозу, повторити аналіз на печінкові ферменти через 4–6 тиж. Обережне відновлення терапії може розглядатися після нормалізації рівня АлАТ.
Рівень КФК у пацієнтів, що отримують ліпідознижувальну терапію, необхідно визначати до лікування. Якщо базовий рівень КФК перевищено в 5 разів, терапію статинами не починати, повторити аналізи. Якщо на фоні ліпідознижувальної терапії зростання КФК більше ніж у 5 разів, слід припинити терапію, перевірити функцію нирок і визначати рівень КФК кожні 2 тиж. Розглянути можливість транзиторного підвищення рівня КФК з іншої причини, наприклад м’язові вправи. Якщо зростання менше ніж у 5 разів і немає симптомів з боку м’язів, продовжити прийом статинів (пацієнти повинні бути попереджені про симптоми); розглянути питання про подальше визначення рівня КФК. Якщо є симптоми з боку м’язів, необхідно контролювати симптоми та регулярно визначати рівень КФК.
Освітні заходи щодо способу життя
Усі пацієнти мають бути поінформовані щодо корекції способу життя, що зумовлює зниження серцево-судинного ризику. Пацієнти з високим ризиком, зокрема особи з дисліпідеміями, за можливості повинні отримати дієтичні рекомендації. Калорійність їжі варто підбирати з урахуванням профілактики надмірної маси тіла та ожиріння. Варто заохочувати до споживання фруктів, овочів, бобових, горіхів, цільнозернових злаків та хліба, риби (особливо жирної). Насичені жири необхідно замінити продуктами з мононенасиченими та поліненасиченими жирами рослинного походження з метою досягти <35% добової калорійності за рахунок споживання жирів, у тому числі <7% за рахунок насичених жирів та <1% — трансжирів, а споживання ХС з продуктами харчування не має перевищувати 300 мг/добу.
Тих, хто вживає алкогольні напої, необхідно спонукати до помірності (<10–20 г/добу для жінок та <20–30 г/добу для чоловіків), а пацієнтам з гіпертригліцеридемією необхідно утриматися від вживання алкоголю взагалі.
Помірне зменшення маси тіла та регулярні фізичні навантаження середньої інтенсивності дуже ефективні для профілактики цукрового діабету 2-го типу, зменшення вираженості усіх метаболічних порушень та факторів серцево-судинного ризику, пов’язаних з інсулінорезистентністю, часто асоційованих з абдомінальним ожирінням. Фізичну активність слід підтримувати, метою є регулярні щоденні фізичні вправи тривалістю не менше ніж 30 хв/день.
Реабілітаційні заходи
Показання та протипоказання щодо санаторного етапу лікування
Реабілітаційні заходи проводяться згідно з протоколами лікування основного захворювання.
Етапність надання медичної допомоги
Первинна допомога
Передбачає раннє виявлення й усунення факторів ризику на популяційному рівні для запобігання новим випадкам серцево-судинних захворювань. Такі профілактичні заходи включають відмову від паління, формування здорових харчових звичок, регулярне фізичне навантаження, зменшення надмірної маси тіла, виявлення супутньої патології, яка може спричинити виникнення дисліпідемії (цукровий діабет, гіпотиреоз, синдром полікістозних яєчників, синдром Кушинга, нефротичний синдром, панкреатит тощо). Призначення ліпідознижувальної терапії — відповідно до виявленого варіанту дисліпідемії.
Вторинна допомога
Забезпечує подальше виявлення й корекцію факторів ризику та лікування з метою запобігання передчасному розвитку ускладнень і передчасної смерті хворих від серцево-судинних захворювань. Рекомендації щодо модифікації способу життя та призначення ліпідознижувальної терапії — відповідно до виявленого варіанту дисліпідемії.
Третинна (високоспеціалізована) допомога
Призначення ліпідознижувальної терапії — відповідно до виявленого варіанту дисліпідемії. У рідкісних випадках пацієнтам з тяжкою гіперліпідемією, насамперед хворим з гомозиготною (у випадку «нульової» мутації) та вираженою гетерозиготною формами сімейної гіперхолестеринемії, тяжкою гіпертригліцеридемією (для попередження панкреанекрозу), необхідна консультація фахівця для вирішення питання про необхідність проведення аферезу. Процедура аферезу виконується тільки в спеціалізованих закладах кардіологічного профілю.
Перелік фармакологічних препаратів
1. Статини (симвастатин, аторвастатин, розувастатин, пітавастатин). Механізм дії. Статини знижують синтез ХС в печінці шляхом конкурентного інгібування ферменту 3-гідроксил-3метил-глутарил-коферменту А — редуктази (ГМГ-КоА редуктази), який каталізує початкові та проміжні стадії біосинтезу ХС (перетворення ГМГ-КоА на меволат — попередник стеринів) у печінці. Зниження внутрішньоклітинної концентрації ХС спричиняє експресію рецепторів ЛПНЩ на поверхні гепатоцитів, що сприяє підвищенню екстракції ХС ЛПНЩ із крові та зниженню концентрації циркулюючого ХС ЛПНЩ та інших ліпопротеїнів, що містять апо-B.
2. Інгібітори всмоктування ХС (езетиміб). Механізм дії. Езетиміб є першим лікарським засобом, призначеним для зниження рівня ліпідів, який інгібує всмоктування в кишечнику ХС, що надходить з їжею та із жовчі, не впливаючи на всмоктування інших жиророзчинних харчових речовин. Інгібуючи всмоктування ХС на рівні ворсинчастої облямівки кишечнику, езетиміб знижує кількість ХС, що надходить до печінки з ремнантів хіломікронів. У відповідь на зниження надходження ХС печінка активує на своїй поверхні рецептори ЛПНЩ, що призводить до збільшення кліренсу ЛПНЩ із крові.
3. Інгібітори PCSK9. Механізм дії. Інгібітори PCSK9 (еволокумаб, алірокумаб) — інгібітори пропротеїнової конвертази субтилізин-кексин 9-го типу. PCSK9 — це ключова ланка в регуляції обміну ліпідів крові за рахунок безпосередньої участі в деградації рецепторів до ЛПНЩ (LDLR) та рецепторів до ЛПДНЩ (VLDLR) і рецепторів до аполіпопротеїну Е 2-го типу (ApoER2). Головним чином PCSK9 експресується в тканинах печінки й так само в кишечнику і нирках. Інгібітори PCSK9 є моноклональними антитілами, які зв’язуються і блокують дію PCSK9 поблизу каталітичного домену, що призводить до суттєвого зниження концентрації циркулюючих часток ХС ЛПНЩ.
4. Фібрати (фенофібрат). Механізм дії. Фібрати є агоністами ядерних альфа-рецепторів, активація яких призводить до проліферації пероксисом (PPAR-α), і діють через фактори транскрипції, що регулюють різні етапи метаболізму ліпідів і ліпопротеїнів. Взаємодіючи з PPAR-α, фібрати впливають на різні кофактори й регулюють експресію генів. У підсумку фібрати ефективно знижують рівень ТГ в крові натще, а також постпрандіальний рівень ТГ і концентрацію ремнантних частинок ліпопротеїнів, багатих на ТГ. Фібрати помірно підвищують рівень ХС ЛПВЩ.
5. Омега-3 поліненасичені жирні кислоти. Механізм дії. Омега-3 жирні кислоти є компонентами риб’ячого жиру, входять до складу продуктів середземноморської дієти і використовуються для зниження рівня ТГ. Омега-3 поліненасичені жирні кислоти в лікарських дозах (>2 г/добу) впливають на сироватковий рівень ліпідів і ліпопротеїнів, передусім на концентрацію ЛПДНЩ (табл. 30). Механізм дії може бути пов’язаний з їх здатністю взаємодіяти з ядерними рецепторами (PPAR) і знижувати секрецію частинок Аро-B.
Таблиця 30. Дози гіполіпідемічних препаратів
|
№ з/п |
Назва препарату |
Дози (min–max) |
|
Статини |
||
|
1 |
Аторвастатин |
10–80 мг/добу |
|
2 |
Пітавастатин |
1–4 мг/добу |
|
3 |
Розувастатин |
5–40 мг/добу |
|
4 |
Симвастатин |
20–40 мг/добу |
|
Комбіновані препарати |
||
|
1 |
Розувастатин/езетиміб |
10 мг/10 мг/добу 20 мг/10 мг/добу |
|
2 |
Симвастатин/езетиміб |
10 мг/10 мг/добу 20/10 мг/добу 40 мг/10 мг/добу |
|
Інгібітори PCSK9 |
||
|
1 |
Еволокумаб |
140 мг в 1,0 мл для п/ш введення кожні 2 тиж |
|
2 |
Алірокумаб |
75–150 мг в 1,0 мл для п/ш введення кожні 2 тиж |
|
Фібрати |
||
|
1 |
Фенофібрат |
Залежно від виробника: 145 мг/добу; 200 мг/добу; 250 мг/добу |
|
Омега-3 поліненасичені жирні кислоти |
||
|
1 |
Омега-3 поліненасичені жирні кислоти |
2000–4000 мг/добу |
Інтервенційні та хірургічні методи лікування
Гомозиготна та тяжка гетерозиготна сімейна гіперхолестеринемія. Хворим із гомозиготною гіперхолестеринемією (за наявності «нульової» мутації) та тяжкою гетерозиготною сімейною гіперхолестеринемією потрібна консультація фахівця для вирішення питання про необхідність проведення аферезу ХС ЛПНЩ у спеціалізованому центрі. При використанні цієї процедури ХС ЛПНЩ і ліпопротеїни (а) видаляються з плазми крові у процесі екстракорпорального кровообігу щотижня або раз на 2 тиж.
Лікування тяжкої гіпертригліцеридемії. Після виключення або лікування панкреатиту, у тяжких випадках для швидкого зниження рівня ТГ можна використовувати плазмаферез.
Стандарти надання медичної допомоги пацієнтам із гіпертонічною хворобою (есенціальною АГ)
(Ю.М. Сіренко, Л.А. Міщенко, Г.Д. Радченко, О.Г. Купчинська, О.Л. Рековець)
Стратифікація серцево-судинного ризику у пацієнтів з АГ
Максимально корисною є стратегія, що базується на визначенні загального ризику. Під останнім розуміють той ризик ускладнень, який має даний хворий внаслідок підвищення АТ та наявності супутніх серцево-судинних захворювань, ураження органів-мішеней та основних факторів ризику, наведених у табл. 31 і 32.
Таблиця 31. Класифікація серцево-судинного ризику залежно від факторів ризику, ступеня, стадії захворювання, ураження органів-мішеней та наявності серцево-судинного або ниркового захворювання
|
Стадія АГ |
Інші фактори ризику, ураження органів-мішеней або захворювання |
Ступінь підвищення АТ |
|||
|
Високий нормальний САТ 130–139 або ДАТ |
Ступінь 1 CAT 140–159 або ДАТ |
Ступінь 2 CAT 160–179 або ДАТ |
Ступінь 3 САТ ≥180 або ДАТ ≥110 мм рт. ст. |
||
|
Стадія 1 (неускладнена) |
Немає факторів ризику 1 або 2 фактори ризику ≥3 факторів ризику |
Низький Низький Низький — помірний |
Низький Помірний Помірний — високий |
Помірний Помірний — високий Високий |
Високий Високий Високий |
|
Стадія 2 (безсимптомне захворювання) |
Ураження органів-мішеней, ХХН, цукровий діабет без ураження органів-мішеней |
Помірний — високий |
Високий |
Високий |
Високий — дуже високий |
|
Стадія 3 (симптомне захворювання) |
Симптомне серцево-судинне захворювання, ХХН ≥4, цукровий діабет із ураженням органів-мішеней |
Дуже високий |
Дуже високий |
Дуже високий |
Дуже високий |
Таблиця 32. Фактори (крім АТ), які застосовують для стратифікації загального серцево-судинного ризику
|
Демографічні або лабораторні параметри:
|
|
Пов’язане з АГ асимптомне ураження органів-мішеней:
|
|
Встановлене серцево-судинне захворювання або захворювання нирок:
|
*Електронний калькулятор для розрахунку ШКФ за формулою CKD-EPI на сайті www.kidney.org/professionals/kdoqi/gfr_calculator (або використовувати відповідну програму для смартфона).
Виділяють чотири групи ризику розвитку серцево-судинних ускладнень:
1. Низький ризик (ризик 1) — мають хворі з АГ 1-го ступеня без факторів ризику. До цієї групи відносять лише жінок, оскільки чоловіча стать сама по собі є фактором ризику серцево-судинних захворювань. Ризик розвитку серцево-судинних захворювань і ускладнень у найближчі 10 років становить 15%.
2. Помірний ризик (ризик 2) — АГ 1-го ступеня з факторами ризику та АГ 2-го ступеня, не більше 2 факторів ризику або вони відсутні. Немає ураження органів-мішеней і серцево-судинних ускладнень. Ризик їх розвитку у найближчі 10 років становить 15–20%.
3. Високий ризик (ризик 3) — мають пацієнти з АГ II стадії. До цієї групи відносять також хворих з АГ І стадії за наявності цукрового діабету або високого тиску (АГ 2-го або 3-го ступеня), які не мають ускладнень АГ. Ризик розвитку серцево-судинних ускладнень у найближчі 10 років — більше 20%.
4. Дуже високий ризик (ризик 4) — пацієнти з АГ III стадії. До цієї групи ризику відносять також хворих з АГ ІІ стадії + цукровий діабет і хворих будь-якої стадії з тяжким ураженням нирок (ШКФ <30 мл/хв/1,73 м2). Ризик розвитку серцево-судинних ускладнень або смерті в найближчі 10 років перевищує 30%.
Стандарти діагностики АГ
Обстеження пацієнта з підвищеним АТ проводиться з метою: 1) підтвердження діагнозу АГ; 2) встановлення можливих причин вторинної АГ; 3) стратифікації ризику серцево-судинних ускладнень, виявлення ураження органів-мішеней і супутніх клінічних станів.
Вимірювання АТ
Золотим стандартом скринінгу, діагностики та оцінки ефективності терапії АГ є традиційне вимірювання АТ в умовах медичного закладу («офісне» вимірювання АТ).
Правила вимірювання АТ:
- вимірювання АТ починають після 3–5-хвилинного відпочинку пацієнта в положенні сидячи; мінімум 2 вимірювання АТ з інтервалом 1–2 хв (3-тє додаткове — у разі значної різниці між першими двома вимірюваннями) й обчислюють середнє арифметичне значення. При первинній оцінці пацієнта вимірювання АТ проводять на обох руках і визначають домінантну (рука з вищим рівнем АТ), на якій у подальшому буде вимірюватися АТ;
- для вимірювання АТ використовують манжетки відповідного розміру: стандартна (ширина 12–13 см, довжина 35 см), велика (окружність плеча пацієнта >32 см) і маленька манжетка (для дітей віком менше 5 років); манжету розміщують посередині плеча на рівні серця, щоб її нижній край знаходився на 2–2,5 см вище ліктьової ямки, а між манжетою і поверхнею плеча проходив палець;
- у разі використання аускультативного методу вимірювання АТ визначають І фазу (появу) і V фазу (зникнення) тонів Короткова, які відповідають САТ і ДАТ;
- вимірювання АТ на 1-й та 3-й хвилині після переходу в ортостаз необхідно обов’язково проводити в осіб похилого віку, а також у хворих з цукровим діабетом і в усіх випадках наявності ортостатичної гіпотензії (зниження САТ на 20 мм рт. ст. і більше або ДАТ на 10 мм рт. ст. і більше) або при підозрі на неї.
Важливим доповненням до традиційного «офісного» є вимірювання АТ поза межами медичного закладу — амбулаторне добове моніторування АТ і домашнє моніторування АТ. Вони надають можливість точніше оцінити рівень АТ на основі оцінки більшої кількості вимірювань в обставинах реального життя пацієнта, а його результати є більш точними предикторами серцево-судинних ускладнень у пацієнтів з АГ. Основними показаннями для амбулаторного добового та домашнього моніторування АТ є підозра на гіпертензію «білого халата», масковану або нічну гіпертензію, гіпотензію, значна міжвізитна варіабельність АТ при «офісних» вимірюваннях і резистентна АГ.
Діагностичні критерії АГ за даними різних типів вимірювання АТ представлені в табл. 33.
Таблиця 33. Діагностичні критерії АГ за даними «офісних» і «позаофісних» вимірювань АТ
|
Категорія |
САТ, мм рт. ст. |
ДАТ, мм рт. ст. |
|
|
Офісний АТ |
≥140 |
та/або |
≥90 |
|
Амбулаторний АТ |
|||
|
Середній денний (неспання) |
≥135 |
та/або |
≥85 |
|
Середній нічний (під час сну) |
≥120 |
та/або |
≥70 |
|
24-годинний |
≥130 |
та/або |
≥80 |
|
Домашній АТ |
≥135 |
та/або |
≥85 |
Оцінка факторів ризику серцево-судинних захворювань: обов’язковим є визначення вмісту в венозній крові глюкози, загального ХС та ТГ, при можливості — ХС ЛПНЩ і ЛПВЩ.
Оцінка ураження органів-мішеней
Серце: ЕКГ є обов’язковою для всіх пацієнтів; додаткові дослідження (ехоКГ, навантажувальні тести, холтерівське моніторування ЕКГ) проводиться за показаннями, що визначаються при фізикальному обстеженні та за даними ЕКГ. ЕхоКГ для всіх є бажаною на етапі первинної ланки і обов’язковою на етапі вторинної допомоги.
Артерії: допплерографія сонних і периферичних артерій, визначення швидкості пульсової хвилі та гомілково-плечовий індекс можуть застосовуватися в якості додаткових досліджень.
Нирки: визначення сироваткового креатиніну і розрахунок ШКФ (кліренсу креатиніну)*, загальний аналіз сечі рекомендовано всім пацієнтам з АГ, за необхідності додатково — оцінка екскреції альбуміну з сечею, УЗД нирок.
*Електронний калькулятор для розрахунку ШКФ за формулою CKD-EPI на сайті www.kidney.org/professionals/kdoqi/gfr_calculator (або використовувати відповідну програму для смартфона).
Діагностика вторинних АГ
Вторинна АГ — це АГ, причина якої може бути виявлена, і яка може бути вилікувана втручанням, специфічним для причини. Настороженість щодо підозри та раннього виявлення вторинних причин АГ є важливою, оскільки втручання можуть сприяти одужанню, особливо у молодих пацієнтів (наприклад хірургічна корекція коарктації аорти, ниркова ангіопластика у молодих пацієнтів з фібромускулярною дисплазією ниркової артерії, усунення ендокринної причини АГ (наприклад шляхом видалення аденоми надниркової залози) або медикаментозне лікування моногенного розладу засобом, що впливає на специфічний іонний канал, чутливий до препарату (наприклад селективне застосування амілориду при синдромі Лідла)). Відтермінована діагностика та лікування вторинної АГ (втручання, за допомогою яких можливо вилікувати причину вторинної АГ), будуть менш ефективними (тобто не зможуть позбавити потреби в антигіпертензивному лікуванні) тому, що тривала АГ призводить до ушкодження судин та інших органів, які підтримують підвищений АТ, але втручання все ж є важливим, оскільки часто сприятиме набагато кращому контролю АТ за допомогою меншого числа антигіпертензивних препаратів.
Поширеність вторинної АГ становить 5–15% серед осіб з АГ. Скринінг усіх хворих на АГ на предмет виявлення вторинної АГ є неможливим або економічно неефективним; однак існують певні загальні характеристики хворих, які вказують на те, що вони більш імовірно можуть мати вторинну АГ, і в яких після підтвердження підвищеного рівня АТ методом амбулаторного моніторування АТ (АМАТ) слід провести такий скринінг (табл. 34).
Таблиця 34. Особливості хворих, які дають можливість запідозрити вторинну АГ
|
Характеристики |
|
Молоді пацієнти (<40 років) з АГ 2-го ступеня або початком АГ будь-якого ступеня в дитинстві |
|
Гостре погіршення (поява) АГ у пацієнтів з раніше документованою хронічно стабільною нормотензією |
|
Резистентна АГ |
|
Тяжка АГ (3-й ступінь) або невідкладний стан при АГ |
|
Наявність виражених уражень органів-мішеней, обумовлених АГ |
|
Клінічні або біохімічні ознаки наявності у хворого ендокринних причин АГ або хронічної хвороби нирок (ХХН) |
|
Клінічні ознаки наявності синдрому обструктивного апное сну (СОАС) |
|
Симптоми, підозрілі на феохромоцитому, або сімейний анамнез феохромоцитоми |
Вторинну АГ варто запідозрити в першу чергу у пацієнтів з резистентним перебігом хвороби.
Резистентна АГ
АГ визначається як резистентна до лікування, коли рекомендована стратегія терапії не дозволяє знизити рівень офісного САТ та ДАТ до <140 мм рт. ст. та/або <90 мм рт. ст. відповідно, а неадекватний контроль АТ підтверджується при АМАТ або домашньому моніторуванні АТ (ДМАТ) у хворих, прихильність до терапії у яких була верифікована. Рекомендована стратегія лікування повинна включати відповідні заходи щодо зміни способу життя та лікування оптимальними або найкраще переносимими дозами трьох або більше препаратів, які повинні включати, як правило, діуретик, інгібітор АПФ або БРА, і блокатори кальцієвих каналів. Також необхідно виключити псевдорезистентну АГ та вторинні причини АГ. Резистентна АГ відмічається приблизно у 10% пацієнтів із АГ. У близько 50% пацієнтів з діагнозом резистентної АГ відмічають псевдорезистентність, а не істинну резистентну АГ.
Рекомендоване наступне лікування резистентної АГ:
- посилення заходів щодо способу життя, особливо обмеження вживання солі <5 г/добу;
- додавання до існуючого лікування низьких доз спіронолактону;
- або подальше доповнення діуретичної терапії при непереносимості спіронолактону призначенням еплеренону або амілориду, або більш високих доз тіазидних/тіазидоподібних діуретиків, або призначення петльового діуретика (при ШКФ <30 мл/хв);
- або додаткове призначення до попередньої терапії бісопрололу, доксазозину, препарату центральної дій чи будь-якого антигіпертензивного препарату інших груп, що ще не застосовувалися, та не заборонені для поєднаного застосування.
Псевдорезистентна АГ
Перш ніж зробити висновок про те, що у пацієнта має місце резистентна АГ, повинні бути оцінені та виключені кілька можливих причин псевдорезистентної АГ:
(1) Погана прихильність до лікування є частою причиною псевдорезистентної АГ, яка відмічається у ≤50% пацієнтів, коли її оцінюють за допомогою моніторингу терапевтичних препаратів (у крові або сечі), і безпосередньо пов’язана з кількістю призначених таблеток.
(2) «Феномен білого халата» (при якому офісний рівень АТ підвищений, але АТ контролюється за даними АМАТ або ДМАТ) не є рідкісним у цих пацієнтів, отже, перш ніж підтвердити діагноз резистентної АГ, рекомендовано підтвердити офісну АГ методом АМАТ або ДМАТ.
(3) Неправильна методика вимірювання офісного АТ, включаючи використання манжет, що є занадто малими відносно окружності руки, можуть призвести до хибного визначення високого АТ.
(4) Виражена кальцифікація плечової артерії, особливо у хворих похилого віку з сильно кальцифікованими артеріями.
(5) Клінічна інерція, внаслідок чого призначають неадекватні дози або нераціональні комбінації антигіпертензивних препаратів.
Інші причини резистентної АГ
(1) Фактори способу життя, такі як ожиріння або значне збільшення маси тіла, надмірне споживання алкоголю та натрію.
(2) Вживання вазопресорів або натрійзатримувальних речовин, препаратів, призначених для інших станів, крім АГ, деяких засобів рослинного походження або рекреаційних препаратів і субстанцій (кокаїн, анаболічні стероїди тощо) (див. табл. 38).
(3) Обструктивне апное сну (як правило, але не завжди пов’язане з ожирінням).
(4) Невиявлені форми вторинної АГ (табл. 35).
(5) Виражене ураження органів-мішеней, обумовлене АГ, зокрема ХХН або підвищення жорсткості великих артерій.
Резистентна АГ, пов’язана із старшим віком (особливо >75 років), чоловічою статтю, негроїдною расою африканського походження, вищим початковим рівнем АТ на час діагностики АГ, більш високими цифрами АТ, які виявляються протягом життя пацієнта, частими амбулаторними візитами, ожирінням, цукровим діабетом, атеросклеротичним захворюванням та ураженням органів-мішеней, обумовлене АГ, ХХН і рівнем коронарного ризику протягом 10 років за Фремінгемською шкалою >20%.
Таблиця 35. Резистентна АГ, характеристики, вторинні причини та підтримувальні фактори
|
Характеристики хворих із резистентною АГ |
Вторинні причини резистентної АГ |
Ліки та субстанції, які можуть бути причиною підвищення АТ |
|
Демографія:
|
Найбільш часті причини:
|
Призначені ліки:
|
|
Супутні захворювання:
|
Нечасті причини:
|
Субстанції, які не призначають:
|
Діагностичний підхід при резистентній АГ
Діагностика резистентної АГ:
(1) Анамнез пацієнта, включаючи особливості способу життя, алкоголь та дієтичне споживання натрію, прийом ліків або субстанцій, які можуть впливати на контроль АТ, а також історію сну.
(2) Характер та дозування антигіпертензивної терапії.
(3) Фізикальний огляд з особливим акцентом на виявлення наявності ураження органів-мішеней, обумовлене АГ, та ознак вторинної АГ.
(4) Підтвердження резистентності до лікування шляхом позаофісного вимірювання АТ (наприклад АМАТ або ДМАТ).
(5) Лабораторні тести для виявлення порушень вмісту електролітів (гіпокаліємія), пов’язаних факторів ризику (цукровий діабет), ураження органів (розвинена дисфункція нирок) та вторинної АГ.
(6) Підтвердження прихильності до антигіпертензивної терапії.
Пацієнти повинні пройти обстеження для виявлення вторинної причини АГ, найбільше щодо первинного альдостеронізму або атеросклеротичного стенозу ниркової артерії, особливо у пацієнтів похилого віку або з ХХН. Необхідно враховувати слабку прихильність до лікування, але її виявлення у звичайній клінічній практиці може бути достатньо складним. Деякі методи є простими у використанні, але мають обмежену цінність (наприклад стандартизовані опитувальники), тоді як інші, такі як скринінг на вміст лікарських засобів у сечі або крові, демонструють значні перспективи, але ще не доступні для широкого використання.
Причини вторинної АГ, клінічного перебігу та скринінгових тестів описані в табл. 36, а типовий віковий розподіл цих причин вторинної АГ наведено в табл. 37. Огляд цих таблиць показує, що більшість скринінгових процедур можливо розпочати з аналізів крові та сечі, УЗД органів черевної порожнини та ехоКГ. Направлення до спеціалізованого центру рекомендується для проведення додаткових досліджень для підтвердження можливого діагнозу вторинної АГ, який підозрюють, та для клінічного лікування. Інші причини вторинної АГ внаслідок прийому ліків та субстанцій, а також рідкісні моногенні причини, описані нижче, наведені в табл. 38 та 39.
Таблиця 36. Типові причини вторинної АГ
|
Причина |
Поширеність серед хворих на АГ, % |
Симптоми та ознаки |
Скринінгові дослідження |
|
Причина |
Поширеність серед хворих на АГ, % |
Симптоми та ознаки |
Скринінгові дослідження |
|
Синдром обструктивного апное сну |
5–10 |
Хропіння; ожиріння (може бути і у худих); ранковий головний біль; денна сонливість |
Шкала Епворта, амбулаторна полісомнографія |
|
Хвороба паренхіми нирок |
2–10 |
Переважно безсимптомний перебіг; цукровий діабет; гематурія; протеїнурія, ніктурія; анемія; множинний полікістоз нирок у дорослих |
Креатинін плазми, електроліти, рШКФ; стрічковий тест сечі на кров, протеїн, відношення альбумін/креатинін у сечі; УЗД нирок |
|
Реноваскулярні захворювання |
|||
|
Атеросклеротичне реноваскулярне захворювання |
1–10 |
Старший вік, поширений атеросклероз (особливо ЗПА; цукровий діабет; паління; рецидиви флеш-набряку легень; систолічний шум у черевній порожнині |
Дуплексне допплерівське ультразвукове дослідження або КТ- чи МРТ-ангіографія |
|
Фібромускулярна дисплазія |
Молодший вік, частіше у жінок, систолічний шум у черевній порожнині |
||
|
Ендокринні причини |
|||
|
Первинний альдостеронізм |
5–15 |
Переважно безсимптомний перебіг; м’язова слабкість (рідко) |
Альдостерон і ренін у плазмі та їх відношення; гіпокаліємія (у меншості); гіпокаліємія може знижувати рівень альдостерону |
|
Феохромоцитома |
<1 |
Епізодичні симптоми: пароксизмальна АГ, потужний головний біль, підвищена пітливість, тремор верхніх кінцівок, блідість; АТ може підвищуватися після прийому ліків (у тому числі блокаторів бета-рецепторів, метоклопраміду, симпатоміметиків, опіоїдів, трициклічних антидепресантів) |
Метанефрини у фракціонованій плазмі або сечі |
|
Синдром Кушинга |
<1 |
Місяцеподібне обличчя, центральне ожиріння, атрофія шкіри, стриї на нижній частині живота, підшкірні крововиливи; цукровий діабет; хронічний прийом стероїдів |
Вільний кортизол у 24-годинній пробі сечі |
|
Хвороби щитоподібної залози (гіпер- та гіпотиреоз) |
1–2 |
Симптоми гіпер- або гіпотиреозу |
Вміст тиреоїдних гормонів |
|
Гіперпаратиреоз |
<1 |
Гіперкальціємія, гіпофосфатемія |
Паратиреоїдний гормон, кальцій |
|
Інші причини |
|||
|
Коарктація аорти |
<1 |
Зазвичай виявляється у дитинстві або підлітковому віці; різниця між рівнем АТ (≥20/10 мм рт. ст.) між верхніми та нижніми кінцівками або між правою та лівою руками та відстрочена радіально-феморальна пульсація; низький КПІ; шум між лопатками; дефекти нижніх країв ребер при рентгендослідженні грудної клітки |
ЕхоКГ |
ЗПА — захворювання периферичних артерій; КПІ — кісточково-плечовий індекс; рШКФ — розрахункова швидкість клубочкової фільтрації.
Таблиця 37. Поширеність та типові причини вторинної АГ відповідно до віку
|
Вікова група |
Частка, % |
Типові причини |
|
Молодші діти (<12 років) |
70–85 |
|
|
Підлітки (12–18 років) |
10–15 |
|
|
Молоді дорослі (19–40 років) |
5–10 |
|
|
Дорослі середнього віку (41–65 років) |
5–15 |
|
|
Дорослі похилого віку (>65 років) |
5–10 |
|
Препарати та інші субстанції, які можуть викликати вторинну АГ
Прийом ліків та інших речовин може призвести до підвищення АТ та викликати підозру на вторинну АГ (див. табл. 38). Збір анамнезу щодо прийому ліків є важливим при розгляді діагнозу вторинної АГ. Лікарські засоби, такі як НПЗП або глюкокортикоїди, можуть протидіяти ефекту зниження АТ при прийомі антигіпертензивних засобів у хворих, які вже лікуються від АГ, що може зумовити втрату контролю АТ.
Таблиця 38. Лікарські засоби та субстанції, які можуть підвищувати АТ
|
Лікарські засоби/субстанції |
|
|
Оральні контрацептивні засоби |
Особливо ті, що містять естроген; викликають АГ в ~5 % жінок, зазвичай м’яку, але може бути і тяжка |
|
Дієтичні таблетки (для схуднення) |
Наприклад, фенілпропаноламін і сибутрамін |
|
Назальні деконгестанти |
Наприклад, фенілефрину гідрохлорид, нафазоліну гідрохлорид |
|
Стимулюючі засоби |
Амфетамін, кокаїн, екстазі; ці засоби викликають частіше гостру, ніж хронічну АГ |
|
Локриця |
Хронічне надмірне споживання локриці імітує гіперальдостеронізм шляхом стимуляції мінералокортикоїдних рецепторів і пригнічення метаболізму кортизолу |
|
Імуносупресивні засоби |
Наприклад, циклоспорин А (такролімус чинить менший ефект на АТ, а рапаміцин майже не впливає на АТ) та стероїди (кортикостероїди та гідрокортизон) |
|
Антиангіогенні засоби для лікування раку |
Антиангіогенні засоби, такі, як інгібітори VEGF (зокрема бевасизумаб), інгібітори тирозинкінази (у тому числі сунітиніб) та сорафеніб |
|
Інші препарати та субстанції, які можуть підвищувати АТ |
Анаболічні стероїди, еритропоетини, НПЗП, засоби рослинного походження (ефедра та ма хуанг) |
Генетичні причини вторинної АГ
Генетичні причини вторинної АГ, як правило, обумовлені порушенням одного гена. Рекомендації щодо генетичного тестування при АГ наведені в табл. 40. Вони є рідкісними, але важливими причинами вторинної АГ, тому що виявлення причини може визначати специфічну медикаментозну терапію (див. табл. 39). Загальні особливості цих генетичних розладів полягають у тому, що вони, як правило, обумовлюють наявність АГ у дітей, підлітків або осіб молодого віку, а також більшість моногенних розладів викликають АГ через підвищення реабсорбції натрію в ниркових канальцях. Вони зазвичай асоціюються зі зниженою концентрацією або активністю реніну в плазмі крові, що є нетиповим для молодих пацієнтів, а особливо тих, хто приймає антигіпертензивні препарати (наприклад блокатори ренін-ангіотензинової системи, блокатори кальцієвих каналів або діуретики), які, як очікується, підвищують концентрацію або активність реніну в плазмі крові. Таким чином, виявлення зниженої концентрації або активності реніну в плазмі крові, особливо під час прийому блокаторів ренін-ангіотензинової системи, блокаторів кальцієвих каналів або діуретиків, повинно викликати підозру на вторинну АГ через стан, що зумовлює затримку солі в організмі людини. Важливо, що, зокрема, блокатори бета-адренорецепторів, НПЗП, альфа-метилдопа або клонідин, пригнічують концентрацію або активність реніну в плазмі крові. Прийом цих препаратів слід припинити (якщо це клінічно можливо!) принаймні за 2 тиж до визначення концентрації або активності реніну в плазмі крові.
Таблиця 39. Рідкісні генетичні причини вторинної АГ
|
Стан |
Фенотип |
Механізм та ефекти |
|
Синдром Ліддла |
Гіпокаліємія, метаболічний алкалоз, низька активність або концентрація реніну в плазмі крові, низький рівень альдостерону в плазмі крові |
Підвищена активність епітеліальних натрієвих каналів у ниркових канальцях: відповідають на лікування амілоридом |
|
Синдром явного мінералокортикоїдного надлишку |
Гіпокаліємія, метаболічний алкалоз, низька активність або концентрація реніну в плазмі крові, низький рівень альдостерону в плазмі крові |
Зниження активності 2-го ізоензиму 11b-дегідрогенази |
|
Синдром Гордона |
Гіпокаліємія, метаболічний алкалоз, низька активність або концентрація реніну в плазмі крові, низький рівень альдостерону в плазмі крові |
Підвищена активність натрійхлорного котранспортера |
|
Синдром Геллера |
АГ, яка посилюється при вагітності, низька активність або концентрація реніну в плазмі крові, низький рівень альдостерону в плазмі крові |
Агоністичний ефект прогестерону на мінералокортикоїдні рецептори |
|
Глюкокортикоїд-лікована АГ |
Гіпокаліємія, метаболічний алкалоз, низька активність або концентрація реніну в плазмі крові, високий рівень альдостерону в плазмі крові |
Химерні гени CYP 11b1 та CYP 11b2: відповідь на лікування глюкокортикоїдами |
Таблиця 40. Генетичне тестування при АГ
|
Рекомендації |
Клас рекомендацій |
Рівень доказів |
|
Генетичні дослідження повинні розглядатися в спеціалізованих центрах для пацієнтів, у яких є підозри на рідкісні моногенні причини вторинної АГ, або для хворих на феохромоцитому |
IIa |
B |
|
Рутинне генетичне тестування при АГ не рекомендовано |
ІІІ |
С |
Лікування вторинних АГ
Синдром обструктивного апное сну (СОАС). Пацієнтам із СОАС рекомендують уникати спати на спині, зменшити масу тіла. Стандартна антигіпертензивна терапія без відновлення прохідності дихальних шляхів малоефективна. Одним із основних методів лікування СОАС є застосування мікропроцесорних апаратів, що створюють постійний позитивний тиск у дихальних шляхах та забезпечують надходження повітря в легені пацієнта — СРАР-терапія. Хворим із СОАС, у яких не відмічають зниження АТ в нічний час (non-dipper), рекомендований вечірній прийом антигіпертензивних препаратів.
У пацієнтів із ХОЗЛ блокатори бета-адренорецепторів можуть негативно впливати на початково знижену функцію легень, знижують ефективність бета-агоністів тривалої дії та ускладнюють можливість розрізнити бронхіальну астму та ХОЗЛ. Застосування кардіоселективних блокаторів β1-адренорецепторів у пацієнтів із ХОЗЛ довело свою безпеку при АГ. Діуретики можуть знижувати рівень калію в плазмі крові (на додаток до гіпокаліємічного ефекту глюкокортикоїдів та агоністів β2-адренорецепторів), збільшувати затримку вуглекислого газу (включаючи гіпоксію, пов’язану з метаболічним алкалозом, у пацієнтів із гіповентиляцією), збільшувати гематокрит та погіршувати секрецію слизу в бронхах. Таким чином, діуретики не рекомендуються для широкого застосування у хворих на АГ із ХОЗЛ. Для медикаментозного лікування пацієнтів із ХОЗЛ препаратами вибору рекомендовані блокатори кальцієвих каналів, БРА або інгібітори АПФ, або комбінація блокаторів кальцієвих каналів і блокаторів ренін-ангіотензинової системи. Якщо зниження АТ незадовільне, залежно від наявності інших супутніх захворювань можна розглянути призначення тіазидів або тіазидоподібних діуретиків та блокаторів β1-селективних адренорецепторів.
Захворювання паренхіми нирок. Пацієнтам із ХХН, коли рівень їх офісного АТ становить >140/90 мм рт. ст., рекомендовано обмеження натрію (<5 г/добу кухонної солі), та призначення медикаментозного лікування. Для досягнення цільових рівнів АТ при ХХН необхідна комбінована терапія, яка повинна розпочинатися комбінацією блокатора ренін-ангіотензинової системи (інгібітор АПФ/сартан) із блокаторами кальцієвих каналів або діуретиком. Комбінація двох блокаторів ренін-ангіотензинової системи не рекомендується. Слід замінювати тіазидні діуретики на петльові, коли величина рШКФ становить <30 мл/хв/1,73 м2. Контроль дисліпідемії статинами (переваги надаються аторвастатину в максимальних чи максимально переносимих дозах до досягнення цільових рівнів ХС ЛПНЩ <1,8 ммоль/л (70 мг/дл) — для пацієнтів високого ризику, чи ХС ЛПНЩ <1,4 ммоль/л (55 мг/дл) – для пацієнтів дуже високого ризику, або ≥50% від початкового рівня для обох груп пацієнтів; відмова від паління; контроль глікемії (цільовий рівень глікозильованого гемоглобіну <7,0%). Хворим на ХХН, у яких не відмічають зниження АТ в нічний час (non-dipper), рекомендована стратегія вечірнього прийому антигіпертензивних препаратів.
Атеросклеротичне ураження ниркових артерій. За наявності АГ слід використовувати інгібітори АПФ або сартани, за необхідності в комбінації з антагоністами кальцію та/або діуретиками з регулярною оцінкою функції нирок (рівень креатиніну крові та ШКФ (за CKD-EPI). Блокатори ренін-ангіотензинової системи протипоказані при білатеральному ураженні ниркових артерій, ураженні судини єдиної нирки, атрофії контралеральної нирки, ШКФ <30 мл/хв/м2 .
Застосування статинів у максимальних/максимально переносимих дозах до досягнення цільових рівнів ХС ЛПНЩ <1,8 ммоль/л (70 мг/дл) — для пацієнтів високого ризику, чи ХС ЛПНЩ <1,4 ммоль/л (55 мг/дл) — для пацієнтів дуже високого ризику, або ≥50% від початкового рівня для обох груп пацієнтів; відмова від паління; контроль глікемії; ацетилсаліцилова кислота 75–100 мг/добу після досягнення цільового рівня АТ.
Реваскуляризація є резервним методом лікування у таких випадках:
- рецидивуюча гостра серцева недостатність та набряк легень;
- рецидивуюча нестабільна стенокардія;
- прогресуюче зниження функції нирок;
- недостатня ефективність медикаментозної антигіпертензивної терапії або її непереносимість.
Фібромускулярна дисплазія. При безсимптомному перебігу та відсутності АГ стан вважається доброякісним, специфічне лікування не проводиться. Рекомендовано інструментальний контроль у динаміці в ділянці судинного ураження. Для зниження ризику тромбозів у таких пацієнтів може застосовуватися антитромбоцитарна терапія (ацетилсаліцилова кислота 75–100 мг/добу). За наявності АГ слід використовувати інгібітори АПФ або сартани, за необхідності в комбінації з антагоністами кальцію та/або діуретиками (тіазидними/тіазидподібними), при ШКФ <30 мл/хв/м2 — призначення петльових діуретиків з регулярною оцінкою функції нирок (рівень креатиніну крові та ШКФ (за CKD-EPI)).
Блокатори ренін-ангіотензинової системи протипоказані при:
- білатеральному ураженні ниркових артерій;
- ураженні судини єдиної нирки;
- атрофії контралеральної нирки;
- ШКФ <30 мл/хв/м2.
За відсутності ефекту від терапії АГ та при зниженні функції нирок або розвитку інших ускладнень рекомендована черезшкірна балонна ангіопластика, частіше без стентування ниркових артерій, однак за наявності уражень може бути використане стентування.
Аденома наднирникових залоз. При однобічному процесі (альдостеронпродукуюча аденома або однобічна гіперплазія) показана лапароскопічна адреналектомія. У післяопераційний період визначається рівень альдостерону та активного реніну в крові. Відміняється прийом препаратів калію, спіронолактону, знижуються дози антигіпертензивних засобів (під контролем АТ). Зниження АТ відбувається протягом 1–12 міс після операції.
При білатеральному ураженні або відмові пацієнта від оперативного втручання — лікування антагоністами мінералокортикоїдних рецепторів. Препаратом вибору є спіронолактон. Початкова доза — 25 мг/добу. Максимальною вважається доза 200 мг/добу. Якщо розвиваються ускладнення, пацієнта переводять на еплеренон у початковій дозі 25 мг. Блокатори ренін-ангіотензинової системи та блокатори кальцієвих каналів знижують АТ, але не впливають на гіперпродукцію альдостерону.
При сімейному гіперальдостеронізмі рекомендується з метою пригнічення секреції АКТГ (адренокортикотропного гормону) призначати глюкокортикоїди (дексаметазон 0,125–0,25 мг/добу або преднізолон — 2,5–5 мг/добу) перед сном у найнижчій ефективній дозі під контролем рівня калію в крові та АТ. У частини хворих додатково необхідне призначення спіронолактону.
Феохромоцитома. Лікування — хірургічне. Рекомендована лапароскопічна техніка. У випадку двобічного ураження при спадкових формах можливе виконання субтотальної адреналектомії. Лікування в період до оперативного втручання — препаратом вибору є блокатори альфа-адренорецепторів (доксазозин) для пригнічення ефектів циркулюючих катехоламінів протягом 3–4 тиж і більше. Також рекомендовані блокатори кальцієвих каналів тривалої дії.
Синдром Кушинга. Лікування — трансфеноїдальна аденомектомія — основний метод лікування. При тотальній і двобічній адреналектомії необхідна пожиттєва замісна терапія глюкокортикостероїдами. Однобічна адреналектомія показана при пухлині наднирникової залози (глюкостерома, карцинома) а також при АКТГ-незалежній макронодулярній гіперплазії надниркових залоз, первинній пігментній мікронодулярній хворобі надниркових залоз.
Тиреотоксикоз. Мета лікування — стійка нормалізація рівня тиреоїдних гормонів. Лікування АГ базується на застосуванні блокаторів бета-адренорецепторів, краще неселективних, бо вони можуть впливати на синтез тироксину та трийодтироніну. Також можна застосовувати недигідропіридинові антагоністи кальцію, діуретики та інгібітори АПФ або сартани.
Гіпотиреоз. Лікування — пожиттєва замісна терапія препаратами тиреоїдних гормонів. Мета терапії — підтримання рівня ТТГ у межах цільових значень 0,4–4,0 мкОд/мл. АГ терапія — інгібітори АПФ або сартани, дигідропіридинові антагоністи кальцію, діуретики; блокатори альфа-адренорецепторів (за необхідності).
Гіперпаратиреоз. Хірургічне лікування — видалення аденоми паращитоподібної залози або субтотальна паратиреоїдектомія при спадковій гіперплазії паращитоподібної залози. Медикаментозне лікування АГ проводиться за загальноприйнятими правилами. Переваги надають діуретикам, особливо петльовим.
Коарктація аорти. Медикаментозне лікування у пацієнтів з коарктацією аорти неефективне. Це абсолютне показання для хірургічного втручання. Після хірургічної корекції АТ знижується протягом кількох років. Препаратами вибору для лікування АГ після операції є інгібітори АПФ/сартани, антагоністи кальцію, блокатори бета-адренорецепторів.
Уніфікований клінічний протокол первинної, екстреної та вторинної (спеціалізованої) медичної допомоги. Артеріальна гіпертензія
(Ю.М. Сіренко, Л.А. Міщенко, Г.Д. Радченко, О.Г. Купчинська, О.Л. Рековець, С.М.Кушнір)
Затверджено наказом Міністерства охорони здоров’я від 24 травня 2012 р. № 384.
Діагноз — АГ.
Код МКХ-10: I10–I15.
Мета — впровадження медико-організаційних та лікувально-діагностичних підходів, які відповідають положенням доказової медицини, у процесі надання медичної допомоги пацієнтам з АГ в Україні.
Епідеміологічна інформація. За офіційними даними Центру медичної статистики МОЗ України, станом на 01.01.2015 р. в Україні зареєстровано 10 450 502 хворих на АГ, що становить 29,8% дорослого населення країни.
Для закладів, що надають первинну медичну допомогу
Організація надання медичної допомоги
Первинна медична допомога надається лікарями загальної практики — сімейними лікарями та дільничними лікарями-терапевтами в амбулаторіях, амбулаторіях загальної практики — сімейної медицини, сільських лікарських амбулаторіях, фельдшерських пунктах, фельдшерсько-акушерських пунктах (номенклатура згідно з наказом МОЗ України від 28.10.2002 р. № 385); у центрах первинної медико-санітарної допомоги, амбулаторіях загальної практики — сімейної медицини, фельдшерсько-акушерських пунктах, фельдшерських пунктах в амбулаторних умовах (на прийомі у лікаря, у денному стаціонарі) або за місцем проживання (перебування) пацієнта (номенклатура згідно з наказом МОЗ України від 05.10.2011 р. № 646).
Первинна профілактика
Первинна профілактика АГ розглядається з позиції загальної профілактики серцево-судинних захворювань і полягає у виявленні й корекції доведених факторів ризику: тютюно-паління, гіперхолестеринемії, надмірної маси тіла, недостатньої фізичної активності, зловживання алкоголем.
Необхідні дії лікаря
Обов’язково всім пацієнтам на прийомі:
- вимірювання АТ;
- виявлення факторів ризику, оцінка загального серцево-судинного ризику;
- надання рекомендацій щодо дотримання здорового способу життя.
Діагностика
Клінічне, лабораторне та інструментальне обстеження пацієнтів з АГ проводиться з метою виявлення підвищеного АТ, ідентифікації можливих причин високого АТ (виявлення вторинної АГ); стратифікації ризику розвитку серцево-судинних ускладнень: оцінка ступеня АГ; виявлення факторів ризику, супутньої патології, що негативно впливає на перебіг АГ (ІХС, цукровий діабет, ХХН); виявлення ураження органів-мішеней; визначення стадії АГ; виявлення ускладнень АГ.
Необхідні дії лікаря щодо діагностики АГ
Обов’язкові
Вимірювання АТ при кожному зверненні до лікаря у стандартних умовах мінімум 2 рази упродовж прийому. При першому зверненні АТ вимірюють на обох руках. При виявленні різниці в рівні АТ на руках для подальших вимірювань використовують руку з більш високим АТ.
Проведення лікарського огляду всім пацієнтам: фізикальне обстеження; оцінка неврологічного статусу; офтальмоскопія очного дна пацієнтам із САТ >160 мм рт. ст. та пацієнтам з офтальмологічною та неврологічною симптоматикою.
Лабораторні обстеження: загальний аналіз крові, сечі, визначення рівня глікемії, рівня загального ХС, креатиніну з обчисленням ШКФ за формулою CKD-EPI* або за формулою Кокрофта — Голта — проводити всім пацієнтам при первинному зверненні. За неможливості виконання досліджень у закладах первинної медичної допомоги слід направити пацієнта до закладу, який надає вторинну медичну допомогу.
Реєстрація ЕКГ у 12 відведеннях.
Визначення факторів ризику та попередня оцінка загального серцево-судинного ризику.
При вторинній АГ, резистентній АГ, АГ у пацієнтів молодого віку (до 40 років), у період вагітності з АГ — направлення для проведення обстеження до закладів, які надають вторинну медичну допомогу.
Бажані
Лабораторні обстеження: визначення АлАТ; ТГ; ТТГ, сечової кислоти, мікроальбумінурії.
Інструментальні обстеження: проведення УЗД серця (ехоКГ, допплер-КГ); УЗД екстра-краніальних судин шиї; УЗД нирок.
*Електронний калькулятор для розрахунку ШКФ за формулою CKD-EPI на сайті www.kidney.org/professionals/kdoqi/gfr_calculator (або використовувати відповідну програму для смартфона).
Лікування
Мета лікування пацієнта з АГ — досягнення максимального зниження сумарного ризику розвитку серцево-судинних ускладнень за рахунок досягнення та підтримання для всіх категорій хворих на АГ єдиного цільового рівня АТ при офісному вимірюванні <140/90 мм рт. ст. (із акцентуванням уваги на жорсткій необхідності його досягнення). За умови, якщо на фоні антигіпертензивної терапії досягнутий більш низький рівень АТ (<130/80 мм рт. ст.), а терапія добре переноситься, немає жодних побічних ефектів з боку самопочуття хворого або якості життя, схему лікування не варто коригувати; модифікація факторів ризику, ефективне лікування супутніх клінічних станів. У табл. 41 наведені рекомендації щодо початку лікування залежно від початкового рівня офісного АТ.
Таблиця 41. Початок антигіпертензивної терапії (зміни способу життя та медикаментозна терапія) при різних рівнях початкового офісного АТ
|
Високий нормальний АТ 130–139/85–89 мм рт. ст. |
Ступінь 1-й АГ 140–159/90–99 мм рт. ст. |
Ступінь 2-й АГ 160–179/100–110 мм рт. ст. |
Ступінь 3-й АГ ≥180/110 мм рт. ст. |
|
Рекомендації щодо |
Рекомендації щодо |
Рекомендації щодо |
Рекомендації щодо |
|
Розглядати медикаментозне лікування у хворих дуже високого ризику за наявності серцево-судинного захворювання, |
Негайне призначення медикаментозного лікування хворим високого і дуже високого ризику, пацієнтам із серцево-судинними захворюваннями, ХХН або ураженням органів-мішеней |
Негайне призначення медикаментозного лікування усім хворим |
Негайне призначення медикаментозного лікування усім хворим |
|
Призначення медикаментозного лікування хворим низького/помірного ризику, без серцево-судинних захворювань, ХХН або ураження органів-мішеней після 3–6 міс запровадження змін способу життя і відсутності контролю АТ |
Мета — контроль АТ протягом 3 міс |
Мета — контроль АТ протягом 3 міс |
Коментарів щодо початку немедикаментозного і медикаментозного лікування небагато. Важливо, що розглядається необхідність лікування і за наявності показань при високому нормальному рівні АТ. Встановлюються більш чіткі межі для оцінки ефективності немедикаментозної терапії у пацієнтів низького та помірного ризику — 3–6 міс. Визначено мету для досягнення контролю АТ у часі — 3 міс.
Немедикаментозні методи лікування
Необхідні дії лікаря
Обов’язкові
Усім пацієнтам з АГ слід проводити корекцію наявних факторів ризику і модифікацію стилю життя згідно з рекомендаціями щодо профілактики, наведеними вище.
Рекомендувати дотримання дієти з обмеженням споживання кухонної солі, солодощів, насичених жирів та збільшенням вживання фруктів/овочів.
Заохочувати пацієнтів до самоконтролю АТ та інших факторів ризику, постійно підтримувати стратегію поведінки, спрямовану на підвищення прихильності до виконання рекомендацій лікаря.
Медикаментозні методи лікування
Тактика призначення пацієнту медикаментозної терапії залежить від рівня загального серцево-судинного ризику та рівня САТ і ДАТ.
Необхідні дії лікаря
Обов’язкові
Для лікування АГ застосовують антигіпертензивні препарати з доведеною ефективністю щодо зниження ризику розвитку серцево-судинних ускладнень. Препарати І ряду: (тіазидні або тіазидоподібні діуретики, інгібітори АПФ, БРА, антагоністи кальцію, блокатори бета-адренорецепторів) та їх комбінації. NB! Не поєднувати інгібітори АПФ та БРА або прямі блокатори реніну разом. Перевага для початку терапії надається дво- та трикомпонентній антигіпертензивній терапії, у першу чергу у вигляді фіксованих комбінацій. У разі неможливості нормалізації АТ за допомогою препаратів І ряду додатково призначають антагоністи альдостерону. Якщо й надалі немає досягнення цільового рівня АТ, то призначають інші препарати ІІ ряду (блокатори альфа-адренорецепторів, препарати центральної дії, агоністи імідазолінових рецепторів, прямі блокатори реніну (але їх не поєднують разом з інгібіторами АПФ або БРА), прямі вазодилататори, алкалоїди раувольфії). До досягнення цільового АТ при призначенні антигіпертензивної терапії планові візити пацієнта до лікаря з метою оцінки переносимості, ефективності й безпеки лікування, а також контролю виконання пацієнтом отриманих рекомендацій проводяться 1 раз на місяць. Після досягнення цільового рівня АТ з урахуванням його стійкого утримання — повторний огляд лікаря 1 раз на 3–6 міс.
Усім пацієнтам групи високого/дуже високого ризику обов’язково додатково призначати (за відсутності протипоказань) медикаментозну корекцію дисліпідемії — статини у стандартних дозах.
Пацієнтам із встановленим діагнозом серцево-судинного захворювання за відсутності протипоказань після досягнення ефективного контролю АТ (рівень АТ <140/90 мм рт. ст.) додатково призначається ацетилсаліцилова кислота в дозі 75–100 мг.
Медикаментозне лікування супутніх захворювань (ІХС, цукровий діабет та ін.) проводиться відповідно до чинних медико-технологічних документів.
При недосягненні цільового АТ слід:
- упевнитися, що пацієнт виконує рекомендації щодо прийому препаратів;
- провести корекцію терапії.
При неефективності медикаментозної терапії (за умови призначення препаратів в адекватних дозах) — направлення до закладів охорони здоров’я, які надають вторинну медичну допомогу.
Лікування неускладнених гіпертензивних кризів проводиться в амбулаторних умовах у разі можливості моніторингу стану пацієнта. При неможливості моніторингу та/або розвитку ускладненого гіпертонічного кризу пацієнт якнайшвидше направляється до закладів, що надають вторинну стаціонарну медичну допомогу.
Бажані дії: у разі неефективності медикаментозної терапії виконувати амбулаторний моніторинг АТ або моніторинг АТ у домашніх умовах.
Характеристики очікуваних кінцевих результатів лікування
Стійке зниження АТ до цільового. Зменшення вираженості скарг хворого з боку серцево-судинної системи. Корекція факторів серцево-судинної системи. Корекція факторів серцево-судинного ризику.
Тривалість лікування
Амбулаторне лікування проводиться безперервно протягом життя.
Критерії якості лікування
Стабілізація АТ у межах цільового. Відсутність ускладнень гіпертонічної хвороби.
Диспансерний нагляд
Диспансерний нагляд проводиться за всіма пацієнтами з АГ для профілактики розвитку ускладнень (обов’язково при низькому та середньому ризику серцево-судинних ускладнень та у випадку неможливості забезпечення проведення диспансерного нагляду за пацієнтами групи високого/дуже високого ризику у закладах, які надають вторинну амбулаторну медичну допомогу за умови забезпечення лікаря закладу, який надає первинну медичну допомогу, від-повідними рекомендаціями). Досягнення і підтримка цільового рівня АТ потребує тривалого лікарського спостереження з регулярним контролем виконання пацієнтом рекомендацій щодо зміни способу життя і дотримання режиму прийому призначених антигіпертензивних засобів, а також корекції терапії, залежно від ефективності, безпеки і переносимості лікування. Важливе значення мають корекція та моніторинг інших факторів ризику та супутніх клінічних станів: гіперхолестеринемії, цукрового діабету тощо.
Освітні заходи щодо способу життя
Рекомендованим є широке залучення пацієнтів з АГ до школи здоров’я, програм спеціалізованого медсестринського патронату. За наявності шкідливих звичок — відмова від тютюнопаління, обмеження вживання алкоголю.
Реабілітаційні заходи
Відмова від праці в нічний час, нормалізація сну, режиму праці й відпочинку. Рекомендована оптимізація фізичної активності. Не рекомендуються перебування під прямими сонячними променями, переохолодження й перегрівання.
Для закладів, що надають вторинну амбулаторну медичну допомогу
Організація надання медичної допомоги
Вторинна медична допомога на амбулаторному рівні надається лікарями-спеціалістами в діагностичних центрах, поліклініках (центральна міська, міська, центральна районна) (номенклатура згідно з наказом МОЗ України від 28.10.2002 р. № 385); у центрах з медичних консультацій та діагностики (консультативно-діагностичних центрах), спеціалізованих медичних центрах (номенклатура згідно з наказом МОЗ України від 05.10.2011 р. № 646).
Профілактика
У закладах, які надають вторинну медичну допомогу, проводяться заходи вторинної профілактики, які спрямовані на уповільнення прогресування ураження органів-мішеней та запобігання розвитку ускладнень АГ. Як і заходи первинної профілактики, вони полягають у досягненні цільового рівня АТ та корекції доведених факторів ризику (див. вище).
Діагностика
Діагностичні заходи, що проводяться у закладах, які надають вторинну медичну допомогу, спрямовані на уточнення діагнозу, діагностику вторинної АГ, виявлення причин резистентної АГ та/або злоякісного перебігу АГ, виявлення супутньої патології, що негативно впливає на перебіг АГ, серцево-судинних ускладнень, стратифікацію ризику з використанням методик та обстежень, що не можуть бути проведені в закладах первинної медичної допомоги. Для пацієнтів, які вперше направлені до закладів, які надають вторинну медичну допомогу, термін обстеження не повинен перевищувати 30 днів.
Необхідні дії лікаря
Обов’язкові
Оцінка результатів діагностичних заходів, проведених у закладах первинної медичної допомоги.
Збір анамнезу, лікарський огляд та обстеження, спрямовані на виявлення ознак вторинної АГ, уточнення ступеня ураження органів-мішеней, наявності супутніх захворювань і факторів ризику.
Фізикальне обстеження з обов’язковим вимірюванням АТ на обох руках, на ногах та визначенням гомілково-плечового індексу, з оцінкою неврологічного статусу.
Консультація спеціалістів проводиться відповідно до переважання проявів ускладнень АГ, наявних факторів ризику та супутніх захворювань.
Обсяг додаткових обстежень визначається спеціалістом, що проводить консультування пацієнта з АГ.
До переліку обстежень входять:
Обов’язкові лабораторні обстеження: загальний аналіз крові, сечі, доповнений визначенням мікроальбумінурії (за добу); рівень глікемії, калію, натрію, сечової кислоти, АлАТ, АсАТ, білірубіну; рівень креатиніну з розрахунком ШКФ за формулою CKD-EPI* або Кокрофта — Голта.
За наявності показань: аналіз сечі методом Нечипоренка (або Аддіса — Каковського, або Амбурже); коагулограма (МНВ, фібриноген, тромбіновий час); визначення катехоламінів (метанефринів) у сечі; глікемічний профіль, визначення рівня глікозильованого гемоглобіну, ТТГ (при змінах ТТГ — рівня трийодтироніну та тироксину), реніну, альдостерону, ренін-альдостеронового співвідношення, кортизолу (у крові та добовій сечі), паратгормону, соматотропного гормону.
Обов’язкові інструментальні обстеження: реєстрація ЕКГ в 12 відведеннях; УЗД серця (ехоКГ, допплер-КГ); УЗД нирок; офтальмоскопія; гомілково-плечовий індекс АТ; домашнє або амбулаторне добове моніторування АТ; УЗД екстракраніальних судин шиї, у тому числі допплерографія сонних артерій; допплерографія ниркових артерій.
За наявності показань: КТ, МРТ головного мозку, обстеження черевної порожнини (при показаннях — із контрастним підсиленням).
Бажані: повний ліпідний профіль (загальний ХС, ТГ, ХС ЛПВЩ, ХС ЛПНЩ, ХС ЛПДНЩ); полісомнографія; за наявності показань — радіоізотопна ренографія/реносцинтиграфія; консультація невролога; визначення швидкості розповсюдження пульсової хвилі.
*Електронний калькулятор для розрахунку ШКФ за формулою CKD-EPI на сайті www.kidney.org/professionals/kdoqi/gfr_calculator (або використовувати відповідну програму для смартфона).
Лікування
Проводиться корекція терапії пацієнтам, у яких не вдалося досягти цільового АТ та корекції факторів ризику в закладах, які надають первинну медичну допомогу. При виявленні причини АГ (вторинної АГ) проводиться етіотропна та патогенетична терапія. Призначається планова терапія вагітним з АГ.
Немедикаментозні методи лікування
Необхідні дії лікаря
Обов’язкові: рекомендації щодо заходів корекції факторів ризику надаються лікарями-спеціалістами відповідно до вказаних вище.
Медикаментозні методи лікування
Тактика призначення медикаментозної терапії залежить від рівня загального серцево-судинного ризику, рівня САТ та ДАТ, наявності серцево-судинних ускладнень та супутньої патології.
Необхідні дії лікаря
Обов’язкові
Для лікування АГ використовуються антигіпертензивні препарати І ряду з доведеною ефективністю щодо зниження ризику розвитку серцево-судинних ускладнень (тіазидні або тіазидоподібні діуретики, інгібітори АПФ, БРА, антагоністи кальцію, блокатори бета-адренорецепторів) та їх комбінації. NB! Не поєднувати інгібітори АПФ та БРА або прямі блокатори реніну разом. Перевага надається дво- та трикомпонентній антигіпертензивній терапії, у першу чергу у вигляді фіксованих комбінацій. У разі неможливості нормалізації АТ за допомогою препаратів І ряду додатково призначають антагоністи альдостерону. Якщо й надалі немає досягнення цільового рівня АТ, то призначають інші препарати ІІ ряду (блокатори альфа-адренорецепторів, препарати центральної дії, агоністи імідазолінових рецепторів, прямі блокатори реніну (але їх не поєднують разом з інгібіторами АПФ або БРА), прямі вазодилататори, алкалоїди раувольфії). Регулярне лікарське спостереження проводиться до досягнення цільового рівня АТ — з інтервалом 1 раз на місяць. Після досягнення цільового рівня АТ з урахуванням його стійкого утримання — повторний огляд лікаря 1 раз на 3–6 міс.
За відсутності протипоказань після уточнення діагнозу та ступеня ризику пацієнтам високого та дуже високого ризику призначається медикаментозна корекція дисліпідемії — статини у стандартних дозах, пацієнтам з діагнозом серцево-судинного захворювання або ХХН призначається ацетилсаліцилова кислота.
Медикаментозне лікування супутніх захворювань здійснюється відповідно до чинних медико-технологічних документів.
У разі недосягнення цільового АТ: упевнитися, що пацієнт виконує рекомендації щодо прийому препаратів; провести домашній моніторинг АТ; провести корекцію терапії.
При неефективності медикаментозної терапії направити на консультацію до відповідного спеціалізованого центру (відділення).
Лікування неускладнених гіпертензивних кризів проводиться в амбулаторних умовах за можливості моніторингу стану пацієнта. У разі неможливості моніторингу, розвитку ускладненого гіпертонічного кризу пацієнт якнайшвидше направляється до закладів, що надають вторинну стаціонарну медичну допомогу.
Бажані: у разі неефективності медикаментозної терапії, а також при підозрі на епізоди гіпотензії — амбулаторне добове моніторування АТ.
Диспансерний нагляд
Проводиться всім пацієнтам з ускладненим перебігом АГ для забезпечення профілактики ускладнень. Проведення спостереження пацієнтів потребує забезпечення наступності ведення пацієнта лікарями закладів, які надають первинну і вторинну медичну допомогу.
Регулярне лікарське спостереження проводиться до досягнення цільового рівня АТ — з інтервалом 1 раз на місяць, після досягнення — 1 раз на 6–12 міс. Пацієнтам з високим і дуже високим ризиком, тим, кому призначено лише немедикаментозне лікування, особам з низькою прихильністю до лікування доцільно проводити спостереження з частотою не менше ніж 1 раз на 3 міс. При диспансерному спостереженні проводяться: моніторинг рівня АТ та факторів ризику; контроль виконання рекомендацій лікаря, підтримка мотивації та корекція рекомендацій і призначень; лабораторні дослідження (загальний аналіз крові та сечі) та реєстрацію ЕКГ доцільно проводити 1 раз на рік за умови відсутності показань. За наявності показань проводяться додаткові обстеження, обсяг та частоту яких визначає лікар-спеціаліст. Бажано проводити моніторинг рівня загального ХС, глюкози та креатиніну в крові.
Для закладів, що надають вторинну стаціонарну допомогу
Організація надання медичної допомоги
Вторинна медична допомога на стаціонарному рівні надається лікарями-спеціалістами у дільничних лікарнях, лікарнях (республіканська, обласна, центральна міська, міська, центральна районна, районна) (номенклатура згідно з наказом МОЗ України від 28.10.2002 р. № 385); у багатопрофільних лікарнях (клінічних лікарнях) інтенсивного лікування, лікарнях відновного (реабілітаційного) лікування, лікарнях (клінічних лікарнях) планового лікування, спеціалізованих центрах (номенклатура згідно з наказом МОЗ України від 05.10.2011 р. № 646).
Догоспітальний етап
Надання екстреної медичної допомоги на догоспітальному етапі здійснюється службою швидкої медичної допомоги, бригадами пунктів невідкладної медичної допомоги для дорослого та дитячого населення (відповідно до наказу МОЗ України від 29.08.2008 р. № 500 «Заходи щодо удосконалення надання екстреної медичної допомоги населенню в Україні»), відділеннями не-відкладної (екстреної) медичної допомоги лікарень (номенклатура відповідно до наказу МОЗ України від 01.06.2009 р. № 370 «Про єдину систему надання екстреної медичної допомоги»).
Показання до госпіталізації
Ускладнений гіпертонічний криз — екстрена госпіталізація з урахуванням ускладнення, яке розвинулося, транспортування пацієнта в профільний стаціонар.
Неускладнений гіпертонічний криз при неможливості моніторингу стану пацієнта у закладах, які надають первинну медичну допомогу, — госпіталізація у профільний стаціонар.
Вагітність з еклампсією/прееклампсією — у профільний стаціонар.
Госпіталізація
Мета госпіталізації пацієнта за екстреними (невідкладними) показаннями: стабілізація стану; запобігання розвитку ускладнень; досягнення стабільного зниження АТ до безпечного рівня.
Після досягнення стабілізації стану пацієнта, а також при плановій госпіталізації проводяться: а) обстеження з метою уточнення діагнозу, визначення ступеня ураження органів-мішеней, виявлення серцево-судинних ускладнень; б) призначення адекватної терапії/корекція планової терапії; в) заходи реабілітації.
Госпіталізація у плановому порядку проводиться до профільного відділення закладу, який надає вторинну медичну допомогу:
При загостренні супутніх хронічних захворювань, станів, що ускладнюють перебіг АГ.
При необхідності проведення обстеження, яке неможливо забезпечити в амбулаторно-поліклінічних умовах.
Для призначення адекватної терапії та/або корекції терапії при неможливості здійснення в амбулаторно-поліклінічних умовах (тяжкий стан пацієнта, наявність комплексної патології тощо).
Для проведення комплексного лікування, у тому числі оперативних втручань з використанням сучасних високоефективних технологій.
Для проведення заходів реабілітації пацієнтам з ускладненим перебігом АГ.
Для надання комплексної медичної допомоги пацієнтам з резистентною АГ. Максимальний термін очікування на планову госпіталізацію не має перевищувати 2 міс з моменту направлення.
Діагностика
Заходи діагностики у пацієнтів, госпіталізованих за екстреними (невідкладними) показаннями, проводяться одночасно із заходами інтенсивної терапії.
Заходи діагностики проводяться з метою визначення можливих причин підвищення АТ (у тому числі вторинної АГ); стратифікації ризику серцево-судинних ускладнень та смерті: оцінка ступеня АГ; виявлення факторів ризику; виявлення супутньої патології, що негативно впливає на перебіг АГ (ІХС, СН, цукровий діабет, ХХН); виявлення ураження органів-мішеней; виявлення серцево-судинних та інших ускладнень АГ.
Необхідні дії лікаря
Обов’язкові
Збір анамнезу, фізикальний огляд та обстеження, спрямовані на виявлення ознак вторинної АГ, уточнення ступеня ураження органів-мішеней, наявності супутніх захворювань і факторів ризику.
При фізикальному обстеженні проводяться вимірювання АТ на обох руках, вимірювання АТ на ногах та визначення гомілково-плечового індексу, аускультація серця, легень, аорти, судин шиї, проекції ниркових артерій, пальпація органів черевної порожнини, оцінка неврологічного статусу.
Консультація профільних спеціалістів проводиться відповідно до проявів ускладнень АГ, наявних факторів ризику та супутніх захворювань.
Обсяг додаткових обстежень визначається профільним спеціалістом, що проводить консультування пацієнта з АГ.
Лабораторні обстеження
Обов’язкові: загальний аналіз крові та сечі, визначення мікроальбумінурії (за добу); рівень глікемії, калію, натрію, сечової кислоти, АлАТ, АсАТ, білірубіну; рівень креатиніну за розрахунком ШКФ за формулою CKD-EPI* або (при неможливості) за формулою Кокрофта — Голта;
За наявності показань: аналіз сечі методом Нечипоренка (або Аддіса — Каковського, або Амбурже); коагулограма (МНВ, фібриноген, тромбіновий час); визначення катехоламінів (метанефринів) у сечі; глікемічний профіль, визначення рівня глікозильованого гемоглобіну; ТТГ (при його змінах — трийодтироніну та тироксину), реніну, альдостерону, ренін-альдостеронового співвідношення, кортизолу (в крові та добовій сечі), паратгормону, соматотропного гормону.
Інструментальні обстеження
Обов’язкові: реєстрація ЕКГ у 12 відведеннях; УЗД серця (ехоКГ, допплер-КГ); УЗД нирок; офтальмоскопія; визначення гомілково-плечового індексу АТ; домашнє або амбулаторне добове моніторування АТ; УЗД екстракраніальних судин шиї, у тому числі допплерографія сон них артерій; допплерографія ниркових артерій.
За наявності показань: КТ, МРТ головного мозку, обстеження черевної порожнини (при показаннях із контрастним підсиленням), ангіографія.
Бажані: повний ліпідний профіль (загальний ХС, ТГ, ХС ЛПВЩ, ХС ЛПНЩ, ХС ЛПДНЩ); полісомнографія; радіоізотопна ренографія/реносцинтиграфія при показаннях; консультація невролога; визначення швидкості розповсюдження пульсової хвилі.
*Електронний калькулятор для розрахунку ШКФ за формулою CKD-EPI на сайті www.kidney.org/professionals/kdoqi/gfr_calculator (або використовувати відповідну програму для смартфона).
Лікування
Мета лікування пацієнта з АГ у закладах, які надають вторинну стаціонарну медичну допомогу: стабілізація стану при госпіталізації за невідкладними показаннями, а також — досягнення максимального зниження сумарного ризику розвитку серцево-судинних ускладнень за рахунок досягнення та підтримання у всіх категорій хворих на АГ єдиного цільового рівня АТ при офісному вимірюванні <140/90 мм рт. ст. (із акцентом уваги на жорсткій необхідності його досягнення). За умови, якщо на фоні антигіпертензивної терапії досягнуто більш низького рівня АТ (<130/80 мм рт. ст.), а терапія добре переноситься, немає жодних побічних ефектів з боку самопочуття хворого або якості життя, схему лікування не варто коригувати.
Немедикаментозні методи лікування
Необхідні дії лікаря
Обов’язкові: заходи немедикаментозної корекції проводяться лікарем стаціонару з урахуванням консультацій профільних спеціалістів відповідно до зазначених вище.
Медикаментозні методи лікування
Необхідні дії лікаря
Обов’язкові: лікування ускладнених та неускладнених гіпертонічних кризів проводиться відповідно до алгоритму. Для подальшого лікування пацієнтів з АГ після дообстеження та стабілізації стану використовуються антигіпертензивні препарати І ряду з доведеною ефективністю щодо зниження ризику розвитку серцево-судинних ускладнень (діуретики, інгібітори АПФ, антагоністи кальцію (блокатори кальцієвих каналів), блокатори бета-адренорецепторів, БРА) та їх комбінації. NB! Не поєднувати інгібітори АПФ та БРА або прямі блокатори реніну разом. У закладах, які надають вторинну медичну допомогу, частіше призначається дво- та трикомпонентна антигіпертензивна терапія, у першу чергу у вигляді фіксованих комбінацій. У разі неможливості нормалізації АТ за допомогою препаратів І ряду додатково призначають антагоністи альдостерону. Якщо й надалі немає досягнення цільового рівня АТ, то призначають інші препарати ІІ ряду (блокатори альфа-адренорецепторів, препарати центральної дії, агоністи імідазолінових рецепторів, прямі блокатори реніну (але їх не поєднують разом з інгібіторами АПФ або БРА), прямі вазодилататори, алкалоїди раувольфії). Усім пацієнтам групи високого/дуже високого ризику обов’язково додатково призначати (за відсутності протипоказань):
- медикаментозну корекцію дисліпідемії — статини у стандартних дозах;
- пацієнтам з діагнозом серцево-судинного захворювання або ХХН за відсутності протипоказань додатково призначається ацетилсаліцилова кислота.
Лікування супутніх хронічних захворювань та станів, що ускладнюють перебіг АГ (ІХС, СН, цукровий діабет та ін.) проводиться відповідно до чинних медико-технологічних документів.
Бажані: для визначення ефективності антигіпертензивної терапії проводити добовий моніторинг АТ.
Хірургічне лікування
Хірургічне лікування вторинних АГ приводить у частини пацієнтів до повного одужання, у інших — до зменшення тяжкості перебігу захворювання, зниження частоти ускладнень та скорочення кількості антигіпертензивних препаратів, необхідних для контролю досягнення цільового АТ.
За наявності показань до хірургічного лікування пацієнт направляється на консультацію до відповідного спеціаліста.
Оперативні втручання за показаннями проводяться після консультативного висновку спеціаліста.
За наявності показань до хірургічного лікування вторинних АГ пацієнта слід направити:
- при вторинних ендокринних АГ — до спеціаліста з ендокринної хірургії;
- при реноваскулярних вторинних АГ — до спеціаліста з інтервенційної кардіології або радіології або серцево-судинного хірурга;
- за наявності показань до хірургічного лікування за іншими спеціальностями (серцево-судинна хірургія, нейрохірургія, урологія та ін.) — до фахівця відповідного профілю.
На сьогодні лікування резистентної АГ за допомогою радіочастотної абляції не рекомендоване для широкого загалу пацієнтів у клінічній практиці та залишене виключно у вигляді клінічних досліджень у високоспеціалізованих закладах.
Виписка з рекомендаціями на післягоспітальний період
Лікар стаціонару надає пацієнту виписку з історії хвороби із зазначенням діагнозу, результатів проведеного лікування та обстеження, а також — рекомендаціями щодо лікування та диспансерного нагляду у закладах, які надають первинну медичну допомогу. У разі необхідності у виписці зазначають терміни повторної планової госпіталізації.
Реабілітація
Проводиться пацієнтам з ускладненим перебігом АГ, наявністю серцево-судинних захворювань, після оперативного втручання та перенесеного гострого порушення мозкового кровообігу або гострого ІМ.
Перелік фармакологічних препаратів
Перелік лікарських засобів, що показані для лікування АГ, представлені в табл. 42 за міжнародними непатентованими найменуваннями.
Таблиця 42. Перелік препаратів та рекомендації щодо їх застосування згідно з Державним реєстром лікарських засобів МОЗ України
|
№ |
Клас |
Препарат |
Дозування |
|
1 |
Діуретики |
Фуросемід |
Табл. у бліст. по 40 мг; табл. у контр. чарунк. уп. по 40 мг; або р-н д/ін’єкцій в амп. по 2 мл по 10 мг/ мл у пачці, у блістерах та у контр. чарунк. уп. Призначається в дозах, що необхідні для забезпечення адекватного діурезу |
|
2 |
Еплеренон |
Табл., вкриті п/о, у бліст. по 25 мг та 50 мг. Для лікування хворих на АГ рекомендована стартова доза — 50 мг 1 раз на добу; якщо клінічний ефект недостатній, доза може бути підвищена до 100 мг 1 раз на добу; у деяких пацієнтів клінічний ефект може бути досягнутий застосуванням 200 мг 1 раз на добу |
|
|
3 |
Індапамід |
Табл. у бліст. 1,25 мг та 2,5 мг; табл., вкриті п/о, у бліст. 2,5 мг; табл. пролонг. дії по 1,5 мг у бліст.; табл. п/о у бліст. пролонг. дії по 1,5 мг; табл. п/о у бліст. з модифікованим вивільненням по 1,5 мг; капс. у бліст. по 2,5 мг. Призначається дорослим по 1 табл. по 2,5 мг або табл. пролонг. дії по 1,5 мг 1 раз на добу, найкраще вранці |
|
|
4 |
Торасемід |
Табл. у бліст. по 2,5 мг, 5 мг, 10 мг , 20 мг, 50 мг, 100 мг та 200 мг; р-н д/ін’єкцій в амп. по 10 мг/2 мл по 2 мл, 20 мг/4 мл по 4 мл, по 5 мг/ мл по 2 мл, 5 мг/мл по 4 мл, 200 мг/20 мл по 20 мл; р-н д/ін’єкцій у флак. По 5 мг/мл по 4 мл. Pекомендована доза становить 2,5 мг; гіпотензивна дія торасеміду розпочинається поступово в 1-й тиждень. Доза препарату та тривалість лікування встановлюються лікарем індивідуально |
|
|
5 |
Спіронолактон |
Табл. у конт. чарунк. уп. по 25 мг, 50 мг, 100 мг; табл. у бліст. по 25 мг, 50 мг, 100 мг; капс. у бліст. по 50 мг, 100 мг; табл. п/о у бліст. по 25 мг, 50 мг, 100 мг. Призначається лікарем індивідуально |
|
|
6 |
Спіронолактон + фуросемід |
Капс. по 50/20 мг у бліст. Доза препарату та тривалість лікування встановлюються лікарем індивідуально |
|
|
7 |
Гідрохлоротіазид |
Табл. по 25 мг у блістері. Доза препарату та тривалість лікування встановлюються лікарем індивідуально |
|
|
8 |
Гідрохлоротіазид + спіронолактон |
Табл., вкриті п/о, у бліст. по 50/50 мг та 25/25 мг. Доза препарату та тривалість лікування встановлюються лікарем індивідуально |
|
|
9 |
Хлорталідон |
Табл. у бліст. по 25 мг та 50 мг, призначаються в дозах, що необхідні для забезпечення адекватного контролю АТ |
|
|
10 |
Еплеренон |
Табл., вкриті п/о, у бліст. по 25 мг, 50 мг. Доза препарату та тривалість лікування встановлюються лікарем індивідуально |
|
|
11 |
Блокатори бета-адренорецепторів |
Атенолол |
Табл. у бліст. по 50 мг; 100 мг. Табл. п/о у бліст. по 50 мг та 100 мг. Табл. у бліст. по 0,05 г. При АГ призначають у початковій дозі 25–50 мг 1–2 рази на добу; при недостатній вираженості гіпотензивного ефекту протягом 1–2 тиж дозу підвищують до 100 мг/добу; подальше підвищення дози не сприяє суттєвому збільшенню вираженості гіпотензивного ефекту |
|
12 |
Атенолол + хлорталідон |
Табл. п/о у бліст. 50 мг/12,5 мг та 100 мг/25 мг. Табл. п/о у контур. чарунк. уп. по 100/25 мг; табл. п/о у стрипах по 100/25 мг. Режим дозування у перерахуванні на атенолол. Початкова доза становить 25 мг 1 раз на добу. Доза може бути поступово підвищена до 100 мг на добу за 1–2 прийоми. Максимальна добова доза (МДД) — 200 мг за 2 прийоми. Підвищення добової дози >100 мг (атенололу) не призводить до суттєвого збільшення вираженості антигіпертензивного ефекту |
|
|
13 |
Атенолол + хлорталідон + ніфедипін |
Табл. п/о по 100 мг/10 мг/25 мг. Доза препарату та тривалість лікування встановлюються лікарем індивідуально. Середня доза для дорослих становить 1–2 таблетки на добу |
|
|
14 |
Бетаксолол |
Табл., вкриті п/о, у бліст. по 10 мг та 20 мг. Звичайна доза — 1 табл. по 20 мг/добу при АГ та з метою профілактики нападів стенокардії напруження; максимальна рекомендована доза — 40 мг/добу |
|
|
15 |
Бісопролол |
Табл. у бліст. по 2,5 мг, 5 мг та 10 мг; табл., вкриті п/о, по 2,5 мг, 5 мг та 10 мг. Призначають внутрішньо по 5 мг 1 раз на добу; за необхідності дозу препарату можна підвищити до 10 мг 1 раз на добу; максимальна добова доза — 20 мг/добу; у деяких хворих, особливо з бронхолегеневою патологією, початкова доза має становити 2,5 мг 1 раз на добу; лікування не припиняти раптово — курс повинен закінчуватися з поступовим зниженням дози |
|
|
16 |
Бісопролол + гідрохлоротіазид* |
Табл. п/о у бліст. містить: бісопрололу фумарату 5 мг/гідрохлоротіазиду 12,5 мг або бісопрололу фумарату 10 мг/гідрохлоротіазиду 25 мг. Табл. у бліст. по 10 мг/6,25 мг та 5 мг/6,25 мг. Призначається в дозах, що необхідні для забезпечення адекватного контролю АТ |
|
|
17 |
Бісопролол + амлодипін |
Табл. у бліст. містить бісопрололу 5 мг/5 мг амлодипіну або бісопрололу 5 мг/10 мг амлодипіну або бісопрололу 10 мг/5 мг амлодипіну або бісопрололу 10 мг/10 мг амлодипіну. Призначається в дозах, що необхідні для забезпечення адекватного контролю АТ |
|
|
18 |
Бісопролол + периндоприл |
Табл., вкриті п/о, у конт. по 10 мг/10 мг або 5 мг/5 мг або 10 мг/5 мг або 5 мг/10 мг. Призначається в дозах, що необхідні для забезпечення адекватного контролю АТ |
|
|
19 |
Есмолол |
Р-н д/ін’єкцій у фл. по 10 мг/мл по 10 мл. Р-н д/інфузій 10 мг/мл по 50 мл або 250 мл у контейнері. Доза препарату на початку лікування становить (і підтримувальна доза — 500 мкг/кг/хв) 500 мкг/кг/хв протягом 1 хв, потім підтримувальна доза становить 50 мкг/кг/хв протягом 4 хв; при позитивному результаті — підтримувальна доза 50 мкг/кг/хв; при негативному результаті протягом 5 хв — повторити введення із дозуванням 500 мкг/кг/хв протягом 1 хв; підвищити підтримувальну дозу до 100 мкг/кг/хв протягом 4 хв; при позитивному результаті — підтримувальна доза 100 мкг/кг/хв; при негативному результаті протягом 5 хв — повторити введення з дозуванням 500 мкг/кг/хв протягом 1 хв; підвищити підтримувальну дозу до 150 мкг/кг/хв протягом 4 хв; при позитивному результаті: введення підтримувальної дози 150 мкг/кг/хв; при негативному результаті — повторити введення з дозуванням 500 мкг/кг/хв протягом 1 хв; підвищити підтримувальну дозу до 200 мкг/кг/хв і залишити на цьому рівні; при досягненні бажаного ступеня зниження ЧСС або граничного рівня безпеки необхідно припинити введення навантажувальної дози і знизити базовий інтервал дозування при підтримувальному введенні з 50 мкг/кг/хв до 25 мкг/кг/хв або ще нижче; за необхідності інтервал між кроками титрування можна збільшити з 5 до 10 хв; з появою побічних реакцій можна знизити дозу препарату або припинити введення; побічні реакції мають припинитися протягом 30 хв |
|
|
20 |
Карведилол |
Табл. у бліст. по 3,125 мг, 6,25 мг, 12,5 мг та 25 мг; табл., вкриті п/о, у бліст. по 6,25 мг, 12,5 мг та 25 мг, табл., вкриті п/о, у стрип. 6,25 мг, 12,5 мг та 25 мг. Табл. у фл. по 6,25 мг, 12,5 мг та 25 мг. При АГ разова рекомендована доза 25 мг, максимальна добова доза — 50 мг; для дорослих початкова рекомендована доза становить 12,5 мг 1 раз на добу; для пацієнтів літнього віку початкова рекомендована доза при АГ становить 12,5 мг 1 раз на добу |
|
|
21 |
Карведилол + івабрадин |
Табл., вкриті п/о, у бліст. по 12,5 мг/5 мг або 6,25 мг/7,5 мг або 25 мг/5 мг або 25 мг/5 мг або 12,5 мг/7,5 мг. Режим дозування індивідуальний |
|
|
22 |
Метопрололу тартрат |
Р-н д/ін’єкцій в амп. по 1 мг/1 мл по 5 мл; табл. у бліст. 25 мг, 50 мг, 100 мг; табл. у бліст. 0,05 г та 0,1 г, табл. у фл. 25 мг, 50 мг, 100 мг. Табл. п/о з уповільненим вивільненням по 25 мг, 50 мг та 100 мг. При АГ приймають по 1–2 табл. (50–100 мг) одноразово вранці або в 2 прийоми вранці та ввечері |
|
|
23 |
Метопрололу тартрат + івабрадин |
Табл. п/о у бліст. по 50 мг/5 мг та 50 мг/7,5 мг. Режим дозування індивідуальний |
|
|
24 |
Метопрололу сукцинат |
Табл., вкриті п/о, з уповільненим вивільненням у фл. по 50 мг; 100 мг. Табл. п/о з уповільненим вивільненням у бліст. по 25 мг. Рекомендована доза у пацієнтів з АГ легкої або середньої тяжкості становить 25 мг і може бути підвищена до 50–100 мг 1 раз на добу або в комбінації з іншими антигіпертензивними препаратами |
|
|
25 |
Небіволол |
Табл. у бліст. по 5 мг; табл. по 5 мг у конт. чарунк. уп. Для лікування АГ доза становить 5 мг/добу (краще приймати її завжди в один і той самий час); антигіпертензивний ефект виявляється через 1–2 тиж лікування, в окремих випадках оптимальна дія досягається лише через 4 тиж |
|
|
26 |
Небіволол + гідрохлоротіазид |
Табл. у бліст. по 5 мг/12,5 мг. Призначається в 1 табл. на добу. Режим дозування індивідуальний |
|
|
27 |
Пропранолол |
Табл. у бліст. по 10 та 40 мг. Режим дозування індивідуальний; при АГ початкова доза становить 40 мг 2–3 рази на добу, максимальна добова доза — 320 мг; при феохромоцитомі 30–60 мг/добу у 2–3 прийоми протягом 3 днів перед операцією; у неоперабельних випадках — 30 мг/добу |
|
|
28 |
Антагоністи кальцію (блокатори кальцієвих каналів) |
Амлодипін |
Табл. у бліст. по 2,5 мг, 5 мг та 10 мг, табл. у стрипі по 5 мг та 10 мг; табл. у конт. чарунк. уп. по 5 мг та 10 мг; капсули тверді у бліст. по 5 мг та 10 мг. При АГ та стенокардії звичайна початкова доза — 5 мг 1 раз на добу; залежно від індивідуальної реакції хворого дозу можна підвищити до максимальної добової дози, яка становить 10 мг |
|
29 |
Амлодипін + атенолол |
Табл. у бліст. 5 мг/50 мг, призначаються в дозах, що необхідні для забезпечення адекватного контролю АТ та ЧСС |
|
|
30 |
Амлодипін + розувастатин |
Табл. п/о у бліст. по 5 мг/20 мг, 10 мг/20 мг, 5 мг/15 мг, 10 мг/15 мг, 5 мг/10 мг та 10 мг/10 мг. Призначаються в дозах, що необхідні для забезпечення адекватного контролю АТ та рівня ХС у сироватці крові |
|
|
31 |
Амлодипін + аторвастатин |
Табл. в/о у бліст. по 2,5 мг/10 мг; табл., вкриті п/о, у бліст. по 5 мг/10 мг, 10 мг/10 мг, 5 мг/20 мг та 10 мг/20 мг, призначаються в дозах, що необхідні для забезпечення адекватного контролю АТ та ХС сироватки крові |
|
|
32 |
Амлодипін + валсартан |
Табл., вкриті п/о, у бліст. 5 мг/80 мг, 5 мг/160 мг та 10 мг/160 мг, призначаються в дозах, що необхідні для забезпечення адекватного контролю АТ |
|
|
33 |
Амлодипін + лозартан |
Табл. п/о у бліст. по 5 мг/100 мг або 5 мг/50 мг або 10 мг/50 мг або 10 мг/100 мг. Призначаються в дозах, що необхідні для забезпечення адекватного контролю АТ |
|
|
34 |
Амлодипін + індапамід |
Табл. у бліст. з модифікованим вивільненням по 5 мг/1,5 мг та 10 мг/1,5 мг, призначаються в дозах, що необхідні для забезпечення адекватного контролю АТ |
|
|
35 |
Амлодипін + лізиноприл |
Табл. у бліст. по 5 мг/5 мг, 5 мг/10 мг, 20 мг/10 мг, 20 мг/5 мг; табл. у стрипі по 5 мг/5 мг; табл., вкриті п/о, у бліст. по 5 мг/5 мг. Призначаються в дозах, що необхідні для забезпечення адекватного контролю АТ |
|
|
36 |
Амлодипін + периндоприл |
Табл. у бліст. по 5 мг/4 мг, 5 мг/8 мг, 10 мг4 мг та 10 мг/8 мг; табл. у контейнері по 5 мг/5 мг, 5 мг/10 мг, 10 мг/5 мг, 10 мг/10 мг. Призначаються в дозах, що необхідні для забезпечення адекватного контролю АТ |
|
|
37 |
Амлодипін + раміприл |
Капс. тверді у бліст. по 5 мг/10 мг, 10 мг/10 мг, 5 мг/5 мг та 10 мг/5 мг; капс. у бліст. по 2,5 мг/2,5 мг, 10 мг/5 мг, 5 мг/10 мг, 10 мг/10 мг, 5 мг/5 мг. Призначається в дозах, що необхідно для забезпечення адекватного контролю АТ |
|
|
38 |
Верапаміл |
Табл., вкриті п/о, у конт. чарунк. уп. по 40 мг, 80 мг; табл. в/о у бліст. по 40 мг, 80 мг; табл., вкриті п/о, у бліст. по 80 мг, 40 мг; капс. пролонг. дії у бліст. 180 мг; табл. пролонг. дії у бліст. по 80 мг, 240 мг. Р-н д/ін’єкцій в амп. по 2,5 мг/мл по 2 мл. Призначається в дозах, що необхідні для забезпечення адекватного контролю АТ |
|
|
39 |
Дилтіазем |
Табл. у бліст. по 60 мг та 90 мг. Табл. п/о у бліст. пролонг. дії по 90 мг. Табл. у бліст. пролонг. дії по 120 мг. При АГ — середня добова доза для дорослих — 180–240 мг, також застосовуються дози до 480 мг/добу; зазвичай початкова доза становить 60 мг 3–4 рази на добу, доза може бути підвищена відповідно до терапевтичного ефекту до 120 мг 3 рази на добу |
|
|
40 |
Лерканідипін |
Табл., вкриті п/о, у бліст.10 мг та 20 мг. Рекомендована доза для дорослих становить 10 мг 1 раз на добу, доза може бути підвищена до 20 мг; максимальна антигіпертензивна дія розвивається протягом 2 тиж лікування |
|
|
41 |
Лерканідипін + еналаприл |
Табл., вкриті п/о, у бліст. по 10 мг/10 мг та 20 мг/20 мг. Призначаються в дозах, необхідних для контролю АТ |
|
|
42 |
Ніфедипін |
Краплі оральні р-н по 20 мг/мл по 10 мл або 20 мл у фл.; табл. в/о по 10 мг, 20 мг, табл. пролонг. дії у бліст. 10 мг, 20 мг, 40 мг. Табл. з модифікованим вивільненням у бліст. по 20 мг, 40 мг. Табл. у бліст. по 10 мг. Табл. п/о у бліст. по 30 мг, 60 мг. Краплі оральні р-н 2% по 5 мл або 25 мл у фл. Для купірування гіпертензивного кризу препарат вводять в/в крапельно по 50 мл (5 мг) протягом 4–8 год; протягом 24 год доза препарату, який вводиться, не повинна перевищувати 150—300 мл, відповідає добовій дозі 15–30 мг; для лікування АГ рекомендується приймати по 1 табл. 2 рази на добу; залежно від тяжкості захворювання та індивідуальної реакції пацієнта дозу ніфедипіну можна поступово підвищити до 120 мг 1 раз на добу |
|
|
43 |
Фелодипін |
Табл. з модифікованим вивільненням у бліст. по 2,5 мг, 5 мг та 10 мг. При гіпертонічній хворобі та симптоматичній АГ початкова доза становить 5 мг 1 раз на добу, при недостатньому ефекті дозу підвищують до 10–20 мг/добу в 1–2 прийоми; максимальна добова доза не повинна перевищувати 40 мг в 1–2 прийоми |
|
|
44 |
Інгібітори АПФ |
Енаплаприл |
Р-н д/ін’єкцій в амп. по 1 мл по 1,25 мг/мл. Табл. у бліст. 0,01 г, 2,5 мг, 5 мг, 10 мг та 20 мг. Табл. у конт. чарунк. уп. 10 мг. Табл. у стрип. 2,5 мг та 10 мг. Режим дозування індивідуальний |
|
45 |
Еналаприл + індапамід |
Комбі-упаковка: табл. + табл., вкриті п/о, у бліст. 10 мг + 2,5 мг; 20 мг + 2,5 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
46 |
Еналаприл + гідрохлоротіазид |
Табл. у бліст. по 5 мг/12, 5 мг, 10 мг/12,5 мг; 10 мг/25 мг; 20 мг/12,5 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
47 |
Еналаприл + нітрендипін |
Табл. у бліст. містить еналаприлу 10 мг/нітрендипіну 20 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
48 |
Еналаприл + лерканідипін |
Табл. п/о у бліст. по 20 мг/20 мг, 20 мг/10 мг, 10 мг/10 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
49 |
Зофеноприл |
Табл. п/о у бліст. по 7,5 мг, 30 мг. Зофеноприл 30 мг приймають незалежно від прийому їжі. Дозу слід підбирати відповідно до терапевтичної реакції пацієнта |
|
|
50 |
Зофеноприл + гідрохлоротіазид |
Табл. п/о у бліст. містить зофеноприлу кальцію 30 мг/12,5 мг гідрохлоротіазиду. Дозу слід підбирати відповідно до терапевтичної реакції пацієнта |
|
|
51 |
Каптоприл |
Табл. у бліст. 0,025 г; 12,5 мг, 25 мг, 50 мг. Призначаються по 12,5–25–50 мг 2–4 рази на добу |
|
|
52 |
Каптоприл + гідрохлоротіазид |
Табл. у бліст. 50 мг/12,5 мг; 50 мг/25 мг, табл. у конт. чарунк. уп. 50 мг/12,5 мг та 50 мг/25 мг |
|
|
53 |
Квінаприл |
Табл., вкриті п/о, у бліст. по 5 мг; 10 мг; 20 мг. Добова доза 10–40 мг/добу, призначаються 1–2 рази на добу |
|
|
54 |
Квінаприл + гідрохлоротіазид |
Табл. п/о у бліст. містить квінаприлу 20 мг/12,5 мг гідрохлоротіазиду або квінаприлу 10 мг/12,5 мг гідрохлоротіазиду. Призначаються в дозах, необхідних для контролю АТ |
|
|
55 |
Лізиноприл |
Табл. у бліст. по 2,5 мг, 5 мг, 10мг, 20 мг. Призначається по 10–20 мг 1 раз на добу |
|
|
56 |
Лізиноприл + гідрохлоротіазид |
Табл. у бліст. по 10 мг/12,5 мг; 20 мг/12,5 мг. Призначаються в дозах, необхідних для контролю АТ |
|
|
57 |
Лізиноприл + амлодипін |
Табл. у бліст. містить лізиноприлу 20 мг/амлодипіну 10 мг або лізиноприлу 20 мг/амлодипіну 5 мг або лізиноприлу 5 мг/амлодипіну 5 мг або лізиноприлу 10 мг/амлодипіну 5 мг. Табл., вкриті п/о, по 5 мг/5 мг. Табл. у стрипах по 5 мг/5 мг. Призначаються у дозах, що необхідні для контролю АТ |
|
|
58 |
Периндоприл |
Табл. у бліст. по 2 мг, 4 мг та 8 мг містять периндоприлу тербутиламіну; табл., що дисперг. в ротовій порожнині в конт. по 2,5 мг, 5 мг та 10 мг містять периндоприлу аргініну. Табл. п/о у конт. по 2,5 мг, 5 мг та 10 мг містять периндоприлу аргініну, табл., що дисперг. в ротовій порожнині, у бліст. по 2,5 мг, 5 мг та 10 мг, 4 мг, 8 мг, містять тербутиламін. Табл. п/о у конт. містять периндоприлу тозилату по 2,5 мг, 5 мг та 10 мг. Призначаються в дозі 4–10 мг 1 раз на добу |
|
|
59 |
Периндоприл + індапамід |
Табл. у бліст. містить периндоприлу тербутиламіну 2 мг/індапаміду 0,625 мг або периндоприлу тербутиламіну 4 мг/індапаміду 1,25 мг або периндоприлу тербутиламіну 8 мг/індапаміду 2,5 мг. Табл. п/о у конт. містить периндоприлу аргініну 5 мг/індапаміду 1,25 мг, периндоприлу аргініну 2,5 мг/індапаміду 0,625 мг або периндоприлу аргініну 10 мг/індапаміду 2,5 мг. Табл. п/о у конт. містять периндоприлу тозилату 2,5 мг/індапаміду 0,625 мг та периндоприлу тозилату 5 мг/індапаміду 1,25 мг, периндоприлу тозилату 10 мг/індапаміду 2,5 мг. Призначаються в дозах, необхідних для контролю АТ |
|
|
60 |
Периндоприл + амлодипін |
Табл. у бліст. містить амлодипіну 5 мг/периндоприлу тербутиламіду 8 мг, амлодипіну 10 мг/периндоприлу тербутиламіду 4 мг, амлодипіну 5 мг/периндоприлу тербутиламіду 4 мг, амлодипіну 10 мг/периндоприлу тербутиламіду 8 мг. Табл. у конт. містить периндоприлу аргініну 7 мг/5 мг амлодипіну, периндоприлу аргініну 3,5 мг/2,5 мг амлодипіну, периндоприлу аргініну 14 мг/10 мг амлодипіну. Табл. у конт. містить периндоприлу тозилату 5 мг/амлодипіну 10 мг, периндоприлу тозилат 10 мг/амлодипіну 10 мг, периндоприлу тозилату 5 мг/амлодипіну 5 мг, периндоприлу тозилату 10 мг/амлодипіну 5 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
61 |
Периндоприл + бісопролол |
Табл. п/о у контейнерах містить бісопрололу фумарату 10 мг, периндоприлу аргініну 10 мг, або бісопрололу фумарату 10 мг, периндоприлу аргініну 5 мг або бісопрололу фумарату 5 мг, периндоприлу аргініну 10 мг або бісопрололу фумарату 5 мг, периндоприлу аргініну 5 мг. Призначаються в дозах, необхідних для контролю АТ |
|
|
62 |
Периндоприл + індапамід + амлодипін* |
Табл. п/о у конт. містить периндоприлу аргініну 2,5 мг/індапаміду 0,625 мг/амлодипіну 5 мг або периндоприлу аргініну 5 мг/індапаміду 1,25 мг/амлодипіну 5 мг або периндоприлу аргініну 5 мг/індапаміду 1,25 мг/амлодипіну 10 мг або периндоприлу аргініну 10 мг/індапаміду 2,5 мг/амлодипіну 5 мг або периндоприлу аргініну 10 мг/індапаміду 2,5 мг/ амлодипіну 10 мг. Табл. у бліст. містить периндоприлу тертбутиламіну 8 мг/індапаміду 2,5 мг/амлодипіну 5 мг або периндоприлу тертбутиламін 2 мг/індапаміду 0,625 мг/амлодипіну 5 мг або периндоприлу тертбутиламіну 4 мг/індапаміду 1,25 мг/амлодипіну 10 мг або периндоприлу тертбутиламіну 4 мг/індапаміду 1,25 мг/амлодипіну 5 мг або периндоприлу тертбутиламіну 8 мг/індапаміду 2,5 мг/амлодипіну 10 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
63 |
Периндоприл + амлодипін + аторвастатин |
Табл. п/о у конт. містять аторвастатину 40 мг/периндоприлу аргініну 10 мг/амлодипіну 10 мг або аторвастатину 20 мг/периндоприлу аргініну 10 мг/амлодипіну 5 мг, або аторвастатину 20 мг/периндоприлу аргініну 10 мг/амлодипіну 10 мг, або аторвастатину 10 мг/периндоприлу аргініну 5 мг/амлодипіну 5 мг, або аторвастатину 20 мг/периндоприлу аргініну 5 мг/амлодипіну 5 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
64 |
Периндоприл + розувастатин + індапамід |
Табл., вкриті п/о, містять розувастатину 10 мг/периндоприлу 8 мг/індапаміду 2,5 мг або розувастатину 10 мг/периндоприлу 4 мг/індапаміду 2,5 мг, або розувастатину 20 мг/периндоприлу 8 мг/індапаміду 2,5 мг або розувастатину 20 мг/периндоприлу 4 мг/індапаміду 2,5 мг. Призначається індивідуально |
|
|
65 |
Раміприл |
Табл. у бліст. по 1,25; 2,5, 5 та 10 мг, капс. у бліст. по 2,5 мг, 5 мг, 10 мг. Капс. тверді по 2,5 мг, 5 мг та 10 мг. Призначаються в дозі від 2,5 мг 1 раз на добу до 10 мг 1 раз на добу |
|
|
66 |
Раміприл + гідрохлоротіазид |
Табл. у бліст. по 2,5 мг/12,5 мг; 5 мг/12,5 мг; 5 мг/25 мг; 10 мг/12,5 мг; 10 мг/25 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
67 |
Раміприл + амлодипін |
Капс. тверді містять 5 мг/10 мг або 10 мг/10 мг або 5 мг/5 мг або 10 мг/5 мг. Капс. у бліст. містять10 мг/10 мг або 5 мг/5 мг або 2,5 мг/2,5 мг або 10 мг/5 мг або 5 мг/10 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
68 |
Кислота ацетилсаліцилова + аторвастатин + раміприл |
Капс. тверді містять кислоту ацетилсаліцилову 100 мг/аторвастатин 20 мг/раміприл 5 мг, кислоту ацетилсаліцилову 100 мг/аторвастатин 20 мг/раміприл 2,5 мг або кислоту ацетилсаліцилову 100 мг/аторвастатин 20 мг/раміприл 10 мг |
|
|
69 |
Трандолаприл + верапаміл |
Табл. п/о з модифікованим вивільненням, містять трандолаприлу 2 мг/верапамілу гідрохлориду 180 мг та трандолаприлу 4 мг/верапамілу гідрохлориду 240 мг, призначається у дозах, необхідних для контролю АТ |
|
|
70 |
БРА |
Кандесартан |
Табл. у бліст. по 4 мг, 8 мг, 16 мг та 32 мг. Призначаються у дозах, необхідних для контролю АТ |
|
71 |
Кандесартан + гідрохлоротіазид |
Табл. у бліст. містить кандесартану целексетилу 8 мг/гідрохлоротіазиду 12,5 мг або кандесартану целексетилу 16 мг/гідрохлоротіазиду 12,5 мг, або кандесартану целексетилу 32 мг/гідрохлоротіазиду 12,5 мг та кандесартану целексетилу 32 мг/гідрохлоротіазиду 25 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
72 |
Лозартан |
Табл., вкриті п/о, у бліст. по 12,5 мг, 25 мг, 50 мг, 100 мг. Табл. в/о у бліст. по 12,5 мг, 50 мг та 100 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
73 |
Лозартан + гідрохлоротіазид |
Табл. п/о у бліст. містить лозартану калію 50 мг та гідрохлоротіазиду 12,5 мг або лозартану калію 100 мг та гідрохлоротіазиду 25 мг та лозартану калію 100 мг та гідрохлоротіазиду 12,5 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
74 |
Лозартан + амлодипін |
Табл. п/о у бліст. містить лозартану калію 50 мг/амлодипіну 5 мг або лозартану калію 100 мг/амлодипіну 5 мг, лозартану калію 50 мг/амлодипіну 10 мг, лозартану калію 100 мг/амлодипіну 10 мг Призначаються у дозах, необхідних для контролю АТ |
|
|
75 |
Олмесартан |
Табл., вкриті п/о, у бліст.10 мг, 20 мг, 40 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
76 |
Олмесартан + гідрохлоротіазид* |
1 табл. п/о у бліст. містить олмесартан медоксоміл 20 мг та гідрохлоротіазид 12,5 мг або олмесартан медоксоміл 20 мг та гідрохлоротіазид 25 мг, або олмесартан медоксоміл 40 мг та гідрохлоротіазид 12,5 мг, або олмесартан медоксоміл 40 мг та гідрохлоротіазид 25 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
77 |
Олмесартан + амлодипін |
Табл. п/о у бліст. містить олмесартан медоксоміл 20 мг, амлодипін 5 мг або олмесартан медоксоміл 40 мг, амлодипін 5 мг або олмесартан медоксоміл 40 мг, амлодипін 10 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
78 |
Олмесартан + амлодипін + гідрохлоротіазид |
Табл., вкриті п/о, містять олмесартану медоксомілу 20 мг/амлодипіну 5 мг/гідрохлоротіазиду 12,5 мг або олмесартану медоксомілу 40 мг/амлодипіну 10 мг/гідрохлоротіазиду 25 мг, або олмесартану медоксомілу 40 мг/амлодипіну 10 мг/гідрохлоротіазиду 12,5 мг, або олмесартану медоксомілу 40 мг/амлодипіну 5 мг/гідрохлоротіазиду 25 мг, або олмесартану 40 мг/амлодипіну 5 мг/гідрохлоротіазиду 12,5 мг. Призначається індивідуально |
|
|
79 |
Ірбесартан |
Табл. у бліст. по 75 мг, 150 мг, 300 мг, табл. в/о у бліст. 75 мг, 150 мг, 300 мг, табл. п/о у бліст. по 75 мг, 150 мг, 300 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
80 |
Ірбесартан + гідрохлоротіазид |
Табл. у бліст. містять ірберсартану 150 мг/гідрохлоротіазиду 12,5 мг, ірберсартану 300 мг/гідрохлоротіазиду 12,5 мг, табл. п/о у бліст. містять ірберсартану 300 мг/гідрохлоротіазиду 12,5 мг або ірберсартану 150 мг/гідрохлоротіазиду 12,5 мг, ірберсартану 300 мг/гідрохлоротіазиду 25 мг, табл. в/о у бліст. ірберсартану 300 мг/гідрохлоротіазиду 12,5 мг, ірберсартану 300 мг/гідрохлоротіазиду 25 мг, ірберсартану 150 мг/гідрохлоротіазиду 12,5 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
81 |
Епросартан |
Табл. п/о у бліст. по 600 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
82 |
Валсартан |
Табл., вкриті п/о, у бліст. 40 мг, 80 мг, 160 мг та 320 мг. Табл. п/о у фл. по 40 мг, 80 мг, 160 мг, 320 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
83 |
Валсартан + гідрохлоротіазид |
Табл., вкриті п/о, у бліст. 80 мг валсартану/12,5 мг гідрохлоротіазиду, 160 мг валсартану/12,5 мг гідрохлоротіазиду, 160 мг валсартану/25 мг гідрохлоротіазиду, 320 мг валсартану/12,5 мг гідрохлоротіазиду, 320 мг валсартану/25 мг гідрохлоротіазиду. Табл., вкриті п/о, у фл. 80 мг/12,5 мг або 160 мг/12,5 мг, або 160 мг/25 мг, або 320 мг/12,5 мг, або 320 мг/25 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
84 |
Валсартан + амлодипін |
Табл. п/о у бліст. містять валсартану 160 мг і амлодипіну 5 мг або валсартану 160 мг і амлодипіну 10 мг, або валсартану 80 мг і амлодипіну 5 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
85 |
Валсартан + розувастатин |
Табл., вкриті п/о, у бліст. по 20 мг/160 мг або 10 мг/160 мг, або 20 мг/80 мг, або 10 мг/80 мг. Призначається індивідуально |
|
|
86 |
Валсартан + сакубітрил |
Табл., вкриті п/о, по 100 мг: сакубітрил 48,6 мг/вальсакор 51,4 мг або 50 мг: сакубітрил 24,3 мг/25,7 мг або 200 мг: сакубітрил 97,2 мг/102,8 мг. Призначається індивідуально |
|
|
87 |
Валсартан + гідрохлоротіазид + амлодипін |
Табл. п/о у бліст. містить валсартану 160 мг/гідрохлоротіазиду 12,5 мг/амлодипіну бесилату 5 мг, або валсартану 160 мг/амлодипіну бесилату 10 мг/гідрохлоротіазиду 12,5 мг, або валсартану 160 мг/гідрохлоротіазид 25 мг/амлодипіну 10 мг, або валсартану 160 мг/гідрохлоротіазиду 25 мг/амлодипіну 5 мг. Табл., вкриті п/о, у конт. чарунк. уп. 10 мг/12,5 мг/160 мг або 5 мг/12,5 мг/160 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
88 |
Телмісартан |
Табл. у бліст. по 40 мг, 80 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
89 |
Телмісартан + гідрохлоротіазид |
Табл. у бліст. по 40 мг/12,5 мг та 80 мг/12,5 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
90 |
Телмісартан + амлодипін |
Табл. у бліст. по 80 мг/5 мг або 80 мг/10 мг, або 40 мг/10 мг, або 40 мг/5 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
91 |
Азілсартан* |
Табл. у бліст. містять 20 мг, 40 мг або 80 мг азілсартану медоксомілу. Призначаються у дозах, необхідних для контролю АТ |
|
|
92 |
Азілсартан + хлорталідон* |
Табл. у бліст. містить азілсартану медоксомілу 40 мг/хлорталідону 12,5 мг; або азілсартану медоксомілу 40 мг/хлорталідону 25 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
93 |
Антигіпертензивні лікарські засоби центральної дії |
Гуанфацин |
Табл. у бліс. містить 1 мг. Призначаються у дозах, необхідних для контролю АТ |
|
94 |
Клонідин |
Табл. у бліст. по 0,15 мг, 0,1 мг, 0,3 мг або табл. у конт. чарунк. уп. по 0,15 мг або р-н д/ін’єкцій в амп. 0,01% 1 мл в амп. Призначаються у дозах, необхідних для контролю АТ. Призначаються у дозах, необхідних для контролю АТ |
|
|
95 |
Метилдопа |
Табл. по 250 мг у фл. Призначаються у дозах, необхідних для контролю АТ |
|
|
96 |
Моксонідин |
Табл. п/о у бліст. по 0,2 мг, 0,3 мг, 0,4 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
97 |
Раунатин |
Табл. в/о у бліст. по 2 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
98 |
Хомвіотензин |
Табл. у бліст. (резерпін 32 мг, рауфольфія 32 мг). Призначаються у дозах, необхідних для контролю АТ |
|
|
99 |
Блокатори рецепторів альдостерону |
Спіронолактон |
Табл. по 25 мг, 50 мг, 100 мг, табл. п/о по 25 мг, 50 мг, 100 мг, капс. по 50 мг та 100 мг. Табл. у контр. чарунк. уп. по 25 мг, 50 мг 100 мг. Призначаються у дозах, необхідних для контролю АТ |
|
100 |
Спіронолактон + фуросемід |
Капс. у бліст. містить спіранолоктону 50 мг та фуросеміду 20 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
101 |
Еплеренон |
Табл., вкриті п/о, у бліст. по 25 мг, 50 мг. Призначаються у дозах, необхідних для контролю АТ |
|
|
102 |
Антиадренергічні засоби, гангліоблокатори |
Гексаметоній (немає) |
Р-н для ін’єкцій в амп. 2,5% по 1 мл по 25 мг/1мл. Призначаються у дозах, необхідних для контролю АТ при гіпертонічному кризі |
|
103 |
Блокатори альфа-адренорецепторів |
Доксазозин |
Табл. у бліст. 1 мг, 2 мг, 4 мг, або табл. п/о з модифікованим вивільненням по 4 мг. Призначаються у дозах, необхідних для контролю АТ |
|
104 |
Урапідил |
Капс. пролонгованої дії тверді у фл. по 30 мг та 60 мг, або р-н для ін’єкцій в амп. по 5 мл по 5 мг/мл, 10 мл по 5 мг/мл. Призначаються у дозах, необхідних для контролю АТ |
В табл. 43 наведено перелік препаратів, рекомендованих до застосування при гіпертонічному кризі.
Таблиця 43. Перелік препаратів та рекомендації щодо їх застосування при гіпертонічному кризі згідно з Державним реєстром лікарських засобів України
|
№ |
Клас |
Препарат |
Дозування |
|
1 |
Діуретики |
Фуросемід |
Табл. у бліст. по 40 мг, табл. у контур. чарунк. уп. по 40 мг, або р-н д/ін’єкцій в амп. по 2 мл по 10 мг/ мл, в амп. У пачці, в амп. У блістері та в амп. в конт. чарунк. уп. Призначається в/в в дозах 40–80 мг болюсно, початок дії ч/з 5–10 хв, тривалість дії 6–8 год, при ускладнених кризах, переважно з гострою серцевою чи нирковою недостатністю. При неускладнених кризах по 40–120 мг per os або в/м, початок дії препарату ч/з 5–30 хв |
|
2 |
Торасемід |
Табл. у бліст. по 5 мг, 10 мг , 20 мг, 50 мг, 100 мг та 200 мг; р-н д/ін’єкцій в амп. по 10 мг/2 мл по 2 мл, 20 мг/4 мл по 4 мл, по 5 мг/мл по 2 мл, 5 мг/мл по 4 мл, 200 мг/20 мл по 20 мл; р-н д/ін’єкцій у флаконах по 5 мг/мл по 4 мл. По 10–100 мг в/в, початок дії ч/з 5–30 хв, тривалість дії 6–8 год, при неускладнених кризах переважно з гострою серцевою чи нирковою недостатністю. При неускладнених кризах по 10–100 мг per os або в/м, початок дії препарату ч/з 5–30 хв |
|
|
3 |
Блокатори бета-адренорецепторів |
Пропранолол |
Табл. у бліст. по 10 та 40 мг. При ускладнених кризах в/в крапельно 2–5 мг зі швидкістю 0,1 мг/хв, початок дії ч/з 10–20 хв, тривалість дії 2–4 год. При неускладненому кризі по 20–80 мг per os, початок дії ч/з 30–60 хв |
|
4 |
Есмолол |
Р-н д/ін’єкцій у фл. по 10 мг/мл по 10 мл. При ускладненому кризі по 80 мг болюсно 250 мкг/кг/хв інфузія, початок дії ч/з 1–2 хв, тривалість дії 10–20 хв |
|
|
5 |
Метопролол |
Р-н д/ін’єкцій в амп. По 1 мг/1 мл по 5 мг; табл. у бліст. 25 мг, 50 мг, 100 мг; табл. у бліст. по 0,05 г та 0,1 г; табл. у фл. по 25 мг, 50 мг, 100 мг; табл., вкриті п/о, з уповільненим вивільненням по 25 мг, 50 мг; 100 мг. При неускладненому кризі по 50–100 мг per os або 5–10 мг в/в повільно, початок дії ч/з 20–30 та 3–5 хв відповідно |
|
|
6 |
Лабеталол |
Р-н д/ін’єкцій у фл. по 5 мг/мл по 4 мл і 20 мл. При ускладненому кризі по 80 мг болюсно 250 мкг/кг/хв інфузія, початок дії ч/з 1–2 хв, тривалість дії 10–20 хв. При ускладнених кризах в/в болюсно по 20–80 мг зі швидкістю 2 мг/хв. Або в/в інфузія 50–300 мг, початок дії ч/з 5–10 хв, тривалість дії 4–8 год. Препарат не зареєстрований в Україні |
|
|
7 |
Антогоністи кальцію (блокатори кальцієвих каналів) |
Верапаміл |
Табл. п/о у контур. чарунк. уп. по 40 мг, 80 мг, табл. в/о у бліст. по 40 мг, 80 мг, табл., вкриті п/о, у бліст. по 80 мг, капс. пролонг. дії у бліст. 180 мг. Табл. пролонг. дії у бліст. по 240 мг, 80 мг. Р-н д/ін’єкцій в амп. по 2,5 мг/мл по 2 мл. При ускладнених кризах в/в по 5–10 мг, можна продовжити в/в крапельно 3–25 мг/год, початок дії ч/з 1–5 хв, тривалість дії 10–30 хв |
|
8 |
Ніфедипін |
Краплі оральні р-н по 20 мг/мл по 10 мл або 20 мл у фл.; табл. в/о по 10 мг, 20 мг, табл. пролонг. дії у бліст. 10 мг, 20 мг, 40 мг. Табл. з модифікованим вивільненням у бліст. по 20 мг, 40 мг. Табл. у бліст. по 10 мг. Табл. п/о у бліст. по 30 мг, 60 мг. Краплі оральні р-н 2% по 5 мл або 25 мл у фл. Для купірування гіпертензивного кризу препарат вводять в/в крапельно по 50 мл (5 мг ніфедипіну) протягом 4–8 год, тобто зі швидкістю 6,3—12,5 мл інфузійного р-ну за 1 год; протягом 24 год доза препарату, який вводиться, не повинна перевищувати 150—300 мл, що відповідає добовій дозі 15–30 мг. Або по 10–20 мг per os або сублінгвально, початок дії ч/з 15–30 хв |
|
|
9 |
Інгібітори АПФ |
Еналаприл |
Р-н д/ін’єк. в амп. по 1 мл по 1,25 мг/мл. Табл. у бліст. 0,01 г, 2,5 мг, 5 мг, 10 мг та 20 мг. Табл. у конт. чарунк. уп. 10 мг. При ускладнених кризах в/в по 1,25–5 мг, початок дії ч/з 15–30 хв, тривалість дії 6 год |
|
10 |
Каптоприл |
Табл. у бліст. 0,025 г; 12,5 мг, 25 мг, 50 мг. Призначаються по 12,5–25–50 мг per os сублінгвально, початок дії ч/з 15–45 хв. При неускладнених кризах |
|
|
11 |
Симпатолітик центральної дії |
Клонідин |
Р-н д/ін’єкцій в амп. по 1 мл 0,01%. Табл. у бліст. 0,15 мг, 0,1 мг, 0,3 мг. При ускладненому кризі в/в по 0,5–1,0 мл або в/м 0,5–2,0 мл, початок дії ч/з 5–15 хв, тривалість дії 2–6 год. При неускладнених кризах в/м 0,5–2,0 або 0,075–0,3 мг per os, початок дії ч/з 30–60 хв |
|
12 |
Периферичні вазодилататори |
Дибазол |
Р-н д/ін’єкцій в амп. по 1 мл або 5 мл по 10 мг/мл. Табл. у контур. чарунк. уп. по 20 мг. При неускладненому кризі в/в по 3,0–5,0 або в/м 4,0–8,0, початок дії ч/з 10–30 хв |
|
13 |
Нітрогліцерин |
Р-н д/ін’єк. в амп. по 2 мл і 5 мл по 10 мг/мл. Табл. сублінг. по 0,5 мг, 0,4 мг, 0,3 мг в банках, в пробірках і в контейнерах. Спрей сублінгв. 0,4 мг/дозу по 10 мг (180 доз) або по 0,4 мг/дозу по 15 мг (300 доз). Табл. пролонг. дії по 5,2 мг або 2,9 мг у бліст. Концентрат для р-ну д/інфузій 1 мг/мл по 5 мл в амп. При ускладненому кризі в/в крапельно по 50–100 мкг/хв, початок дії ч/з 2–5 хв, тривалість дії 3–5 хв |
|
|
14 |
Урапідил |
Р-н д/ін’єк. в амп. по 5 мл і 10 мл по 5 мг/мл. Капс. пролонг. дії тверді по 30 мг та 60 мг у фл. Концентр. для р-ну д/інфузій 5 мг/мл по 20 мл. В/в болюсно по 0,025 г 0,5% розчину протягом 5 хв, також в/в крапельно повільно 250 мг на фізрозчині із розрахунку 9–30 мг/год |
|
|
15 |
Анксіолітик |
Діазепам |
Р-н д/ін’єк. в амп. по 2 мл або 5 мл по 5 мг/мл. Табл. у бліст. по 5 мг, 0,01 г та 0,005 г. При неускладненому кризі 0,5% в/м по 1,0–2,0, початок дії ч/з 15–30 хв |
|
16 |
Інші препарати |
Магнію сульфат |
Р-н д/ін’єкцій в амп. по 5 мл і 10 мл по 250 мг/мл. Порошок для р-ну для орального застосування по 25 мг в контейнері або саше. При ускладненому кризі 25% в/в болюсно по 5,0–20,0, початок дії ч/з 30–40 хв, тривалість дії 3–4 год |
Стандарти надання медичної допомоги хворим з легеневою гіпертензією (у дорослих)
(Ю.М. Сіренко, Г.Д. Радченко, Л.Ф. Конопльова, Л.В. Кулик, К.В. Руденко, Н.Н. Руденко, В.А. Ханенкова, Л.І. Васильєва)
Стандарти діагностики та лікування
Умови надання медичної допомоги
Усіх пацієнтів з ЛГ умовно можна розподілити на такі групи:
Група 1: ідіопатична ЛАГ, спадкова, асоційована з ліками та токсинами, асоційована з іншими захворюваннями.
Група 2: ЛГ, асоційована із ураженням лівих відділів серця.
Група 3: ЛГ, асоційована із захворюванням легень або гіпоксією.
Група 4: хронічна тромбоемболічна ЛГ, ЛГ, асоційована з обструкцією легеневої артерії.
Група 5: ЛГ з невідомими та/або багатофакторними механізмами.
Усі пацієнти з ЛГ із груп 1 та 4 підлягають амбулаторному або стаціонарному обстеженню в спеціалізованих центрах ЛГ або у високоспеціалізованих кардіологічних центрах, що надають третинну медичну допомогу. Пацієнти з ЛГ групи 2 потребують обстеження та лікування згідно з протоколами для пацієнтів із СН. Пацієнти з ЛГ груп 3 та 5 потребують обстеження та лікування у спеціалізованих центрах за профілем захворювання. За необхідності проводиться консультація в спеціалізованому центрі ЛГ для пацієнтів груп 2, 3 та 5.
Програма діагностики
1. Визначення скарг і анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ та ЧСС.
4. Обов’язкові лабораторні обстеження:
- загальний аналіз крові;
- загальний аналіз сечі;
- біохімічне дослідження крові (калій, натрій, креатинін, білірубін, АлАТ, АсАТ, глюкоза, рівень сечової кислоти);
- ревмопроби (антистрептолізин, С-реактивний протеїн, за необхідності – маркери ревматологічних захворювань);
- маркери хронічного гепатиту В та С (якщо не визначено при попередніх обстеженнях);
- коагулограма (МНВ);
- рівень BNP або NT-pro-BNP;
- ТТГ, якщо раніше не визначали або були виявлені відхилення від норми.
За наявності показань:
- маркери, необхідні для верифікації системного захворювання сполучної тканини;
- визначення феритину у крові;
- імунологічні обстеження на ВІЛ-інфекцію та маркери гепатиту.
5. Обов’язкові інструментальні обстеження:
- реєстрація ЕКГ в 12 відведеннях;
- УЗД серця (ехоКГ з допплер-КГ);
- УЗД органів черевної порожнини;
- рентгенографія органів грудної клітки;
- ангіопульмонографія (КТ з контрастуванням або пряма ангіопульмонографія);
- пульсоксиметрія;
- 6-хвилинний тест (з оксиметрією);
- катетеризація правих відділів серця згідно із спеціальним протоколом (при остаточному встановленні діагнозу ЛГ, через 3–4 міс після призначення/корекції специфічної терапії, при погіршенні стану, у плановому порядку кожні 3 роки) з проведенням вазореактивного тесту у разі необхідності (пацієнтам з ЛАГ до призначення специфічного лікування);
- скринінгова полісомнографія; якщо раніше не проводилася.
За наявності показань:
- перфузійна пульмоносцинтиграфія;
- спірографія;
- спіроергометрія;
- бронхоскопія;
- трансезофагеальна ехоКГ (ТЕ-ехоКГ).
6. Бажані:
- полісомнографія;
- кардіопульмональний тест (пікове споживання О2);
- проводиться оцінка ризику смерті (табл. 44, обов’язково для хворих 1-ї групи).
Таблиця 44. Визначення ризику для оцінки прогнозу та ефективності терапії у пацієнтів з ЛАГ
|
Фактор ризику |
Низький ризик |
Помірний ризик |
Високий ризик |
|
Розрахункова 1-річна смертність |
<5% |
5–10% |
>10% |
|
Клінічні ознаки СН |
Відсутні |
Відсутні |
Наявні |
|
Прогресування симптомів |
Немає |
Повільне |
Швидке |
|
Синкопальні стани |
Немає |
Поодинокі епізоди |
Повторні епізоди |
|
ФК ВОЗ |
І, ІІ |
ІІІ |
ІV |
|
6-хвилинний тест |
>440 м |
165–440 м |
<165 м |
|
Кардіопульмональний навантажувальний тест |
Пік VO2 >15 мл/хв/кг (>65%) |
Пік VO2 11–15 мл/хв/кг (35–65%) |
Пік VО2 <11 мл/хв/кг (<35%) |
|
NT-proBNP-рівень |
BNP <50 пг/л NT-proBNP <300 пг/л |
BNP 50–300 пг/л NT-proBNP 300–1400 пг/л |
BNP >300 пг/л NT-proBNP >1400 пг/л |
|
Дані візуалізуючих методів дослідження (ехоКГ, МРТ) |
ПП <18 см2 Немає рідини в перикарді |
ПП 18–26 см2 Немає рідини в перикарді або мінімальна кількість |
ПП >26 см2 Рідина в перикарді |
|
Показники гемодинаміки |
Тиск ПП <8 мм рт. ст. СІ >2,5 л/хв/м2 SvO2 >65% |
Тиск ПП 8–14 мм рт. ст. СІ 2–2,4 л/хв/м2 SvO2 60–65% |
Тиск ПП >14 мм рт. ст. СІ <2 л/хв/м2 SvO2 <60% |
ПП — праве передсердя, СІ — серцевий індекс, SvO2 — сатурація змішаної венозної крові киснем.
Стратифікація серцево-судинного ризику
У настанові 2015-ESC/ERS рекомендується оцінка ризику у хворих на ЛГ із використанням багатовимірної стратифікації перемінних із відомим прогностичним значенням, які можуть бути модифікованими в процесі спостереження: клінічних проявів, функціональних параметрів, толерантності до фізичного навантаження, біохімічних, ехоКГ та гемодинамічних показників. Запропоновано розділяти пацієнтів на три категорії на основі очікуваної смертності протягом 1 року: низький, проміжний або високий ризик. Оцінка ризику при ЛАГ за цими критеріями представлена у табл. 44.
Індивідуальний ризик розраховується при першому візиті та під час наступного візиту при спостереженні. Кожному критерію призначаються умовні бали 1, 2 або 3 відповідно до ступеня ризику (1 — низький ризик, 2 — проміжний ризик та 3 — високий ризик) і середня величина округлюється до більшого значення.
Оцінка ризику при ЛГ має певні обмеження, включаючи ретроспективний характер валідаційних аналізів. Інші важливі прогностичні змінні, такі як показники ехоКГ, МРТ та кардіопульмональні тести з фізичним навантаженням, не збирали систематично та не аналізували. Крім того, ускладнення, які несуть безпосередню загрозу для життя, такі як кровохаркання, розширення аневризми легеневої артерії зі стисканням органів грудної клітки, аритмії та ін., не включаються до поточних характеристик стратифікації ризику. Ці дані повинні розглядатися як частина комплексної стратегії оцінки ризику для прийняття правильного клінічного рішення в референтному центрі ЛГ.
Програма лікування
Специфічна терапія призначається тільки пацієнтам 1-, 4-ї та деяким із 5-ї груп і тільки спеціалістом референтного центру ЛГ, за наявності ургентних показань, як виняток, лікарем-кардіологом після консультації з референтним центром ЛГ. Тактика призначення медикаментозної терапії залежить від причини ЛГ, функціонального стану пацієнта та наявності маркерів несприятливого прогнозу.
Перелік обов’язкових медичних послуг
Лікування невідкладних станів проводиться відповідно до алгоритму, наведеного в табл. 45.
Таблиця 45. Ускладнення ЛГ
|
Ускладнення та симптоми |
Лікування |
|
Загострення ЛГ (легеневий гіпертензивний криз). Ознаки посилення правошлуночкової недостатності та гіпотензії. Клінічними проявами стану є скарги на різку слабкість, запаморочення, непритомний стан; блідість шкіри, ціаноз, ниткоподібний пульс, можливе порушення ритму, АТ знижується до 80–70/60–40 мм рт. ст., відзначається посилена прекардіальна пульсація, прослуховується посилений 2-й тон над легеневою артерією |
Термінова госпіталізація до відділення інтенсивної терапії. Крім загального симптоматичного лікування (діуретики, оксигенотерапія), слід застосовувати такі принципи терапії: 1. Усунення причини декомпенсації (порушення режиму прийому препаратів, тромбоемболія легеневої артерії, аритмії, інфекція з повільним перебігом, перевантаження рідиною). 2. Зниження постнавантаження ПШ за допомогою максимально селективних вазодилататорів легеневої артерії (внутрішньовенно простаноїди — ілопрост у початковій дозі 0,5 нг/кг/хв, яку підвищують через 30–60 хв на 0,1–0,2 нг/кг/хв, або інгаляційний ілопрост, або силденафіл перорально/сублінгвально). 3. Застосування позитивних інотропів (дофамін, добутамін, левосимендан) при недостатній ефективності легеневих вазодилататорів |
|
Аритмії. ФП, як правило, виникає на пізніх етапах захворювання |
При персистуючій формі рекомендовано відновлення синусового ритму, за наявності показань та відсутності протипоказань. Для підтримання синусового ритму рекомендовані антиаритмічні препарати без негативної інотропної дії (аміодарон). Застосування блокаторів бета-адренорецепторів не рекомендовано, і певній категорії пацієнтів протипоказано |
|
Такі порушення ритму та провідності, як екстрасистолія, синоатріальна блокада, міграція водія ритму по передсердях, виявляють досить часто |
Як правило, антиаритмічного лікування не потребують |
|
Кровохаркання. Причиною кровохаркання у пацієнтів з ЛГ найчастіше є розриви легенево-бронхіальних анастомозів. У таких випадках кровохаркання рідко буває значним і припиняється самостійно. При частому та тривалому кровохарканні може розвинутися анемія. При значній легеневій кровотечі необхідна гемостатична терапія. У пацієнтів з розшаровуючою аневризмою легеневої артерії виникає смертельна кровотеча. У пацієнтів з ЛГ на фоні тромбоемболії легеневої артерії кровохаркання виникає при інфаркті легень. У пацієнтів з посткапілярною (венозною) ЛГ кровохаркання виникає внаслідок венозного застою в малому колі кровообігу. У пацієнтів із системними захворюваннями сполучної тканини кровохаркання частіше викликається основним захворюванням (васкулітами) і рідше пов’язане з ЛГ. У пацієнтів з ХОЗЛ також необхідно проводити диференційну діагностику кровохаркання. Частіше його причинами бувають деструктивні процеси в легенях (туберкульоз, рак) або бронхоектази |
Спеціального лікування не потребує. Проводиться лікування анемії. Часті кровохаркання можуть бути протипоказаннями для антикоагулянтної терапії. Емболізація бронхіальних судин. Хірургічне лікування за ургентними показаннями. Спеціального лікування не потребує. При виявлені патології легень та бронхів лікування згідно з відповідними медико-технологічними документами |
|
Механічні ускладнення (парез голосових зв’язок, аневризма стовбура легеневої артерії, компресія стовбура ЛКА, легеневих вен, бронхів) виникають внаслідок дилатації та дисекції легеневої артерії |
Як правило, специфічного лікування не потребують. Ефективність хірургічних втручань не доведена. При встановленому діагнозі компресії стовбура ЛКА можливе проведення перкутанних процедур (стентування) |
|
Правошлуночкова СН. Ознаки правошлуночкової недостатності: набрякання шийних вен, збільшення розмірів печінки, позитивний симптом Плеша, набряки нижніх кінцівок, асцит |
Діуретична терапія, застосування інотропних препаратів, вазодилататорів легеневого русла (ілопрост, силденафіл) |
Для подальшого лікування пацієнтів з ЛГ після обстеження та стабілізації стану використовуються:
- сечогінна терапія (фуросемід, торасемід) показана пацієнтам з ЛГ та ознаками правошлуночкової СН або ознаками затримки рідини. Спіронолактон слід призначати при значно збільшених розмірах ПШ та/або високому рівні НУП;
- довгострокові інгаляції кисню показані пацієнтам з ЛГ при PaO2 <8 кПа (60 мм рт. ст.), рекомендуються ефективні дози концентрації кисню (≥3 л/хв);
- лікування пероральними антикоагулянтами (варфарин, аценокумарол, ривароксабан, апіксабан, едоксабан, дабігатран) для запобігання тромбоутворенню в системі легеневої артерії — у пацієнтів з хронічною тромбоемболічною ЛГ та за наявності специфічних показань (ФП, тромбофлебіт та ін.);
- дигоксин — для лікування пацієнтів з ЛГ, у яких розвивається тахісистолічна форма ФП або при правошлуночковій СН на фоні низького серцевого викиду;
- препарати заліза за наявності анемії або дефіциту заліза;
- блокатори кальцієвих каналів (ніфедипін, дилтіазем, амлодипін) показані певній категорії пацієнтів з ЛАГ групи 1, 5 з позитивною відповіддю на гострий вазореактивний тест;
- інгаляційні простагландини або їх в/в та п/ш тривалі інфузії (ілопрост, трепростиніл, епопростанол та ін.). В Україні зареєстровано інгаляційний та в/в ілопрост);
- інгібітор фосфодіестерази-5 (силденафіл або тадалафіл);
- блокатори рецепторів ендотеліну (бозентан, амбрізентан);
- стимулятори розчинної гуанілатциклази (ріоцигуат);
- оперативне лікування (передсердна септостомія, трансплантація легень або комплексу серце — легені, тромбендартеріоектомія, балонна ангіопластика легеневих артерій).
Для досягнення ефекту лікування у пацієнтів з ЛГ помірного та високого ризику часто буває недостатньо монотерапії незалежно від класу препаратів, що застосовуються. У таких випадках є сенс використовувати комбіновану терапію як стартову, враховуючи різні точки прикладання та можливість впливати на різні ланки патоґенезу ЛГ. При цьому можливе одночасне призначення двох препаратів або додавання другого або третього лікарського засобу до попередньої терапії, яка виявилася недостатньо ефективною.
Ріоцигуат використовують як препарат вибору для лікування дорослих пацієнтів ІІ–ІІІ ФК з неоперабельною хронічною тромбоемболічною ЛГ, стійку або рецидивуючу хронічну тромбоемболічну ЛГ після хірургічного втручання. Він також може застосовуватися як монотерапія або в комбінації з антагоністами рецепторів ендотеліну для лікування дорослих пацієнтів з ЛАГ при ІІ–ІІІ ФК, особливо у випадках низької ефективності інгібіторів фосфодіестерази-5.
Призначення специфічної терапії (антагоністів кальцію, простагландинів, інгібіторів фосфодіестерази-5, блокаторів рецепторів ендотеліну та ріоцигуату) проводиться лікарями спеціалізованого центру. Алгоритм призначення медикаментозної терапії наведено нижче (схема 2).
Лікування супутніх станів (системних захворювань сполучної тканини, гепатиту, печінкової недостатності, ВІЛ-інфекції, пульмонологічних ускладнень) проводиться відповідно до чинних медико-технологічних документів.
Специфічне лікування пацієнтів з ЛГ груп 2 та 3 може призначатися лише після узгодження зі спеціалістом з лікування ЛГ, адже в більшості випадків воно може призвести до погіршення стану пацієнта.
Програма додаткових медичних послуг
Немедикаментозні методи лікування:
- психологічна терапія;
- фізична реабілітація (навчання правильному диханню, ДФН);
- дієтичні рекомендації, відмова від паління.
Хірургічне лікування
За наявності показань до хірургічного лікування пацієнт направляється на консультацію до відповідного спеціаліста.
Хірургічні методи лікування включають:
- передсердну балонну септостомію;
- анастомоз Поттса (у дітей);
- звужування легеневої артерії;
- ендартеректомію;
- балонну ангіопластику легеневих артерій;
- легеневі або комбіновані серцево-легеневі трансплантації (рідко — серце — легені — печінка).
Хірургічне лікування проводиться окремим категоріям пацієнтів з ЛГ для збільшення тривалості їхнього життя.
Характеристики очікуваних кінцевих результатів лікування
Покращення загального стану пацієнтів, збільшення дистанції при проведенні 6-хвилинного тесту на 10%, зниження ФК, відсутність погіршення симптомів ЛГ, перебування або перехід до низького ризику 1-річної смерті.
Тривалість лікування
При медикаментозному лікуванні хворі потребують постійного щоденного застосування препаратів.
Критерії якості лікування
Покращення загального стану пацієнтів, збільшення дистанції при проведенні 6-хвилинного тесту на 10%, зниження ФК, низький ризик 1-річної смерті. Покращення якості життя, збільшення терміну між госпіталізаціями. Подовження тривалості життя пацієнта з ЛГ.
Можливі побічні реакції терапії та ускладнення захворювання
Можливі побічні реакції, що відповідають фармакологічним властивостями препаратів. Ускладнення захворювання: загострення ЛГ (ознаки посилення правошлуночкової недостатності та гіпотензії); аритмії (ФП, як правило, виникає на пізніх етапах захворювання, екстрасистолія, синоатріальна блокада, міграція водія ритму по передсердях відмічаються досить часто); кровохаркання; механічні ускладнення (парез голосових зв’язок, аневризма стовбура легеневої артерії, компресія стовбура ЛКА, легеневих вен, бронхів); правошлуночкова СН.
Рекомендації щодо амбулаторного нагляду
Диспансерний нагляд проводиться за всіма пацієнтами з ЛГ для профілактики розвитку та своєчасного виявлення ускладнень. Проведення спостереження пацієнтів потребує забезпечення наступності ведення хворого лікарями закладів, які надають вторинну та третинну медичну допомогу. Досягнення позитивного результату лікування пацієнтів вимагає забезпечення тривалого лікарського спостереження із регулярним контролем виконання пацієнтом рекомендацій щодо способу життя та режиму прийому препаратів.
Обов’язкові
1. Регулярне лікарське спостереження кожні 3–6 міс.
2. Диспансерне спостереження.
3. Оцінка ризику смерті та ефективності терапії у зниженні ризику.
4. При диспансерному спостереженні проводяться:
- клінічна оцінка ФК;
- вимірювання АТ, ЧСС;
- контроль маси тіла;
- ЕКГ;
- ехоКГ (кожний рік, через 3–4 міс після початку або змін у терапії, у разі клінічного погіршення);
- контроль за прийомом специфічної терапії;
- 6-хвилинний тест (кожні 6 міс, через 3–4 міс після початку терапії, у разі клінічного погіршення) з пульсоксиметрією;
- пульсоксиметрія при кожному візиті пацієнта.
Бажані
Визначення рівня BNP або NTpro-BNP (кожні 3–6 міс, через 3–4 міс після початку або зміни терапії, у разі клінічного погіршення).
Необхідні дії лікаря у спеціалізованому консультативному центрі з діагностики та лікування ЛГ
У разі розвитку ускладнень — направлення у заклад, що надає спеціалізовану медичну допомогу.
Освітні заходи щодо способу життя
Рекомендованим є широке залучення пацієнтів з ЛГ у школи здоров’я, програми спеціалізованого медсестринського патронату. За наявності шкідливих звичок — відмова від тютюнопаління, обмеження вживання алкоголю.
Реабілітаційні заходи
Вимоги до режиму праці, відпочинку, реабілітації представлено у табл. 46.
Таблиця 46. Вимоги до режиму праці, відпочинку, реабілітації пацієнтів з ЛГ
|
№ з/п |
Положення |
|
1 |
При встановленні діагнозу ЛГ (особливо груп 1 та 4) та наявності ІІ–ІV ФК за ВООЗ хворі направляються на медико-соціальну експертну комісію у зв’язку із стійкою втратою працездатності |
|
2 |
Пацієнтам з ЛГ слід уникати вагітності |
|
3 |
Для пацієнтів з ЛГ рекомендується імунізація проти грипу та пневмококової інфекції |
|
4 |
У пацієнтів з ЛГ слід розглянути психосоціальну підтримку |
|
5 |
У пацієнтів із ФК III–IV та в осіб з напругою О2 <60 мм рт. ст. при авіаперельотах та під час перебування у високогірних районах повинно розглядатися призначення кисневої терапії |
|
6 |
Якщо можливо, то при плановій операції замість загального наркозу повинна бути використана епідуральна анестезія |
|
7 |
Пацієнтам з ЛГ не рекомендується надмірне фізичне навантаження, що призводить до симптомів стомлення |
Етапність надання медичної допомоги
Етапність надання медичної допомоги пацієнтам із ЛГ представлена у схемі 3.
Показання для направлення на консультацію до спеціалістів відповідного профілю/госпіталізація (табл. 47)
Таблиця 47. Показання для направлення на консультацію до спеціалістів відповідного профілю/госпіталізація
|
Клінічна ситуація |
Консультація/госпіталізація |
|
Необхідність термінової допомоги: |
|
|
1. Ускладнення ЛГ (легеневий гіпертензивний криз, синкопальні стани, кровохаркання та легенева кровотеча, аневризма та розрив легеневої артерії, тромбоз гілок легеневої артерії, порушення ритму та провідності, гостра правошлуночкова недостатність) 2. Погіршення функціонального стану пацієнта з ЛГ 3. Виникнення загрози життю матері або плода при вагітності |
Госпіталізація, бажано у спеціалізоване відділення |
|
Виникнення підозри щодо можливого підвищення тиску у легеневій артерії |
Консультація кардіолога та/або спеціаліста з ЛГ |
|
Наявність у пацієнта захворювань, що можуть призводити до ЛГ Невідповідність клініки основного захворювання стану пацієнта або його відсутність Виявлення при ехоКГ-дослідженні ознак ЛГ |
Консультація спеціаліста відповідно до захворювання Консультація кардіолога та/або спеціаліста з ЛГ Консультація кардіолога та/або спеціаліста з ЛГ |
Перелік фармакологічних препаратів
У табл. 48 представлено перелік лікарських засобів, показаних при ЛГ, за міжнародними непатентованими найменуваннями, а також їх дози та спосіб застосування.
Таблиця 48. Перелік фармакологічних препаратів
|
Клас |
Препарат |
Дозування |
|
Діуретики |
Фуросемід |
Табл. 40 мг або амп. 10 мг в 1 мл, призначається в дозах, що необхідні для забезпечення адекватного діурезу |
|
Торасемід |
Табл. 10 мг, 20 мг, 50 мг, 100 мг, 200 мг або амп. 10 мг в 1 мл, призначається в дозах, що необхідні для забезпечення адекватного діурезу |
|
|
Спіронолактон |
Табл. або капс. по 25–50 мг, призначається в дозі 25–50 мг 1 раз на добу |
|
|
Еплеренон |
Табл. 25 мг, 50 мг призначаються 1 раз на добу в дозі 50 мг при непереносимості спіронолактону |
|
|
Пероральні антикоагулянти |
Варфарин |
Табл. 2,5 мг, 3 мг, 5 мг, призначається в дозах, необхідних для забезпечення МНВ 2–3 |
|
Ривароксабан |
Табл. 15 або 20 мг 1 раз на добу у хворих після операцій з приводу хронічної тромбоемболічної ЛГ або непереносимості варфарину |
|
|
Аценокумарол |
Табл. 2 мг, призначається в дозах, необхідних для забезпечення МНВ 2–3 лише у хворих після операцій з приводу хронічної тромбоемболічної ЛГ або непереносимості варфарину |
|
|
Інотропні препарати |
0,5% розчин допаміну |
Р-н для ін’єкцій 0,5%, 5–25 мкг/кг/хв внутрішньовенно. Дозу титрують залежно від необхідного ефекту дії — інотропний чи вазоконстрикторний |
|
Добутамін |
Інфузійним насосом або крапельно на 5% розчині глюкози в дозі 5–20 мкг/кг/хв, внутрішньовенно; максимальна доза — 20 мкг/кг/хв |
|
|
Левосимендан |
Р-н для д/ін’єкцій 2,5 мг в 1 мл, інфузійним насосом у дозі відповідно до фази (насичувальна або підтримувальна) та маси тіла |
|
|
Дигоксин |
Табл. 0,25 мг або р-н д/ін’єкцій, в амп. 0,25 мг/мл, починають з підтримувальних доз 0,125–0,5 мг/добу в 1–2 прийоми |
|
|
Антиаритмічні препарати |
Дигоксин |
Табл. 0,25 мг або р-н д/ін’єкцій, в амп. 0,25 мг/мл, починають з підтримувальних доз 0,125—0,5 мг/добу в 1—2 прийоми |
|
Аміодарон |
Табл. 200 мг або р-р для ін’єкцій в амп. 150 мг; починають з 200 мг 3 рази на добу або ін’єкцій внутрішньовенно 300 мг до досягнення терапевтичного ефекту |
|
|
Блокатори кальцієвих каналів |
Амлодипін |
Табл. 5 та 10 мг, титрація дози, починаючи з 2,5 мг/добу до 20 мг/добу або максимально переносимої дози |
|
Ніфедипін з повільним вивільненням |
Табл. 30 або 40 мг, титрація дози з 30 мг/добу до 120–240 мг/добу або максимально переносимої дози |
|
|
Дилтіазем |
Табл. 60 мг, 90 мг, 180 мг, титрація дози з 30 мг 3 рази на добу до 240–720 мг/добу або до максимально переносимої дози |
|
|
Простагландини |
Ілопрост |
Р-н для інгаляцій в амп. 10 мкг/мл, починають з дози 2,5 мкг 6–9 разів на добу, потім дозу підвищують до 5 мкг 6–9 разів на добу |
|
Інгібітор фосфодіестерази-5 |
Силденафіл |
Табл. 20 мг. Початкова доза 20 мг 3 рази на добу. Максимальна доза — 80 мг 3 рази на добу* |
|
Тадалафіл |
Табл. 10 або 20 мг, початкова доза 5 мг 1 раз на добу, титрація до 40 мг/добу |
|
|
Стимулятори розчинної гуанілатциклази |
Ріоцигуат |
Табл. 0,5–2,5 мг, початкова доза 1 мг 3 рази на добу протягом 2 тиж із наступною титрацією по 0,5 мг 3 рази на добу протягом 2 тиж до досягнення цільової дози 2,5 мг 3 рази на добу |
|
Блокатори рецепторів ендотеліну |
Бозентан |
Табл. 62,5 мг або 125 мг, початкова доза 62,5 мг 2 рази на добу, потім через 4 тиж дозу підвищують до 125 мг 2 рази на добу |
|
Амбризентан |
Табл. 5 або 10 мг, початкова доза 5 мг 1 раз на добу, через 4 тиж доза підвищується до 10 мг 1 раз на добу |
*Високі дози призначаються лише в спеціалізованому центрі.
Інтервенційні та хірургічні методи лікування
За наявності показань до хірургічного лікування пацієнта направляють на консультацію до відповідного спеціаліста.
Хірургічні методи лікування включають:
- передсердну балонну септостомію;
- анастомоз Поттса у дітей;
- звужування легеневої артерії;
- ендартеректомію;
- балонну ангіопластику легеневих артерій;
- легеневі або комбіновані серцево-легеневі трансплантації.
Обґрунтування
Хірургічне лікування проводиться окремим категоріям пацієнтів з ЛГ для збільшення тривалості їхнього життя.
Необхідні дії
1. Оперативні втручання за показаннями проводяться після консультативного висновку спеціаліста.
2. За наявності показань до хірургічного лікування пацієнта слід направляти:
- до лікаря-хірурга серцево-судинного;
- до лікаря-трансплантолога.
Термін стаціонарного лікування при проведенні хірургічного втручання визначається індивідуально.
Стандарти надання медичної допомоги хворим із ДКМП
(В.М. Коваленко, О.Г. Несукай, С.В. Чернюк, Л.Г. Воронков, Д.В. Рябенко)
Рубрика за МКХ-10: І42.0.
Умови надання медичної допомоги
Хворі з ДКМП підлягають амбулаторному обстеженню і лікуванню за місцем проживання. Обстеження може проводитися в районних поліклініках, а за необхідності додаткових обстежень — у міських кардіологічних диспансерах і діагностичних центрах. При прогресуванні СН показано лікування в кардіологічних стаціонарах за місцем проживання.
Діагностика
Обов’язкові дослідження при первинній діагностиці
1. Визначення скарг та анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ на обох руках.
4. Дослідження лабораторних показників (загальні аналізи крові і сечі, визначення в крові глюкози, АлАТ, АсАТ, КФК загальної та МВ-фракції, білірубіну, креатиніну, загального ХС, ТГ, калію, натрію, загального білка і білкових фракцій, С-реактивного протеїну).
5. ЕКГ у 12 відведеннях.
6. ЕхоКГ в М-, В- і допплерівському режимах.
7. Рентгенографія органів грудної порожнини.
8. МРТ серця з відстроченим контрастуванням.
Додаткові дослідження
1. Коагулограма, визначення протромбінового індексу (ПТІ), МНВ.
2. НУП сироватки крові.
3. Добовий моніторинг ЕКГ.
4. Тест із 6-хвилинною ходьбою.
5. Спекл-трекінг.
6. Генетичні дослідження.
7. Лабораторні дослідження функції щитовидної залози, надниркової залози (при підозрі на ендокринну кардіоміопатію).
8. Ендоміокардіальна біопсія.
9. Диференційна діагностика дилатаційної кардіоміопатії з іншими формами кардіоміопатій здійснюється відповідно до рекомендацій ВАКУ.
Лікування
Перелік і обсяг обов’язкових медичних послуг
Хворі мають одержувати комплексну терапію систолічної СН із застосуванням:
- інгібіторів АПФ або БРА (за непереносимості інгібіторів АПФ);
- блокаторів бета-адренорецепторів — метопрололу, карведилолу, бісопрололу, небівололу, які показані всім гемодинамічно стабільним хворим за відсутності протипоказань;
- блокаторів мінералокортикоїдних рецепторів. Використовують спіронолактон або еплеренон як тимчасові діуретичні і як засоби додаткового впливу на нейрогуморальні механізми розвитку СН, що здатні поліпшувати прогноз виживання (у цьому разі в дозі 25–50 мг/добу);
- салуретиків за наявності ознак затримки рідини;
- івабрадину — пацієнтам із ІІ–ІІІ ФК з ФВ ЛШ <35% та синусовим ритмом з частотою >70/хв, які отримують стандартну (див. вище) фармакотерапію при хронічній СН, з метою зниження ризику смерті та госпіталізацій, зумовлених СН;
- дигоксину за наявності тахі- і нормосистолічного варіантів ФП (нетривало).
Перелік і обсяг додаткових медичних послуг
1. Аміодарон у хворих із симптоматичними або тяжкими шлуночковими аритміями, а також при тахісистолічній формі ФП при недостатньому ефекті інших препаратів.
2. Внутрішньовенно інотропні симпатоміметичні засоби — допамін, добутамін або інгібітори фосфодіестерази ІІІ (левосимендан) — використовують при недостатньому ефекті лікування СН тільки в умовах стаціонару, бажано із застосуванням спеціальних дозаторів.
3. Нітрати внутрішньовенно або сублінгвально — похідні нітрогліцерину або ізосорбіду динітрату за наявності ознак лівошлуночкової недостатності, з відміною після стабілізації гемодинаміки.
4. Антикоагулянти у пацієнтів із постійною формою ФП, тромбоемболічними ускладненнями в анамнезі, за наявності тромбів у порожнинах серця. Обов’язковий контроль МНВ. За неможливості визначення МНВ — визначення ПТІ.
5. Застосування комбінації сакубітрилу і валсартану для лікування резистентної СН.
6. ІКД за наявності рецидивуючої ФШ або стійкої шлуночкової тахікардії та їх резистентності до антиаритмічних препаратів.
7. Імплантація трикамерного електрокардіостимулятора (ЕКС) у режимі DDDR (у правому передсерді і правому шлуночку розміщують по два електроди — що стимулює і що сприймає) при тяжкій СН, рефрактерній до медикаментозної терапії, у хворих зі значними порушеннями внутрішньошлуночкової провідності і десинхронізацією скорочення шлуночків.
8. Трансплантація серця.
Характеристика остаточного очікуваного результату лікування
Відсутність прогресування СН, збільшення тривалості життя.
Тривалість лікування
Хворі мають потребу у щоденному застосуванні препаратів протягом невизначено тривалого періоду. Термін стаціонарного лікування визначається ступенем СН і ефектом від лікування.
Критерії якості лікування
1. Усунення або зменшення вираженості суб’єктивних симптомів СН — задишки, серцебиття, підвищеної стомлюваності.
2. Підвищення ФВ ЛШ.
3. Усунення клінічних ознак затримки рідини в організмі.
4. Підвищення якості життя.
5. Збільшення періоду між госпіталізаціями.
Можливі побічні дії та ускладнення
Можливі побічні дії препаратів — відповідно до їх фармакологічних властивостей.
Найчастіше — артеріальна гіпотензія. Проведення неадекватної антикоагулянтної терапії може спровокувати кровотечі, особливо у хворих з існуючими ураженнями травного тракту й іншими факторами ризику. У даних пацієнтів існує високий ризик тромбоемболічних ускладнень, особливо при застосуванні масивної діуретичної терапії. У групі хворих із ДКМП високий ризик аритмічної смерті.
Рекомендації щодо амбулаторного спостереження
Хворі у стані еуволемії мають перебувати під диспансерним наглядом за місцем проживання й обстежуватися не менше ніж 1 раз на 2 міс або частіше, якщо така необхідність зумовлена клінічною ситуацією.
Вимоги до дієтичних призначень і обмежень
Обмеження добового споживання рідини і хлориду натрію: <3 г/добу при доклінічній і помірній СН (<1,5 г/добу — при вираженій СН [III–IV ФК]). При надмірній масі тіла обмежується енергетична цінність їжі.
Відмова від тютюнопаління та вживання алкоголю.
Вимоги до режиму роботи, відпочинку, реабілітації
Рекомендоване обмеження фізичних навантажень відповідно до ступеня й вираженості СН. Регулярна фізична активність (повільна ходьба, фізичні вправи невисокої інтенсивності) відповідно до функціональних можливостей пацієнта (комфортний, але регулярний руховий режим). Більшість хворих потребують направлення на медико-соціальну експертну комісію у зв’язку зі стійкою втратою працездатності, яка зумовлена СН.
Стандарти надання медичної допомоги хворим із ГКМП
(В.М. Коваленко, О.Г. Несукай, С.В. Чернюк, В.Й. Целуйко)
Рубрика за МКХ-10: І42.1.
Умови надання медичної допомоги
Хворі підлягають амбулаторному обстеженню та лікуванню за місцем проживання. Обстеження може проводитися в районних поліклініках, а за необхідності додаткових обстежень — у міських кардіологічних диспансерах і діагностичних центрах. За наявності показань хворі підлягають направленню на хірургічне лікування до відповідних спеціалізованих установ. У разі неможливості хірургічного лікування при прогресуванні СН хворих направляють до кардіологічних стаціонарів за місцем проживання.
Діагностика
Обов’язкові дослідження
1. Визначення скарг і сімейного анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ.
4. Дослідження лабораторних показників (загальні аналізи крові та сечі, АлАТ, АсАТ, білірубін, креатинін, ХС, глюкоза крові, калій, натрій).
5. ЕКГ у 12 відведеннях.
6. ЕхоКГ в М-, В- і допплерівському режимах.
7. Добовий моніторинг ЕКГ.
8. Рентгенографія органів грудної порожнини.
Додаткові дослідження
1. ЕхоКГ із фізичним навантаженням з оцінкою градієнта тиску на виносному тракті ЛШ.
2. МРТ серця із відстроченим контрастуванням.
3. КВГ.
4. Генетичне тестування.
Лікування
Перелік і обсяг обов’язкових медичних послуг
1. Блокатори бета-адренорецепторів.
2. Дизопірамід за наявності показань.
3. Блокатори кальцієвих каналів (верапаміл, дилтіазем).
4. Антиаритмічна терапія (аміодарон).
Перелік і обсяг додаткових медичних послуг
1. Інгібітори АПФ (за наявності супутньої АГ або СН).
2. Оперативне лікування, міектомія або абляція за наявності показань.
3. Імплантація кардіостимулятора, а за наявності показань — кардіовертера-дефібрилятора.
Характеристика очікуваного кінцевого результату лікування
Поліпшення клінічного стану, підвищення толерантності до фізичного навантаження.
Тривалість лікування
Строки стаціонарного лікування при проведенні хірургічного втручання визначаються індивідуально, при лікуванні СН у кардіологічному стаціонарі термін лікування встановлюють індивідуально залежно від тяжкості СН і ефективності терапії.
Критерії якості лікування
1. Поліпшення клінічного стану.
2. Підвищення толерантності до фізичного навантаження.
3. Зниження частоти госпіталізацій.
4. Усунення загрозливих для життя аритмій.
5. Зниження градієнту тиску на виносному тракті ЛШ при ехоКГ-дослідженні.
Можливі побічні дії та ускладнення
Можливі побічні дії препаратів відповідно до їх фармакологічних властивостей.
Профілактика раптової кардіальної смерті (РКС)
Вірогідність РКС протягом наступних 5 років оцінюється за формулою:
І — 0,998exp (прогностичний індекс) • 100 (%),
де «прогностичний індекс» = [0,15939858 • максимальна товщина стінки ЛШ (мм)] – [0,00294271 • максимальна товщина стінки ЛШ² (мм²)] + [0,0259082 • діаметр лівого передсердя (мм)] + [0,00446131 • максимальний градієнт на виносному тракті ЛШ (мм рт. ст.)] + [0,4583082 • сімейний анамнез РКС] + [0,82639195 • пароксизми нестійкої шлуночкової тахікардії] + [0,71650361 • синкопальний стан нез’ясованого ґенезу] – [0,01799934 • вік на момент обстеження (роки)].
При 5-річному ризику РКС <4% ІКД не показана, при ризику РКС ≥4 і <6% питання про ІКД може бути розглянуто, при ризику РКС ≥6% ІКД рекомендована.
Модель не слід використовувати для оцінки ризику РКС у осіб віком молодше 16 років, професійних спортсменів та пацієнтів із хворобами накопичення.
Рекомендації щодо амбулаторного спостереження
Хворі мають перебувати під постійним диспансерним спостереженням з обстеженням не менше ніж 1 раз на рік.
Вимоги до дієтичних призначень і обмежень
При надмірній масі тіла обмежується енергетична цінність їжі. Відмова від тютюнопаління, обмеження вживання алкоголю.
Вимоги до режиму праці, відпочинку, реабілітації
Індивідуальне вирішення питання працездатності відповідно до стану пацієнта. Забороняється робота на транспорті, на висоті, обмежуються фізичні навантаження.
Стандарти надання медичної допомоги хворим із міокардитом
(В.М. Коваленко, О.Г. Несукай, С.В. Чернюк, Д.В. Рябенко)
Рубрика за МКХ-10: І40, І41, І51.4.
Умови надання медичної допомоги
Хворі з міокардитом підлягають обстеженню у спеціалізованих кардіологічних центрах, верифікація діагнозу має проводитися у стаціонарах кардіологічного профілю. Хворі з дифузним міокардитом середньої тяжкості або з тяжким перебігом мають потребу в лікуванні в кардіологічних стаціонарах за місцем проживання з обов’язковим продовженням терапії в амбулаторних умовах.
Діагностика
Обов’язкові дослідження
1. Визначення скарг і анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ.
4. Дослідження лабораторних показників (загальні аналізи крові і сечі, АлАТ, АсАТ, білірубін, креатинін, С-реактивний білок, КФК або МВ-фракція КФК, тропонін Т або I, титр антистрептолізину-О, ХС, глюкоза в крові).
5. Визначення показників імунологічного стану (антитіл до міокарда і їх титру, реакції бласттрансформації лімфоцитів, індукованих міокардом, та ін.).
6. ЕКГ у 12 відведеннях.
7. ЕхоКГ в М-, В- і допплерівському режимах.
8. Рентгенографія органів грудної порожнини.
9. МРТ серця із відстроченим контрастуванням.
Додаткові дослідження
1. Добовий моніторинг ЕКГ.
2. Спекл-трекінг ехоКГ.
3. КВГ.
4. Ендоміокардіальна біопсія (включає аналіз результатів світлової мікроскопії, імуногістохімічного дослідження, полімеразної ланцюгової реакції).
5. Визначення NT-proBNP в сироватці крові.
6. Позитронна емісійна КТ.
7. Диференційна діагностика з гострим коронарним синдромом та іншими формами ІХС проводиться згідно з відповідними рекомендаціями ВАКУ.
Лікування
Перелік і обсяг обов’язкових медичних послуг
При фульмінантному міокардиті лікування проводиться згідно з рекомендаціями ВАКУ з гострої СН. Відповідно до сучасних алгоритмів, лікування міокардиту відрізняється залежно від поширеності міокардіального ушкодження та тяжкості перебігу захворювання.
При гострому ізольованому міокардиті за відсутності ускладнень
1. Етіологічне лікування при верифікації збудника: противірусні засоби, препарати інтерферону, антибактеріальні препарати і т.п.
2. Блокатори бета-адренорецепторів.
3. Метаболічна терапія.
4. Антиаритмічні препарати за показаннями.
При гострому дифузному міокардиті
1. Етіологічне лікування при верифікації збудника: препарати інтерферону, противірусні та антибактеріальні препарати та ін.
2. Блокатори бета-адренорецепторів.
3. Інгібітори АПФ, при їх непереносимості — БРА. 4. Блокатори мінералокортикоїдних рецепторів.
5. Діуретики.
6. Антикоагулянти за наявності показань.
7. Антиаритмічні препарати за наявності показань.
8. Імуномодулююча терапія (глюкокортикоїди та імуносупресанти за наявності показань).
9. Метаболічна терапія.
10. На даному етапі також можливе застосування:
- інотропних засобів (допамін, добутамін, левосимендан) при резистентній СН;
- глюкокортикостероїдів як імуносупресорів при ідіопатичному або аутоімунному міокардиті;
- симпатоміметиків — для підтримки параметрів гемодинаміки при симптомах гострої тяжкої СН і кардіогенного шоку;
- імуноадсорбції.
При хронічному дифузному міокардиті
1. Симптоматичне лікування СН:
- блокатори бета-адренорецепторів (метопролол, карведилол, бісопролол, небіволол);
- інгібітори АПФ, при їх непереносимості — БРА;
- блокатори мінералокортикоїдних рецепторів;
- івабрадин за наявності показань;
- діуретики за наявності ознак застою рідини;
- застосування комбінації сакубітрилу і валсартану при резистентній СН.
2. Лікування та профілактика ускладнень:
- антикоагулянти за наявності показань;
- антиаритмічні препарати за наявності показань.
3. Імуномодифікуюча терапія (глюкокортикоїди та імуносупресанти за наявності показань).
4. Метаболічна терапія.
Перелік і обсяг додаткових медичних послуг
1. Санація вогнищ хронічних інфекцій.
2. Імуноадсорбція.
3. За наявності показань:
- інотропні засоби (допамін, добутамін, левосимендан) при резистентній СН;
- ІКД за наявності рецидивуючої ФШ або стійкої шлуночкової тахікардії та їх резистентності до антиаритмічних препаратів;
- імплантація трикамерного ЕКС у режимі DDDR за наявності рефрактерної до медикаментозної терапії СН, у хворих зі значними порушеннями внутрішньошлуночкової провідності і десинхронізацією скорочення шлуночків;
- трансплантація серця.
Алгоритм застосування глюкокортикоїдів у хворих з міокардитом*
Застосування глюкокортикоїдів може бути рекомендовано при тяжкому перебігу міокардиту, що характеризується появою наступних клінічних проявів (необхідна наявність не менше 4 умов із нижчеперелічених):
- зниження систолічного АТ ≤90 мм рт. ст.;
- індекс кінцево-діастолічного об’єму (ІКДО) ЛШ ≥95 мл/м² за результатами ехоКГ;
- зниження ФВ ЛШ <40% та/або зниження поздовжньої глобальної систолічної деформації (ПГСД) ЛШ ≤9,0% за результатами спекл-трекінг ехоКГ;
- наявність ≥3,0 сегментів ЛШ, уражених запальними змінами, або загального об’єму ураження ≥5,0 сегментів ЛШ (включаючи відстрочене контрастування);
- наявність епізодів нестійкої та/або стійкої шлуночкової тахікардії, ФП, АV-блокади ІІ ст. і вище;
- наявність ІІ або ІІІ ФК СН за NYHA;
- наявність антитіл до β1-адренорецептора та кардіального міозину.
До призначення курсу глюкокортикоїдної терапії хворі повинні пройти обстеження для виключення вірусних гепатитів, ВІЛ-інфекції, інфекції COVID-19, туберкульозу, цукрового діабету, патології шлунково-кишкового тракту, остеопорозу.
*Прийнятий на ХХ Національному конгресі кардіологів України і доповнений.
Термін застосування та дози
Дексаметазон 8 мг/добу в/в крапельно протягом 5 днів.
Метилпреднізолон перорально 0,25 мг/кг маси тіла на добу або преднізолон в еквівалентній дозі (0,31 мг/кг маси тіла) протягом 3 міс із подальшим зниженням дози на 1–2 мг щотижня.
Загальний термін застосування і доза можуть бути скориговані залежно від клінічної ситуації.
Контроль ефективності
Покращення толерантності до фізичного навантаження за результатами 6-хвилинного тесту.
Холтерівське моніторування ЕКГ (зменшення кількості порушень ритму і провідності).
Рентгенографія грудної порожнини (зменшення розмірів серця).
ЕхоКГ (збільшення ФВ ЛШ та поздовжньої глобальної систолічної деформації, зменшення ІКДО ЛШ).
МРТ серця (зменшення кількості сегментів, уражених запальними змінами).
Комплексне імунологічне обстеження (відсутність антитіл до β1-адренорецептора та кардіального міозину та зниження активності експресії Toll-like рецепторів 4-го типу).
Характеристика очікуваного кінцевого результату лікування
Видужання при легкому перебігу, відсутність прогресування СН, збільшення тривалості життя.
Тривалість лікування
Термін стаціонарного лікування визначається ступенем СН та ефектом від лікування. Строки амбулаторного лікування встановлюють індивідуально, залежно від поширеності і тяжкості перебігу міокардиту. Загальний термін лікування може становити до 6 міс, а при тяжкому перебігу дифузного міокардиту симптоматична терапія може проводитися протягом невизначено тривалого періоду.
Критерії якості лікування
Поліпшення загального стану. Позитивна динаміка показників лабораторних та інструментальних методів дослідження. При хронічному тяжкому дифузному міокардиті — усунення або зменшення вираженості суб’єктивних симптомів СН, підвищення ФВ ЛШ, підвищення якості життя, подовження строку між госпіталізаціями.
Можливі побічні ефекти й ускладнення
Можливі побічні дії препаратів відповідно до їх фармакологічних властивостей.
Рекомендації щодо амбулаторного спостереження
Хворі потребують спостереження протягом 6 міс після стаціонарного лікування. При хронічному дифузному міокардиті пацієнти мають перебувати на диспансерному обліку за місцем проживання й обстежуватися не менше 1 разу на 2 міс або частіше (при певній клінічній ситуації).
Вимоги до дієтичних призначень і обмежень
Повноцінне раціональне харчування; у разі виникнення СН — з обмеженням споживання рідини й кухонної солі. Відмова від тютюнопаління, обмеження вживання алкоголю.
Вимоги до режиму праці, відпочинку, реабілітації
Не рекомендуються перебування під прямими сонячними променями, переохолодження й перегрівання.
Стандарти надання медичної допомоги хворим із гострим перикардитом, хронічним констриктивним перикардитом
(В.М. Коваленко, О.Г. Несукай, С.В. Чернюк, О.А. Крикунов)
Рубрика за МКХ-10: I30, I32.
Умови надання медичної допомоги
Хворі з гострим перикардитом підлягають стаціонарному лікуванню за місцем проживання, а за наявності показань їх направляють на хірургічне лікування у відповідні спеціалізовані заклади.
Хворі на констриктивний перикардит підлягають направленню на хірургічне лікування до відповідної спеціалізованої установи.
Діагностика
Обов’язкові дослідження
1. Визначення скарг і анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ.
4. Дослідження лабораторних показників (загальний аналіз крові, ШОЕ, С-реактивний протеїн, АлАТ, АсАТ, креатинін, ХС, глюкоза в крові, калій, натрій, загальний аналіз сечі).
5. ЕКГ у 12 відведеннях.
6. ЕхоКГ в М-, В- і допплерівському режимах.
7. Рентгенографія органів грудної порожнини.
8. МРТ серця.
Додаткові дослідження
1. Добовий моніторинг ЕКГ.
2. Пункція перикарда з цитологічним дослідженням випоту.
3. КТ.
Лікування
Перелік і обсяг обов’язкових медичних послуг
1. АСК або нестероїдні протизапальні препарати.
2. Колхіцин.
3. Етіопатогенетичне лікування основного захворювання.
4. Діуретики.
Перелік і обсяг додаткових медичних послуг
1. Глюкокортикоїди.
2. Імуноглобулін в/в, анакінра, азатіоприн в певних клінічних ситуаціях.
3. Аміодарон у хворих із симптоматичними або тяжкими шлуночковими аритміями, а також при тахісистолічній формі ФП у разі недостатньої ефективності інших препаратів.
4. Перикардіоцентез при значній кількості випоту.
5. Оперативне лікування.
Характеристика очікуваного кінцевого результату лікування
Видужання, поліпшення клінічного стану.
Тривалість лікування
Строк стаціонарного лікування при проведенні хірургічного втручання визначають індивідуально.
Критерії якості лікування
Поліпшення клінічного стану хворих. Нормалізація показників крові. Позитивна динаміка показників ехоКГ і допплерівського дослідження. Підвищення толерантності до фізичного навантаження. Зникнення ознак СН.
Можливі побічні дії та ускладнення
Можливі побічні ефекти препаратів відповідно до їх фармакологічних властивостей. При проведенні перикардіоцентезу можливі специфічні ускладнення.
Рекомендації щодо амбулаторного спостереження
Хворі мають перебувати під постійним диспансерним спостереженням з обстеженням не менше 1 разу на рік.
Вимоги до дієтичних призначень і обмежень
Повноцінне харчування. За наявності симптомів СН обмеження добового споживання хлориду натрію: <3 г/добу при доклінічній і помірній СН та <1,5 г/добу при вираженій СН (ІІІ–ІV ФК). При надмірній масі тіла обмежується енергетична цінність їжі.
Відмова від тютюнопаління, обмеження вживання алкоголю.
Вимоги до режиму роботи, відпочинку, реабілітації
Обмеження фізичної активності до малорухомого рівня на період до зникнення симптомів та нормалізації рівня С-реактивного протеїну рекомендовано у неспортсменів. Спортсменам рекомендовано утриматися від занять спортом до зникнення симптомів та нормалізації результатів діагностичних тестів (С-реактивний протеїн, ЕКГ, ехоКГ).
Індивідуальне вирішення питання працездатності відповідно до стану пацієнта. Не рекомендуються перебування під прямими сонячними променями, переохолодження і перегрівання.
Стандарти надання медичної допомоги хворим з інфекційним ендокардитом
(В.М. Коваленко, О.Г. Несукай, О.А. Крикунов, С.В. Чернюк)
Рубрика за МКХ-10: І33.0.
Умови надання медичної допомоги
Хворі з інфекційним ендокардитом підлягають стаціонарному лікуванню за місцем проживання. За наявності показань пацієнтів слід направляти на хірургічне лікування у відповідні спеціалізовані установи.
Діагностика
Обов’язкові дослідження
1. Визначення скарг та анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ.
4. Дослідження лабораторних показників (загальні аналізи крові і сечі, АлАТ, АсАТ, білірубін, креатинін, глюкоза в крові, калій, натрій).
5. Посіви крові на стерильність і визначення чутливості флори до антибіотиків.
6. Коагулограма.
7. ЕКГ в 12 відведеннях.
8. ЕхоКГ в М-, В- і допплерівському режимах.
9. Рентгенографія органів грудної порожнини.
10. Консультація кардіохірурга.
Додаткові дослідження
1. Черезстравохідна ехоКГ.
2. КТ.
Лікування
Перелік і обсяг обов’язкових медичних послуг
1. Оперативне лікування.
2. Етіопатогенетична терапія: антибіотикотерапія під контролем чутливості збудника, глюкокортикостероїди і т.п.
3. Симптоматичне лікування СН.
Перелік і обсяг додаткових медичних послуг
1. Аміодарон у хворих із симптоматичними або тяжкими шлуночковими аритміями, також при тахісистолічній формі ФП у разі недостатнього ефекту інших препаратів.
2. Антикоагулянти за показаннями. Обов’язковий контроль МНВ. За неможливості встановлення МНВ — визначення ПТІ.
Характеристика очікуваного кінцевого результату лікування
Видужання, поліпшення клінічного стану, відсутність прогресування уражень клапанного апарату і СН.
Тривалість лікування
Термін стаціонарного лікування при проведенні хірургічного втручання визначають індивідуально. При лікуванні в кардіологічному стаціонарі хворі потребують щоденного застосування препаратів протягом невизначено тривалого періоду (залежно від ефективності лікування).
Критерії якості лікування
1. Поліпшення клінічного стану хворих.
2. Нормалізація показників крові.
3. Негативна гемокультура.
4. Позитивна динаміка ЕКГ, показників ехоКГ і допплерівського дослідження.
Можливі побічні дії та ускладнення
Можливі побічні ефекти препаратів відповідно до їх фармакологічних властивостей. Захворювання може ускладнюватися тромбоемболією легеневої артерії і розвитком гострої і хронічної СН.
Рекомендації щодо амбулаторного спостереження
Хворі потребують постійного диспансерного спостереження з обстеженням не менше 1 разу на рік.
Вимоги до дієтичних призначень і обмежень
Повноцінне харчування. За наявності симптомів СН — обмеження добового споживання хлориду натрію. При надмірній масі тіла обмежується енергетична цінність їжі.
Відмова від тютюнопаління, обмеження вживання алкоголю.
Вимоги до режиму роботи, відпочинку, реабілітації
Індивідуальне вирішення питання залишкової працездатності відповідно до стану пацієнта.
Стандарти надання медичної допомоги хворим із набутими вадами серця
(В.М. Коваленко, О.Г. Несукай, С.В. Чернюк)
Рубрики за МКХ-10: І05–І09; І34–І37.
Умови надання медичної допомоги
Усі хворі з вадами серця за наявності показань підлягають направленню на хірургічне лікування до відповідних спеціалізованих установ. У разі неможливості або відстрочки хірургічного лікування такі пацієнти підлягають амбулаторному обстеженню та лікуванню за місцем проживання. Обстеження може проводитися в районних поліклініках, а за необхідності додаткових обстежень — у міських кардіологічних диспансерах і діагностичних центрах. При прогресуванні СН хворих направляють у кардіологічні стаціонари за місцем проживання.
Амбулаторний контроль та стаціонарне лікування проводять до хірургічного втручання або за неможливості останнього.
Діагностика
Обов’язкові дослідження
1. Визначення скарг та анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ.
4. Дослідження лабораторних показників (загальні аналізи крові і сечі, АлАТ, АсАТ, білірубін, креатинін, ХС, глюкоза в крові, калій, натрій, С-реактивний протеїн; титри антистрептолізину-О, антигенів, ревматоїдного фактора).
5. ЕКГ в 12 відведеннях.
6. ЕхоКГ в М-, В- і допплерівському режимах.
7. Рентгенографія органів грудної порожнини.
Додаткові дослідження
1. Добовий моніторинг ЕКГ.
2. КВГ.
Лікування
Перелік і обсяг обов’язкових медичних послуг
1. Оперативне лікування вади серця за показаннями.
2. Лікування СН.
3. Антикоагулянти — у пацієнтів з постійною формою ФП, тромбоемболічними ускладненнями в анамнезі, з мітральним стенозом і протезованими клапанами серця. Обов’язковий контроль МНВ. За неможливості встановлення МНВ — визначення ПТІ.
Характеристика очікуваного кінцевого результату лікування
Поліпшення клінічного стану, підвищення толерантності до фізичного навантаження.
Тривалість лікування
Термін стаціонарного лікування при проведенні хірургічного втручання визначають індивідуально. При лікуванні СН в кардіологічному стаціонарі термін лікування встановлюють залежно від стадії СН і ефективності терапії.
Критерії якості лікування
Видужання або поліпшення клінічного стану хворих після хірургічного лікування. При консервативній терапії — відсутність прогресування СН, підвищення толерантності до фізичного навантаження, зниження частоти госпіталізації.
Можливі побічні дії та ускладнення
Можливі побічні дії препаратів відповідно до їх фармакологічних властивостей. Найбільш характерними ускладненнями є прогресування СН, легенево-судинна тромбоемболія, раптова серцева смерть.
Рекомендації щодо амбулаторного спостереження у безсимптомних пацієнтів
При тяжкій аортальній регургітації пацієнти підлягають клінічному моніторингу із проведенням ехоКГ 1 раз на рік, при вперше виявленій аортальній регургітації — 1 раз на 3–6 міс. При тяжкому аортальному стенозі безсимптомні пацієнти повинні проходити обстеження щонайменше 1 раз на 6 міс, а при помірному аортальному стенозі — 1 раз на рік. Безсимптомні пацієнти з помірною мітральною регургітацією і збереженою систолічною функцією ЛШ підлягають щорічному огляду з проведенням ехоКГ, а при тяжкій мітральній регургітації — 2 рази на рік. Безсимптомним пацієнтам із клінічно значущим мітральним стенозом необхідно проводити ехоКГ 1 раз на рік, а при помірному стенозі — 1 раз на 2–3 роки.
Вимоги до дієтичних призначень і обмежень
При надмірній масі тіла обмежується енергетична цінність їжі. Відмова від тютюнопаління, обмеження вживання алкоголю. За наявності СН — обмеження добового споживання хлориду натрію.
Вимоги до режиму роботи, відпочинку, реабілітації
За наявності СН рекомендоване обмеження фізичних навантажень відповідно до стадії СН. Регулярна фізична активність (повільна ходьба, фізичні вправи невисокої інтенсивності) відповідно до функціональних можливостей пацієнта (комфортний, але регулярний руховий режим).
Санація вогнищ хронічних інфекцій, уникання переохолоджень. Не рекомендуються робота вночі.
Індивідуальне вирішення питання працездатності відповідно до стану пацієнта.
Алгоритми ведення хворих з вадами аортального і мітрального клапана (схеми 4–8)
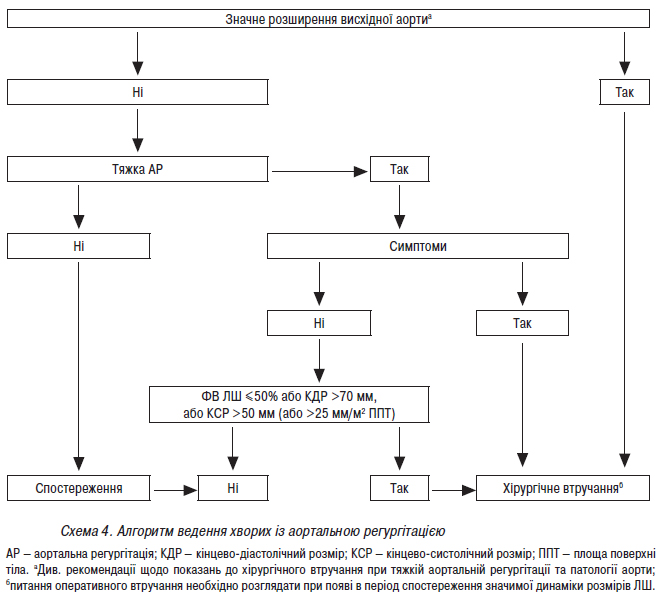
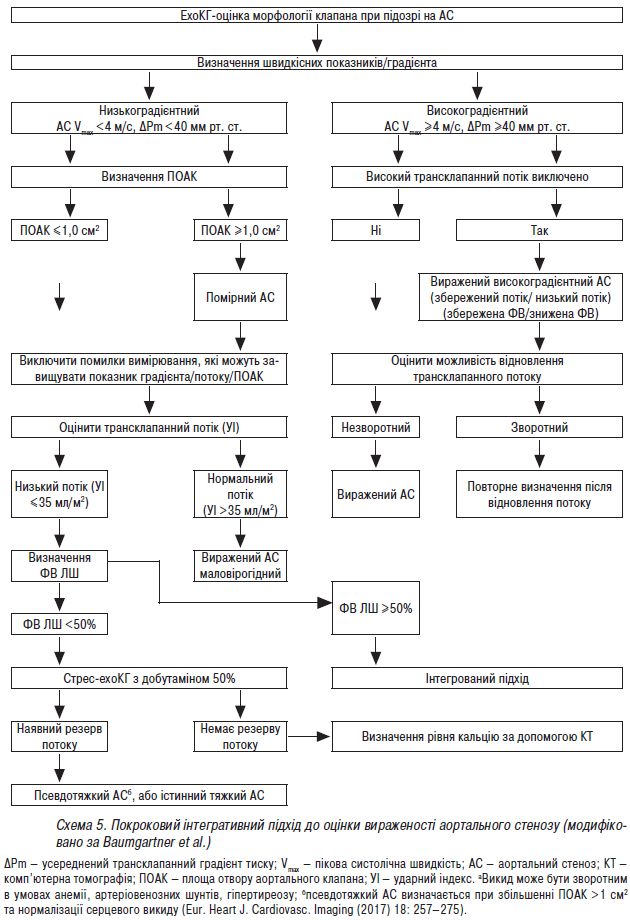
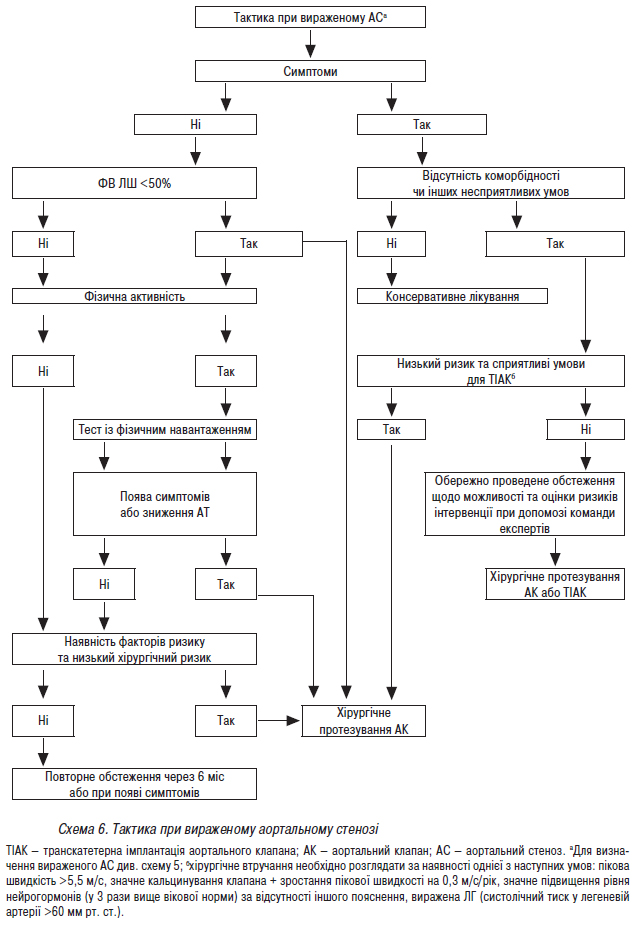
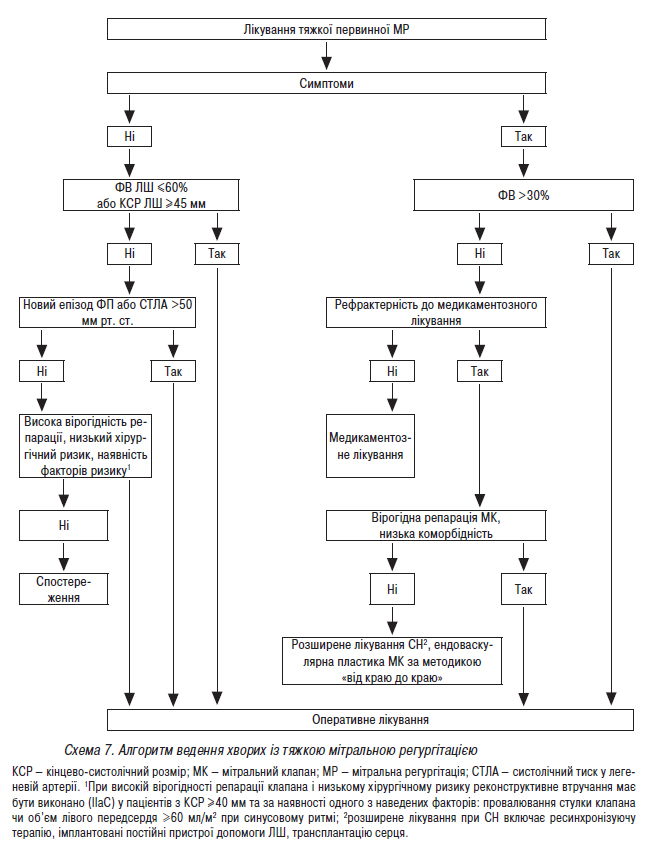
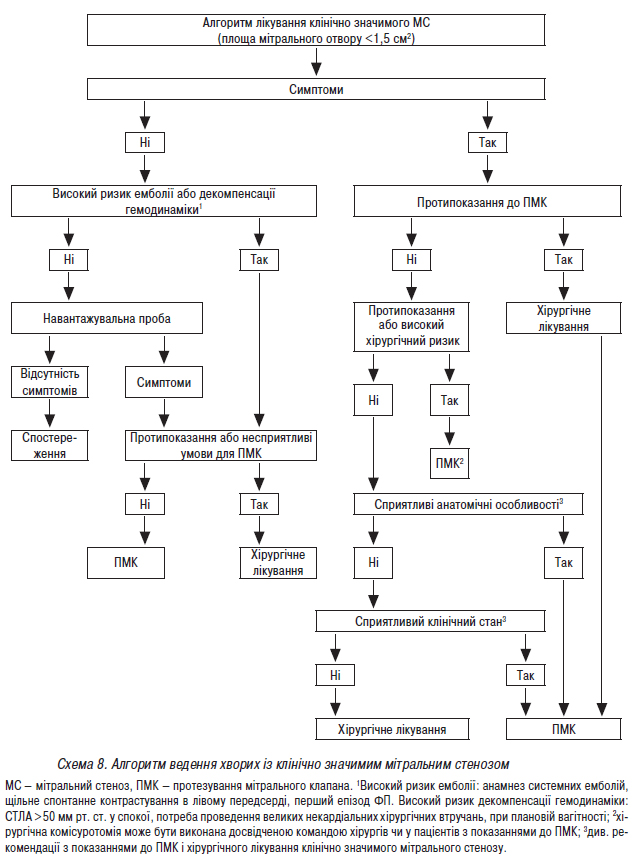
Застосування антитромботичної терапії у хворих з механічними протезами (схеми 9 і 10, табл. 49)
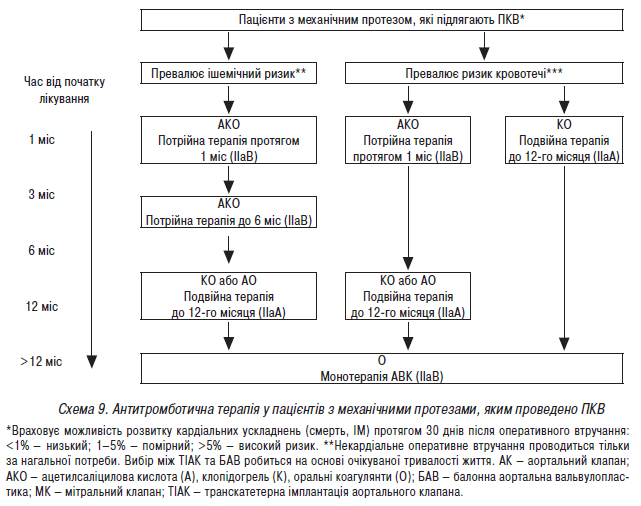

Таблиця 49. Цільові рівні МНВ у хворих з механічними протезами клапанів
|
Тромбогенність протеза* |
Фактори ризику в конкретного пацієнта** |
|
|
Відсутність факторів ризику |
Наявність одного або більше факторів ризику |
|
|
Низька |
2,5 |
3,0 |
|
Помірна |
3,0 |
3,5 |
|
Висока |
3,5 |
4,0 |
*Тромбогенність протеза: низька — Carbomedics, Medtronic Hall, ATS, St. Jude Medical, On-X, Sorin Bicarbon; помірна — інші двостулкові клапани з недостатньо вивченою тромбогенністю; висока — Lillehei-Kaster, Omniscience, Starr-Edvards, Bjork-Shiley та інші клапани з нахиленим диском. **Фактори ризику: трансплантація мітрального чи трикуспідального клапана; тромбоемболія в анамнезі; ФП; мітральний стеноз будь-якого ступеня; ФВ ЛШ <35%.
Стандарти надання медичної допомоги хворим із порушеннями ритму та провідності серця
(О.С. Сичов, А.О. Бородай, Т.В. Гетьман, В.П. Залевський, Ю.В. Зінченко, Б.Б. Кравчук, В.Г. Лизогуб, Є.В. Могильницький, О.М. Романова, Н.М. Середюк, Г.М. Соловьян, О.В. Срібна, В.К. Тащук, О.І. Фролов, М.З. Чередниченко, О.О. Ханюков)
Діагноз: НШТ
Код МКХ-10: І47.1 — НШТ.
Пароксизмальні надшлуночкові тахіаритмії становлять 4/5 загального числа тахікардій. Вони займають проміжне місце між потенційно летальними аритміями і доброякісними порушеннями серцевого ритму. Пароксизмальні НШТ мають такі характеристики: 1) раптовий початок і закінчення нападу; 2) зазвичай регулярний ритм із незначними коливаннями частоти; 3) ЧСС 100–250 уд./хв, зазвичай — 140–220 уд./хв; 4) ЧШС відповідає частоті скорочень передсердь або нижча за наявності AV-блокади; 5) комплекси QRS, як правило, вузькі, але при аберантному проведенні можуть розширюватися. Основні механізми розвитку пароксизмальних тахікардій включають re-entry, ектопічний автоматизм і тригерну активність.
Класифікація НШТ
Реципрокні:
- хронічні;
- пароксизмальні.
Вогнищеві (ектопічні):
- хронічні;
- пароксизмальні.
НШТ:
- сино-передсердна (синоатріальна);
- передсердна (атріальна);
- передсердно-шлуночкова (атріовентрикулярна);
- вузлова:
— звичайного типу;
— незвичайного типу;
- з додатковими шляхами проведення:
— ортодромна;
— антидромна.
Приклади формулювання діагнозів
Діагнози надшлуночкових аритмій не є самостійними, а мають бути включені в основний клінічний діагноз серцево-судинного захворювання. Для застосування в клінічному діагнозі пропонується використовувати варіанти клінічної класифікації порушень ритму та провідності серця Всеукраїнської асоціації кардіологів.
1. Міокардіофіброз, пароксизмальна передсердно-шлуночкова вузлова реципрокна тахікардія (звичайного типу). СН 0 стадії.
2. Синдром Вольфа — Паркінсона — Уайта, пароксизмальна передсердно-шлуночкова реципрокна ортодромна тахікардія. СН 0 стадії.
Первинна медична допомога
Первинна профілактична терапія
Положення протоколу
Хворі з НШТ підлягають амбулаторному обстеженню та лікуванню за місцем проживання. Обстеження може проводитися в районних поліклініках, а при необхідності додаткових обстежень — у міських кардіологічних диспансерах та діагностичних центрах. При необхідності відновлення ритму за неефективності амбулаторного лікування та/або при порушеннях гемодинаміки хворі підлягають госпіталізації в кардіологічний стаціонар, за відповідними показаннями — у відділення інтенсивної терапії. При рідкісних безсимптомних (зі стабільною гемодинамікою) нападах хворі потребують відновлення синусового ритму за допомогою пероральних медикаментозних засобів в амбулаторних умовах. При частих симптомних нападах відновлення ритму проводиться бригадами швидкої допомоги за допомогою внутрішньовенного введення препаратів.
Необхідні дії
Лікарю на етапі першого контакту з пацієнтами, які мають ту чи іншу форму НШТ, необхідно вирішити кілька питань:
1. Потребує даний хворий відновлення синусового ритму чи йому необхідна медикаментозна корекція ЧШС (враховується форма НШТ).
2. Оцінити безпеку відновлення ритму на догоспітальному етапі (наявність тяжких структурних уражень міокарда, захворювань щитовидної залози, наявність і тяжкість хронічної СН).
3. Якщо пацієнт потребує відновлення ритму, то це слід робити на догоспітальному етапі, або ця процедура має проводитися в плановому порядку в стаціонарі.
4. Якщо пацієнт потребує відновлення синусового ритму на догоспітальному етапі, необхідно обрати спосіб його відновлення: медикаментозна або електрична кардіоверсія, або ЕІТ (за умови наявності дефібрилятора та відповідно до компетенції лікаря загальної практики — сімейного лікаря).
Показання до відновлення синусового ритму на догоспітальному етапі
1. Пароксизм НШТ з ЧШС >250 за хв.
2. Пароксизм НШТ у поєднанні:
- з вираженою задишкою і вологими хрипами в легенях;
- артеріальною гіпотензією <90/60 мм рт. ст., спричиненою тахікардією;
- ангінозним болем, ознаками ішемії на ЕКГ (депресія ST, елевація ST, негативний зубець Т).
Показання до госпіталізації
1. Вперше виявлена НШТ.
2. Пароксизмальна НШТ, коли немає ефекту від препаратів, застосованих для відновлення ритму.
3. Пароксизмальна НШТ, що супроводжувалася розладами гемодинаміки або ішемією міокарда, яку вдалося усунути медикаментозно або за допомогою електричної кардіоверсії.
4. У разі виникнення ускладнень антиаритмічної терапії.
5. При хронічних формах НШТ госпіталізація показана при високій тахісистолії, збільшенні вираженості СН (для корекції медикаментозної терапії).
Діагностика НШТ
Ознаки та критерії діагностики захворювання
1. Мають пароксизмальний характер, раптовий початок і кінець.
2. У більшості випадків регулярний ритм з незначними коливаннями частоти.
3. ЧСС 100–250 уд./хв, зазвичай 140–220 уд./хв.
4. ЧШС відповідає частоті скорочень передсердь або менше за наявності АV-блокади.
5. Комплекси QRS вузькі, але при аберантному проведенні можуть бути широкими.
Головні механізми тахікардії такі: рі-ентрі (re-entry), ектопічний автоматизм та тригерна активність.
Положення протоколу
Обовʼязкові дослідження
1. Збір скарг та анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ.
4. Лабораторне дослідження (загальний аналіз крові та сечі, АлАТ, АсАТ, білірубін, креатинін, визначення електролітного балансу в плазмі крові, ліпідограма, ТГ, глюкоза в крові, гормони щитовидної залози (ТТГ), коагулограма).
5. ЕКГ в 12 відведеннях.
6. ЕхоКГ.
7. Проба з фізичним навантаженням (за показаннями).
8. Добовий моніторинг ЕКГ.
Додаткові дослідження
1. Електрофізіологічне дослідження (ЕФД).
2. Рентгенографія органів грудної клітки.
3. Лабораторне дослідження: гормони щитовидної залози (Т3, Т4), маркери запального процесу в міокарді.
Обґрунтування
Пароксизмальні порушення серцевого ритму — одна з найбільш гострих проблем сучасної кардіології. За даними Американської колегії кардіологів, вони щорічно забирають 300–600 тис. життів, що становить 1 смерть щохвилини. Більшість хворих — особи працездатного віку. Зазвичай до такого фатального результату, як зупинка кровообігу, призводять шлуночкова фібриляція (75%), асистолія (20%) й електромеханічна дисоціація (5%). Відносно більш сприятливий перебіг пароксизмальних порушень серцевого ритму може ускладнювати безліч захворювань. Пароксизмальні суправентрикулярні тахіаритмії становлять 4/5 загального числа тахікардій. Вони займають проміжне місце між потенційно летальними аритміями і доброякісними порушеннями серцевого ритму.
Необхідні дії
Тахікардії з вузькими комплексами QRS
Тахікардія з вузькими комплексами QRS (комплекс QRS <120 мс) може бути викликана формуванням імпульсів у синусному вузлі (синусова тахікардія), петлею re-entry у синусному вузлі або прилягаючій ділянці передсердя (синусова реципрокна тахікардія), у передсерді (передсердна тахікардія, тріпотіння та ФП, у ділянці AV-вузол — пучок Гіса (тахікардія AV-зʼєднання), а також у результаті re-entry, що виникає в AV-вузлі або в перехідній зоні по периметру AV-вузла — AV-вузлова реципрокна тахікардія або re-entry, при якому AV-вузол і пучок Гіса утворюють шлях антероградної AV-провідності, а додатковий AV-шлях забезпечує ретроградне проведення — ортодромна AV-реципрокна тахікардія. Досить часто ретельний аналіз ЕКГ у 12 відведеннях, особливо якщо вдається зареєструвати її в ході масажу каротидного синуса або іншої вагусної проби, полегшує встановлення правильного діагнозу. Правильна ідентифікація місця виникнення передсердної активності, її частоти та звʼязку зі шлуночковим ритмом має важливе значення.
Диференційна діагностика тахікардії з вузькими комплексами QRS
Пацієнтам необхідно виконати ЕКГ у 12 стандартних відведеннях у стані спокою. Виявлення синдрому передзбудження шлуночків (дельта-хвилі) на ЕКГ у пацієнтів з анамнезом пароксизмів ритмічного серцебиття досить для постановки діагнозу WPW-синдрому, і немає необхідності у реєстрації спонтанних епізодів тахікардії для призначення терапії.
Клінічний анамнез ритмічного і неритмічного серцебиття у пацієнтів із встановленим синдромом передзбудження шлуночків вказує на епізоди ФП, що вимагає проведення ЕФД, оскільки у цих пацієнтів відзначають високий ризик раптової смерті. В інших випадках діагноз встановлюють на підставі ретельного аналізу ЕКГ (у 12 відведеннях), знятої під час тахікардії.
При вузьких комплексах QRS (<120 мс) тахікардія майже завжди є надшлуночковою. Якщо відсутні зубці Р або є явні ознаки передсердної активності, а інтервали R–R однакові, то найімовірніше це AV-вузлова реципрокна тахікардія. Зубець Pʹ при AV-вузловій реципрокній тахікардії може частково ховатися всередині комплексу QRS або деформувати комплекс QRS, імітуючи псевдозубець R у відведенні V1 і/або псевдозубець S у нижніх відведеннях. Якщо зубець Pʹ виявляється на сегменті ST і відстоїть від комплексу QRS >70 мс, то швидше за все це AV-реципрокна тахікардія. Якщо при тахікардії інтервал R–P довший, ніж інтервал P–R, то найбільш імовірний діагноз — «атипова AV-вузлова реципрокна тахікардія».
У диференційній діагностиці можуть допомогти реакції тахікардії з вузькими комплексами QRS на аденозин фосфат або масаж каротидного синуса. При введенні аденозин фосфату та масажі каротидного синуса бажано проводити запис ЕКГ у 12 відведеннях. Якщо зубців Pʹ не видно, то може бути корисним використання стравохідних електродів.
Синоатріальна тахікардія виникає за механізмом re-entry з циркуляцією хвилі збудження в синоатріальній зоні (синусний вузол, міокард правого передсердя). Це напади підвищення частоти ритму з ЧСС 100–200 уд./хв, що характеризуються раптовим початком і раптовим припиненням.
Передсердна тахікардія — це порушення ритму, що виникає за механізмом ектопічного автоматизму.
Найбільше клінічне значення мають AV-вузлові реципрокні тахікардії. Електрофізіологічною основою пароксизмальною AV-вузлової тахікардії є наявність усередині вузла двох шляхів проведення, що мають різні функціональні властивості. Ці два шляхи замикають кільце циркуляції хвилі збудження. При виникненні пароксизмальної AV-вузлової тахікардії імпульс проводиться повільним шляхом до шлуночків і повертається до передсердь швидким шляхом. У звʼязку з тим, що збудження шлуночків і передсердь під час пароксизму тахікардії настає майже одночасно, на ЕКГ рідко вдається зареєструвати зубці Р. Вони, як правило, зливаються зі шлуночковими комплексами.
Пароксизмальна AV-реципрокна тахікардія за участю ДШП виникає на фоні синдромів преекзитації і розглядається як класична модель тахікардії, що має перебіг за електрофізіологічним механізмом re-entry. Синдром преекзитації полягає в тому, що під час одного серцевого циклу шлуночки збуджуються як імпульсом, проведеним із передсердь додатковим (аномальним) шляхом, так і по провідній системі, що нормально функціонує, причому при проведенні імпульсу додатковим шляхом проведення частина міокарда чи весь шлуночок збуджуються раніше, тобто передчасно.
ЕКГ-реєстрація пароксизму тахікардії є однією з найважливіших умов верифікації синдрому преекзитації та правильного вибору лікування. У той же час кардіологам нерідко доводиться виявляти клінічні випадки захворювання, коли ЕКГ-реєстрація пароксизму тахікардії утруднена з тих або інших причин. У такій ситуації обʼєктивну інформацію можна одержати з використанням неінвазивного ЕФД (черезстравохідна електрокардіостимуляція).
Пароксизм ортодромної суправентрикулярної тахікардії характеризується частими (140–250 уд./хв), позбавленими ознак преекзитації, нормальними (вузькими) комплексами QRS. У ряді випадків після комплексу QRS відмічають інвертовані зубці Р, що вказує на ретроградну активацію передсердь.
Антидромна суправентрикулярна тахікардія проявляється на ЕКГ частим регулярним ритмом (150–200 уд./хв), шлуночковими комплексами за типом максимально вираженої преекзитації (QRS >0,1 с), після яких іноді виявляються інвертовані зубці Р.
Уточнення діагнозу «пароксизмальна AV-вузлова тахікардія», як правило, вимагає застосування методу клінічного ЕФД. Найбільш корисна інформація при диференціації AV-вузлової тахікардії та реципрокної тахікардії за участю ДШП може бути отримана на черезстравохідній електрограмі при пароксизмі тахікардії. Величина інтервалу V–A за даними стравохідного відведення <100 мс у 90% випадків вказує на AV-вузлову тахікардію.
Синусові тахікардії
Синусова тахікардія визначається як підвищення частоти синусового ритму >100 уд./хв у відповідь на відповідний ступінь фізичного, емоційного, патологічного або фармакологічного стресу. Петлі re-entry можуть перебувати всередині або поруч із синусним вузлом, що призводить до так званої реципрокної синусової тахікардії, яку іноді називають синоатріальне re-entry.
Синусова тахікардія виникає в результаті нейрогуморальних впливів на пейсмейкерні клітини та морфологічних змін у самому синусному вузлі. Синусова тахікардія — непароксизмальна, що відрізняє її від інших re-entry.
Патологічна (аномальна) синусова тахікардія
Патологічна синусова тахікардія — це персистувальне підвищення ЧСС у стані спокою, що не відповідає рівню фізичного, емоційного, патологічного або фармакологічного стресу. Патологічна основа аномальної синусової тахікардії включає багато факторів, проте передбачається два основних механізми: 1) підвищений автоматизм синусного вузла; 2) порушення автономної регуляції синусного вузла з підвищенням симпатичного та зниженням парасимпатичного тонусу. Синусову тахікардію діагностують на підставі критеріїв, одержаних за допомогою неінвазивних досліджень: 1) персистируюча синусова тахікардія (ЧСС >100 уд./хв) протягом дня з надмірним підвищенням частоти пульсу у відповідь на фізичну активність і нормалізацією ЧСС у нічний час, підтверджений результатами 24-годинного холтерівського моніторування; 2) тахікардія і симптоми мають непароксизмальний характер; 3) морфологія зубця Р на ЕКГ при тахікардії ідентична такій при синусовому ритмі; 4) виключення вторинних причин (наприклад гіпертиреоз, феохромоцитома, фізична нетренованість).
Тахікардії з широкими комплексами QRS
За широкими комплексами QRS (>120 мс) важливо диференціювати НШТ від шлуночкової тахікардії. При лікуванні пацієнтів із НШТ препарати, що призначаються парентерально, особливо верапаміл або дилтіазем, є потенційно небезпечними, оскільки можуть зумовити розвиток колапсу у хворих зі шлуночковими тахікардіями. Якщо діагноз «НШТ» неможливо підтвердити або заперечити, то тахіаритмію слід розцінювати як шлуночкову тахікардію і лікувати відповідно.
Тахікардії з широкими комплексами QRS можна розподілити на 3 групи: 1) НШТ з блокадою ніжок пучка Гіса; 2) НШТ з проведенням по додатковому передсердно-шлуночковому зʼєднанню; 3) шлуночкова тахікардія.
НШТ з блокадою ніжок пучка Гіса. Блокада ніжок пучка Гіса може визначатися первинно або виникати лише під час тахікардії, коли одна з гілок пучка Гіса перебуває в рефрактерному періоді у звʼязку з частим ритмом. Блокада ніжок пучка Гіса може виникнути при будь-якій НШТ. Якщо під час ортодромної AV-реципрокної тахікардії розвивається блокада ніжок пучка Гіса, то частота тахікардії може знизитися у разі, якщо блокована ніжка пучка Гіса розміщена на тому ж боці, що й додаткове передсердно-шлуночкове зʼєднання.
НШТ з проведенням по додатковому передсердно-шлуночковому зʼєднанню. НШТ за участю додаткового передсердно-шлуночкового зʼєднання може виникнути під час передсердної тахікардії, ТП, ФП, AV-вузлової реципрокної тахікардії або антидромної AV-реципрокної тахікардії. Остання виникає при антероградному проведенні по додатковому передсердно-шлуночковому зʼєднанню і ретроградному проведенні по AV-вузлу або другому додатковому передсердно-шлуночковому зʼєднанню.
Шлуночкова тахікардія. Тахікардії з широкими комплексами QRS >120 мс можуть бути зумовлені надшлуночковими аритміями з постійним або частотнозалежним аберантним внутрішньошлуночковим проведенням, надшлуночковими аритміями з антероградним передзбудженням, а також шлуночковими аритміями. Незважаючи на запропоновані ЕКГ-критерії для диференціації НШТ з аберантним проведенням і шлуночкової тахікардії, ці відмінності можуть викликати труднощі, навіть якщо для аналізу доступні повні записи ЕКГ. ЕФД дозволяє точно діагностувати практично всі тахікардії з широкими комплексами, а також визначити послідовність і взаємозвʼязок між активацією передсердь і шлуночків. Оскільки знання механізму аритмії зазвичай має вирішальне значення для вибору належної терапії, ЕФД часто займають важливе місце в клінічній діагностиці у пацієнтів з тахікардіями з широкими комплексами.
Лікування
Положення протоколу
Обґрунтування
Невідкладна допомога
Невідкладна терапія при тахікардії з вузькими комплексами QRS
Для купірування тахікардії з вузькими комплексами QRS слід почати з вагусних прийомів (проба Вальсальви, масаж каротидного синуса), що впливають на AV-провідність. При відсутності позитивного ефекту пацієнтам зі стабільною гемодинамікою слід почати внутрішньовенне введення антиаритмічних препаратів. Препаратами вибору є аденозин фосфат або антагоністи кальцієвих каналів негідропіридинового ряду. Перевага аденозин фосфату порівняно з блокаторами кальцієвих каналів або блокаторами бета-адренорецепторів при внутрішньовенному введенні — у швидкому початку дії та короткому періоді напіввиведення. Тому найчастіше перевага надається внутрішньовенному введенню аденозин фосфату, крім пацієнтів із тяжкою формою бронхіальної астми. Надається перевага застосуванню препаратів тривалої дії (блокатори кальцієвих каналів або блокатори бета-адренорецепторів) у пацієнтів із частими передсердними або шлуночковими екстрасистолами, які є пусковим механізмом непароксизмальних НШТ. Аденозин фосфат або ЕІТ (кардіоверсія) є методом вибору у осіб з гемодинамічно значимою НШТ. Аденозин фосфат може спровокувати ФП у 1–15% випадків, що зазвичай має тимчасовий характер, але може бути загрозливою для життя у пацієнтів із синдромом передзбудження шлуночків. Необхідно дотримуватися суворої обережності при одночасному внутрішньовенному застосуванні блокаторів кальцієвих каналів і блокаторів бета-адренорецепторів, оскільки існує небезпека появи гіпотензії та/чи брадикардії. Під час виконання вагусних прийомів або ведення препаратів доцільна реєстрація ЕКГ, оскільки реакція на них може допомогти в діагностиці, навіть якщо аритмія не припинилася. Передсердна тахікардія часто нечутлива до аденозин фосфату. Трансформація в тахікардію з AV-блокадою фактично вказує на передсердну тахікардію чи ТП (залежно від інтервалу Р–Р або F–F), виключає AV-реципрокну тахікардію і робить AV-вузлову реципрокну тахікардію малоймовірною (рис. 2).
Звичайна НШТ
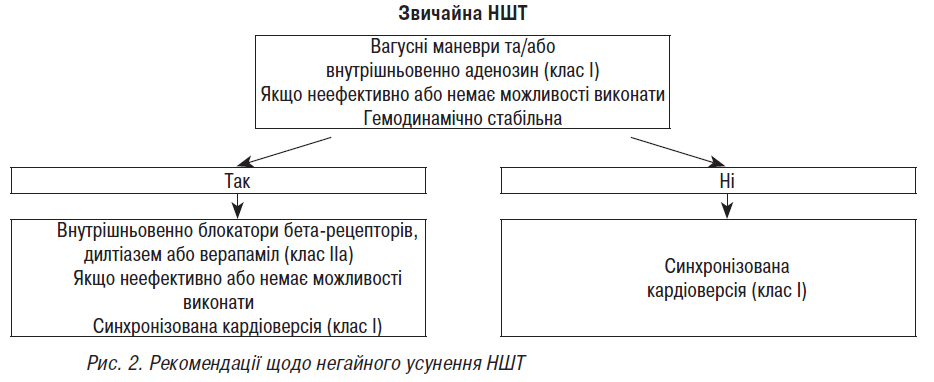
Невідкладна терапія тахікардії з широкими комплексами QRS
Алгоритм фармакотерапії
Екстрена ЕІТ показана при гемодинамічно значимих тахікардіях. Якщо тахікардія не призводить до гемодинамічних порушень і є надшлуночковою, то лікування таке ж, як і при тахікардії в вузькими комплексами QRS. Для усунення тахікардії з широкими QRS-комплексами при відсутності порушень гемодинаміки можна застосовувати прокаїнамід або соталол у парентеральних формах. Також може бути застосований аміодарон, якому надають перевагу порівняно з прокаїнамідом і соталолом при лікуванні пацієнтів зі зниженою ФВ ЛШ або ознаками СН. Для припинення тахікардії з широким комплексом QRS (ФП із проведенням по додатковому передсердно-шлуночковому зʼєднанню) рекомендується ЕІТ. Якщо у пацієнта немає гемодинамічних порушень, можна використати фармакологічну кардіоверсію з внутрішньовенним введенням ібутиліду або флекаїніду. Пацієнтам з гемодинамічно незначимою тахікардією з вузькими комплексами QRS, збереженою функцією ЛШ і нормальною ЕКГ під час синусового ритму специфічна терапія може не знадобитися. У пацієнтів з резистентністю до медикаментозної терапії або поганою її переносимістю, а також у осіб, які не бажають постійно приймати антиаритмічні препарати, за необхідності лікування необхідно зробити вибір: катетерна абляція чи медикаментозна терапія. У звʼязку з ризиком летального результату у всіх хворих із WPW-синдромом показано проведення подальшого обстеження (табл. 50).
Таблиця 50. Рекомендації щодо невідкладної допомоги при гемодинамічно стабільній НШТ
|
ЕКГ-ознаки |
Рекомендації |
Ефективність |
|
Вузький комплекс QRS |
Вагусні проби Аденозин фосфат Верапаміл, дилтіазем Блокатори бета-адренорецепторів Аміодарон Дигоксин |
Високоефективно Високоефективно Високоефективно Низькоефективно Низькоефективно Низькоефективно |
|
Тахікардії з широкими комплексами QRS: — НШТ + блокада гілки пучка Гіса — преекзитація + НШТ/ФП — тахікардії з широким комплексом QRS невизначеного походження |
Вагусні проби Аденозин фосфат Верапаміл, дилтіазем Блокатори бета-адренорецепторів Аміодарон Дигоксин Електрична кардіоверсія Прокаїнамід Флекаїнід* Ібутилід* Прокаїнамід Соталол Аміодарон Електрична кардіоверсія Лідокаїн Аденозин фосфат Блокатори бета-адренорецепторів Верапаміл |
Високоефективно Високоефективно Високоефективно Низькоефективно Низькоефективно Високоефективно Високоефективно Високоефективно Високоефективно Високоефективно Високоефективно Високоефективно Високоефективно Високоефективно Низькоефективно Низькоефективно Не показані Не показаний |
|
Тахікардії з широким комплексом QRS невизначеного походження у пацієнтів із порушеною функцією ЛШ |
Аміодарон Електрична кардіоверсія Лідокаїн |
Високоефективно Високоефективно Високоефективно |
*За умов реєстрації цього препарату в Україні.
Диспансерне спостереження
Ведення хворого на початковому етапі
У пацієнта, у якого запідозрено або виявлено НШТ, необхідно ретельно вивчити медичний анамнез. Слід вивчити дані ЕКГ у 12 відведеннях для виявлення органічної патології серця (наприклад гострого та перенесеного раніше ІМ, гіпертрофії ЛШ, блокади ніжки пучка Гіса або шлуночкового передзбудження, ознак кардіоміопатії або ішемії).
Вторинна (спеціалізована) медична допомога
Профілактика
Положення протоколу
Спеціаліст, який займається веденням пацієнта з НШТ, повинен не тільки проводити початкову оцінку його стану та призначати належне лікування, але й розробити структурований план подальшого спостереження хворого.
Нижче перераховані важливі фактори, які слід брати до уваги при подальшому спостереженні пацієнта з НШТ.
- Чи змінився профіль ризику пацієнта (наприклад при розвитку цукрового діабету або АГ)?
- Чи зменшується вираженість симптоматики пацієнта на фоні терапії; якщо ні, то чи слід визначити доцільність іншої стратегії лікування?
- Чи є будь-які ознаки проаритмії або ризик проаритмії; якщо так, то слід знизити дозу протиаритмічного засобу чи перейти до іншої стратегії лікування?
- Чи ефективний застосовуваний підхід контролю ЧСС?
На візитах подальшого спостереження слід виконувати ЕКГ у 12 відведеннях для документування ритму та ЧСС та оцінки прогресування захворювання. Для пацієнтів, які приймають протиаритмічні засоби, важливо оцінювати потенційні ЕКГ-провісники проаритмії, такі як подовження інтервалів P–R, QRS або Q–T, НШТ або паузи (випадіння одного або кількох суміжних шлуночкових комплексів, епізоди асистолії). Якщо у пацієнта відмічають погіршення симптоматики, слід оцінити доцільність проведення повторних аналізів крові, тривалої ЕКГ-реєстрації та повторних ЕКГ.
Пацієнт повинен бути повністю поінформований про переваги і недоліки різних методів лікування — протиаритмічних засобів або інтервенційного лікування.
Необхідні дії
Рекомендації з діагностики та початкового ведення НШТ.
Діагностика
Необхідні дії
Програма діагностики НШТ
1. Збір скарг та анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ.
4. Лабораторні дослідження:
- загальний аналіз крові;
- загальний аналіз сечі;
- АлАТ;
- АсАТ;
- білірубін;
- креатинін;
- ліпідограма та ТГ;
- глюкоза в крові;
- гормони щитовидної залози (Т3, Т4 вільний, ТТГ);
- коагулограма.
5. ЕКГ у 12 відведеннях.
6. ЕхоКГ.
7. Проба з фізичним навантаженням.
8. Добовий моніторинг ЕКГ та реєстрація випадків.
9. ЕФД.
10. Рентгенографія органів грудної клітки.
11. Маркери запального процесу в міокарді.
Лікування
Положення протоколу
Перелік і обсяг обовʼязкового асортименту медичних послуг
При обстеженні необхідно чітко визначити механізм аритмії. Підібрати ефективне медикаментозне лікування, визначити показання для хірургічного лікування аритмії.
Для невідкладної терапії застосовують:
- при тахікардіях за механізмом re-entry — вагусні проби, АТФ, верапаміл, дилтіазем, блокатори бета-адренорецепторів, пропафенон;
- при тахікардіях за участю ДШП — пропафенон, флекаїнід*, соталол, аміодарон;
- при тахікардіях за механізмом ектопічного вогнища — блокатори бета-адренорецепторів, верапаміл, дилтіазем, пропафенон.
*У разі реєстрації цього препарату в Україні.
Для профілактики нападів застосовують: верапаміл (ретардні форми), блокатори бета-адренорецепторів, дилтіазем, пропафенон, соталол, аміодарон.
AV-вузлова реципрокна тахікардія. Супроводжується серцебиттям, запамороченням, пульсацією в ділянці шиї і, звичайно, не повʼязана зі структурним захворюванням серця. Пульс при тахікардії, як правило, в межах 140–250 уд./хв.
Для виникнення AV-вузлової реципрокної тахікардії необхідні два функціонально та анатомічно різних канали. У більшості випадків швидкий шлях (fast pasthway) розміщується поруч із верхівкою трикутника Коха. Повільний шлях розміщений ззаду і нижче компактної частини AV-вузла і проходить вздовж септального краю фіброзного кільця тристулкового клапана на рівні або дещо вище коронарного синуса. Під час типової AV-вузлової реципрокної тахікардії повільний шлях (slow pathway) виступає у якості антероградної ділянки петлі, у той час як швидкий канал — це ретроградне коліно (тобто slow-fast re-entry AV-вузла). Рідко (5–10%) петля тахікардії має зворотний напрямок, тобто проведення здійснюється антероградно по швидкому каналу і ретроградно по вільному каналу (fast-slow re-entry AV-вузла або атипова AV-вузлова реципрокна тахікардія).
Для лікування пацієнтів із частими і стійкими нападами AV-вузлової реципрокної тахікардії, які надають перевагу постійній пероральній терапії і відмовляються від катетерної абляції, може використовуватися ряд протиаритмічних препаратів (табл. 51). Стандартна терапія включає блокатори кальцієвих каналів, блокатори бета-адренорецепторів і дигоксин. При лікуванні пацієнтів без структурної патології міокарда з резистентністю до препаратів, що сповільнюють AV-провідність, перевагу надають антиаритмічним препаратам класу IC — флекаїніду і пропафенону. У більшості випадків препарати класу III, такі як соталол або аміодарон, не застосовують; препарати класу IA — хінідин, прокаїнамід і дизопірамід використовують обмежено, оскільки вони вимагають тривалого застосування, мають помірну ефективність і володіють проаритмогенною дією (рис. 3).
Таблиця 51. Рекомендації щодо тривалої терапії зворотної AV-реципрокної тахікардії
|
Клінічні дані |
Рекомендації |
Ефективність |
|
Нестійка AV-реципрокна тахікардія з гемодинамічною нестабільністю |
Катетерна абляція Верапаміл, дилтіазем Блокатори бета-адренорецепторів Соталол, аміодарон Флекаїнід*, пропафенон |
Високоефективно Ефективно Ефективно Ефективно Ефективно |
|
Зворотна симптоматична AV-реципрокна тахікардія |
Катетерна абляція Верапаміл, дилтіазем Блокатори бета-адренорецепторів Дигоксин |
Високоефективно Високоефективно Високоефективно Низькоефективно |
|
Зворотна AV-реципрокна тахікардія, стійка до блокаторів бета-адренорецепторів, блокаторів кальцієвих каналів і у пацієнтів, які не бажають проводити радіочастотну абляцію |
Флекаїнід*, пропафенон Соталол, аміодарон |
Ефективно Низькоефективно |
|
Нечасті або поодинокі епізоди AV-реципрокної тахікардії у пацієнтів, які бажають повного контролю аритмії |
Катетерна абляція |
Високоефективно |
|
Пароксизмальна суправентрикулярна тахікардія, яка проявляється лише двоспрямованим проведенням по AV-вузлу, зареєстрована при ЕФД, і відсутні будь-які інші ознаки аритмії |
Верапаміл, дилтіазем Блокатори бета-адренорецепторів Флекаїнід*, пропафенон Катетерна абляція |
Високоефективно Ефективно Ефективно Високоефективно |
|
Повільна стійка AV-вузлова реципрокна тахікардія |
Без лікування Вагусні проби Верапаміл, дилтіазем Блокатори бета-адренорецепторів у таблетках Катетерна абляція |
Високоефективно Високоефективно Високоефективно Ефективно Високоефективно |
*У разі реєстрації цього препарату в Україні.
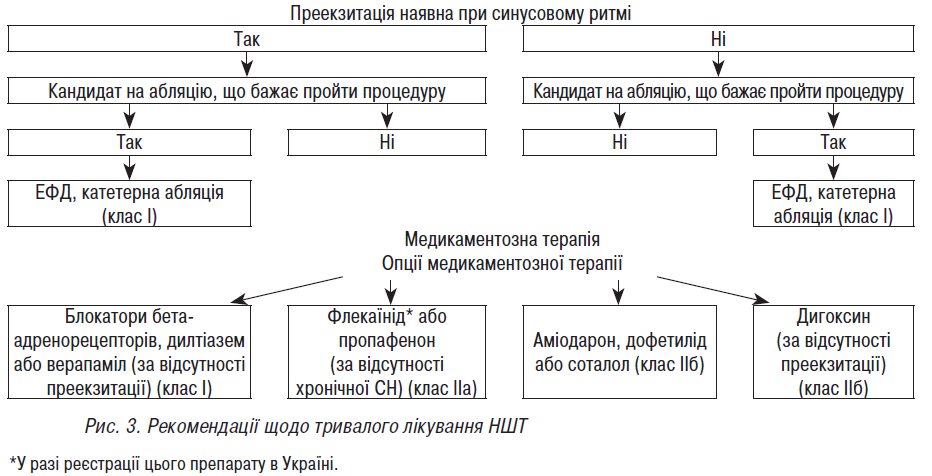
AV-реципрокна тахікардія (додаткові передсердно-шлуночкові зʼєднання). WPW-синдром діагностують у пацієнтів за наявності поєднання синдрому передзбудження шлуночків з тахіаритмією. Серед пацієнтів із WPW-синдромом найпоширеніша аритмія — AV-реципрокна тахікардія, що становить 95% реципрокних тахікардій за участю додаткового передсердно-шлуночкового зʼєднання.
AV-тахікардія за механізмом re-entry поділяється на ортодромну й антидромну AV-реципрокну тахікардію. Під час ортодромної AV-реципрокної тахікардії імпульси проводяться антероградно по AV-вузлу і спеціалізованій провідній системі з передсердя в шлуночки, а ретроградно — із шлуночків на передсердя по додатковому передсердно-шлуночковому зʼєднанню. Під час антидромної AV-реципрокної тахікардії імпульси йдуть у зворотному напрямку з антероградним проведенням з передсердь у шлуночки через додаткове передсердно-шлуночкове зʼєднання та ретроградним проведенням через AV-вузол або друге додаткове передсердно-шлуночкове зʼєднання. Антидромну AV-реципрокну тахікардію виявляють лише у 5–10% пацієнтів з WPW-синдромом. Тахікардії з передзбуженням шлуночків можуть виникати й у осіб з передсердною тахікардією, ТП, ФП або AV-вузловою реципрокною тахікардією, при цьому додатковий шлях виступає в якості «свідка» (тобто не є критичною частиною кола тахікардії).
ФП є життєво небезпечною для пацієнтів із WPW-синдромом. Якщо додатковий шлях має короткий антероградний рефрактерний період, то проведення імпульсів на шлуночки з високою частотою під час ФП може призвести до ФШ. У близько 1/3 пацієнтів із WPW-синдромом відзначають ФП. Додаткові передсердно-шлуночкові зʼєднання відіграють патофізіологічну роль у розвитку ФП у цієї категорії хворих; більшість із них — особи молодого віку без структурної патології серця. AV-реципрокна тахікардія з високою частотою ритму може відігравати певну роль в індукції ФП. Хірургічні методи лікування та катетерна абляція додаткових шляхів здатні усунути ФП так само, як і AV-реципрокну тахікардію.
Медикаментозна антиаритмічна терапія може використовуватися при лікуванні аритмій за участю додаткового передсердно-шлуночкового зʼєднання, проте катетерна абляція стала методом вибору при лікуванні цих аритмій (табл. 52). До антиаритмічних препаратів, що безпосередньо модифікують проведення по AV-вузлу, належать дигоксин, верапаміл, блокатори бета-адренорецепторів, аденозин фосфат і дилтіазем. Протиаритмічні препарати, що пригнічують проведення через додатковий шлях, включають препарати I класу, такі як прокаїнамід, дизопірамід, пропафенон і флекаїнід, а також препарати III класу — ібутилід (у разі реєстрації цього препарату в Україні), соталол й аміодарон (див. рис. 3).
Лікування при аномальній синусовій тахікардії в основному симптоматичне (табл. 53). Блокатори бета-адренорецепторів можуть бути ефективними і мають призначатися як терапія першої лінії більшості пацієнтам із цією тахікардією. Можна вважати, що блокатори кальцієвих каналів, такі як верапаміл і дилтіазем, також ефективні.
Модифікація синусного вузла методом катетерної абляції потенційно може бути використана при лікуванні більшості рефрактерних випадків аномальної синусової тахікардії. Можливими ускладненнями процедури катетерної абляції є перикардит, ушкодження діафрагмального нерва, деструкція синусного вузла з необхідністю імплантації системи постійної електрокардіостимуляції.
Таблиця 52. Рекомендації щодо тривалої терапії пацієнтів з аритмією за наявності ДШП
|
Вид аритмії |
Рекомендації |
Ефективність |
|
WPW-синдром (преекзитація і симптоматичні аритмії), що добре переносяться |
Катетерна абляція Флекаїнід*, пропафенон, соталол, аміодарон Блокатори бета-адренорецепторів Верапаміл, дилтіазем, дигоксин |
Високоефективно Ефективно Низькоефективно Не показано |
|
WPW-синдром (із ФП і AV-реципрокною тахікардією, що швидко проводиться або погано переноситься (без преекзитації) |
Катетерна абляція Флекаїнід*, пропафенон, соталол, аміодарон Блокатори бета-адренорецепторів Верапаміл, дилтіазем, дигоксин |
Високоефективно Ефективно Низькоефективно Не показано |
|
Поодинокі або нечасті епізоди AV-реципрокної тахікардії (без преекзитації) |
Терапію не проводити Вагусні проби Верапаміл, дилтіазем Блокатори бета-адренорецепторів Катетерна абляція Соталол, аміодарон Флекаїнід*, пропафенон Дигоксин |
Високоефективно Високоефективно Високоефективно Ефективно Ефективно Низькоефективно Низькоефективно Не показано |
|
Преекзитація асимптоматична |
Терапію не проводити Катетерна абляція |
Високоефективно Ефективно |
*У разі реєстрації цього препарату в Україні.
Таблиця 53. Рекомендації щодо лікування синусової тахікардії
|
Методи терапії |
Рекомендації |
Ефективність |
|
Медикаментозний (неінвазивний) |
Блокатори бета-адренорецепторів Верапаміл, дилтіазем |
Високоефективно Ефективно |
|
Інвазивний |
Катетерна абляція — модифікація/усунення синусного вузла |
Низькоефективно |
Вогнищева (фокусна) AV-вузлова тахікардія. Відмінна риса вогнищевих вузлових тахікардій — їх походження з AV-вузла або пучка Гіса. До ЕКГ-ознак вогнищевої вузлової тахікардії належать ЧСС 110–250 уд./хв, вузькі комплекси QRS або морфологія типової блокади ніжок пучка Гіса. Часто відзначається AV-дисоціація, хоча транзиторно може виявлятися ретроградне проведення у співвідношенні 1:1. Вважається, що електрофізіологічним механізмом такої аритмії є або порушення автоматизму або тригерна активність, зумовлені бета-адренергічною стимуляцією і блокадою кальцієвих каналів.
Непароксизмальна вузлова тахікардія. Непароксизмальна вузлова тахікардія — доброякісна форма аритмії, що характеризується тахікардією з вузькими комплексами з ЧСС 70–120 уд./хв, механізми аритмії — підвищення автоматизму з верхніх відділів AV-вузла або тригерний механізм. Тахікардія має період розігріву й охолодження і не може бути купірувана при електричній стимуляції. Характерною рисою цієї форми тахікардії є те, що вона може бути проявом серйозного патологічного стану, такого як дигіталісна інтоксикація, стан після операції на серці, гіпокаліємія або ішемія міокарда. Часто ця тахікардія розвивається при ХОЗЛ з гіпоксією та при міокардиті. У деяких випадках, особливо при інтоксикації препаратами наперстянки, може зʼявлятися антероградна AV-блокада з періодами Самойлова — Венкебаха.
Основний принцип лікування при непароксизмальній вузловій тахікардії — корекція основної патології (табл. 54). Персистувальна вузлова тахікардія може бути купірувана застосуванням блокаторів бета-адренорецепторів або блокаторів кальцієвих каналів.
Таблиця 54. Рекомендації щодо лікування при синдромах ектопічної і непароксизмальної вузлової тахікардії
|
Тахікардія |
Рекомендації |
Ефективність |
|
Ектопічна вузлова тахікардія |
Блокатори бета-адренорецепторів Флекаїнід* Пропафенон Соталол Аміодарон Катетерна абляція |
Ефективно Ефективно Ефективно Ефективно Ефективно Ефективно |
|
Непароксизмальна вузлова тахікардія |
Усунення інтоксикації препаратами наперстянки Корекція гіпокаліємії Лікування ішемії міокарда Блокатори бета-адренорецепторів Блокатори кальцієвих каналів |
Високоефективно Високоефективно Високоефективно Ефективно Ефективно |
*У разі реєстрації цього препарату в Україні.
Перелік медичних послуг додаткового асортименту
1. У хворих старшого віку з ознаками ІХС при велоергометрії рекомендовано проведення КВГ.
2. Імплантація кардіостимулятора у відповідному режимі за наявності супутніх порушень AV-провідності та СССВ.
3. Катетерне лікування при:
- неефективності медикаментозної терапії, що проводиться в адекватних дозах;
- аритмогенної дії антиаритмічних препаратів;
- нападах НШТ з погіршенням гемодинаміки;
- поєднанні ФП із синдромом передчасного збудження шлуночків.
4. Пацієнти потребують адекватного лікування супутніх захворювань, АГ, уражень щитовидної залози та цукрового діабету.
Третинна (високоспеціалізована) медична допомога
Профілактика
Положення протоколу
Спеціаліст, який займається веденням пацієнта з НШТ, повинен не тільки проводити початкову оцінку його стану та призначати належне лікування, але й розробити структурований план подальшого спостереження хворого.
Нижче перераховані важливі фактори, які слід брати до уваги при подальшому спостереженні пацієнта з НШТ.
- Чи змінився профіль ризику пацієнта (наприклад при розвитку цукрового діабету або АГ, яких раніше не було)?
- Чи зменшується вираженість симптоматики у пацієнта на фоні терапії; якщо ні, то чи слід визначити доцільність застосування іншої стратегії лікування?
- Чи є будь-які ознаки проаритмії або ризик проаритмії; якщо так, то слід знизити дозу протиаритмічного засобу чи перейти до іншої стратегії лікування?
- Чи ефективний застосовуваний підхід контролю ЧСС?
На візитах подальшого спостереження слід виконувати ЕКГ у 12 відведеннях для документування ритму та ЧСС й оцінки прогресування захворювання. Для пацієнтів, які приймають протиаритмічні засоби, важливо оцінювати потенційні ЕКГ-провісники проаритмії, такі як подовження інтервалів P–R, QRS або Q–T, НШТ або паузи (випадіння одного або кількох суміжних шлуночкових комплексів, епізоди асистолії). Якщо у пацієнта відмічають погіршення симптоматики, слід визначити доцільність проведення повторних аналізів крові, тривалої ЕКГ-реєстрації та повторних ЕКГ.
Пацієнт повинен бути повністю поінформований про переваги й недоліки різних методів лікування — протиаритмічних засобів або інтервенційного лікування.
Необхідні дії
Рекомендації з діагностики та початкового ведення НШТ.
Діагностика
Програма діагностики НШТ
1. Збір скарг та анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ.
4. Лабораторні дослідження:
- загальний аналіз крові;
- загальний аналіз сечі;
- АлАТ;
- АсАТ;
- білірубін;
- креатинін;
- ліпідограма та ТГ;
- глюкоза в крові;
- гормони щитовидної залози (Т3, Т4 вільний, ТТГ);
- коагулограма.
5. ЕКГ у 12 відведеннях.
6. ЕхоКГ.
7. Проба з фізичним навантаженням.
8. Добовий моніторинг ЕКГ та реєстрація випадків.
9. ЕФД.
10. Рентгенографія органів грудної клітки.
11. Маркери запального процесу в міокарді.
Лікування
Положення протоколу
1. Хворі повинні отримувати комплексну терапію (табл. 55) із застосуванням антиаритмічних препаратів, препаратів для профілактики ремоделювання серця (інгібітори АПФ/БРА).
2. Радіочастотна катетерна абляція.
3. За наявності пацієнти потребують адекватного лікування супутніх хвороб (ІХС, АГ, уражень щитовидної залози, цукрового діабету або інших соматичних захворювань.
4. Імплантація кардіостимулятора у відповідному режимі за наявності супутніх порушень AV-провідності та СССВ.
Таблиця 55. Антиаритмічні лікарські засоби для лікування НШТ
|
Антиаритмічний препарат (за класифікацією Вогана — Вільямса) |
Пероральна доза, мг/добу1 |
Часті або важливі прояви побічної дії |
Показання |
Протипоказання та застереження |
|
Прокаїнамід (IA) |
1000–2000 |
Висип, міалгія, васкуліт, гіпотензія, вовчак, агранулоцитоз, брадикардія, подовження інтервалу Q–T, TdP |
AV-вузлова реципрокна тахікардія, AV-реципрокна тахікардія (додаткові передсердно-шлуночкові зʼєднання) |
Тяжкий СССВ (крім наявності ШВРС); тяжке порушення AV-провідності (крім наявності ШВРС); тяжке порушення внутрішньошлуночкової провідності; перенесений ІМ; ІХС; СН; знижена ФВ ЛШ; синдром Бругада |
|
Дизопірамід* (IA) |
250–750 |
Негативний інотропний ефект, подовження QRS, AV-блокада, проаритмія (ТП, мономорфна ШТ, періодична TdP), антихолінергічний ефект |
AV-вузлова реципрокна тахікардія, AV-реципрокна тахікардія (додаткові передсердно-шлуночкові зʼєднання) |
Тяжкий СССВ (крім наявності ШВРС); тяжке порушення AV-провідності (крім наявності ШВРС); тяжке порушення внутрішньошлуночкової провідності; перенесений ІМ; ІХС; СН; знижена ФВ ЛШ; гіпотензія |
|
Хінідин (IA) |
600–800 |
Нудота, діарея, порушення слуху та зору, сплутаність свідомості, гіпотензія, тромбоцитопенія, гемолітична анемія, анафілаксія, подовження комплексу QRS та інтервалу Q–T, TdP |
AV-вузлова реципрокна тахікардія |
Тяжкий СССВ (крім наявності ШВРС); тяжке порушення AV-провідності (крім наявності ШВРС); тяжке порушення внутрішньошлуночкової провідності; перенесений ІМ; ІХС; СН; знижена ФВ ЛШ; гіпотензія; спадковий LQTS; одночасна терапія, повʼязана з подовженням інтервалу Q–T |
|
Флекаїнід (IC) |
200–300 |
Негативний інотропний ефект, розширення комплексу QRS, AV-блокада, синусова брадикардія, проаритмія (ТП, мономорфна ШТ, періодична TdP) |
AV-вузлова реципрокна тахікардія, вогнищева AV-вузлова тахікардія, AV-реципрокна тахікардія (додаткові передсердно-шлуночкові зʼєднання) |
Дисфункція синусного вузла (крім наявності ШВРС); ФП/ТП (без одночасного застосування блокаторів бета-адренорецепторів); тяжке порушення AV-провідності (крім наявності ШВРС); тяжке порушення внутрішньошлуночкової провідності); перенесений ІМ; ІХС; СН; знижена ФВ ЛШ; синдром Бругада; спадковий LQTS; одночасна терапія, повʼязана з подовженням інтервалу Q–T |
|
Пропафенон (IC) |
450–900 |
Негативний інотропний ефект, порушення з боку шлунково-кишкового тракту, подовження комплексу QRS, AV-блокада, синусова брадикардія, проаритмія (ТП, мономорфна ШТ, періодична TdP) |
AV-вузлова реципрокна тахікардія, вогнищева AV-вузлова тахікардія, AV-реципрокна тахікардія (додаткові передсердно-шлуночкові зʼєднання) |
Тяжка синусова брадикардія та СССВ (крім наявності ШВРС); ФП/ТП (без одночасного застосування блокаторів бета-адренорецепторів); тяжке порушення AV-провідності (крім наявності ШВРС); тяжке порушення внутрішньошлуночкової провідності); ІМ; ІХС; СН; знижена ФВ ЛШ; синдром Бругада; спадковий LQTS; одночасна терапія, повʼязана з подовженням інтервалу Q–T |
|
Блокатори бета-адренорецепторів (II) |
Різна |
Бронхоспазм, гіпотензія, синусова брадикардія, AV-блокада, депресія, сексуальні розлади |
AV-вузлова реципрокна тахікардія, вогнищева AV-вузлова тахікардія, непароксизмальна вузлова тахікардія |
Тяжка синусова брадикардія та СССВ (крім наявності ШВРС); гостра фаза ІМ (уникати при брадикардії, гіпотензії, недостатності ЛШ); декомпенсована СН |
|
Аміодарон (III) |
200–400 |
Легеневий фіброз, гіпотиреоїдизм та гіпертиреоїдизм, нефропатія, відкладення на рогівці, фоточутливість, знебарвлення шкіри, гепатотоксичність, синусова брадикардія, подовження інтервалу Q–T та періодична TdP |
AV-вузлова реципрокна тахікардія, вогнищева AV-вузлова тахікардія, AV-реципрокна тахікардія (додаткові передсердно-шлуночкові зʼєднання) |
Захворювання та одночасне лікування, повʼязане з подовженням інтервалу Q–T; спадковий LQTS; синусова брадикардія (крім випадків зупинки серця); СССВ (крім наявності ШВРС); тяжке порушення AV-провідності (крім наявності ШВРС); декомпенсована СН або кардіоміопатія |
|
Соталол (III) |
160–320 |
Як і для інших блокаторів бета-адренорецепторів, а також при TdP |
AV-вузлова реципрокна тахікардія, вогнищева AV-вузлова тахікардія, AV-реципрокна тахікардія (додаткові передсердно-шлуночкові зʼєднання) |
Тяжка синусова брадикардія та СССВ (крім наявності ШВРС); порушення AV-провідності (крім наявності ШВРС); тяжка СН; спадковий LQTS; одночасна терапія, повʼязана з подовженням інтервалу Q–T |
|
Дофетилід* (III) |
1000 мкг/добу |
Подовження інтервалу Q–T та періодична TdP |
AV-вузлова реципрокна тахікардія |
Тяжка синусова брадикардія та СССВ (крім наявності ШВРС); порушення AV-провідності (крім наявності ШВРС); тяжка СН; одночасна терапія, повʼязана з подовженням інтервалу Q–T |
|
Верапаміл (IV) |
240–480 |
Негативний інотропний ефект (у пацієнтів зі зниженою ФВ ЛШ), гіпотензія, синусова брадикардія, AV-блокада, висип, порушення з боку шлунково-кишкового тракту |
AV-вузлова реципрокна тахікардія, вогнищева AV-вузлова тахікардія, непароксизмальна вузлова тахікардія |
Тяжка синусова брадикардія та СССВ (крім наявності ШВРС); тяжке порушення AV-провідності (крім наявності ШВРС); ІМ у гострій фазі (за винятком брадикардії, гіпотензії, недостатності ЛШ); СН; знижена ФВ ЛШ; ТП/ФП, повʼязані з додатковими шляхами проведення |
|
Дилтіазем (IV) |
180–360 |
Гіпотензія, синусова брадикардія, AV-блокада, негативний інотропний ефект |
AV-вузлова реципрокна тахікардія, вогнищева AV-вузлова тахікардія, непароксизмальна вузлова тахікардія |
Тяжка синусова брадикардія та СССВ (крім наявності ШВРС); тяжке порушення AV-провідності (крім наявності ШВРС); ІМ у гострій фазі (за винятком брадикардії, гіпотензії, недостатності ЛШ); СН; знижена ФВ ЛШ; ТП/ФП, повʼязані з додатковими шляхами проведення |
*У разі реєстрації препарату в Україні; 1у таблиці зазначено дозування для дорослих; LQTS — синдром подовженого інтервалу Q–T; TdP — torsades de pointes (веретеноподібна ШТ).
Радіочастотна катетерна абляція
Частота випадків раптової смерті серед пацієнтів із WPW-синдромом коливається в межах 0,15–0,39% протягом періоду динамічного спостереження від 3 до 10 років. Майже в половині випадків зупинка серця у пацієнтів з WPW-синдромом є першим проявом AV-реципрокної тахікардії. З метою запобігання розвитку ФП у пацієнтів з WPW-синдромом і ризиком раптової смерті в результаті ФП має значення проведення катетерної абляції. У дослідженнях пацієнтів з WPW-синдромом, що перенесли зупинку серця, ретроспективно визначили ряд критеріїв, за допомогою яких можна виявити пацієнтів з підвищеним ризиком раптової смерті. До них належать: 1) укорочений R–R <250 мс при передзбудженні шлуночків під час спонтанної чи індукованої ФП; 2) симптоматична тахікардія в анамнезі; 3) множинні додаткові шляхи; 4) аномалія Ебштейна.
Результати катетерної абляції
Найпоширеніші НШТ: АV-вузлова реципрокна тахікардія — ефективність 96–97%, частота рецидивів 5%; АV-реципрокна тахікардія/ДШП — ефективність 93%, частота рецидивів 8%. Менш поширені НШТ: фокальна передсердна тахікардія — ефективність 80–100%, частота рецидивів 4–27%.
Рекомендації асимптоматичним пацієнтам з преекзитацією (IIa, B)
1. Проведення ЕФД є доцільним в асимптоматичних пацієнтів з преекзитацією для стратифікації ризику аритмогенних подій.
2. Катетерна абляція ДШП доцільна у асимптоматичних пацієнтів з преекзитацією, якщо ЕФД виявило високий ризик виникнення аритмогенних подій, включаючи ФП, що часто проводиться через ДШП.
3. Катетерна абляція ДШП доцільна в асимптоматичних пацієнтів, якщо наявність преекзитації заважає специфічній трудовій діяльності (пілоти, професійні спортсмени).
Характеристика кінцевого очікуваного результату лікування
Відсутність нападів аритмії, що супроводжуються падінням гемодинаміки, зменшення кількості та тривалості пароксизмів. Зниження ЧШС під час тахікардії.
Тривалість лікування
При нападах показана терапія для відновлення синусового ритму. При нападах, що супроводжуються зниженням гемодинаміки, хворим показано хірургічне лікування аритмії. При неефективному хірургічному лікуванні показаний постійний прийом препаратів. Хворі після хірургічного лікування не потребують антиаритмічної терапії.
Критерії якості лікування
Відсутність або суттєве зменшення кількості та тривалості пароксизмів тахікардії, повна відсутність нападів аритмії, що супроводжуються зниженням гемодинаміки. Зниження ЧШС під час тахікардії. Нормальна толерантність до буденних фізичних навантажень.
Можливі побічні дії та ускладнення
Можливі побічні дії й ускладнення внаслідок прийому препаратів згідно з їх фармакологічними властивостями. Після хірургічного лікування не виключені рецидиви аритмії, які потребують повторних втручань, та порушення провідності.
Рекомендації щодо подальшого надання медичної допомоги
Хворі, що отримують медикаментозну терапію, повинні знаходитися на диспансерному спостереженні за місцем проживання. Обовʼязкові щорічне обстеження та корекція терапії. Після катетерних абляцій хворі повторно обстежуються через 3 міс.
Вимоги до дієтичних призначень і обмежень
Хворі повинні отримувати дієту з обмеженням солі в разі схильності до гіпертензії, при підвищеному рівні ХС обмежується споживання продуктів з високим вмістом тваринних жирів. При надмірній масі тіла обмежується калорійна цінність їжі. Обмеження вживання алкоголю.
Вимоги до режиму праці, відпочинку, реабілітації
За наявності частих пароксизмів та гемодинамічно значимих пароксизмів хворі потребують направлення на медико-соціальну експертну комісію для вирішення питання про можливість продовжувати професійну діяльність.
Шлуночкові порушення ритму
Класифікація шлуночкових аритмій (табл. 56).
Таблиця 56. Клінічна систематизація шлуночкових порушень ритму
|
Критерії систематизації |
Систематизація |
|
І. Кількість, морфологія і градація шлуночкової екстрасистолії [Lown B., 1971] |
I — поодинокі шлуночкові екстрасистолії (<30 на годину) ІІ — часті мономорфні шлуночкові екстрасистолії (>30 на годину) ІІІ — поліморфні шлуночкові екстрасистолії IVa — парні шлуночкові екстрасистолії IVb — «пробіжки» ШТ V — ранні («R на T») шлуночкові екстрасистолії |
|
ІІ. Тривалість пароксизму ШТ |
|
|
ІІІ. Характер змін ЕКГ під час пароксизму ШТ |
|
|
IV. Прогностичне значення шлуночкових аритмій |
|
Приклади формулювання діагнозів
Діагнози шлуночкових аритмій не є самостійними, а мають бути включені в основний клінічний діагноз серцево-судинного захворювання. Для застосування в клінічному діагнозі пропонується використовувати варіанти клінічної класифікації порушень ритму та провідності серця Всеукраїнської асоціації кардіологів.
Скринінг пацієнтів із шлуночковою аритмією
1. Анамнез хвороби.
2. Клінічний огляд.
3. Лабораторне дослідження: загальний аналіз крові, загальний аналіз сечі, АлАТ, АсАТ, білірубін, креатінін, визначення електролітного балансу в плазмі крові, глюкоза, гормони щитовидної залози, ревмопроби.
4. Неінвазивні та інвазивні дослідження (табл. 57, 58, схема 11).
Таблиця 57. Неінвазивне дослідження пацієнтів із шлуночковою аритмією
|
Рекомендації |
Клас |
Рівень |
|
ЕКГ у 12 відведеннях у стані спокою ЕКГ у 12 відведеннях у стані спокою рекомендовано проводити всім пацієнтам, обстежуваним щодо шлуночкових аритмій |
I |
A |
|
ЕКГ-моніторинг 1. ЕКГ рекомендовано для визначення та діагностики аритмії. Реєстрацію ЕКГ у 12 відведеннях рекомендовано для визначення змін інтервалу Q–T або ST 2. Документування серцевих явищ рекомендовано при спорадичних виявах симптомів для встановлення їх спричинення транзиторною аритмією 3. Імплантований петльовий реєстратор рекомендовано застосовувати у разі, якщо симптоми на кшталт синкопе мають спорадичний характер та ймовірно пов’язані з аритмією, а також якщо не можна встановити кореляцію «симптом–ритм» за допомогою традиційних діагностичних методів 4. Сигнал-усереднену ЕКГ рекомендовано для уточнення діагнозу аритмогенної кардіопатії шлуночків (АКПШ) у пацієнтів із шлуночковою аритмією або осіб з ризиком її розвитку із загрозою для життя |
I I I I |
A B B B |
|
ЕКГ з фізичним навантаженням 1. ЕКГ з фізичним навантаженням рекомендовано дорослим пацієнтам із шлуночковою аритмією з перехідною або вищою ймовірністю наявності ІХС відповідно до віку та симптомів, що провокують ішемічні порушення або шлуночкову аритмію 2. ЕКГ з фізичним навантаженням рекомендовано пацієнтам з відомою або підозрюваною шлуночковою аритмією, викликаною фізичним навантаженням, включаючи АКПШ, для встановлення діагнозу та визначення прогнозу 3. ЕКГ з фізичним навантаженням слід взяти до уваги при дослідженні відповіді на фармакологічну та абляційну терапію у пацієнтів з відомою шлуночковою аритмією, викликаною фізичним навантаженням |
I I IIa |
B B C |
|
Візуалізація 1. ЕхоКГ для оцінки функції ЛШ та виявлення структурного захворювання серця рекомендовано всім пацієнтам з підозрюваною або відомою шлуночковою аритмією. 2. ЕхоКГ для оцінки функції ЛШ та ПШ та виявлення структурного захворювання серця рекомендовано пацієнтам з високим ризиком розвитку серйозної шлуночкової аритмії або РКС, із ДКМП, ГКМП або АКПШ, що перенесли ІМ, або родичам пацієнтів зі спадковими порушеннями, пов’язаними з РКС 3. ЕКГ з фізичним навантаженням та візуалізацію (ехоКГ з фізичним навантаженням або ядерну перфузію, ОФЕКТ) рекомендовано для визначення «тихої» ішемії в пацієнтів із шлуночковою аритмією з перехідною ймовірністю наявності ІХС відповідно до віку або симптомів, та в яких ЕКГ менш достовірна (застосування дигоксину, гіпертрофія ЛШ, депресія сегмента ST <1 мм у стані спокою, WPW-синдром або блокада лівої ніжки пучка Гіса) 4. Дослідження при фармакологічному навантаженні та візуалізація змін рекомендовані для визначення «тихої» ішемії в пацієнтів із шлуночковою аритмією з перехідною ймовірністю наявності ІХС відповідно до віку або симптомів, що фізично неспроможні виконати тест із фізичним навантаженням до появи симптомів, які обмежують навантаження 5. Слід взяти до уваги можливість виконання СМР або КТ для пацієнтів із шлуночковою аритмією, якщо ехоКГ не може надати точної оцінки функції ЛШ та ПШ та/або результатів дослідження структурних змін |
I I I I IIa |
B B B B B |
Таблиця 58. Інвазивне дослідження пацієнтів зі шлуночковою аритмією
|
Рекомендації |
Клас |
Рівень |
|
Коронарна ангіографія Слід розглянути необхідність проведення коронарної ангіографії при встановленні або запереченні значного обструктивного ІХС у пацієнтів при шлуночковій аритмії із загрозою для життя або таких, які пережили реанімаційні заходи після РКС, з перехідною або вищою ймовірністю наявності ІХС відповідно до віку та симптомів |
IIa |
C |
|
Інвазивне ЕФД серця 1. ЕФД рекомендовано пацієнтам з ІХС, які перенесли ІМ із симптомами, що вказують на ШТ, включаючи відчуття серцебиття, пресинкопе та синкопе 2. ЕФД рекомендовано пацієнтам із синкопе при підозрі на брадиаритмію або тахіаритмію, ґрунтуючись на симптомах (наприклад відчуття серцебиття) або результатах неінвазивних досліджень, зокрема в пацієнтів із структурним захворюванням серця 3. Слід розглянути необхідність проведення ЕФД для диференційної діагностики АКПШ та слабко вираженої тахікардії або саркоїдозу виносного тракту ПШ |
I I IIb |
B C B |

Лікування шлуночкової аритмії
1. Лікування основного захворювання серця та супутньої патології.
2. Фармакотерапія при шлуночковій аритмії та запобігання раптовій серцевій смерті представлена в табл. 59. При «доброякісній» аритмії (поодинокі рідкі монофокусні ШЕ) у хворих із серцево-судинною патологією без порушення гемодинаміки призначення антиаритмічних препаратів не показано.
Хворим із кардіальною патологією та ШЕ високих градацій (алоритмія, поліморфні та політопні екстрасистоли, короткі епізоди ШТ) показаний підбір антиаритмічної терапії (з урахуванням негативного інотропного ефекту антиаритмічних препаратів та можливої проаритмогенної дії).
Таблиця 59. Антиаритмічні лікарські засоби для лікування шлуночкової аритмії, доступні в більшості європейських країн
|
Антиаритмічний препарат (за класифікацією Воана — Вільямса) |
Пероральна доза, мг/добу1 |
Часті або важливі прояви побічної дії |
Показання |
Протипоказання та застереження |
|
Аміодарон (III) |
200–400 |
Фіброзний альвеоліт, гіпотиреоїдизм та гіпертиреоїдизм, нефропатія, відкладення на рогівці, фоточутливість, знебарвлення шкіри, гепатотоксичність, синусова брадикардія, подовження інтервалу Q–T та періодична TdP |
ШТ, ФШ |
Захворювання та одночасне лікування, пов’язане з подовженням інтервалу Q–T; спадковий LQTS; синусова брадикардія (крім випадків зупинки серця); СССВ (крім наявності ШВРС); тяжке порушення АV-провідності (крім наявності ШВРС); декомпенсована СН або кардіоміопатія |
|
Блокатори бета-адренорецепторів (II) |
Різна |
Бронхоспазм, гіпотензія, синусова брадикардія, АV-блокада, стомлюваність, депресія, сексуальні розлади |
ШЕ, ШТ, LQTS |
Тяжка синусова брадикардія та СССВ (крім наявності ШВРС); порушення АV-провідності (крім наявності ШВРС); гостра фаза ІМ (уникати при брадикардії, гіпотензії, недостатності ЛШ); декомпенсована СН; стенокардія Принцметала |
|
Дизопірамід* (IA) |
250–750 |
Негативний інотропний ефект, подовження QRS, АV-блокада, проаритмія (ТП, мономорфна ШТ, періодична TdP), антихолінергічний ефект |
ШТ, ШЕ |
Тяжкий СССВ (крім наявності пейсмейкера); тяжке порушення АV-провідності (крім наявності ШВРС); тяжке порушення внутрішньошлуночкової провідності; раніше перенесений ІМ; ІХС; СН; знижена ФВ ЛШ; гіпотензія |
|
Флекаїнід (IC) |
200–400 |
Негативний інотропний ефект, розширення комплексу QRS, АV-блокада, синусова брадикардія, проаритмія (ТП, мономорфна ШТ, періодична TdP), підвищена частота смертності після ІМ |
ШЕ, ШТ |
Дисфункція синусного вузла (крім випадків наявності ШВРС); ФП/ТП (без одночасного застосування блокаторів АV-проведення); тяжке порушення АV-провідності (крім наявності ШВРС); тяжке порушення внутрішньошлуночкової провідності; раніше перенесений ІМ; ІХС; СН; знижена ФВ ЛШ; гемодинамічно значна вада клапана серця; синдром Бругада; спадковий LQTS (крім LQTS3); одночасна терапія, пов’язана з подовженням інтервалу Q–T |
|
Мексилетин (IB) |
450–900 |
Тремор, дизартрія, запаморочення, порушення з боку шлунково-кишкового тракту, гіпотензія, синусова брадикардія |
ШТ, LQT3 |
Дисфункція синусного вузла (крім наявності ШВРС); тяжке порушення |
|
Прокаїнамід (IA) |
1000–4000 |
Висип, міалгія, васкуліт, гіпотензія, вовчак, агранулоцитоз, брадикардія, подовження інтервалу Q–T; TdP |
ШТ |
Тяжкий СССВ (крім випадків наявності ШВРС); тяжке порушення |
|
Пропафенон (IC) |
450–900 |
Негативний інотропний ефект, порушення з боку шлунково-кишкового тракту, подовження комплексу QRS, АV-блокада, синусова брадикардія, проаритмія (ТП, мономорфна ШТ, періодична TdP) |
ШЕ, ШТ |
Тяжка синусова брадикардія та СССВ (крім наявності ШВРС); ФП/ТП (без одночасного застосування речовин, які блокують АV-проведення); тяжке порушення АV-провідності (крім наявності ШВРС); тяжке порушення внутрішньошлуночкової провідності; раніше перенесений ІМ; ІХС; СН; знижена ФВ ЛШ; синдром Бругада; спадковий LQTS (крім LQTS3); одночасна терапія, пов’язана з подовженням інтервалу Q–T |
|
Хінідин* |
600–1600 |
Нудота, діарея, порушення слуху та зору, сплутаність свідомості, гіпотензія, тромбоцитопенія, гемолітична анемія, анафілаксія, подовження комплексу QRS та інтервалу Q–T, TdP |
ШТ, ФШ, SQTS, синдром Бругада |
Тяжкий СССВ (крім наявності ШВРС); тяжке порушення АV-провідності (крім наявності ШВРС); тяжке порушення внутрішньошлуночкової провідності; раніше перенесений ІМ; ІХС; СН; знижена ФВ ЛШ; гіпотензія; спадковий LQTS; одночасна терапія, пов’язана з подовженням інтервалу Q–T |
|
Ранолазин (IB) |
750–2000 |
Сплутаність свідомості, нудота, закреп, гіпотензія, порушення з боку шлунково-кишкового тракту, головний біль, висип, синусова брадикардія, подовження інтервалу Q–T |
LQTS32 |
Тяжка синусова брадикардія та СССВ (крім наявності ШВРС); тяжка СН; спадковий синдром подовження інтервалу Q–T (крім LQTS3); одночасна терапія, пов’язана з подовженням інтервалу Q–T |
|
Соталол (III) |
160–320 |
Як і для інших блокаторів бета-адренорецепторів, а також при TdP |
ШТ (АКПШ)3 |
Тяжка синусова брадикардія та СССВ (крім наявності ШВРС); порушення АV-провідності (крім випадків наявності ШВРС); тяжка СН; стенокардія Принцметала; спадковий LQTS; одночасна терапія, пов’язана з подовженням інтервалу Q–T |
|
Верапаміл (IV) |
120–480 |
Негативний інотропний ефект (особливо в пацієнтів зі зниженою ФВ ЛШ), висип, порушення з боку шлунково-кишкового тракту, гіпотензія, синусова брадикардія, АV-блокада, ШТ |
Фасцикулярна лівошлуночкова тахікардія |
Тяжка синусова брадикардія та СССВ (крім наявності ШВРС); тяжке порушення АV-провідності (крім наявності ШВРС); ІМ у гострій фазі (за винятком брадикардії, гіпотензії, недостатності ЛШ); СН; знижена ФВ ЛШ; ТП або ФП, пов’язані з додатковими шляхами проведення |
LQTS3 — синдром подовженого інтервалу Q–T 3-го типу; ШЕ — шлуночкова екстрасистолія; ШТ — шлуночкова тахікардія; TdP — torsades de pointes (веретеноподібна ШТ).
*За умови реєстрації препарату в Україні. 1Зазначено дозування для дорослих. 2Ранолазин — єдиний затверджений препарат для лікування хронічної стабільної стенокардії. Зверніть увагу, в окремих випадках може застосовуватися інше дозування. 3Соталол показаний при АКПШ, але його застосування суперечливе.
Характеристика кінцевого очікуваного результату лікування
Критерії оцінки ефекту антиаритмічної терапії за допомогою холтерівського моніторування:
- зменшення на 50% загальної кількості ШЕ;
- зниження на 90% парних ШЕ;
- повне зникнення пробіжок ШТ.
Хірургічні методи лікування
Використання медичних пристроїв (наприклад ІКД), катетерні абляції, оперативне втручання та проведення реваскуляризації залежно від виду патологічного стану.
Хворі з прогностичними «несприятливими» аритміями, рефрактерними до антиаритмічної терапії, з порушеннями гемодинаміки, коронарного кровотоку або в поєднанні з пароксизмами ШТ та ФШ потребують хірургічного лікування (стентування, АКШ, деструкція ектопічного вогнища, імплантація антитахікардитичних пристроїв і водіїв ритму, кардіовертерів-дефібриляторів та ін.).
Вимоги до режиму праці, відпочинку, реабілітації
Впорядкувати режим праці та відпочинку. Уникати несприятливих психоемоційних впливів. Санаторно-курортне лікування на фоні підібраної терапії.
Первинна медична допомога
Хворі зі шлуночковими порушеннями ритму підлягають амбулаторному обстеженню та лікуванню за місцем проживання. Обстеження може проводитися в районних поліклініках, а при необхідності додаткових обстежень — у міських кардіологічних диспансерах та діагностичних центрах.
Вторинна (спеціалізована) медична допомога
Термінова госпіталізація у відділення інтенсивної терапії необхідна при виникненні нападу потенційно загрозливих аритмій, при порушеннях гемодинаміки (втрата свідомості, ГКС, АГ).
Планова госпіталізація в кардіологічний стаціонар показана за наявності нападів в анамнезі ШТ, суб’єктивної непереносимості аритмії, неефективності медикаментозного лікування на амбулаторному етапі.
Третинна (високоспеціалізована) медична допомога
Обстеження і лікування у високоспеціалізованому кардіологічному або кардіохірургічному стаціонарі показане у разі необхідності виконання деяких неінвазивних та інвазивних досліджень. Госпіталізація показана для вирішення питання про вибір тактики лікування аритмії (за умови її неефективності за місцем проживання), а також для проведення хірургічного лікування.
Діагноз: фібриляція і ТП (табл. 60, 61, 62).
Таблиця 60. Класи ФП залежно від вираженості симптомів за EHRA (European Heart Rhythm Association)
|
Клас EHRA |
Пояснення |
|
EHRA I |
Відсутність симптомів |
|
EHRA II |
Помірні симптоми: нормальна щоденна діяльність без змін |
|
EHRA III |
Серйозні симптоми: нормальна щоденна діяльність змінена |
|
EHRA IV |
Симптоми інвалідизації: нормальна щоденна діяльність порушена |
Таблиця 61. Ризик тромбоемболій при ФП неклапанної етіології за шкалою CHA2DS2-VASc
|
Фактор ризику |
Бали |
|
Застійна СН/дисфункція ЛШ |
1 |
|
Гіпертензія |
1 |
|
Вік >75 років |
2 |
|
Цукровий діабет |
1 |
|
Інсульт/ТІА/тромбоемболії |
2 |
|
Захворювання судин |
1 |
|
Вік 65–74 роки |
1 |
|
Стать (жіноча) |
1 |
|
Максимум балів |
9 |
Таблиця 62. Ризик кровотечі за шкалою HAS-BLED
|
Літера |
Клінічна характеристика* |
Бали |
|
H |
АГ |
1 |
|
A |
Порушення ниркової та печінкової функції (1 бал кожне) |
1 або 2 |
|
S |
Інсульт |
1 |
|
В |
Кровотеча |
1 |
|
L |
Лабільний INRs (МНВ) |
1 |
|
E |
Похилий вік (наприклад >65 років) |
1 |
|
D |
Ліки або алкоголь (1 бал кожний) |
1 або 2 |
|
Максимум балів |
9 |
|
*Гіпертензією в цій шкалі вважається САТ >160 мм рт. ст. Порушення ниркової функції визначене як наявність хронічного діалізу або ниркової трансплантації або креатиніну в сироватці крові >200 ммоль/л. Порушення функції печінки визначено як хронічна печінкова хвороба (наприклад цироз печінки) або біохімічне підтвердження значного печінкового порушення (наприклад білірубін більше ніж у 2 рази перевищує верхню межу норми і АсАТ/АлАТ/лужна фосфатаза перевищує верхню межу норми у більше ніж у 3 рази). Кровотеча — наявність в анамнезі кровотеч та/або схильність до кровотеч, наприклад геморагічний діатез, анемія та ін. Лабільний INR — рівень INR знаходиться в терапевтичному діапазоні <60% часу. Застосування ліків/алкоголю — супутнє застосування препаратів, таких як антитромботичні, нестероїдні протизапальні препарати, алкогольна залежність тощо.
Шкала симптомів за EHRA
|
Клас |
Симптоми |
Характеристика |
|
I |
Відсутні |
ФП не проявляється симптомами |
|
IIa |
Легкі |
Нормальна щоденна активність не порушена симптомами ФП |
|
IIb |
Помірні |
Нормальна щоденна активність не порушена симптомами ФП, але пацієнт стурбований симптомами ФП |
|
III |
Серйозні |
Нормальна щоденна активність ускладнена у результаті симптомів ФП |
|
IV |
Інвалідизуючі |
Нормальна щоденна активність припинена |
Фактори ризику кровотечі у пацієнтів, які отримують антикоагулянтну терапію
|
Фактори ризику кровотечі, що можливо модифікувати у пацієнтів, які отримують антикоагулянтну терапію |
|
Гіпертензія (особливо з підвищенням САТ >160 мм рт. ст.) |
|
Лабільне МНВ або час знаходження у терапевтичному діапазоні МНВ <70% у пацієнтів, які приймають АВК |
|
Прийом препаратів, що підвищують ризик кровотеч, таких як антитромбоцитарні та нестероїдні протизапальні препарати |
|
Надмірне вживання алкоголю (≥8 «дрінків» на тиждень) |
|
Фактори ризику, що потенційно можуть бути модифіковані |
|
Анемія |
|
Порушення функції нирок |
|
Порушення функції печінки |
|
Зниження кількості чи функції тромбоцитів |
|
Фактори ризику, що не модифікуються |
|
Вік (>65 років, ≥75 років) |
|
Значна кровотеча в анамнезі |
|
Інсульт в анамнезі |
|
Захворювання нирок, що потребує діалізу або трансплантації нирки |
|
Циротичне захворювання печінки |
|
Новоутворення |
|
Генетичні фактори |
|
Фактори ризику кровотеч, які визначаються біомаркерами |
|
Високочутливий тропонін |
|
Фактор росту та диференціації I5 |
|
Креатинін сироватки/визначений кліренс креатиніну |
Код МКХ-10: І48.0 — фібриляція і тріпотіння передсердь:
I48.0 — пароксизмальна (ритм відновлюється самостійно в межах 7 діб)*:
- брадисистолічна (ЧШС <60 уд./хв)**;
- тахісистолічна (ЧШС >110 уд./хв)**.
I48.1 — персистуюча (епізод, що триває понад 7 діб, коли для відновлення синусового ритму необхідне втручання)*:
- брадисистолічна (ЧШС <60 уд./хв)**;
- тахісистолічна (ЧШС >110 уд./хв)**.
I48.1 — тривало персистуюча (епізод, що триває 1 рік та більше, коли синусовий ритм доцільно відновлювати)*:
- брадисистолічна (ЧШС <60 уд./хв)**;
- тахісистолічна (ЧШС >110 уд./хв)**.
I48.2 — постійна (коли синусовий ритм відновити неможливо або недоцільно)*:
- брадисистолічна (ЧШС <60 уд./хв)**;
- тахісистолічна (ЧШС >110 уд./хв)**.
*Усі форми можуть бути такими, що вперше виникли.
**Вказується при клінічно значимому стані.
Приклад формулювання діагнозу
Міокардіофіброз. Персистуюча форма ФП, що вперше виникла. EHRAI, CHA2DS2-VASc 2 бали, HAS-BLED 1 бал. ГХ ІІІ ст., 2-га ст., ризик дуже високий. СН 0 стадії.
Первинна медична допомога
Первинна профілактика
Положення протоколу
Хворі з ФП підлягають амбулаторному обстеженню та лікуванню за місцем проживання. Обстеження може проводитися в районних поліклініках, а при необхідності додаткових обстежень — у міських кардіологічних диспансерах та діагностичних центрах. При необхідності відновлення синусового ритму при персистуючій формі аритмії за неефективності амбулаторного лікування рутинними заходами та/або при порушеннях гемодинаміки, або для планової ЕІТ хворі підлягають госпіталізації в кардіологічний стаціонар, за відповідними показаннями — у відділення інтенсивної терапії.
Необхідні дії
Лікарю на етапі першого контакту з пацієнтами, які мають ту чи іншу форму ФП, необхідно вирішити декілька досить складних питань:
1. Чи потребує даний хворий відновлення синусового ритму чи йому потрібна медикаментозна корекція ЧШС (враховується форма ФП, її тривалість, розміри лівого передсердя, наявність тромбоемболічних ускладнень в анамнезі, наявність електролітних розладів і захворювань щитовидної залози та ін.).
2. Оцінити безпеку відновлення синусового ритму на догоспітальному етапі: наявність клапанних вад серця, тяжких структурних уражень міокарда (постінфарктний кардіосклероз, ДКМП, виражена гіпертрофія міокарда), захворювань щитовидної залози (гіпер- і гіпотиреоз), наявність і тяжкість хронічної СН.
3. Якщо пацієнт потребує відновлення синусового ритму, то чи потрібно це робити на догоспітальному етапі, або ця процедура повинна проводитися в плановому порядку в стаціонарі після необхідної підготовки.
4. Якщо пацієнт потребує відновлення синусового ритму на догоспітальному етапі, необхідно обрати спосіб його відновлення: медикаментозна або електрична кардіоверсія або ЕІТ (за умови наявності дефібрилятора та відповідно до компетенції лікаря загальної практики — сімейного лікаря).
Вирішення питання про необхідність відновлення синусового ритму на догоспітальному етапі залежить у першу чергу від поєднання двох факторів: форми ФП і наявності та тяжкості розладів гемодинаміки та/або ішемії міокарда.
Показання до відновлення синусового ритму на догоспітальному етапі:
1. Тривалість ФП <48 год (див. вище).
2. Тривалість ФП >48 год у поєднанні з (див. вище):
- вираженою задишкою і вологими хрипами в легенях;
- артеріальною гіпотензією <90/60 мм рт. ст, спричиненою тахіаритмією;
- ангінозним болем, ознаками ішемії міокарда на ЕКГ (депресія ST, елевація ST, негативний зубець Т);
- ЧШС >250 за 1 хв.
Показання до госпіталізації:
1. Вперше виявлена ФП.
2. Пароксизмальна ФП, коли немає ефекту від препаратів, застосованих для відновлення синусового ритму.
3. Пароксизмальна ФП, що супроводжувалася розладами гемодинаміки або ішемією міокарда, яку вдалося усунути медикаментозно або за допомогою електричної кардіоверсії.
4. У разі виникнення ускладнень антиаритмічної терапії.
5. Часто рецидивуючі пароксизми ФП (з метою підбору антиаритмічної терапії).
6. При постійній формі ФП госпіталізація показана при високій тахісистолії, збільшенні вираженості СН (для корекції медикаментозної терапії).
Діагностика
Положення протоколу
Обов’язкові дослідження:
1. Збір скарг та анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ.
4. Лабораторне обстеження (загальні аналізи крові та сечі, АлАТ, АсАТ, білірубін, креатинін, ліпідограма, ТГ, глюкоза в крові, гормони щитовидної залози і гіпофізу (ТТГ), коагулограма, МНВ, АЧТЧ).
5. ЕКГ у 12 відведеннях.
6. ЕхоКГ.
7. Проба з фізичним навантаженням (за показаннями).
8. Добовий моніторинг ЕКГ або моніторинг подій.
Додаткові дослідження:
1. ЕФД.
2. Черезстравохідна ехоКГ.
3. Рентгенографія органів грудної клітки.
4. Лабораторне обстеження: гормони щитовидної залози і гіпофізу (Т3, Т4), маркери запального процесу в міокарді.
Обґрунтування
Ведення пацієнтів з ФП має на меті зменшення вираженості симптоматики та запобігання тяжким ускладненням, асоційованим із ФП. Ці терапевтичні завдання повинні виконуватися паралельно, особливо при початковій маніфестації (вперше виявленої ФП) (рис. 4). Профілактика пов’язаних з ФП ускладнень проводиться за допомогою антитромботичної терапії, контролю ЧШС та належного лікування супутніх серцевих захворювань. Ці методи лікування вже самі по собі можуть зменшувати вираженість симптоматики, але іноді для полегшення симптомів необхідне застосування додаткових методів лікування, що забезпечують контроль серцевого ритму, таких як кардіоверсія, прийом антиаритмічних препаратів або абляція (рис. 5).
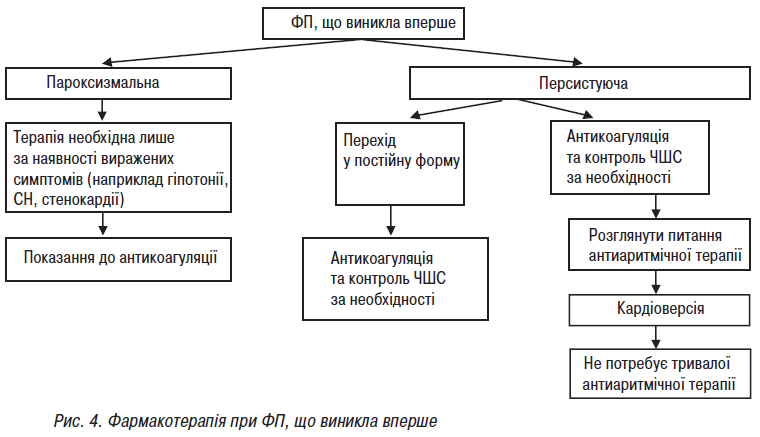
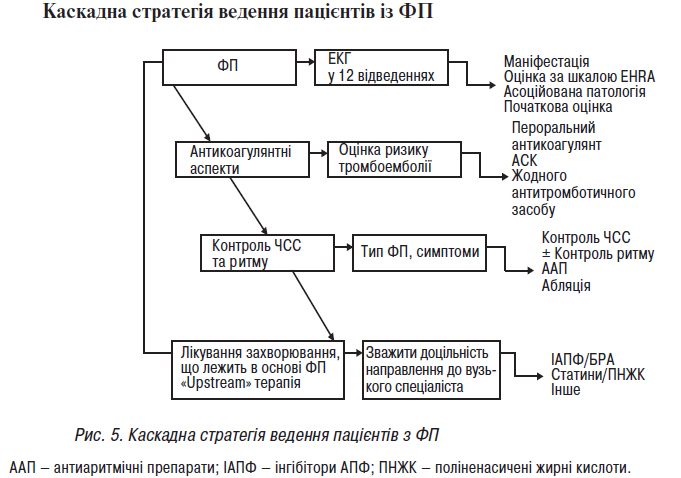
Необхідні дії
Каскадна стратегія ведення пацієнтів із ФП — див. вище.
Стратегія антитромботичної терапії
ФП — часта причина інсультів і тромбоемболії. Ризик смерті, інвалідність, рецидиви інсульту частіше виникають при інсультах на тлі ФП, ніж при інсультах іншої етіології. Тактика ведення пацієнтів з ФП має бути спрямована на оцінку ризику інсульту і використання відповідних засобів тромбопрофілактики.
Лікування
Положення протоколу
Алгоритм стратегії профілактики тромбоемболічних ускладнень у пацієнтів з ФП див. вище.
Хворі повинні отримувати комплексну терапію:
1. Антикоагулянтна терапія показана всім хворим з ФП (СHА2DS2-VASc ≥2(3)) невизначено довго.
2. Слід надавати перевагу новим оральним антикоагулянтам (НОАК) (СHА2DS2-VASc ≥2(3)).
3. Цільові рівні МНВ при застосуванні непрямих антикоагулянтів:
- вік ≥60 років, цукровий діабет, ІХС — МНВ 2,0–3,0, цільовий рівень 2,5;
- вік ≥75 років, жіноча стать — МНВ 2,0–3,0, цільовий рівень 2,5;
- хронічна СН та/чи ФВ ≤35% — МНВ 2,0–3,0, цільовий рівень 2,5;
- тиреотоксикоз — МНВ 2,0–3,0, цільовий рівень 2,5;
- АГ — МНВ 2,0–3,0, цільовий рівень 2,5;
- ревматичний мітральний стеноз — МНВ 2,5–3,5, цільовий рівень 3;
- протезовані клапани серця — МНВ 2,5–3,5, цільовий рівень 3;
- тромбоемболії в анамнезі — МНВ 2,5–3,5, цільовий рівень 3;
- тромбоутворення в порожнинах серця за даними трансторакальної ехоКГ та черезстравохідної ехоКГ — МНВ 2,5–3,5, цільовий рівень 3.
Профілактична антикоагулянтна терапія АВК (варфарин) або НОАК показана хворим із персистуючою формою ФП (тривалістю понад 48 год), яким запланована медикаментозна або електрична кардіоверсія протягом 3 тиж до (якщо у хворого при черезстравохідній ехоКГ не виявлено тромбів, то цей строк може бути скорочений), і 4 тиж після кардіоверсії. Коли наявні фактори високого ризику тромбоемболічних ускладнень у хворих із постійною формою ФП, показана профілактична антикоагулянтна терапія НОАК або АВК. У хворих з підвищеним ризиком кровотеч (HAS-BLED ≥3) слід надавати перевагу НОАК (апіксабан, ривароксабан, дабігатрану етексилат).
Коли неможливе використання варфарину або НОАК, можливий прийом комбінації клопідогрелю 75 мг та АСК 75 мг. З обережністю у хворих з високим ризиком кровотеч (HAS-BLED ≥3).
4. Для контролю ЧШС при ФП:
- у хворих без ДШП — внутрішньовенно блокатори бета-адренорецепторів або недигідропіридинові блокатори кальцієвих каналів (верапаміл, дилтіазем);
- при СН — блокатори бета-адренорецепторів ± дигоксин, аміодарон + дигоксин; блокатори бета-адренорецепторів + аміодарон;
- у хворих з ДШП — аміодарон;
- у хворих із ХОЗЛ — дилтіазем, верапаміл, препарати наперстянки, селективні блокатори бета-адренорецепторів.
5. Антиаритмічні препарати, показані для відновлення синусового ритму: пропафенон, аміодарон.
6. Фонове лікування після відновлення синусового ритму: інгібітори АПФ/БРА/статини, блокатори бета-адренорецепторів за показаннями.
7. Антиаритмічні препарати, показані для збереження синусового ритму:
- при ідіопатичній ФП (у хворих без структурних захворювань серця) — дронедарон, флекаїнід, пропафенон, етацизин, соталол, при неефективності цих препаратів — аміодарон;
- при ФП у хворих з АГ за відсутності гіпертрофії ЛШ — пропафенон, етацизин, соталол, флекаїнід, при відсутності ефекту — аміодарон. За наявності значної гіпертрофії ЛШ — аміодарон;
- при ФП на тлі ІХС — дронедарон, соталол, аміодарон;
- при хронічній СН — аміодарон.
8. Препарати, що застосовуються при постійній формі ФП для контролю ЧШС:
- дигоксин — у пацієнтів з СН та систолічною дисфункцією ЛШ, а також пацієнтів, які ведуть малорухливий (неактивний) спосіб життя (переважно — у комбінації з блокатори бета-адренорецепторів);
- блокатори бета-адренорецепторів — при ІХС, АГ, СН (за необхідності — у комбінації з дигоксином);
- недигідропіридинові антагоністи кальцію — при АГ, ІХС, ХОЗЛ, за наявності протипоказань до блокаторів бета-адренорецепторів;
- соталол, аміодарон — при неефективності вказаних препаратів або за наявності ДШП.
9. Електрична кардіоверсія.
1) Планова електрична кардіоверсія показана при:
- неефективності медикаментозної терапії у пацієнтів з персистуючою ФП;
- непереносимості антиаритмічних засобів або ризику, пов’язаному з їх призначенням;
- прогресуванні СН, погіршенні кровопостачання серця, мозку, нижніх кінцівок, що спричинені тахіаритмією;
- наявності даних про те, що лише кардіоверсія була раніше ефективна для відновлення синусового ритму при ФП.
2) Невідкладна електрична кардіоверсія показана:
- при пароксизмі ФП з високою ЧШС на тлі гострого ІМ, нестабільної стенокардії;
- при пароксизмі ФП, який супроводжується симптоматичною гіпотензією, гострою або прогресуючою хронічною СН;
- тяжкому пароксизмі ФП, який не піддається медикаментозному лікуванню.
10. Черезстравохідна електрокардіостимуляція — з метою припинення епізоду ТП (за умови насичення антиаритмічними засобами).
11. В амбулаторних умовах введення прокаїнаміду для відновлення синусового ритму протипоказане.
12. Хворим, які не переносять АСК, показані тієнопіридинові антитромбоцитарні препарати.
13. Імплантація кардіостимулятора у відповідному режимі за наявності супутніх порушень АV-провідності та СССВ.
14. Катетерне лікування при:
- неефективності медикаментозної терапії в адекватних дозах;
- аритмогенній дії антиаритмічних препаратів;
- симптомних нападах ФП і ТП;
- поєднанні ФП із синдромом передчасного збудження шлуночків;
- ізольованому ТП.
15. Пацієнти потребують адекватного лікування супутніх захворювань, АГ, уражень щитовидної залози та цукрового діабету.
Обґрунтування
Невідкладна допомога: контроль ЧСС та серцевого ритму.
Невідкладні заходи при пароксизмі ФП спрямовані на забезпечення захисту від тромбоемболічних подій та швидке покращання функції серця. Залежно від тяжкості спричинених ФП симптомів обирається тактика невідкладного відновлення синусового ритму (у тяжких пацієнтів із скомпрометованою гемодинамікою) або інтенсивної терапії з контролем ЧСС (у більшості інших хворих).
Контроль ЧСС
Неадекватна ЧШС та нерегулярний серцевий ритм можуть зумовлювати симптоми та тяжкі гемодинамічні порушення у пацієнтів із ФП. Пацієнти із частою відповіддю шлуночків зазвичай потребують невідкладної терапії з контролем ЧСС. У стабільних хворих такий контроль може бути досягнутий пероральним застосуванням блокаторів бета-адренорецепторів або недигідропіридинових блокаторів кальцієвих каналів. У тяжких пацієнтів із скомпрометованою гемодинамікою дуже корисними для швидкого сповільнення проведення імпульсів через AV-вузол можуть бути верапаміл або метопролол у формі для внутрішньовенного введення. У невідкладній клінічній ситуації цільовою ЧШС зазвичай є 80–100 за хвилину. В окремих пацієнтів може застосовуватися аміодарон, особливо у разі зниженої функції ЛШ. ФП з низькою ЧШС може відповідати на атропін (0,5–2 мг внутрішньовенно), але багато пацієнтів із симптомною брадиаритмією можуть потребувати кардіоверсії або імплантації тимчасового водія ритму з електродом у ПШ.
Після невідкладного початку терапії з контролем ЧСС завжди необхідно передбачити стратегію подальшого контролю цього показника.
Медикаментозна кардіоверсія
Багато епізодів ФП завершуються спонтанно в перші години або дні після початку. За наявності медичних показань (наприклад у тяжких пацієнтів із скомпрометованою гемодинамікою) у пацієнтів, які залишаються симптомними, незважаючи на адекватний контроль ЧСС, або у хворих, для яких показана терапія з контролем серцевого ритму, може бути здійснена медикаментозна кардіоверсія ФП за допомогою болюсного введення антиаритмічного препарату.
Частота успішних конверсій ритму при застосуванні антиаритмічних препаратів є нижчою, ніж на фоні ЕІТ, але в цьому випадку не потрібна седація пацієнта або застосування наркозу; надалі це може сприяти вибору стратегії лікування антиаритмічними препаратами для запобігання рецидиву ФП. Більшість хворих, яким виконується медикаментозна кардіоверсія, потребують постійного медичного нагляду та ЕКГ-моніторування під час інфузії препарату та протягом певного періоду після її завершення (зазвичай протягом терміну, який відповідає приблизно половині періоду напіввиведення цього лікарського засобу) для виявлення антиаритмічних подій, таких як шлуночкова проаритмія, відмова синусного вузла або AV-блокада. В окремих амбулаторних пацієнтів може бути прийнятною повторна пероральна фармакологічна кардіоверсія (підхід «таблетка в кишені» (pill-in-the-pocket)), оскільки раніше була показана безпека такого втручання. Для проведення фармакологічної кардіоверсії можуть бути використані декілька препаратів (табл. 65).
У кількох плацебо-контрольованих рандомізованих дослідженнях була показана ефективність пропафенону для відновлення синусового ритму при пароксизмі ФП. Через кілька годин після внутрішньовенного введення препарату (2 мг/кг протягом 10–20 хв) очікувана частота кардіоверсії становить 41–91%. Відповідна частота успішних конверсій у пацієнтів, що отримували плацебо, становила 10–29%. Водночас пропафенон виявляв лише обмежену ефективність щодо конверсії персистуючої ФП та ТП. Як і для флекаїніду, слід уникати призначати пропафенону пацієнтам із серцевими захворюваннями, при яких відмічають порушення функції ЛШ та ішемію міокарда. Крім того, беручи до уваги слабкі бета-блокуючі властивості пропафенону, слід уникати його призначення при тяжких обструктивних захворюваннях легень. Час від введення препарату до конверсії коливається від 30 хв до 2 год. Пропафенон також ефективний при пероральному застосуванні (конверсія відбувається за період 2–6 год).
При застосуванні аміодарону кардіоверсія відбувається кількома годинами пізніше, аніж при застосуванні флекаїніду чи пропафенону. Приблизна частота успішних кардіоверсій за період 24 год у пацієнтів, що отримували плацебо, становила 40–60%, у той час як після застосування аміодарону вона зростала до 80–90%. Аміодарон не дає можливості виконати кардіоверсію у короткі або середні строки. Але через 24 год цей препарат продемонстрував кращу ефективність у порівнянні з контролем за результатами деяких, хоча і не всіх, рандомізованих досліджень.
Інші препарати
В одному дослідженні, де порівнювалася ефективність плацебо та двох різних доз соталолу, частота успішних конверсій становила 14% (2/14 пацієнтів), 11% (2/11 пацієнтів) та 13% (2/16 пацієнтів). Ця різниця між групами не була статистично значущою.
В одному дослідженні, у якому взяли участь 79 пацієнтів із ФП (без групи контролю), після внутрішньовенного введення блокатора бета-адренорецепторів (метопрололу) конверсія до синусового ритму відбулася у 13%. Не опубліковано значущих даних щодо такого ефекту для атенололу, карведилолу, бісопрололу, пропранололу, тимололу або есмололу.
Досі не опубліковано результатів жодного рандомізованого контрольованого дослідження з достатньою кількістю учасників, у якому порівнювалися б верапаміл та плацебо. У дослідженнях, у яких верапаміл порівнювався з флекаїнідом, есмололом або пропафеноном, конверсія до синусового ритму відбулася відповідно у 6; 12 та 14% з 17; 24 та 29 пацієнтів відповідно, які отримали верапаміл.
Дигоксин неефективний для припинення ФП. В одному дослідженні, у якому взяли участь 239 пацієнтів із ФП, епізод якої тривав <7 діб, частота успішних конверсій за 16 год становила 46% у групі плацебо та 51% серед пацієнтів, що отримували дигоксин; у двох інших дослідженнях, у яких взяли участь 40 та 82 пацієнти, частота успішних конверсій після застосування плацебо та дигоксину становила 40% проти 47% і 14% проти 32% відповідно.
Таким чином, існують достатньо чіткі підтвердження того, що дигоксин не є ефективним для відновлення синусового ритму. Хоча отримані для верапамілу доказові дані менш переконливі, вони свідчать про незначну ефективність препарату щодо відновлення ритму. В одному дослідженні продемонстрована відсутність ефективності соталолу. Метопролол не виявляв ефективності в жодному з досліджень і не отримано доказових даних із цього питання для інших блокаторів бета-адренорецепторів.
Підхід «таблетка в кишені» (pill-in-the-pocket)
У стаціонарних умовах пероральне застосування пропафенону дозволяло виконати кардіоверсію у 55 зі 119 (45%) пацієнтів протягом 3 год після прийому препарату порівняно з 22 із 121 (18%) пацієнта групи плацебо. У менших дослідженнях подібний ефект було продемонстровано як для пропафенону, так і для флекаїніду.
За результатами одного дослідження з середньою кількістю учасників пероральні препарати пропафенону (450–600 мг) або флекаїніду (200–300 мг) можуть безпечно (1/569 епізодів конверсії до ТП із швидким проведенням імпульсу) та ефективно (94%, 534/569 епізодів конверсії до синусового ритму) прийматися пацієнтом в амбулаторних умовах.
Цей підхід може використовуватися в окремих пацієнтів із вираженою симптоматикою та нечастими (наприклад від 1 разу на місяць до 1 разу на рік) епізодами ФП. Для запровадження підходу «таблетка в кишені» необхідно проводити скринінг серед пацієнтів щодо показань та протипоказань та перевіряти ефективність і безпеку цієї стратегії перорального лікування в стаціонарних умовах. Пацієнтів слід інструктувати щодо прийому пропафенону або флекаїніду в разі появи симптомів ФП.
Кардіоверсія постійним струмом (КПС)
КПС є ефективним методом конверсії ФП до синусового ритму (табл. 64, 65).
Процедура. За винятком випадків, коли за 3 тиж до процедури пацієнту була проведена адекватна і задокументована антикоагулянтна терапія або коли епізод ФП розпочався <48 год тому, слід виконати ТЕ-ехоКГ для виключення наявності тромбу в передсерді (рис. 6 і 7). На випадок виникнення асистолії або брадикардії може знадобитися катетер з електродами водія ритму або зовнішній водій ритму.
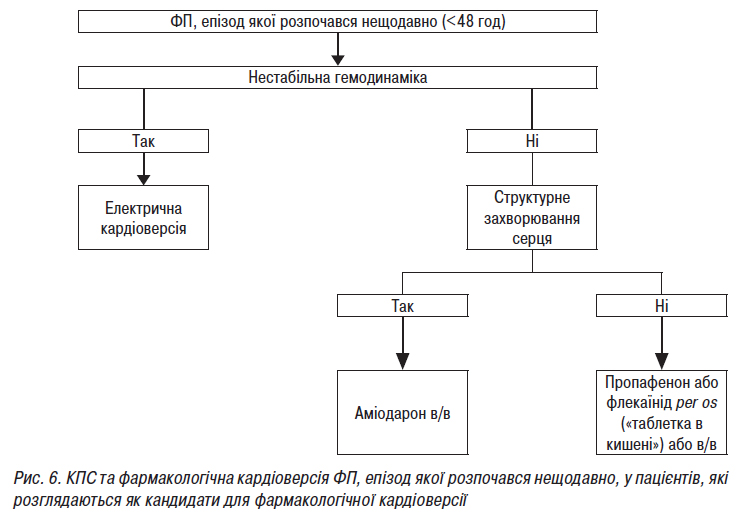
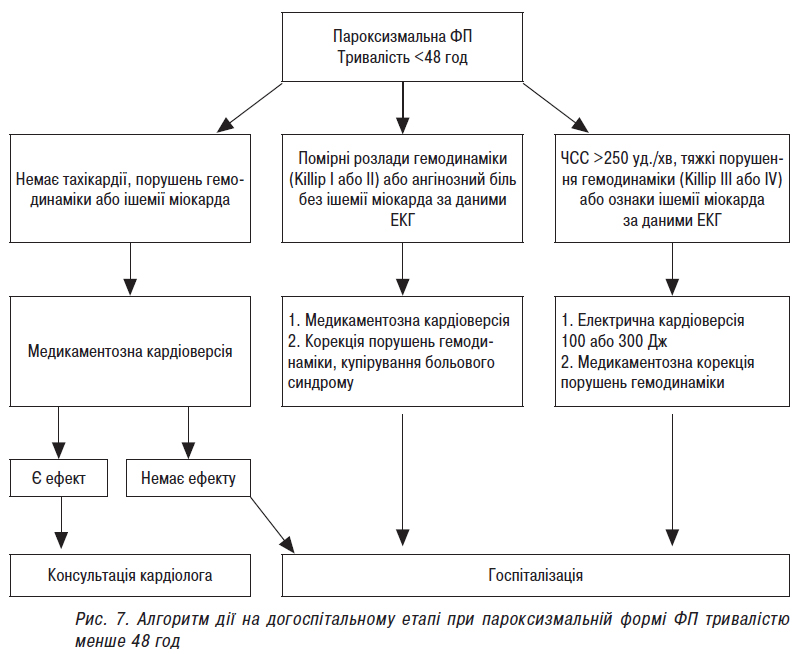
Успішна КПС, як правило, визначається припиненням ФП, що документується за наявності двох або більше послідовних зубців P після електричного розряду. Доказові дані свідчать на користь використання зовнішніх біфазних дефібриляторів, враховуючи те, що вони вимагають застосування менш сильних електричних імпульсів та мають вищу ефективність порівняно з монофазними дефібриляторами. У дослідженнях було продемонстровано статистично значуще підвищення частоти успішної конверсії після першого електричного розряду під час КПС у пацієнтів із ФП при застосуванні біфазних імпульсів.
На сьогодні зазвичай застосовують дві традиційні схеми розміщення електродів. У кількох дослідженнях було показано, що передньо-заднє розміщення електродів є більш ефективним, ніж передньо-бічне. Якщо перший електричний розряд неуспішний щодо припинення аритмії, слід змінити розміщення електродів і повторити спробу кардіоверсії.
КПС може проводитися амбулаторно у пацієнтів, у яких стабільна гемодинаміка та відсутні тяжкі захворювання серця. Після процедури необхідне моніторування ЕКГ та гемодинамічних показників протягом принаймні 3 год, перш ніж пацієнту буде дозволено залишити клініку.
Внутрішня кардіоверсія може бути корисною у деяких особливих клінічних ситуаціях, наприклад, коли пацієнту проводиться інвазивне втручання і катетери для проведення кардіоверсії можуть бути введені без виконання додаткових судинних доступів, але такий метод практично не застосовується з метою кардіоверсії, за винятком випадків, коли наявні імплантовані дефібрилятори.
Ускладнення
Ризики та ускладнення кардіоверсії асоційовані головним чином з тромбоемболічними подіями, післякардіоверсійними аритміями та ризиками, зумовленими загальним знеболюванням. Процедура асоційована з ризиком тромбоемболічних ускладнень на рівні 1–2%, який може бути знижений за допомогою належної антикоагулянтної терапії протягом кількох тижнів перед кардіоверсією або за допомогою виключення наявності тромбу в лівому передсерді перед процедурою. Частим ускладненням є опіки шкіри. У пацієнтів з дисфункцією синусного вузла, особливо в осіб похилого віку з органічними ураженнями серця, може виникнути пролонгована відмова синусного вузла без адекватного замісного ритму. На фоні гіпокаліємії, інтоксикації препаратами наперстянки або незадовільної синхронізації можуть виникнути небезпечні для життя аритмії, такі як ШТ та ФП. Через седацію пацієнт може перенести гіпоксію або гіповентиляцію, але АГ і набряк легень відзначають рідко.
Кардіоверсія у пацієнтів з імплантованими водіями ритму та дефібриляторами
Пластинка електроду має бути розміщена на відстані не менше ніж 8 см від батареї водія ритму, рекомендоване передньо-заднє розташування пластинок. Перевагу мають біфазні електричні розряди. У пацієнтів, залежних від роботи імплантованого водія ритму, слід передбачити можливе підвищення порогу стимуляції. Цим хворим показане ретельне моніторування. Після кардіоверсії імплантований прилад слід перевірити та оцінити на предмет забезпечення його нормального функціонування.
Рецидиви ФП після кардіоверсії
Рецидиви ФП після КПС можна розділити на три фази:
1) Негайні рецидиви, які виникають у перші кілька хвилин після КПС.
2) Ранні рецидиви, які виникають у перші 5 днів після процедури.
3) Пізні рецидиви, які виникають пізніше.
До факторів, що зумовлюють рецидивування ФП, належать вік, тривалість ФП до проведення кардіоверсії, кількість попередніх рецидивів, збільшені розміри лівого передсердя або погіршена функція лівого передсердя та наявність коронарного атеросклерозу або ураження клапана легеневої артерії чи мітрального клапана. Передсердні ектопічні скорочення з послідовністю «довге–коротке», більш висока ЧСС та варіації передсердного проведення підвищують ризик рецидивування ФП.
Попереднє лікування антиаритмічними препаратами, такими як аміодарон, соталол, флекаїнід та пропафенон, підвищує ймовірність відновлення синусового ритму.
У деяких пацієнтів з вираженою симптоматикою, у яких епізоди ФП розвиваються нечасто (наприклад 1 або 2 рази на рік), дуже рекомендується надавати перевагу проведенню повторних кардіоверсій у якості довготривалої стратегії контролю серцевого ритму перед вибором стратегії контролю ЧСС або інших підходів до контролю ритму, які можуть бути незручними для таких пацієнтів.
Найчастіше при вперше виявленій ФП застосовується наступна тактика:
1. Контроль ЧШС за необхідності, найчастіше за допомогою блокаторів бета-адренорецепторів та/або дигоксину.
2. Антикоагулянти, АВК (варфарин) або НОАК (апіксабан, ривароксабан, дабігатран), для профілактики тромбоемболічних ускладнень відповідно до показань.
3. Обговорення питання антиаритмічної терапії.
4. Обговорення питання щодо доцільності відновлення синусового ритму.
Після відновлення синусового ритму на 1 міс призначаються антиаритмічний препарат з метою запобігання рецидиву ФП (тривала терапія не потрібна) й антикоагулянт (НОАК або АВК).
Необхідні дії
Алгоритм фармакотерапії ФП, що виникла вперше
Диспансерне спостереження
Ведення хворого на початковому етапі
У пацієнта, в якого є підозрювана або відома ФП, необхідно ретельно вивчити медичний анамнез (табл. 67). Ведення хворого в гострий період ФП повинно бути спрямоване на полегшення симптомів та оцінки ризику, асоційованого із ФП. Клінічне обстеження має включати визначення класу проявів аритмії за шкалою EHRA, оцінку ризику інсульту та діагностичний пошук станів, які сприяють ФП та ускладнень аритмії. Необхідно вивчити дані ЕКГ у 12 відведеннях для виявлення ознак органічної патології серця (наприклад гострого або перенесеного раніше ІМ, гіпертрофії ЛШ, блокади ніжки пучка Гіса або шлуночкового передзбудження, ознак кардіоміопатії або ішемії).
Вторинна (спеціалізована) медична допомога
Профілактика
Положення протоколу
Спеціаліст, який займається веденням пацієнта із ФП, повинен не тільки проводити початкову оцінку його стану та призначити належне лікування, але й розробити структурований план подальшого спостереження хворого.
Нижче перераховано важливі фактори, які слід брати до уваги при подальшому спостереженні пацієнта із ФП:
- Чи змінився профіль ризику пацієнта (наприклад у разі розвитку цукрового діабету або АГ, яких раніше не було), особливо у контексті призначення антикоагулянтної терапії?
- Чи необхідна зараз антикоагулянтна терапія — чи не з’явилися у пацієнта нові фактори ризику або чи не зникла необхідність в антикоагулянтах, наприклад, після кардіоверсії у хворого з низьким тромбоемболічним ризиком?
- Чи зменшується вираженість симптоматики у пацієнта на фоні терапії; якщо ні, то чи слід зважити доцільність іншої стратегії лікування?
- Чи є які-небудь ознаки проаритмії або ризик проаритмії; якщо так, то чи слід знизити дозу протиаритмічного засобу або перейти до іншої стратегії лікування?
- Чи прогресувала пароксизмальна ФП до персистуючої/постійної форми, незважаючи на прийом протиаритмічних засобів; у такому разі чи слід визначити доцільність застосування іншої стратегії лікування? Чи ефективний застосовуваний підхід контролю ЧСС; чи досягнуто цільового рівня ЧСС у стані спокою та при фізичному навантаженні?
Під час візитів подальшого спостереження слід виконувати ЕКГ у 12 відведеннях для документування ритму та ЧСС і оцінки прогресування захворювання. Для пацієнтів, які приймають протиаритмічні засоби, важливо оцінювати потенційні ЕКГ-провісники проаритмії, такі як подовження інтервалів P–R, QRS або Q–T, нестійка шлуночкова тахікардія або паузи (випадіння одного або кількох суміжних шлуночкових комплексів, епізоди асистолії). Якщо у пацієнта відмічають погіршення симптоматики, слід оцінити доцільність проведення повторних аналізів крові, тривалої ЕКГ-реєстрації та повторних ЕКГ.
Пацієнт повинен бути повністю інформований про переваги і недоліки різних методів лікування — антикоагулянтної терапії, засобів для контролю ЧСС, протиаритмічних засобів або інтервенційного лікування. Також доречно повідомити хворому з «ізольованою» або ідіопатичною ФП про сприятливий прогноз, якщо буде виключено наявність серцево-судинного захворювання.
Необхідні дії
Рекомендації з діагностики та початкового ведення ФП
Діагностика
Необхідні дії
Програма діагностики фібриляції (тріпотіння) передсердь
1. Збір скарг та анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ.
4. Лабораторне обстеження:
- загальний аналіз крові;
- загальний аналіз сечі;
- АлАТ;
- АсАТ;
- білірубін;
- креатинін (з визначенням кліренсу креатиніну);
- ліпідограма та ТГ;
- глюкоза в крові;
- гормони щитовидної залози і гіпофізу (Т3,Т4 вільний, ТТГ);
- коагулограма та МНВ, АЧТЧ.
5. ЕКГ у 12 відведеннях.
6. ЕхоКГ.
7. Проба з фізичним навантаженням.
8. Добовий моніторинг ЕКГ або реєстрація випадків.
9. ЕФД (за необхідності).
10. Черезстравохідна (ТЕ-ехоКГ).
11. Рентгенографія органів грудної клітки.
12. Маркери запального процесу в міокарді.
Лікування
Положення протоколу
Перелік і обсяг медичних послуг обов’язкового асортименту
Хворі повинні отримувати комплексну терапію:
1. Антикоагулянтна терапія показана всім хворим з ФП (СHА2DS2-VASc ≥2(3)) невизначено довго. Слід надавати перевагу НОАК (СHА2DS2-VASc ≥2(3)).
2. Непрямі антикоагулянти під контролем МНВ (ПТІ при неможливості визначення МНВ) за наявності таких факторів:
- вік ≥60 років, за наявності цукрового діабету, ІХС (МНВ 2,0–3,0, цільова величина 2,5);
- вік ≥75 років, жіноча стать (МНВ 2,0–3,0, цільова величина 2,5);
- хронічна серцева недостатність та/чи ФВ ≤35% (МНВ 2,0–3,0, цільова величина 2,5);
- тиреотоксикоз (МНВ 2,0–3,0, цільова величина 2,5);
- АГ (МНВ 2,0–3,0, цільова величина 2,5);
- ревматичний мітральний стеноз (МНВ 2,5–3,5, цільова величина 3);
- протезовані клапани серця (МНВ 2,5–3,5, цільова величина 3);
- тромбоемболії в анамнезі (МНВ 2,5–3,5, цільова величина 3);
- тромбоутворення в порожнинах серця за даними трансторакальної ехоКГ та черезстравохідної ехоКГ (МНВ 2,5–3,5, цільова величина 3).
Профілактична антикоагулянтна терапія АВК (варфарин) або НОАК (апіксабан, ривароксабан, дабігатран) показана хворим з персистуючою формою ФП (тривалістю понад 48 год), яким запланована медикаментозна або електрична кардіоверсія, протягом 3 тиж до і 4 — після кардіоверсії (рис. 8). За наявності факторів високого ризику тромбоемболічних ускладнень у хворих із постійною формою ФП показана профілактична антикоагулянтна терапія АВК або НОАК. У хворих, що приймають АВК, із підвищеним ризиком кровотечі, але за відсутності протипоказань для проведення антикоагулянтної терапії (із цільовими показниками МНВ 2,0–3,0) цільове значення МНВ повинно відповідати інтервалу 1,6–2,5.
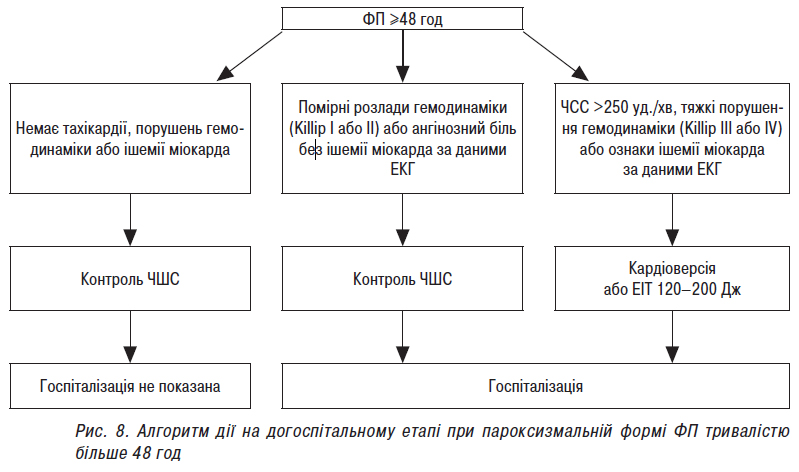
Оцінку МНВ необхідно проводити кожного тижня з початку пероральної антикоагулянтної терапії та кожного місяця після досягнення необхідного рівня МНВ.
Обов’язковий 3-тижневий період застосування ОАК перед процедурою кардіоверсії може бути скорочений, якщо при ТЕ-ехоКГ не виявлені тромби в лівому передсерді або вушку лівого передсердя (ВЛП). ТЕ-ехоКГ може не лише виявити тромби у ВЛП або будь-де в іншій ділянці порожнини лівого передсердя, але й ідентифікувати спонтанний ехо-контраст або ускладнену аортальну атеросклеротичну бляшку. Стратегія кардіоверсії під контролем ТЕ-ехоКГ рекомендована у якості альтернативи кардіоверсії з попередньою 3-тижневою антикоагулянтною терапією, якщо доступні досвідчений персонал та належне устаткування, а також за необхідності раннього проведення кардіоверсії за умови, якщо попередня терапія ОАК не може бути використана через відмову пацієнта приймати таке лікування або через високий ризик геморагічних ускладнень, чи при наявності високого ризику утворення тромбу в лівому передсерді/ВЛП.
Якщо при ТЕ-ехоКГ тромб у лівому передсерді не виявляється, перед процедурою кардіоверсії необхідно розпочати введення нефракціонованого гепарину або низькомолекулярного гепарину і продовжувати введення цього препарату до того часу, поки ОАК не дозволить досягнути цільового рівня МНВ. Як альтернатива при проведенні кардіоверсії можливе використання НОАК (ривароксабану, дабігатрану, апіксабану та ін.).
Якщо при ТЕ-ехоКГ виявляється тромб у лівому передсерді або у ВЛП, показаний принаймні 3-тижневий прийом АВК (МНВ 2,0–3,0) або НОАК, після чого виконується повторна ТЕ-ехоКГ. Якщо при цьому підтверджується зникнення тромбу, можна виконати кардіоверсію, після якої пожиттєво призначається ОАК. Якщо тромб все ще залишається, стратегія контролю серцевого ритму може бути змінена на стратегію контролю ЧСС, особливо якщо симптоми ФП контролюються, оскільки у таких пацієнтів відзначається високий ризик тромбоемболічних ускладнень у разі проведення кардіоверсії. Про високий ризик тромбоемболій свідчить наявність феномену спонтанного контрастування 3+–4+ за даними ТЕ-ехоКГ.
3. Для контролю ЧШС при ФП:
- у хворих без ДШП — внутрішньовенно блокатори бета-адренорецепторів та недигідропіридинові блокатори кальцієвих каналів (верапаміл, дилтіазем);
- при СН — внутрішньовенно блокатори бета-адренорецепторів + дигоксин, аміодарон + дигоксин;
- у хворих з ДШП — пропафенон, аміодарон;
- у хворих із ХОЗЛ — дилтіазем, верапаміл, препарати наперстянки, селективні блокатори бета-адренорецепторів.
4. Антиаритмічні препарати, показані для відновлення синусового ритму: пропафенон, флекаїнід, аміодарон.
5. Антиаритмічні препарати показані для збереження синусового ритму:
- при ідіопатичній ФП (у хворих без структурних захворювань серця) — профілактика ремоделювання, інгібітори АПФ/БРА/статини, блокатори бета-адренорецепторів за показаннями, дронедарон, пропафенон, флекаїнід, етацизин, соталол, при неефективності цих препаратів — аміодарон;
- при ФП у хворих з АГ за відсутності гіпертрофії ЛШ — пропафенон, етацизин, флекаїнід, соталол, у разі відсутності ефекту — аміодарон. За наявності значної гіпертрофії ЛШ — аміодарон;
- при ФП на тлі ІХС — соталол, аміодарон;
- при хронічній СН — аміодарон.
6. Препарати, що застосовуються при постійній формі ФП для контролю ЧШС:
- дигоксин — у пацієнтів із СН та дисфункцією ЛШ, а також осіб, які ведуть малорухливий (неактивний) спосіб життя (у комбінації з блокаторами бета-адренорецепторів);
- блокатори бета-адренорецепторів — при ІХС, АГ, СН (у комбінації з дигоксином);
- недигідропіридинові антагоністи кальцію — при АГ, ІХС, ХОЗЛ;
- соталол, аміодарон — при неефективності препаратів або за наявності ДШП.
7. Електрична кардіоверсія.
1) Планова електрична кардіоверсія показана при:
- неефективності медикаментозної терапії,
- непереносимості антиаритмічних засобів або при ризику, пов’язаному з їх призначенням,
- прогресуванні СН, погіршенні кровопостачання серця, мозку, нижніх кінцівок, пов’язаному з тахіаритмією;
- наявності даних про те, що лише кардіоверсія була раніше ефективною для відновлення синусового ритму при ФП.
2) Невідкладна електрична кардіоверсія показана:
- при пароксизмі ФП з високою ЧСС на тлі гострого ІМ, нестабільної стенокардії;
- при пароксизмі ФП, який супроводжується симптоматичною гіпотензією, гострою або прогресуючою хронічною СН;
- тяжкому пароксизмі ФП, який не піддається медикаментозному лікуванню;
- черезшкірна електрокардіостимуляція при ТП з метою його купірування (за умови насичення антиаритмічних препаратів).
8. В амбулаторних умовах введення прокаїнаміду для відновлення синусового ритму протипоказане.
Перелік медичних послуг додаткового асортименту
1. Хворим, які не переносять АСК, показані тієнопіридинові антитромбоцитарні препарати.
2. Імплантація кардіостимулятора у відповідному режимі за наявності супутніх порушень АV-провідності та СССВ.
3. Катетерне лікування при:
- неефективності медикаментозної терапії, що проводиться в адекватних дозах;
- аритмогенній дії антиаритмічних препаратів;
- нападах ФП і ТП з погіршенням гемодинаміки;
- поєднанні ФП із синдромом передчасного збудження шлуночків;
- ізольованому ТП.
4. Пацієнти потребують адекватного лікування супутніх захворювань, АГ, уражень щитовидної залози та цукрового діабету.
Обґрунтування
Завдання стаціонарного етапу:
1. Лікування ускладнень, пов’язаних із тахіаритмією (зменшення вираженості ознак СН та ішемії міокарда, якщо такі мали місце).
2. Вирішення питання про доцільність відновлення синусового ритму для кожного пацієнта індивідуально.
3. Підбір адекватної (можливо комбінованої) антиаритмічної терапії для утримання синусового ритму.
4. Підготовка хворого до планової електричної кардіоверсії.
Необхідні дії
Тривалий контроль ЧСС
Нерегулярний ритм та висока ЧШС при ФП можуть викликати різні симптоми, такі як відчуття посиленого серцебиття, задишка, підвищена втомлюваність та запаморочення. Адекватний контроль ЧШС може зменшити вираженість цієї симптоматики та покращити гемодинаміку, забезпечуючи достатньо часу для наповнення шлуночків та попереджаючи розвиток тахікардіоміопатії.
Інтенсивність контролю ЧСС
Рівень контролю ЧСС, який є оптимальним щодо захворюваності, смертності, якості життя та симптоматики, наразі невідомий. У попередніх настановах рекомендувався жорсткий контроль ЧСС, який має на меті забезпечити цей показник на рівні 60–80 уд./хв у стані спокою та 90–115 уд./хв під час помірного фізичного навантаження, що ґрунтувалося на типі терапії, яка застосовувалася в дослідженні AFFIRM.
Фармакологічний контроль ЧСС
Лікарські засоби, які використовуються для фармакологічного контролю ЧСС
Головними факторами, які визначають ЧШС при ФП, є характер проведення імпульсу, рефрактерність AV-вузла та тонус симпатичної і парасимпатичної нервової системи. Часто використовуються такі лікарські засоби, як блокатори бета-адренорецепторів, недигідропіридинові блокатори кальцієвих каналів і препарати наперстянки. Може виявитися необхідним застосування комбінацій різних препаратів. Аміодарон може бути корисним для деяких пацієнтів, у яких ЧСС рефрактерна до інших лікарських засобів. У пацієнтів із СН може мати переваги застосування комбінації блокатора бета-адренорецепторів та препарату наперстянки.
До лікарських засобів, які дозволяють контролювати ЧСС, належать:
- блокатори бета-адренорецепторів — можуть бути особливо корисними на фоні високого адренергічного тонусу або при симптоматичній ішемії міокарда, що розвивається при ФП. У кількох дослідженнях, де блокатори бета-адренорецепторів порівнювалися з плацебо та дигоксином, були показані ефективність та безпека тривалого лікування цими препаратами. У дослідженні AFFIRM блокатори бета-адренорецепторів широко застосовувалися з метою жорсткого контролю ЧСС. Дози блокаторів бета-адренорецепторів, які застосовуються найчастіше, представлені у табл. 68, 69;
- недигідропіридинові блокатори кальцієвих каналів (верапаміл та дилтіазем) — ефективні для контролю ЧСС при ФП як у гострий період, так і для тривалої терапії ФП. Цих лікарських засобів слід уникати у пацієнтів із систолічною СН з огляду на їх негативний інотропний ефект;
- дигоксин — ефективний для контролю ЧСС у стані спокою, але не під час фізичного навантаження. У комбінації з блокаторами бета-адренорецепторів він може бути ефективним у пацієнтів як із СН, так і без неї. Дигоксин може викликати (небезпечні для життя) побічні ефекти, і тому має призначатися з обережністю. При застосуванні цього препарату можуть відмічати лікарські взаємодії з іншими засобами;
- аміодарон є ефективним лікарським засобом для контролю ЧСС. Внутрішньовенне застосування аміодарону є ефективним та добре переноситься пацієнтами з порушеннями гемодинаміки. Аміодарон також може призначатися для тривалого лікування ФП, коли звичайні підходи виявляються неефективними, але він може викликати тяжкі екстракардіальні побічні ефекти, такі як дисфункція щитовидної залози та брадикардія. Аміодарон, який зазвичай призначається для контролю серцевого ритму, може при цьому ненавмисно продовжувати використовуватися і для контролю ЧСС при прогресуванні захворювання до постійної ФП. У такій клінічній ситуації аміодарон слід відмінити, за винятком випадків, коли більш безпечні лікарські засоби не можуть бути призначені.
Інші протиаритмічні препарати I класу неефективні для контролю ЧСС. Соталол не повинен використовуватися для контролю ЧСС у якості монотерапії, хоча його додаткові ефекти по відношенню до контролю ЧСС можуть бути корисними, якщо він використовується в першу чергу для контролю ритму.
Як здійснювати контроль ЧСС
Результати, отримані у дослідженні RACE II, та раніше зроблені спостереження, за даними нерандомізованих досліджень, свідчать про те, що спочатку слід використовувати гнучкий контроль ЧСС, спрямований на утримання цього показника на рівні <110 уд./хв у стані спокою. Дози лікарських засобів, які використовуються для контролю ЧСС, можуть підвищуватися, і ці препарати можуть комбінуватися один з одним, поки цього цільового рівня не буде досягнуто. Якщо при цьому пацієнт продовжує залишатися симптомним, особливо якщо скарги пов’язані з надмірною ЧСС або нерегулярністю серцевого ритму, необхідно орієнтуватися на більш жорсткі цільові рівні ЧСС. ЧШС має знижуватися, поки не зникнуть симптоми або поки симптоми не стануть такими, що легко переносяться, або поки не стане зрозумілим, що симптоми обумовлені супутнім захворюванням, а не ЧСС чи серцевим ритмом. Якщо застосовується стратегія жорсткого контролю ЧСС (цільова ЧСС <80 уд./хв у стані спокою та <110 уд./хв при помірному фізичному навантаженні), слід виконати 24-годинне холтерівське моніторування для оцінки наявності пауз (випадіння одного або кількох суміжних шлуночкових комплексів, епізодів асистолії) та брадикардії. Якщо симптоми пов’язані із фізичним навантаженням, необхідно виконати дослідження з навантажувальними пробами (рис. 9). Вибір лікарських засобів для контролю ЧСС залежить від віку пацієнта, наявності серцевого захворювання та цілей лікування (рис. 10). У пацієнтів, які залишаються симптомними, при застосуванні стратегії жорсткого контролю ЧСС може бути оцінена доцільність застосування терапії, орієнтованої на контроль серцевого ритму.
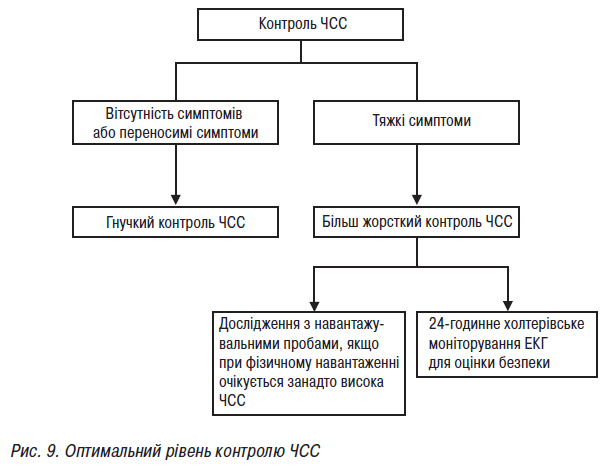
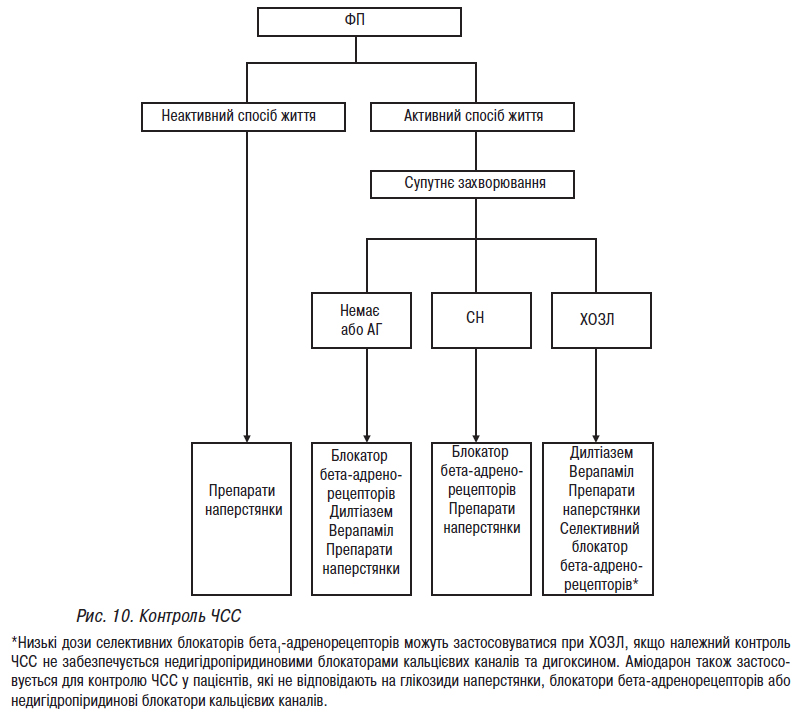
Тривалий контроль серцевого ритму
Протиаритмічні лікарські засоби, які використовуються для підтримання синусового ритму
Головною метою терапії, спрямованої на контроль серцевого ритму, є зменшення вираженості симптомів, обумовлених ФП. Навпаки, асимптомні пацієнти (або ті, що стають асимптомними при адекватному контролі ЧСС) зазвичай не повинні отримувати антиаритмічних лікарських засобів.
Нижче представлені принципи лікування антиаритмічними препаратами з метою підтримання синусового ритму при ФП:
1) Лікування обумовлене спробою полегшити пов’язані з ФП симптоми.
2) Ефективність антиаритмічних препаратів у підтриманні синусового ритму є невисокою.
3) Клінічно ефективна терапія антиаритмічними препаратами може знизити ймовірність рецидивів ФП, але не усунути їх зовсім.
4) Якщо один антиаритмічний препарат виявляється неефективним, клінічно прийнятна відповідь може бути отримана при застосуванні іншого.
5) Часто виявляють індуковану лікарськими засобами проаритмію або екстракардіальні побічні ефекти застосування таких препаратів.
6) При виборі антиаритмічного препарату слід орієнтуватися в першу чергу на його безпеку, а не на ефективність.
Окремі лікарські препарати обговорюються нижче, і їх основні недоліки представлені в табл. 68–70.
Вибір антиаритмічних препаратів
Стратегію антиаритмічної терапії рецидивуючої ФП рекомендується розробляти на основі вибору безпечнішого, хоча, можливо, й менш ефективного лікарського засобу, відмовляючись від більш ефективного, але менш безпечного лікування. ФП, яка розвивається у пацієнтів без серцево-судинного захворювання або з невираженим ураженням серця, може лікуватися за допомогою майже будь-якого антиаритмічного препарату, схваленого для терапії ФП. Більшість пацієнтів з ФП будуть спочатку отримувати блокатори бета-адренорецепторів для контролю ЧСС. Аміодарон є резервним препаратом для тих пацієнтів, у яких лікування іншими антиаритмічними препаратами виявилося неуспішним або які мають виражене органічне ураження серця.
Пацієнти з ФП та мінімальною або відсутньою патологією серця (ізольована ФП). У пацієнтів з мінімальною або відсутньою патологією серця призначення блокаторів бета-адренорецепторів є логічною першою спробою профілактики рецидивів ФП, коли аритмія чітко пов’язана з психічним або фізичним перенапруженням (адренергічна ФП). Оскільки блокатори бета-адренорецепторів не дуже ефективні у багатьох інших пацієнтів з «ізольованою ФП», зазвичай призначаються флекаїнід, пропафенон, соталол або дронедарон (рис. 11).
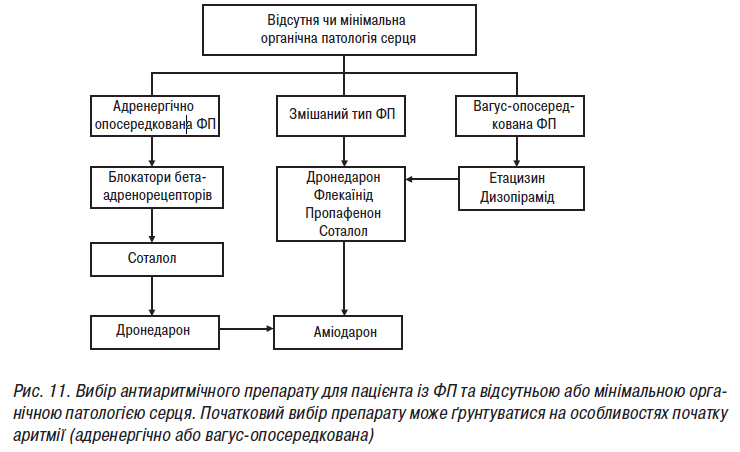
Пацієнти із захворюваннями серця. Серцево-судинне захворювання традиційно включає різноманітні патофізіологічні субстрати: гіпертрофію, ішемію та застійну СН (рис. 12). При кожному із цих уражень рекомендується уникати певних лікарських засобів. У дослідженнях за участю пацієнтів з ФП або іншими аритміями було показано значну токсичність флекаїніду та пропафенону, яка була визначена як наслідок антиаритмічного та/або негативного інотропного ефектів цих препаратів. Відомо, що соталол подовжує інтервал Q–T та спричиняє виникнення torsades de pointes у вразливих пацієнтів, до яких, ймовірно, належать особи з вираженою гіпертрофією ЛШ та СН. Дослідження за участю пацієнтів, що перенесли ІМ, показали, що соталол може відносно безпечно застосовуватися у пацієнтів з коронарним атеросклерозом. Для більшості пацієнтів із значущими органічними захворюваннями серця, особливо із СН та гіпертрофією ЛШ, в Україні доступний лише аміодарон. Починають з’являтися дані про те, що аміодарон може не бути безпечним для довготривалого застосування у пацієнтів із СН III ФК за NYHA.
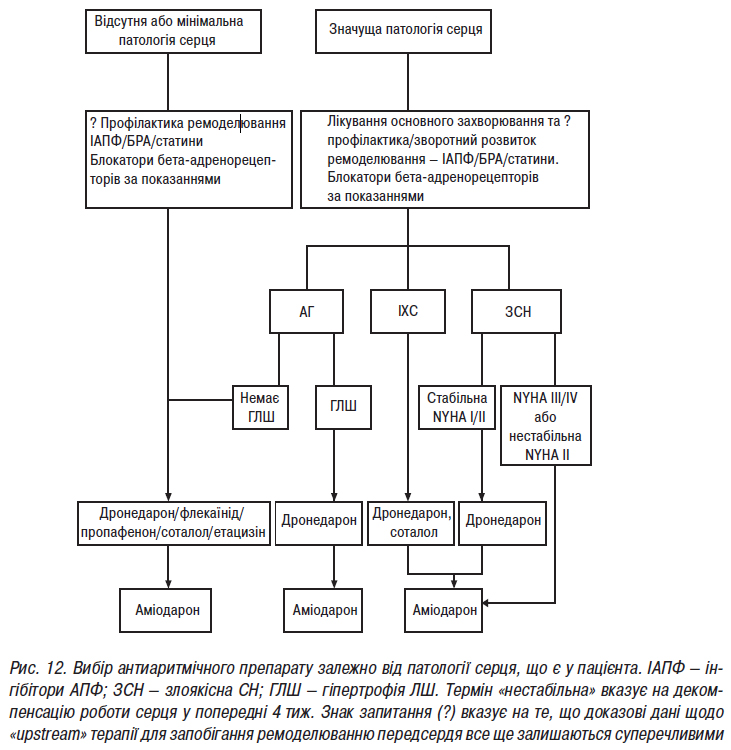
Госпіталізація
Положення протоколу
У разі необхідності відновлення синусового ритму при персистуючій формі аритмії за неефективності амбулаторного лікування рутинними заходами та/або при порушеннях гемодинаміки, або для планової ЕІТ. За відсутності ефекту від антиаритмічної терапії.
Обґрунтування
Якщо медикаментозно в стаціонарі не вдалося відновити синусовий ритм, але є обставини на користь проведення планової електричної кардіоверсії, то:
1. Пацієнт виписується з клініки з подальшим наглядом дільничного терапевта або кардіолога.
2. Триває лікування основного захворювання і призначається антиаритмічний препарат для контролю ЧШС.
3. Триває розпочате в стаціонарі лікування варфарином протягом 3–4 тиж (МНВ у межах 2,0–3,0) або НОАК до проведення кардіоверсії і 4 тиж після її проведення.
4. Перед проведенням планової електричної кардіоверсії або ЕІТ обов’язкове черезстравохідне ехоКГ-дослідження.
Якщо пацієнт прийшов до терапевта і давність ФП невідома, що робити?
1. Якщо існують обставини на користь відновлення синусового ритму, то планувати проведення планової електричної кардіоверсії.
2. Обов’язкове проведення черезстравохідного ехоКГ-дослідження.
3. Призначається антиаритмічний препарат для контролю ЧСС і лікується основне захворювання (цільові рівні АТ, стабілізація ФК стенокардії або хронічної СН та ін.).
4. Призначається варфарин протягом 3–4 тиж (МНВ у межах 2,0–3,0) до проведення кардіоверсії або НОАК і 4 тиж після її проведення.
Коли можна проводити електричну кардіоверсію, якщо ФП триває більше 48 год?
1. За умови відсутності тромбів за даними черезстравохідної ехоКГ.
2. У разі екстреної кардіоверсії (нестабільна гемодинаміка).
3. Болюсно вводиться гепарин у дозі 5–10 тис. ОД з наступним його введенням у дозі, необхідній для подовження АЧТЧ (активованого парціального тромбопластинового часу) в 1,5–2 рази від контрольних значень (у нормі 25–42 с). Можливе застосування НОАК за 2–4 год до кардіоверсії.
4. Після відновлення ритму на 3–4 тиж призначають варфарин (МНВ 2,0–3,0) або НОАК.
Коли можна проводити електричну кардіоверсію (ЕІТ) без черезстравохідної ехоКГ?
1. Якщо ФП триває менше 48 год і немає факторів ризику розвитку тромбоемболічних ускладнень.
2. Внутрішньовенно болюсно вводиться гепарин у дозі 5–10 тис. ОД з наступним його введенням у дозі, необхідній для подовження АЧТЧ (або активованого парціального тромбопластинового часу) в 1,5–2 рази від контрольних значень (у нормі від 25–42 сек). Можливе використання НОАК за ≥2–4 год до кардіоверсії.
3. Після відновлення ритму на 3–4 тиж призначають варфарин (МНВ 2,0–3,0) або НОАК.
Рекомендації щодо антитромботичної терапії при ТП і ІХС
1. Антитромботична терапія при ТП, як правило, така сама, як при ФП.
2. Вибір антитромботичного препарату за одними й тими самими критеріям незалежно від типу ТП.
3. Лікувати хворих з ІХС непрямими антикоагулянтами на основі тих самих критеріїв, які застосовують у хворих без ІХС.
Досить часто ставлять питання щодо того, як вчинити з пацієнтом, який має постійну ФП і якому планується хірургічне втручання з приводу ІХС.
Проведення операцій на коронарних артеріях у пацієнтів з ІХС та ФП
|
Коронарне втручання у пацієнтів з ФП при терапії ПОАК |
||
|
Лікування при госпіталізації |
||
|
Планове ЧКВ при стабільній ІХС |
ГКС з підйомом сегмента ST |
ГКС без підйому сегмента ST |
|
|
|
|
|
|
|
|
|
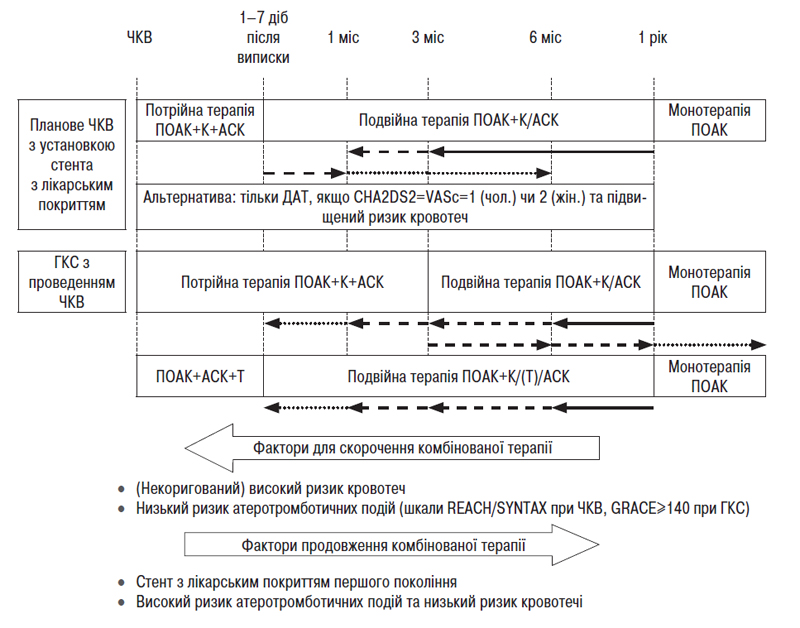
При черезшкірних втручаннях (ЧШВ) на коронарних артеріях зазвичай доводиться переривати антикоагулянтну терапію або знижувати її інтенсивність.
Відмінити варфарин за 1 тиж до операції.
У подальшому необхідно користуватися схемами, що представлені на рисунках.
Необхідні дії
Див. алгоритм дії на догоспітальному етапі при пароксизмальній формі ФП тривалістю <48 год.
Див. алгоритм дії на догоспітальному етапі при пароксизмальній формі ФП тривалістю >48 год.
Виписка
Положення протоколу
ЧШС вважається контрольованою, коли вона варіює в діапазоні 60–80 уд./хв у стані спокою і 90–110 уд./хв — при помірному ФН.
Якщо у пацієнта відновився синусовий ритм або він госпіталізований у стаціонар з таким, то при виборі антиаритмічного препарату рекомендується діяти згідно з наступними алгоритмами, оскільки пацієнти із ФП і відновленим синусовим ритмом можуть бути віднесені до тієї чи іншої групи.
Обґрунтування
Алгоритм дій для вибору стратегії профілактичної антиаритмічної терапії при ФП
Група I: пацієнти з першим або вперше виявленим пароксизмом ФП.
А. У пацієнта відбулося спонтанне відновлення синусового ритму.
Б. Пароксизми ФП, купірувані за допомогою фармакологічної або електричної кардіоверсії.
Коментар: імовірність рецидиву ФП невідома. Тривала антитромботична терапія невиправдана.
- Таким пацієнтам на 1 міс призначається антитромботична терапія з метою утримання синусового ритму.
- На 1 міс призначається антитромботичний препарат за умови відсутності факторів ризику тромбоемболії, про які буде зазначено нижче. Якщо ризик тромбоемболічних ускладнень високий або середній, то застосування непрямих антикоагулянтів довічне.
Група II: пацієнти з рецидивуючими пароксизмами ФП (без попередньої антиаритмічної терапії).
А. Пацієнти з безсимптомними пароксизмами ФП (за результатами холтерівського моніторування ЕКГ).
Коментар: роль антиаритмічної терапії в профілактиці рецидивів пароксизмів ФП/ТП достовірно не визначено, але рекомендується постійний прийом антитромботичної терапії.
Б. Пацієнти з епізодами ФП, що супроводжується клінічною симптоматикою, але рідше 1 разу на 3 міс.
Коментар: купірування нападу ФП або контроль ЧШС (див. табл. 68, 69).
С. Пацієнти з нападами ФП і клінічною симптоматикою, але частіше 1 разу на 3 міс.
Коментар: виправдано тривале призначення антиаритмічних препаратів для профілактики пароксизмів ФП, антикоагулянтів або розглядається хірургічне лікування.
Група III: пацієнти з рецидивуючими пароксизмами ФП й неефективною антиаритмічною терапією.
А. Пацієнти з безсимптомними пароксизмами ФП.
Коментар: спроба підбору більш ефективних антиаритмічних препаратів (клінічні дослідження проводяться), антикоагулянтів, можливо хірургічне лікування (див. табл. 74–77).
Б. Пацієнти з пароксизмами і клінічною симптоматикою під час ФП, але рідше 1 разу на 3 міс.
Коментар: спроба підбору антиаритмічних препаратів, антитромботична терапія, доцільне хірургічне лікування.
С. Пацієнти з пароксизмами ФП частіше 1 разу на 3 міс, що супроводжуються клінічною симптоматикою.
Коментар: необхідні хірургічне лікування, антитромботична терапія. При неможливості хірургічного лікування — контроль ЧШС.
Якими препаратами найкраще утримувати синусовий ритм?
Метааналіз 35 рандомізованих досліджень з використанням 8 антиаритмічних препаратів показав, що найвищу ефективність для профілактики пароксизмів ФП мають аміодарон, соталол і пропафенон, флекаїнід. При тривалому призначенні зазначених лікарських засобів слід пам’ятати про побічні ефекти (особливо при терапії аміодароном) і разом з регулярним ЕКГ-моніторуванням контролювати стан органів-мішеней препарату.
Необхідні дії
При виборі препарату слід враховувати основне захворювання, яке стало причиною ФП, а також його перебіг і ускладнення, пов’язані з ним (інтервал Q–T до призначення антиаритмічних препаратів, порушення внутрішньошлуночкової провідності, ФК хронічної СН та ін.).
1. Якщо ФП виникла у хворих без патології серця або з його мінімальними структурними змінами (наприклад пролапс мітрального клапана, вегетативно-дизоваріальна кардіоміопатія та ін.), то профілактичну антиаритмічну терапію слід починати з антиаритмічного препарату 1С класу пропафенону або флекаїніду.
2. Якщо антиаритмічний препарат не запобігає рецидивам ФП або його застосування супроводжується побічними ефектами, слід переходити на призначення аміодарону або комбінованої антиаритмічної терапії, або обговорювати питання хірургічного лікування тахіаритмії.
3. Лікування ФП і ТП у хворих з ІХС та застійною СН, як правило, обмежується використанням аміодарону.
4. АГ, що призводить до гіпертрофії міокарда ЛШ, підвищує ризик розвитку поліморфної шлуночкової тахікардії torsade de pointes. У зв’язку із цим для запобігання рецидивам ФП надається перевага антиаритмічним препаратам 1С класу, наприклад, пропафенону, який істотно не впливає на тривалість реполяризації й інтервал Q–T.
5. Алгоритм фармакотерапії при ФП і АГ є наступним: 1) якщо гіпертрофія міокарда ЛШ >1,4 см, то використовувати аміодарон; 2) якщо гіпертрофії міокарда ЛШ немає або вона <1,4 см, то починати лікування з пропафенону або флекаїніду, а в разі його неефективності використовувати аміодарон або соталол.
Реабілітація
Положення протоколу
Вимоги до режиму праці, відпочинку, реабілітації
Не рекомендується перебування під прямими сонячними променями хворим, що приймають аміодарон. За наявності частих пароксизмів та пароксизмів з порушенням гемодинаміки хворі потребують направлення на медико-соціальну експертну комісію для визначення можливості продовжувати професійну діяльність.
На підставі наказу МОЗ України від 30.10.1992 р. № 206 санаторно-курортному лікуванню підлягають хворі з пароксизмальною або персистуючою формами ФП та ТП після відновлення синусового ритму та підбору адекватної протирецидивної терапії, з нападами порушень ритму не частіше 2 разів на місяць.
Обґрунтування
Специфічної реабілітації хворі із ФП не потребують.
Необхідні дії
Реабілітація основного захворювання.
Вимоги до дієтичних призначень і обмежень
Хворі повинні отримувати дієту з обмеженням солі до 6 г/добу, обмежується вживання тваринних жирів та продуктів, які містять ХС. При надмірній масі тіла обмежується енергетична цінність їжі. Нормалізація індексу маси тіла.
За наявності шкідливих звичок — відмова від тютюнопаління, обмеження вживання алкоголю, кофеїну.
Диспансерне спостереження
Диспансерне спостереження має бути спрямоване на ефективну профілактику пароксизмів ФП та їх ускладнень.
Положення протоколу
При нападах ФП частіше ніж 1 раз на 3 міс хворі потребують постійного щоденного застосування препаратів.
Хворі повинні перебувати на диспансерному обліку за місцем проживання. Щорічне обов’язкове обстеження, при необхідності обстеження й корекція терапії частіше ніж 1 раз на рік. Обов’язковий регулярний контроль МНВ (ПТІ при неможливості визначення МНВ).
Обґрунтування
Перед дільничним терапевтом та/або кардіологом можуть стояти кілька завдань із ведення пацієнтів із ФП на амбулаторному етапі:
1. Перш за все це лікування основного захворювання, яке стало причиною ФП.
2. Утримання синусового ритму якомога довше.
3. Контроль ЧШС при постійній формі ФП.
4. Активне використання критеріїв обставин у вирішенні питання про відновлення синусового ритму.
5. Дотримання послідовності в рекомендаціях, які були дані в стаціонарі (наприклад прийняте рішення про відновлення синусового ритму за допомогою планової електричної кардіоверсії).
6. Використання алгоритмів з тактики і тривалості застосування антиаритмічних препаратів і можливостей хірургічного лікування хворих.
Необхідні дії
Щорічне обов’язкове обстеження, при необхідності обстеження і корекція терапії частіше, ніж 1 раз на рік.
Обов’язковий регулярний контроль МНВ (ПТІ при неможливості визначення МНВ) (кожного тижня):
Слід підраховувати час у терапевтичному діапазоні (TTR) на кожному візиті:
- використовувати валідовані методи вимірювання (наприклад метод Rosendaal) для комп’ютеризованого обчислення дозування;
- % вимірів у терапевтичному діапазоні під час підрахунку вручну;
- виключати показники за перші 6 тиж застосування АВК;
- враховувати дані принаймні за 6 міс.
Оптимальне МНВ
На сьогодні рівень антикоагуляції при застосуванні АВК оцінюється за допомогою величини МНВ, яка є відношенням дійсного протромбінового часу пацієнта та протромбінового часу стандартизованої контрольної сироватки.
Враховуючи необхідність збалансування ризику інсульту, який підвищується зі зниженням МНВ, та ризику геморагічних ускладнень, який зростає при підвищенні МНВ, було визначено, що оптимальним діапазоном для профілактики інсульту та системного емболізму у пацієнтів з неклапанною ФП вважається МНВ на рівні 2,0–3,0.
Однією з багатьох проблем, з якою доводиться стикатися при антикоагулянтній терапії за допомогою АВК, є високі міжіндивідуальні та внутрішньоіндивідуальні варіації рівнів МНВ. Крім того, при застосуванні АВК відмічають суттєву взаємодію цих препаратів з іншими лікарськими засобами, харчовими продуктами та алкоголем. За даними контрольованих клінічних досліджень, пацієнти можуть утримуватися в межах цільового діапазону МНВ 2,0–3,0 у середньому протягом 65–70% усього часу лікування, але багато досліджень з вивчення пацієнтів у «реальних клінічних умовах» показують, що ця цифра може становити <50%. У дійсності лікування пацієнтів з утриманням МНВ у межах терапевтичного діапазону протягом <65% часу може повністю нівелювати всі переваги застосування АВК. Для підрахунку відсотку часу в «терапевтичному вікні» слід застосовувати метод Rosendaal. За відсутності адекватного відсотка часу (<70%) пацієнтам необхідно рекомендувати прийом нових оральних антикоагулянтів.
Хоча для пацієнтів похилого віку були запропоновані більш низькі рівні діапазону МНВ (1,8–2,5), цей висновок не отримав доказового обґрунтування в жодному великому дослідженні. Когортні дослідження продемонстрували 2-кратне підвищення ризику інсульту при МНВ 1,5–2,0, тому утримання МНВ на рівні <2,0 не рекомендується.
На підтримання МНВ у межах цільового діапазону, а також на безпеку та ефективність цього діапазону при терапії АВК можуть впливати фармакогенетичні фактори, зокрема ген цитохрому P450 2C9 (CYP 2C9) та субодиниця 1 гена менадіону епоксид-редуктазного комплексу (VKORC1). Генотипи CYP 2C9 та VKORC1 можуть впливати на потребу пацієнта в дозі варфарину, у той час як генотипи CYP 2C9 асоційовані з геморагічними ускладненнями. Систематичне генотипування зазвичай не потрібне, оскільки воно навряд чи буде задовольняти належне співвідношення вартість/ефективність для типових пацієнтів з неклапанною ФП, але це співвідношення може бути сприятливим у хворих з високим ризиком геморагічних ускладнень, які починають приймати АВК.
Рутинні заходи щодо поліпшення результативності антикоагулянтної терапії
|
Рекомендації |
Клас |
Рівень |
|
Необхідно активно виявляти пацієнтів, які не перебувають у цільовому діапазоні МНВ при прийомі АВК |
I |
А |
|
Оцінку МНВ на початку терапії АВК необхідно здійснювати на третю добу, 1 раз на 3 дні амбулаторно та щоденно в стаціонарі. А після досягнення терапевтичного значення МНВ (тобто отримання двох послідовних результатів МНВ у межах терапевтичного діапазону) — щомісяця |
I |
А |
|
Час в терапевтичному діапазоні МНВ (TTR) необхідно рахувати на кожному візиті пацієнта (з урахуванням регулярності вимірювань МНВ):
|
IIa |
В |
|
Терапія АВК не рекомендована при поганому контролі МНВ, що підтверджується одним із наступного:
|
III |
В |
|
Якщо у пацієнта з ФП виявлено ознаки поганого контролю МНВ або неможливо регулярно проводити контроль МНВ, необхідно перевести пацієнта на один із НОАК (ривароксабан, дабігатран, апіксабан) |
I |
В |
|
У пацієнтів з ФП антиагрегантна монотерапія як альтернатива НОАК не рекомендується |
III |
В |
|
У випадках, коли пацієнт не може чи відмовляється приймати антикоагулянти, можливо розглянути призначення комбінації АСК і клопідогрелю |
ІІВ |
С |
ПТІ
Для оцінки стану системи згортання крові при застосуванні АВК показник МНВ є надійнішим, ніж ПТІ, тому що не залежить від якості реагенту. На жаль, документація, яка додається до тромбопластинів, які використовуються сьогодні в більшості українських лабораторій, не містить інформації відносно чутливості реагенту. Тому ПТІ залишається єдиним показником, за яким може здійснюватися контроль антикоагулянтної терапії. Його традиційно розраховують за формулою:
ПТІ = (контрольний протромбіновий час/протромбіновий час пацієнта) • 100%.
Для профілактики інсульту і системних емболій у пацієнтів з неклапанною ФП оптимальний ПТІ становить 50–60%, що приблизно відповідає МНВ 2,0–3,0.
Третинна (високоспеціалізована) медична допомога
Профілактика
Положення протоколу
Спеціаліст, який займається веденням пацієнта з ФП, повинен не тільки проводити початкову оцінку його стану та призначити належне лікування, але й розробити структурований план подальшого спостереження хворого.
Нижче перераховані важливі фактори, які слід брати до уваги при подальшому спостереженні пацієнта з ФП:
- Чи змінився профіль ризику пацієнта (наприклад при розвитку цукрового діабету або АГ, яких раніше не було), особливо у контексті призначення антикоагулянтної терапії?
- Чи необхідна зараз антикоагулянтна терапія — чи не з’явилися у пацієнта нові фактори ризику або чи не зникла необхідність в антикоагулянтах, наприклад, після кардіоверсії у хворого з низьким тромбоемболічним ризиком?
- Чи зменшується вираженість симптоматики у пацієнта на фоні терапії; якщо ні, то чи слід оцінити доцільність іншої стратегії лікування?
- Чи є будь-які ознаки проаритмії або ризик проаритмії; якщо так, то слід знизити дозу протиаритмічного засобу чи перейти до іншої стратегії лікування?
- Чи прогресувала пароксизмальна ФП до персистуючої/постійної форми, незважаючи на прийом протиаритмічних засобів; у такому разі чи слід оцінити доцільність застосування іншої стратегії лікування?
- Чи ефективний застосовуваний підхід контролю ЧСС; чи досягнуто цільового рівня ЧСС у стані спокою та при фізичному навантаженні?
На візитах подальшого спостереження слід виконувати ЕКГ у 12 відведеннях для документування ритму та ЧСС і оцінки прогресування захворювання. Для пацієнтів, які приймають антиаритмічні засоби, важливо оцінювати потенційні ЕКГ-провісники проаритмії, такі як подовження інтервалів PR, QRS або QT, НШТ або паузи (випадіння одного або кількох суміжних шлуночкових комплексів, епізоди асистолії). Якщо у пацієнта відмічено погіршення симптоматики, слід визначити доцільність проведення повторних аналізів крові, тривалої ЕКГ-реєстрації та повторних ЕКГ.
Пацієнт повинен бути повністю поінформований про переваги і недоліки різних методів лікування — антикоагулянтної терапії, засобів для контролю ЧСС, антиаритмічних засобів або інтервенційного лікування. Також доречно повідомити хворому з «ізольованою» або ідіопатичною ФП про сприятливий прогноз, якщо буде виключено наявність серцево-судинного захворювання.
Необхідні дії
Рекомендації з діагностики та початкового ведення ФП — табл. 71.
Діагностика
Необхідні дії
1. Збір скарг та анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ.
4. Лабораторне обстеження:
- загальний аналіз крові;
- загальний аналіз сечі;
- АлАТ;
- АсАТ;
- білірубін;
- креатинін;
- ліпідограма та ТГ;
- глюкоза в крові;
- гормони щитовидної залози і гіпофізу (Т3, Т4 вільний, ТТГ);
- коагулограма та МНВ, АЧТЧ.
5. ЕКГ у 12 відведеннях.
6. ЕхоКГ.
7. Проба із фізичним навантаженням.
8. Добовий моніторинг ЕКГ або реєстрація випадків.
9. ЕФД (за необхідності).
10. Черезшкірна ехоКГ.
11. Рентгенографія органів грудної клітки
12. Маркери запального процесу в міокарді.
Лікування
Положення протоколу
1. Хворі повинні отримувати комплексну терапію із застосуванням антиаритмічних, антикоагулянтних препаратів.
2. За необхідності проведення запланованої медикаментозної або електричної кардіоверсії доцільно чітко визначити необхідність ТЕ-ехоКГ для пацієнта молодого віку при прийнятті рішення про планову дефібриляцію для центрів без можливості ТЕ-ехоКГ, тобто обов’язковість направлення такого пацієнта до центру з можливістю ТЕ-ехоКГ.
3. Препарати для профілактики ремоделювання, інгібітори АПФ/БРА/статини.
4. Радіочастотна абляція ектопiчного вогнища.
5. За наявності пацієнти потребують адекватного лікування супутніх хвороб (ІХС, АГ, уражень щитовидної залози, цукрового діабету або інших соматичних захворювань).
6. Імплантація кардіостимулятора у відповідному режимі за наявності супутніх порушень АV-провідності та СССВ.
Катетерна абляція лівого передсердя
Стратегії лікування, що ґрунтуються на проведенні абляції, були розроблені з метою виліковування ФП в окремих популяціях пацієнтів. Тривале подальше спостереження цих хворих свідчить про те, що тоді як синусовий ритм після цієї процедури зберігається краще, ніж при застосуванні антиаритмічних препаратів, пізні рецидиви ФП не є рідкісним явищем. При цьому в більшості з відповідних досліджень брали участь пацієнти із симптомною пароксизмальною ФП та відсутньою або мінімальною органічною патологією серця.
Показання
У цілому катетерна абляція має бути резервним методом лікування пацієнтів, у яких ФП залишається симптомною, незважаючи на оптимальну медикаментозну терапію, що включає стратегії контролю ЧСС і серцевого ритму. Для вирішення питання про доцільність проведення процедури абляції у симптомного пацієнта слід взяти до уваги наступне:
1) Стадія ураження передсердя (тобто тип перебігу ФП, розміри лівого передсердя, анамнез ФП).
2) Наявність та тяжкість супутніх серцево-судинних захворювань.
3) Можливі альтернативні методи лікування (антиаритмічні препарати, контроль ЧСС).
4) Уподобання самого пацієнта.
Для кожного конкретного пацієнта із симптомною ФП необхідно отримати достатньо потенційних переваг цього втручання, щоб виправдати складну процедуру абляції, що може бути асоційована з тяжкими ускладненнями. Досвід лікаря, який виконує цю процедуру, є важливим фактором, який слід враховувати під час прийняття рішення про доцільність проведення абляції. Дослідження, результати яких стали обґрунтуванням для рекомендацій щодо виконання абляції, майже виключно проводилися за допомогою лікарів з великим досвідом проведення цієї процедури і досвідченого персоналу, що працює в спеціалізованих клініках, але в реальній клінічній практиці в багатьох клініках до виконання цього втручання можуть бути причетні менш досвідчені лікарі та молоді спеціалісти.
Доказові дані з прямого порівняння лікування антиаритмічними препаратами та катетерної абляції в якості терапії першої лінії у пацієнтів із симптомною пароксизмальною ФП є обмеженими, але окремі аналізи ефективності антиаритмічних препаратів та катетерної абляції лівого передсердя при ФП свідчать про більші переваги абляції. Проте, зважаючи на потенціал катетерної абляції ФП щодо досягнення контролю серцевого ритму у симптомних пацієнтів із пароксизмальною ФП та мінімальною або відсутньою патологією серця, а також на відносну безпеку процедури за умови її виконання досвідченими лікарями, абляція може розглядатися як стартовий метод лікування у окремих пацієнтів (рис. 13).
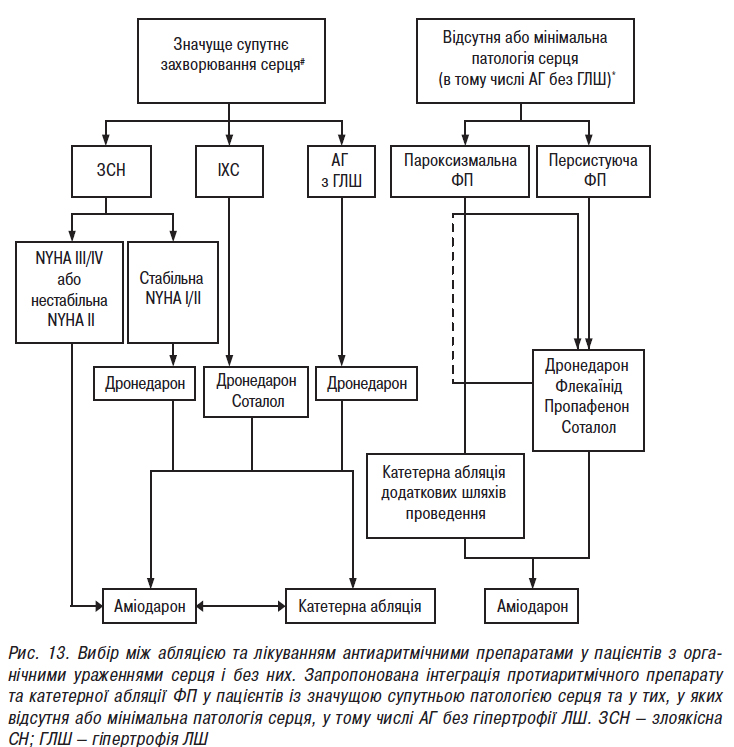
#Може знадобитися більш поширена абляція лівого передсердя; *зазвичай достатньо проведення ізоляції легеневих вен. У кожному підрозділі антиаритмічні препарати наведені в алфавітному порядку. Слід зауважити, що застосування абляції лівого передсердя у якості терапії першої лінії (пунктирна лінія) є рекомендацією класу IIb для пацієнтів з пароксизмальною ФП та відсутньою або мінімальною патологією серця, які залишаються значною мірою симптомними, незважаючи на контроль ЧСС, та які відмовляються від терапії антиаритмічними препаратами.
Для пацієнтів з персистуючою або тривалою персистуючою ФП та відсутньою або мінімальною органічною патологією серця стратегії лікування та співвідношення користь/ризик для катетерної абляції на сьогодні вивчені гірше. У таких пацієнтів можуть знадобитися поширені та часто повторювані процедури абляції, і вважається за доцільне рекомендувати перед прийняттям рішення щодо застосування абляції впевнитися в тому, що вони рефрактерні до лікування антиаритмічними препаратами. Оскільки лікування аміодароном може бути асоційоване із серйозними та частими побічними ефектами, особливо при тривалому лікуванні, доцільно оцінити можливість застосування катетерної абляції як альтернативи терапії аміодароном у пацієнтів молодшого віку.
Для симптомних хворих із пароксизмальною та персистуючою ФП та із значущими органічними захворюваннями серця перед застосуванням катетерної абляції рекомендовано призначити лікування антиаритмічними препаратами. У таких пацієнтів більш складно досягти успіху при абляції. Виправдати необхідність проведення цієї процедури може наявність серйозних симптомів, асоційованих із аритмією. Абляція персистуючої та тривалої персистуючої ФП асоційована з варіабельними, але досить оптимістичними рівнями ефективності, проте дуже часто вимагає повторних процедур. Ці процедури тривалі та технічно складні й асоційовані з вищим ризиком, ніж лише ізоляція ЛВ. У кожного окремого пацієнта слід ретельно оцінити, слід йому призначити терапію аміодароном чи катетерну абляцію після неефективності лікування менш токсичними антиаритмічними препаратами. До інших факторів, які необхідно враховувати при цьому, належать вік пацієнта, тип та тяжкість органічної патології серця, розміри лівого передсердя, супутні захворювання та уподобання хворого. Існують доказові дані на користь того, що у пацієнтів із супутніми захворюваннями, пов’язаними із ФП, можна отримати переваги від застосування абляції у якості первинної стратегії лікування; наприклад, пацієнти із СН отримують переваги від абляції лівого передсердя, оскільки при цьому можуть значно покращитися ФВ і функціональні показники, такі як переносимість фізичного навантаження.
Переваги абляції ФП не були продемонстровані для асимптомних пацієнтів.
Показання до ресинхронізувальної терапії у пацієнтів із постійною формою ФП
Імплантація пристрою для кардіоресинхронізації показана пацієнтам із ФП, які мають прояви застійної СН III та IV ФК за NYHA, тривалість QRS >120 мс та ФВ ЛШ <35% за умови, що бівентрикулярна стимуляція може бути досягнута у 100%. З метою досягнення 100% бівентрикулярної стимуляції таким пацієнтам виконують абляцію АV-вузла. Також при недостатньому медикаментозному контролі ЧШС хворим з метою контролю цього показника може бути запропонована комбінована терапія: абляція АV-вузла та імплантація CRT (табл. 73).
Можливе проведення заміни ШВРС на CRT-пристрій у пацієнтів із симптомами СН, ФВ <35% та високим відсотком шлуночкової стимуляції, у яких залишається III, IV ФК за NYHA, незважаючи на адекватну медикаментозну терапію.
Алгоритм ведення хворих із СН та постійною ФП
Обґрунтування
Доказові дані з прямого порівняння лікування антиаритмічними препаратами та катетерної абляції в якості терапії першої лінії у пацієнтів із симптомною пароксизмальною ФП є обмеженими, але окремі аналізи ефективності антиаритмічних препаратів та катетерної абляції лівого передсердя при ФП свідчать про більші переваги абляції. Проте, зважаючи на потенціал катетерної абляції ФП щодо досягнення контролю серцевого ритму у симптомних пацієнтів із пароксизмальною ФП та мінімальною або відсутньою патологією серця, а також на відносну безпеку процедури за умови її виконання досвідченими лікарями, абляція може розглядатися як стартовий метод лікування у окремих пацієнтів (рис. 14).
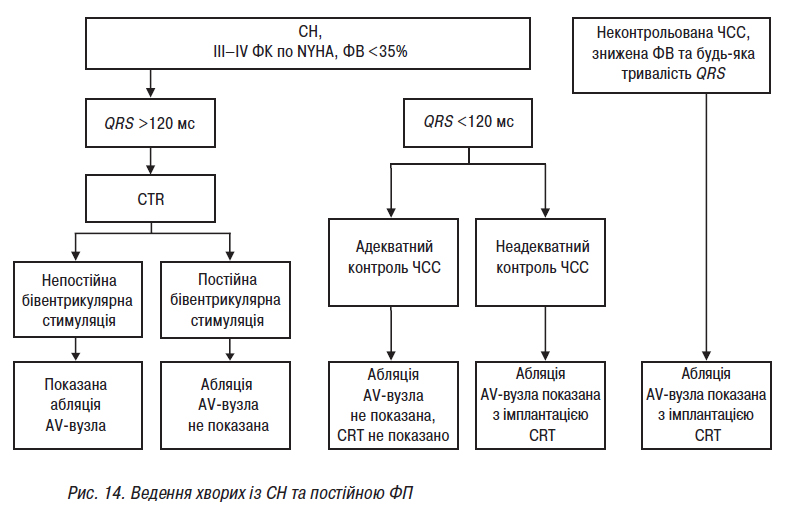
Необхідні дії
Електрична планова кардіоверсія при ФП
ФП — порушення ритму, яке досить часто доводиться відмічати в клінічній практиці. Частота виникнення ФП підвищується з віком і за наявності органічної патології серця. Так, поширеність ФП становить 0,4% серед дорослого населення, зростаючи з 0,5% в осіб віком 50–59 років до майже 9% в осіб віком 80–89 років. Також з віком підвищується ризик розвитку тромбоемболічних ускладнень — від 1,5% у віці 50–59 років до 23,5% у 80–89 років.
Розрізняють основні форми ФП: пароксизмальну, персистуючу, тривало персистуючу та постійну. Кожна із цих форм може бути вперше зареєстрованою. Пароксизмальна — повторні епізоди ФП тривалістю до 1 доби, при яких відновлення синусового ритму відбувається спонтанно, персистуюча — 1 або більше пароксизмів ФП тривалістю більше 1 доби, відновлення синусового ритму відбувається після медикаментозного лікування або електричної кардіоверсії, тривало персистуюча — епізод, що триває 1 рік та більше, коли синусовий ритм доцільно відновлювати, постійна — коли відновлення ритму не планується або протипоказано.
Перебіг ФП асоціюється з виникненням таких небезпечних ускладнень, як розвиток тромбоемболій, дестабілізацією гемодинаміки, зниженням систолічної функції серця і, як наслідок, підвищенням рівня летальності хворих.
Головною метою терапії персистуючої форми ФП є утримання та відновлення синусового ритму. Припинення ФП призводить до відновлення AV-синхронізації і фізіологічного контролю ритму, до нормальних співвідношень між провідністю і рефрактерністю (зникнення дисперсії електрофізіологічних показників), поліпшення гемодинаміки, запобігання розвитку дилатації лівого передсердя і дисфункції ЛШ, усунення загрози тромбоемболічних ускладнень, підвищення толерантності до фізичних навантажень і поліпшення якості життя хворих.
Відновлення синусового ритму можливе за допомогою електричної або фармакологічної кардіоверсії, а також їх поєднання. Усі антиаритмічні препарати, що застосовуються для фармакологічної кардіоверсії, є потенційно небезпечними і можуть викликати різні серйозні кардіальні та некардіальні побічні ефекти. Фармакологічна кардіоверсія ефективна лише у 40–70% хворих. Крім того, для відновлення синусового ритму зазвичай необхідний тривалий час. Електрична кардіоверсія є найбільш ефективним та керованим методом відновлення синусового ритму, метод є ефективним у понад 90% хворих із ФП.
Показання до відновлення синусового ритму
1) Усі пацієнти з першим епізодом, у яких не відбувається спонтанне відновлення синусового ритму протягом 48 год.
2) Пацієнти, у яких ФП, ймовірно, викликана гострою патологією (наприклад пневмонією, гіпертиреозом, вживанням алкоголю або інших токсичних продуктів, електролітними порушеннями).
3) Пацієнти, у яких після відновлення синусового ритму існує вибір способу його підтримки.
Успіх кардіоверсії сумнівний, якщо є наступні маркери зниження ймовірності досягнення та/або підтримання синусового ритму: ліве передсердя збільшено в діаметрі >50 мм; швидкість вигнання з вушка ЛШ <20 мм/с, тривалість хронічної ФП більше 12 міс; наявність тяжкої недостатності ЛШ; вади серця; хвороби легень; похилий вік; документована дисфункція синусного вузла.
Показання до електричної кардіоверсії
1. Непереносимість антиаритмічних препаратів.
2. Відсутність ефекту медикаментозної антиаритмічної терапії.
3. Прогресуюча внаслідок тахіаритмії СН, симптоми погіршення кровопостачання серця, головного мозку, порушення периферичного кровообігу.
4. Вказівка в анамнезі на позитивний ефект ЕІТ при лікуванні тахіаритмії.
Протипоказання до процедури
1. Можливий тромб у лівому передсерді:
- тривалість ФП >48 год без застосування антикоагулянтів;
- відсутні данні черезстравохідної ехоКГ (тривалість ФП >48 год без застосування антикоагулянтів).
2. Електролітний дисбаланс.
3. Глікозидна інтоксикація.
4. Протипоказання до анестезії з боку дихальної системи.
5. Маніфестний гіпертиреоз.
6. Алкогольна інтоксикація.
7. Гостра інфекція.
8. Декомпенсація застійної СН.
9. Документований СССВ без ШВРС.
10. Безперервно рецидивуюча ФП.
Підготовка до процедури
Антикоагулянтна терапія
Проведення кардіоверсії може ускладнюватися системними емболіями (так звані нормалізаційні емболії), які можуть виникати як в момент нанесення розряду, так і протягом декількох тижнів після кардіоверсії. З метою зниження ризику розвитку тромбоемболій хворим перед плановою кардіоверсією проводиться антикоагулянтна терапія, призначення якої викладено у відповідних методичних рекомендаціях.
Черезстравохідна ехо-КГ
Під час підготовки хворих до кардіоверсії виявлення тромбів, феномену спонтанного контрастування в порожнині серця за допомогою черезстравохідної ехоКГ дозволяє оцінити ризик хворого та уникнути тривалої антикоагулянтної терапії, допускаючи замість цього використання антикоагулянтів безпосередньо перед кардіоверсією і продовження терапії протягом 4 тиж після неї до відновлення механічної функції передсердь. Черезстравохідна ехоКГ дозволяє також визначити швидкість вигнання з вушка лівого передсердя, яка є незалежним маркером утримання синусового ритму.
Мультиспіральна КТ
З метою верифікації тромбоутворення в порожнинах серця може бути використана мультиспіральна КТ з контрастуванням, яка також дозволяє скоротити час підготовки до процедури.
При підготовці до планової кардіоверсії необхідно попередньо відмінити серцеві глікозиди. Тривалість відміни залежить від дози прийнятих серцевих глікозидів: при повній (насичує) терапевтичній дозі серцеві глікозиди відміняють за 3–4 дні до кардіоверсії, при невисоких дозах дигоксину кардіоверсію можна проводити після 1-, 2-денної паузи. Також за кілька днів припиняють прийом препаратів, що змінюють електролітну й кислотно-лужну рівновагу. Всередину або внутрішньовенно вводяться препарати калію, оскільки при гіпокаліємії кардіоверсія менш надійна і більш небезпечна. Необхідно відмінити препарати, що погіршують функцію синусного вузла та АV-вузла.
Метод зовнішньої електричної кардіоверсії
Електрична кардіоверсія проводиться кардіологом в умовах палати, яка оснащена електричним дефібрилятором, апаратом ШВЛ, тимчасовим зовнішнім ШВРС, монітором ЕКГ, ларингоскопом. Бригада кардіологів повинна володіти навичками інтубації та ШВЛ, нав’язування ритмоведення за допомогою тимчасового водія ритму серця.
Антифібриляторний механізм кардіоверсії обумовлений одночасною деполяризацією «критичного» числа кардіоміоцитів, що виникає після нанесення електричного розряду, і призводить до відновлення контролю над частотою водія ритму I порядку — синоатріального вузла.
Електрична кардіоверсія може бути здійснена кількома способами. Найбільш поширеною є зовнішня (трансторакальна) кардіоверсія, застосовувана з 1960-х років. При передньозадньому методі обидва електроди розміщують на грудну клітку, один з яких — на ділянку проекції правого передсердя, другий — на спину нижче лівої лопатки. Успішне відновлення серцевого ритму при використанні передньо-задньої позиції досягає понад 90%. Сучасні зовнішні дефібрилятори розраховані на проведення кардіоверсії передньобоковим методом, коли один електрод накладається на бокову стінку грудної клітки, дещо нижче ділянки верхівки серця, другий — на проекцію правого передсердя, ефективність — 80–90%.
Кардіоверсія може бути неефективною при високому порозі дефібриляції. Це може бути пов’язано з хронічним ремоделюванням передсердь (стійке зменшення ефективного рефрактерного періоду і швидкості проведення), високим грудним імпедансом. Використання передньо-задньої позиції розташування електродів дозволяє зменшити грудний імпеданс. У деяких пацієнтів дуже важливим фактором може бути особливість будови грудної клітки, хоча і у цих хворих спочатку рекомендується застосувати передньо-задню позицію. Грудний імпеданс значно зменшується при повному видиху. Слід намагатися, щоб вектор деполяризації проходив через міокард передсердь.
У ряді проведених досліджень показано, що антиаритмічні препарати IА і III класів (за класифікацією Вогана — Вільямса) мають тенденцію до зниження порогу дефібриляції, а препарати IС класу — до його підвищення. У цих ситуаціях, якщо кардіоверсія неефективна, слід припинити прийом небажаного препарату і повторити її, коли препарат буде повністю виведений.
Нанесення розряду необхідно синхронізувати з комплексом QRS, оскільки у разі його потрапляння на зубець Т можливе виникнення ФШ. Бажано також уникати проведення кардіоверсії при призначенні серцевих глікозидів, оскільки підвищується ризик виникнення шлуночкової аритмії. У пацієнтів з виявленим або удаваним синдромом тахі-брадиаритмій на випадок постконверсійної асистолії необхідно підготувати тимчасовий ЕКС.
У разі проведення планової кардіоверсії пацієнт повинен не їсти протягом 6–8 год для уникнення можливої аспірації.
Зважаючи на біль під час процедури і наявність страху у пацієнта, застосовують загальну анестезію (наприклад пропофол у дозі 10 мг/кг маси тіла або тіопентал натрію в середній дозі 4–5 мг/кг маси тіла, максимальна — 8 мг/кг маси тіла) або внутрішньовенну анальгезію та седацію (наприклад фентаніл у дозі 1 мкг/кг, потім діазепам 5–10 мг; особам літнього віку або ослабленим хворим — 10 мг тримеперидину). При вихідному пригніченні дихання використовують ненаркотичні анальгетики.
Послідовність дій при проведенні електричної дефібриляції
Хворий повинен перебувати в положенні, що дозволяє у разі необхідності проводити інтубацію трахеї (видалити зубні протези, що знімаються) і закритий масаж серця. Не допускається контакт з водою або металевою поверхнею. Повністю звільнити грудну клітку (видалити трансдермальні лікарські форми).
Обов’язковий надійний доступ до вени хворого, моніторинг ЕКГ, сатурація кисню, моніторинг АТ.
Зручніше працювати з двома ручними електродами. Встановити електроди на передній поверхні грудної клітки: один електрод встановлюють над зоною серцевої тупості (у жінок — назовні від верхівки серця, за межами молочної залози), другий — під правою ключицею, а якщо електрод спинний, то під лівою лопаткою.
Електроди можуть розташовуватися в передньозадньому положенні (вздовж лівого краю грудини в ділянці 3-го і 4-го міжреберних проміжків і в лівій підлопатковій ділянці).
Електроди можуть розташовуватися в передньобоковому положенні (у проміжку між ключицею і 2-м міжребер’ям вздовж правого краю груднини і над 5-м і 6-м міжреберними проміжками, в ділянці верхівки серця). Запобігайте розташуванню електродів над ШВРС.
Для максимального зниження електричного опору при ЕІТ шкіру під електродами знежирюють спиртом або ефіром. При цьому використовують марлеві прокладки, добре змочені натрію хлоридом 0,9%, або спеціальні пасти.
Електроди притискають до грудної стінки щільно і з силою (близько 10 кг). Слід попередити присутній персонал про початок кардіоверсії, впевнитися, що ніхто з присутніх не торкається пацієнта або ліжка.
Розряд наносять у момент повного видиху хворого.
Рекомендовані параметри кардіоверсії-дефібриляції у дорослих:
- при ФП для першого впливу досить розряду в 100 Дж;
- при збереженні аритмії у кожному наступному розряді енергію збільшують на 50– 100 Дж до максимального — 360 Дж.
Проміжок часу між спробами повинен бути мінімальним і потрібний лише для оцінки ефекту дефібриляції і набору, у разі необхідності, наступного розряду. Відразу після ЕІТ слід спостерігати хворого до виходу із седації, оцінити ритм і в разі його відновлення зареєструвати ЕКГ у 12 відведеннях.
Після проведення кардіоверсії хворий повинен зберігати режим мінімальних навантажень протягом доби після цієї процедури.
Ускладнення та їх ведення
Дія електричного струму на персонал:
- зазвичай призводить до тимчасового дискомфорту;
- кращим лікуванням є профілактика.
Тимчасове або постійне порушення роботи ШВРС: після успішного проведення і стабілізації гемодинаміки може з’явитися потреба у заміні ШВРС, при необхідності слід розпочати черезшкірну або тимчасову трансвенозну кардіостимуляцію.
Опіки шкіри: зазвичай це опіки першого ступеня, однак можуть бути глибокими. Слід провести лікування згідно зі ступенем опіку.
Збереження синусового ритму після електричної кардіоверсії не гарантовано. За даними контрольованих досліджень встановлено, що протягом 1 року тільки у 30% хворих, які отримували плацебо, зберігається синусовий ритм, отже, після його відновлення може виникнути необхідність в антиаритмічній терапії.
Госпіталізація
Положення протоколу
За необхідності відновлення синусового ритму при персистуючій формі аритмії та неефективності амбулаторного лікування рутинними заходами та/або порушеннях гемодинаміки, або для планової ЕІТ. У разі відсутності ефекту антиаритмічної терапії на амбулаторному етапі.
Необхідні дії
Якщо медикаментозно в стаціонарі не вдалося відновити синусовий ритм, але є обставини на користь проведення планової електричної кардіоверсії, то:
1. Пацієнт виписується з клініки з подальшим наглядом дільничного терапевта або кардіолога.
2. Триває лікування основного захворювання і призначається антиаритмічна терапія для контролю за ЧШС.
3. Триває розпочате в стаціонарі лікування варфарином протягом 3–4 тиж (МНВ у межах 2,0–3,0) або НОАК до кардіоверсії і 4 тиж після її проведення.
4. Перед проведенням планової електричної кардіоверсії або ЕІТ обов’язковим є черезстравохідного ехоКГ-дослідження.
Якщо пацієнт прийшов до терапевта і давність ФП невідома. Що робити?
1. Якщо існують обставини на користь відновлення синусового ритму, то планувати проведення планової електричної кардіоверсії.
2. Обов’язкове проведення черезстравохідного ехоКГ-дослідження.
3. Призначається антиаритмічна терапія для контролю ЧШС і лікується основне захворювання (цільові рівні АТ, стабілізація ФК стенокардії або хронічна серцева недостатність та ін.).
4. Призначається варфарин протягом 3–4 тиж (МНВ в межах 2,0–3,0) до проведення кардіоверсії або НОАК і 4 тиж після її проведення.
Коли можна проводити електричну кардіоверсію (ЕІТ), якщо ФП триває >48 год?
1. За умови відсутності тромбів за даними черезстравохідної ехоКГ.
2. У разі екстреної кардіоверсії (нестабільна гемодинаміка).
3. Болюсно вводиться гепарин у дозі 5–10 тис. ОД з наступним його введенням у дозі, необхідній для подовження АЧТЧ (активованого парціального тромбопластинового часу) в 1,5–2 рази від контрольних значень (у нормі 25–42 с). Можливе застосування НОАК за ≥2–4 год до кардіоверсії.
4. Після відновлення ритму на 3–4 тиж призначають варфарин (МНВ 2,0–3,0) або НОАК.
Коли можна проводити електричну кардіоверсію без черезстравохідної ехоКГ?
1. Якщо ФП триває <48 год і немає факторів ризику розвитку тромбоемболічних ускладнень.
2. Внутрішньовенно болюсно вводиться гепарин у дозі 5–10 тис. ОД з наступним його введенням у дозі, необхідній для подовження АЧТЧ (або активованого парціального тромбопластинового часу) в 1,5–2 рази від контрольних значень (у нормі від 25–42 с). Можливе застосування НОАК за ≥2–4 год до кардіоверсії.
3. Після відновлення ритму на 3–4 тиж призначають варфарин (МНВ 2,0–3,0) або НОАК.
Рекомендації щодо антитромботичної терапії при ТП та ІХС
1. Антитромботична терапія при ТП, як правило, така ж, як і при ФП.
2. Вибір антитромботичного препарату за одним і тим самим критерієм незалежно від типу ТП.
3. Лікування хворих з ІХС непрямими антикоагулянтами на основі тих самих критеріїв, які використовуються у пацієнтів без ІХС.
Досить часто ставлять питання про те, як вчинити з пацієнтами із постійною ФП, яким планується хірургічне втручання з приводу ІХС.
Якщо у пацієнтів з ФП, які отримують антикоагулянтну терапію, відмічають помірний або високий ризик тромбоемболічних ускладнень, при виконанні ЧКВ можна надати перевагу стратегії безперервної антикоагулянтної терапії, і навіть на фоні терапевтичної антикоагуляції у якості втручання першого вибору слід використовувати ЧКВ з радіальним доступом. Після операції необхідно призначити подвійну (потрійну) терапію ОАК згідно з рекомендаціями.
Виписка
Положення протоколу
Виписка зі стаціонару здійснюється за таких умов:
- відсутність або суттєве зменшення пароксизмів ФП і ТП (при пароксизмальній та персистуючій формах);
- відсутність порушень гемодинаміки під час нападу;
- контроль ЧШС;
- відсутність прогресування хронічної СН (при постійній формі ФП).
ЧШС вважається контрольованою, коли вона варіює в діапазоні 60–80 уд./хв у стані спокою і 90–110 уд./хв — при помірному фізичному навантаженні.
Якщо у пацієнта відновився синусовий ритм або він госпіталізований у стаціонар з таким, то при виборі антиаритмічного препарату рекомендується діяти згідно із зазначеними нижче алгоритмами, оскільки пацієнти з ФП і відновленим синусовим ритмом можуть бути віднесені до тієї чи іншої групи.
Обґрунтування
Алгоритм дій для вибору стратегії профілактичної антиаритмічної терапії при ФП
Група I: пацієнти з першим або вперше виявленим пароксизмом ФП.
А. У пацієнта відбулося спонтанне відновлення синусового ритму.
Б. Пароксизми ФП купірувані за допомогою фармакологічної або електричної кардіоверсії.
Коментар: ймовірність рецидиву ФП невідома, тривала антиаритмічна терапія невиправдана.
- Таким пацієнтам на 1 міс призначається антиаритмічний препарат з метою утримання синусового ритму.
- На 1 міс призначається антитромботичний препарат за умови відсутності факторів ризику тромбоемболії, про які буде зазначено нижче. Якщо ризик тромбоемболічних ускладнень високий або середній, то застосування непрямих антикоагулянтів довічне.
Група II: пацієнти з рецидивуючими пароксизмами ФП (без попередньої антиаритмічної терапії).
А. Пацієнти з безсимптомними пароксизмами ФП (за результатами холтерівського моніторування ЕКГ).
Коментар: роль антиаритмічної терапії в профілактиці рецидивів пароксизмів ФП/ТП достовірно не визначена, але рекомендується постійний прийом антитромботичної терапії.
Б. Пацієнти з епізодами ФП, що супроводжується клінічною симптоматикою, але рідше 1 разу на 3 міс.
Коментар: купірування нападу ФП або контроль ЧШС (див. табл. 74, 77)?
С. Пацієнти з нападами ФП і клінічною симптоматикою, але частіше 1 разу на 3 міс.
Коментар: виправдане тривале призначення антиаритмічної терапії для профілактики пароксизмів ФП, антикоагулянтів або розглядається хірургічне лікування.
Група III: пацієнти з рецидивуючими пароксизмами ФП і неефективною антиаритмічною терапією.
А. Пацієнти з безсимптомними пароксизмами ФП.
Коментар: спроба підбору більш ефективних антиаритмічних препаратів? (клінічні дослідження проводяться), антикоагулянти, можливо хірургічне лікування.
Б. Пацієнти з пароксизмами і клінічною симптоматикою під час ФП, але рідше 1 разу на 3 міс.
Коментар: спроба підбору антиаритмічного препарату, антитромботична терапія, доцільне хірургічне лікування.
С. Пацієнти з пароксизмами ФП частіше 1 разу на 3 міс, що супроводжуються клінічною симптоматикою.
Коментар: необхідне хірургічне лікування, антитромботична терапія. При неможливості хірургічного лікування — контроль ЧШС.
Якими препаратами найкраще утримувати синусовий ритм?
Метааналіз 35 рандомізованих досліджень з використанням 8 антиаритмічних препаратів показав, що найвищу ефективність для профілактики пароксизмів ФП мають аміодарон, соталол і пропафенон. При тривалому призначенні зазначених лікарських засобів слід пам’ятати про побічні ефекти (особливо при терапії аміодароном) і разом з регулярним ЕКГ-моніторингом контролювати стан органів-мішеней препарату.
Необхідні дії
При виборі препарату необхідно враховувати основне захворювання, яке стало причиною ФП, а також його перебіг і ускладнення, пов’язані з ним (інтервал Q–T до призначення антиаритмічних препаратів, порушення внутрішньошлуночкової провідності, ФК хронічної серцевої недостатності та ін.).
1. Якщо ФП виникла у хворих без патології серця або з його мінімальними структурними змінами (наприклад пролапс мітрального клапана, вегетативно-дизоваріальна кардіоміопатія та ін.), то профілактичну антиаритмічну терапію слід починати з антиаритміка 1С класу пропафенону або флекаїніду.
2. Якщо антиаритмічний препарат не запобігає рецидивам ФП або його застосування супроводжується побічними ефектами, слід переходити до призначення аміодарону або комбінованої антиаритмічної терапії, або обговорювати питання щодо хірургічного лікування тахіаритмії.
3. Лікування ФП і ТП у хворих із ІХС та застійною СН, як правило, обмежується використанням аміодарону.
4. АГ, що призводить до гіпертрофії міокарда ЛШ, підвищує ризик розвитку поліморфної шлуночкової тахікардії типу «пірует». У зв’язку із цим для запобігання рецидивам ФП надається перевага антиаритмічним препаратам 1С класу, наприклад пропафенону, що істотно не впливає на тривалість реполяризації і інтервал Q–T. 5. Алгоритм фармакотерапії при ФП і АГ є наступним: 1) якщо гіпертрофія міокарда ЛШ >1,4 см, то використовується аміодарон; 2) якщо гіпертрофії міокарда ЛШ немає або вона <1,4 см, то лікування слід розпочинати з пропафенону або флекаїніду, а при його неефективності використовувати аміодарон або соталол.
Реабілітація
Положення протоколу
Вимоги до режиму праці, відпочинку, реабілітації
Не рекомендується перебування під прямими сонячними променями хворим, що приймають аміодарон. За наявності частих пароксизмів та пароксизмів з порушенням гемодинаміки хворі потребують направлення на медико-соціальну експертну комісію для визначення можливості продовжувати професійну діяльність.
На підставі наказу МОЗ України від 30.10.1992 р. № 206 санаторно-курортному лікуванню підлягають хворі з пароксизмальною або персистуючою формами ФП/ТП після відновлення синусового ритму та підбору адекватної протирецидивної терапії, з нападами порушень ритму не частіше 2 разів на місяць.
Обґрунтування
Специфічної реабілітації хворі на ФП не потребують.
Необхідні дії
Реабілітація основного захворювання.
Вимоги до дієтичних призначень і обмежень
Хворі повинні дотримуватися дієти з обмеженням солі до 6 г/добу, обмеженням вживання тваринних жирів та продуктів, які містять ХС. При надмірній масі тіла обмежується енергетична цінність їжі.
За наявності шкідливих звичок — відмова від тютюнопаління, обмеження вживання алкоголю.
Диспансерне спостереження
Положення протоколу
При нападах ФП частіше ніж 1 раз на 3 міс хворі потребують постійного щоденного застосування препаратів.
Хворі повинні перебувати на диспансерному обліку за місцем проживання. Проходити щорічне обов’язкове обстеження, при необхідності — корекція терапії частіше ніж 1 раз на рік. Обов’язковий регулярний контроль МНВ (ПТІ при неможливості визначення МНВ).
Обґрунтування
Перед дільничним терапевтом та/або кардіологом можуть постати кілька завдань з ведення пацієнтів з ФП на амбулаторному етапі:
1. Перш за все це лікування основного захворювання, що стало причиною ФП.
2. Утримання синусового ритму якомога довше.
3. Контроль ЧШС при постійній формі ФП.
4. Активне користування критеріями обставин у вирішенні питання про відновлення синусового ритму.
5. Дотримуватися послідовності в рекомендаціях, які були дані в стаціонарі (наприклад прийняте рішення про відновлення синусового ритму за допомогою планової електричної кардіоверсії).
6. Використання алгоритмів з тактики і тривалості застосування антиаритмічних препаратів і можливостей хірургічного лікування хворих.
Необхідні дії
Щорічне обов’язкове обстеження, при необхідності обстеження і корекція терапії частіше ніж 1 раз на рік.
Обов’язковий регулярний контроль МНВ (ПТІ при неможливості визначення МНВ) (кожного тижня):
Необхідно підраховувати час у терапевтичному діапазоні (TTR) на кожному візиті:
- використовувати валідовані методі виміру (наприклад метод Rosendaal) для комп’ютеризованого розрахунку дозування;
- % вимірів у терапевтичному діапазоні під час розрахунку вручну;
- виключати показники за перші 6 тиж використання АВК;
- враховувати дані як мінімум за 6 міс.
Етапи медичної допомоги
Фармакотерапія при ФП, що вперше виникла
ААП — антиаритмічні препарати; ІАПФ — інгібітори АПФ; ПНЖК — поліненасичені жирні кислоти.
Стратегія профілактики тромбоемболічних ускладнень у пацієнтів із ФП
Таблиця 63. Профілактика тромбоемболічних ускладнень у пацієнтів із ФП
|
Кількість балів за шкалою CHA2DS2-VASc |
Рекомендована антитромботична терапія |
|
≥2 (чол.) ≥3 (жін.) |
НОАК або ОАК |
|
1 (чол.) 2 (жін.) |
Розглянути НОАК або ОАК |
|
0 |
Призначення антикоагулянтної або антитромбоцитарної монотерапії не потрібне |
Таблиця 64. Препарати та дози, які використовуються для фармакологічної кардіоверсії ритму при ФП (яка розпочалася нещодавно)
|
Препарат |
Доза |
Подальша доза |
Ризики |
|
Аміодарон |
5 мг/кг внутрішньовенно протягом 1 год або 600–800 мг/добу у кілька прийомів п/о (загального навантаження до 10 г) |
50 мг/год або після загального навантаження до 10 г п/о, 200 мг 1 раз на добу п/о |
Флебіт, АГ. Сповільнює ЧШС. Затримує конверсію ФП до синусового ритму |
|
Пропафенон |
2 мг/кг внутрішньовенно протягом 10 хв або 450–600 мг п/о |
Не підходить для пацієнтів з вираженим структурним ураженням серця; може подовжувати комплекс QRS; дещо сповільнює ЧШС, але може також підвищувати її через трансформацію фібриляції у ТП з проведенням імпульсів до шлуночків у співвідношенні 1:1 |
|
|
Флекаїнід |
2 мг/кг маси тіла в/в протягом 10 хв або 200–300 мг п/о |
Не підходить для пацієнтів з вираженим структурним ураженням серця; може подовжувати комплекс QRS; дещо сповільнює ЧШС, але може також підвищувати її через трансформацію фібриляції у ТП з проведенням імпульсів до шлуночків у співвідношенні 1:1 |
Таблиця 65. Рекомендації з фармакологічної кардіоверсії
|
Рекомендації |
Класa |
Рівеньb |
|
Якщо перевага надається фармакологічній кардіоверсії і у пацієнта відсутнє органічне захворювання серця, для кардіоверсії ФП, епізод якої розпочався нещодавно, рекомендоване застосування флекаїніду або пропафенону внутрішньовенно |
I |
А |
|
У пацієнтів з ФП, епізод якої розпочався нещодавно, та з органічним ураженням серця рекомендоване застосування аміодарону внутрішньовенно |
I |
А |
|
В окремих пацієнтів з ФП, епізод якої розпочався нещодавно, та без значущого структурного ураження серця слід зважити доцільність застосування однократної високої дози флекаїніду або пропафенону перорально (підхід «таблетка в кишені» (pill-in-the-pocket)), забезпечивши безпеку такого лікування за допомогою попередньої перевірки цієї стратегії в контрольованих клінічних умовах |
IIa |
В |
|
Дигоксин (РД А), верапаміл, соталол, метопролол (РД В), інші блокатори бета-рецепторів (РД С) неефективні для конверсії ФП, епізод якої розпочався нещодавно, до синусового ритму і не рекомендуються до застосування з цією метою |
III |
А, В, C |
aклас рекомендації, bрівень доказовості.
РД — рівень доказовості.
Таблиця 66. Рекомендації з КПС
|
Рекомендації |
Класa |
Рівеньb |
|
Невідкладна КПС рекомендується у разі, коли висока ЧШС не відповідає негайно на фармакологічні втручання у пацієнтів із ФП та супутньою ішемією міокарда, симптомною АГ, стенокардією або СН |
I |
С |
|
Невідкладна КПС рекомендується у пацієнтів із ФП, що включає передзбудження шлуночків, з вираженою тахікардією або гемодинамічною нестабільністю |
I |
В |
|
Слід зважити доцільність проведення планової КПС, щоб ініціювати стратегію довготривалого контролю серцевого ритму у пацієнтів з ФП |
IIa |
В |
|
Слід зважити доцільність проведення попередньої терапії аміодароном, флекаїнідом, пропафеноном або соталолом для підвищення вірогідності успішності КПС та запобігання рецидивуванню ФП |
IIa |
В |
|
У пацієнтів із вираженою симптоматикою, рефрактерних до інших методів лікування, може бути оцінена доцільність проведення повторних процедур КПС |
IIb |
C |
|
Може бути оцінена доцільність попереднього лікування блокаторами бета-адренорецепторів, дилтіаземом або верапамілом з метою контролю ЧСС, хоча ефективність цих препаратів для підвищення вірогідності успішності КПС або запобігання раннім рецидивам ФП наразі не визначена |
IIb |
С |
|
Проведення КПС протипоказане у пацієнтів з інтоксикацією препаратами наперстянки |
III |
С |
aклас рекомендації, bрівень доказовості.
Таблиця 67. Значущі питання, які мають бути поставлені перед пацієнтом з можливою або діагностованою ФП
|
Яким відчувається серцевий ритм під час епізоду аритмії — регулярним чи нерегулярним? |
|
Чи існують будь-які фактори, що сприяють виникненню епізоду аритмії, наприклад, фізичне навантаження, емоційне перенапруження або вживання алкоголю? |
|
Чи є симптоми під час епізоду аритмії помірними або тяжкими (тяжкість симптомів може бути виражена за допомогою шкали EHRA3, яка є подібною до шкали CCS-SAF41)? |
|
Чи епізоди аритмії є частими або нечастими і вони тривалі чи короткі? |
|
Чи є в анамнезі пацієнта супутні захворювання, такі як АГ, коронарний атеросклероз, СН, захворювання периферичних артерій, цереброваскулярна патологія, інсульт, цукровий діабет або хронічне захворювання легень? |
|
Чи зловживає пацієнт алкоголем? |
|
Чи є ФП у членів родини пацієнта? |
CCS-SAF = шкала тяжкості ФП Канадського серцево-судинного товариства (Canadian Cardiovascular Society Severity in Atrial Fibrillation).
Електрична кардіоверсія може виконуватися за умови наявності дефібрилятора та відповідно до компетенції лікаря загальної практики — сімейного лікаря (рис. 6).
Алгоритм дії на догоспітальному етапі при пароксизмі ФП, який виник менш ніж впродовж останніх 48 год, наведено залежно від методу відновлення ритму на рис. 7.
Таблиця 68. Лікарські засоби, які застосовують для контролю ЧСС
|
Препарат |
Доза для внутрішньовенного введення |
Звичайна підтримувальна доза для перорального прийому |
|
Блокатори бета-адренорецепторів |
||
|
Метопролол CR/XL |
2,5–5 мг |
100–200 мг 1 раз на добу (ER) |
|
Бісопролол |
н/з |
2,5–10 мг 1 раз на добу |
|
Атенолол |
н/з |
25–100 мг 1 раз на добу |
|
Пропранолол |
1 мг |
10–40 мг 3 рази на добу |
|
Карведилол |
н/з |
3,125–25 мг 2 рази на добу |
|
Недигідропіридинові блокатори кальцієвих каналів |
||
|
Верапаміл |
5 мг |
Від 40 мг 2 рази на добу до 360 мг (ER) 1 раз на добу |
|
Дилтіазем |
н/з |
Від 60 мг 3 рази на добу до 360 мг (ER) 1 раз на добу |
|
Глікозиди наперстянки |
||
|
Дигоксин |
0,5–1 мг |
0,125–0,5 мг 1 раз на добу |
|
Інші |
||
|
Аміодарон |
5 мг/кг протягом 1 год та 50 мг/год підтримувальна доза |
100–200 мг 1 раз на добу |
ER — лікарська форма сповільненого вивільнення (extended release); н/з — не зареєстровано.
Таблиця 69. Препарати для перорального прийому з метою контролю ЧШС у хворих із ФП
|
Препарат |
Навантажувальна доза |
Початок дії, год |
Підтримувальна доза |
|
Контроль ЧШС |
|||
|
Дилтіазем |
Відповідає підтримувальній дозі |
2–4 |
120–360 мг/добу; існує форма з уповільненим вивільненням |
|
Метопролол |
Відповідає підтримувальній дозі |
4–6 |
25–100 мг 2 рази на добу всередину |
|
Пропранолол |
Відповідає підтримувальній дозі |
1–1,5 |
80–240 мг/добу всередину |
|
Верапаміл |
Відповідає підтримувальній дозі |
1–2 |
120–360 мг/добу; існує форма з уповільненим вивільненням |
|
Аміодарон |
800 мг/добу протягом 1 тиж, 600 мг/добу протягом 1 тиж 400 мг/добу протягом 4–6 тиж |
1–3 тиж |
200 мг/добу |
|
Дигоксин |
0,5 мг |
2 доби |
0,125–0,375 мг/добу |
Таблиця 70. Рекомендовані дози найчастіше застосовуваних протиаритмічних препаратів та основні застереження щодо них
|
Препарат |
Доза |
Головні протипоказання та застереження |
Зміни на ЕКГ, які обумовлюють необхідність зниження дози або відміни препарату |
Сповільнення проведення імпульсу через АV-вузол |
|
Етацизин |
50–100 мг 3 рази на добу |
Протипоказаний за наявності виражених структурних змін міокарда (Q-інфаркт міокарда в анамнезі, гострі форми ІХС, ФВ <45%, ГКМП, ДКМП, виражена гіпертрофія ЛШ ≥14 мм, СН ІІА стадії та вище, гостра СН), за наявності ураження провідної системи серця та дисфункції нирок (кліренс креатиніну <15 мл/хв) |
Тривалість QRS зростає на >25% від початкового рівня |
Невелике |
|
Пропафенон |
150–300 мг 3 рази на добу |
Протипоказаний за наявності виражених структурних змін міокарда (Q-інфаркт міокарда в анамнезі, гострі форми ІХС, ФВ <45%, ГКМП, ДКМП, виражена гіпертрофія ЛШ ≥14 мм, СН ІІА стадії та вище, гостра СН), за наявності ураження провідної системи серця та дисфункції нирок (кліренс креатиніну <15 мл/хв) |
Тривалість QRS зростає на >25% від початкового рівня |
Невелике |
|
Флекаїнід |
50–100 мг 2 рази на добу |
Протипоказаний за наявності виражених структурних змін міокарда (Q-інфаркт міокарда в анамнезі, гострі форми ІХС, ФВ <45%, ГКМП, ДКМП, виражена гіпертрофія ЛШ ≥14 мм, СН ІІА стадії та більше, гостра СН), за наявності ураження провідної системи серця та дисфункції нирок (кліренс креатиніну <15 мл/хв) |
Тривалість QRS зростає на >25% від початкового рівня |
Невелике |
|
d,l-Соталол |
80–160 мг 2 рази на добу |
Протипоказаний за наявності виражених структурних змін міокарда (Q-інфаркт міокарда в анамнезі, гострі форми ІХС, ФВ <45%, ГКМП, ДКМП, виражена гіпертрофія ЛШ ≥14 мм, СН ІІА стадії та вище, гостра СН), за наявності ураження провідної системи серця та дисфункції нирок (кліренс креатиніну <15 мл/хв) |
Тривалість QRS зростає на >25% від початкового рівня |
Невелике |
|
Аміодарон |
600 мг 1 раз на добу протягом 4 тиж, 400 мг 1 раз на добу протягом 4 тиж, потім 200 мг 1 раз на добу |
Застосовується з обережністю при одночасному прийомі препаратів, які подовжують інтервал Q–T, при СН. Дози АВК та дигоксину мають бути знижені |
Інтервал Q–T >500 мс |
На 10–12 уд./хв при ФП |
|
Дронедарон |
400 мг 2 рази на добу |
Протипоказаний при СН в анамнезі або на даний момент, нестабільній СН; у разі токсичних реакцій з боку печінки та легень, пов’язаних із попереднім застосуванням аміодарону; на фоні одночасного прийому препаратів, які подовжують інтервал Q–T; на фоні одночасного прийому інгібіторів CYP 3A4; та при кліренсі креатиніну <30 мг/мл. Дози дигоксину мають бути знижені. Підвищення сироваткового вмісту креатиніну на 0,1–0,2 мг/дл є поширеним явищем і не відображає погіршення функції нирок |
Інтервал Q–T >500 мс |
На 10–12 уд./хв при ФП |
CYP — цитохром P450.
Таблиця 71. Рекомендації з діагностики та початкового ведення ФП
|
Рекомендації |
Класa |
Рівеньb |
|
Діагноз ФП вимагає документації даними ЕКГ |
I |
B |
|
У пацієнтів з недіагностованою ФП необхідно намагатися записати ЕКГ на фоні симптомів, які викликали підозру щодо ФП |
I |
B |
|
Для кількісної оцінки пов’язаних із ФП симптомів рекомендується використання простої шкали симптомів (шкала EHRA) |
I |
B |
|
Усім пацієнтам із ФП необхідно провести ретельне фізикальне обстеження, а також зібрати у них дані анамнезу, які можуть мати відношення до патології серця й аритмії |
I |
C |
|
У пацієнтів з тяжкими симптомами, документованою або підозрюваною патологією серця або з наявністю факторів ризику рекомендується проведення ехоКГ |
I |
B |
|
При подальшому спостереженні у пацієнтів, які отримують антиаритмічні препарати, слід регулярно записувати ЕКГ у 12 відведеннях |
I |
C |
|
У пацієнтів з підозрою на симптомну ФП слід оцінити доцільність додаткового ЕКГ-моніторування з метою документування аритмії |
IIa |
B |
|
Слід оцінити доцільність додаткового ЕКГ-моніторування з метою виявлення «німої» аритмії у пацієнтів, у яких може розвинутися пов’язане з ФП ускладнення |
IIa |
B |
|
У пацієнтів з ФП, які отримують засоби для контролю ЧСС, слід визначити доцільність проведення холтерівського моніторування ЕКГ з метою оцінки ефективності контролю ЧСС або визначення наявності брадикардії |
IIa |
C |
|
У молодих активних пацієнтів, які отримують засоби для контролю ЧСС, слід оцінити доцільність проведення навантажувальних проб (із фізичним навантаженням) з метою оцінки ефективності контролю ЧШС |
IIa |
C |
|
У пацієнтів з документованою або можливою ФП слід визначити доцільність виконання ехоКГ |
IIa |
C |
|
У пацієнтів із симптомною ФП або пов’язаними з ФП ускладненнями слід оцінити доцільність направлення до кардіолога |
IIa |
C |
|
Структурований план подальшого спостереження пацієнта, складений спеціалістом, корисний для ведення хворого лікарем загальної практики або дільничним терапевтом |
IIa |
C |
|
У пацієнтів, які отримують засоби для контролю серцевого ритму, можна визначити доцільність проведення повторних ЕКГ з метою оцінки ефективності лікування |
IIb |
B |
|
Більшість пацієнтів з ФП можуть отримати переваги від регулярного спостереження у спеціаліста в подальшому |
IIb |
C |
aклас рекомендації, bрівень доказовості.
Таблиця 72. Рекомендації щодо ресинхронізувальної терапії у пацієнтів з постійною формою ФП
|
Рекомендації |
Клас |
Рівень |
|
1. Пацієнти із СН, широкими QRS, низькою ФВ 1А. CRT необхідно рекомендувати хворим із хронічною СН, тривалістю QRS >120 мс та ФВ ЛШ <35%, котрі залишаються у III та амбулаторному IV ФК за NYHA, незважаючи на адекватну медикаментозну терапію за умови, що бівентрикулярна стимуляція може бути досягнута у 100% |
IIa |
B |
|
1Б. Абляція AV-вузла має бути проведена у разі непостійної бівентрикулярної стимуляції |
IIa |
B |
|
2. Пацієнти з неконтрольованою ЧСС, котрі є кандидатами для абляції АV-вузла. CRT необхідно рекомендувати хворим зі зниженою ФВ ЛШ, котрим показана абляція АV-вузла з метою контролю ЧШС |
IIa |
B |
При вирішенні питання про відновлення синусового ритму необхідно зважувати всі «за» і «проти», враховуючи критерії, представлені в табл. 73. В основному при невідновленні синусового ритму в стаціонарі здійснюється контроль ЧШС за допомогою лікарських засобів.
Таблиця 73. Обставини, які слід враховувати під час вирішення питання про відновлення синусового ритму
|
Відновлення ритму і призначення антиаритмічних препаратів |
Збереження ФП і контроль ЧШС |
|
Вираженість симптомів хронічної СН або слабкості збільшується за відсутності синусового ритму |
Відсутність погіршення симптоматики на тлі ФП, якщо ЧШС контролюється |
|
Гіпертрофія або виражене порушення функції ЛШ |
|
|
Розмір лівого передсердя <50 мм |
Нормальна або майже нормальна функція ЛШ |
|
Тривалість ФП менше 1 року |
Тривалість ФП більше 1 року |
|
Молоді активні хворі |
Малоактивні особи літнього віку |
|
Наявність пароксизмальної ФП |
Стійка ФП |
|
Протипоказання для тривалої антикоагулянтної терапії |
Відсутність протипоказань до призначення антикоагулянтів |
|
Неможливість утримувати синусовий ритм, незважаючи на кардіоверсію й адекватну антиаритмічну терапію |
Клінічний алгоритм застосування пероральних антикоагулянтів з метою профілактики інсульту при ФП
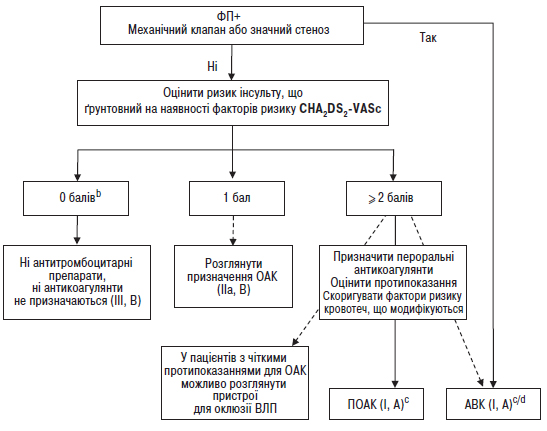
Алгоритм ведення хворих із СН та постійною ФП
Таблиця 74. Застосування антикоагулянтів до та після процедур абляції та імплантації пристроїв
|
Алгоритм дії |
Рівень доказів |
|
|
Антиагреганти |
||
|
Первина профілактика ІМ |
Відмінити антиагреганти за 3–7 діб до процедури, залежно від препарату |
Нерандомізоване дослідження, думка експертів |
|
Подвійна антиагрегантна терапія після стентування або ГКС |
||
|
Період невисокого ризику |
Продовжити тільки прийом АСК (невисокий ризик ускладнень) |
Нерандомізоване дослідження, думка експертів |
|
Період високого ризику |
Продовжити терапію в повному обсязі (високий ризик ускладнень) |
|
|
Терапія варфарином |
Відмінити варфарин за 3–6 днів до процедури, або продовжувати під контролем МНВ (нижня межа рекомендованого МНВ), вирішує лікар залежно від оцінки ризиків |
Міжнародний консенсус експертів |
|
НОАК |
Відмінити за 1–3 дні до процедури або продовжити залежно від оцінки ризику. Відновити після досягнення надійного гемостазу |
Консенсус експертів |
Показання та протипоказання для застосування НОАК у пацієнтів із клапанною ФП
Таблиця 75. Застосування НОАК у пацієнтів із клапанною ФП
|
Показання |
Допустимо |
Протипоказано |
|
Механічний протез клапана |
• |
|
|
Помірно виражений мітральний стеноз (зазвичай ревматичного походження) |
• |
|
|
Невелике/помірного ступеня ураження клапанів іншого походження |
• |
|
|
Тяжкий аортальний стеноз |
• Дані обмежені. У більшості випадків планується втручання |
|
|
Клапанний біопротез |
• (за винятком перших 3 міс після оперативного втручання) |
|
|
Реконструкція мітрального клапана |
• (за виключенням перших 3–6 міс після оперативного втручання) |
|
|
Перкутанна транслюмінальна аортальна вальвулопластика та транскатетерна імплантація аортального клапана |
• (але немає проспективних даних; може знадобиться комбінація з одним або двома антиагрегантами: оцінити ризик кровотеч) |
|
|
ГКМП |
• (але немає проспективних даних) |
Пацієнти, що потребують запланованого хірургічного втручання або лікування шляхом абляції
Коли слід припинити прийом НОАК?
При хірургічних втручаннях або інвазивних процедурах, пов’язаних із ризиком виникнення кровотеч, прийом НОАК слід тимчасово припинити. За результатами досліджень, 1/4 пацієнтів, які потребують антикоагулянтної терапії, мають тимчасово припинити застосування препарату протягом 2 років. Необхідно взяти до уваги характеристики пацієнтів (функція нирок, вік, геморагічні ускладнення в анамнезі, супутня терапія) та хірургічні фактори ризику з метою прийняття рішення про те, коли слід припинити та відновити прийом препарату, згідно з табл. 76.
Таблиця 76. Класифікація планових хірургічних втручань за ризиком виникнення кровотечі
|
Хірургічні втручання, що не потребують обов’язкової відміни антикоагулянтів Стоматологічні операції Видалення 1–3 зубів Пародонтальна хірургія Розріз абсцесу Установка імпланта Офтальмологія Операції з видалення катаракти або глаукоми Ендоскопія без хірургічного втручання Хірургія поверхневих тканин (розріз абсцесу, незначні дерматологічні видалення тощо) |
|
Хірургічні втручання з низьким ризиком виникнення кровотечі Ендоскопія з біопсією Біопсія передміхурової залози або сечового міхура ЕФД або радіочастотна катетерна абляція НШТ (включаючи лівобічну абляцію методом взяття транссептальної пункції) Ангіографія Імплантація ЕКС або ІКД (окрім випадків анатомічних ускладнень, таких як вроджена вада серця) |
|
Хірургічні втручання з високим ризиком виникнення кровотечі Складна лівобічна абляція (ізоляція легеневих вен, абляція вогнища шлуночкової тахікардії) Спінальна або епідуральна анестезія, діагностика за допомогою люмбальної пункції Хірургія органів грудної клітки Хірургія органів черевної порожнини Ортопедична хірургія Біопсія печінки Трансуретральна резекція передміхурової залози Біопсія нирки |
|
Окремі фактори, які можуть впливати на виникнення кровотечі та розвиток тромбоемболічних явищ, слід взяти до уваги та обговорити з хірургом |
«Бриджинг-терапія» є доцільною у пацієнтів з ФП, які мали високий ризик розвитку тромбоемболічних ускладнень та отримують лікування АВК, проте у такому шунтуванні може не бути особливої необхідності у пацієнтів, які отримують терапію НОАК, оскільки застережні заходи, пов’язані з антикоагуляційним ефектом препаратів, вимагають лише короткочасного припинення та подальшого відновлення терапії НОАК після операції.
У разі, коли хірургічне втручання не передбачає клінічно значущого ризику кровотечі та/або за можливості досягнення місцевого гемостазу, як при деяких стоматологічних процедурах або операції з видалення катаракти або глаукоми, його можна провести з використанням мінімальної концентрації НОАК (тобто через 12 або 24 год після останнього прийому залежно від дозування — 1 або 2 рази на добу), проте не при пікових концентраціях у плазмі крові.
Таким чином, більш практичним було б запланувати хірургічні процедури через 18–24 год після останнього прийому, а потім відновити терапію через 6 год (тобто після досягнення гемостазу). У будь-якому випадку пацієнт може залишити клініку лише після повної впевненості у відсутності кровотечі. Крім того, його слід повідомити про післяопераційний курс лікування та заходи у разі виникнення кровотечі, а саме повідомити лікаря або стоматолога, якщо кровотеча не зупиняється сама по собі. У такому випадку лікар або дантист (або інший медичний персонал, що володіє ситуацією) мають бути на зв’язку з пацієнтом. При проведенні стоматологічних процедур пацієнти можуть обережно прополоскати ротову порожнину 10 мл 5% транексамової кислоти 4 рази на добу протягом 5 днів.
При проведенні операцій у пацієнтів з нормальною функцією нирок з мінімальним ризиком кровотеч (деякі з них відмічено у табл. 76) прийом НОАК рекомендується припинити за 24 год до проведення планової операції (табл. 77). У разі проведення процедур у пацієнтів з нормальною функцією нирок, що можуть викликати значні кровотечі, останню дозу НОАК рекомендується приймати за 48 год до втручання.
Таблиця 77. Останній прийом препарату перед хірургічним втручанням
|
Кліренс креатиніну в сироватці крові, мл/хв |
Дабігатран |
Апіксабан |
Eдоксабан |
Ривароксабан |
||||||
|
Ризик кровотечі незначний та/або можлива підтримка місцевого гемостазу: при мінімальному рівні препарату в крові |
||||||||||
|
Низький ризик |
Високий ризик |
Низький ризик |
Високий ризик |
Низький ризик |
Високий ризик |
Низький ризик |
Високий ризик |
|||
|
>80 |
≥24 год |
≥48 год |
≥24 год |
≥48 год |
Дані відсутні |
Дані відсутні |
≥24 год |
≥48 год |
||
|
50–80 |
24–48 год |
48–72 год |
≥24 год |
≥48 год |
Дані відсутні |
Дані відсутні |
≥24 год |
≥48 год |
||
|
30–50a |
≥48 год |
≥96 год |
≥24 год |
≥48 год |
Дані відсутні |
Дані відсутні |
≥24 год |
≥48 год |
||
|
15–30 |
Показань немає |
Показань немає |
≥36 год |
≥48 год |
Дані відсутні |
Дані відсутні |
≥36 год |
≥48 год |
||
|
<15 |
Немає офіційних показань до застосування |
|||||||||
Показники, виділені жирним шрифтом, відхиляються від загального правила зупинки дослідження при низькому ризику >24 год, високому ризику >48 год. aБагато з цих пацієнтів можуть отримувати лікування дабігатраном у низьких дозах (110 мг 2 рази на добу) або апіксабаном (25 мг 2 рази на добу), або низькими дозами ривароксабану (15 мг 1 раз на добу). Низький ризик — операція з низьким ризиком виникнення кровотечі: високий ризик — операція з високим ризиком виникнення кровотечі.
У пацієнтів як з помірним, так і з тяжким порушенням функції нирок (кліренс креатиніну >30 мл/хв.), що приймають ривароксабан, рекомендується припинити прийом ривароксабану раніше ніж за 24 год при хірургічних втручаннях із низьким ризиком та за 48 год при хірургічних втручаннях із високим ризиком кровотечі.
У пацієнтів з кліренсом креатиніну 15–30 мл/хв, що приймають ривароксабан, рекомендується припинити прийом ривароксабану за ≥36 год та ≥48 год при хірургічних втручаннях із низьким ризиком та високим ризиком кровотечі відповідно.
При застосуванні дабігатрану рекомендується припинення прийому перед хірургічним втручанням з низьким та високим ризиком виникнення кровотечі та залежно від функції нирки (див. табл. 65).
Спінальна анестезія, епідуральна анестезія та люмбальна пункція можуть потребувати досягнення повного гемостазу та належать до категорії втручань «високого ризику кровотечі».
Не рекомендується застосування НОАК при нейроаксіальній анестезії. Хоча АЧТЧ та протромбіновий час можуть забезпечити напівкількісну оцінку ефективності дабігатрану та інгібіторів фактора Ха, відповідно, методика, що включає нормалізацію АЧТЧ та протромбінового часу до планових/невідкладних операцій, не була валідована.
Коли слід відновлювати курс лікування новими пероральними антикоагулянтами?
При досягненні повного гемостазу прийом НОАК можна відновити через 6–8 год після процедури. Те ж саме стосується застосування після атравматичної спінальної/епідуральної анестезії або люмбальної пункції (без домішок крові).
Однак відновлення прийому антикоагулянтів у повній дозі протягом 48–72 год після анестезії або пункції під час хірургічних втручань може підвищувати ризик виникнення кровотеч, що може переважати над ризиком розвитку кардіоемболії. Слід взяти до уваги відсутність специфічного антидоту у разі виникнення кровотечі та/або необхідності у хірургічному втручанні. Для процедур, пов’язаних з іммобілізацією, вважається за доцільне розпочати профілактику венозного тромбозу або введення проміжної дози низькомолекулярного гепарину через 6–8 год після операції у разі досягнення гемостазу, при цьому слід оцінити доцільність затриманого відновлення прийому НОАК на 48–72 год після інвазивного втручання. Максимальний антикоагуляційний ефект НОАК досягається через 2 год після прийому таблетки.
Відсутні дані щодо безпеки та ефективності післяопераційного застосування зниженої дози НОАК (які застосовуються для запобігання венозній тромбоемболії після протезування стегнового/колінного суглоба) у пацієнтів із ФП, які потребують хірургічного втручання.
Лікування геморагічних ускладнень НОАК
Наразі специфічні антидоти для різних НОАК відсутні, а методи пригнічення антикоагулянтних ефектів мають деякі обмеження. Пригнічення ефекту АВК шляхом застосування вітаміну К відбувається дуже повільно (щонайменше 24 год), проте введення свіжозамороженої плазми крові або факторів коагуляції швидше відновлює процеси згортання крові. При застосуванні НОАК високі концентрації препарату в плазмі крові також можуть блокувати нещодавно введені фактори коагуляції крові. З іншого боку, відновлення процесу коагуляції крові не обов’язково гарантує гарні клінічні результати. Дослідження вказують на меншу тяжкість кровотеч, особливо внутрішньочерепних та інших небезпечних для життя кровотеч, при застосуванні НОАК, ніж при застосуванні варфарину. Незважаючи на це, зі збільшенням кількості пацієнтів, що прийматимуть один з НОАК, кількість кровотеч, ймовірно, чисельно збільшиться.
Лікування кровотеч, що не є небезпечними для життя
Окрім виконання стандартних заходів (таких як механічна компресія, оперативний гемостаз, відновлення об’єму плазми крові та інші заходи щодо підтримки гемодинаміки), з огляду на відносно короткий період напіввиведення, найважливішим антидотом НОАК є час (табл. 66, 67 та рис. 15).
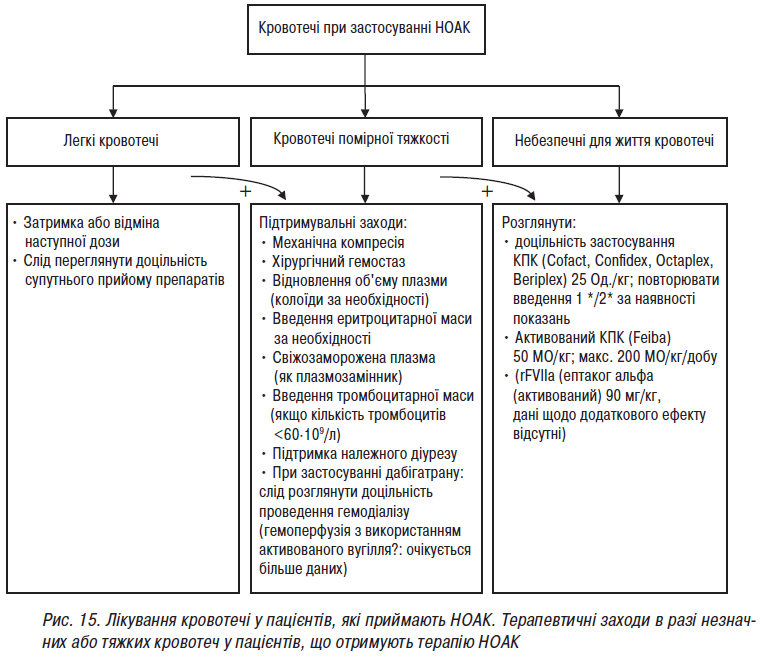
Після закінчення лікування відновлення гемостазу слід очікувати протягом 12–24 год після останнього прийому препарату, зважаючи на те, що період напіввиведення більшості НОАК з плазми крові становить близько 12 год. У зв’язку із цим недооцінюється важливість інформації щодо режиму дозування, точного часу прийому препаратів, факторів, які впливають на концентрацію в плазмі крові (Р-глікопротеїн, ХХН та ін.), та інших факторів, які впливають на систему гемостазу (супутнє застосування антитромботичних засобів).
Період виведення препарату з організму значною мірою залежить від стану нирок у пацієнтів, що отримують лікування дабігатраном. У разі виникнення кровотечі у хворих, що приймають дабігатран, слід підтримувати адекватний діурез. Незважаючи на те що дабігатран може виводитися шляхом діалізу, слід взяти до уваги, що існує лише обмежений досвід застосування діалізу в такому випадку. Крім того, слід оцінити ризик виникнення кровотечі в місці проколу для діалізу та ризик від очікування. У відкритому дослідженні, у якому дабігатран у дозі 50 мг вводився 6 пацієнтам з термінальною стадією хвороби нирок, яким проводять гемодіаліз, середня частка препарату, виведеного шляхом діалізу, становила 62% протягом 2 год та 68% протягом 4 год. Можливість посиленого виведення дабігатрану з плазми крові за допомогою гемоперфузії через вугільний фільтр наразі вивчається. На цей час останні не можна рекомендувати таким пацієнтам.
На противагу дабігатрану, діаліз не рекомендується пацієнтам, що отримують лікування будь-якими інгібіторами фактора Ха, оскільки у зв’язку зі здатністю більшості інгібіторів фактора Ха значною мірою зв’язуватися з білками плазми крові, не виявлено значного їх виведення шляхом діалізу.
Лікування небезпечних кровотеч
На основі обмежених експериментальних даних та беручи до уваги те, що ефективність факторів згортання крові у пацієнтів з активними кровотечами не була чітко визначена (тобто не визначена їх здатність зменшувати втрату крові та поліпшувати результат), можливе застосування концентрату факторів протромбінового комплексу (КПК); або аКПК (aКПК, тобто подібні до КПК, проте з активованим фактором VIIa) у пацієнтів із небезпечними кровотечами у разі необхідності термінової підтримки системи гемостазу. До отримання більшої кількості даних щодо клінічної ефективності цих методик їх вибір може залежати від їх наявності та досвіду лікувально-дослідного центру. На основі досліджень з використанням КПК у клінічних зразках та у здорових добровольців, введення можна розпочинати у дозі 25 МО/кг маси тіла та повторювати за наявності клінічних показань. Подальші дослідження можуть дати більше інформації щодо дозування та необхідності у пристосуванні дози до НОАК, що приймаються.
Можливе застосування активованих концентратів протромбінового комплексу (50 МО/кг маси тіла, з максимум 200 МО/кг/добу) за наявності їх у лікарні. Роль активованого рекомбінантного фактора VIIa (90 мг/кг маси тіла) потребує подальшого дослідження.
Можливе застосування інших прокоагулянтів, таких як антифібринолітики (транексамова або амінокапронова кислота) або десмопресин (особливо при коагулопатії або тромбопатії), хоча клінічні дані стосовно їх ефективності при кровотечах, спричинених НОАК, майже відсутні. Крім того, застосування інших прокоагулянтів не відміняє заходи, зазначені вище. Свіжозаморожена плазма крові не інгібує процес антикоагуляції, проте може призначатися для наповнення об’єму плазми крові у пацієнтів, які потребують значного переливання крові. За відсутності дефіциту вітаміну К або лікування АВК, застосування вітаміну К (менадіон) не впливає на лікування кровотечі, що виникла внаслідок прийому НОАК. Подібним чином протамін інгібує антикоагулянтний ефект гепарину, проте не відіграє жодної ролі у кровотечі, спричиненій застосуванням НОАК. Рекомендується проконсультуватися у кардіологів, спеціалістів з порушення гемостазу та лікарів невідкладної допомоги для визначення методики лікування кровотечі (рис. 15).
Таблиця 78. Вплив лікарських взаємодій та інших клінічних чинників на концентрацію НОАК у плазмі крові
|
Препарат |
Дія через |
Дабігатран |
Апіксабан |
Едоксабан |
Ривароксабан |
|
Антиаритмічні препарати |
|||||
|
Аміодарон |
Помірне конкурентне інгібування Р-ГП |
+12–60% |
Немає ФКД˚ |
+40% |
Мінімальний вплив˚ (застосовувати з обережністю при кліренсі креатиніну <50 мл/хв) |
|
Дигоксин |
Інгібування Р-ГП |
Не впливає |
На сьогодні немає даних |
Не впливає |
Не впливає |
|
Дилтіазем |
Конкурентне інгібування Р-ГП та слабке інгібування CYP 3A4 |
Не впливає |
+40% |
На сьогодні немає даних |
Мінімальний вплив˚ (застосовувати з обережністю при кліренсі креатиніну 15–50 мл/хв) |
|
Дронедарон |
Конкурентне інгібування Р-ГП та інгібування CYP 3A4 |
+70–100% (США: 2х75 мг при кліренсі креатиніну 30–50 мл/хв) |
Немає ФКД чи ФДД: застосовувати з обережністю |
+85% (знизити дозу НОАК на 50%) |
Помірний вплив˚, однак немає ФКД або ФДД: застосовувати з обережністю; намагатися уникати прийому |
|
Хінідин |
Конкурентне інгібування Р-ГП |
+53% |
На сьогодні немає даних |
+77% (немає потреби у зниженні дози, якщо призначений за показаннями) |
Ступінь збільшення невідомий |
|
Верапаміл |
Конкурентне інгібування Р-ГП та слабке інгібування CYP 3A4 |
+12–180% (знизити дозу НОАК і приймати одночасно) |
Немає ФКД |
+53% (УВ) (немає потреби у зниженні дози, якщо призначений за показаннями) |
Мінімальний вплив˚ (застосовувати з обережністю при кліренсі креатиніну 15–50 мл/хв) |
|
Інші серцево-судинні препарати |
|||||
|
Аторвастатин |
Інгібування Р-ГП та інгібування CYP 3A4 |
+18% |
На сьогодні немає даних |
Не впливає |
Не впливає |
|
Антибіотики |
|||||
|
Кларитроміцин; еритроміцин |
Помірне конкурентне інгібування Р-ГП та інгібування CYP 3A4 |
+15–20% |
На сьогодні немає даних |
+90% (знизити дозу НОАК на 50%) |
+30–54% |
|
Рифампіцин· |
Р-ГП/ВСМР та CYP 3A4/CYP 2J2-індуктори |
–66%˚ |
–54%˚ |
Уникати прийому за можливості: –35%, однак з компенсаторним збільшенням в активних метаболітівˆ |
До –50%˚ |
|
Противірусні препарати |
|||||
|
Інгібітори протеази ВІЛ (наприклад ритонамір) |
Конкурентне інгібування або індукція Р-ГП та ВСМР; інгібування CYP 3A4 |
На сьогодні немає даних |
Виражене збільшення [M] |
На сьогодні немає даних |
До +153% |
|
Протигрибкові засоби |
|||||
|
Флуконазол |
Помірне інгібування CYP 3A4 |
На сьогодні немає даних |
На сьогодні немає даних |
На сьогодні немає даних |
+42% (якщо систематично приймається) |
|
Ітраконазол Кетоконазол Позаконазол Вориконазол |
Потужне конкурентне інгібування Р-ГП та BCRP; інгібування CYP 3A4 |
+140–150% (США: 2×75 мг при кліренсі креатиніну 30–50 мл/хв) |
+100% |
+87–95% (знизити дозу НОАК на 50%) |
До +160% |
|
Імуносупресори |
|||||
|
Циклоспорин Такролімус |
Конкурентне інгібування Р-ГП |
Не рекомендовано |
На сьогодні немає даних |
+73% |
Ступінь збільшення невідомий |
|
Протизапальні засоби |
|||||
|
Напроксен˚ |
Конкурентне інгібування Р-ГП |
На сьогодні немає даних |
+55% |
Не впливає (однак фармакодинамічно призводить до подовження часу кровотечі) |
На сьогодні немає даних |
|
Антациди |
|||||
|
Блокатори ІПП Гідроксиди Al-Mg |
Абсорбція у травному тракті |
–12–30% |
Не впливає |
Не впливає |
Не впливає |
|
Інші препарати |
|||||
|
Карбамзепін· Фенобарбітал· |
Р-ГП/ВСМР та CYP 3A4/CYP 2J2-індуктори |
-66%˚ |
–54%˚ [M] |
–35%ˆ |
До –50%˚ |
|
Інші чинники |
|||||
|
Вік ≥80 років |
Зростання плазмового рівня |
*
|
|||
|
Вік ≥75 років |
Зростання плазмового рівня |
||||
|
Маса тіла ≤60 кг |
Зростання плазмового рівня |
* |
|||
|
Функціональний стан нирок |
Зростання плазмового рівня |
Див. табл. 67 |
|||
|
Інші чинники підвищеного геморагічного ризику |
Фармакодинамічна взаємодія (антиагреганти; нестероїдні протизапальні препарати; системна терапія глюкокортикоїдами; інші антикоагулянти); дані про шлунково-кишкові кровотечі; нещодавно виконані оперативні втручання на «критичних» органах (молок, очі); тромбоцитопенія (наприклад на тлі хіміотерапії); HAS-BLED ≥3 балів |
||||
ФКД — фармакокінетичні дані; ФДД — фармакодинамічні дані; М — монографії до препарату; УВ — уповільнене вивільнення.
Заштриховані клітинки: немає клінічних або фармакокінетичних даних.
*Поєднання протипоказане/не рекомендоване; знизити дозу (зі 150 до 110 мг 2 рази на добу для апіксабану); розглянути питання про зниження дози препарату, якщо наявні 2 або більше таких чинників. % — вік не чинить статистично значущого впливу після стандартизації за масою тіла і функціональним станом нирок. ·Деякі взаємодії призводять до зниження рівня НОАК у плазмі крові, на відміну від більшості взаємодій, у результаті яких рівень НОАК у плазмі крові підвищується. 1У низці випадків це є протипоказанням до поєднаного застосування. ˆДля едоксабану означає, що таке поєднане застосування можливе, незважаючи на зниження рівня препарату в плазмі крові, яке вважається клінічно незначущим. Однак оскільки така комбінація проспективно не досліджувалася, її слід застосовувати з обережністю або уникати за можливості. ˚Базується на дослідженнях in vitro, у яких порівнювали IC50 (концентрація напівмаксимального інгібування) для інгібування Р-ГП з максимальними рівнями в плазмі крові при терапевтичних дозах; та/або аналізі взаємодії кінцевих точок ефективності й безпеки лікування у фазі ІІІ клінічних досліджень. На цей час немає даних про пряму фармакокінетичну взаємодію.
Згідно з даними літератури, необхідно знизити дозу з 5 до 2,5 мг 2 рази на добу, якщо виконуються 2 з 3 критеріїв: вік ≥80 років, маса тіла ≤60 кг, креатинін у сироватці крові ≥1,5 мг/дл.
Таблиця 79. Фармакокінетичні властивості НОАК та їх дозування при ХХН
|
Показник |
Дабігатран, % |
Апіксабан, % |
Едоксабан, % |
Ривароксабан, % |
|
Частка діючої речовини, виведеної шляхом ниркового кліренсу, від абсорбованої дози |
80 |
27 (52–55) |
50 (36) |
35 |
|
Біодоступність |
3–7 |
50 |
62 (51) |
66 (без прийому їжі, майже 100% при прийомі з їжею) |
|
Частка діючої речовини, виведеної шляхом ниркового кліренсу, від уведеної дози |
4 |
12–29 (52–55) |
37 |
33 |
|
Ухвалено до застосування при кліренсі креатиніну >…мл/хв |
>30 |
15 |
15 |
15 |
|
Рекомендації щодо дозування |
Кліренс креатиніну >50 мл/хв: немає потреби в корекції (тобто 150 мг 2 рази на добу) |
Креатинін у сироватці крові >1,5 мг/дл: немає потреби в корекції дози (тобто 5 мг 2 рази на добу)1 |
Кліренс креатиніну >50 мл/хв: немає потреби в корекції дози (тобто 60 мг 1 раз на добу)2 |
Кліренс креатиніну >50 мл/хв: немає потреби в корекції (тобто 20 мг 1 раз на добу) |
|
Дозування ХХН |
Якщо кліренс креатиніну Примітка: режим дозування 75 мг 2 рази на добу схвалений лише в США3: при кліренсі креатиніну 15–30 мл/хв Якщо кліренс креатиніну 30–49 мл/хв та інші чинники (наприклад верапаміл) |
Кліренс креатиніну 15–29 мл/хв: 2,5 мг 2 рази на добу якщо наявні два з трьох таких критеріїв: вік >80 років; маса тіла <60 кг; креатинін у сироватці крові >1,5 мг/дл: знизити дозу до 2,5 мг 2 рази на добу |
Кліренс креатиніну |
Кліренс креатиніну |
|
Не рекомендується, якщо… |
Кліренс креатиніну <30 мл/хв |
Кліренс креатиніну <15 мл/хв |
Кліренс креатиніну <15 мл/хв |
Кліренс креатиніну <15 мл/хв |
![]() Протипоказано/не рекомендується/
Протипоказано/не рекомендується/ ![]() знизити дозу (при застосуванні за показаннями).
знизити дозу (при застосуванні за показаннями). ![]() Розглянути питання про зниження дози препарату, якщо наявні два або більше таких чинників. 1Згідно з даними монографій до препарату, рекомендується зниження дози з 5, до 2,5 мг 2 рази на добу, якщо виконуються три критерії: вік >80 років; маса тіла <60 кг; креатинін у сироватці крові >1,5 мг/дл. 2FDA застерігає від застосування едоксабану у пацієнтів з кліренсом креатиніну >95 мл/хв. ЕМА радить, що «едоксабан може бути призначений пацієнтам з високим кліренсом креатиніну лише після ретельного визначення індивідуальних ризиків тромбоемболічних та геморагічних ускладнень», враховуючи тенденцію до ефективності порівняно з АВК. 3Немає показань з боку ЕМА. Рекомендації FDA базуються на фармакокінетичних даних. Слід ретельно оцінювати ризики та користь такого підходу. Слід врахувати, що капсули 75 мг недоступні на європейському фармацевтичному ринку.
Розглянути питання про зниження дози препарату, якщо наявні два або більше таких чинників. 1Згідно з даними монографій до препарату, рекомендується зниження дози з 5, до 2,5 мг 2 рази на добу, якщо виконуються три критерії: вік >80 років; маса тіла <60 кг; креатинін у сироватці крові >1,5 мг/дл. 2FDA застерігає від застосування едоксабану у пацієнтів з кліренсом креатиніну >95 мл/хв. ЕМА радить, що «едоксабан може бути призначений пацієнтам з високим кліренсом креатиніну лише після ретельного визначення індивідуальних ризиків тромбоемболічних та геморагічних ускладнень», враховуючи тенденцію до ефективності порівняно з АВК. 3Немає показань з боку ЕМА. Рекомендації FDA базуються на фармакокінетичних даних. Слід ретельно оцінювати ризики та користь такого підходу. Слід врахувати, що капсули 75 мг недоступні на європейському фармацевтичному ринку.
Порушення провідності
Класифікація та кодування за МКХ-10
І.44.0 Атрiовентрикулярна блокада.
I.44.1 Атрiовентрикулярна блокада другого ступеня.
I.44.2 Атрiовентрикулярна блокада повна.
I.44.3 Iнша та неуточнена атрiовентрикулярна блокада.
I.45 Iншi порушення провiдностi.
I.45.2 Бiфасцикулярна блокада.
I.45.3 Трифасцикулярна блокада.
I.45.8 Iншi уточненi порушення провiдностi.
I.45.9 Порушення провiдностi, неуточнене.
I.49.5 Синдром слабкостi синусного вузла.
I.44.7. Блокада лівої гілки пучка Гіса неуточнена.
Синдром слабкості синусного вузла, або «хвороба синусного вузла» — поширена причина брадикардії. Він містить весь спектр СА-дисфункції, яка варіює від доброякісної синусової брадикардії до синус-арешту або так званого синдрому брадикардії-тахікардії. Останній характеризується розвитком пароксизмальних передсердних тахіаритмій, що чергуються з періодами повільного предсердного і шлуночкового ритму у пацієнтів із синусовою брадикардією або СА-блокадою. Інші прояви СССВ — це тяжка персистуюча, без зворотних причин синусова брадикардія; зупинка синусного вузла з передсердними екстрасистолами або вузловим висковзувальним ритмом; СА-блокада виходу та неадекватна хронотропна відповідь на фізичне навантаження (табл. 80). У різних випадках у одного й того ж пацієнта може бути зареєстровано кілька таких станів.
Таблиця 80. Причини розвитку брадикардії
|
Внутрішньосерцеві причини |
Ідіопатична дегенерація |
|
ІХС |
|
|
Інфільтративні захворювання (саркоїдоз, амілоїдоз) |
|
|
Захворювання сполучної тканини |
|
|
М’язова дистрофія |
|
|
Хірургічна травма |
|
|
Вроджені захворювання, патологія синусного та АV-вузла |
|
|
Інфекційні хвороби (дифтерія, сепсис, черевний тиф) |
|
|
Зовнішні причини |
Фізична тренованість |
|
Підвищений вагусний тонус, гіперчутливість каротидного синуса |
|
|
Препарати з негативним хронотропним ефектом |
|
|
Електролітний дисбаланс (гіпокаліємія) |
|
|
Метаболічний дисбаланс (гіпотиреоз, гіпотермія) |
|
|
Неврологічні порушення |
|
|
Синдром обструктивного апное |
СССВ як нозологічна одиниця охоплює не тільки розлади формування імпульсу в синусному вузлі або його проведення по правому передсердю, але також більш поширені порушення внутрішньопередсердного проведення. СССВ може бути причиною розвитку передсердних тахіаритмій. Крім того, у деяких пацієнтів з дисфункцією синусного вузла можуть відмічати порушення АV-проведення, у такому разі використовують термін «бінодальна хвороба».
Синусова брадикардія — це деполяризація синусного вузла з частотою <60 уд./хв, з нормальним зубцем P перед кожним комплексом QRS. Синусова брадикардія — поширений та зазвичай доброякісний стан. Транзиторну синусову брадикардію можна відмічати у пацієнтів після ІМ.
Синусові паузи (зупинка тривалістю >150% довжини серцевого циклу) можуть бути наслідком порушення формування імпульсу в синусному вузлі (зупинка синусного вузла) або порушенням проведення з вузлової зони в прилеглу ділянку передсердь (блокада виходу синусного вузла). При паузах, зумовлених СА-блокадою виходу, інтервал P–P під час паузи, як правило, кратний основному інтервалу P–P, у той час як при зупинці синусного вузла такого зв’язку не виявлено. Хоча синусові паузи і зупинки синусного вузла можуть не мати істотного клінічного значення, поява висковзувальних передсердних або вузлових водіїв ритму для запобігання асистолії шлуночків підвищує ризик ФП або ТП. Синдром брадикардії-тахікардії зазвичай асоціюється з клінічними проявами, оскільки надчасті імпульси під час тахікардії пригнічують автоматизм синусного вузла та призводять до тривалих пауз у результаті збільшеного часу відновлення синусного вузла, як наслідок — синкопе під час припинення тахікардії. Крім того, спроби знизити частий ритм серця (наприклад за допомогою блокаторів бета-адренорецепторів або дигоксину) можуть ще більше придушити автоматизм синусного вузла або АV-проведення і посилити порушення. Відомо, що СССВ не чинить несприятливого впливу на виживаність, якщо у пацієнта не діагностують такі прогностично значущі стани, як ішемія міокарда, СН або системні емболії. Отже, для усунення симптоматики, пов’язаної з брадикардією, показана тільки постійна стимуляція.
Порушення АV-проведення
Порушення АV-проведення можуть виникати на будь-якому рівні, від АV-з’єднання вниз до системи внутрішньошлуночкового проведення. Вони включають різні ступені блокади в АV-вузлі, пучку Гіса, правій або лівій ніжках пучка та/або передніх і задніх розгалуженнях лівої ніжки пучка (блокада лівої передньої або лівої задньої гілки). Блокада може з’явитися або на одній ділянці, або уражувати 2 і більше компоненти провідної системи. АV-вузол і пучок Гіса надзвичайно чутливі до ішемії та травматичного пошкодження, оскільки вони створюють вузький шлях проведення між передсердями і шлуночками.
При АV-блокаді збудження передсердь передається на шлуночки із затримкою або не проводиться зовсім. Традиційно, ґрунтуючись на ЕКГ-критеріях, АV-блокаду класифікують на І, ІІ або ІІІ ступінь, тоді як залежно від анатомічної зони, у якій порушено проведення хвилі збудження, вона описується як супрагісіальна, інтрагісіальна й інфрагісіальна.
При I ступені АV-блокади кожен передсердний імпульс проводиться на шлуночки, але інтервал P–R подовжений до >200 мс. Затримка проведення може виникнути на рівні АV-вузла або в системі Гіса — Пуркіньє. Якщо комплекс QRS вузький, то затримка проведення, як правило, знаходиться в АV-вузлі або, рідше, у пучку Гіса. Якщо комплекс QRS широкий, то затримка проведення може бути або в АV-вузлі, або в системі Гіса — Пуркіньє, і тільки електрограма пучка Гіса може визначити це точно. АV-блокада не викликає брадикардію, якщо вона не прогресує періодично до ІІ або ІІІ ступеня, або поєднується з дисфункцією синусного вузла. У пацієнтів із переднім ІМ і порушеннями проведення локалізуються нижче пучка Гіса, блокада І ступеня може прогресувати до повної інфрагісіальної блокади і викликати асистолію шлуночків, а нижній інфаркт частіше поєднується з відносно доброякісною внутрішньовузловою й атропінчутливою блокадою.
АV-блокада II ступеня характеризується відсутністю проведення одного або більше передсердних імпульсів до шлуночків. Вона класифікується на типи Мобітц I (Венкебаха) або Мобітц II:
- АV-блокада II ступеня типу Мобітц I (або блокада Венкебаха) характеризується прогресивним подовженням інтервалів Р–R до тих пір, поки не настане після P блокада проведення на шлуночки. Під час наступного циклу інтервал P–R знову приймає своє початкове значення і знову прогресивно подовжується до блокування після чергового зубця P. Цей тип блокади рідко проявляється непритомністю. Затримка зазвичай відбувається в АV-вузлі і прогресування в більш високий ступінь АV-блокади відбувається рідко. Однак у разі реєстрації широкого комплексу QRS необхідне проведення ЕФД для визначення рівня блокади;
- АV-блокада II ступеня типу Мобітц II характеризується раптовою зупинкою проведення і, за умови нормального синусового ритму, інтервал P–R однаковий до і після блокованого комплексу QRS. Блокада типу Мобітц II, як правило, виникає в результаті пошкодження нижче пучка Гіса (інфрагісіально), може поєднуватися із широким комплексом QRS, прогресує різко в повну АV-блокаду і часто проявляється синкопе.
АV-блокада III ступеня (повна блокада серця) характеризується повною дисоціацією роботи передсердь і шлуночків, що мають кожен свій ритм. При цьому типі блокади передсердні стимули не проводяться до шлуночків, а шлуночки деполяризуються за рахунок шлуночкових водіїв ритму. Зазвичай АV-блокада ІІІ ступеня має перебіг із значною вираженістю симптоматики у вигляді синкопе або задишки. Частота ритму шлуночків має значення для розвитку симптоматики, стосовно безпеки пацієнта важлива локалізація джерела ритму шлуночків.
Клінічні дослідження показують, що постійна кардіостимуляція у разі АV-блокади III ступеня покращує виживаність, особливо у пацієнтів із синкопе, оскільки призводить до запобігання раптовій серцевій смерті.
Внутрішньошлуночкова блокада
Уповільнення внутрішньошлуночкового проведення (блокада ніжок пучка Гіса) на будь-якому рівні системи Гіса — Пуркіньє призводить до втрати синхронізму збудження і скорочення шлуночків. Внутрішньошлуночкова блокада може бути фасцикулярною (ліва верхня або ліва нижня гілки), що призводить до внутрішньошлуночкової дисинхронії, або уражувати ніжку пучка Гіса (блокада лівої чи правої ніжки пучка Гіса), викликаючи міжшлуночкову дисинхронію.
Приклади формулювання діагнозів
1. ІХС: стабільна стенокардія напруження ІІ ФК. Стенозуючий атеросклероз. Повна АV-блокада від 26.05.2016. Синкопе від 26.05.2016 р. Імплантація ШВРС 26.05.2016 р. тип DDD. СН І стадії зі збереженою ФВ.
2. ІХС: стабільна стенокардія напруження ІІІ ФК. Постінфарктний кардіосклероз (Q-ІМ передньої стінки ЛШ від 13.01.1998 р.). СССВ. Синусова брадикардія. Еквіваленти синкопе. Імплантація ШВРС 26.05.2016 р. тип AAIR. СН ІІА стадії без систолічної дисфункції ЛШ.
3. ДКМП. Минуча АV-блокада І ст. Постійна блокада лівої ніжки пучка Гіса. Поліморфна шлуночкова екстрасистолія, періодично парна. ІКД з функцією ресинхронізаційної терапії (CRT-D) 28.05.2016 р. СН ІІБ стадії з систолічною дисфункцією ЛШ ІІІ ФК за NYHA.
Надання допомоги хворим з порушеннями проведення
Діагностичний етап може проводитися як в амбулаторних умовах, так і в умовах спеціалізованого медичного закладу, це передусім залежить від гемодинаміки хворого та скарг, з якими він звернувся.
Первинна допомога
Відповідно у асимптомних пацієнтів на первинному етапі надання допомоги в амбулаторних умовах можуть бути проведені діагностичні процедури:
- Визначення скарг та анамнезу.
- Клінічний огляд.
- Вимірювання АТ на обох руках.
- Дослідження лабораторних показників:
- загальні аналізи крові і сечі;
- визначення рівня глюкози в крові;
- АлАТ, АсАТ, КФК загальної і МВ-фракції, тропонін Т або І;
- білірубін;
- креатинін;
- калій, натрій;
- С-реактивний протеїн;
- ревмопроби;
- коагулограма;
- ПТІ або МНВ;
- лабораторні методи визначення функції щитовидної залози;
- визначення показників імунологічного стану (за можливості);
- група крові та резус-фактор;
- експрес-визначення RW;
- визначення титру HCV та Нв-sAg.
- ЕКГ у 12 відведеннях.
- Добовий моніторинг ЕКГ (24, 48 год).
- ЕхоКГ.
- Рентгенографія органів грудної клітки.
- Тест із ДФН (велоергометрія або тредміл) (за можливості).
Вторинна допомога
Для отримання вторинної спеціалізованої допомоги при синкопальних станах, нестабільній гемодинаміці хворий повинен звернутися до кардіологічного стаціонару, де йому проведуть лікування неінвазивними та інвазивними методиками:
- Визначення скарг та анамнезу.
- Клінічний огляд.
- Вимірювання АТ на обох руках.
- Дослідження лабораторних показників:
-
- загальні аналізи крові і сечі;
- визначення глюкози в крові;
- АлАТ, АсАТ, КФК загальної і МВ-фракції, тропонін Т або І;
- білірубін,
- креатинін,
- калій, натрій, С-реактивний протеїн;
- ревмопроби;
- коагулограма;
- ПТІ або МНВ;
- лабораторні методи визначення функції щитовидної залози;
- визначення показників імунологічного стану (за можливості);
- група крові та резус-фактор;
- експрес-визначення RW; визначення титру HCV та Нв-sAg.
- ЕКГ у 12 відведеннях.
- Добовий моніторинг ЕКГ (24, 48 год).
- ЕхоКГ.
- Рентгенографія органів грудної клітки.
- КВГ.
- Тест із ДФН (велоергометрія або тредміл).
- Неінвазивне черезстравохідне ЕФД.
- Фармакологічні проби.
- Епізодичне амбулаторне моніторування ЕКГ.
- Імплантація пристроїв тривалого моніторування ЕКГ.
- Тілт-тест.
- Інвазивне ЕФД.
Згідно з рекомендаціями Європейської асоціації серцевого ритму від 2013 р. надзвичайно важливо виявити та зафіксувати механізм брадикардії. Не менш важливо довести зв’язок скарг пацієнта з брадикардією. Із цією метою рекомендовано дві стратегії ведення хворих зі скаргами на брадикардію.
Активна стратегія — провокація брадикардії та дослідження показників провідної системи серця. Пасивна стратегія — тривала реєстрація ЕКГ під час виникнення симптомів у пацієнта (табл. 81). Обидві стратегії мають переваги та недоліки.
Таблиця 81. Виявлення механізму брадикардії
| Стратегія тривалого моніторингу ЕКГ | Стратегія провокаційного тесту |
|
|
Лікування хворих із порушеннями провідності
Хворі мають знаходитися у блоках з можливістю цілодобового моніторингу ЕКГ та за наявності приладів для тимчасової та тривалої кардіостимуляції. Метою діагностичного пошуку є реєстрація та виявлення механізму брадикардії, доказ зв’язку появи симптомів у пацієнта та брадикардії. Лікар має надати невідкладну допомогу у разі нестабільної гемодинаміки (прогресуюча недостатність ЛШ, високий ризик повторних синкопе) встановити тимчасовий шлуночковий кардіостимулятор.
При стабільній гемодинаміці необхідно зрозуміти, чи є причини брадикардії зворотними. При зворотному характері брадикардії необхідно за допомогою препаратів коригувати стани, що призвели до брадикардії. При незворотних причинах брадикардії показання до імплантації кардіостимулятора викладені в табл. 82.
Таблиця 82. Показання до імплантації кардіостимулятора при незворотних причинах брадикардії
| Механізм брадикардії | Рекомендації | Клас доказів | Рівень доказів |
| СССВ | Імплантація показана, коли симптоми чітко пов’язані з брадикардією | I | B |
| Імплантація може бути виконана, коли зв’язок симптомів з брадикардією не доведений | IIb | C | |
| АV-блокада | Імплантація показана пацієнтам з АV-блокадою III ступеня або II ступеня, Мобіц ІІ незалежно від симптомів | I | С |
| Імплантація може бути проведена у пацієнтів з АV-блокадою II ступеня, Мобіц І, що є причиною симптомів | IIa | С |
Вибір типу кардіостимулятора залежить від механізму брадикардії та представлений на рис. 16.
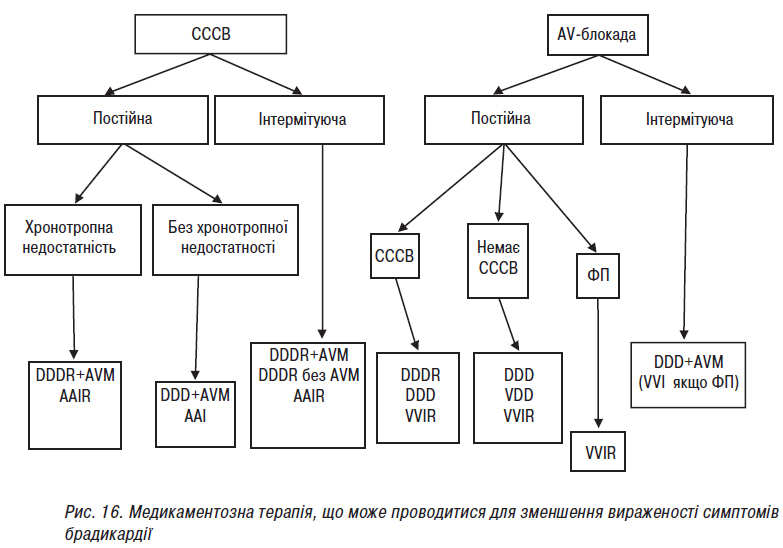
Хворим показані:
- препарати атропіну;
- краплі Зеленіна;
- діуретики за наявності ознак затримки рідини:
- фуросемід;
- торасемід;
- гідрохлоротіазид;
- антагоністи альдостерону;
- антагоністи кальцію для корекції АТ;
- аміодарон у хворих із симптоматичними або тяжкими шлуночковими аритміями, а також при тахісистолічній формі ФП при недостатньому ефекті інших препаратів;
- внутрішньовенно симпатоміметичні засоби — допамін та/або добутамін — бажано використовувати із застосуванням спеціальних дозаторів;
- нітрати внутрішньовенно або сублінгвально похідні нітрогліцерину чи ізосорбіду динітрату;
- антикоагулянти прямі (гепарини), непрямі (варфарин) та нові (ривароксабан, апіксабан, дабігатрану ексилат).
I44.7. Блокада лівої гілки пучка Гіса неуточнена
Діагностика повної блокади лівої гілки пучка Гіса у пацієнтів із хронічною СН
- Визначення скарг та анамнезу.
- Клінічний огляд.
- Вимірювання АТ на обох руках.
- Дослідження лабораторних показників:
-
- креатинін;
- загальних ХС та ТГ;
- калій, натрій;
- АЧТЧ, МНВ.
- ЕКГ у 12 відведеннях.
- ЕхоКГ.
- Рентгенографія органів грудної клітки.
Лікування при повній блокаді лівої гілки пучка Гіса у пацієнтів із хронічною СН
З метою корекції передсердно-шлуночкової, міжшлуночкової та внутрішньолуночкової дисинхронії хворим із синусовим ритмом показана імплантація кардіоресинхронізувального пристрою (трикамерного стимулятора). Хворим із постійною формою ФП показана імплантація бівентрикулярного ЕКС.
Пацієнти зі зниженою ФВ (<35%) входять у групу високого ризику раптової серцевої смерті та є кандидатами для ІКД.
Тому в переважної більшості пацієнтів слід імплантувати пристрої, що мають як функцію ІКД, так і функцію ресинхронізації (CRT-D).
Кандидати на CRT-терапію мають відповідати таким критеріям:
- CН на оптимізованій терапії II–IV ФК за
- Графіка блокади лівої ніжки пучка Гіса.
- Тривалість QRS >120 мс (чим довше, тим вища вірогідність позитивної відповіді на кардіоресинхронізацію).
- ФВ <35%.
Амбулаторне спостереження
Після імплантації ШВРС хворого необхідно направити на медико-соціальну експертизу з метою визначення подальшої працездатності.
Хворі з імплантованими пристроями повинні з’являтися на огляди до електрофізіолога з метою перевірки ШВРС, адаптації програми (налаштувань) ШВРС. Графік візитів викладено в табл. 83.
Таблиця 83. Візити пацієнтів для перевірки ШВРС
| № з/п візиту | Термін візиту після імплантації |
| 1 | 10 днів |
| 2 | 1 міс |
| 3 | 3 міс |
| 4 | 6 міс |
| 5 | Кожні 6 міс |
Пацієнти з ІКД мають звертатися до електрофізіолога, крім планових візитів, після кожного розряду ІКД, пацієнти з кардіоресинхронізатором повинні, крім перевірки з програматором, проходити налаштування під контролем ехоКГ (табл. 84).
Таблиця 84. Код стимулятора NASPE/BPEG
| Камера що стимулюється | Камера що аналізується | Реакція на власний ритм серця | Частотна адаптація |
| A (atrium) передсердя | A (atrium) передсердя | T (triggered): Реагує на свій ритм антитахікардитичною стимуляцією | R: частотна адаптація |
| V (ventriculum) шлуночок | V (ventriculum) шлуночок | I: Поява свого ритму пригнічує роботу стимулятора | O: none |
| D (dual (A+V)): обидві | D (dual (A+V)): обидві | D (dual (T+I)): залежно від програми реакція може бути подвійною | |
| О (none): немає стимуляції | О (none): немає чутливості, асинхронний режим | O: none | |
| S (single (A or V)) або шлуночок, або передсердя | S (single (A or V)) або шлуночок, або передсердя |
Синкопальні стани (R55)
I. Рефлекторні (неврогенні) запаморочення:
- вазовагальні (I95.1):
- внаслідок емоційного стресу: страх, біль, фобія крові, медичних маніпуляцій та інструментарію;
- ортостатичне навантаження;
- ситуаційні (R57.9): чхання, кашель;
- стимуляція шлунково-кишкового тракту: ковтання, дефекація, вісцеральний біль;
- реакція на сечовиділення;
- після фізичного навантаження;
- постпрандіальні (після прийому їжі);
- інші (сміх, гра на духових музичних інструментах, підняття тяжких предметів);
- подразнення каротидного синуса (G90.0);
- атипові (неуточнений тригер або атипові прояви).
II. Запаморочення внаслідок ортостатичної гіпотензії (I95.1):
- первинна вегетативна недостатність: чиста вегетативна недостатність, множинна системна атрофія, хвороба Паркінсона з вегетативною недостатністю, деменція Леві;
- вторинна вегетативна недостатність: цукровий діабет, амілоїдоз, уремія, травма спинного мозку;
- ортостатична гіпотензія, спровокована хімічними речовинами/медикаментами: алкоголь, діуретики, вазодилататори, фенотіазиди, антидепресанти;
- дефіцит ОЦК: кровотеча, діарея, блювання та ін.
III. Кардіогенні запаморочення (R57):
- аритмогенні (первинна причина) (I45.9):
а) брадикардія:
- дисфункція синусного вузла, включаючи синдром тахі-/бради-;
- порушення АV-провідності;
- дисфункція імплантованого водія ритму;
б) тахікардія:
- суправентрикулярна;
- шлуночкова (ідіопатична, патологія функції іонних каналів внаслідок структурної кардіальної патології);
в) бради- і тахіаритмії, спричинені прийомом ліків;
2. структурна патологія:
а) кардіальна: клапанні вади серця, ГКС, ГКМП, внутрішньосерцеві об’ємні утворення (міксома, пухлини та ін.), перикардит/тампонада, вроджені аномалії розвитку коронарних артерій, дисфункція протезу клапана і т.д.;
б) інші: емболії малого кола кровообігу, гостре розшарування аневризми аорти, ЛГ.
Діагностика синкопе
Первинна оцінка
Первинне обстеження пацієнта, який переніс короткочасну втрату свідомості, включає:
- Ретельний збір анамнезу.
- Об’єктивне обстеження, у тому числі вимірювання АТ стоячи, ЕКГ. Тільки з урахуванням цих даних можна проводити подальше обстеження:
- масаж каротидного синусу у пацієнтів віком молодше 40 років;
- ехоКГ у разі підтвердженого захворювання серця, при підозрі на нього чи синкопе внаслідок серцево-судинної патології;
- ЕКГ-моніторування при підозрі на синкопе аритмічного походження;
- ортостатичні проби (активна (перехід з положення лежачи в положення стоячи) і пасивна) у разі, якщо синкопе асоціюється з перебуванням у положенні стоячи чи при підозрі на рефлекторний механізм.
Інші обстеження, такі як неврологічне, аналіз крові, показані при підозрі на несинкопальну природу втрати свідомості.
Початкові обстеження повинні дати відповідь на основні питання:
- Чи синкопальним є епізод?
- Чи є отримані дані підґрунтям для підозри високого ризику серцево-судинних захворювань чи смерті?
Діагностика
Збір анамнезу, але іноді це зробити досить складно. Необхідно з’ясувати декілька питань:
- Чи була втрата свідомості повною?
- Чи була втрата свідомості транзиторною зі швидким розвитком нападу чи нетривалою?
- Чи було у пацієнта відновлення стану спонтанним, повним чи з ускладненнями?
- Чи втрачав пацієнт постуральний тонус?
Якщо відповіді на ці питання позитивні, то, найімовірніше, маємо справу з синкопе. Якщо ж хоча б на одне питання відповідь негативна, то перед тим, як продовжити оцінку синкопе, необхідно виключити інші форми втрати свідомості.
Клінічні особливості, що вказують на діагноз при первинному огляді
Нейроопосередковані синкопе:
- відсутність патології серця;
- тривалий анамнез повторних синкопе;
- розвиток синкопе після неочікуваного неприємного звуку, запаху, образи чи болю;
- тривале перебування у положенні стоячи, особливо в людних, задушливих місцях;
- нудота, блювання, асоційовані із синкопе;
- розвиток синкопе під час чи після прийому їжі;
- розвиток синкопе при повороті голови протягом тривалого часу чи при стискуванні каротидного синуса (при пухлинах у цій ділянці, під час гоління, при носінні тугих комірців);
- після нервового напруження.
Синкопе, асоційовані з ортостатичною гіпотензією:
- розвиток синкопе після тривалого перебування у положенні стоячи;
- тимчасовий взаємозв’язок з початком прийому судинозвужувальних препаратів чи зміна їх дозування, що могло б призвести до гіпотензії;
- тривале перебування у положенні стоячи, особливо в людних і задушливих місцях;
- наявність автономної нейропатії чи хвороби Паркінсона;
- стан після нервового напруження.
Синкопе кардіоваскулярного ґенезу:
- наявність органічної патології серця;
- наявність у сімейному анамнезі раптової смерті чи патології іонних каналів;
- відхилення на ЕКГ;
- несподіваний напад прискореного серцебиття, після якого відразу виникає напад синкопе.
ЕКГ-ознаки синкопе внаслідок аритмії:
- двопучкова блокада (визначена як блокада лівої чи правої ніжки пучка Гіса у поєднанні з блокадою передньоверхнього чи нижньозаднього розгалуження лівої ніжки пучка Гіса);
- інші порушення внутрішньошлуночкової провідності (тривалість QRS >0,12 с);
- АV-блокада ІІ ступеня типу Мобітц I;
- безсимптомна синусова брадикардія (<50 уд./хв), синоаурикулярна блокада чи синусова пауза >3 с за відсутності препаратів з негативним хронотропним ефектом;
- нетривала шлуночкова тахікардія;
- стимульовані QRS-комплекси;
- довгі чи короткі інтервали Q–T;
- рання реполяризація;
- блокада правої ніжки пучка Гіса з підняттям сегмента ST у відведеннях V1–V3 (синдром Бругада);
- підозра на аритмогенну кардіопатію ПШ через наявність негативних Т-хвиль у правому грудному відведенні, епсилон-хвиль та пізніх шлуночкових потенціалів;
- характер Q-хвиль свідчить про ІМ.
Стратифікація ризику
Фактори високого ризику, наявність яких потребує термінової госпіталізації чи надання інтенсивної допомоги
Тяжке органічне захворювання серця чи ІХС (СН, знижена ФВ ЛШ чи ІМ в анамнезі).
Клінічні чи ЕКГ-ознаки синкопе аритмогенної етіології:
- напад синкопе під час напруження чи в положенні лежачи на спині;
- прискорення серцебиття під час синкопе;
- випадки раптової смерті в сімейному анамнезі;
- нетривала шлуночкова тахікардія;
- двопучкова блокада (блокада лівої чи правої ніжки пучка Гіса в поєднанні з блокадою передньоверхнього чи нижньозаднього розгалуження лівої ніжки пучка Гіса) чи інші відхилення внутрішньошлуночкової провідності з тривалістю QRS >120 мс);
- безсимптомна синусова брадикардія (<40 уд./хв), синоаурикулярна блокада чи синусова пауза >3 с при відсутності препаратів з негативним хронотопним ефектом чи фізичного напруження;
- стимульовані QRS-комплекси;
- довгі чи короткі інтервали Q–T;
- ознаки блокади правої ніжки пучка Гіса з підняттям сегмента ST у відведеннях V1–V3 (синдром Бругада);
- підозра на аритмогенну кардіопатію ПШ через наявність негативних Т-хвиль у правому грудному відділі, епсилон-хвиль та пізніх шлуночкових потенціалів.
Важливі супутні патологічні стани:
- анемія тяжкого ступеня;
- порушення електролітного балансу.
Ортостатична проба
Інструментальні методи обстеження:
- 24-годинне амбулаторне холтерівське моніторування;
- Tilt-тести (якщо підозрюються ваговагальні синкопе);
- зовнішні рекордери (якщо напади виникають кожні <30 днів);
- імплантовані рекордери (якщо напади минущі або рідкісні — >30 днів);
- ЕФД серця (при підозрі чи наявності органічного захворювання серця).
Інші методи за необхідності:
- неврологічне обстеження;
- психіатричне обстеження;
- вказівка на прийом деяких препаратів.
Терапія синкопе
- Імплантація пейсмейкера.
- ІКД.
- Катетерна абляція аритмій.
- Інші методи лікування синкопальних станів.
Стандарти надання медичної допомоги хворим із хронічною серцевою недостатністю
(Л.Г. Воронков, А.В. Ляшенко, Н.А. Ткач)
Діагностика
Положення протоколу
Клінічне, лабораторне та інструментальне обстеження пацієнтів проводиться з метою:
- встановлення або виключення діагнозу СН;
- виявлення етіологічних факторів розвитку СН;
- виявлення супутньої патології, що негативно впливає на перебіг СН;
- визначення тактики та програми лікування;
- скринінг пацієнтів, які потребують направлення до закладів охорони здоров’я вищого рівня.
Необхідні дії лікаря щодо діагностики СН
Оцінка скарг пацієнта та об’єктивних ознак:
- проведення клінічного огляду пацієнта, до якого входять:
- збір скарг та анамнезу;
- визначення етіологічних факторів;
- фізикальне обстеження серця, легень, черевної порожнини.
Базове лабораторне обстеження:
- загальний аналіз крові (гемоглобін, еритроцити, лейкоцити, тромбоцити, гематокрит, ШОЕ); загальний аналіз сечі; біохімічні тести: K+, Na+, сечова кислота, креатинін з розрахунком ШКФ за формулами СКD-ЕРІ або MDRD, білірубін, «печінкові» ферменти, глюкоза.
Базове інструментальне обстеження:
- реєстрація ЕКГ у 12 відведеннях;
- ехоКГ;
- рентгенографія грудної клітки.
Остаточна оцінка вірогідності наявності СН та рівня ризику за результатами клінічного огляду та проведених обстежень
Додаткові дослідження за показаннями:
- Магнітно-резонансне дослідження серця.
- Стрес-ехоКГ.
- Черезстравохідна ехоКГ.
- Коронарна ангіографія.
- КТ серця.
- Холтерівське моніторування ЕКГ.
- Тест із фізичним навантаженням.
- Концентрація НУП у плазмі крові.
- Кардіоспецифічні ферменти.
- МНВ.
- ТТГ.
- Феритин у плазмі крові, насичення трансферину залізом.
- Катетеризація правих відділів серця.
- Ендоміокардіальна біопсія.
Стратифікація серцево-судинного ризику
Оцінка клінічного прогнозу
Можливості індивідуального прогнозування перебігу хронічної СН є обмеженими, враховуючи те, що відомі з літератури відповідні прогностичні маркери відображають імовірність виживання великих груп хворих, а не окремих пацієнтів. Втім, для визначення оптимальної стратегії ведення хворих лікареві доцільно враховувати доступні для визначення у звичайній клінічній практиці ознаки, наявність кожної з яких у пацієнтів із хронічною СН асоційована з поганим прогнозом виживання (табл. 85).
Таблиця 85. Показники очікуваної низької виживаності у пацієнтів із хронічною СН
| Клініко-демографічні | Інструментальні | Лабораторні |
| ІІІ–ІV ФК за NYHA | Стійка артеріальна гіпотензія | Високий рівень циркулюючих НУП |
| Похилий вік | Розширення QRS (>0,12 с) | (BNP >600 пкг/мл NT-proBNP |
| Зупинка кровообігу в анамнезі | Значно знижена (<30%) ФВ ЛШ | >2000 пкг/мл) |
| ІІІ протодіастолічний тон | Шлуночкові аритмії високих градацій | Гіпонатріємія (Na+ <135 ммоль/л) |
| Асцит | Підвищений рівень тропоніну | |
| Рефрактерність до діуретиків | Тахісистолія (САТ >60 мм рт. ст.) | Креатинін у сироватці крові |
| Нижча за норму маса тіла | Супутня систолічна дисфункція ПШ | >200 мкмоль/л, ШКФ <60 мл/хв |
| Супутній цукровий діабет | Рестриктивний тип наповнення ЛШ | Рівень білірубіну вищий за норму |
| Супутнє ХОЗЛ | Максимальне cпоживання кисню | Гемоглобін <120 г/л |
| Синдром нічного апное | <11 мл/хв/м2 (спіроергометрія) | Сечова кислота >600 мкмоль/л |
| Аортальний стеноз | ||
| Недостатня прихильність до лікування | ||
| Депресія |
Алгоритм діагностики хронічної СН
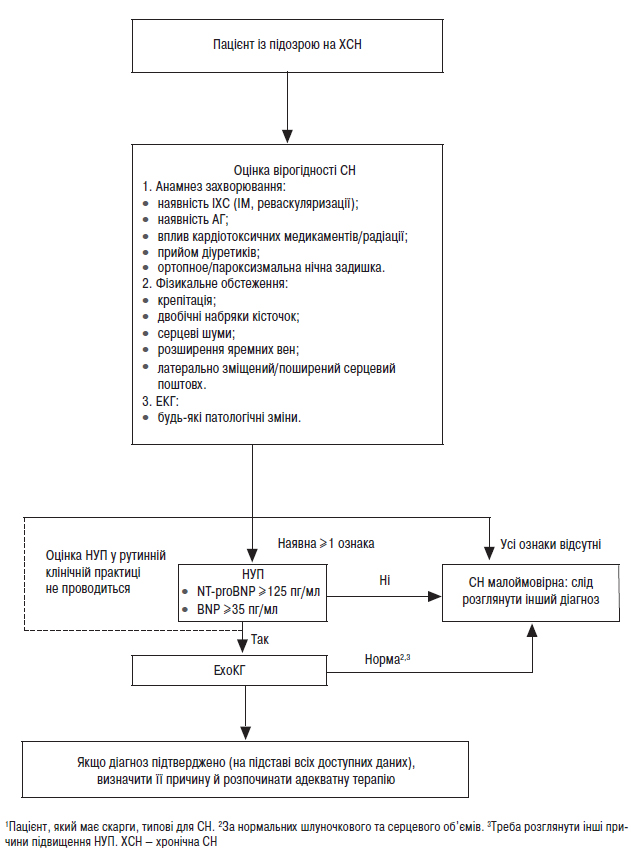
Лікування
Цілі лікування хронічної СН
Цілями лікування хворих із СН є поліпшення їх клінічного статусу, функціональних можливостей та якості життя, запобігання госпіталізаціям та зниження смертності. Встановлено, що кілька класів препаратів, упроваджених для лікування хронічної СН, здатні покращити довготривалий прогноз. Лікування пацієнтів із хронічною СН має здійснюватися необмежено довго під контролем клінічного стану та переносимості лікування.
Програма лікування
Пацієнтам із хронічною СН починають проводити медикаментозне лікування, щоб зменшити вираженість симптомів та поліпшити прогноз (табл. 86).
Таблиця 86. Лікарські засоби з доведеним сприятливим впливом на клінічний прогноз хронічної СН зі зниженою ФВ ЛШ та їх дози
| Засіб | Стартова доза | Цільова доза |
| Інгібітори АПФ | ||
| Каптоприл | 6,25 мг 3 рази на добу | 50 мг 3 рази на добу |
| Еналаприл | 2,5 мг 2 рази на добу | 20 мг 1–2 рази на добу |
| Лізиноприл | 2,5–5,0 мг/добу | 30–35 мг/добу |
| Раміприл | 2,5 мг/добу | 10 мг/добу |
| Трандолаприл | 0,5 мг/добу | 4 мг/добу |
| Блокатори бета-адренорецепторів | ||
| Бісопролол | 1,25 мг/добу | 10 мг/добу |
| Карведилол | 3,125 мг 2 рази на добу | 25 мг 2 рази на добу |
| Метопрололу сукцинат (CR/XL) | 12,5–25 мг/добу | 200 мг/добу |
| Небіволол | 1,25 мг/добу | 10 мг/добу |
| БРА | ||
| Кандесартан | 4–8 мг/добу | 32 мг/добу |
| Валсартан | 40 мг 2 рази на добу | 160 мг 2 рази на добу |
| Лозартан | 50 мг/добу | 150 мг/добу |
| БРА/інгібітор неприлізину | ||
| Сакубітрил/валсартан* | 49/51 мг 2 рази на добу | 97/103 мг 2 рази на добу |
| Антагоністи мінералокортикоїдних рецепторів | ||
| Еплеренон | 25 мг/добу | 50 мг/добу |
| Спіронолактон | 25 мг/добу | 25–50 мг/добу |
| Інгібітор If-каналів | ||
| Івабрадин | 5 мг 2 рази на добу | 7,5 мг 2 рази на добу |
*Максимальна доза 50 мг 2 рази на добу може бути призначена пацієнтам із масою тіла >85 кг.
- Інгібітори АПФ. Рекомендовано призначати інгібітори АПФ (поряд із блокатором бета-адренорецепторів) пацієнтам із маніфестною СН зі зниженою ФВ. Мета — зниження частоти госпіталізацій із приводу СН та смертності (клас рекомендацій І).
- Блокатори бета-адренорецепторів. Рекомендовано призначати блокатор бета-адренорецепторів (поряд із інгібіторами АПФ) пацієнтам із маніфестною СН зі зниженою ФВ у гемодинамічно стабільному стані. Мета — зниження частоти госпіталізацій із приводу СН і смертності (клас рекомендацій І). Призначення блокаторів бета-адренорецепторів також може бути розглянуте в амбулаторних пацієнтів із ХСН та ФВ ЛШ у проміжному діапазоні (40–49%) та синусовим ритмом. Мета — зниження ризику смерті від будь-яких причин та серцево-судинної смерті.
- Блокатори рецепторів ангіотензину ІІ. Рекомендовано призначати БРА симптомним хворим, які не переносять інгібітори АПФ та отримують блокатори бета-адренорецепторів та антагоністи мінералокортикоїдних рецепторів. Мета — зниження ризику госпіталізацій, спричинених СН, та серцево-судинної смерті (клас рекомендацій І).
Кандесартан може бути розглянутий в амбулаторних пацієнтів із симптомами СН та ФВ ЛШ у проміжному діапазоні (40–49%) з метою зниження ризику госпіталізацій з приводу СН та смерті від серцево-судинних причин.
- Інгібітори неприлізину/рецепторів ангіотензину ІІ. Рекомендовано призначати валсартан/сакубітрил замість інгібіторів АПФ амбулаторним хворим із СН зі зниженою ФВ, яка залишається маніфестною, незважаючи на оптимальну терапію інгібіторами АПФ, блокаторами бета-адренорецепторів та антагоністами мінералокортикоїдних рецепторів. Мета — подальше зниження ризику госпіталізацій, спричинених СН, та смерті (клас рекомендацій І).
Ініціація сакубітрилу/валсартану, радше, ніж ініціація інгібіторів АПФ/БРА, може бути розглянута у пацієнтів зі зниженою ФВ ЛШ, госпіталізованих з приводу декомпенсації ХСН після попередньої стабілізації гемодинаміки. Мета — зниження наступного ризику несприятливих клінічних подій.
- Антагоністи мінералокортикоїдних рецепторів. Рекомендовано призначати антагоністи мінералокортикоїдних рецепторів пацієнтам із СН зі зниженою ФВ, яка залишається маніфестною, попри лікування інгібіторами АПФ і блокатором бета-адренорецепторів. Мета — зниження частоти госпіталізацій із приводу СН і смертності (клас рекомендацій І).
Призначення спіронолактону може бути розглянуте в амбулаторних пацієнтів із симптомами ХСН та ФВ ЛШ у проміжному діапазоні з метою зниження ризику серцево-судинної смерті та госпіталізацій з приводу СН.
- Івабрадин. Слід обговорити доцільність призначення івабрадину симптомним хворим із ФВ ЛШ ≤35% і синусовим ритмом із частотою у спокої ≥70 уд./хв, незважаючи на терапію рекомендованими дозами блокаторів бета-адренорецепторів (або нижчими дозами, які хворі можуть максимально переносити), інгібіторів АПФ (або БРА), а також антагоністів мінералокортикоїдних рецепторів (або БРА). Мета — зниження ризику госпіталізацій, спричинених СН, та серцево-судинної смерті (клас рекомендацій ІІa). Слід також обговорити доцільність призначення івабрадину симптомним хворим із ФВ ЛШ ≤35% і синусовим ритмом із частотою у спокої ≥70 уд./хв, які не переносять блокатори бета-адренорецепторів або які мають протипоказання до їх прийому, отримують інгібітори АПФ (або БРА) та антагоністи мінералокортикоїдних рецепторів (або БРА). Мета — зниження ризику госпіталізацій, спричинених СН, та серцево-судинної смерті (клас рекомендацій ІІa).
- Дигоксин. У пацієнтів ІI–III ФК за NYHA з ФП слід розглянути можливість призначення дигоксину, якщо ЧШС залишається високою, незважаючи на терапію блокаторами бета-адренорецепторів, або коли блокатори бета-адренорецепторів не переносяться чи протипоказані (клас рекомендацій ІІa). Можна розглянути доцільність призначення дигоксину пацієнтам із синусовим ритмом, які залишаються симптомними, незважаючи на терапію інгібіторами АПФ (або БРА), блокатором бета-адренорецепторів та антагоністами мінералокортикоїдних рецепторів. Мета — зниження ризику госпіталізацій (як спричинених СН, так і загальних) (клас рекомендацій ІІb).
- Діуретики. Рекомендовано призначати діуретики хворим із фізикальними ознаками та/або скаргами, пов’язаними із застоєм. Мета — покращення суб’єктивної симптоматики та здатності до фізичних навантажень (клас рекомендацій І). Слід обговорити доцільність призначення діуретиків хворим із фізикальними ознаками та/або скаргами, пов’язаними із застоєм. Мета — зниження ризику госпіталізацій, спричинених СН (клас рекомендацій ІІa) (табл. 87).
- Пероральні антикоагулянти (ПАК). Терапію ПАК рекомендовано для профілактики тромбоемболізму в усіх пацієнтів із пароксизмальною чи персистуючою/постійною ФП та оцінкою за шкалою CHA2DS2-VASc ≥2 балів за умови відсутності протипоказань і незалежно від того, яку стратегію застосовують, — контролю ритму чи частоти (у тому числі після успішної кардіоверсії) (клас рекомендацій І). Терапія новими ПАК протипоказана пацієнтам із механічними клапанами або з мітральним стенозом (клас рекомендацій ІІІ).
Пацієнтам із ФП тривалістю ≥48 год або якщо тривалість ФП невідома, рекомендовано призначати ПАК у терапевтичній дозі на період ≥3 тиж перед виконанням електричної чи фармакологічної кардіоверсії (клас рекомендацій І). Поєднання ПАК і антитромбоцитарного засобу не рекомендовано в пацієнтів із хронічною (>12 міс після гострої події) ІХС або з іншим артеріальним захворюванням через високий ризик розвитку серйозної кровотечі (клас рекомендацій ІІІ).
У таких пацієнтів після 12 міс перевагу слід віддавати монотерапії ПАК. У пацієнтів із СН та неклапанною ФП, які є кандидатами на антикоагулянтну терапію за результатами оцінки за шкалою CHA2DS2VASc, слід віддавати перевагу новим ПАК перед варфарином, оскільки прийом нових ПАК асоціюється з нижчим ризиком розвитку інсульту, внутрішньочерепних крововиливів та нижчою смертністю, що переважує підвищений ризик розвитку шлунково-кишкових кровотеч (клас рекомендацій ІІа).
У стабільних (NYHA I–II) амбулаторних пацієнтів із хронічною ІХС, ускладненою ХСН, із синусовим ритмом та ФВ ЛШ >30% може бути розглянуте додавання ривароксабану в дозі 2,5 мг 2 рази на добу до базової антитромбоцитарної терапії АСК. Мета — зниження ризиків інсульту та смерті від серцево-судинних причин.
Таблиця 87. Дози діуретиків, зареєстрованих в Україні, які зазвичай призначають хворим із хронічною СН
| Діуретик | Стартова доза, мг | Звичайна добова доза, мг | ||
| Петльові діуретики1 | ||||
| Фуросемід | 20–40 | 40–240 | ||
| Торасемід | 5–10 | 10–20 | ||
| Тіазидні/тіазидоподібні діуретики | ||||
| Гідрохлоротіазид2 | 25 | 12,5–100 | ||
| Ксипамід | 10 | 10–40 | ||
| Калійзберігаючі діуретики | ||||
| Спіронолактон або еплеренон | Інгібітори АПФ/БРА | Інгібітори АПФ/БРА | Інгібітори АПФ/БРА | Інгібітори АПФ/БРА |
| 12,5–25 | 50 | 50 | 100–200 | |
1Доза засобу, який призначають перорально або внутрішньовенно, може потребувати корекції залежно від волемічного статусу/маси тіла; надмірні дози здатні спричинити ураження нирок або ототоксичну дію.
2Не варто призначати гідрохлоротіазид, якщо обчислена ШКФ становить <30 мл/хв/1,73 м2, за винятком випадків, коли одночасно призначають петльові діуретики.
- Антитромбоцитарні засоби. АСК (75–100 мг/добу) та клопідогрель — у комбінації або окремо — показані пацієнтам із хронічною СН на фоні ІХС з ГКС, перкутанними втручаннями, стенокардією — відповідно до чинних стандартів лікування зазначених категорій пацієнтів.
- Внутрішньовенні препарати заліза. Необхідно обговорити доцільність внутрішньовенного призначення карбоксимальтози заліза в пацієнтів із маніфестною СН зі зниженою ФВ і дефіцитом заліза (сироватковий рівень феритину <100 мкг/л або в межах 100–299 мкг/л на тлі сатурації трансферином <20%). Мета — полегшення симптоматики СН, поліпшення якості життя і здатності виконувати фізичні навантаження (клас рекомендацій ІІа).
- Апаратні методи лікування хронічної СН зі зниженою ФВ ЛШ.
12.1. Встановлення ІКД. Вторинна профілактика: встановлення ІКД рекомендовано для зниження ризику раптової смерті та загальної смертності у пацієнтів, які відновилися після шлуночкової аритмії з гемодинамічною нестабільністю, якщо очікувана тривалість їхнього життя в задовільному функціональному стані становить >1 року (клас рекомендацій І). Первинна профілактика: встановлення ІКД рекомендовано для зниження ризику раптової смерті та загальної смертності у пацієнтів із симптомною хронічною СН (II– III ФК за NYHA) та ФВ ЛШ ≤35%, незважаючи на ≥3 міс ОМТ, за умови, якщо очікувана тривалість життя в задовільному функціональному стані значно >1 року, якщо хронічна СН зумовлена:
- ІХС (за винятком ІМ у попередні 40 днів — див. нижче) (клас рекомендацій І);
- дилатаційною кардіоміопатією (клас рекомендацій І).
ІКД не рекомендована протягом 40 днів після ІМ, оскільки в цей проміжок часу не покращується прогноз (клас рекомендацій ІІІ). ІКД не рекомендовано пацієнтам ІV ФК за NYHA з тяжкими симптомами, стійкими до фармакотерапії, якщо вони не є кандидатами на проведення КРТ, встановлення пристроїв допомоги шлуночкам або трансплантацію серця (клас рекомендацій ІІІ). Перед заміною генератора пацієнта має ретельно обстежити досвідчений кардіолог, оскільки мета надання допомоги, потреби пацієнта і його клінічний стан можуть змінитися (клас рекомендацій ІІa). Зовнішній портативний ІКД може бути запропонований пацієнтам із СН та ризиком раптової серцевої смерті на обмежений проміжок часу або як міст до встановлення імплантованого приладу (клас рекомендацій ІІb).
12.2. Імплантація пристроїв КРТ. КРТ рекомендована:
а) симптомним пацієнтам із СН, синусовим ритмом, тривалістю QRS ≥130 мс із морфологією блокади лівої ніжки пучка Гіса та ФВ ЛШ ≤35%, яка зберігається, незважаючи на ОМТ, з метою зменшення вираженості симптомів, зниження захворюваності та смертності (клас рекомендацій І);
б) КРТ слід розглядати у симптомних пацієнтів із СН, синусовим ритмом, тривалістю QRS ≥150 мс без морфології блокади лівої ніжки пучка Гіса та ФВ ЛШ ≤35%, яка зберігається, незважаючи на ОМТ, з метою зменшення вираженості симптомів, зниження захворюваності та смертності (клас рекомендацій ІІа);
в) КРТ можна розглянути у симптомних пацієнтів із СН, синусовим ритмом, тривалістю QRS 130–149 мс без морфології блокади лівої ніжки пучка Гіса та з ФВ ЛШ ≤35%, яка зберігається, незважаючи на ОМТ, з метою зменшення вираженості симптомів, зниження захворюваності та смертності (клас рекомендацій ІІb);
г) КРТ, радше, ніж стимуляція ПШ, рекомендована з метою зниження ризику розвитку ускладнень у пацієнтів із СН зі зниженою ФВ, незалежно від ФК за NYHA, які мають показання до стимуляції шлуночків й високий ступінь АV-блокади. Це також стосується пацієнтів із ФП (клас рекомендацій І);
д) КРТ слід розглянути у пацієнтів із ФВ ЛШ ≤35% та ІІІ–IV ФК за NYHA, незважаючи на ОМТ, з метою зменшення вираженості симптомів, зниження захворюваності та смертності; за наявності ФП та тривалості QRS ≥130 мс слід переконатися, що буде забезпечено бівентрикулярну стимуляцію або можливе відновлення синусового ритму (клас рекомендацій ІІа);
е) у пацієнтів із СН зі зниженою ФВ, яким було встановлено традиційний водій ритму або ІКД і у яких згодом перебіг СН погіршився, незважаючи на ОМТ, і при цьому спостерігається велика пропорція стимуляції ПШ, можна розглянути можливість застосування КРТ. Це не стосується пацієнтів зі стабільним перебігом СН (клас рекомендацій ІІb);
ж) КРТ протипоказана пацієнтам із тривалістю QRS <130 мс (клас рекомендацій ІІІ).
Абляція легеневих вен у пацієнтів із СН та симптомною пароксизмальною ФП може бути розглянута в разі наявності симптомів, що турбують пацієнта, незважаючи на застосування рекомендованої медикаментозної терапії та лікування за допомогою пристроїв апаратної терапії.
Абляція АV-вузла, як правило, з імплантацією бівентрикулярного електрокардіостимулятора (ЕКС), може бути розглянута, якщо пароксизми ФП провокують тяжку симптоматику, а абляція легеневих вен неефективна або неможлива.
Абляція легеневих вен при персистуючій ФП може бути розглянута у пацієнтів із СН та зниженою ФВ ЛШ з імплантованим пристроєм (КРТ або перманентний ЕКС), якщо виникнення ФП асоціювалося зі збільшенням вираженості симптоматики СН або якщо пацієнт є кандидатом на імплантацію КРТ.
13. Медикаментозне лікування пацієнтів із хронічною СН та збереженою ФВ ЛШ. Єдиного стандарту лікування таких хворих не існує. Принциповий алгоритм допомоги передбачає:
- адекватне лікування (фармакологічне або хірургічне) основного захворювання;
- адекватне лікування супутньої патології;
- терапію симптомів та циркуляторних порушень, притаманних СН;
- застосування діуретиків у пацієнтів з ознаками гіперволемії.
Алгоритм лікування хворих із маніфестною (ІІ–ІV ФК) хронічною СН зі зниженою ФВ ЛШ
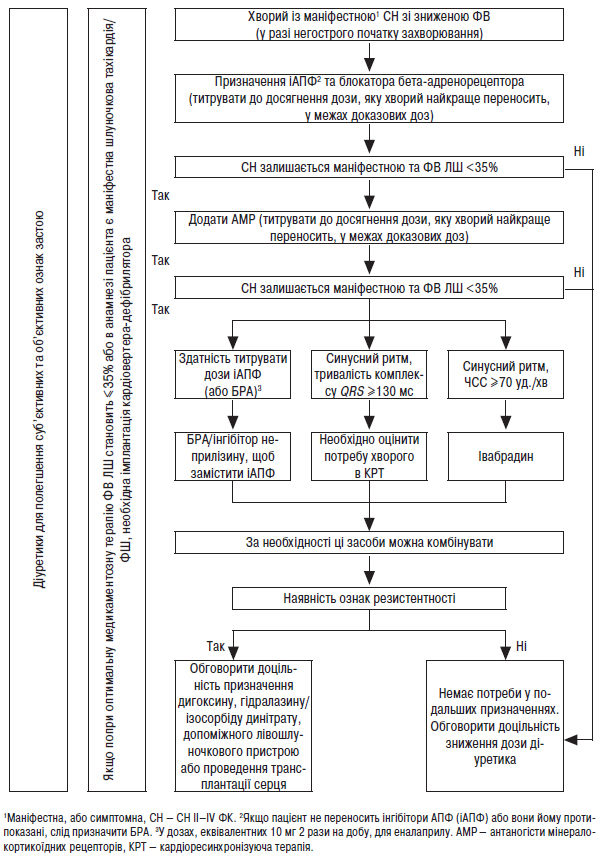
Можливі побічні реакції, що можуть виникати при використанні основних засобів фармакотерапії хронічної СН та їх подолання
Інгібітори АПФ
Асимптомний низький АТ:
- зазвичай не потребує змін терапії.
Симптомна гіпотензія:
- епізоди запаморочення — поширене явище, яке нерідко з часом зникає; пацієнта слід про це попередити;
- переглянути потребу в прийомі нітратів, антагоністів кальцію та інших вазодилататорів; якщо можливо, знизити дозу або відмінити препарати;
- якщо немає ознак чи симптомів затримки рідини, розглянути можливість зниження дози діуретика. Якщо після вжиття зазначених заходів проблему не вирішено, порадитися з фахівцем.
Кашель:
- доволі поширений у пацієнтів із СН, багато з них мають захворювання легень, пов’язане з курінням;
- може бути симптомом набряку легень, що слід виключити в разі появи кашлю, який погіршує стан пацієнта;
- кашель, індукований інгібітором АПФ, не завжди потребує припинення терапії;
- у випадках, коли виникає обтяжливий кашель (наприклад такий, що заважає пацієнту спати) і можна підтвердити, що він спричинений інгібуванням АПФ (наприклад кашель зникає після відміни й знову з’являється при відновленні прийому інгібіторів АПФ), рекомендовано замінити інгібітор АПФ на БРА.
Погіршення функції нирок та гіперкаліємія:
- після початку прийому інгібіторів АПФ слід очікувати деякого підвищення рівнів сечовини (азоту сечовини в крові), креатиніну й калію; якщо підвищення незначне і не супроводжується симптомами, втручатися не потрібно;
- підвищення креатиніну до 50% відносно початкового рівня або до 266 мкмоль/л (3 мг/дл)/ШКФ <25 мл/хв/1,73 м2 вважають прийнятними;
- підвищення рівня калію до ≤5,5 ммоль/л вважають прийнятним;
- якщо рівень сечовини, креатиніну чи калію підвищується понад зазначені межі, розглянути можливість припинення одночасного прийому нефротоксичних лікарських засобів (таких як нестероїдні протизапальні препарати), калійвмісних харчових добавок або калійзберігаючих препаратів (тріамтерен, амілорид), а також якщо немає ознак затримки рідини, знизити дозу діуретика;
- якщо рівні креатиніну та калію продовжують зростати понад вищезазначені межі, незважаючи на корекцію супутньої терапії, слід удвічі знизити дозу інгібітора АПФ (або БРА) і повторити через 1–2 тиж біохімічні аналізи; якщо відповідь усе одно залишається незадовільною, слід порадитися з фахівцем;
- якщо рівень калію підвищується до >5,5 ммоль/л або рівень креатиніну зростає на >100% чи до >310 мкмоль/л (3,5 мг/дл)/ШКФ становить <20 мл/хв/1,73 м2, слід припинити терапію інгібіторами АПФ (або БРА) і порадитися з фахівцем;
- необхідно часто повторювати біохімічні аналізи крові доти, доки концентрації калію та креатиніну почнуть вирівнюватися.
Блокатори бета-адренорецепторів
Збільшення вираженості симптомів (наростання задишки, слабкість, набряки, збільшення маси тіла):
- у разі наростання застійних явищ підвищити дозу діуретика, а якщо це не допомагає, знизити дозу блокатора бета-адренорецепторів удвічі;
- якщо спостерігається брадикардія, знизити дозу блокатора бета-адренорецепторів удвічі (у цьому рідко виникає потреба);
- повторно обстежити пацієнта через 1–2 тиж; якщо покращення не спостерігається, звернутися за порадою до фахівця;
- у разі серйозного погіршення стану знизити дозу блокатора бета-адренорецепторів вдвічі або припинити терапію (у цьому рідко виникає потреба);
- звернутися за порадою до фахівця.
Низька ЧСС:
- якщо ЧСС становить <50 уд./хв і вираженість симптомів збільшується, знизити дозу блокатора бета-адренорецепторів вдвічі, а у разі серйозного погіршення стану припинити терапію (у цьому рідко виникає потреба);
- переглянути потребу в інших препаратах, що знижують ЧСС (наприклад дигоксин, аміодарон, дилтіазем або верапаміл);
- виконати ЕКГ для виключення серцевої блокади;
- звернутися за порадою до фахівця.
Асимптомний низький АТ:
- зазвичай не потребує будь-яких змін терапії.
Симптомна гіпотензія:
- у разі виникнення запаморочення чи синкопальних станів і якщо низький АТ, переглянути потребу в нітратах, антагоністах кальцію та інших вазодилататорах, знизити їх дози або, якщо можливо, відмінити;
- якщо немає ознак та симптомів застою, розглянути можливість зниження дози діуретика;
- якщо виконання зазначених заходів не вирішило проблему, слід порадитися з фахівцем.
Антагоністи мінералокортикоїдних рецепторів
Погіршення функції нирок та гіперкаліємія:
- перевірити функцію нирок та електроліти (особливо К+);
- починати з низької дози;
- розглянути необхідність титрування дози в бік підвищення через 4–8 тиж;
- перевірити біохімічні показники крові через 1 і 4 тиж після початку терапії/підвищення дози, а також через 12 тиж, 6 міс, а згодом принаймні кожні 4 міс:
- якщо рівень К+ підвищується >5,5 ммоль/л або рівень креатиніну до 221 мкмоль/л (2,5 мг/дл)/ШКФ становить <30 мл/хв/1,73 м2, знизити дозу вдвічі й пильно стежити за біохімічними показниками крові;
- якщо рівень К+ підвищується до >6,0 ммоль/л або рівень креатиніну до >310 мкмоль/л (3,5 мг/дл)/ШКФ становить <20 мл/хв/1,73 м2, негайно припинити терапію антагоністами мінералокортикоїдних рецепторів і порадитися з фахівцем;
- найбільше занепокоєння викликає гіперкаліємія (>6,0 ммоль/л); незважаючи на те що вона нечасто виникала в дослідженнях RALES та EMPHASIS-HF, у клінічній практиці трапляється частіше;
- важливо уникати одночасного з антагоністами мінералокортикоїдних рецепторів застосування інших препаратів, що затримують калій (таких як амілорид і тріамтерен), і нефротоксичних лікарських засобів (таких як нестероїдні протизапальні препарати);
- ризик виникнення гіперкаліємії і ниркової дисфункції завжди вищий, якщо антагоністи мінералокортикоїдних рецепторів призначають пацієнту, який уже приймає й інгібітор АПФ, і БРА, ніж у випадку, коли антагоністи мінералокортикоїдних рецепторів додають до одного з препаратів — інгібітора АПФ чи БРА; ця потрійна комбінація інгібітора АПФ, БРА і антагоніста мінералокортикоїдних рецепторів не рекомендується;
- деякі замінники харчової солі містять велику кількість К+;
- у чоловіків, які приймають спіронолактон, іноді відмічають дискомфорт у грудних залозах або гінекомастію (їм слід запропонувати перейти на прийом еплеренону).
Діуретики
Асимптомний низький АТ:
- дозу можна знизити, якщо відсутні симптоми чи ознаки затримки рідини.
Симптомна гіпотензія:
- якщо викликає запаморочення — знизити дозу за відсутності симптомів чи ознак затримки рідини;
- переглянути потребу в нітратах, антагоністах кальцію та інших вазодилататорах;
- якщо вжиті заходи не вирішили проблему, звернутися за порадою до фахівця.
Гіпокаліємія:
- підвищити дозу інгібітора АПФ/БРА;
- додати антагоніст мінералокортикоїдних рецепторів, калієві добавки.
Гіпонатріємія:
- внаслідок дефіциту об’єму рідини:
- якщо можливо, відмінити тіазидний діуретик або перевести пацієнта на петльовий діуретик;
- якщо можливо, знизити дозу або відмінити петльовий діуретик;
- внаслідок перевантаження об’ємом:
- обмежити вживання рідини;
- підвищити дозу петльового діуретика;
- розглянути можливість призначення антагоніста вазопресинових (V2)-рецепторів (наприклад толваптан, якщо він доступний);
- призначити внутрішньовенну інотропну підтримку;
- розглянути можливість застосування ультрафільтрації крові.
Гіперурикемія/подагра:
- розглянути можливість розпочати профілактику шляхом призначення алопуринолу;
- при симптомній подагрі застосовувати колхіцин для полегшення болю;
- уникати застосування нестероїдних протизапальних препаратів.
Гіповолемія/дегідратація:
- оцінити волемічний стан;
- розглянути можливість зниження дози діуретика.
Недостатня відповідь на діуретичну терапію/резистентність до діуретиків:
- перевірити виконання пацієнтом лікарських призначень і кількість уживаної рідини;
- підвищити дозу діуретика;
- розглянути можливість переходу з фуросеміду на торасемід;
- додати/підвищити дозу антагоніста мінералокортикоїдних рецепторів;
- комбінувати петльовий діуретик із тіазидним;
- призначити петльовий діуретик для прийому 2 рази (або більше) на добу чи натще;
- розглянути можливість тимчасового введення петльового діуретика внутрішньовенно;
- розглянути можливість застосування ультрафільтрації.
Ураження нирок (підвищення рівня креатиніну/азоту сечовини в крові):
- перевірити, чи немає ознак гіповолемії/дегідратації;
- виключити застосування інших нефротоксичних лікарських засобів, таких як нестероїдні протизапальні препарати, триметоприм;
- утриматися від застосування антагоністів мінералокортикоїдних рецепторів;
- якщо пацієнт приймає одночасно петльовий і тіазидний діуретик, то відмінити тіазидний;
- розглянути можливість зниження дози інгібітора АПФ/БРА;
- розглянути можливість гемофільтрації/діалізу.
Івабрадин
- Якщо ЧСС у спокої постійно становить <50 уд./хв, слід знизити дозу або припинити терапію. Якщо виникли симптоми брадикардії, необхідно:
- переглянути потребу в інших препаратах, що знижують ЧСС, або лікарських засобах, які впливають на метаболізм івабрадину в печінці;
- виконати ЕКГ для виключення інших, аніж синусова брадикардія, порушень ритму;
- розглянути можливість виявлення вторинних причин брадиаритмії (наприклад дисфункції щитоподібної залози).
- Якщо у пацієнта під час терапії івабрадином розвивається персистуюча або тривала ФП, препарат слід відмінити.
- Зорові порушення зазвичай минущі, зникають у перші кілька місяців прийому івабрадину й не асоціюються із серйозною дисфункцією сітківки. Однак якщо вони викликають у пацієнта дискомфорт, слід розглянути можливість відміни івабрадину.
- У разі непереносимості лактози або галактози (компоненти таблетки івабрадину), якщо з’являються симптоми, може виникнути потреба відмінити препарат.
Таблиця 88. Лікарські засоби (або їх комбінації), які здатні завдати шкоди хворим із маніфестною (ІІ–ІV ФК) хронічною СН зі зниженою ФВ ЛШ
| Рекомендації | Клас рекомендацій |
| Не рекомендовано призначати тіазолідиндіони (глітазони) пацієнтам із СН, оскільки ці засоби підвищують ризик погіршення перебігу СН і потребу в госпіталізації з цього приводу | ІІІ |
| Не рекомендовано призначати нестероїдні протизапальні препарати або інгібітори циклооксигенази 2-го типу пацієнтам із СН, оскільки такі засоби підвищують ризик погіршення перебігу СН і потреби в госпіталізації з цього приводу | ІІІ |
| Не рекомендовано призначати дилтіазем або верапаміл пацієнтам із СН зі зниженою ФВ, оскільки такі засоби підвищують ризик погіршення перебігу СН і потреби в госпіталізації внаслідок цього | ІІІ |
| Не рекомендовано додавати БРА (або інгібітор реніну) до комбінованого лікування інгібіторами АПФ з антагоністами мінералокортикоїдних рецепторів у пацієнтів із СН, оскільки це підвищує ризик розвитку ниркової дисфункції та гіперкаліємії | ІІІ |
Основні ускладнення захворювання:
- Раптова аритмогенна смерть.
- Тромбоемболічні ускладнення (артеріальні або венозні).
- Гостра госпітальна та негоспітальна пневмонія.
- ФП та інші порушення ритму.
Рекомендації щодо амбулаторного нагляду
Загальні положення
Усі пацієнти з хронічною СН, зважаючи на серйозний клінічний прогноз, потребують диспансерного нагляду.
Основними завданнями лікаря під час спостереження пацієнта з хронічною СН на амбулаторному етапі мають бути наступні: якнайдовше підтримання досягнутого у стаціонарі ефекту стабілізації клініко-гемодинамічного стану; запобігання наступним госпіталізаціям із приводу декомпенсації кровообігу та з інших серцево-судинних причин; сприяння досягненню пацієнтом максимально можливої тривалості життя. Цього досягають: а) завдяки регулярному контролю клінічного стану пацієнта та ретельному дотриманню ним рекомендацій щодо при- йому ліків, способу життя, самодогляду і б) за необхідності корекції рекомендованої терапії з урахуванням її переносимості.
Важливе значення має лікування супутніх патологічних станів.
Терміни клінічного огляду
- Після виписки зі стаціонару:
- 1-й візит — протягом перших 7–14 днів;
- 2-й візит — через 1 міс після першого візиту;
- 3-й візит — через 3 міс після виписки.
- Надалі:
- за умови задовільного клініко-функціонального стану (NYHA I–II) — кожні 3–6 міс;
- у разі стабільно тяжкої хронічної СН (NYHA III–IV), якщо пацієнт не потребує стаціонарного лікування, — не рідше 1 разу на місяць.
Дії лікаря, рекомендовані при диспансерному спостереженні
- Загальноклінічне обстеження, оцінка волемічного статусу.
- ЕКГ, вимірювання АТ.
- Контроль і підтримка мотивації дотримання пацієнтом рекомендацій, за необхідності їх корекція.
- Лабораторні аналізи:
- К+, креатинін у плазмі крові через 1 тиж, 1, 3 та 6 міс від початку прийому інгібіторів АПФ (БРА) та/або антагоністів мінералокортикоїдних рецепторів і надалі щонайменше кожні 6 міс;
- інші — за рішенням лікаря з урахуванням клінічної ситуації та характеру лікування.
Трудова експертиза
Хворі із хронічною СН клінічних стадій ІІА, ІІБ і ІІІ є непрацездатними.
Рішення щодо працездатності пацієнтів із СН І стадії приймають органи медично-трудової експертизи індивідуально щодо кожного пацієнта з урахуванням основного захворювання, його клінічного перебігу та характеру трудової діяльності.
Освітні заходи щодо способу життя
Основні положення освітньої стратегії щодо пацієнтів із хронічною СН представлені в табл. 89.
Таблиця 89. Основні положення освітньої стратегії щодо пацієнтів із хронічною СН
| Тема навчання | Навички пацієнта | Професійні дії лікаря |
| Визначення етіології, закономірностей перебігу СН та прогнозу | Розуміти причини розвитку СН, появи симптомів та закономірності перебігу захворювання | Забезпечити пацієнта усною та письмовою інформацією з урахуванням рівня освіти й компетенції в питаннях здоров’я.
Виявити перешкоди в комунікації й постійно забезпечувати інформацією. Коректно інформувати щодо прогнозу на момент встановлення діагнозу, під час ухвалення рішень про лікування, зміни клінічного стану та в будь-який час за запитом пацієнта |
| Моніторування симптомів і самодопомога | Відстежувати й розпізнавати зміни симптомів та ознак.
Знати, як і коли зв’язуватися з лікарем. Спираючись на професійні поради, вміти самостійно керувати діуретичною терапією та регулювати вживання рідини |
Забезпечити пацієнта індивідуалізованою інформацією для сприяння самодопомозі, наприклад: у разі наростання задишки чи набряків або не- сподіваного збільшення маси тіла на >1,5–2 кг за 3 дні пацієнт може підвищити дозу діуретика та/або повідомити про це фахівців; застосовувати гнучкий режим діуретичної терапії |
| Фармакотерапія | Розуміти показання, режими дозування та побічні ефекти призначених препаратів. Розпізнавати основні побічні ефекти і знати, коли слід повідомити про них фахівця. Знати користь переваги від прийому ліків відповідно до призначень | Забезпечити пацієнта усною та письмовою інформацією про дозування, ефекти й побічні дії препаратів |
| Імплантовані пристрої і черезшкірні/хірургічні втручання | Розуміти показання, цілі процедур та імплантації пристроїв.
Розпізнавати основні ускладнення і знати, коли слід повідомити про них фахівця |
Забезпечити пацієнта усною та письмовою інформацією про переваги й побічні ефекти.
Забезпечити пацієнта усною та письмовою інформацією щодо регулярного контролю функціонування пристрою, регламенту планового обслуговування |
| Імунізація | Пройти імунізацію проти грипу та пневмококової інфекції | Надати пацієнту інформацію про місцеву практику імунізації |
| Харчування і вживання алкоголю | Уникати надмірного вживання рідини. Вміти розпізнавати потребу в необхідності змінити кількість вживання рідини: збільшувати в періоди спеки та високої вологості;
обмежувати до 1,5–2 л/добу при тяжкій СН для зменшення вираженості симптомів і застійних явищ; моніторувати масу тіла й не допускати недоїдання; харчуватися здоровою їжею, уникати надмірного вживання солі (>6 г/добу), підтримувати здорову масу тіла; уникати надмірного вживання алкоголю |
Індивідуалізувати інформацію щодо вживання рідини з урахуванням маси тіла, періодів спеки та високої вологості. Коригувати настанови під час періодів гострої декомпенсації і продовжу- вати переглядати обмеження протягом усього подальшого життя пацієнта.
Прив’язати настанови щодо вживання алкоголю до конкретної етіології СН. Наприклад, у разі алкогольної кардіоміопатії необхідно повністю заборонити вживання алкоголю. В інших випадках повідомити пацієнта про прийнятні межі вживання алкоголю: 20 мл/добу для чоловіків і 10 мл/добу для жінок у перерахунку на чистий етиловий спирт (10 мл етанолу міститься в склянці вина, 0,25 л пива, одній чарці міцного напою) |
| Куріння і вживання наркотичних речовин | Припинити курити і вживати наркотичні речовини | Звернутися за порадою до фахівця з припинення куріння та замісної терапії синдрому відміни. Розглянути направлення на когнітивно-поведінкову терапію та психологічну консультацію, якщо пацієнт висловлює потребу в такій підтримці для припинення куріння |
| Фізкультура | Регулярно займатися фізкультурою до легкої чи помірної задишки | Порадити пацієнтові вправи з урахуванням фізичних та функціональних обмежень.
Залучити пацієнта до тренувальної програми, якщо це можливо |
| Подорожі та дозвілля | Планувати поїздки та дозвілля відповідно до фізичної спроможності.
Усвідомлювати ризик небажаних реакцій на сонячне опромінення у разі прийому деяких препаратів (наприклад аміодарону). Усвідомлювати ефект зниження оксигенації на висоті. Під час перельотів тримати ліки в ручному багажі, мати при собі список щодо при- значеного лікування з дозами та назвами препаратів |
Повідомляти про можливі спрацьовування металошукачів в аеропортах за наявності імплантованих пристроїв |
| Сон і дихання | Розпізнавати проблеми зі сном, їх зв’язок із СН і вміти покращувати умови сну | Надати пацієнту поради щодо часу прийому діуретиків, комфортних умов сну, апаратної підтримки.
За наявності розладів дихання під час сну порадити заходи для зменшення/контролю маси тіла |
| Сексуальна активність | Усвідомлювати можливість сексуальної активності, якщо вона не провокує значні симптоми.
Розпізнавати проблеми із сексуальною активністю, їх зв’язок із СН та призначеним лікуванням, знати про можливості лікування еректильної дисфункції |
Надати пацієнтові поради щодо усунення факторів, які спричиняють розвиток еректильної дисфункції, і доступних засобів фармакотерапії еректильної дисфункції.
За необхідності направляти пацієнтів до фахівців із сексопатології |
| Психосоціальні аспекти | Розуміти, що депресію і когнітивну дисфункцію частіше відмічають у пацієнтів із СН і що вони можуть впливати на прихильність до лікування.
Розпізнавати психологічні проблеми, які можуть бути пов’язані зі змінами способу життя, фармакотерапією, імплантованими пристроями або трансплантацією серця |
Регулярно спілкуватися з пацієнтом щодо перебігу захворювання, можливостей лікування та самодопомоги.
Залучати сім’ю та осіб, що здійснюють догляд за пацієнтом, до ведення СН та самодопомоги. За необхідності направляти пацієнта до фахівців із психологічної підтримки |
Етапність надання медичної допомоги
Особливості процесу надання медичної допомоги
Медична допомога пацієнтам із СН надається на первинному, вторинному (спеціалізована — амбулаторна та стаціонарна) та третинному (високоспеціалізована — амбулаторна та стаціонарна) рівнях медичної допомоги.
Первинна медична допомога пацієнтам із СН надається лікарями загальної практики — сімейними лікарями та дільничними лікарями-терапевтами — в амбулаторіях, амбулаторіях загальної практики — сімейної медицини, сільських лікарських амбулаторіях, у центрах первинної медико-санітарної допомоги, на прийомі у лікаря або в денному стаціонарі за місцем проживання (перебування) пацієнта (номенклатура згідно з наказом МОЗ України від 28.10.2002 р. № 385 «Про затвердження переліків закладів охорони здоров’я, лікарських, провізорських посад та посад молодших спеціалістів з фармацевтичною освітою у закладах охорони здоров’я» та наказу МОЗ України від 05.10.2011 р. № 646 «Порядок медичного обслуговування громадян центрами первинної медичної (медико-санітарної) допомоги»).
Вторинна медична допомога на амбулаторному рівні надається лікарями-кардіологами в діагностичних центрах, поліклініках — центральних міських, міських, центральних районних, районних, у центрах з медичних консультацій та діагностики (консультативно-діагностичних центрах), спеціалізованих медичних центрах (номенклатура згідно з наказом МОЗ України від 28.10.2002 р. № 385).
Вторинна медична допомога на стаціонарному рівні надається у спеціалізованих кардіологічних відділеннях багатопрофільних лікарняних закладів: у багатопрофільних лікарнях (клінічних лікарнях) інтенсивного лікування, лікарнях відновного (реабілітаційного) лікування, лікарнях (клінічних лікарнях) планового лікування, обласних центрах кардіологічної допомоги (номенклатура згідно з наказом МОЗ України від 28.10.2002 р. № 385 та наказом МОЗ України та НАМН України від 24.07.2013 р. № 621/60 «Про систему кардіологічної допомоги у закладах охорони здоров’я України»).
Третинна медична допомога надається в науково-дослідних установах, кардіохірургічних центрах — регіонального, міжрегіонального, обласного рівня, відділеннях кардіохірургії закладів охорони здоров’я, центрах рентгеноендоваскулярної діагностики та лікування із функцією реперфузійних втручань (номенклатура згідно з наказом МОЗ України та НАМН України від 24.07.2013 р. № 621/60, наказом МОЗ України та НАМН України від 11.03.2013 р. № 193/20 «Про систему кардіохірургічної допомоги в Україні» та наказом МОЗ України та НАМН України від 18.03.2013 р. № 211/24 «Про організацію і роботу системи з рентгеноендоваскулярної діагностики та лікування у закладах охорони здоров’я України»).
Таблиця 90. Рекомендації з лікування вад серця у хворих із СН
| Рекомендації | Клас рекомендацій |
| Слід обговорити доцільність виконання стрес-ехоКГ із низькими дозами добутаміну в симптомних хворих зі зниженою ФВ ЛШ та «низькошвидкісним/низькоградієнтним» аортальним стенозом (площа аортального отвору <1 см2, ФВ ЛШ <40%, середній градієнт тиску <40 мм рт. ст.). Мета — ідентифікувати хворих із тяжким аортальним стенозом, яким можна виконувати протезування клапана | ІІа |
| Рекомендовано проведення трансаортальної імплантації клапана (ТАІК) хворим із тяжким аортальним стенозом, яким за рішенням команди фахівців не можна виконувати хірургічне втручання і в яких очікувана тривалість життя після ТАІК перевищуватиме 1 рік | І |
| Слід обговорити доцільність проведення ТАІК у хворих високого ризику з тяжким аортальним стенозом, яким ще можна виконати хірургічне втручання, проте в яких ТАІК за висновком команди фахівців має переваги через індивідуальні особливості профілю ризику та анатомії | ІІа |
| При тяжкій аортальній недостатності рекомендовано здійснювати (за відсутності протипоказань) пластику або протезування аортального клапана всім хворим зі скаргами, а також тим безсимптомним пацієнтам, у яких ФВ ЛШ ≤50% | І |
| Рекомендовано призначати медикаментозну терапію, що ґрунтується на доказах, пацієнтам із СН зі зниженою ФВ. Мета — знизити функціональну мітральну недостатність | І |
| Слід обговорити доцільність проведення комбінованого хірургічного втручання на клапані та коронарних артеріях у маніфестних хворих із систолічною дисфункцією ЛШ (ФВ ЛШ <30%), які потребують реваскуляризації для корекції стенокардії, резистентної до медикаментозної терапії | ІІа |
| Можна обговорити доцільність проведення ізольованого хірургічного втручання для корекції мітральної недостатності неішемічного ґенезу в окремих пацієнтів із тяжкою функціональною мітральною недостатністю і тяжкою систолічною дисфункцією ЛШ (ФВ ЛШ <30%). Мета — уникнути або відтермінувати проведення трансплантації серця | ІІb |
Кардіохірургічні методи в лікуванні пацієнтів із хронічною СН
Механічна підтримка кровообігу і трансплантація серця
Таблиця 91. Показання до механічної підтримки кровообігу (МПК)
| Міст до прийняття рішення/міст до іншого мосту | Застосування короткочасної МПК (наприклад систем екстракорпорального життєзабезпечення чи екстракорпоральної мембранної оксигенації) у пацієнтів, які перебувають у стані кардіогенного шоку, до стабілізації гемодинаміки та перфузії периферичних органів, виключення протипоказань до тривалої МПК (ураження головного мозку після реанімації) і визначення подальших стратегій допомоги (імплантація постійного пристрою допомоги ЛШ (ПДЛШ), трансплантація серця) |
| Міст до зарахування у кандидати на трансплантацію | Застосування МПК (зазвичай ПДЛШ) для покращання функціонування периферичних органів з метою переведення пацієнта у категорію кандидатів на трансплантацію серця |
| Міст до трансплантації | Застосування МПК (зазвичай ПДЛШ або пристроїв бівентрикулярної підтримки) для підтримки життя пацієнта, який має високий ризик померти в очікуванні донорського органа |
| Міст до відновлення | Застосування МПК (частіше ПДЛШ) для підтримки життя пацієнта, доки функція серця відновиться достатньою мірою, щоб можна було відключити МПК |
| Пожиттєва терапія | Довготривале застосування МПК (ПДЛШ) як альтернативи трансплантації у пацієнтів із кінцевою стадією СН, які не підходять для трансплантації або з високою ймовірністю не доживуть до неї |
Трансплантація серця
Таблиця 92. Трансплантація серця: показання і протипоказання
| Протипоказання | Активна інфекція.
Тяжке захворювання периферичних артерій або цереброваскулярне захворювання. Фармакологічно неконтрольована ЛГ (слід розглянути можливість імплантації постійного пристрою допомоги ЛШ із подальшим переглядом кандидатури на трансплантацію). Онкологічні захворювання (за участю онкологів слід визначати ризик рецидиву онкологічної патології у кожного пацієнта). Неконтрольована ниркова дисфункція (кліренс креатиніну <30 мл/хв). Системне захворювання з поліорганним ураженням. Інші серйозні супутні захворювання з поганим прогнозом. ІМТ перед трансплантацією >35 кг/м2 (рекомендовано зменшити масу тіла до ІМТ<35 кг/м2). Алкогольна чи наркотична залежність. Недостатня соціальна підтримка пацієнта для забезпечення належного догляду в амбулаторних умовах |
Реабілітаційні заходи
Роль фізичних тренувань при хронічній СН
Гемодинамічно стабільним пацієнтам із хронічною СН ІІ–ІІІ ФК за NYHA зі зниженою ФВ ЛШ показані регулярні аеробні (низької–помірної інтенсивності) фізичні тренування, оскільки вони підвищують функціональну спроможність, поліпшують якість життя та знижують ризик госпіталізацій, зумовлених декомпенсацією кровообігу.
Реалізація програм фізичної реабілітації пацієнтів з хронічною СН перебуває у спільній компетенції фахівця з лікувальної фізкультури та кардіолога і має здійснюватися за відповідними рекомендаціями.
Профілактика розвитку СН
Таблиця 93. Заходи щодо профілактики розвитку СН
| Рекомендації | Клас рекомендацій |
| Рекомендовано лікувати АГ. Мета — збільшення тривалості життя та відтермінування або запобігання розвитку СН | І |
| Рекомендовано лікувати статинами пацієнтів з ІХС або з високим ризиком її розвитку незалежно від наявності в них систолічної дисфункції (СД) ЛШ. Мета – збільшення тривалості життя та відтермінування або запобігання розвитку СН | І |
| Рекомендовано консультувати й призначати лікування, спрямоване на відмову від куріння та зменшення вживання алкоголю в осіб, які палять або вживають надмірну кількість алкоголю. Мета — відтермінування або запобігання розвитку СН | І |
| Необхідно обговорити доцільність корекції інших факторів ризику розвитку СН (наприклад ожиріння, порушення рівня глюкози в крові). Мета — відтермінування або запобігання розвитку СН | ІІа |
| Необхідно обговорити доцільність призначення емпагліфлозину або дапагліфлозину у пацієнтів із цукровим діабетом 2-го типу. Мета — збільшення тривалості життя, відтермінування або запобігання розвитку СН | ІІа |
| Рекомендовано призначати інгібітор АПФ пацієнтам із безсимптомною СД ЛШ та ІМ в анамнезі. Мета — збільшення тривалості життя та відтермінування або запобігання розвитку СН | І |
| Рекомендовано призначати інгібітор АПФ пацієнтам із безсимптомною СД ЛШ без ІМ в анамнезі. Мета – відтермінування або запобігання розвитку СН | І |
| Необхідно обговорити доцільність призначення інгібіторів АПФ пацієнтам зі стабільною ІХС, навіть якщо вони не мають СД ЛШ. Мета – відтермінування або запобігання розвитку СН | ІІа |
| Рекомендовано призначати блокатори бета-адренорецепторів пацієнтам із безсимптомною СД ЛШ та ІМ в анамнезі. Мета — збільшення тривалості життя, відтермінування або запобігання розвитку СН | І |
Перелік фармакологічних препаратів
У табл. 94 представлено перелік фармакологічних препаратів кардіологічної групи за міжнародними непатентованими найменуваннями, що за відповідними показаннями можуть застосовуватися у пацієнтів із хронічною СН.
Таблиця 94
| Групи препаратів | Непатентовані назви |
| Інгібітори АПФ | Еналаприл
Каптоприл Лізиноприл Раміприл Трандолаприл |
| Блокатори бета-адренорецепторів | Бісопролол
Карведилол Метопролол — сукцинат ретард Небіволол |
| Антагоністи мінералокортикоїдних рецепторів | Спіронолактон
Еплеренон |
| Блокатори рецепторів ангіотензину ІІ | Кандесартан
Валсартан Лозартан |
| Інгібітори неприлізину/рецепторів ангіотензину ІІ | Сакубітрил/валсартан |
| Блокатори If-току у синусному вузлі | Івабрадин |
| Серцеві глікозиди | Дигоксин |
| Діуретики | Фуросемід
Торасемід Гідрохлоротіазид Ксипамід |
| Калійзберігаючі діуретики | Спіронолактон
Еплеренон |
| Антикоагулянти | Варфарин
Ривароксабан Дабігатран Апіксабан |
| Антитромбоцитарні засоби | АСК
Клопідогрель |
| Статини | Аторвастатин
Розувастатин Симвастатин |
| Антиаритмічні засоби | Аміодарон |
| Антиангінальні засоби | Ізосорбіду динітрат
Амлодипін Триметазидин |
Стандарти надання медичної допомоги хворим із нейроциркуляторною дистонією
Рубрика за МКХ-10: F45.3.
Умови надання медичної допомоги
Хворі підлягають амбулаторному обстеженню і лікуванню на рівні первинної ланки охорони здоров’я за показаннями у лікарів-спеціалістів у разі диференційної діагностики з іншими хворобами, у тому числі серцево-судинними.
Програма діагностики
Обов’язкові дослідження:
- Визначення скарг та анамнезу.
- Клінічний огляд.
- Вимірювання АТ.
- Дослідження лабораторних показників (загальні аналізи крові і сечі, глюкоза в крові).
- ЕКГ у 12 відведеннях.
- Проби з ДФН.
- ЕКГ-проби (з гіпервентиляцією, ортостатична, калієва, з блокаторами бета-адренорецепторів).
Додаткові дослідження:
- Добовий моніторинг ЕКГ й АТ.
- ЕхоКГ.
- Рентгенографія органів грудної порожнини.
Стандарти надання медичної допомоги хворим із серцево-судинними ускладненнями внаслідок дії протипухлинних препаратів та променевої терапії
(С.М. Кожухов, Н.В. Довганич, І.І. Смоланка, І.А. Крячок, О.Ф. Лигирда, І.Б. Титоренко)
Основні терміни: кардіоміопатія внаслідок дії лікарських засобів та інших зовнішніх факторів, серцева недостатність.
Коди за МКХ-10: І42.7, І50.0.
Серцево-судинні ускладнення на тлі протипухлинного лікування можуть бути поділені на 9 основних категорій:
- дисфункція міокарда ЛШ: симптомна (СН), асимптомна (субклінічна);
- захворювання коронарних артерій, ІХС;
- ураження клапанів серця;
- аритмії, особливо при застосуванні препаратів, які подовжують інтервал Q–T;
- АГ;
- тромбоемболічні ускладнення;
- захворювання периферичних артерій і інсульт;
- легенева гіпертензія;
- захворювання перикарда.
Діагностика
Положення протоколу
Клінічне, лабораторне та інструментальне обстеження пацієнтів проводиться з метою:
- встановлення або виключення діагнозу кардіотоксичності;
- виявлення етіологічних факторів (факторів ризику розвитку) серцево-судинних ускладнень до, під час та після проведеного протипухлинного лікування;
- виявлення супутньої патології, що зумовлює розвиток кардіотоксичних ускладнень;
- визначення тактики та програми лікування;
- скринінгу пацієнтів, які потребують направлення до закладів охорони здоров’я, з метою надання високоспеціалізованої медичної допомоги.
Необхідні дії лікаря щодо діагностики серцево-судинних ускладнень внаслідок протипухлинного лікування
Обов’язкові
Проведення клінічного огляду пацієнта, до якого входять:
- збір скарг та анамнезу;
- визначення етіологічних чинників та факторів ризику;
- фізикальне обстеження серця, легень, черевної порожнини.
Лабораторні обстеження:
- загальний аналіз крові (гемоглобін, еритроцити, лейкоцити, тромбоцити, гематокрит, швидкість осідання еритроцитів);
- біохімічні тести: K+, Na+, сечовина, креатинін, з розрахунком ШКФ, білірубін, АсАТ, АлАТ, глюкоза, ХС, ТГ, ХС ЛПНЩ, ХС ЛПВЩ, ХС ЛДНЩ.
Інструментальні обстеження:
- реєстрація ЕКГ у 12 відведеннях;
- ехоКГ.
Остаточна оцінка вірогідності серцево-судинних ускладнень внаслідок протипухлинного лікування
Додаткові дослідження за показаннями:
- МРТ.
- Спекл-трекінг ехоКГ.
- Черезстравохідна ехоКГ.
- Коронарна ангіографія.
- Мультиспіральна комп’ютерна томографія (МСКТ) серця.
- Холтерівський моніторинг ЕКГ.
- Тест із фізичним навантаженням.
- 24-годинний моніторинг АТ.
- Концентрація N-термінального про-В типу мозкового НУП (МНУП) у плазмі крові.
- Кардіоспецифічні ферменти (тропоніни).
Діагностичні критерії кардіотоксичних ускладнень
Стратегія виявлення та оцінки тяжкості кардіотоксичності на тлі протипухлинного лікування включає ЕКГ, візуалізацію серця і визначення біомаркерів крові.
ЕКГ. ЕКГ-обстеження рекомендовано проводити всім пацієнтам до призначення і під час протипухлинного лікування. Зміни на ЕКГ не є специфічними, але можуть бути ознакою токсичного ураження міокарда: тахікардія в спокої, зміни сегмента ST і зубця T, порушення провідності, подовження інтервалу Q–T або наявність аритмій. Зміни на ЕКГ можуть бути тимчасовими і не пов’язаними з подальшим розвитком кардіоміопатії.
Візуалізація серця може бути здійснена одним із можливих методів: ехоКГ, сцинтиграфія серця, МРТ (табл. 95).
Таблиця 95. Діагностичні критерії кардіотоксичності, переваги та обмеження
| Технічні можливості | Діагностичні критерії | Переваги | Обмеження |
| ЕхоКГ:
3D-ехоКГ 2D-ехоКГ (визначення ФВ ЛШ за Симпсоном) Поздовжня систолічна деформація (Global Longitudinal Strain — GLS) |
ФВ ЛШ: зниження ФВ >10% або до її гранично нормальної межі
GLS: зменшення >15% від вихідного значення |
Широка доступність
Відсутність опромінення Можливість оцінки гемодинаміки та структури серця |
Варіабельність оцінки
Якість зображення GLS: варіабельність оцінки, технічні вимоги |
| Сцинтиграфія серця | Зниження ФВ на >10% від вихідної, при ФВ ЛШ<50% | Відтворюваність | Кумулятивна променева дія
Інформація щодо змін та функції інших структур серця обмежена |
| МРТ | Використовується при неможливості діагностувати іншими технічними засобами або щоб підтвердити наявність дисфункції ЛШ при граничних значеннях ФВ ЛШ | Точність, відтворюваність
Визначення дифузного міокардіального фіброзу з використанням Т1/Т2-картування та оцінки об’єму позаклітинного матриксу |
Обмежена доступність, адаптація пацієнта (клаустрофобія, затримка дихання, тривалість процедури) |
| Біомаркери:
тропонін I, Т Високочутливий тропонін I, Т МНУП NT-про-МНУП |
Дозволяє виявити пацієнтів з ризиком розвитку кардіотоксичного ураження (зниження систолічної функції) | Точність, відтворюваність
Широка доступність Висока чутливість |
Недостатньо доказів для встановлення значень невеликого підвищення
Варіабельність зразків Роль рутинного визначення не з’ясована |
NT-про-МНУП — N-термінальний прo-B типу НУП.
Ехокардіографія. ЕхоКГ є методом вибору для визначення дисфункції міокарда до початку, на фоні протиракового лікування і при довготривалому спостереженні пацієнтів. Найбільш інформативною є 3D-ехоКГ, яка дозволяє оцінити функцію ендокарда, однак у рутинній практиці 2D-ехоКГ може бути використана для визначення розмірів та об’ємів серця, ФВ ЛШ з використанням методу Симпсона. Згідно з рекомендаціями ESC з кардіоваскулярної токсичності 2016 р. дисфункція ЛШ внаслідок кардіотоксичної дії протипухлинних препаратів визначається як зниження ФВ ЛШ більше ніж на 10% та/або до значення нижньої межі її норми, яким вважали значення ФВ ЛШ 50%, встановлене на основі досліджень, що вивчали кардіотоксичні наслідки різних методів лікування онкологічних захворювань. Проте, за даними сучасних рекомендацій з візуалізації, критерієм кардіотоксичності внаслідок протипухлинної терапії є зниження ФВ ЛШ на 10% та більше від вихідної величини та/або до її значення ≤53%, яке має бути підтверджено повторним обстеженням пацієнта протягом 2–3 тиж. Зниження ФВ ЛШ може бути асимптомним або з ознаками СН. Останні декілька років для виявлення ранніх змін скоротливості міокарда досить широко використовують спекл-трекінг ехоКГ із оцінкою деформації (Strain) та швидкості деформації (Strain-rate) відповідних сегментів ЛШ. Показник глобальної поздовжньої систолічної деформації (GLS) є предиктором зниження ФВ ЛШ. Зниження GLS >15% від вихідного рівня вважається патологічним і є маркером субклінічної дисфункції ЛШ.
ЕхоКГ-обстеження слід повторювати при подальшому моніторингу пацієнта для під- твердження нормалізації функції міокарда або виявлення незворотної дисфункції ЛШ. Необхідна частота обстежень (візуалізація серця і визначення біомаркерів) залежить від типу протипухлинного лікування, кумулятивних доз одержуваних препаратів, їх комбінації та тривалості лікування, а також від вихідного серцево-судинного ризику.
МРТ серця. Даний метод застосовують для виявлення причин дисфункції ЛШ й оцінки ступеня ураження як лівого, так і правого шлуночків. МРТ показана для виявлення змін перикарда, що може бути особливо важливим при опроміненні грудної порожнини, дозволяє визначити вогнища фіброзу й рубцеві зміни міокарда, а також є методом для точного визначення маси міокарда та проявів інфільтративних змін. Використання Т2/Т1 картування дозволяє виявляти такі зміни в тканинах, як набряк і запалення, а також визначати їх об’єм.
Біомаркери. Визначення біомаркерів пошкодження міокарда дає можливість виявити раннє ураження міокарда внаслідок протипухлинного лікування.
Визначення тропоніну І або Т також може бути корисним у пацієнтів з маніфестуючою СН та зниженою ФВ ЛШ для діагностики пошкодження міокарда, особливо на фоні використання у схемах лікування антрациклінів. НУП широко використовуються для визначення СН; навіть їх дуже низькі значення дозволяють ідентифікувати пацієнтів високого ризику розвитку кардіотоксичності і призначати патогенетичне лікування. У пацієнтів, які отримують протипухлинні препарати, можливе визначення МНУП і NT-про-МНУП, проте роль цих біомаркерів у рутинній практиці для виявлення пацієнтів високого ризику розвитку кардіотоксичності мало вивчена.
Терміни та частота проведення методів візуалізації та/або аналізів крові на біомаркери залежатимуть від специфічного конкретного лікування раку, загальної кумулятивної дози препаратів з кардіотоксичною дією, протоколу лікування та вихідного серцево-судинного ризику пацієнта.
Стратифікація серцево-судинного ризику
Оцінка клінічного прогнозу
Віддалений прогноз є досить складним, оскільки пацієнт з онкологічним захворюванням найчастіше отримує комбіноване протипухлинне лікування (хіміотерапію, хірургічне втручання, променеву терапію). Взаємодія різних терапевтичних методів потенціює розвиток кардіотоксичності, тому при призначенні протипухлинного лікування необхідно виявляти в першу чергу фактори ризику розвитку можливих серцево-судинних ускладнень.
Для визначення оптимальної стратегії ведення хворих лікареві доцільно визначати фактори ризику у конкретного хворого, що включає ретельний збір анамнезу для виявлення серцево-судинних факторів ризику або вже існуючих серцево-судинних захворювань, а також попереднього лікування з приводу онкологічного захворювання, фізикальний огляд та обстеження серця перед призначенням протипухлинної терапії (ЕКГ, візуалізація серця), наявність яких у пацієнтів асоційована з розвитком кардіотоксичних ускладнень (табл. 96).
Таблиця 96. Фактори ризику розвитку кардіотоксичності (ESC 2016)
|
Існуючі захворювання міокарда |
Попереднє лікування онкозахворювання препаратами з кардіотоксичною дією | Демографічні та інші фактори ризику серцево-судинних захворювань | Модифіковані фактори ризику серцево-судинних захворювань |
|
|
|
|
РКМП — рестриктивна кардіоміопатія.
Таблиця 97. Чинники виникнення серцево-судинних ускладнень на фоні лікування протипухлинними препаратами
| Фактори ризику розвитку кардіотоксичності на тлі лікування антрациклінами: |
|
| Фактори ризику розвитку кардіотоксичності під час лікування анти-HER2 засобами: |
|
| Фактори ризику кардіотоксичності при лікуванні інгібіторами судинного ендотеліального фактора росту (VEGF): |
|
У пацієнтів з високим ризиком серцево-судинних ускладнень до обстеження пацієнта і рішення про подальшу тактику необхідно залучати кардіолога або кардіоонколога (рис. 17).
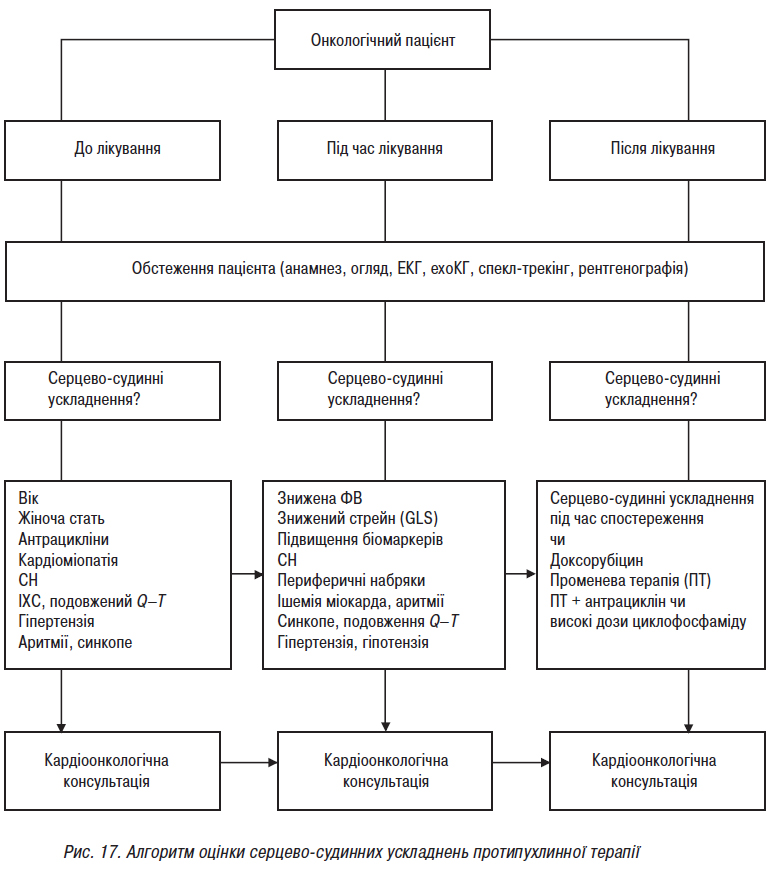
Тактика ведення пацієнтів при виникненні серцево-судинних ускладнень
Дисфункція ЛШ
Дисфункція міокарда і СН внаслідок кардіотоксичної дії протипухлинних препаратів є найбільш частими ускладненнями терапії онкологічних захворювань, а також причиною підвищення смертності. На сьогодні виділяють 3 типи кардіотоксичності: гостру (під час введення антрациклінів), ранню, яка розвивається протягом 1 року, і відтерміновану, що може маніфестувати через декілька років після лікування. Також вирізняють зворотне (при лікуванні трастузумабом) та незворотне (переважно внаслідок дії антрациклінів) кардіотоксичне ураження серця. Основні протипухлинні препарати, які можуть викликати дисфункцію ЛШ, вказані в табл. 98.
Таблиця 98. Частота виникнення дисфункції ЛШ, асоційованої з протипухлинними лікарськими засобами
| Протипухлинний препарат | Частота виникнення, % |
| Антрацикліни (залежно від дози) | |
| Доксорубіцин (адріаміцин) | |
| 400 мг/м2 | 3–5 |
| 550 мг/м2 | 7–26 |
| 700 мг/м2 | 18–48 |
| Ідарубіцин (>90 мг/м2) | 5–18 |
| Епірубіцин (>900 мг/м2) | 0,9–11,4 |
| Мітоксантрон (>120 мг/м2) | 2,6 |
| Ліпосомальна форма антрациклінів (>900 мг/м2) | 2 |
| Алкілувальні агенти (сполуки) | |
| Циклофосфамід | 7–28 |
| Іфосфамід | |
| <10 г/м2 | 0,5 |
| 12,5–16 г/м2 | 17 |
| Антиметаболіти | |
| Клофарабін | 27 |
| Мікротрубочкові інгібітори | |
| Доцетаксел | 2,3–13 |
| Паклітаксел | <1 |
| Моноклональні антитіла до факторів росту та їх рецепторів | |
| Трастузумаб | 1,7–20,1 |
| Бевацизумаб | 1,6–4 |
| Пертузумаб | 0,7–1,2 |
| Малі молекули інгібіторів протеїнкіназ | |
| Сунітиніб | 2,7–19 |
| Пазопаніб | 7–11 |
| Сорафеніб | 4–8 |
| Дазатиніб | 2–4 |
| Іматиніб месилат | 0,2–2,7 |
| Лапатиніб | 0,2–1,5 |
| Нілотиніб | 1 |
| Інгібітори протеасом | |
| Карфілзоміб | 11–25 |
| Бортезоміб | 2–5 |
| Інші | |
| Еверолімус | <1 |
| Темсиролімус | <1 |
Діагноз СН встановлюється за наявності типових симптомів, ехоКГ-ознак та рівня НУП. Наявність у пацієнта підвищеного рівня тропонінів та/або зниження GLS >15% при збереженій ФВ ЛШ відносить цього пацієнта до групи із асимптомним структурним ураженням серця та вищим ризиком прогресування СН. За наявності СН лікування проводиться згідно з алгоритмами та рекомендаціями щодо ведення пацієнтів із СН. Блокатори бета-адренорецепторів та інгібітори АПФ призначаються симптомним та асимптомним пацієнтам зі зниженою ФВ ЛШ для попередження виникнення погіршення СН та ремоделювання ЛШ.
Тривалість лікування СН у хворих після нормалізації ФВ ЛШ є індивідуальною. Рання відміна кардіопротекторного лікування не рекомендована. Для асимптомних пацієнтів за умови ретельного моніторингу та відсутності серцево-судинних факторів ризику, нормальних показників та стабільної функції ЛШ тривалість лікування має визначатися клінічним станом та даними інструментальних та лабораторних обстежень (ФВ, GLS, тропонін та МНУП).
Інгібітори контрольних точок імунної відповіді (ІКТІ), також відомі як чекпойнт-інгібітори (англ. сheck-point inhibitors) — це новий клас протипухлинних лікарських засобів, до яких належать іпілімумаб, ніволумаб, пембролізумаб, атезолізумаб, авелумаб, дурвалумаб.
Серцево-судинні ускладнення, які можуть виникнути при використанні ІКТІ: міокардит, порушення провідності (AV-блокада), кардіоміопатія, перикардит, гострий коронарний синдром. Серцево-судинні ускладнення частіше виникають на ранніх етапах терапії ІКТІ (≤12 тиж). Міокардит внаслідок дії ІКТІ проявляється типовими для даного захворювання ознаками СН, кардіогенним шоком, фульмінантним розвитком, різними видами аритмій, високим ризиком смертності. Оцінка клінічних особливостей міокардиту внаслідок дії ІКТІ проводиться за допомогою лабораторних показників (динаміка тропоніну), КФК (часто супутній міозит), ЕКГ, ехоКГ, МРТ, КВГ і ендоміокардіальної біопсії.
Рекомендується агресивне лікування високими дозами кортикостероїдів (1–2 мг/ кг/добу).
Інші кардіотоксичні побічні явища при застосуванні ІКТІ продовжують вивчатися.
Захворювання коронарних судин (ІХС)
Основні групи препаратів, з якими асоційоване виникнення ІХС:
- антиметаболіти (флуороурацил, капецитабін); основними їх кардіотоксичними механізмами є пошкодження судин ендотелію, коронароспазм і незалежна ендотеліальна вазоконстрикція;
- препарати, що містять платину (цисплатин);
- інгібітори судинного ендотеліального фактора росту (VEGF) (бевацизумаб, сорафеніб, сунітиніб);
- таксани (паклітаксел, доцетаксел);
- етопозид, блеоміцин.
Променева терапія також асоційована з вищою частотою розвитку ІХС:
- ризик та терміни виникнення ІХС залежать від дози (>30 Грей) та зони опромінення (ліва половина грудної клітки та середостіння);
- характерними є раннє виникнення, латентний та атиповий перебіг ІХС;
- симптоми можуть виникнути навіть через 10 років після променевої терапії.
Діагностика та лікування
Скринінг пацієнтів з ІХС до початку проведення протипухлинної терапії.
Алгоритм обстеження для виявлення ІХС у пацієнтів зі злоякісними новоутвореннями здійснюється згідно із загальноприйнятими рекомендаціями.
Основні положення:
- діагностика ІХС базується на даних анамнезу, віку, статі з урахуванням впливу протипухлинної терапії, яка може бути чинником виникнення/прогресування ІХС;
- виявлення ішемії міокарда, у тому числі латентного перебігу ІХС, слід враховувати при виборі протипухлинного лікування;
- пацієнтам, яким призначено флуоропіримідини (флуороурацил, капецитабін), слід регулярно проводити контроль ЕКГ для виявлення ішемії міокарда, за наявності цього ускладнення — розглянути питання щодо припинення хіміотерапії;
- лікування проводиться згідно із загальноприйнятими рекомендаціями; перевага надається застосуванню блокаторів кальцієвих каналів та нітратів;
- засоби, що спричинили коронарний вазоспазм та були відмінені, можуть бути призначені повторно за умови ретельного моніторингу стану пацієнта та відсутності альтернативного протипухлинного препарату.
Гострий коронарний синдром та симптомна ІХС
Пацієнти з ГКС або симптомною ІХС із наявною тромбоцитопенією, спричиненою хіміотерапією, потребують мультидисциплінарного спостереження.
Можливості медикаментозної терапії та інтервенційних втручань є обмеженими, оскільки застосування антиагрегантів та антикоагулянтів часто протипоказане.
Пацієнтам зі злоякісними новоутвореннями, яким необхідно проводити ендоваскулярне втручання, призначення подвійної антитромбоцитарної терапії рекомендовано на мінімальний період, згідно з рекомендаціями для зниження ризику кровотечі.
Ураження клапанів серця
Причини ураження клапанів у пацієнтів із пухлинними захворюваннями:
- наявні вади серця в анамнезі;
- асоційовані з променевою терапією (10% пацієнтів);
- найчастіше фіброз і кальциноз кореня аорти, аортального клапана, мітрального кільця, основи та середини стулок мітрального клапана.
Діагностика та лікування
ЕхоКГ — метод вибору уражень клапанів — слід проводити до та після променевої терапії.
Для оцінки комісур мітрального клапана — доцільним є проведення 3D-ехоКГ.
МРТ і МСКТ можуть бути використані для оцінки тяжкості ураження, МСКТ — рекомендовано для визначення ступеня кальцифікації висхідної аорти.
Моніторинг
Згідно з рекомендаціями European Association of Cardiovascular Imaging and the American Society of Echocardiography (EACVI/ASE) у симптомних пацієнтів слід щорічно проводити огляд та ехоКГ, у асимптомних пацієнтів — ехоКГ рекомендована через 10 років, особливо у пацієнтів після променевої терапії, потім — повторно кожні 5 років.
Аритмії
Окремі порушення ритму і провідності можуть мати серйозні наслідки, бути життєво небезпечними або викликати потребу в зміні схеми лікування (табл. 99).
Таблиця 99. Протипухлинні препарати, асоційовані з порушеннями ритму серця та провідності
| Тип аритмії | Протипухлинні засоби |
| Брадикардія | Бортезоміб, капецитабін, цисплатин, циклофосфамід, доксорубіцин, епірубіцин, флуороурацил, триоксид арсену, інтерлейкін-2, метотрексат, мітоксантрон, паклітаксел, ритуксимаб, талідомід |
| Синусова тахікардія | Антрацикліни, кармустин |
| Атріовентрикулярні блокади | Антрацикліни, триоксид арсену, бортезоміб, циклофосфамід, флуороурацил, мітоксантрон, ритуксимаб, талідомід, таксани |
| Порушення провідності | Антрацикліни, цисплатин, іматиніб, таксани, флуороурацил |
| Подовження інтервалу Q–T | Антрацикліни, триоксид миш’яку, акситиніб, босутиніб, крізотиніб, дазатиніб, понатиніб, пазопаніб, сорафеніб, сунітиніб, вандатеніб, вемурафеніб, рибоцикліб |
| ФП | Алкілувальні сполуки (цисплатин, циклофосфамід, іфосфамід, мелфалан), антрацикліни, антиметаболіти (капецитабін, флуороурацил, гемцитабін), інтерлейкін-2, інтерферони, ритуксимаб, інгібітори малих молекул тирокінази (понатиніб, сорафеніб, сунітиніб, ібрутиніб), інгібітори топоізомерази ІІ (амсакрин, етопозид), алкалоїди барвінку, таксани |
| Суправентрикулярні тахікардії | Алкілувальні сполуки (цисплатин, циклофосфамід, іфосфамід, мелфалан), амсакрин, антиметаболіти (капецитабін, метотрексат, флуороурацил), бортезоміб, доксорубіцин, інтерлейкін-2, інтерферони, паклітаксел, понатиніб |
| Шлуночкові тахікардії і ФШ | Алкілувальні сполуки (цисплатин, циклофосфамід, іфосфамід, мелфалан), амсакрин, антиметаболіти (капецитабін, гемцитабін, флуороурацил), триоксид арсену, інгібітори протеасом (бортезоміб, карфілзоміб), доксорубіцин, інтерлейкін-2, інтерферони, метотрексат, паклітаксел, ритуксимаб, ромідепсин |
| Раптова серцева смерть | Антрацикліни (дуже рідко), триоксид арсену, інтерферони, флуороурацил, нілотиніб, ромідепсин |
Подовження інтервалу Q–T
Може бути зумовлене протипухлинним лікуванням (табл. 100), електролітним дисбалансом, супутньою терапією (антиеметичними, кардіологічними, психотропними препаратами, антибіотиками) та спричиняти розвиток життєво небезпечних аритмій, таких як torsades de pointes. Тривалість інтервалу Q–T та фактори ризику його подовження необхідно визначати до, під час та після лікування.
Таблиця 100. Фактори ризику подовження інтервалу Q–T
| Фактори ризику подовження інтервалу Q–T | |
| Такі, що модифікуються | Такі, що не модифікуються |
Електролітний дисбаланс:
Гіпотиреоз Одночасне (конкурентне) застосування препаратів, що подовжують інтервал Q–T:
|
|
Суправентрикулярні аритмії та ФП
Виникають під час або після хіміотерапії чи опромінення, внаслідок коморбідних станів, впливу злоякісного процесу, токсичного ефекту хіміотерапії, дисфункції ЛШ.
Шлуночкові аритмії
Спричинені подовженням інтервалу Q–T, гострою та хронічною токсичністю протипухлинних препаратів, впливом променевої терапії, дисфункцією ЛШ та ішемією.
Дисфункція синусного вузла та порушення провідності:
- спричинені променевою терапією;
- паклітаксел та талідомід призводять до дисфункції синусного вузла, брадиаритмії і зупинки серця.
Лікування (ключові положення):
- усім пацієнтам, яким призначено протипухлинну терапію, слід призначати ЕКГ у 12 відведеннях із обчисленням інтервалу Q–T за формулою Базетта або Фредеріка;
- у пацієнтів з подовженням інтервалу Q–Т в анамнезі, серцево-судинними захворюваннями, брадикардією, дисфункцією щитоподібної залози чи електролітним дисбалансом, а також у пацієнтів, яким призначено препарати, що подовжують інтервал Q–T, необхідно регулярно контролювати ЕКГ;
- розглянути питання припинення або заміни протипухлинного лікування при тривалості інтервалу Q–T >500 мс або його подовження більше ніж на 60 мс або виникненні порушень ритму;
- запобігання та корекція факторів, що провокують розвиток шлуночкової тахікардії типу torsade de pointes, зокрема гіпокаліємії і брадикардії, у пацієнтів з медикаментозно спричиненим подовженням інтервалу Q–T;
- мінімізувати використання інших препаратів, що подовжують інтервал Q–T, у пацієнтів, яким призначено протипухлинні препарати, що також подовжують інтервал Q–T.
Лікування
Має бути індивідуальним.
При призначенні лікування або ІКД необхідно враховувати кардіо- та онкозалежну очікувану тривалість життя, якість життя, ризик ускладнень.
Фібриляція і ТП
Підходи до лікування ФП/ТП вимагають рішень стосовно відновлення ритму, профілактики тромбоемболічних ускладнень і запобігання інсульту із застосуванням оральних антикоагулянтів. Однак основним питанням у пацієнтів з пухлинними захворюваннями є баланс між тромбоемболічними ризиками за шкалою CHA2DS2-VASc і ризиком кровотеч за шкалою HAS-BLED, які не є валідованими у пацієнтів з онкологічною патологією, тому прийняття рішення щодо призначення антикоагулянтів з метою профілактики інсульту є дуже складним. У пацієнтів чоловічої статі з кількістю балів ≥1 та у жінок ≥2 за шкалою CHA2DS2-VASс антикоагулянти (як правило, АВК) можна призначити за умови кількості тромбоцитів >50 000 м3, адекватному контролі МНВ (з МНВ у межах цільових значень більше 70% часу). Застосовують низькомолекулярний гепарин (для коротко і середньотермінового введення), АВК (варфарин), якщо МНВ стабільне й адекватне. В окремих випадках використовують також НОАК. На даний час не існує конкретних рекомендацій стосовно застосування НОАК при ФП в онкологічних хворих. Традиційно основні клінічні випробування НОАК з дабігатраном, ривароксабаном, апіксабаном та едоксабаном для застосування при ФП виключали хворих на рак. Тому досі немає доказів, що підтверджують ефективність НОАК порівняно з варфарином у онкохворих із ФП. Доцільність і безпека НОАК у цієї групи хворих продовжують вивчати.
За наявності метастазів і високого ризику кровотеч варфарин протипоказаний, перевагу віддають низькомолекулярному гепарину. Рішення щодо призначення антикоагулянтів слід приймати за участю гематологів і онкологів із врахуванням коморбідних захворювань, ризику кровотеч, даних ретельного обстеження пацієнта, зокрема ехоКГ.
Для контролю ЧСС при ФП застосовують:
- блокатори бета-адренорецепторів;
- недигідропіридинові блокатори кальцієвих каналів;
- дигоксин (за наявності протипоказань до застосування вищевказаних препаратів, систолічної дисфункції ЛШ та СН).
АГ
- Часто є супутнім захворюванням.
- Вторинна АГ — в осіб із раком нирки.
- Існуюча АГ може дестабілізуватися під час протипухлинного лікування.
- Також може виникнути de novo внаслідок застосування інгібіторів судинного ендотеліального фактора росту (VEGF) — сунітиніб, сорафеніб, бевацизумаб — (злоякісна АГ 2–20% випадків), а також стероїдів, НПВП, еритропоетинів.
- Частота та тривалість індукованої АГ залежить від виду пухлини, механізму дії протипухлинного препарату та наявності серцево-судинних факторів ризику.
Діагностика та лікування
- Перед початком терапії інгібіторами VEGF слід визначити серцево-судинний ризик та призначити антигіпертензивне лікування.
- АГ у пацієнтів зі злоякісними новоутвореннями слід лікувати відповідно до сучасних рекомендацій (ESC 2018) із застосуванням загальноприйнятої антигіпертензивної терапії.
- Препаратами вибору є інгібітори АПФ, БРА, блокатори бета-адренорецепторів. Дигідропіридинові блокатори кальцієвих каналів та антагоністи альдостерону можуть бути призначені при недостатньому контролі АТ.
- Призначення недигідропіридинових блокаторів кальцієвих каналів (дилтіазем, верапаміл) слід уникати для запобігання виникненню небажаних взаємодій ліків.
- Тіазидні діуретики застосовувати з обережністю внаслідок ризику можливої гіперкаліємії та подовження інтервалу Q–T.
- Раннє й агресивне антигіпертензивне лікування запобігає розвитку серцево-судинних ускладнень, зокрема СН.
- Необхідним є ретельний моніторинг АТ впродовж протипухлинного лікування: контроль АТ щотижня протягом 1 курсу терапії, та кожні 2–3 тиж протягом усього періоду лікування.
- У разі підвищення АТ — посилення антигіпертензивної терапії, однак за відсутності ефективності терапії та недостатнього контролю АТ — зниження дози або тимчасове припинення застосування інгібіторів VEGF, відновлення прийому яких слід розглянути після досягнення оптимального контролю АТ.
Тромбоемболічні ускладнення
Внутрішньоартеріальний тромбоз — 1% випадків у пацієнтів зі злоякісними новоутвореннями.
Найбільш часто розвивається при:
- метастатичному раку підшлункової залози, грудної залози, прямої кишки, легені;
- терапії антрациклінами, сполуками платини, інгібіторами VEGF, інгібіторами тирокіназ;
- за наявності супутніх захворювань та серцево-судинних факторів ризику.
Венозні тромбози та тромбоемболії (ВТЕ)
Часте ускладнення у пацієнтів із пухлинними захворюваннями (до 20% госпіталізованих пацієнтів). Основні чинники розвитку ВТЕ вказані в табл. 101.
Таблиця 101. Фактори розвитку ВТЕ у пацієнтів зі злоякісними новоутвореннями
| Фактори, пов’язані з пухлиною |
|
| Фактори, пов’язані з пацієнтом |
|
| Фактори, пов’язані з лікуванням |
|
| Біомаркери |
|
Таблиця 102. Прогностична модель ВТЕ, асоційованої із хіміотерапією, в амбулаторних пацієнтів зі злоякісними новоутвореннями (шкала Khorana)
| Фактори ризику ВТЕ | Бали ризику |
| Локалізація раку і гістотип пухлини | |
| Дуже високий ризик (аденокарцинома шлунка, аденокарцинома підшлункової залози) | 2 |
| Високий ризик (ЗН легень, гінекологічні пухлини, пухлини сечового міхура, яєчок, лімфоми) | 1 |
| Гематологічні фактори ризику | |
| Рівень тромбоцитів до проведення ХТ ≥350·109/л | 1 |
| Рівень гемоглобіну до проведення ХТ <100 г/л або використання ЕПО | 1 |
| Рівень лейкоцитів до проведення ХТ >11·109/л | 1 |
| Пов’язані з пацієнтом фактори ризику | |
| ІМТ ≥35 кг/м2 | 1 |
Примітка: ВТЕ — венозна тромбоемболія, ЗН — злоякісні новоутворення, ХТ — хіміотерапія, ЕПО — еритропоетини, ІМТ — індекс маси тіла.
Таблиця 103. Вірогідність розвитку ВТЕ відповідно шкали Khorana
| Категорія ризику | Шкала | Вірогідність розвитку тромбозу протягом 2,5 міс |
| Низький | 0 | 0,3–8% |
| Проміжний | 1–2 | 1,8–2% |
| Високий | >2 | 6,7–7,1% |
Профілактика ВТЕ в амбулаторних хворих, які отримують системну хіміотерапію
Ризик виникнення симптомної ВТЕ в амбулаторних пацієнтів, які отримують хіміотерапію, становить близько 5–10%, при цьому ризик ВТЕ та кровотеч залежить від індивідуального ризику, пов’язаного з типом раку, виду лікування раку та особливостей пацієнта (наявність ФР).
За відсутності встановленого діагнозу ВТЕ антикоагулянтна терапія (АКТ) не рекомендована всім пацієнтам з онкологічною патологією, оскільки АКТ не поліпшує виживання.
Призначення АКТ є обґрунтованим тільки у хворих на рак із високим ризиком ВТЕ.
Усі пацієнти зі злоякісним новоутворенням повинні бути стратифіковані на предмет ризику ВТЕ перед початком і в процесі хіміотерапії, і періодично (кожні 3–6 міс) після її закінчення (див. табл. 101, 102). Окремі ФР, включаючи біомаркери і локалізацію раку, не дозволяють достовірно ідентифікувати пацієнтів з високим ризиком ВТЕ.
У питаннях профілактики ВТЕ необхідно враховувати ризик кровотечі та очікувану тривалість життя пацієнта, які можуть варіювати та потребувати повторної оцінки.
Профілактику ВТЕ необхідно проводити не менше ніж 4 тиж після хірургічних втручань.
Для лікування гострої підтвердженої тромбоемболії легеневої артерії гемодинамічно стабільним пацієнтам призначають низькомолекулярний гепарин на 3–6 міс, також доцільною є тривала антикоагулянтна терапія аж до повного вилікування онкологічного захворювання. У разі повторного епізоду ВТЕ на фоні лікування АВК чи низькомолекулярними гепаринами у пацієнтів з онкологічним захворюванням слід змінити АВК на низькомолекулярний гепарин або підвищити дозу низькомолекулярного гепарину.
Нові оральні антикоагулянти (НОАК) для профілактики ВТЕ
Згідно з дослідженнями CASSINI і AVERT ривароксабан і апіксабан можуть бути призначені для первинної профілактики ВТЕ у обраних амбулаторних пацієнтів із раком проміжного та високого ризику виникнення ВТЕ, наявність ≥2 балів за шкалою Khorana.
ТЕЛА
Діагностика ТЕЛА, що виникла при проведенні протипухлинної терапії, здійснюється за алгоритмами, запропонованими рекомендаціями з ведення пацієнтів з ТЕЛА Європейського товариства кардіологів та адаптованими рекомендаціями Асоціації кардіологів України. Визначення D-димеру в онкологічних хворих є не зовсім інформативним, оскільки онкопроцес супроводжується підвищенням рівня цього біомаркера. Користь D-димеру є тільки за умови його рівня нижче верхньої межі норми, у цьому разі діагноз ТЕЛА необхідно переглянути.
Лікування ТЕЛА в гострий період
Тромболітична терапія
- Дані про тромболізис у хворих на рак є обмеженими.
- Рекомендується індивідуальний підхід для прийняття рішення з урахуванням нестабільності гемодинаміки та ризику кровотеч.
- Мультидисциплінарний підхід передбачає залучення до команди лікаря невідкладної
кардіології, який має досвід системного або катетерного тромболізису.
Антикоагулянтна терапія
- Низькомолекулярний гепарин є основою стандартного лікування гострої фази онкоасоційованих тромбозів (ОАТ), внаслідок кращої ефективності стосовно рецидивів тромбозів та кращого профілю безпеки порівняно з АВК (табл. 104).
- Низькомолекулярний гепарин також краще нефракціонованого гепарину протягом перших 5–10 днів антикоагуляції для пацієнтів з ОАТ, з подальшим заміщенням АВK (тільки після досягнення цільового МНВ 2,0–3,0 впродовж не менше 2 послідовних днів), за відсутності тяжкої ниркової недостатності (кліренс креатиніну <30 мл/хв).
Таблиця 104. Препарати, які рекомендовані для лікування ВТЕ у хворих зі злоякісними новоутвореннями в гострій фазі
| Препарат | Доза | Примітка |
| Гепарин (НФГ) | В/в болюс 80 ОД/кг маси тіла (максимальна доза 4000 ОД) з наступною в/в інфузією в дозі 18 ОД/кг/год (максимальна доза 1000 ОД/год) протягом 24–48 год. Контроль АЧТЧ обов’язковий кожні 6 год (АЧТЧ = 50–70 с або в 2,0–2,5 раза вище початкового) | Використовується обмежено внаслідок важкості контролю |
| Еноксапарин | 1,0 мг/кг маси тіла 2 рази на добу або
1,5 мг/кг маси тіла 1 раз на добу підшкірно |
|
| Далтепарин | 100 ОД/кг маси тіла 2 рази на добу або
200 ОД/кг маси тіла 1 раз на добу підшкірно |
|
| Надропарин | 86 ОД/кг маси тіла 2 рази на добу або
171 ОД/кг маси тіла 1 раз на добу підшкірно |
|
| Фондапаринукс | 5 мг раз на добу (маса тіла <50 кг); 7,5 мг (50–100 кг);
10 мг (>100 кг) підшкірно кожні 24 год |
Низькомолекулярні гепарини та антагоністи вітаміну К
Hизькомолекулярні гепарини є кращими порівняно з АВК для раннього лікування ОАТ згідно з дослідженнями CANTHANOX, CLOT, LITE, ONCENOX та CATCH.
Нові оральні антикоагулянти для лікування ВТЕ
Серед всіх НОАК на сьогодні мінімальна доказова база існує для едоксабану (дослідження Hokusay VTE), ривароксабану (дослідження SELECT-D), апіксабану (дослідження ADAM VTE), які можуть бути призначені пацієнтам з низьким ризиком кровотечі за відсутності лікарської взаємодії зі специфічною хіміотерапією.
Режим дозування ривароксабану при ВТЕ: 15 мг двічі на добу впродовж 3 тиж, потім по 20 мг 1 раз на добу.
Едоксабан призначається після початкового застосування НМГ ≥5 днів в дозі 60 мг 1 раз на добу (30 мг 1 раз на добу, якщо кліренс креатиніну 30–50 мл/хв або маса тіла <60 кг).
Апіксабан призначається в дозі 10 мг двічі на добу протягом 7 днів, а потім 5 мг двічі на добу.
Особливості застосування НОАК для лікування ОАТ
НОАК не призначаються пацієнтам з:
- гастроінтестинальними формами раку;
- високим ризиком кровотеч, включаючи пацієнтів з раком шлунка/кишечнику;
- ризиком кровотеч з верхніх відділів шлунково-кишкового тракту, сечового міхура;
- активною дуоденальною виразкою, гастритом, езофагітом або колітом.
Тривалість лікування
У пацієнтів з ВТЕ, що виникла на тлі активного онкозахворювання, з огляду на оновлені дані, рекомендовано лікування низькомолекулярними гепаринами, АВК або НОАК протягом принаймні 6 міс, за відсутності протипоказань.
Мінімальний термін призначення АВК становить 3 міс, хоча в більшості випадків питання про припинення терапії вирішується індивідуально.
При активному онкологічному процесі терапія АВК може бути продовжена невизначено довго або до вилікування від раку, але з урахуванням ризику кровотечі та стану пацієнта, оскільки ризик геморагічних ускладнень у пацієнтів з онкологічними захворюваннями залишається завжди високим.
Пацієнти, у яких розвинувся рецидив ВТЕ на фоні прийому адекватної антикоагулянтної терапії, повинні бути обстежені на предмет прогресування у них злоякісного захворювання.
Захворювання периферичних артерій і інсульт
Виражений атеросклероз і неатеросклеротичні ураження периферичних артерій нижніх кінцівок виявляють у 30% пацієнтів, які приймають нілотиніб, понатиніб або BCR-ABL-інгібітори тирозинкіназ, їх розвиток можливий як у перші місяці лікування, так і через декілька років після його завершення. Синдром Рейно може розвинутися внаслідок дії L-аспарагінази, цисплатину, метотрексату, флуорурацилу та паклітакселу.
Ризик інсульту зростає майже вдвічі після медіастинальної, тазової або краніальної променевої терапії. Необхідно оцінювати ризик захворювань периферичних артерій (визначати фактори ризику, клінічні прояви, гомілково-плечовий індекс). Пацієнти з першою і другою стадіями захворювання за Fontaine (без симптомів або з помірною переміжною кульгавістю) потребують контролю факторів ризику, періодичного клінічного та лабораторного спостереження.
Антитромбоцитарні препарати призначають переважно симптомним пацієнтам. У разі тяжкого захворювання периферичних артерій в анамнезі чи під час лікування пухлинного захворювання рішення щодо проведення реваскуляризації необхідно приймати індивідуально на консиліумі за участю гематологів, судинних хірургів, онкологів і кардіологів. У пацієнтів після променевої терапії з приводу лімфоми або онкологічного ураження голови і шиї слід проводити дуплексне сканування екстра- та інтракраніальних судин через 5 років, та кожні 5 років або частіше, якщо результати першого обстеження були патологічними. Корекція факторів ризику є необхідною для зупинки прогресування атеросклеротичних бляшок. Виражене стенозування судин (особливо сонних артерій) може потребувати стентування чи хірургічного лікування.
Легенева гіпертензія
Виникає нечасто як ускладнення у пацієнтів зі злоякісними утвореннями та трансплантацією кісткового мозку внаслідок дії дазатинібу, циклофосфаміду.
ЕхоКГ необхідно проводити з метою:
- оцінки ознак перевантаження правого шлуночка;
- виявлення інших причин ЛГ (дисфункція ЛШ, хронічна посттромбоемболічна ЛГ);
- при появі слабкості, задишки чи стенокардії під час лікування препаратами, що можуть спричинити появу ЛГ;
- в асимптомних пацієнтів ехоКГ проводити кожні 3–6 міс (табл. 105).
Таблиця 105. Моніторинг пацієнтів із медикаментозно спричиненою ЛГ
| Первинне обстеження |
|
| Моніторинг пацієнтів | Асимптомні пацієнти
Симптомні пацієнти
|
Захворювання перикарда
Гострий перикардит може розвинутися в разі застосування:
- антрациклінів, циклофосфаміду, цитарабіну, блеоміцину,
- нетипово під час променевої терапії;
- часто асоціюється з медіастинальними пухлинами.
Гострий перикардит з типовим больовим синдромом, підвищенням температури тіла, змінами сегмента ST, значним випотом і навіть тампонадою може розвинутися як через 2–6 міс, так і через декілька років після опромінення грудної клітки з кумулятивною частотою 2–5%.
ЕхоКГ є методом вибору при підозрі на перикардит, проте МСКТ краща для виявлення кальцифікації.
Для лікування ексудативного перикардиту застосовують НПВП і колхіцин.
У разі значного випоту з порушенням гемодинаміки рекомендовано перикардіоцентез і створення хірургічного перикардіального вікна.
Відтерміноване ураження перикарда (сухий або ексудативний перикардит, часто асимптомний) може виникнути в період від 6 міс до 15 років після променевої терапії (до 20% пацієнтів).
Стратегії профілактики та програма лікування
Стратифікація серцево-судинного ризику пацієнта кардіологом перед проведенням поліхіміотерапії та променевої терапії:
- виявити фактори ризику серцево-судинних ускладнень, провести відповідну профілактику, а у пацієнтів із серцево-судинними захворюваннями — призначити або переглянути лікування;
- під час лікування — корекція кардіотоксичних ускладнень та коморбідної патології пацієнта;
- у процесі та після проведення протипухлинної терапії — моніторинг кардіотоксичності, в першу чергу у пацієнтів високого ризику, оскільки ускладнення можуть виникати як протягом 1 року після протипухлинної терапії (рання кардіотоксичність), так і через тривалий час (пізня кардіотоксичність).
Стратегії перед призначенням протипухлинного лікування
У разі наявного високого ризику розвитку кардіотоксичності до початку лікування (наявність серцево-судинних захворювань, попереднє застосування антрациклінів або недостатній контроль серцево-судинних факторів ризику), необхідною є оптимізація контролю факторів ризику та призначення профілактичного кардіопротекторного лікування (табл. 106).
Таблиця 106. Стратегії зниження кардіотоксичності внаслідок дії протипухлинних препаратів
| Протипухлинні препарати | Кардіопротекторні заходи |
| Усі протипухлинні препарати |
|
| Антрацикліни та аналоги | Обмеження кумулятивної дози (мг/м2):
Альтернативний спосіб введення (ліпосомальний доксорубіцин або тривала інфузія) Дексразоксан як альтернатива
|
| Трастузумаб |
|
У пацієнтів з високим ризиком серцево-судинних ускладнень до обстеження пацієнта і рішення про подальшу тактику лікування необхідно залучати кардіолога або кардіоонколога.
При виявленні ознак кардіотоксичного серцево-судинного ускладнення пацієнт має отримати консультацію кардіолога (кардіоонколога) для призначення ефективної серцево-судинної терапії та вирішення питання про можливість проведення подальшого протипухлинного лікування або змін у схемі хіміотерапії.
У всіх пацієнтів, які отримують протипухлинне лікування потенційно кардіотоксичними препаратами (антрацикліни, трастузумаб, інгібітори VEGF), необхідно здійснювати контроль стану серцево-судинної системи з метою раннього виявлення дисфункції ЛШ (рис. 18).
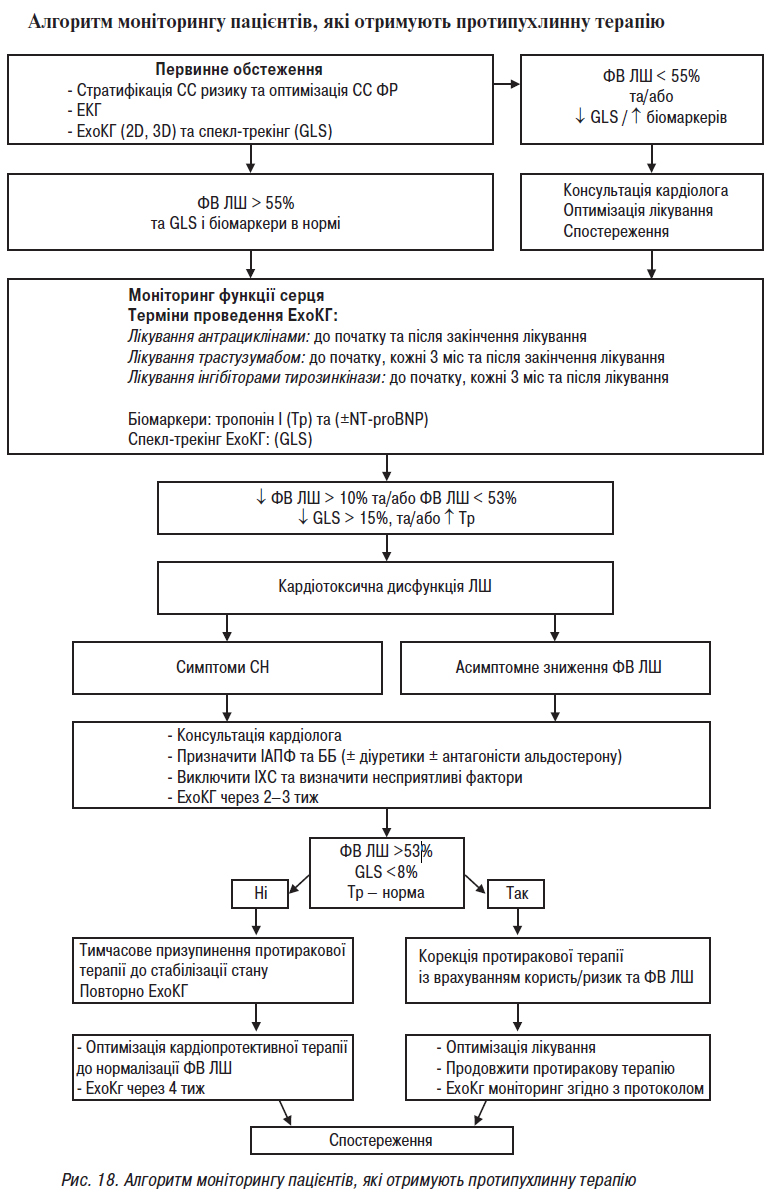
Алгоритм моніторингу пацієнтів, які отримують протипухлинну терапію
При лікуванні антрациклінами та/або трастузумабом моніторинг функції серця із визначенням ФВ ЛШ слід проводити перед початком терапії і надалі через 3; 6; 9; 12; 18 міс та після її завершення. Більш частий контроль можливий за клінічними показаннями.
Цілі лікування серцево-судинних ускладнень внаслідок дії протипухлинних препаратів та променевої терапії
Основними цілями лікування пацієнтів зі встановленим діагнозом кардіотоксичного серцево-судинного ускладнення є усунення його симптомів та ознак, попередження госпіталізацій з приводу погіршення клінічного стану, покращання виживаності, проте основна мета — продовжити та провести протипухлинне лікування в повному обсязі. Бажаними ефектами правильно здійснюваного лікування серцево-судинного ускладнення також є підвищення функціональної спроможності пацієнтів та поліпшення якості їх життя.
Програма лікування
Пацієнтам із кардіотоксичним серцево-судинним ускладненням починають медикаментозне лікування залежно від його прояву (СН, аритмія, АГ тощо), за відсутності протипоказань з метою зменшення вираженості симптомів та покращення прогнозу. Лікування пацієнтів із серцево-судинним ускладненням має здійснюватися необмежено довго під контролем клінічного стану та переносимості лікування.
Лікування пацієнтів із кардіотоксичною дисфункцією серця внаслідок дії антрациклінів є обов’язковим із призначенням інгібіторів АПФ та блокаторів бета-адренорецепторів та має бути розпочато якомога раніше із титруванням препаратів до максимально переносимих доз із урахуванням АТ та ЧСС (табл. 107).
Таблиця 107. Основні групи лікарських засобів з доведеним впливом при лікуванні дисфункції серця/ CН внаслідок кардіотоксичної дії протипухлинних препаратів
| Лікарський засіб | Початкова доза | Цільова доза |
| Інгібітори АПФ | ||
| Еналаприл | 2,5 мг 2 р/добу | 20 мг 2 р/добу |
| Лізиноприл | 2,5–5,0 мг/добу | 20 мг/добу |
| Раміприл | 2,5 мг/добу | 10 мг/добу |
| Периндоприл | 1–2 мг/добу | 8 мг/добу |
| Блокатори бета-адренорецепторів | ||
| Бісопролол | 1,25 мг/добу | 10 мг/добу |
| Карведилол | 3,125 мг 2 р/добу | 25 мг 2 р/добу |
| Небіволол | 1,25 мг/добу | 10 мг/добу |
| БРА | ||
| Кандесартан | 4–8 мг/добу | 32 мг/добу |
| Валсартан | 40 мг 2 р/добу | 160 мг 2 р/добу |
| Антагоністи мінералокортикоїдних рецепторів | ||
| Еплеренон | 25 мг/добу | 50 мг/добу |
| Спіронолактон | 25 мг/добу | 50 мг/добу |
| Інгібітор If-каналів | ||
| Івабрадин | 5 мг 2 р/добу | 7,5 мг 2 р/добу |
Загальні принципи
Ведення пацієнтів, які лікувалися антрациклінами
До призначення лікування антрациклінами пацієнт має пройти початкове обстеження для виявлення факторів ризику або супутніх серцево-судинних захворювань та визначення систолічної функції ЛШ. При призначенні високих доз антрациклінів (≥450 мг/м2), а також у пацієнтів з високим вихідним ризиком розвитку кардіотоксичності додаткове обстеження серця слід призначити при досягненні кумулятивної дози препарату (для доксорубіцину 240 мг/м2). Якщо на фоні лікування антрациклінами відмічено зниження ФВ ЛШ більше ніж на 10% та/або до значення нижньої межі її норми, необхідно провести повторне ехоКГ обстеження пацієнта через 2–3 тиж. При виявленні дисфункції ЛШ слід вирішити питання про можливе альтернативне лікування та призначення кардіопротекторної терапії. Повторне обстеження функції ЛШ має проводитися наприкінці лікування, особливо якщо у пацієнта виявлено високий ризик розвитку ураження міокарда або якщо в подальшому буде призначений наступний препарат з потенційною кардіотоксичною дією. Визначення одного з біомаркерів (тропоніну I або Т чи МНУП) показано до початку та в процесі лікування. Це дозволить виявити пацієнтів з більш високим ризиком кардіотоксичності і вчасно призначити кардіопротекторну терапію.
Ведення пацієнтів, яким призначено інгібітори рецептора епідермального фактора росту людини (HER2) (трастузумаб, пертузумаб)
Консультація кардіолога та початкове обстеження (ЕКГ, ехоКГ, тропонін, виявлення факторів ризику кардіотоксичності) показане всім хворим до призначення лікування інгібіторами HER2. У разі якщо лікування антрациклінами передує терапії інгібіторами HER2 (анти HER2), кардіологічне спостереження необхідно починати до призначення антрациклінів. Кардіомоніторинг (ехоКГ) рекомендований кожні 3 міс анти-HER2-терапії під час лікування і через 1 міс після закінчення протипухлинної терапії. Визначення тропоніну I після кожного циклу протипухлинного лікування показано пацієнтам високого ризику.
Згідно з рекомендаціями Національного інституту вивчення раку (National Cancer Research Institute) визначено:
- при зниженні ФВ ЛШ <45% або >10% від початкової до значень ФВ між 45 і 49% — призначення трастузумабу має бути зупинено, необхідно призначити інгібітори АПФ;
- трастузумаб може бути знову призначений, якщо ФВ ЛШ відновилася >49%;
- зниження ФВ ЛШ <50%, але >44% — прийом трастузумабу можна продовжити, але при одночасному призначенні інгібіторів АПФ;
- при тривалому зниженні ФВ ЛШ показана консультація кардіолога, необхідне призначення блокаторів бета-адренорецепторів.
Серцево-судинні ускладнення на тлі застосування інгібіторів VEGF можуть розвинутися як безпосередньо після лікування, так і через декілька місяців.
- Необхідний ретельний контроль факторів ризику та моніторинг АТ впродовж протипухлинного лікування.
- Раннє й агресивне антигіпертензивне лікування запобігає розвитку серцево-судинних ускладнень, зокрема СН.
Кардіомоніторинг рекомендований кожні 3 міс на тлі терапії інгібіторами VEGF під час лікування та після закінчення терапії.
Основні положення освітньої стратегії щодо пацієнтів із серцево-судинними ускладненнями протипухлинної терапії
За останні десятиріччя зросла популяція пацієнтів, які одужали після онкологічного захворювання. Такі пацієнти мають бути поінформовані про можливе підвищення в них ризику серцево-судинних захворювань й отримати рекомендації щодо відповідної модифікації способу життя. Перед початком протипухлинного лікування пацієнтам слід надати детальний опис симптомів та синдромів серцево-судинних захворювань, у тому числі їх ранніх ознак (рис. 19).
Довготривале спостереження необхідне пацієнтам, що отримали комбіноване протипухлинне лікування (антрацикліни, таргетні препарати, променева терапія).
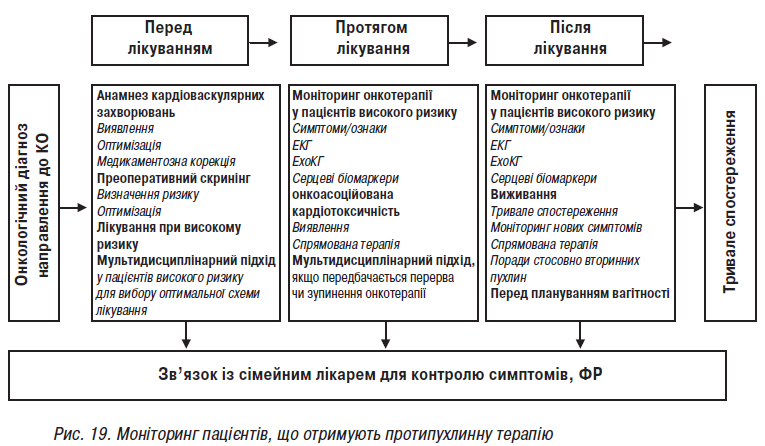
Приклади формулювання діагнозів
- Токсична (антрациклінова) кардіоміопатія. Часта шлуночкова екстрасистолія. Повна блокада лівої ніжки пучка Гіса. СН ІІБ стадії з систолічною дисфункцією ЛШ (ФВ ЛШ 35%). ІІІ ФК за Лівобічний плевральний випіт. Захворювання лівої грудної залози. Стан після комбінованого лікування (6 курсів хіміотерапії, променева терапія 2019 р.).
- Токсична кардіоміопатія. Пароксизмальна форма фібриляції передсердь. CHA2DS2- VASc 2 бали. HAS-BLED 1 бал. СН ІІ А стадія із збереженою ФВ ЛШ. Лімфома Ходжкіна, стан після комбінованого лікування (6 курсів ПХТ за схемою ABVD та променева терапія 2019 р.).