Будова синовіальних суглобів
Содержание
СУЧАСНА УЯВА ПРО БУДОВУ І ФУНКЦІЇ СИНОВІАЛЬНИХ СУГЛОБІВ
ОА — захворювання синовіальних суглобів (диартрозів). Основні функції диартрозів — рухова (наприклад, переміщення складових суглобових елементів по певним осям) і опорна (навантаження при стоянні, ході, стрибку). Синовіальний суглоб складається з кісткових поверхонь, що зчленовуються, покритих хрящем, суглобової порожнини, що містить синовіальну рідину, і суглобової капсули. Непостійними анатомічними елементами диартрозу є зв’язки, розміщені зовні або рідше усередині зчленування, і хрящові меніски
За формою зчленування кісткових поверхонь диартрози розподіляють на наступні види (Насонова В.А., Бунчук Н.В., 1997):
- Плоскі суглоби (наприклад деякі зап’ястні і передплеснові суглоби).
- Шароподібні суглоби, у яких один суглобовий кінець має форму кулі або частини кулі, а інший являє собою увігнуту поверхню, яка конгруентна кулястому кінцю, що зчленовується; прикладом кулястого суглоба є плечовий суглоб, у якому можливий великий обсяг рухів усіх видів — згинання, розгинання, відведення і приведення, кругові рухи.
- Еліпсоїдні суглоби, у яких один з кінців, що зчленовується, має вигляд еліпса, а інший — конгруентної западини. У результаті такої анатомічної будови обсяг рухів у цих зчленуваннях обмежений порівняно з кулястими і в них неможливі, наприклад, кругові рухи; розрізняють прості еліпсоїдні суглоби і складні з декількома парами суглобових зчленувань (наприклад променезап’ястковий).
- Блокоподібні суглоби, у яких один суглобовий кінець являє собою за формою блок, що нагадує котушку, шпульку, а інший увігнутий суглобовий кінець охоплює частину блока і відповідає йому за формою; типовим блокоподібним суглобом є міжфаланговий суглоб кисті та стопи; рухи в таких зчленуваннях можуть відбуватися тільки в одній площині — згинання і розгинання; до блокоподібних суглобів належить і ліктьовий суглоб — він складається із трьох зчленувань — плечеліктьового, плечепроменевого та проксимального променеліктьового, в результаті чого в цьому складному зчленуванні можливі крім згинання і розгинання, супінація та пронація, тобто ротаційні рухи.
- Обертальні (колесоподібні) суглоби, прикладом яких є серединний атлантоосьовий суглоб, що складається з кільця, утвореного передньою дугою атланта і поперечною зв’язкою, та зубоподібного відростка II шийного хребця, що входить у кільце і є своєрідною віссю, навколо якої обертається кільце атланта; у ліктьовому суглобі променеліктьове зчленування також слід віднести до обертального типу суглобів, тому що голівка променевої кістки обертається у кільцевій зв’язці, яка охоплює голівку променя, що прикріплюється до ліктьової вирізки.
- Сідлоподібні суглоби, прикладом яких є зап’ястково-п’ястковий суглоб великого пальця кисті; зчленовану поверхню у формі сідла має трапецієподібна кістка, а форму ввігнутого сідла — I п’ясткова кістка; така анатомічна будова дозволяє робити кругові рухи в сагітальній та фронтальній площинах, кругові рухи по осі в цьому суглобі неможливі.
- Виросткові суглоби, анатомічною особливістю яких є парні виростки — опуклі та увігнуті, у яких можливі співдружні рухи; прикладом виросткового суглоба може бути коліно, що складається з трьох компонентів, які утворюють єдину біомеханічну систему — пателофеморального та внутрішнього і зовнішнього тибіофеморального зчленувань; не зовсім удосконалена конгруентність відростків великої гомілкової кістки заповнюється зовнішнім та внутрішнім менісками; потужні бічні зв’язки перешкоджають бічним і гойдальним рухам гомілки навколо стегна, а також зберігають гомілку від підвивиху вперед та назад під час рухів суглоба; у цьому виростковому суглобі можливі згинання і розгинання, зовнішня та внутрішня ротація у напівзігнутому положенні суглоба; при згинально-розгинальних рухах відбувається обертання виростків стегна відносно виростків великої гомілкової кістки та одночасне їх ковзання за рахунок переміщення осей обертання; таким чином, колінний суглоб є багатовісьовим або поліцентричним, під час повного розгинання бічні зв’язки і сухожилля, вплетені в суглобову капсулу, максимально напружені, що створює умови для найбільшої стійкості та опороздатності суглоба у цьому положенні.
Суглоб оточений фіброзною капсулою, що прикріплюється до кістки поблизу периферії суглобового хряща і переходить в окістя. Капсула синовіального суглоба складається з двох шарів: зовнішнього — фіброзного та внутрішнього — синовіального. Фіброзний шар складається зі щільної волокнистої тканини. У деяких місцях фіброзний шар капсули стоншується з утворенням заворотів або бурс, у інших місцях він потовщений, виконуючи функцію зв’язок суглоба. Товщина фіброзного шару капсули визначається функціональним навантаженням на суглоб.
Потовщення капсули утворюють зв’язки, що складаються зі щільних паралельних пучків колагенових волокон, які служать для стабілізації і зміцнення суглоба та обмежують певні рухи. Серед особливостей капсули, крім виконання нею функції опори для синовіальної оболонки і з’єднання зі зв’язками, слід зазначити велику кількість нервових закінчень, що знаходяться в ній, на відміну від синовії, що має незначну кількість таких закінчень, і суглобового хряща, що не містить їх зовсім. Вважається, що разом з нервами м’язів нерви капсули беруть участь у контролі положення, а також реагують на больові подразнення (Вернон-Робертс В., 1990).
Синовіальна оболонка — найменша за масою і об’ємом, але найбільш важлива складова частина синовіального суглоба, оскільки більша частина ревматичних хвороб має перебіг із запаленням синовіальної оболонки. Цей процес має загальну назву «синовіт». Синовіальна оболонка вистилає всі внутрішньосуглобові структури, крім суглобового хряща, її товщина становить 25–35 мкм. Гістологічно вона являє собою шар сполучної тканини, що складається з покривного, колагенового та еластичного шарів (Павлова В.Н., 1980). Синовіальна оболонка в нормі має певну кількість складок і пальцеподібних ворсин та формує тонкий синовіальний шар (який іноді називають покривним); до його складу входить шар покривних клітин, які утворюють вистилку поверхонь суглоба, що не зчленовуються, і субсиновіальний підтримувальний шар, що складається з фіброзно-жирової сполучної тканини різної товщини, яка з’єднується з капсулою. Синовіальний шар часто зливається з субсиновіальною тканиною шляхом плавного переходу від аваскулярного внутрішнього покриття, що містить безліч клітин, до васкуляризованої субсиновіальної сполучної тканини з меншою кількістю клітин, яка по мірі наближення до з’єднання з фіброзною капсулою стає все більш насиченою колагеновими волокнами. Із кровоносних судин субсиновіальної сполучної тканини в синовіальну рідину виходять клітини і поживні речовини завдяки відсутності морфологічного роз’єднання синовіального і субсиновіального шарів (відсутності базальної мембрани, наявності проміжків між покривними клітинами).
Синовіальна оболонка в нормі вистелена 1–3 шарами синовіцитів — синовіальних клітин, розміщених у матриксі (основній речовині), багатому на мікрофібрили й агрегати протеогліканів. Синовіцити поділять на дві групи — типу А (макрофагоподібні) і типу В (фібробластоподібні). Синовіцити типу А мають нерівну клітинну поверхню з великою кількістю виростів, у них добре розвинений комплекс Гольджі, багато вакуолей і везикул, однак рибосомальна ендоплазматична мережа виражена слабко. Макрофагальні синовіцити також можуть містити велику кількість фагоцитованого матеріалу. У синовіцитів типу В поверхня відносно гладка, добре розвинена рибосомальна ендоплазматична мережа, вони містять лише незначну кількість вакуолей. Класичний розподіл синовіцитів на А-клітини, що виконують фагоцитуючу функцію, і В-клітини, основною функцією яких є вироблення компонентів синовіальної рідини, насамперед гіалуронової кислоти, не відображає всіх функцій синовіцитів. Так, були описані синовіцити типу С, які за своїми ультраструктурними ознаками займають проміжне положення між клітинами типу А і В. Крім того, встановлено, що макрофагоподібні клітини здатні синтезувати гіалуронову кислоту, а фібробластоподібні мають здатність до активного фагоцитозу (Вернон-Робертс Б., 1990).
СУЧАСНІ УЯВЛЕННЯ ПРО БУДОВУ І ФУНКЦІЇ СУГЛОБОВОГО ХРЯЩА
Структура суглобового хряща людини
Суглобовий хрящ має унікальну структуру і складається переважно з позаклітинного матриксу (ПКМ), що синтезується хондроцитами (Poole A.R. et al., 2001). Нормальний суглобовий хрящ виконує дві основні функції: поглинання тиску шляхом деформації під час механічного навантаження і забезпечення гладкості суглобових поверхонь, що дозволяє максимально зменшити тертя при рухах у суглобі.
Нормальний суглобовий хрящ дорослого можна розподілити на кілька шарів, або зон (рис. 3.1): поверхнева або тангенціальна зона, перехідна зона, глибока або радіальна зона і кальцифікована зона. Шар між поверхневою та перехідною зоною і особливо між перехідною та глибокою зоною не має чітких границь. З’єднання між некальцифікованим і кальцифікованим суглобовим хрящем називається хвилястою границею — це лінія, що визначається при фарбуванні декальцифікованої тканини. Кальцифікована зона хряща становить відносно постійну пропорцію (6–8%) у загальній висоті зрізу хряща (Oegema T.R., Thompson R.C., 1992). Загальна товщина суглобового хряща, включаючи зону кальцифікованого хряща, варіює залежно від навантаження на певну ділянку суглобової поверхні і від виду суглоба. Переміжний гідростатичний тиск у субхондральній кістці відіграє важливу роль у підтримці нормальної структури хряща, уповільнюючи осифікацію.На відміну від багатьох інших тканин організму, у хрящовій тканині виявлений лише єдиний тип клітин — ходроцити (Archer C.W., Francis-West P., 2003), становлячи від 2–3% до 10% загальної маси тканини; у поверхневій (тангенціальній) зоні вони розміщені поздовжньо, а в глибокій (радіальній) — перпендикулярно до поверхні хряща; у перехідній зоні хондроцити формують групи по 2–4 клітини, що розсіяні по всьому матриксу. Залежно від зони суглобового хряща варіює щільність розміщення хондроцитів — найвища щільність клітин у поверхневій зоні, найнижча — у кальцифікованій (див. рис. 3.1). Крім того, щільність розподілу клітин варіює від суглоба до суглоба, вона обернено пропорційна товщині хряща і навантаженню, яке припадає на відповідну його ділянку.
Найбільш поверхово розміщені хондроцити мають дископодібну форму і утворюють у тангенціальній зоні кілька шарів клітин, розміщених нижче вузької смужки матриксу; глибше розміщені клітини цієї зони мають тенденцію до більш нерівних контурів. У перехідній зоні хондроцити мають сферичну форму, іноді вони об’єднуються в невеликі групи, що розсіяні у матриксі. Хондроцити глибокої зони мають переважно еліпсоїдну форму, групуються в радіально розміщені ланцюжки з 2–6 клітин. У кальцифікованій зоні вони розподілені ще більш розріджено; деякі з них некротизовані, хоча більшість життєздатна. Клітини оточені некальцифікованим матриксом, міжклітинний простір — кальцифікований.
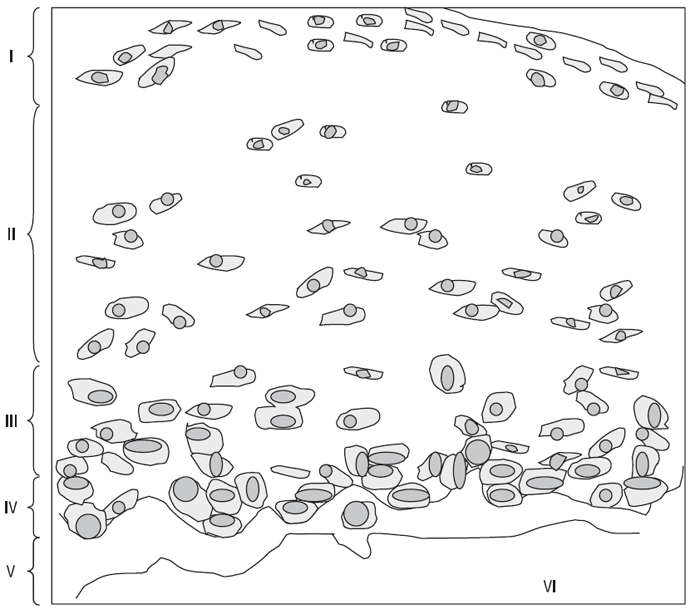
Рис. 3.1. Зони суглобового хряща. Схематичне зображення зрізу суглобового хряща медіального відділу великогомілкової кістки 66-річної жінки. Товщина хряща — 1,8 мм; I — тангенціальна зона, II — перехідна зона, III — радіальна зона, за нею йде хвиляста границя, що відокремлює некальцифікрований хрящ від кальцифікрованої зони (IV). Остеохондральне з’єднання (V) зв’язує субхондральную кістку (VI) з хрящем (за: Kuettner K.E., Thonar E.J.M.A., 1998)
Таким чином, суглобовий хрящ людини складається з гідратованого ПКМ і занурених у нього клітин, які становлять 2–3% від загального об’єму тканини. Внаслідок того, що хрящова тканина не має кровоносних і лімфатичних судин, взаємодія між клітинами, постачання їх поживними речовинами, видалення продуктів обміну здійснюється шляхом дифузії через ПКМ. Незважаючи на те що метаболічно хондроцити дуже активні, в нормі у дорослих людей вони не поділяються. Хондроцити існують у безкисневому середовищі, вважають, що їх метаболізм здійснюється переважно анаеробним шляхом (Shapiro I.M. et al., 1991). У 2005 р. C. Ruiz-Romero та співавтори опублікували протеонемічну карту (proteomic reference map) людського хондроциту, що допомогла ідентифікувати 93% різноманітних внутрішньоклітинних білків хондроциту, серед яких 26% залучені в організацію клітини, 16% — у процес вироблення енергії, 14% — у білковий синтез, 12% — у клітинний метаболізм та 12% представлені білками клітинного стресу.
Кожний хондроцит розглядають як окрему метаболічну одиницю хряща, ізольовану від сусідніх клітин, але відповідальну за продукцію елементів ПКМ у безпосередній близькості від цієї клітини і підтримку його складу (Aydelotte M.B., Kuettner K.E., 1988).
У ПКМ виділяють три відділи (рис. 3.2), кожний з яких має унікальну морфологічну структуру (Hunziker E.B., 1992) і певний біохімічний склад (Mok S.S. et al., 1994; Hauselmann H.J. et al., 1996).
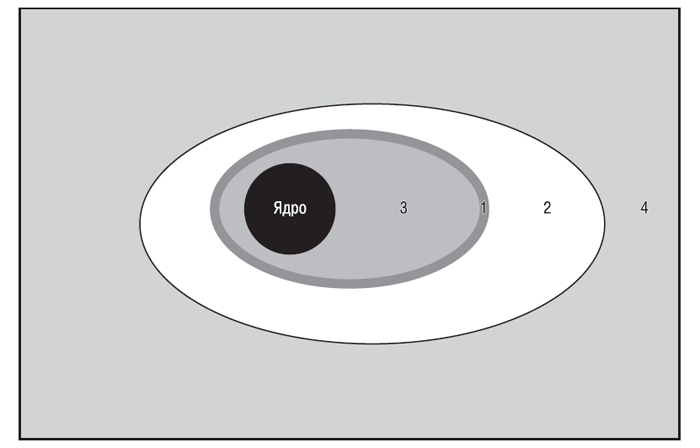
Рис. 3.2. Відділи ПКМ суглобового хряща. Тонкий шар перицелюлярного матриксу (1) і територіальний матрикс (2) навколо хондроциту (3) формує клітково-асоційований матрикс, метаболічно активний відділ ПКМ. Метаболічно інертний міжтериторіальний матрикс (4) становить >90% від загального об’єму ПКМ суглобового хряща людини (за: Kuettner K.E., Thonar E.J.M.A., 1998)
ПКМ, що безпосередньо прилягає до базальної мембрани хондроциту, називається перицелюлярним, або лакунарним, матриксом. Він характеризується високим вмістом агрегатів протеогліканів, пов’язаних із клітинною взаємодією гіалуронової кислоти із СD44-подібними рецепторами (Knudson C.B., Knudson W., 1993), і відносною відсутністю організованих фібрил колагенів. Безпосередньо з перицелюлярним матриксом стикається територіальний, або капсулярний, матрикс, який складається з мережі перехресних фібрилярних колагенів, що інкапсулює окремі клітини або (іноді) групи клітин, формуючи хондрон, та, ймовірно, забезпечує спеціальну механічну підтримку клітин (Kuettner K.E., Thonar E.J.M.A., 1998). Контакт хондроцитів з капсулярним матриксом здійснюється за допомогою численних цитоплазматичних відростків, багатих на мікрофіламенти, а також за допомогою специфічних матриксних молекул, таких як анкорин і СD44-подібні рецептори. Найбільший і найвіддаленіший від базальної мембрани хондроциту відділ ПКМ — міжтериторіальний матрикс, що містить найбільшу кількість колагенових фібрил і протеогліканів (Hunziker E.B., 1992).
Поділ ПКМ на відділи більш чітко окреслений в суглобовому хрящі дорослої людини, ніж у незрілому суглобовому хрящі (Kuettner K.E., Thonar E.J.M.A., 1998). Відносний розмір кожного відділу варіює не тільки в різних суглобах, але навіть у межах того самого хряща. Кожний хондроцит виробляє оточуючий його матрикс. За даними досліджень (Hunziker E.B., 1992; Mok S.S. et al., 1994) хондроцити зрілої хрящової тканини здійснюють активний метаболічний контроль над своїми перицелюлярним і територіальним матриксами, менш активно вони контролюють міжтериторіальний матрикс, який може бути метаболічно інертним.
Як зазначено раніше, суглобовий хрящ головним чином складається з розповсюдженого ПКМ, синтезованого й регульованого хондроцитами. Тканьові макромолекули і їх концентрація змінюються протягом життя відповідно до мінливих функціональних потреб. Проте залишається невизначеним: клітини синтезують весь матрикс одночасно або в певні фази відповідно до фізіологічних потреб (Kuettner K.E., Thonar E.J.M.A., 1998). Концентрація макромолекул, метаболічна рівновага між ними, взаємовідношення та взаємодія визначають біохімічні властивості і, таким чином, функцію суглобового хряща у межах одного суглоба. Основним компонентом ПКМ суглобового хряща дорослої людини є вода (65–70% загальної маси), яка міцно зв’язана всередині нього завдяки особливим фізичним властивостям макромолекул хрящової тканини, що входять до складу колагенів, протеогліканів і неколагенових глікопротеїнів (Thonar E.J.M.A. et al., 1999).
Біохімічний склад хряща
Колагенові волокна складаються з молекул фібрилярного білка колагену. У ссавців на частку колагену припадає четверта частина всіх білків організму. Колаген формує фібрилярні елементи (колагенові фібрили), що складаються зі структурних субодиниць, що називаються тропоколагеном. Молекула тропоколагену має три ланцюги, які утворюють потрійну спіраль. Така будова молекули тропоколагену, а також структура колагенового волокна, в якому ці молекули розміщуються паралельно у поздовжньому напрямку з постійним зміщенням приблизно на 1/4 довжини і забезпечують високу пружність і міцність тканинам, у яких вони знаходяться. На сьогодні відомі 10 генетично різних типів колагену, що відрізняються за хімічною структурою α-ланцюгів і/або їх набором у молекулі. Найбільш вивчені перші чотири типи колагену здатні формувати до 10 молекулярних ізоформ.
Колагенові фібрили входять до складу позаклітинного простору більшості видів сполучної тканини, у тому числі й хрящової. Всередині нерозчинної тривимірної мережі з перехресних колагенових фібрил заплутані інші більш розчинні компоненти, такі як протеоглікани, глікопротеїни і тканиноспецифічні протеїни; іноді вони ковалентно пов’язані з колагеновими елементами.
Організовані у фібрили колагенові молекули становлять близько 50% органічного сухого залишку хряща (10–20% нативного хряща) (Thonar E.J.M.A. et al., 1999). У зрілому хрящі біля 90% колагенів становлять колагени II типу, які виявляють лише у деяких тканинах (наприклад склоподібне тіло, ембріональна спинна струна). Колаген II типу належить до I класу колагенових молекул, які формують фібрили. Крім нього у зрілому суглобовому хрящі людини також знаходять колагени IX, XI типу і в невеликій кількості VI типу. Відносна кількість колагенових волокон IX типу в колагенових фібрилах знижується від 15% у хрящі плода до близько 1% у зрілому хрящі бика (Mayne R., 1989; Eyre D.R., 1991; 1992).
Молекули колагену II типу складаються із трьох ідентичних поліпептидних α1(II)-ланцюгів, синтезованих і секретованих у вигляді проколагену-попередника. Як тільки готові молекули колагену вивільняються в позаклітинний простір, вони формують фібрили (Kuettner K.E., Thonar E.J.M.A., 1992). У зрілому суглобовому хрящі колаген II типу утворює фібрилярні аркади, у яких товщі молекули розміщені в глибоких шарах тканини, а тонші — горизонтально у поверхневих шарах (Schenk R.K. et al., 1986; Aydelotte М.B., Kuettner K.E., 1988).
У гені проколагену II типу виявлений екзон, що кодує багатий цистеїном N-термінальний пропептид. Цей екзон експресує не в зрілому хрящі, а на ранніх стадіях розвитку (прехондрогенез). Завдяки наявності цього екзону молекула проколагену II типу (тип IIА) довша колагену II типу (Ryan M.C., Sandell L.J., 1990). Імовірно, експресія цього типу проколагену пригнічує накопичення елементів у ПКМ суглобового хряща. Можливо, він відіграє певну роль у розвитку патології хряща (наприклад, неадекватна репаративна відповідь, утворення остеофітів та ін.) (Sundell L.J. et al., 1992).
Мережа із колагенових фібрил II типу забезпечує функцію опору розтягненню і необхідна для підтримки об’єму і форми тканини (Eyre D.R. et al., 1992; Hunziker E.B., 1992). Ця функція підсилюється ковалентними і поперечними зв’язками між молекулами колагену (Eyre D.R. et al., 1990). У ПКМ фермент лізилоксидаза утворює альдегід з гідроксилізину, який потім перетворюється в мультивалентну амінокислоту гідроксилізил-пірідінолін, що формує поперечні зв’язки між ланцюгами. З одного боку, концентрація цієї амінокислоти підвищується з віком, проте у зрілому хрящі вона практично не змінюється (Eyre D.R. et al., 1988). З іншого боку, у суглобовому хрящі виявляють підвищення з віком концентрації поперечних зв’язків різних типів, що утворюються без участі ферментів (Monnier V.M., Cerami А., 1981).
Близько 10% загальної кількості колагенів хрящової тканини становлять так звані мінорні колагени, які багато в чому зумовлюють унікальну функцію цієї тканини (Thonar E.J.M.A. et al., 1999). Колаген IX типу належить до III класу короткоспіральних молекул і до унікальної групи Facit-колагенів (Fibril-Associated Collagen with Interrupted Triple-helices — фібриласоційований колаген з перерваною потрійною спіраллю) (Olsen B.R., 1992). Він складається з трьох генетично різних ланцюгів. Один з них — α2-ланцюг глікозилюється одночасно з хондроїтину сульфатом, що робить цю молекулу одночасно протеогліканом. Між сегментами спіралі колагену IX типу і колагеном II типу виявляють як зрілі, так і незрілі гідроксипіридинові поперечні зв’язки (Eyre D.R. et al., 1987; van der Rest М., Mayne R., 1988). Колаген IХ також може функціонувати як міжмолекулярний-інтерфібрилярний конектор (або місток) між розміщеними поруч колагеновими фібрилами (Muller-Glauser W. et al., 1986; Wu J.J., Eyre D.R., 1989). Молекули колагену IХ утворюють поперечні зв’язки між собою, що збільшує механічну стабільність фібрилярної тривимірної мережі й захищає її від впливу ферментів. Вони також забезпечують опір деформації, обмежуючи набрякання протеогліканів, що перебувають усередині мережі. Крім аніонного CS-ланцюга, молекула колагену IХ містить катіонний домен, що передає фібрилі великий заряд і схильність до взаємодії з іншими матриксними макромолекулами (Vasios G. et al., 1988).
Колаген ХI типу становить тільки 2–3% загальної маси колагенів. Він належить до I класу (що утворюють фібрили) колагенів і складається із трьох різних α-ланцюгів. Разом із колагенами II і IХ типів колаген ХI типу утворює гетеротипові фібрили суглобового хряща (Eyre D.R., 1991). Молекули колагену ХI типу виявлені всередині колагенових фібрил II типу за допомогою імуноелектромікроскопії. Можливо, вони організують молекули колагену II типу, контролюючи латеральний ріст фібрил і детермінуючи діаметр гетеротипової колагенової фібрили (Eikenberry E.F. et al., 1992). Крім того, колаген ХI бере участь у формуванні поперечних зв’язків, однак навіть у зрілому хрящі поперечні зв’язки залишаються у вигляді незрілих дивалентних кетоамінів (Eyre D.R. et al., 1992).
Невелика кількість колагену VI типу, іншого представника III класу короткоспіральних молекул, виявлена в суглобовому хрящі (Eyre D.R., 1991; Thomas J.T. et al., 1994). Колаген VI типу утворює різні мікрофібрили і, можливо, концентрується в капсулярному матриксі хондрону (Poole C.A. et al., 1988).
Протеоглікани — це білки, до яких ковалентно приєднаний принаймні один глікозаміноглікановий ланцюг. Протеоглікани належать до одних із найскладіших біологічних макромолекул. Найбільше поширення протеоглікани мають у ПКМ хряща. Заплутані всередині мережі з колагенових фібрил гідрофільні протеоглікани виконують свою основну функцію — надають хрящу здатності зворотно деформуватися (Kuettner K.E., Thonar E.J.M.A., 1998). Припускають, що протеоглікани здійснюють і ряд інших функцій, суть яких до кінця ще не відома (Wight T., Mecham R., 1987; Hardingham T.E. et al., 1992; Sandy J.D., 1992).
Агрекан — основний протеоглікан суглобового хряща: він становить близько 90% загальної маси протеогліканів у тканині (Thonar E.J.M.A. et al., 1999). Його стрижневий білок масою 230 кД глікозильований безліччю ковалентно зв’язаних глікозаміногліканових ланцюгів, хондроїтину сульфату та кератану сульфату, а також N- і O-кінцевими олігосахаридами (Kiani C. et al., 2002) (рис. 3.3).
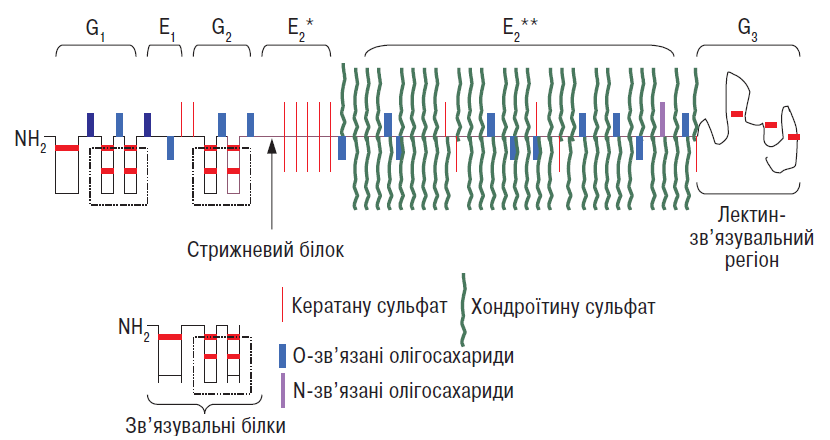
Рис. 3.3. Структура агрекану і молекулзв’язувальних білків. Три глобулярні домени (G1, G2, G3) в агрекані розділено двома сегментами (Е1 і Е2). Е1 несе на собі глікозаміноглікан хондроїтину сульфат, Е2 має два домени — той, що несе хондроїтину сульфати (*) і кератану сульфати (**) (за: Eyre D.R. et al., 1992, зі змінами)
Глікозаміногліканові ланцюги суглобового хряща, які становлять близько 90% загальної маси макромолекул, — кератану сульфат (являє собою послідовність із сульфатованого дисахариду N-ацетилглюкозамінгалактоза із множинними сульфатованими ділянками та інших моносахаридних залишків, таких як сіалова кислота) і хондроїтину сульфат (являє собою послідовність із дисахариду N-ацетилгалактозамін-глюкуронової кислоти із сульфатним ефіром, приєднаним до кожного четвертого або шостого атому вуглецю N-ацетилгалактозаміну).
Стрижневий білок агрекану містить три глобулярні (G1, G2, G3) і два міжглобулярні (Е1 і Е2) домени (див. рис. 3.3). N-кінцева ділянка містить G1— і G2-домени, розділені Е1-сегментом довжиною 21 нм. G3-домен, розміщений на С-кінцевій ділянці, відділений від G2 довшим (близько 260 нм) Е2-сегментом, який несе на собі >100 ланцюгів хондроїтину сульфатів, близько 15–25 ланцюгів кератану сульфатів, а також О-зв’язані олігосахариди. N-зв’язані олігосахариди виявляють головним чином у межах G1— і G2-доменів та Е1-сегмента, а також поблизу G3-регіона. Глікозаміноглікани групуються у двох регіонах: найбільш поширений (так званий регіон, багатий на хондроїтину сульфати) містить ланцюги хондроїтину сульфатів і близько 50% кератану сульфатних ланцюгів (Thonar E.J.M.A., Kuettner K.E., 1987). Регіон, багатий на кератану сульфати, локалізується на Е2-сегменті поблизу G2-домену й передує регіону, багатому на хондроїтину сульфати (Hardingham T.E. et al., 1992). Молекули агрекану також містять фосфатні ефіри, локалізовані насамперед на ксилозних залишках, які приєднують ланцюги хондроїтину сульфату до стрижневого білка; їх також виявляють на серинових залишках стрижневого білка (Thonar E.J.M.A. et al., 1999).
С-термінальний сегмент G3-домену складається з трьох складових, що включають ділянку гомологічну до епідермального фактору росту (ЕФР), зона високогомологічна до лектину типу С (також називається вуглеводорозпізнавальна зона), зона гомологічна до комплементзв’язувального протеїну.
Використовуючи анти-ЕФР поліклональні антитіла, ЕФР-подібний епітоп був локалізований усередині пептиду з масою 68 кД в агрекані суглобового хряща людини. При цьому він може складатися з ЕФР-1; -2 або обох одиниць (Fulop C. et al., 1993). Однак його функції вимагають уточнення (Kuettner К.E., Thonar E.J.M.A., 1998). Цей субдомен також виявлений у структурі молекул адгезії, що контролюють міграцію лімфоцитів (Hardingham T.E. et al., 1992). Складові зони гомологічної до лектину С, здатні зв’язуватися з фруктозою, манозою, а також тенасцином С (Halberg D.F., 1988), сульфітованими гліколіпідами (Miura R et al., 1999), та фібуліном-1 (Aspberg A. et al., 1999) та -2 (Olin A.I. et al., 2001).
Лише близько третини молекул агрекану, ізольованих зі зрілого суглобового хряща людини, містять інтактний G3-домен; імовірно, це пов’язано з тим, що у ПКМ молекули агрекану можуть бути зменшені в розмірах ферментним шляхом. Подальша доля і функція відщеплених фрагментів невідомі (Kuettner K.E., Thonar E.J.M.A., 1998).
Головним функціональним сегментом молекули агрекану є Е2-сегмент, що несе глікозаміноглікан. Ділянка, багата на кератану сульфати, містить амінокислоти пролін, серин і треонін. Більшість залишків серину і треоніну О-глікозильовані N-ацетилгалактозаміновими залишками, вони запускають синтез деяких олігосахаридів, які вбудовуються в ланцюг кератану сульфатів, тим самим подовжуючи їх. Інша частина Е2-сегмента містить більше 100 послідовностей серин — гліцин, у яких серин забезпечує прикріплення до ксилозильних залишків на початку ланцюгів хондроїтину сульфатів. Зазвичай і хондроїтин-6-сульфат, і хондроїтин-4-сульфат існують одночасно в межах однієї й тієї ж молекули протеоглікану, їх співвідношення варіює залежно від локалізації хрящової тканини і віку людини (Thonar E.J.M.A. et al., 1999, Roughley P. et al., 2006).
Структура молекул агрекану в матриксі суглобового хряща людини зазнає ряду змін у процесі дозрівання і старіння (Roughley Р.J., Mort J.S., 1986; Thonar E.J.M.A. et al., 1986; Thonar E.J.M.A., Kuettner К.E., 1987; Bayliss M.T., 1990). Зміни, пов’язані зі старінням, включають зменшення гідродинамічного розміру в результаті зміни середньої довжини ланцюгів хондроїтину сульфатів, збільшення кількості й довжини ланцюгів кератану сульфатів (Thonar E.J.M.A., Kuettner K.E., 1987). Молекули агрекану також зазнають ряду змін під дією протеолітичних ферментів (наприклад агреканази і стромілезину) на стрижневий білок (Plass A.H.K., Sandy J.D., 1995). Це призводить до прогресуючого зменшення середньої довжини стрижневого білка молекул агрекану.
Молекули агрекану синтезуються хондроцитами і секретуються у ПКМ, де вони формують агрегати, стабілізовані молекулами зв’язувальних білків. Ця агрегація містить у собі високоспецифічні нековалентні й кооперативні взаємодії між ниткою глюкуронової кислоти та майже 200 молекулами агреканів і зв’язувальних білків. Глюкуронова кислота — несульфатований лінійний глікозаміноглікан з великою молекулярною масою, що складається з безлічі послідовно зв’язаних молекул N-ацетилглюкозаміну і глюкуронової кислоти (Knudson C.B., Knudson W., 1993). Гіалуронова кислота розміщується переважно позаклітинно, перицелюлярно, але може локалізуватися й у внутрішньоклітинному просторі (Hascall V.C. et al., 2004). Роль гіалуронової кислоти полягає у створенні певних в’язкоеластичних властивостей деяких рідинних сполучних тканин, зокрема синовіальної рідини та скловидного тіла, вона регулює ступінь тканинної гідратації та транспорт води у тканинах. Крім того, встановлена здатність гіалуронової кислоти брати участь у мітозі, міграції клітин (Turley E.A. et al., 2002), запаленні (Hascall V.C. et al., 2004), розвитку пухлин (Turley E.A. et al., 2002) та їх метастазуванні (Toole B.P. et al., 2002). У хрящі гіалуронова кислота функціонує у супрамолекулярній сукупності з протеогліканами та стрижневим білком у структурі агрегатів (Pooley A.R. et al., 2001). Спарені петлі G1-домену агрекану (див. рис. 3.3) зворотно взаємодіють із п’ятьма послідовно розміщеними дисахаридами гіалуронової кислоти. Зв’язувальний білок, який містить аналогічні (високогомологічні) спарені петлі (Neame P.J. et al., 1987), взаємодіє з G1-доменом і молекулою гіалуронової кислоти та стабілізує структуру агрегату. Комплекс G1-домену — гіалуронова кислота — зв’язувальний білок формує високостабільну взаємодію, яка захищає G1-домен і зв’язувальний білок від дії протеолітичних ферментів. Ідентифіковано дві молекули зв’язувального білка з молекулярною масою 40–50 кД; вони відрізняються одна від одної ступенем глікозилювання. Тільки одна молекула зв’язувального білка є у місці зв’язку гіалуронова кислота — агрекан. Третя, дрібніша, молекула зв’язувального білка утворюється з великих шляхом протеолітичного відщеплення (Roughley P.J. et al., 1992).
Близько 200 молекул агрекану можуть зв’язуватися з однією молекулою гіалуронової кислоти з утворенням агрегату довжиною 8 мкм. В клітинноасоційованому матриксі, що складається з перицелюлярного і територіального відділів, агрегати зберігають свій зв’язок із клітинами шляхом зв’язування (через нитку гіалуронової кислоти) з CD44-подібними рецепторами на клітинній мембрані (Knudson C.B., Knudson W., 1993).
Утворення агрегатів у ПКМ — процес складний. Знову синтезовані молекули агрекану не відразу виявляють здатність зв’язуватися з гіалуроновою кислотою (Sandy J.D., Plass A.H.K., 1989). Це може служити регуляторним механізмом, що дозволяє знову синтезованим молекулам досягти міжтериторіальної зони матриксу перед тим, як вони будуть імобілізовані у великі агрегати (Mok S.S. et al., 1994). Кількість знову синтезованих молекул агрекану і зв’язувальних білків, здатних утворювати агрегати шляхом взаємодії з гіалуроновою кислотою, значно зменшується з віком (Bayliss М.T., 1992). Крім того, з віком значно зменшуються розміри агрегатів, виділені із суглобового хряща людини. Це частково пов’язано із зменшенням середньої довжини молекул гіалуронової кислоти і молекул агрекану.
Встановлено два види агрегатів у суглобовому хрящі (Manicourt D.H. et al., 1988). Середній розмір агрегатів першого виду — 60 S, агрегатів другого виду (швидко осаджувальні суперагрегати) — 120 S. Останній містить велику кількість молекул зв’язувального білка (Manicourt D.H. et al., 1988; Pita J.C. et al., 1992). Наявність цих суперагрегатів, можливо, відіграє велику роль у функціонуванні тканини; під час відновлення тканини після імобілізації кінцівки у середніх шарах суглобового хряща виявляють вищі їх концентрації, у суглобі, ураженому ОА, на ранніх стадіях захворювання їх розміри значно зменшуються (Pita J.C. et al., 1992).
Окрім колагену та протеогліканів, хрящ складається зі значної кількості позаклітинних білків, які мають численні функції, підтримуючи структуру матриксу, зокрема механічні властивості тканини, беруть участь у ізоляції факторів росту та протеїназ у окремих ділянках матриксу, а також відіграють важливу роль у взаємодії з клітинами, регулюючи таким чином їх активність. Функція деяких білків уже відома, але водночас у більшості випадків окремі функціональні властивості більшості білків мають бути уточнені.
Біглікан і декорин — молекули, що несуть дерматан сульфати, мають молекулярну масу близько 100 і 70 кД відповідно; маса їх стрижневого білка — близько 30 кД (Fisher L.W. et al., 1989). Молекули декорину та біглікану синтезуються у вигляді попередників (пропептидів з кінцевими амінокислотними залишками), частина якого може бути відокремлена у ході внутрішньоклітинного синтезу (Oldberg et al., 1996) або позаклітинно (Roughley et al., 1996).
У суглобовому хрящі людини молекула біглікану містить два ланцюги дерматан сульфату, в той час як декорин, який частіше виявляють, — тільки одну. Ці молекули становлять лише невелику частину протеогліканів у суглобовому хрящі, хоча їх може бути так само багато, як і великих агрегованих протеогліканів. Дрібні протеоглікани взаємодіють з іншими макромолекулами у ПКМ, включаючи колагенові фібрили, фібронектин, фактори росту та ін. (Kuettner K.E., Thonar E.J.M.A., 1998). Декорин спочатку локалізується на поверхні колагенових фібрил і пригнічує колагеновий фібрилогенез (Vogel K.G. et al., 1984; Scott J.E., 1990). Стрижневий протеїн міцно зв’язується з клітиннозв’язувальним доменом фібронектину, тим самим, імовірно, перешкоджаючи зв’язуванню останнього з рецепторами клітинної поверхні (інтегринами). У зв’язку з тим що і декорин, і біглікан зв’язуються з фібронектином і стримують адгезію та міграцію клітин, а також утворення тромбів, вони здатні пригнічувати процеси тканинної репарації (Rosenberg L., 1992). На користь значення декорину у фібрилогенезі колагену свідчать результати спостереження за тваринами з порушення синтезу молекули декорину, у яких розвивається витонченість (тендітність) шкірних покривів. Зазначене зниження опору на розтягнення може бути пояснене порушенням формування волокон колагену у шкірі. Крім того, незалежно від взаємодії з ТФР-β, декорин здатен пригнічувати клітинну проліферацію, впливаючи безпосередньо шляхом сигнальної трансдукції, викликаючи активацію інгібіторів циклінзалежної кінази (De Luca A. et al., 1996).
У свою чергу у мишей з дефіцитом біглікану (Young M.E. et al., 2002) відзначається зменшення кісткової маси, що посилюється з віком, а також порушення здатності до утворення кістки. Причиною цього може бути зниження здатності до утворення клітин строми (клітин-попередників кістки), що також характеризуються зниженням відповіді на вплив факторів росту, зниженням синтезу колагену та зростанням апоптозу.
Фібромодулін суглобового хряща — це протеоглікан з молекулярною масою 50–65 кД, асоційований з колагеновими фібрилами (Olberg A. et al., 1989). Його стрижневий протеїн, гомологічний стрижневим протеїнам декорину й біглікану, містить велику кількість залишків сульфату тирозину (Onnerfjord P. et al. 2004). Ця глікозильована форма фібромодуліну (раніше її називали матричний протеїн 59 кД) може брати участь у регуляції утворення і підтримці структури колагенових фібрил (Plass A.H.K. et al., 1992). Фібромодулін і декорин розміщуються на поверхні колагенових фібрил. Таким чином, як вказувалося раніше, збільшенню фібрили в діаметрі повинно передувати селективне видалення цих протеогліканів (а також молекул колагену IX типу) (Kuettner K.E., Thonar E.J.M.A., 1998).
Остеоадгерин (Wendel M. et al., 1998) складається з восьми залишків тирозину сульфату і характеризується іншим принципом групування порівняно з фібромодуліном (Onnerfjord P. et al. 2004). Небагато відомо про цей протеїн, який є більш типовим для кісткової тканини, але при цьому також може продукуватися й гіпертрофованими хондроцитами. Остеоадгерин здатен зв’язувати клітини через їх α2β3-інтегрини (Wendel M. et al. 1998), але деталі взаємодії до цього часу невідомі.
Особливістю структури хондроадгерину (Neame P.J. et al,, 1994) є формування подвійної дисульфідної петлі на С-кінці молекули, крім того унікальність цього білка полягає у відсутності його посттрансляційної модифікації (Larsson T. et al., 1991). Хондроадгерин здатен зв’язуватися з інтегринами α2β1, але при цьому не взаємодіє з жодним іншим колагензв’язувальним інтегрином (Camper L. et al., 1997). Цікавим є також той факт, що хондроадгерин може зв’язуватися з фібрилформуючим колагеном І та ІІ типу (Mansson B. et al., 2001). Імовірно, хондроадгерин може зв’язувати клітини з колагеном оточуючого матриксу. Але на сьогодні маловідомо про точні функції цього протеїну у хрящі, так само як і не встановлено значення його взаємодій з інтегринами. Відомо, що хондроадгерин є досить чітко локалізований у хрящі. Так, білок виявляється переважно у пластинках росту та у прегіпертрофічній ділянці (Shen Z. et al., 1998).
Суглобовий хрящ містить у ПКМ ряд білків, які не належать ні до протеогліканів, ні до колагенів (рис. 3.4). Вони взаємодіють з іншими макромолекулами з утворенням мережі, в яку включена більшість молекул ПКМ (Heingard D., Oldberg A., 1989; Heingard D. et al., 1995).
Анкорин — білок з масою 34 кД, локалізується на поверхні хондроцитів і в клітинній мембрані, опосередковує взаємодію між клітиною і матриксом. У зв’язку з його високою афінністю до колагену II типу він може виступати в якості механорецептора, що передає сигнал про змінений тиск на фібрилу хондроциту (von der Mark K. et al., 1986).
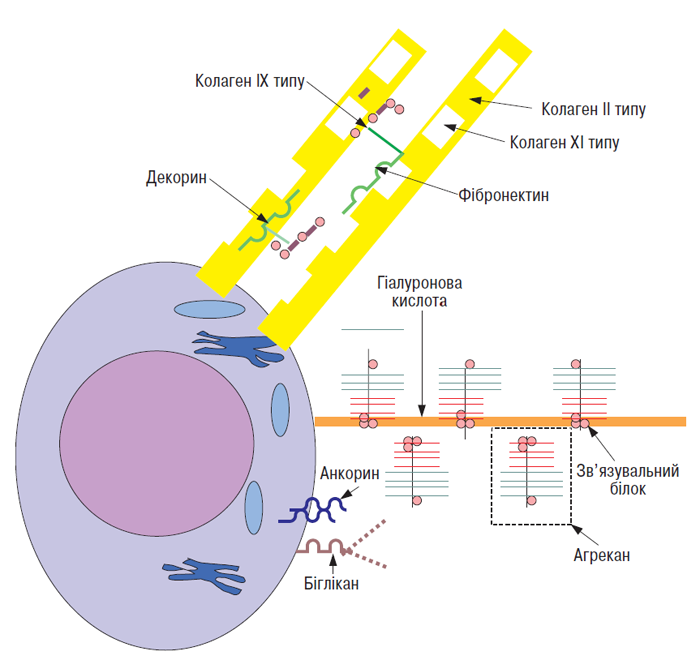
Рис. 3.4. Деякі макромолекули ПКМ суглобового хряща і їх можливі взаємодії. Колаген XI типу локалізований усередині волокон колагену ІІ типу, останні несуть на собі прикріплені молекули колагену ІХ типу. Декорин і фібромодулін можуть зв’язуватися з колагеновими фібрилами, можливо, за допомогою взаємодії їх негативно заряджених глікозаміногліканів з катіонними сегментами колагену ІХ типу. Протеоглікановий агрегат, що складається з агрекану зв’язувального білка і гіалуронової кислоти, пов’язаний із клітинною мембраною шляхом взаємодії гіалуронової кислоти і поверхневого рецептора клітини (за: Heingard D., Oldberg A., 1989, зі змінами)
Тенасцин С є членом родини тенасцинів, до складу якої входить чотири представники (С, R, W, X) (Chiquet-Ehrismann R., Tucker R.P., 2004), що характеризуються різною тканинною поширеністю. Тенасцин С є однією з цих молекул, яка достовірно присутня у хрящі у період росту та при різноманітних патологічних станах (Salter D.M., 1993; Mackie E.J., Ramsey S. et al., 1996). Білок також продукується фібробластами, включаючи ті, що входять до складу строми пухлин, клітини гладких м’язів та нервової системи (Chiquet-Ehrismann R., Tucker R.P., 2004). Однією із функцій тенасцину є регуляція клітинного стану. Так, він здатен зв’язуватися з фібронектином, блокуючи його взаємодію з синдеканом (Chiquet-Ehrismann R., Tucker R.P., 2004), що є важливим у процесі клітинної міграції. Роль тенасцину при патології хряща підтверджується зростанням його продукції у хрящі хворих на ОА (Salter D.M., 1993).
Фібриліни. Вивченню фібрилінів приділяється велика увага, частково внаслідок того, що серія мутацій, що виникають у різних частинах молекули, призводить до розвитку чисельних фенотипів, наприклад синдрому Марфана (Robison P.N. et al., 2006). Наразі відомо три варіанти фібрилінів, кожен з яких характеризується доволі великою структурою. Так, фібрилін-1 складається майже з 1100 амінокислотних залишків.
Фібриліни — білки, які здатні до формування мікрофібрил (Kielty C.M. et al., 2005) та виявляються у надмірній кількості у ділянках, де тканина піддається механічному стресу (Kielty C.M. et al.,2002).Чітка молекулярна організація цих волокон залишається невідомою, проте без сумніву вона є надзвичайно важливою. Відомо, що міжмолекулярні з’єднання утворюються за допомогою трансглутамінази і мають важливе значення для підтримки стабільності волокна. Одними з молекул, що здатні взаємодіяти з фібриліновими волокнами, є мікрофібриласоційований глікопротеїн-1 та -2 (Penner A.S. et al., 2002; Kielty C.M. et al., 2005). Крім того, мікрофібриласоційований глікопротеїн-1 здатен взаємодіяти також з α3-ланцюгом колагену IV типу, опосередковуючи утворення сітки матриксу (Cain S.A. et al., 2006). Фібрилін може з’єднуватися з гепарином, ця взаємодія може сприяти їх зв’язку з протеогліканами клітинної мембрани, зокрема синдеканом та глипіканом. На ранніх стадіях ембріогенезу фібрилін експресується у кінцівках, але не в самому хрящі, а переважно у перихондріумі. На більш пізніх стадіях та протягом періоду росту організму фібрилін утворює сітку фібрил у матриксі хряща. Пізніше зазначені фібрили реорганізуються з утворенням грубіших волокон у матриксі, що оточує хондроцити (Keene D.R. et al., 1997).
Фібронектин — компонент більшості хрящових тканин, незначною мірою відрізняється від фібронектину плазми крові (Kuettner K.E., Thonar Е.J.M.A., 1998). Припускають, що фібронектин сприяє інтеграції матриксу шляхом взаємодії із клітинними мембранами та іншими складовими матриксу, такими як колаген II типу і тромбоспондин (Heingard D. et al., 1995). Фрагменти фібронектину негативно впливають на метаболізм хондроцитів — пригнічують синтез агрекану, стимулюють катаболічні процеси. Встановлено, що синтез та концентрація фібронектину суттєво зростає у хрящі при ОА (Lorenzo P., et al., 2004). Зазначений факт хоч і є порівняно ранньою подією при ОА, але при цьому цей стан зберігається протягом усього процесу розвитку хвороби. Крім того, у суглобовій рідині хворих на ОА виявлена висока концентрація фрагментів фібронектину, таким чином, вони можуть брати участь у патогенезі захворювання і на пізніх стадіях (Homandberg G.A. et al., 1992). Імовірно, такі ефекти мають і фрагменти інших матричних молекул, які зв’язуються з рецепторами хондроцитів (Poole A.R., 1995).
Тромбосподини — це білки, побудовані з певної кількості однакових структурних одиниць, що наділені чисельними функціями. Складаються зазначені білки з трьох (тромбосподин-1 або -2) або п’яти (тромбосподин-3; -4 або 5) ідентичних частин.
Олігомерний матричний протеїн хряща — член суперродини тромбоспондинів, зокрема тромбосподину-5 (Adams J.C., Lawler J., 2004; Hankenson K.D. et al., 2005), являє собою пентамер з п’ятьма ідентичними субодиницями з молекулярною масою близько 83 кД. У хрящі ідентифіковано переважно тромбосподин-1; -3 або 5/олігомерний матричний протеїн хряща, причому останній є домінуючим (Lorenzo P. et al., 2004). Тромбосподини виявляють у великій кількості в суглобовому хрящі, особливо у шарі проліферуючих клітин у тканині, що росте. Тому, можливо, олігомерний матричний протеїн хряща бере участь у регуляції росту клітин (Heingard D. et al., 1995). У значно нижчій концентрації їх виявляють у ПКМ зрілого суглобового хряща (Heingard D. et al., 1995). Олігомерний матричний протеїн хряща здатен зв’язувати молекули колагену І та ІІ типу, сприяючи більш швидкому та посиленому фібрилогенезу колагену. При цьому молекула олігомерного матричного протеїну хряща є одночасно зв’язаною з декількома молекулами колагену, розміщуючи їх дуже близько та сприяючи їх з’єднанню при формуванні фібрил (Rosenberg K. et al., 1998). Олігомерний матричний протеїн хряща може також взаємодіяти з колагеном ІХ типу, а також фібронектином (Di Cesare P.E. et al., 2002). Але до цього часу невідомо чи виникає останній взаємозв’язок in vivo та чи впливає це на окремі функції фібронектину, такі як взаємодія з клітинною мембраною.
Синтез та надмірна кількість олігомерного матричного протеїну хряща у матриксі суттєво зростає на ранніх стадіях ОА (Lorenzo P. et al., 2004), навіть на дуже ранніх та доклінічних його стадіях. Розподіл білка у нормальному хрящі дорослого змінюється від міжтериторіального матриксу у напрямку до перицелюлярного матриксу залежно від супутньої деградації та нових відкладень у різних ділянках.
Матриліни — це родина білків, представлена у різноманітних тканинах у вигляді чотирьох одиниць (від 1 до 4) (Deak F. et al., 1999), які є продуктами різних генів і представляють собою мультимерні білки, що складаються з трьох або чотирьох ланцюгів. У хрящі представлений переважно матрилін-1 та -3 (Segat D. et al., 2000). При цьому, якщо матрилін-3 присутній у більшості хрящів, матрилін-1 має більш обмежену поширеність. Зокрема він присутній у тканинах молодого організму, що росте, і в надлишку виявляється у хрящах трахеї. Водночас матрилін-1 не виявляють ані у суглобовому хрящі, ані у структурах міжхребцевого диску (Paulsson M. et al., 1984). У випадку мутацій у генах, що кодують синтез матрилінів, у пацієнтів розвивається множинна епіфізарна дисплазія з аномаліями росту скелета (Cotterill S.L. et al., 2005). У свою чергу при імунізації матриліном-1 мишей чи щурів з певною генетичною схильністю розвивалося тяжке захворювання органів дихання в результаті вираженої аутоімунної та запальної реакції у трахеї (Hansson A-S. et al., 1999). У тварин також виявляють ураження інших тканин, де був виявлений зазначений білок, наприклад носової перетинки. Проте ураження суглобів не відзначали.
CLIP (cartilage intermediate layer protein) — білок проміжного шару хряща, вперше був ідентифікований як компонент суглобового хряща, рівень якого зростає на ранніх стадіях ОА (Lorenzo P. et al., 2004). Було встановлено, що цей білок локалізується переважно у міжтериторіальному матриксі всередині суглобового хряща дорослої людини. На сьогодні досить мало відомо про роль СLIP, але вже встановлено, що його кількість значно зростає при ОА і може служити антигеном при захворюваннях суглобів (Yao Z. et al., 2004). Також існує припущення, що CLIP може бути регулятором активності ІФР у клітинах (Johnson K. et al., 2003).
До матричних протеїнів також належать:
- основний матричний протеїн (36 кД), що має високу афінність до хондроцитів, може опосередковувати взаємодію клітин у ПКМ, наприклад під час ремоделювання тканини;
- GP-39 (39 кД) експресується у поверхневому шарі суглобового хряща і у синовіальній мембрані (його функції невідомі) (Heingard D. et al., 1995);
- 21 кД-протеїн синтезується гіпертрофованими хондроцитами, взаємодіє з колагеном Х типу, може функціонувати у зоні хвилястої границі (Heingard D. et al., 1995).
Крім того, хондроцити експресують неглікозильовані форми малих неагрегованих протеогліканів на певних стадіях розвитку хряща та у патологічних умовах, проте їх специфічна функція на сьогодні не вивчається.
Функціональні властивості суглобового хряща
Молекули агрекану передають здатність суглобовому хрящу переносити оборотну деформацію (Maroudas A. et al., 1992). Вони демонструють специфічні взаємодії всередині позаклітинного простору й, безсумнівно, відіграють важливу роль в організації, структурі та функції ПКМ. У хрящовій тканині молекули агрекану досягають концентрації 100 мг/мл (Thonar E.J.M.A. et al., 1999). У хрящі молекули агрекану стиснуті до 20% об’єму, який вони займають у розчині. Тривимірна мережа, утворена фібрилами колагену, надає тканині властиву їй форму й запобігає збільшенню об’єму протеогліканів. Усередині колагенової мережі нерухливі протеоглікани несуть великий негативний електричний заряд (містять велику кількість аніонних груп), який дозволяє взаємодіяти з рухливими катіонними групами інтерстиціальної рідини (Kuettner K.E., Thonar E.J.M.A., 1998). Взаємодіючи з водою, протеоглікани забезпечують так званий тиск набрякання, якому протидіє колагенова мережа (Maroudas A., 1975).
Наявність води у ПКМ є дуже важливим моментом. Вода визначає об’єм тканини; пов’язана із протеогліканами вона забезпечує опір стисненню. Крім того, вода забезпечує транспорт молекул і дифузію у ПКМ. Висока щільність негативного заряду на великих протеогліканах, фіксованих у тканині, створює ефект виключеного об’єму (Kuettner K.E., Thonar E.J.M.A., 1998). Розмір пор усередині концентрованого розчину протеогліканів настільки малий, що дифузія великих глобулярних білків у тканину різко обмежена (Urban J.P.G., 1990). ПКМ відштовхує дрібні негативно заряджені (наприклад іони хлору) і великі (такі як альбумін та імуноглобуліни) білки. Розмір комірок усередині щільної мережі з колагенових фібрил і протеогліканів можна порівняти лише з розмірами деяких неорганічних молекул (наприклад натрію й калію, але не кальцію).
У ПКМ певна кількість води присутня в колагенових фібрилах. Фізико-хімічні й біомеханічні властивості хряща визначає екстрафібрилярний простір (Maroudas A. et al., 1992). Вміст води у внутрішньофібрилярному просторі залежить від концентрації протеогліканів в екстрафібрилярному просторі і підвищується при зниженні концентрації останніх.
Фіксований негативний заряд на протеогліканах визначає іонний склад позаклітинного середовища, що містить вільні катіони у високій концентрації і вільні аніони у низькій концентрації (Urban J.P.G., 1990). Унаслідок підвищення концентрації молекул агрекану від поверхневої до глибокої зони хряща змінюється іонне середовище тканини. Концентрація неорганічних іонів у ПКМ створює високий осмотичний тиск.
Властивості хряща як матеріалу залежать від взаємодії колагенових фібрил, протеогліканів і рідкої фази тканини. Структурні й композиційні зміни, пов’язані з невідповідністю між процесами синтезу і катаболізму, деградацією макромолекул і фізичною травмою, значно впливають на матеріальні властивості хряща та змінюють його функцію. У зв’язку зі зміною концентрації, розподілу і макромолекулярної організації колагенів і протеогліканів залежно від глибини зони хряща, варіюють біомеханічні властивості кожної зони. Наприклад, поверхнева зона з її високою концентрацією колагену, тангенціально розміщеними фібрилами, відносно низькою концентрацією протеогліканів має найбільш виражені властивості протидії розтягненню, розподіляючи навантаження рівномірно по всій поверхні тканини (Kuettner K.E., Thonar E.J.M.A., 1998). У перехідній і глибокій зонах висока концентрація протеогліканів надає тканині властивість переносити компресійне навантаження. На рівні хвилястої границі матеріальні властивості хряща різко змінюються від м’якої некальцифікованої зони до більш твердого мінералізованого хряща (Donohue J.M. et al., 1983). У ділянці хвилястої границі міцність тканини забезпечується колагеновою мережею. Колагенові фібрили не перетинають оточуючих відділів хряща; у ділянці кістково-хрящового з’єднання міцність тканини забезпечується особливими контурами границі між зонами некальцифікованого і кальцифікованого хряща у вигляді нерегулярних пальцеподібних виростів, які замикають два шари і перешкоджають їх поділу. Кальцифікований хрящ менш щільний, ніж субхондральна кістка, таким чином, він виконує функцію проміжного шару, який пом’якшує компресійне навантаження на хрящ і передає її субхондральній кістці (Radin E.L. et al., 1984).
Під час навантаження відбувається складний розподіл трьох сил — розтягання, зрушення і стиснення. Суглобний матрикс деформується за рахунок вигнання води (а також продуктів метаболізму клітин) із зони навантаження, підвищується концентрація іонів в інтерстиціальній рідині (рис. 3.5) (Urban J.P.G., 1994). Рух води прямо залежить від тривалості й сили прикладеного навантаження і затримується негативним зарядом протеогліканів (Torzilli P.A., 1988; Maroudas A., Grushko G., 1990). Під час деформації тканини протеоглікани більш щільно притискуються один до одного, тим самим ефективно підвищуючи щільність негативного заряду, а міжмолекулярні, відштовхуючи негативний заряд сили, у свою чергу підвищують опір тканини подальшій деформації. Врешті деформація досягає рівноваги, у якій зовнішні сили навантаження врівноважені внутрішніми силами опору — тиском набрякання (взаємодія протеогліканів з іонами) і механічним стресом (взаємодія протеогліканів і колагенів). Коли навантаження усунуте, хрящова тканина набуває своєї вихідної форми шляхом всмоктування води разом з поживними речовинами. Вихідна (до навантаження) форма тканини досягається тоді, коли тиск набрякання протеогліканів урівноважується опором колагенової мережі їх поширенню.
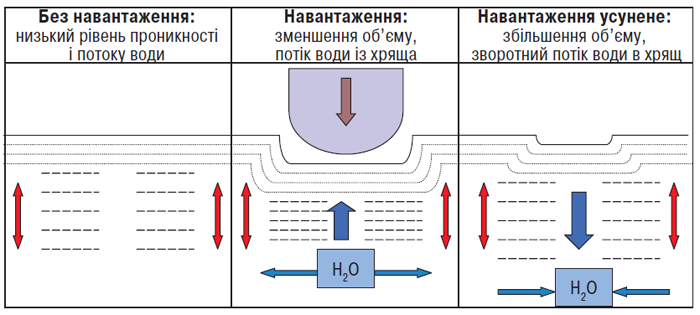
Рис. 3.5. Потік води в суглобовому хрящі під дією навантаження і без нього (за: Kuettner K.E., Thonar E.J.M.A., 1998)
Без навантаження більша частина води в тканині пов’язана з протеогліканами. Під дією навантаження вода рухається в бік навантаження (вбік синовіальної порожнини), захоплюючи із собою продукти клітинного метаболізму. (Невелика кількість води спрямовується вниз і в сторони — у зони, багаті на протеоглікани). Як тільки навантаження усунуте, вода повертається із синовіальної порожнини, приносячи з собою поживні речовини для клітин. При ОА концентрація протеогліканів знижена, тому при навантаженні потік води спрямовується не тільки у вертикальному напрямку в синовіальну порожнину, але й в інших напрямках, що зменшує забезпечення клітин поживними речовинами (Kuettner K.E., Thonar E.J.M.A., 1998).
Біомеханічні властивості суглобового хряща ґрунтуються на структурній цілісності тканини — колагеново-протеоглікановій композиції як твердої фази і води та розчинених у ній іонах як рідкої фази (Myers Е.R. et al., 1984). Поза навантаженням гідростатичний тиск суглобового хряща становить близько 1–2 атм. Цей гідростатичний тиск може підвищуватися in vivo до 100–200 атм./мс під час стояння та до 40–50 атм. під час ходьби. Дослідження in vitro показали, що гідростатичний тиск 50–150 атм. (фізіологічний) протягом короткого проміжку часу зумовлює помірний ріст хрящового анаболізму, протягом 2 год — призводить до втрати хрящем рідини, але не викликає будь-яких інших змін (Sah R.L. et al., 1992). Залишається невирішеним питання, наскільки швидко хондроцити реагують in vivo на такого роду навантаження.
Індуковане зменшення гідратації з наступним підвищенням концентрації протеогліканів призводить до притягання позитивно заряджених іонів, таких як Н+ і Na+ (Urban J., Hall A., 1992). Це призводить до зміни загального іонного складу та рН ПКМ і хондроцитів. Тривале навантаження індукує зниження рН і одночасне зниження синтезу протеогліканів хондроцитами. Можливо, вплив позаклітинного іонного середовища на синтетичні процеси також частково пов’язаний з його впливом на склад ПКМ. Знову синтезовані молекули агрекану в слабкокислому середовищі пізніше, ніж у нормальних умовах, дозрівають в агреговані форми (Plaas A.H.K., Sandy J.D., 1986). Імовірно, зниження рН навколо хондроцитів (наприклад під час навантаження) дозволяє більшій кількості знову синтезованих молекул агрекану досягти міжтериторіального матриксу (Mok S.S. et al., 1994).
Імобілізація або невелике навантаження призводить до помітного зниження синтетичних процесів у хрящовій тканині та вмісту протеогліканів, тоді як збільшення динамічного навантаження зумовлює помірне підвищення синтезу та вмісту протеогліканів (Palmoski M.J., Brandt K.D., 1981). Напружені тренування (20 км/день протягом 15 тиж) у собак викликали зміни вмісту протеогліканів, зокрема різке зниження їх концентрації в поверхневій зоні (Helminen H.J. et al., 1992). Відбулося деяке оборотне розм’якшення хряща й ремоделювання субхондральної кістки. Більше статичне навантаження, проте, викликало ушкодження хряща й наступну дегенерацію. Крім того, втрата агрекану ПКМ ініціює аномальні зміни, характерні для ОА (Helminen H.J. et al., 1992). Втрата агрекану призводить до притягання води і набрякання невеликої кількості протеогліканів, що залишилася. Це розчинення агрекану сприяє зниженню щільності локального фіксованого заряду і в результаті призводить до зміни осмолярності.