Епідеміологія остеоартрозу
Содержание
ПОШИРЕНІСТЬ І ЗАХВОРЮВАНІСТЬ
Хвороби кістково-м’язової системи, об’єднані в XIII клас МКХ, розглядаються в усьому світі як одна з найпоширеніших патологій сучасного суспільства (Насонова В.А. и соавт., 2000; табл. 1.1). Серед них остеоартроз (ОА) — найбільш поширена патологія синовіальних суглобів. Поширеність ОА в популяції (6,43%) корелює з віком і досягає максимальних показників (13,9%) у осіб віком старше 45 років (Цветкова Е.С., 1997).
Нещодавно в дослідженні R.С. Lawrence та співавторів (2008) встановлено, що у 26,9 млн американців віком старше 25 років наявні клінічні симптоми ОА якогось суглоба. Згідно з даними ВООЗ ОА є причиною непрацездатності щонайменше 10% популяції осіб віком старше 60 років (Global Economic and Health Care Burden of Musculoskeletal Disease, 2001), а рентгенологічні ознаки ОА виявляються у більше ніж 85% людей віком старше 60 років (Коваленко В.М., Корнацький В.М., 2009; Murphy L. et al., 2008). За даними статистичної звітності за 2008 р. захворюваність на ОА в Україні становить 226 545 (598,3 на 100 тис. населення), а поширеність — 1 229 380 (3426,6 на 100 тис. населення) відповідно (табл. 1.2) (Коваленко В.М., Корнацький В.М., 2009). Статистичні показники в Україні суттєво нижчі світових, але це пов’язане з тим, що населення надто пізно звертається до лікаря — при значному ураженні суглобів, часто у запущених випадках, коли єдиним виходом для пацієнта є ендопротезування суглобів. Слід відзначити, що показник поширеності ОА за період з 2005 р., коли вийшло з друку друге видання цієї настанови, до 2008 р. зріс як серед дорослого (від 2995,8 до 3246,6), так і серед працездатного населення (від 1318,8 до 1428, 6) більше ніж на 8%.
Залишається високою відмінність показників у регіонах України. Так, показники поширеності цієї хвороби в Черкаській (7052,1) та Житомирській (6665,7) областях більше ніж у 2 рази вищі середніх по Україні. При цьому у Луганській області показник в 2,5 раза менший (1453,8). Значно вища за середні показники захворюваність в Івано-Франківській та Дніпропетровській областях, в тому числі у працездатного населення (див. табл. 1.2). Аналіз подібної тенденції утруднений.
Таблиця 1.1
Захворюваність на ревматичні хвороби в різних країнах світу (за: Ciocci A., 1999)
| Країна | Загальна кількість випадків, млн | Кількість випадків на 100 тис. населення | Рік | Посилання |
| Нідерланди | — | 18,5 | 1975 | Служба соціального забезпечення |
| ФРН | 20 | 16 | 1974 | Федеральна служба статистики |
| Австрія | — | 15,4 | 1977 | Josenhans |
| Данія | 0,560 | 14 | 1957 | Robecchi et al. |
| Великобританія | 5,8 | 11 | 1976 | ЛБР* Великобританії |
| Франція | 4 | 8 | 1976 | Rubens-Duval і Chaouat |
| США | 20 | 7 | 1976 | Public Health Service Arthritis Foundation |
| Швейцарія | — | 8–13 | 1977 | Федеративна ЛБР |
| Італія | 5,5 | 10 | 1986 | Італійська ЛБР |
| Іспанія | 4 | 12,7 | 1992 | Іспанська ЛБР |
| В усьому світі | 200 | 4 | 1971 | ВООЗ |
*ЛБР — Ліга боротьби з ревматизмом.
Таблиця 1.2
Динаміка показників поширеності й захворюваності на артроз у 1999–2001, 2003, 2008 р. на 100 тис. дорослого населення (за даним Державної статистичної звітності України, 2008 р.)
| Регіон, обл. | Поширеність артрозу | Захворюваність на артроз | ||||||||
| 1999 | 2000 | 2001 | 2003 | 2008 | 1999 | 2000 | 2001 | 2003 | 2008 | |
| Україна | 1790 | 1968,5 | 2200,6 | 2515,7 | 3246,6 | 420 | 453,84 | 497,1 | 527,0 | 1703,5 |
| АР Крим | 1037 | 1175,18 | 1422,0 | 1539,6 | 1594,3 | 269 | 319,5 | 312,3 | 323,2 | 711,6 |
| Вінницька | 3175 | 3317,16 | 3625,1 | 3886,8 | 4730,7 | 591 | 650,77 | 586,3 | 656,7 | 3527,3 |
| Волинська | 3094 | 3261,79 | 3378,9 | 3463,1 | 3781,1 | 446 | 526,29 | 538,2 | 514,0 | 1276,9 |
| Дніпропетровська | 1894 | 2104,64 | 2377,8 | 2556,5 | 3467,8 | 602 | 676,01 | 745,2 | 695,1 | 1467,3 |
| Донецька | 2668 | 2709,95 | 3012,5 | 3372,7 | 4230,8 | 460 | 453,66 | 566,8 | 565,3 | 3449,2 |
| Житомирська | 2107 | 3319,27 | 4552,0 | 5541,2 | 6665,7 | 426 | 488,2 | 677,1 | 477,5 | 3576,8 |
| Закарпатська | 977 | 1335,24 | 2136,9 | 2590,9 | 3264,6 | 337 | 473,25 | 668,0 | 706,9 | 2110,5 |
| Запорізька | 1207 | 1210,53 | 1234,4 | 1742,5 | 2102,2 | 356 | 279,16 | 335,3 | 368,7 | 1296,7 |
| Івано-Франківська | 3645 | 3963,99 | 4159,3 | 4496,5 | 4469,2 | 780 | 937,84 | 962,3 | 1080,2 | 1426,1 |
| Київська | 1287 | 1459,4 | 1550,1 | 1612,5 | 2032,7 | 352 | 411,77 | 415,6 | 386,0 | 645,1 |
| Кіровоградська | 1988 | 2237,42 | 2465,7 | 3013,4 | 3550,1 | 365 | 435,47 | 439,3 | 473,7 | 1155,7 |
| Луганська | 1161 | 1138,77 | 1168,3 | 1221,7 | 1453,8 | 350 | 330,82 | 339,7 | 344,6 | 776,2 |
| Львівська | 700 | 764,38 | 877,7 | 1084,1 | 1569,6 | 310 | 290,6 | 365,5 | 443,5 | 749,1 |
| Миколаївська | 668 | 796,98 | 894,4 | 1128,5 | 1934,0 | 204 | 238,31 | 271,2 | 301,5 | 749,0 |
| Одеська | 2239 | 2355,66 | 2478,5 | 2544,4 | 3284,6 | 535 | 556,55 | 575,5 | 346,2 | 1031,5 |
| Полтавська | 829 | 970,93 | 1032,8 | 1197,4 | 2181,2 | 321 | 366,7 | 364,6 | 402,8 | 1271,0 |
| Рівненська | 1075 | 1063,28 | 1107,8 | 1325,4 | 1910,2 | 239 | 238,78 | 239,3 | 309,4 | 1188,3 |
| Сумська | 1606 | 1828,03 | 2115,5 | 2307,5 | 2866,9 | 365 | 420,15 | 465,4 | 440,6 | 2212,3 |
| Тернопільська | 1896 | 2072,99 | 2113,6 | 2265,5 | 2822,7 | 234 | 282,82 | 273,6 | 342,3 | 1374,4 |
| Харківська | 1189 | 1265,75 | 1317,6 | 1899,1 | 3831,3 | 323 | 357,28 | 456,9 | 614,8 | 2064,7 |
| Херсонська | 2109 | 2677,82 | 3074,3 | 4147,0 | 4796,5 | 775 | 724,55 | 797,0 | 925,6 | 3048,4 |
| Хмельницька | 1318 | 1451,12 | 1480,0 | 1732,8 | 2728,8 | 257 | 298,94 | 296,5 | 383,0 | 1490,1 |
| Черкаська | 2950 | 3437,19 | 4420,0 | 5224,1 | 7052,1 | 534 | 675,5 | 660,9 | 712,4 | 2864,7 |
| Чернівецька | 3447 | 3811,79 | 3909,9 | 3910,8 | 4540,7 | 417 | 681,84 | 370,8 | 452,0 | 2567,5 |
| Чернігівська | 2253 | 2304,32 | 2539,8 | 2567,5 | 3218,9 | 517 | 433,2 | 539,3 | 494,3 | 1359,8 |
| м. Київ | 1239 | 1419,51 | 1559,3 | 2040,0 | 2641,6 | 395 | 405,29 | 467,3 | 591,3 | 765,7 |
| м. Севастополь | 1665 | 1653,92 | 1789,1 | 2274,2 | 2559,3 | 384 | 343,9 | 397,8 | 467,1 | 384,7 |
Відносно даних про поширеність ОА у світі слід зауважити, що в різних епідеміологічних дослідженнях, як правило, використовували два види критеріїв діагностики хвороби — рентгенологічні за класифікацією Келлгрена — Лоуренса (Kellgren J., Lawrence J., 1957) і критерії АСR (Altman R. et al., 1986; 1990; 1991). Відповідно до останніх діагноз ОА встановлюється лише за наявності основної ознаки — біль у суглобах протягом більшості днів попереднього місяця. Очевидно, що поширеність ОА, яка оцінюється із застосуванням різних критеріїв, буде різною та, ймовірно, що цей показник буде заниженим при використанні критеріїв АCR порівняно із традиційною рентгенологічною оцінкою (рис. 1.1) (Hart D.-J. et al., 1991; Spector Т.О., Hochberg M.C., 1994; Loesser R.F., 2000).
У США найбільш глибоко епідеміологію ОА було вивчено в рамках двох національних програм — National Health Examination Survey (NHES) і First National Health and Nutrition Examination Survey (NHANES-I), які проводилися з 1960 по 1962 р. і з 1971 по 1975 р. відповідно (National Center for Health Statistics, 1966; Maurer K., 1979). Пізніше дані цих двох досліджень було узагальнено National Arthritis Data Work Group у 1989 і 1998 р. (Lawrence R.C. et al., 1989; 1998). Діагностика ОА базувалася на рентгенологічних ознаках ОА суглобів кистей та нижніх кінцівок (NHES) та колінних і кульшових суглобів (NHANES-I). В останньому дослідженні при діагностиці ОА також враховували клінічну картину хвороби.
За даним NHES і NHANES-I у близько ⅓ осіб віком від 25 до 74 років виявляють рентгенологічні ознаки ОА щонайменше однієї локалізації. Зокрема, у 33% виявлено достовірний ОА суглобів кистей, 22% — ОА суглобів стоп, 4% — колінних суглобів (Lawrence R.C. et al., 1989). Серед осіб віком від 55 до 74 років ОА суглобів кистей діагностовано у 70%, суглобів стоп — у 40%, гонартроз — у 10%, коксартроз — у 3% (Lawrence R.C. et al., 1998). Серед 6913 обстежених у рамках NHANES-I ОА діагностовано у 12% осіб віком від 25 до 74 років (Maurer K., 1979). Подібні дані приводять також S.A. Oliveria та співавтори (1995) (див. рис. 1.1; рис. 1.2).

Рис. 1.1. Поширеність ОА, діагностованого патологоанатомічно, рентгенологічно і клінічно (Loesser R.F., 2000)
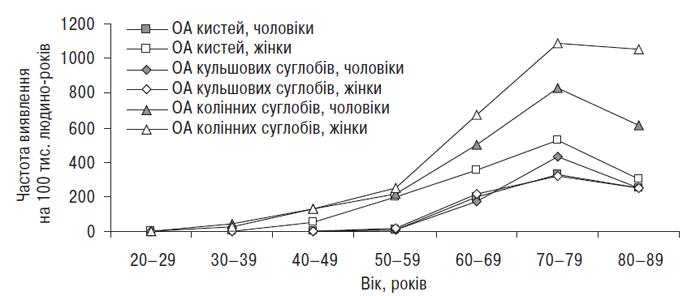
Рис. 1.2. Частота різних локалізацій клінічно маніфестованого ОА залежно від віку та статі (за: Oliveria S.A. et al., 1995)
Аналізуючи дані за 1990 р., National Arthritis Data Work Group зробила висновок, що у понад 20 млн дорослого населення США відзначають клінічні ознаки ОА (Lawrence R.C. et al., 1998).
За даними Framingham Osteoarthritis Study (дослідження поширеності ОА серед американців — представників європеоїдної раси віком від 63 до 93 років), у ⅓ осіб виявляють достовірні рентгенологічні ознаки ОА колінного суглоба (Felson D.T. et al., 1987). Аналогічні дані одержано при проведенні Baltimore Longitudinal Study on Aging (Lethbridhe-Cejku M. et al., 1994).
Поширеність маніфестного ОА колінних суглобів вивчали у NHANES-I і Framingham Osteoarthritis Study. ОА вважали маніфестним, якщо пацієнт скаржився на біль у колінних суглобах протягом більшості днів щонайменше 1 міс. За даними NHANES-I поширеність маніфестного гонартрозу становила 1,6% серед осіб віком 25–74 років (Maurer K., 1979), за даними Framingham Osteoarthritis Study — 9,5% серед осіб віком 63–93 років (Felson D.T. et al., 1987).
Проведене в 1990 р. в Іспанії дослідження — анкетування поширеності ревматичних хвороб показало, що в повідомленнях 12,7% респондентів (25,7% віком старше 60 років) є скарги, характерні для деяких ревматичних хвороб, з яких 43% (29,4% чоловіків і 52,3% жінок) скаржилися на наявність симптомів ОА (Martin P. et al., 1992).
Таблиця 1.3
Структура захворюваності на ревматичні хвороби в Італії в 1994 р. (за: Ciocci A., 1996)
| Захворювання | Загальна кількість хворих | Частка від загальної кількості пацієнтів із ревматичними хворобами, % |
| ОА | 4 млн | 72,63 |
| Позасуглобовий ревматизм | 700 тис. | 12,71 |
| Ревматоїдний артрит (РА) | 410 тис. | 7,45 |
| Анкілозивний спондиліт | 151 тис. | 2,74 |
| Подагричний артрит | 112 тис. | 2,03 |
| Хвороби сполучної тканини | 33,6 тис. | 0,61 |
| Гострий ревматичний артрит | 500 тис. | 0,01 |
| Інші ревмопатії | 100 тис. | 1,82 |
| Усього | 5 млн 500 тис. | 100 |
За даними 1994 р. в Італії налічувалося 4 млн хворих на ОА, що становило 72% серед пацієнтів із ревматичними захворюваннями (табл. 1.3) (Ciocci A., 1996).
За даними епідеміологічного дослідження щодо поширеності хронічних хвороб у гірських районах Шотландії, поширеність маніфестного ОА становила 65 на 1000 населення (Steven M.M., 1992).
I. Petersson (1996) виявив ОА суглобів кистей у 10% осіб віком 40–49 років і у 92% (понад 90% жінок, 80% чоловіків) віком старше 70 років, які проживають у Європі. У популяціях Швеції та Нідерландів поширеність ОА суглобів кистей у віковій групі старше 70 років становила 92 і 75%, у осіб старше 15 років — 22 і 29% відповідно.
У Великобританії поширеність коксартрозу III–IV стадії за класифікацією Келлгрена — Лоуренса у віковій групі старше 55 років становила 8,4% серед жінок і 3,1% — серед чоловіків (Kellgren J.A., Lawrence J.S., 1958). У Нідерландах поширеність ОА серед осіб вікової групи старше 60 років оцінюється як 5,6% у жінок і 3,7% — у чоловіків (Jоrring K., 1980). У проспективному дослідженні 12 051 рентгенограми у Швеції виявлено, що поширеність коксартрозу підвищується від менше 1% у віковій групі молодше 55 років до 10% — у осіб старше 85 років; середня поширеність ОА серед осіб понад 55 років становила 3,1% без урахування гендерних відмінностей. (Lindberg H., 1985). У Нідерландах поширеність коксартрозу II–IV стадії за класифікацією Келлгрена — Лоуренса становить близько 3% у віковій групі 45–49 років (van Saase J.L.C.M., 1966).
За результатами різних досліджень поширеність ОА колінних суглобів широко варіює. Так, за даними J.A. Kellgren і J.S. Lawrence (1958), у віковій групі 55–64 роки серед жінок цей показник становив 40,7%, серед чоловіків — 29,8%. T.D. Spector та співавтори (1991) виявили ОА колінних суглобів у 2,9% жінок віком 45–65 років. У рамках голландського дослідження гонартроз діагностовано у 7,7–14,3% осіб віком 45–49 років (van Saase J.L.C.M., 1966).
У 12-річному проспективному спостереженні за участю 258 осіб із загальної популяції віком старше 45 років встановлено, що у приблизно 25% жінок і 10% чоловіків протягом цього періоду з’явилися рентгенологічні ознаки ОА колінних суглобів (Badia Llach X., 1999). За даними E. Bagge та співавторів (1992), у віковій групі 75–79 років захворюваність на ОА дрібних суглобів кистей становила 13,6%, колінних суглобів — 4,5% за 5-річний період спостереження. J.P. Masse та співавтори (1992) виявили, що середній вік появи хронічного болю у жінок із латеральним пателофеморальним (надколінно-стегновим), медіальним і латеральним тибіофеморальним (великогомілково-стегновим) ОА становив 56,6±12; 62,7±12 і 69,2±10 років відповідно. У чоловіків біль у колінних суглобах появився дещо пізніше: у віці 60,5±10 років при латеральному пателофеморальному ОА і 64±10 років — при медіальному тибіофеморальному ОА.
У США ОА посідає друге місце після захворювань серцево-судинної системи як причина передчасного виходу на пенсію (понад 5% на рік) (Hochberg M.C. et al., 1995).
ЕКОНОМІЧНІ АСПЕКТИ ОА
Патологія кістково-м’язової системи, у якій ОА займає провідне місце, веде до значних втрат в економічній, соціальній і психологічній сферах. Збитки, пов’язані із захворюваннями цієї групи, зросли за останні роки і становлять 1–2,5% валового національного доходу таких розвинених країн світу, як США, Канада, Великобританія, Франція, Австралія (March L.M., Bachmeier C.J., 1997). У 1980 р. у США витрати, пов’язані із хворобами опорно-рухового апарата, становили 21 млрд дол. США (1% валового національного продукту) (Gabriel S.E., 1995), у 1988 р. — 54,6 млрд дол. (Praemer A. et al., 1992), а в 1992 р. — 64,8 млрд дол. (Yelin E., Callahan L.F., 1995). У 1986 р. в Канаді ці втрати оцінювалися у 8,3 млрд канадських доларів (Tugwell P., 1992); у Франції — 4 млрд французьких франків прямих витрат (лікарські засоби, відвідування лікарів, лабораторні аналізи, рентгенологічні дослідження, реабілітаційна терапія тощо) і близько 600 млн франків непрямих витрат, пов’язаних зі збитками на виробництві, де зайняті працівники, які хворіють на ОА (Levy E. et al., 1993). У Великобританії на нестероїдні протизапальні препарати (НПЗП) витрачається близько 219 млн фунтів стерлінгів на рік (більшу їх частину витрачають хворі на ОА), що становить 5% загальних витрат на лікарські засоби (Dieppe P.A. et al., 1993; Bird W., 1994). У Норвегії щорічно на НПЗП витрачається сума, еквівалентна 8 млн фунтів стерлінгів (Kvien T.K., Brors O., 1992).
ФАКТОРИ РИЗИКУ РОЗВИТКУ ОА
ОА виникає внаслідок взаємодії великої кількості генетичних факторів і факторів середовища (включаючи травматичні). Саме аналіз факторів ризику розвитку ОА різних локалізацій сприяв виникненню концепції про гетерогенність захворювання.
Так, встановлені чіткі відмінності факторів ризику розвитку коксартрозу і гонартрозу: при ОА кульшових суглобів немає відмінностей за статевою приналежністю, відмічається часте поєднання із вродженими вадами розвитку, його рідко діагностують у представників монголоїдної раси; гонартроз частіше розвивається у жінок негроїдної раси, ніж у представниць європеоїдної раси, для нього характерне попереднє травматичне ушкодження суглоба. З’явилися дані про те, що група факторів ризику ОА пателофеморального відділу колінних суглобів відрізняється від факторів ризику ураження медіального тибіофеморального відділу — перший тип пов’язаний із родинним анамнезом ОА та наявністю вузликового ураження кистей, другий — частково пов’язаний з ожирінням і попередніми хірургічними втручаннями на колінному суглобі (Алексеева Л.И., 2000).
Фактори ризику виникнення ОА (Craemer P., Hochberg M.C., 1997)
| Генетичні |
|
| Негенетичні |
|
| Екзогенні |
|
Стать має важливе значення в розвитку ОА — жінки частіше схильні до розвитку ОА більшості локалізацій. Результати фінського дослідження за участю 6647 фермерів показали, що жіноча стать — незалежний фактор, що сприяє розвитку гонартрозу (Manninen P. et al., 1996). Дані огляду 29 епідеміологічних досліджень остеоартрозу колінного і кульшового суглобів у 14 країнах світу свідчать про те, що ОА кульшових суглобів частіше розвивається у чоловіків, ніж у жінок; колінні суглоби частіше уражуються у жінок, особливо віком старше 45 років (Sun Y., 1997). Проте у більшості інших досліджень відзначається висока захворюваність жінок на коксартроз (Bjelle A., 1982; Lindberg H., 1985; Spector T.D. et al., 1996). При ОА суглобів кистей спостерігається швидке підвищення захворюваності серед жінок віком молодше 60 років, далі частота ОА цієї локалізації суттєво не змінюється; у чоловіків відзначається більш повільне підвищення захворюваності, воно триває і протягом 7–8-го десятиріччя життя (van Saase J.L.C.M. et al., 1989). Виявлені відмінності в поширеності моноостеоартрозу, олігоостеоартрозу і генералізованого (полі-) ОА серед чоловіків та жінок (рис. 1.3).
Зазначені особливості дозволили припустити, що певну роль у розвитку ОА відіграють ендокринні фактори. Дійсно, результати багатьох робіт, особливо досліджень на моделях ОА у тварин, свідчать про те, що статеві гормони здатні модифікувати метаболізм хрящової тканини. Рецептори естрогенів виявлено в суглобовому хрящі багатьох видів тварин (Young P.C.M., Stack M.T., 1982; Sheridan P.J. et al., 1985; Hart D.-J. et al., 1991). У дослідженні J.A.P. Da Silva та співавторів (1994) відзначено, що оваріоектомія збільшує швидкість деструктивних процесів у хрящовій тканині тварин. На моделях ОА у тварин продемонстровано, що естрадіол може пригнічувати синтез протеогліканів (Rosner L.A. et al., 1979). Надфізіологічні дози естрадіолу збільшують деструкцію хряща, яку блокували антиестрогеном тамоксифеном (Rosner L.A. et al., 1982; Rosner L.A. et al., 1986). У кроликів, які після оваріоектомії одержували естрогени у високих дозах, розвивалися стоншення і розволокнення суглобового хряща, тобто зміни, типові для ОА у людини (Tsai C.L., Liu Т.К., 1993).
Існує також ряд епідеміологічних доказів участі статевих гормонів, перш за все естрогенів, у розвитку ОА. До них відносять більш високу частоту ОА у жінок, яка підвищується до менопаузального періоду, зв’язок розповсюдженого ОА з такими факторами, як гінекологічні операції, маса кістки та ожиріння, які можуть відображати вплив ендогених статевих гормонів. За даними T.D. Spector і G.C. Champion (1989) жінки з гіперпродукцією естрогенів схильні до генералізованого ОА.
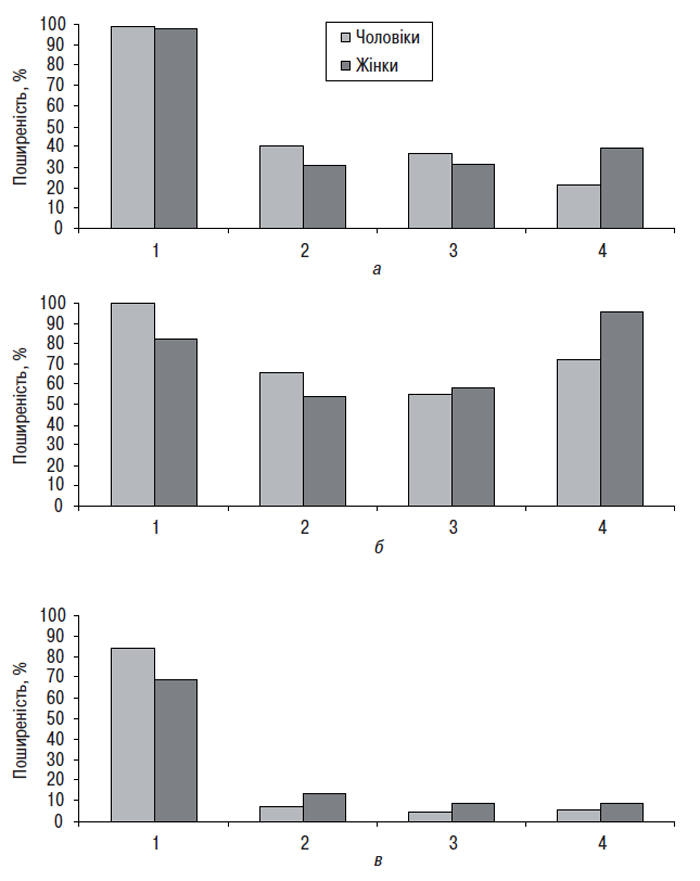
Рис. 1.3. Частота моноостеоартрозу (а), олігоостеоартрозу (б) і генералізованого ОА (в) різних локалізацій серед чоловіків та жінок. 1 — хребет; 2 — колінний суглоб; 3 — кульшовий суглоб; 4 — інші локалізації (кисті, стопи тощо)
Крім того, можлива роль естрогенів у патогенезі ОА передбачається на підставі «антагоністичних» взаємовідносин остеопорозу з ОА та підвищеним ризиком розвитку ОА при ожирінні (Spector T.D., Champion G.C., 1989). Естрогени регулюють кістковий метаболізм, їх дефіцит викликає втрату кістковою тканиною мінерального компонента у жінок в перед- і постменопаузальний період; висока мінеральна щільність кісткової тканини (МЩКТ) у постменопаузальний період може свідчити про тривале збереження надлишку естрогенів (Kritz-Silverstein D.K., Barret-Connor E., 1993). У жінок в постменопаузальний період з гонартрозом, коксартрозом, ОА суглобів кистей і поліостеоартрозом відзначається підвищення МЩКТ, що не викликано ожирінням (Hannan M.T. et al., 1993) або більш повільною втратою кісткової тканини у жінок з ОА в період менопаузи (Burger H. et al., 1996). При високій МЩКТ суглобовий хрящ може витримувати підвищене механічне навантаження.
Ожиріння також пов’язують із більш високим рівнем ендогенних естрогенів у постменопаузальний період. Ожиріння підвищує ризик розвитку ОА колінних, кульшових суглобів і суглобів кистей у жінок, але питання про те, чим це зумовлене (механічним впливом надмірної маси тіла на хрящ, більш високим рівнем естрогенів або іншими системними впливами), досі не вивчено (Felson D.T., 1996).
Деякі докази зв’язку жіночих статевих гормонів з ОА одержані у роботах, присвячених вивченню факторів ризику розвитку ОА у жінок, які застосовують замісну гормональну терапію (ЗГТ) естрогенами. Показано, що ЗГТ естрогенами знижує ризик розвитку гонартрозу і коксартрозу (Nevitt M.C. et al., 1994). У жінок, які застосовували ЗГТ естрогенами протягом 8 років, спостерігали сповільнення прогресування ОА (Zhang Y.O. et al., 1995).
Згідно з результатами останніх досліджень із використанням методики магнітно-резонансної терапії (МРТ) доведено, що у жінок, які приймають препарати ЗГТ естрогенами об’єм суглобового хряща більший порівняно із жінками, які не застосовують цієї терапії. Так, загальний об’єм хряща великогомілкової кістки був на 7,7% (0,23 мл) більшим у групі жінок, які приймали ЗГТ естрогенами порівняно з жінками, які не приймали естрогени. Зазначена різниця зберігалася навіть після вирівнювання груп за індексом маси тіла (ІМТ), тривалістю і віком настання менопаузи та тютюнопалінням (вирівняна різниця становила 0,30 мл, 95% довірчий інтервал (ДІ) 0,08–0,52).
Оскільки ЗГТ естрогенами знижує кістковий метаболізм, можна припустити, що естрогени сприяють стабілізації ОА за рахунок уповільнення ремоделювання субхондральної кістки.
Роль естрогенів у розвитку ОА, наймовірніше, реалізується шляхом впливу на протизапальні та анаболічні цитокіни, які, у свою чергу, впливають на метаболізм хряща. Дія естрогенів на кістку, ймовірно, частково пов’язана з інтерлейкіном (ІЛ)-1, ІЛ-6, фактором некрозу пухлини (ФНП)-α (Manologas S.C., Jilka R.L., 1995). Рецептори естрогенів виявляються в суглобовому хрящі та, можливо, ІЛ-1 і ІЛ-6 здатні опосередковувати вплив естрогенів на його метаболізм. Інсуліноподібний фактор росту (ІФР)-1 і трансформуючий фактор росту (ТФР)-β беруть участь у синтезі та відновленні матрикса хряща, а естрогени, вірогідно, виявляють комплексну дію на фактори росту (Romagnoli E. et al., 1994).
Загалом докази асоціації ОА з факторами, пов’язаними із впливом статевих гормонів у жінок, суперечливі. Можливо, естрогени виявляють різну дію, яка залежить від часу настання менопаузи та стадії ОА (Spector Т., Campion G.C., 1989; Oldenhave A. et al., 1996).
Іншої точки зору щодо можливого впливу статі на розвиток ОА дотримуються S. Ding та співавтори (2003), розглядаючи вірогідність наявності різниці у розмірах суглобового хряща у чоловіків та жінок. Так, згідно з даними проведеного ними дослідження встановлено, що для чоловіків характерний більший об’єм колінного та великогомілкового суглобового хряща порівняно з особами жіночої статі. Після вирівнювання гендерної різниці за зростом, масою та розміром кісток пацієнтів (Ding C. et al., 2003) ця різниця зменшилась, але все ж таки залишилася. Згідно з результатами іншого невеликого дослідження, в яке були включені особи молодого віку із здоровими колінними суглобами, встановлено, що гендерні відмінності у об’ємі суглобового хряща зумовлені перш за все різницею у розмірах простору між суглобовими поверхнями (розмірах епіфізіальної кістки), а не різницею у товщині хряща (Faber S.C. et al., 2001).
Важливим серед генетичних факторів ризику ОА є успадкована чи набута мутація гена проколагену II типу (основного колагена гіалінового хряща) COL2A1, розташованого на 12-й хромосомі. Одні з найбільш ранніх описів генетичного зв’язку між фенотипом раннього ОА і COL2A1 належать до кінця 80-х — початку 90-х років ХХ ст. (Palotie A. et al., 1989; Knowlton R.G. et al., 1990). В одному з них повідомлялося про мутацію COL2A1 у родичів з раннім ОА, що проявлялася заміною амінокислоти аргініну на цистеїн у положенні 519 в молекулі колагену II типу (Ala-Kokko L. et al., 1990). На сьогодні подібна мутація описана ще у 4 родин (Bleasel J.F. et al., 1998). C.J. Williams та співавтори (1995) виявили іншу мутацію COL2A1 у родині, серед членів якої відзначався ранній розвиток ОА, — заміну аргініну на цистеїн у положенні 75. Автори відзначають, що фенотип ОА в цій родині відрізняється від такого у родинах, серед членів яких виявлена заміна аргініну на цистеїн у положенні 519. J.F. Вleasel та співавтори (1995) виявили таку ж мутацію COL2A1 в іншій родині. Крім вищеописаних у родинах, серед членів яких діагностовано ранній ОА, також відзначають інші мутації COL2A1: заміна гліцину на серин у положенні 976 (Williams C.J. et al., 1995), у положенні 493 (Katzenstein P.L. et al., 1992).
Спадкова схильність частіше виявляється при генералізованій формі ОА. J.H. Kellgren та співавтори (1963) виявили вузлики Бушара і Гебердена серед 36% родичів чоловічої і 49% — жіночої статі з генералізованим ОА; у загальній популяції ці показники становили 17 і 26% відповідно. У хворих з генералізованим ОА частіше виявляють HLA A1 В8 гаплотип (Lawrence J.S. et al., 1983; Pattrick M. et al., 1989) і MZ-форму α1-антитрипсину (Pattrick M. et al., 1989). T.D. Spector та співавтори (1996) при дослідженні впливу спадковості на виникнення вузликової форми захворювання у близнюків також відзначають певну роль генетичних факторів у розвитку цієї форми ОА.
У великих родинах з генералізованим ОА шляхом аналізу зчеплення показане спільне успадкування ОА і алелі гена проколагену II типу (COL2A1) (Knowlton R.G. et al., 1990). Цей алель був клонований і в ньому виявлено єдину мутацію в позиції 519 в одному ланцюгу колагену, наявну у всіх членів родини, які захворіли, але відсутню у всіх здорових (Ala-Kokko L. et al., 1990). Первинний генералізований ОА, очевидно, є гетерогенним захворюванням і може бути асоційованим з мутаціями інших генів. Нещодавно проведені дослідження поліморфних маркерів генів, що кодують колаген II типу, протеїн матрикса хряща і сполучний протеїн, у 38 пар сибсів не підтвердили припущення про їх відношення до локусів схильності розвитку ОА (Loughlin J. et al., 1994). Вірогідно, лише невелику частину випадків захворювання можна пояснити цим генетичним відхиленням.
Але наразі актуальним є вивчення ролі спадкової схильності у розвитку та прогресуванні ОА кульшового суглоба. Так, результати Роттердамського дослідження встановили схильність до формування рентгенологічних ознак ОА кульшового суглоба як у гетерозигот, так і у гомозигот, що є носіями ІL1B-511T та ІL1RN VNTR алелю 2 (Meulenbelt I. et al., 2004). В свою чергу наявність специфічного алелю CRTM розглядається як можливий захисний фактор проти розвитку ОА кульшового суглоба (Meulenbelt I. et al., 1997).
Результати Фремінгемського дослідження виявили вісім локусів у хромосомах — 1, 2, 7, 9, 11–13, 19, які, ймовірно, зчепленні щонайменше з одним фенотипом для ОА кистей, але вони не збігаються з тими локусами, зв’язок яких з ОА встановлений раніше (Demissie S. et al., 2002). Дослідження E. Gillapsy та співавторів (2002) при використанні картування генів не виявило жодного достовірного зчеплення у хромосомі 2q специфічного для ОА кистей та колінних суглобів (Gillaspy E. et al., 2002). Загалом результати цих досліджень свідчать, що ОА суглобів кисті не має стійкого зчеплення з жодною ділянкою хромосоми. Після того, як був вибраний напрямок специфічного ураження окремих груп суглобів, результати Фремінгемського дослідження виявили чотири локуси, які продемонстрували доведене зчеплення. Так, ділянка зчеплення для ОА дистальних міжфалангових суглобів була виявлена на хромосомі 7, для ОА зап’ястково-п’ясткового суглоба І пальця кисті — на хромосомі 15, і лише у жінок, для ОА дистальних міжфалангових суглобів на хромосомі 1 та для ОА І зап’ястково-п’ясткового суглоба І пальця кисті — на хромосомі 20 (Hunter D.J. et al., 2004).
J. Loughlin (2005) дійшов висновку, що серед генів, які, ймовірно, мають значення у розвитку схильності до ОА, необхідно виділити групу генів ІЛ-1 (Meulenbelt I. et al., 2004), ген матриліну 3 (MATN3), ген (альфа) ланцюга ІЛ-4, ген секретованого білка опікового шоку 3 (FRZB) (Loughlin J. et al., 2004; Min J.L. et al., 2005), ген металопротеїнази ADAM12 та ген аспорину (ASPN) (Kizawa H. et al., 2005; Mustafa Z. et al., 2005).
Популяційні дослідження свідчать про роль расової/етнічної належності в розвитку ОА (табл. 1.4), проте нерідко автори наводять протилежні дані. Так, за даними J.J. Anderson і D.T. Felson (1988), серед афроамериканок частіше, ніж у жінок з білим кольором шкіри, відзначається ОА колінних суглобів; для коксартрозу расових відмінностей авторами не виявлено. У вищенаведеному огляді 29 епідеміологічних досліджень, проведених у 14 країнах світу, зазначено, що у представників європеоїдної раси частіше, ніж у представників інших рас, виявляють рентгенологічні ознаки коксартрозу; проте поширеність гонартрозу в обох популяціях виявилася однаковою (Sun Y. et al., 1997).
Таблиця 1.4
Поширеність ОА серед представників різних етнічних/расових груп (Peyron J.G., Altman R.D., 1992)
| Етнічна/расова група | Вік, років | Поширеність ОА,% | |
| у жінок | у чоловіків | ||
| Англійці | ≥35 | 70 | 69 |
| Американці — представники європеоїдної раси | ≥40 | 44 | 43 |
| Ескімоси Аляски | ≥40 | 24 | 22 |
| Сільське населення Ямайки | 35–64 | 62 | 54 |
| Північноамериканські індіанці племені Піма | ≥30 | 74 | 56 |
| Північноамериканські індіанці племені Blackfoot | ≥30 | 74 | 61 |
| Південно-африканці — представники негроїдної раси | ≥35 | 53 | 60 |
| В середньому в 17 популяціях | ≥35 | 60 | 60 |
Незважаючи на той факт, що на ОА хворіють переважно особи похилого віку і поширеність його у віковій групі молодше 45–50 років надзвичайно низька (рис. 1.4, 1.5, табл. 1.5), його не можна назвати неминучим наслідком старіння. Поширеність ОА суглобів кистей, кульшових і колінних суглобів різко підвищується серед чоловіків та жінок віком від 50 до 80 років (Lethbridge-Cejku M. et al., 1994; Oliveria S.A. et al., 1995). Проте причини, за якими вік є одним зі значимих факторів ризику виникнення ОА, невідомі. Можливо, з одного боку, хондроцити людини у процесі старіння втрачають здатність до поповнення чи відновлення матрикса суглобового хряща, що «втрачається» внаслідок ушкодження або нормальних (вікових) процесів обміну, і в результаті розвивається дефіцит компонентів матрикса (як при остеопорозі). З іншого боку, матрикс хряща у людей похилого віку може стати більш чутливим до нормальних кумулятивних мікротравм, і механізми відновлення клітин не можуть компенсувати цю підвищену чутливість. В обох випадках існує розбіжність між впливом зовнішнього середовища на суглобовий хрящ і здатністю хондроцитів або матрикса реагувати на ці впливи. І хоча час від появи первинних змін у суглобах до виникнення симптомів і рентгенологічних ознак ОА різний, як правило, він вимірюється роками й десятиріччями. Разом із тим, швидкість прогресування ОА у окремих хворих варіює навіть в одній віковій групі і при однаковій локалізації захворювання (Lomander L.S., 1991). Це дозволяє припустити участь у розвитку ОА таких факторів, як генетична схильність, рівень фізичної активності, відмінності між суглобами тощо.
Таблиця 1.5
Поширеність ОА в різних вікових групах залежно від статі (за: Peyron J.G., 1979, у модифікації: Carrabba M., Colombo B., 1982)
| Вік, років | Автор | Поширеність, % | ||
| загальна | у чоловіків | у жінок | ||
| 15–24 | Tzonchev et al.* | 0,8 | — | — |
| 18–24 | Gordon** | 4,0 | — | — |
| ≥15 | Lawrence et al.* | — | 19,0 | 22,0 |
| ≥16 | Mikkelsen et al.** | — | 19,5 | 23,0 |
| 18–79 | Gordon** | 37,4 | — | — |
| ≥40 | Blumberg et al.# | — | 42,6 | 44,0 |
| 55–64 | Kellgren et Lawrence## | — | 83,0 | 87,0 |
| ≥65 | Gordon** | — | 78,0 | 87,0 |
| Tzonchev et al.* | 36,9 | — | — | |
*Рентгенографія кистей, стоп і шийного відділу хребта; **рентгенографія кистей і стоп; #рентгенографія кистей; ##клінічна і рентгенологічна діагностика.
За даними L. Buratti та співавторів (1995) з віком підвищується захворюваність на ОА кульшових, колінних суглобів, суглобів кистей, проте знижується захворюваність на ОА шийного відділу хребта (рис. 1.6). Крім того, у осіб більш старших вікових груп спостерігається збільшення кількості уражених ОА суглобів, що відображено в табл. 1.6 (Ciocci A., 1996).
Таблиця 1.6
Кількість суглобів, уражених ОА, у різних вікових групах (за: Ciocci A., 1996, зі змінами)
| Вік, років | Кількість хворих на,% | ||
| моноартроз | олігоартроз | генералізований ОА | |
| ≤50 | 54,8 | 33,9 | 11,3 |
| 51–60 | 56,5 | 34 | 9,5 |
| 61–70 | 38,2 | 45,3 | 16,5 |
| >70 | 19,4 | 20 | 60,6 |
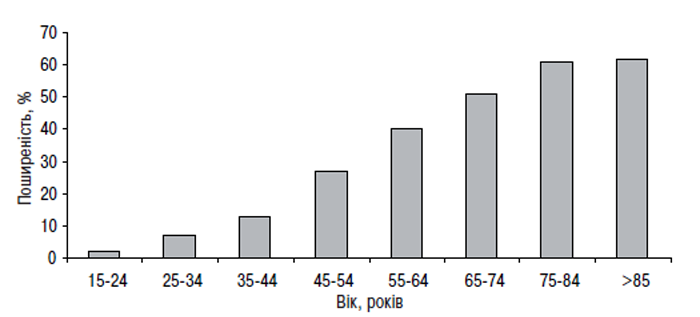
Рис. 1.4. Середня поширеність клінічно діагностованого ОА у осіб різних вікових груп (дані National Health Interview Survey в США, 1989–1991 рр.)
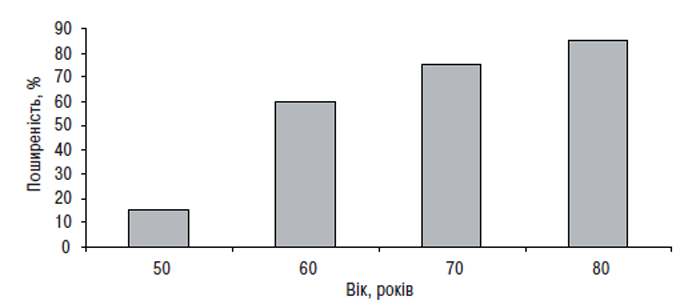
Рис. 1.5. Поширеність ОА в різних вікових групах (за: Ciocci A., 1996)
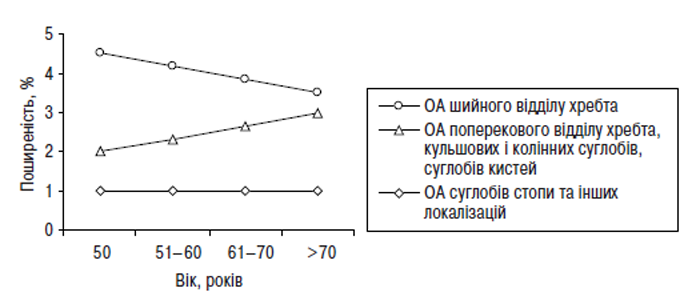
Рис. 1.6. Поширеність ОА окремих локалізацій у різних вікових групах
Проведено відносно небагато досліджень, у яких вивчали вплив старіння на прогресування ОА, хоча значення похилого віку в розвитку ОА є загальновизнаним. В одному з них у більшості хворих на ОА (60% обстежених колінних суглобів) протягом 11 років спостереження не виявлено жодних рентгенологічних змін (за класифікацією Келлгрена — Лоуренса), у 33% — лише незначні зміни (Spector T.D. et al., 1992). Таким чином, прогресування ОА не завжди є неминучим процесом і, вірогідно, залежить від різної здатності до відновлення і деградації тканин суглоба після їх ушкодження.
У популяційних дослідженнях однозначно виявлено, що у осіб з надмірною масою тіла більш високий ризик розвитку гонартрозу (Hartz A.J. et al., 1986; Anderson J.J., Felson D.T., 1988; Davis M.A. et al., 1988; 1989; 1990; 1998). Найвищий ризик виникнення ОА у осіб з ІМТ ≥25 (Centers for Disease Control,1996). У дослідженні NHANES-1 показано, що у жінок з надмірною масою тіла з ІМТ >30, але <35 ризик розвитку ОА був у 4 рази вищим порівняно з жінками, у яких ІМТ досягав 25. У чоловіків з такою ж надмірною масою ризик підвищувався в 4,8 раза порівняно із чоловіками з нормальною масою тіла. Виявлена значна пряма асоціація між ІМТ і гонартрозом у осіб будь-якої статі: на кожні 5 одиниць ІМТ відношення шансів (ВШ) (95% ДІ) зв’язку з ОА колінних суглобів становило 2,1 (1,7; 2,58) для чоловіків і 2,2 (1,95; 2,5) — для жінок (Аnderson J.J., Felson D.T., 1988). Ці дані порівняні з результатами інших досліджень. За даними Т. Macalinden та співавторів (1996) надмірна маса тіла асоціювалася з ОА і тибіофеморального, і пателофеморального відділів колінного суглоба. Автори припустили, що маса тіла збільшувалася вже після розвитку ОА у зв’язку з обмеженням рухової активності. Проте є дані, що за наявності надмірної маси тіла у осіб віком 37 років, у віковий період, коли ОА спостерігається вкрай рідко, значно зростає ризик розвитку ОА колінних суглобів у віці до 70 років (Felson D.T. et al., 1988). Результати проспективного популяційного дослідження і повторне рентгенологічне спостереження дали підставу стверджувати, що надмірна маса тіла у осіб без ОА є потенційним чинником ризику розвитку ОА колінних суглобів у подальшому (Felson D.T. et al., 1995).
За даними тривалих спостережень при надмірній масі тіла існує не лише високий ризик розвитку ОА колінних суглобів, але також високий ризик прогресування захворювання (Dougados M. et al., 1992), а у жінок — розвитку білатерального ОА (Spector T.D. et al., 1994).
M.A. Davis та співавтори (1989) досліджували зв’язок між надмірною масою тіла та уні-/білатеральним ОА колінних суглобів, діагностованим рентгенологічно. У дослідженні NHAINS-I брали участь 3885 осіб віком 45–74 роки, з яких у 226 (4,9%) був білатеральний і у 75 (1,8%) — унілатеральний гонартроз; ІМТ >30 визначений у 65% хворих із білатеральним гонартрозом, у 37,4% — з ОА правого колінного суглоба, у 43,3% — з ОА лівого колінного суглоба і у 17,7% — здорових осіб. ВШ (95% ДІ) зв’язку надмірної маси тіла з білатеральним гонартрозом становило 6,58 (4,71; 9,18), тоді як із право- та лівобічним ОА — відповідно 3,26 (1,55; 7,29) і 2,35 (0,96; 5,75).
Зв’язок між надлишковою масою тіла і гонартрозом відносно характеру розподілу підшкірної жирової клітковини (ПЖК) у осіб віком 45–74 років, які брали участь у дослідженні NHAINS-I, вивчали M.A. Davis та співавтори (1990). Центральний характер розподілу ПЖК визначали шляхом вимірювання товщини шкірної складки нижче кута лопатки, периферичний — складки у ділянці триголового м’яза плеча. Автори не виявили зв’язку між товщиною відповідних шкірних складок із наявністю уні-/білатерального ОА колінних суглобів незалежно від статі, віку, расової належності, ІМТ. Проте зв’язок величини ІМТ з білатеральним гонартрозом чітко виявлявся у чоловіків і жінок, з унілатеральним — лише у чоловіків.
M.C. Hochberg та співавтори (1995) досліджували зв’язок між розподілом ПЖК, процентним вмістом ПЖК у 465 чоловіків і 275 жінок — представників європеоїдної раси, що брали участь у Baltimore Longitudinal Study of Aging, а також у 169 чоловіків і 99 жінок із рентгенологічно діагностованим ОА. Розподіл ПЖК визначали за допомогою співвідношення окружності зап’ястка і стегна, тоді як для розрахунків процентного вмісту ПЖК використовували стандартне рівняння, яке включало такі показники, як товщина складок нижче кута лопатки, живота, а також у ділянці триголового м’яза плеча. Як і передбачалося, ІМТ був тісно пов’язаний із наявністю гонартрозу у осіб будь-якої статі. Проте автори дослідження не виявили асоціації між рентгенологічно діагностованим ОА колінних суглобів і характером розподілу ПЖК (центральний/периферичний), а також процентним вмістом ПЖК.
У дослідженнях K. Martin та співавторів (1997), M.A. Davis та співавторів (1988) показано, що при ожирінні на виникнення ОА колінних суглобів впливають механічні, а не метаболічні фактори.
При надмірній масі тіла характерний підвищений ризик розвитку ОА кульшових суглобів (Hartz A.J. et al., 1986), проте не на стільки, як при гонартрозі. Результати подібних досліджень суперечливі. Відзначено, що такі особи схильні до дво-, а не однобічного ОА кульшових суглобів (van Saase J.L.C.M. et al., 1988; Heliovaara M. et al., 1993). В свою чергу дані Роттердамського дослідження підтверджують, що надмірна маса є фактором ризику виникнення саме ОА колінного, а не кульшового суглоба (Reijman M. et al., 2005).
За даними проспективного (протягом 23 років) спостереження при надмірній масі тіла відзначається і більш високий ризик розвитку ОА суглобів кистей (Carman W.J. et al., 1994). У дослідженнях, проведених у Лондоні за участю близнюків, також виявлено поєднання надмірної маси тіла з ОА зап’ястково-п’ясткового суглоба I пальця кисті (Cicuttini P.M. et al., 1996).
Взаємозв’язок надмірної маси тіла і ОА можна пояснити підвищенням навантаження на суглоби, спричиненим механічним ушкодженням хряща, що в подальшому призводить до розвитку ОА. Проте таке пояснення можна застосовувати лише для ОА суглобів, що несуть надмірну масу тіла: колінних і кульшових, але не для ОА суглобів кистей. Можливо також, що у осіб з ожирінням існує поки невідомий фактор, що прискорює ураження хряща та сприяє розвитку захворювання. Крім того, у людей з надмірною масою тіла виявляється більш висока МЩКТ, яка також вважається фактором ризику ОА (Hannan M.T. et al., 1993).
У Фремінгемському дослідженні огляд пацієнтів здійснювали 1 раз на 2 роки протягом 40 років, при цьому встановлено, що збільшення маси тіла є чинником ризику розвитку маніфестного ОА колінних суглобів у жінок, а зменшення маси на 5 кг у жінок з ІМТ, що становив 25 (тобто вище середнього), знижувало ризик розвитку ОА на 50% (Felson D.T. et al., 1992). Для жінок з ІМТ нижче середньої величини ні збільшення, ні зменшення маси тіла не мали значного впливу на ризик розвитку захворювання. Отже, ожиріння — важливий фактор ризику ОА колінних, кульшових суглобів і суглобів кистей, у таких пацієнтів існує також високий ризик прогресуючого перебігу захворювання. Зменшення маси тіла може запобігти захворюванню, особливо ОА колінних суглобів.
Зв’язок МЩКТ та ОА колінних суглобів вивчали у багатьох тривалих клінічних дослідженнях, зокрема у когортах пацієнтів Фремінгемського, Роттердамського та Чайнгфордського (Сhingford) досліджень. Згідно з результатами Zhang та співавторів (2000) в ході 8-річного спостереження когорти учасників Фремінгемського дослідження ризик виникнення ОА був нижчим у хворих з нижчою МЩКТ у ділянці шийки стегна (5,6%) і був вищим при високій МЩКТ (14,2%) відповідно. Аналогічні результати отримано у Роттердамському дослідженні, де частота рентгенологічних ознак ОА колінних суглобів була вищою у пацієнтів із високою МЩКТ у ділянці шийки стегна (10,5%) та хребта (14,3%) порівняно з групою пацієнтів з низькими значеннями МЩКТ (3,4 та 3,3% відповідно) (Bergink A.P. et al., 2005). У жінок, які брали участь у Чайнгфордському дослідженні, частота розвитку остеофітів у колінних суглобах була вищою при високих вихідних значеннях МЩКТ у ділянці шийки стегна та хребта (Hart D. et al., 2002). У обох (Фремінгемському та Чайнгфордському) дослідженнях встановлено, що у пацієнтів з ОА колінного суглоба МЩКТ на 5 та 10% вища порівняно з учасниками дослідження без симптомів ОА колінного суглоба (Hannan M.T. et al., 1993; Zhang Y. et al., 2001), при цьому ця різниця зберігалася навіть після вирівнювання груп за віком та ІМТ.
Аналогічні результати отримано в популяції учасників Роттердамського дослідження, хворі з ОА колінного та/чи кульшового суглоба мали на 3–8% вищу МЩКТ у шийці стегна порівняно з пацієнтами без симптомів ОА, проте різниця була достовірною лише серед осіб жіночої статті (Burger H. et al., 1996). Повторні визначення МЩКТ через 2 роки виявили, що втрата кісткової маси була вищою серед учасників дослідження із симптомами ОА. Теоретично це може бути пояснено або можливим впливом цитокінів, або наслідком зниження фізичної активності (Burger H. et al., 1996).
На думку K.D. Brandt та співавторів (1986), близько 80% усіх випадків ідіопатичного ОА кульшових суглобів пов’язані з нерозпізнаними вадами розвитку, такими, як дисплазія та підвивихи. Водночас частота цих аномалій розвитку не дає чіткого пояснення високої поширеності ОА кульшових суглобів у Європі та США.
Є переконливі докази зв’язку професійних факторів із розвитком ОА, надмірне навантаження на певні суглоби асоціюється з підвищеним ризиком розвитку ОА цих суглобів. Ризику піддаються шахтарі (ОА колінних суглобів і поперекового відділу хребта), докери і робітники верфі (ОА колінних суглобів і суглобів кистей), збирачі бавовни і працівники мірошницького виробництва (ОА окремих суглобів кистей), оператори пневматичних інструментів (ОА ліктьового і променево-зап’ясткового суглобів), малярі та бетонники (ОА колінних суглобів), фермери (ОА кульшових суглобів) (Scott J.C. et al., 1999). На думку S. Solovieva та співавторів (2005), імовірність виникнення тяжкого ОА великого пальця правої руки, а також вказівного та середнього пальця є вищою у стоматологів порівняно з учителями.
Професійний спорт (футбол, легка атлетика тощо) пов’язаний з високим ризиком розвитку ОА (Lane N.E., Buckwalter J.A., 1993; Panush R.S., Lane N.E., 1994). У осіб, які займаються фізичною культурою непрофесійно, ризик виникнення ОА колінних і кульшових суглобів не відрізняється від загального в популяції (Lane N.E. et al., 1986; 1990; 1993).
Дуже важливим фактором ризику виникнення ОА є травма/ушкодження суглоба. Травмування колінного суглоба (особливо передньої хрестоподібної зв’язки) пов’язане з високим ризиком розвитку ОА колінного суглоба у професійних футболістів (Scott J.C. et al., 1999).
M.A. Davis та співавтори (1989) в описаному вище NHAINS-I досліджували зв’язок між травмою колінного суглоба та уні-/білатеральним рентгенологічно підтвердженим гонартрозом. У 5,8% обстежених осіб із білатеральним гонартрозом, у 15,8% із 37 осіб із правобічним гонартрозом і у 1,5% — контрольної групи в анамнезі були дані про травму правого колінного суглоба, в той час як відомості про травму лівого колінного суглоба в анамнезі були у 4,6% осіб із білатеральним ураженням, у 27% — із лівобічним гонартрозом і у 1,8% — у контрольній групі. Статистичний аналіз одержаних даних показав, що ВШ (95% ДІ) асоціації травми колінного суглоба і білатерального гонартрозу становило 3,51 (1,8; 6,83), правобічного гонартрозу — 16,3 (6,5; 40,9) і лівобічного гонартрозу — 10,9 (3,72–31,93).
S. Tepper і M.C. Hochberg (1993) вивчали зв’язок між травмою кульшового суглоба і рентгенографічно підтвердженим коксартрозом у 2359 осіб віком 55–74 роки, які брали участь у NHAINS-I; з них лише у 73 (3,1%) діагностовано ОА одного або обох кульшових суглобів. Статистичний аналіз виявив значну асоціацію між травмою кульшового суглоба в анамнезі й коксартрозом — ВШ (95% ДІ) — 7,84 (2,11; 29,1). Аналізуючи зв’язок між травмою кульшового суглоба та уні-/білатеральним ушкодженням, автори визначили більш виражену асоціацію з унілатеральним — ВШ (95% ДІ) — 24,2 (3,84; 153), ніж із білатеральним коксартрозом — ВШ (95% ДІ) — 4,17 (0,5; 34,7). Таким чином, травма кульшового і колінного суглобів — важливий фактор ризику розвитку коксартрозу і гонартрозу, особливо унілатерального.
Крім вищенаведеного, K.D. Brandt (2000) виділяє слабкість періартикулярних м’язів як фактор ризику розвитку гонартрозу.
У хворих на ОА колінних суглобів часто виявляють слабкість чотириголового м’яза стегна, що зазвичай позв’язують із атрофією внаслідок обмеження руху в ураженій кінцівці. Проте слабкість цього м’яза також виявляють у пацієнтів із неманіфестним гонартрозом, у яких був відсутній біль у суглобі і в момент огляду, і в анамнезі, м’язова маса не тільки не зменшувалася, а навіть іноді збільшувалася (Slemenda C. et al., 1997). Результати проспективних досліджень свідчать про те, що слабкість чотириголового м’яза стегна є не лише наслідком маніфестного гонартрозу, але також може бути чинником ризику ОА (Slemenda C. et al., 1998; Brandt K.D. et al., 1999). Серед жінок без рентгенологічних ознак гонартрозу на початку спостереження і з рентгенологічно діагностованим ОА через 30 міс вихідна сила розгинача коліна була значно меншою (р<0,04), ніж у жінок, у яких не розвинулись ознаки ОА (Slemenda C. et al., 1997; Slemenda C. et al., 1998).
C. Slemenda та співавтори (1997) визначили, що збільшення сили розгинача коліна на кожні 10 фунтів/фут2 асоційоване зі зниженням імовірності розвитку ОА колінного суглоба на 20%, маніфестного ОА — на 29%. Відносно невелике збільшення сили розгинача коліна (приблизно на 20% середнього значення для чоловіків і на 25% — для жінок) асоційоване зі зниженням ризику розвитку гонартрозу на 20 і 30% відповідно.
Роль чотириголового м’яза стегна у захисті колінного суглоба від ушкодження пов’язана із функцією, що стабілізує суглоб, а також із тим, що вона забезпечує опір гравітації всієї нижньої кінцівки.