Амбулаторне моніторування електрокардіограми за Холтером
Содержание
- СТВОРЕННЯ І РОЗВИТОК СИСТЕМ ЕКГ-МОНІТОРУВАННЯ
- ПОКАЗАННЯ ДО ПРОВЕДЕННЯ ХОЛТЕРІВСЬКОГО МОНІТОРУВАННЯ ЕКГ
- КОРОТКІ ДАНІ ПРО ТЕХНІЧНІ АСПЕКТИ ПРИЛАДУ ДЛЯ ПРОВЕДЕННЯ ДОБОВОГО МОНІТОРУВАННЯ ЕКГ
- ВСТАНОВЛЕННЯ РЕЄСТРАТОРА ТА ІНСТРУКТАЖ ПАЦІЄНТА
- АРТЕФАКТИ ЕКГ ПРИ МОНІТОРУВАННІ
- РИТМ СЕРЦЯ ЗДОРОВОЇ ЛЮДИНИ
- ОЦІНКА СИНУСОВОГО РИТМУ
- ПОРУШЕННЯ AV-ПРОВІДНОСТІ
- СУПРАВЕНТРИКУЛЯРНІ АРИТМІЇ
- ДІАГНОСТИКА ПЕРЕДЧАСНИХ ДЕФОРМОВАНИХ КОМПЛЕКСІВ QRS
- ОЦІНКА ФУНКЦІЇ КАРДІОСТИМУЛЯТОРА
- ОЦІНКА ЕФЕКТИВНОСТІ Й БЕЗПЕКИ АНТИАРИТМІЧНОЇ ТЕРАПІЇ МЕТОДОМ ХОЛТЕРІВСЬКОГО МОНІТОРУВАННЯ
- Оцінка ефективності антиаритмічної терапії
- Виявлення проаритмогенної дії антиаритмічних засобів
- ОЦІНКА ІНТЕРВАЛУ Q–T ЯК ПРЕДИКТОРА АРИТМІЙ
- ВИКОРИСТАННЯ ХОЛТЕРІВСЬКОГО МОНІТОРУВАННЯ ЕКГ У ДІАГНОСТИЦІ ІХС
- Помилки в автоматичному вимірюванні зсувів сегмента ST
- Гострий ІМ
- ОЦІНКА АКТИВНОСТІ ВЕГЕТАТИВНОЇ НЕРВОВОЇ СИСТЕМИ МЕТОДОМ ХОЛТЕРІВСЬКОГО МОНІТОРУВАННЯ
- Порушення ритму та провідності як прояви вегетативної дисрегуляції
- Депресія сегмента ST як прояв вегетативної дистонії
- Інші зміни періоду реполяризації на ЕКГ, зумовлені вегетативною дистонією
- ЗВІТ ПРО ПРОВЕДЕННЯ ХОЛТЕРІВСЬКОГО МОНІТОРУВАННЯ
- БІФУНКЦІОНАЛЬНЕ МОНІТОРУВАННЯ ЕКГ ТА РІВНЯ АТ
- ЛІТЕРАТУРА
Холтерівське ЕКГ-моніторування міцно увійшло у клінічну практику. Без нього у більшості випадків неможлива якісна діагностика порушень ритму серця і контроль ефективності лікування. Цей метод — складова частина обстеження пацієнтів із ІХС. Останнім часом з’явилося багато нових вітчизняних і закордонних холтерівських систем, у яких використовують різні протоколи дослідження. Часто дослідники по-різному трактують поняття норми, неоднаково оцінюють ефективність терапії та погіршення стану хворих, як, наприклад прояв проаритмогенного впливу лікарських препаратів. Все це спонукало авторів розробити вітчизняні стандарти щодо проведення холтерівського ЕКГ-моніторування у клінічній практиці.
СТВОРЕННЯ І РОЗВИТОК СИСТЕМ ЕКГ-МОНІТОРУВАННЯ
У 1961 р. Norman J. Holter запропонував новий метод реєстрації ЕКГ і можливості передачі по радіо ЕКГ, узагальнивши тим самим 25-річний досвід роботи. Протягом наступних 25 років ми стали свідками вдосконалення цього дослідницького методу. За ці роки 40-кілограмовий реєстратор, що закріплювався на спині хворого як рюкзак, зазнав значних змін і важить зараз менше 0,5 кг. Технічні вдосконалення були спрямовані на поліпшення якості запису ЕКГ, з’явилася можливість одночасної реєстрації декількох відведень ЕКГ, автоматичного аналізу. Вдосконалення апаратури дозволило збільшити кількість параметрів, які реєструються і аналізуються: при проведенні аналізу порушень ритму серця з’явилася можливість кількісного визначення депресії сегмента ST, оцінки функції електрокардіостимулятора і варіабельності серцевого ритму у вигляді різних тимчасових і спектральних параметрів, автоматичного виміру інтервалу Q–T, а останнім часом з’явилися апарати, що реєструють усереднені сигнали ЕКГ при великому підсиленні. Впроваджується система передачі сигналів ЕКГ за допомогою телефонного зв’язку і запис інформації «на вимогу» на реєстратор.
Враховуючи надходження нової інформації щодо модифікації методу і появу більш широких можливостей інтерпретації результатів, потреба в холтерівському моніторуванні не може бути визначена однозначно. Нами зроблена спроба узагальнити накопичені знання і коротко викласти показання до проведення холтерівського моніторування ЕКГ.
ПОКАЗАННЯ ДО ПРОВЕДЕННЯ ХОЛТЕРІВСЬКОГО МОНІТОРУВАННЯ ЕКГ
1. Наявність у хворого скарг, які можуть бути наслідком порушень ритму серця (серцебиття, епізоди втрати свідомості, запаморочення, перебої в роботі серця).
2. Оцінка ризику розвитку небезпечних для життя аритмій у пацієнтів без вищезазначених скарг при таких патологіях:
а) ГКМП;
б) перенесений ІМ, ускладнена СН або порушенням ритму;
в) синдром подовженого інтервалу Q–T.
3. Оцінка ефективності антиаритмічної терапії чи проявів проаритмогенних ефектів.
4. Оцінка роботи електрокардіостимулятора.
5. Оцінка епізодів ішемії міокарда.
6. Оцінка варіабельності серцевого ритму.
7. Оцінка добової динаміки інтервалу Q–T при підозрі на синдром подовженого інтервалу Q–T.
Слід зазначити, що для оцінки ризику розвитку небезпечних для життя аритмій (пункт 2), на думку експертів ACC і AHA, холтерівське моніторування малоінформативне:
1) у хворих зі стабільною стенокардією без порушень ритму серця і симптомів СН;
2) у хворих із безсимптомним пролапсом мітрального клапана;
3) у хворих без симптомів із появами порушень ритму серця, що викликають втрату свідомості під час виконання професійної діяльності, що може становити загрозу для навколишніх. У цих випадках імовірність реєстрації порушень ритму під час 24-годинного моніторування ЕКГ незначна, тобто результат дослідження не дозволяє зробити достовірні висновки.
Оцінюючи ефективність лікування пацієнтів з аритмією, слід пам’ятати, що існує природна варіабельність шлуночкової ектопічної активності, коли кількість екстрасистол може істотно змінюватися протягом доби.
КОРОТКІ ДАНІ ПРО ТЕХНІЧНІ АСПЕКТИ ПРИЛАДУ ДЛЯ ПРОВЕДЕННЯ ДОБОВОГО МОНІТОРУВАННЯ ЕКГ
Апаратура, призначена для холтерівського моніторування, має бути забезпечена пристроєм для реєстрації, відтворення, аналізу і документування результатів. Можна виділити дві основні системи, які використовують для проведення моніторингу: традиційна, тобто з прискореним аналізом, і система аналізу в реальному масштабі часу.
Реєструвальний пристрій складається з таких елементів:
1) електроди;
2) дроти, які з’єднують електроди з головним кабелем;
3) головний кабель;
4) притискний сигналізатор;
5) реєстратор.
Електроди, що застосовуються для реєстрації ЕКГ, мають відповідати певним вимогам: з одного боку, вони повинні забезпечити стабільний і якісний прийом сигналу, а з іншого — не викликати подразнення шкіри при тривалому контакті з нею. Найкращу і стабільну провідність мають електроди з хлориду срібла, у яких металевий центр з’єднаний зі шкірою через насичену провідним гелем губку. Від кожного електрода відходить екранований дріт, що йде до реєстратора. У класичних реєстраторах використовується магнітна стрічка, у цьому разі реєстратор виконує роль магнітофона, що носить під час дослідження пацієнт. Реєстратори використовують джерела постійного струму, батарейки чи акумулятори. Швидкість руху стрічки у пристрої становить 1 мм/с. Реєстратор обладнаний кнопкою сигналу інциденту для активної реєстрації пацієнтом клінічних симптомів.
Використання для запису ЕКГ електромагнітної стрічки створює деякі складності:
1) величина касети зі стрічкою обмежує розміри реєстратора;
2) стрічка потребує відповідної обробки перед кожним дослідженням;
3) одна стрічка може бути використана 6–7 разів;
4) обов’язкове постійне очищення голівок реєстратора і відтворювального приладу;
5) обмеженість діапазону частот;
6) існує можливість фальсифікованого запису у разі порушення руху стрічки або її низької якості.
З урахуванням вищенаведеного останнім часом розроблені реєстратори, у яких магнітна стрічка замінена дисками з постійним електронним записом. Цифровий запис гарантує якість і вірогідність даних.
Після добового моніторування дані, зареєстровані на стрічці або в електронній пам’яті реєстратора, передаються на стаціонарний прилад, що дає можливість відтворення й аналізу ЕКГ. Стаціонарний прилад — це комп’ютер, що завдяки відповідній програмі надає такі можливості, як:
1) відтворення добової ЕКГ;
2) аналіз добової ЕКГ;
3) різні форми подання і документації добової ЕКГ;
4) різні форми подання і документації результатів аналізу ЕКГ.
Ілюстративно-документальні функції реалізуються за допомогою так званих периферійних приладів: моніторів, принтерів тощо.
На сьогодні використовують різні способи проведення аналізу ЕКГ:
1) автоматичний аналіз — використання відповідної програми, що самостійно, без участі оператора, визначає зміни ЕКГ і проводить оцінку порушень ритму;
2) ретроспективний аналіз — зміни ЕКГ визначаються автоматично і на першому етапі аналізу контролюються та коригуються оператором, після чого відбувається новий аналіз запису;
3) проспективний аналіз — під час аналізу комп’ютер показує біжучу ЕКГ, яку оператор може підтвердити або спростувати.
Остаточна достовірна оцінка порушень ритму не має спиратися лише на результати автоматичного аналізу.
ВСТАНОВЛЕННЯ РЕЄСТРАТОРА ТА ІНСТРУКТАЖ ПАЦІЄНТА
Для місця накладання електродів обирається ділянка грудної клітки з найменшою рухливістю і невеликою кількістю підшкірної жирової клітковини і малою товщиною м’язів. Перед накладанням реєстратора за необхідності слід поголити використовувану ділянку шкіри. Електроди необхідно протерти 99% ізопропанолом або ацетоном (не рекомендується використовувати спирт), а потім провести обробку шкіри. Ця операція виконується за допомогою абразивної пасти. Електроди необхідно приклеїти способом, що гарантує їх хороше прилягання і не виключає видавлювання маси електродного гелю з губки, розташованої між шкірою та металевою частиною електрода. Накладають електроди в місцях, де немає великих груп м’язів, щоб уникнути деформації сигналу під час звичайної активності пацієнта, скорочення м’язів, дихальних рухів.
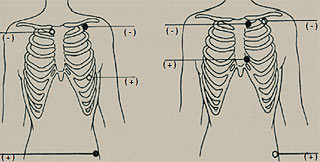
При холтерівському моніторуванні найчастіше використовують модифіковані грудні відведення СS-1 і СМ-5. Запис, зареєстрований у відведенні СМ-5 (негативний електрод у правій підключичній ділянці, позитивний — у положенні V5), приблизно відповідає звичайній ЕКГ у відведенні V5, іноді також — у II стандартному відведенні. У цьому відведенні найкраще видно зубець R, що в нормі вищий, ніж зубець Т. Таким чином, у цьому відведенні найкраще аналізувати порушення серцевого ритму. У відведенні СМ-5 також добре видно зміни сегмента ST, що відображає процеси реполяризації в передньобоковій стінці ЛШ. Відведення СS-1 (негативний електрод у лівій підключичній ділянці, позитивний — у положенні V1) відповідає відведенню V1. У цьому відведенні добре видно зубець Р, що має ключове значення для діагностики суправентрикулярних порушень ритму, а також для аналізу порушень AV- і внутрішньошлуночкової провідності. Приклад розміщення електродів на грудній клітці пацієнта наведено на рис. 3.1.
Рис. 3.1. Розміщення електродів СМ-5 і CS-1
Звичайно для діагностики порушень ритму досить двох відведень, осі яких перетинаються під прямим або близьким до нього кутом. Водночас для діагностики ішемії міокарда необхідно використати не менше трьох відведень, які могли б якомога повніше відображати перебіг процесів реполяризації у всіх стінках міокарда ЛШ.
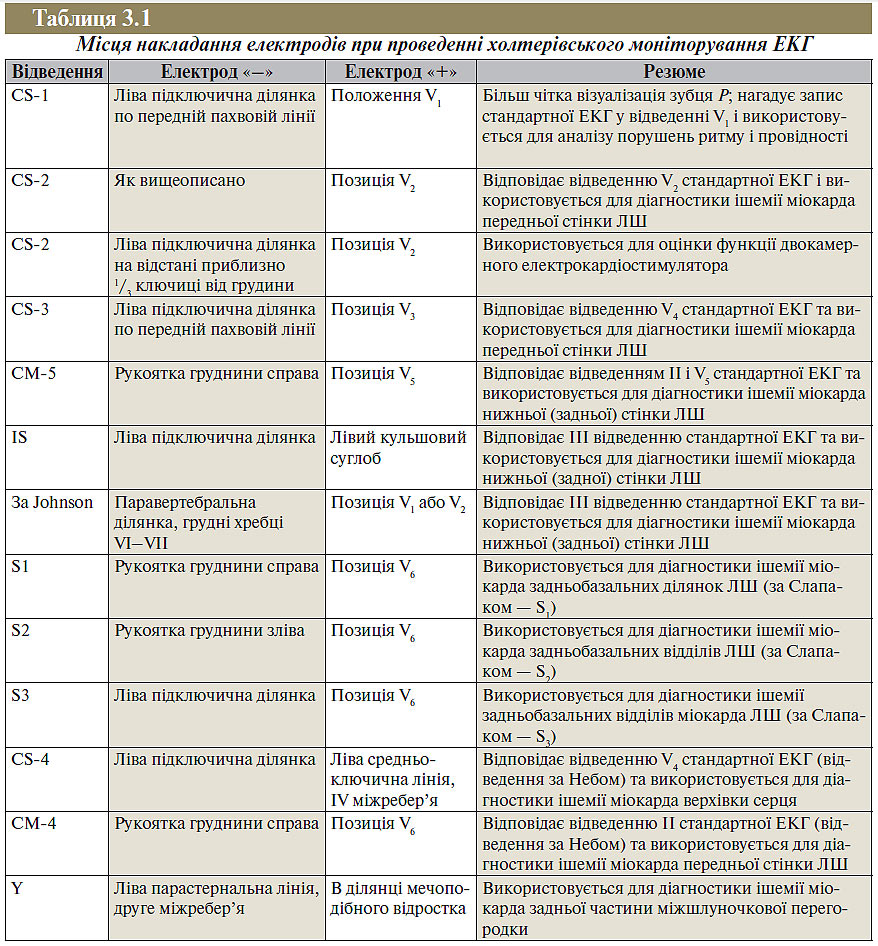
Місця накладання електродів наведені в табл. 3.1.
До наклеєних електродів слід підключити потрібні проводи відповідних кольорів. Потім необхідно прикріпити проводи до грудної клітки пластиром. Дистальні кінці проводів вставляють у рознімання на головному кабелі, що, у свою чергу, приєднують до реєстратора. Останній розміщений у футлярі, закріпленому на поясі пацієнта.
З метою зіставлення зареєстрованого запису ЕКГ і дій, які виконувалися пацієнтом під час дослідження, а також зміни самопочуття, кожен хворий веде під час холтерівського моніторування так званий щоденник пацієнта.
Щоденник пацієнта
У щоденнику необхідно відображати:
1. Рід занять (сон, лікування, прогулянка, прийом їжі, водіння автомобіля, фізичне навантаження, психоемоційний стрес тощо).
2. Симптоми захворювання (біль, відчуття поколювання, тиску, ядуха, серцебиття, запаморочення, загальне нездужання, слабкість).
3. Застосування лікарських засобів (назва препарату і час прийому).
4. Зазначати час початку і закінчення різного роду діяльності, появи і зникнення симптомів.
Пацієнти з болем у ділянці грудної клітки мають звертати увагу на такі моменти:
1. Характер болю: тупий, біль, що давить, колючий.
2. Біль з’явився під час відпочинку, навантаження, емоцій, вночі.
3. Біль зник самостійно (зазначити час).
4. Біль зник після припинення навантаження (час).
5. Біль зник після прийому препаратів (час).
6. Інші причини.
На початку кожного дослідження пацієнту необхідно ознайомитися з такою інформацією:
1. Час звернення до лабораторії з метою зняття реєструвального пристрою.
2. Правила заповнення щоденника пацієнта і показання до використання кнопкового сигналізатора.
3. Заборона на проведення водних гігієнічних процедур на період дослідження.
4. Заборона на використання електричних подушок і покривал.
5. Заборона маніпуляцій з реєстратором.
6. Обов’язковий контроль за станом електродів і проводів та усунення дефекту у разі відклеювання електродів або від’єднання проводів.
АРТЕФАКТИ ЕКГ ПРИ МОНІТОРУВАННІ
ЕКГ-крива достовірно відображає біоелектричну активність серця. Не всі явища, які можуть спостерігатися при відтворенні холтерівського запису, є результатом біоелектричної активності серця; частина з них, що несуть помилкову інформацію, називається артефактами.
Найчастішими причинами артефактів є:
1. Погана підготовка шкіри обстежуваного.
2. Так званий сухий електрод (самостійне висихання гелю, яким насичена губка, що утворює контакт шкіри з металом або висихання гелю у процесі накладання електрода).
3. Поганий контакт між компонентами електричного ланцюга: шкіра обстежуваного — електрод — проведення — головний кабель — реєстратор.
4. Порушення проведення у проводі чи в головному кабелі.
5. Брудні або зношені голівки.
6. Погана якість магнітної стрічки.
7. Погане розмагнічування стрічки.
8. Несправне джерело струму.
9. Несправний реєстратор.
Для запобігання появи артефактів необхідно дотримуватися таких умов:
1. Правильне виконання методики накладання електродів.
2. Відповідна підготовка шкіри перед накладанням електродів.
3. Використання лише рекомендованих електродів.
4. Проведення контролю опору на полюсах 2-полюсних електродів.
5. Використання екранованих проводів і кабелів та їх надійне з’єднання.
6. Контроль надійності з’єднання системи відведень.
7. Прикріплення реєструвальної системи способом, що максимально виключає можливість натягання електродів, яке виникає під час дослідження.
8. Контроль якості зображення ЕКГ на моніторі перед проведенням дослідження.
9. Використання для запису лише спеціальних, рекомендованих виробником устаткування магнітних стрічок (при експлуатації систем, що потребують їх використання).
10. Якісне розмагнічування стрічок, використаних у попередніх дослідженнях.
11. Очищення голівки реєстратора безпосередньо перед кожним дослідженням, а голівки системи аналізу — щодня після виконання аналізу холтерівського запису.
12. Використання спеціальних джерел електроживлення, рекомендованих виробником.
13. Контроль напруги у джерелі струму перед кожним дослідженням.
14. Ознайомлення хворого з методикою дослідження, його метою та основними умовами.
РИТМ СЕРЦЯ ЗДОРОВОЇ ЛЮДИНИ
Холтерівське моніторування ЕКГ зробило революцію в оцінці фізіологічного діапазону порушень ритму і провідності. Виявилося, що межі норми розрізняються залежно від віку, статі, ступеня фізичної та психічної активності обстежуваного. Підсумовуючи висновки різних публікацій, присвячених цьому питанню для різних періодів життя людини, визначимо характерні вікові риси серцевого ритму:
- діти грудного віку: дисфункція синусного вузла;
- діти шкільного віку: АV-блокада;
- особи молодого віку: брадикардія;
- дорослі особи віком молодше 60 років: поодинокі шлуночкові екстрасистоли;
- особи віком старше 60 років: шлуночкова екстрасистолія.
Мінімальна частота синусового ритму протягом доби, частіше під час сну, відзначається у школярів та в юнацькому віці, потім поступово з віком підвищується. Максимальна ЧСС протягом доби у дітей грудного віку досягає 220 уд./хв, у 13-річних дітей — 200 уд./хв, у дорослих вона знижується. Незначно виражена дисфункція синусного вузла при проведенні холтерівського моніторування виявляється практично у всіх здорових пацієнтів. Частіше це спостерігається під час сну у фазу швидких рухів очних яблук.
АV-блокаду I–II ступеня типу Самойлова — Венкебаха досить часто відзначають у дітей, підлітків і спортсменів короткими періодами в денний час під час відпочинку та у період нічного сну. Суправентрикулярну екстрасистолію виявляють приблизно у 3/4 здорових людей: у дітей — у 13% випадків, у осіб молодого віку — 60%, осіб віком старше 60 років — у 90–100% випадків, і практично у всіх пацієнтів віком понад 80 років. У осіб віком старше 80 років без захворювань серця при холтерівському моніторуванні ЕКГ епізоди суправентрикулярної тахікардії реєструють у кожного 3-го хворого.
Виявляємість шлуночкової екстрасистолії у здорових осіб за даними різних авторів коливається від 40 до 80%. У дітей та осіб віком молодше 20 років поодинокі шлуночкові екстрасистоли реєструються приблизно в 1/4 досліджень, з віком частота реєстрації шлуночкової екстрасистолії та загальна їх кількість протягом доби збільшується. У міру старіння організму підвищується частота виявлення складніших шлуночкових аритмій: поліморфних і парних шлуночкових екстрасистол. За даними літератури не підтверджується залежність частоти виявлення шлуночкових порушень ритму від тютюнопаління, фізичної активності.
Порушення ритму, що реєструють у здорових осіб при холтерівському моніторуванні ЕКГ, наведені в табл. 3.2.
ОЦІНКА СИНУСОВОГО РИТМУ
Умовою розпізнавання синусового ритму на ЕКГ, зареєстрованій при проведенні холтерівського моніторування, є наявність позитивних зубців P. Зміни амплітуди зубців P, що часто виявляють на холтерівському записі, є переважно вираженням дихальних або позиційних змін ЕКГ, але можуть бути також ознакою міграції водія ритму по передсердях. Якщо зміни амплітуди зубця P супроводжуються змінами амплітуди інших морфологічних елементів ЕКГ, слід враховувати можливість дихальних або позиційних впливів. Якщо зміни амплітуди зубців P відбуваються ізольовано, це може свідчити про міграцію водія ритму по передсердях.
Синусова тахікардія
Синусова тахікардія — прискорення синусового ритму протягом доби залежно від природної активності людини. У здорових осіб під час значного фізичного навантаження ЧСС може досягати 180 уд./хв. Фізичне чи психоемоційне навантаження зазвичай викликає поступове прискорення синусового ритму. Раптове, як правило, не пов’язане з фізичним чи психоемоційним напруженням, підвищення частоти синусового ритму до 120, а іноді до 200 уд./хв, слід розцінювати як пароксизм синусової тахікардії. Характерною рисою цієї форми порушення синусового ритму є несподіваний початок і несподіване закінчення при ідентичності форми зубців P під час нападу тахікардії та під час основного синусового ритму. Пароксизмальна синусова тахікардія спостерігається переважно у людей середнього і старшого віку, зазвичай при органічних захворюваннях серця.
Синусова брадикардія
Хоча немає конкретної нижньої межі ЧСС при нормальному синусовому ритмі, проте у дорослих пацієнтів уповільнення ЧСС до рівня <50 уд./хв в активний період і <40 уд./хв під час сну вказує на пригнічення функції синусного вузла, пов’язане з гіперваготонією чи органічним ураженням його анатомічної структури. ЕКГ-картина синусової брадикардії може бути зумовлена синоаурикулярною блокадою II ступеня з частотою проведення імпульсів 2:1. Діагностика синоаурикулярної блокади в цьому разі ґрунтується на раптовому зниженні в 2 рази ЧСС під час виникнення блокади і раптовому 2-разовому підвищенні ЧСС після зникнення блокади.
Критерії діагностики дисфункції синусного вузла
1. Постійна синусова брадикардія: протягом всього 24-годинного періоду моніторування ЕКГ ЧСС не перевищує 50 уд./хв.
2. Синусові паузи досягають 3–6 с.
3. Тривалі чи інтермітуючі періоди відмови синусного вузла із заміщаючими ритмами AV-вузла.
4. Документований синдром тахібрадикардії, особливо з відновленням рідкого синусового ритму після припинення суправентрикулярної тахікардії.
Існують певні складності в диференційній діагностиці органічного ураження синусного вузла та вегетативної дисфункції синусного вузла внаслідок підвищення тонусу блукаючого нерва чи зниження тонусу симпатичного нерва. Вегетативна дисфункція синусного вузла може бути крайнім проявом підвищеного тонусу блукаючого нерва у осіб молодого віку, особливо у спортсменів. Відмінною рисою синусової брадикардії внаслідок підвищення тонусу блукаючого нерва є наявність синусової аритмії на вдиху, коли зменшується інтервал R–R і збільшується тривалість інтервалу P–Q. При ураженні синусного вузла вдих не впливає на частоту ритму. Важливе значення в діагностиці має вивчення циркадного ритму. Відношення ЧСС день/ніч при синусовій брадикардії, викликаній підвищенням тонусу блукаючого нерва, становить >1,0, а у хворих із синдромом слабкості синусного вузла <1,0. Також для діагностики синдрому слабкості синусного вузла використовують показники варіабельності серцевого ритму: SDNN, SDANN, SDNNind., яка при цій патології знижена (детальна інформація про ці показники наведена в главі 4 секції 5).
Синусова аритмія
Нерегулярність синусового ритму з укороченням або подовженням інтервалів P–P хоча б на 10% відносно часу попереднього циклу спостерігається у всіх пацієнтів, які пройшли обстеження. Зміна тривалості інтервалів P–P у межах від 50 до 100% часто з’являється під час сну у молодих пацієнтів, значно рідше — в середньому та старшому віці. Для лікаря, який оцінює холтерівський запис, синусова аритмія з великими коливаннями тривалості окремих інтервалів P–P становить складність при диференційній діагностиці з короткочасною відмовою синусного вузла. Якщо на фоні синусового ритму з тривалістю основного циклу, наприклад 0,75 с, виникає пауза 1,7 с між черговими зубцями Р, то відповідно до критеріїв, що використовуються у стандартній ЕКГ, діагностується відмова синусного вузла, оскільки: 1) зубець Р синусового походження не зареєстрований у період більший, ніж 2 інтервали P–P основного ритму; 2) пауза не була кратною тривалості основного циклу. Проте, якщо для синусового ритму в цьому дослідженні характерні значні коливання тривалості інтервалу P–P, то синусова аритмія діагностується навіть тоді, коли з’являються періоди подовження чи укорочення основного циклу серця більше ніж на 100% тривалості попереднього циклу.
Синоаурикулярна блокада
Синоаурикулярна блокада характеризується двома типами на ЕКГ: за типом Мобітц I і Мобітц II. При проведенні холтерівського моніторування найбільша складність полягає в діагностиці синоаурикулярної блокади з періодами Венкебаха. ЕКГ-картина синоаурикулярної блокади II ступеня з періодами Венкебаха залежить від співвідношення кількості проведених до передсердь синусових імпульсів щодо заблокованих синусових імпульсів. ЕКГ-картина синоаурикулярної блокади з періодами Венкебаха має відповідати трьом основним критеріям:
1) поступове зменшення тривалості інтервалів P–P перед випаданням комплексу Р–QRS–T, аналогічне поступовому зменшенню тривалості інтервалів R–R у класичних періодах Венкебаха в AV-вузлі;
2) тривалість інтервалу з випаданням комплексу Р–QRS–T коротша, ніж тривалість двох інтервалів P–P основного ритму;
3) тривалість інтервалу P–P після періодів Венкебаха більша, ніж тривалість інтервалу P–P перед випаданням комплексу Р–QRS–T.
При оцінці холтерівського запису найбільші діагностичні сумніви викликають поодинокі цикли періодів Венкебаха, що з’являються спорадично протягом доби, зазвичай у нічний час.
ПОРУШЕННЯ AV-ПРОВІДНОСТІ
Відображенням AV-провідності на ЕКГ є інтервал P–Q. У дорослих пацієнтів у нормі час проведення імпульсу через праве передсердя, AV-вузол, пучок Гіса та волокна Пуркіньє перебуває в межах 0,12–0,20 с, а у осіб віком старше 50 років — в межах 0,12–0,23 с. Раптове подовження інтервалу P–Q більше ніж на 0,04 мс щодо тривалості попереднього інтервалу P–Q може бути розцінене як поява порушення AV-провідності, навіть якщо величина інтервалу P–Q при цьому не перевищує верхньої межі норми. Принципи діагностики AV-блокади всіх ступенів такі ж, як при звичайній ЕКГ.
Синдром передчасного збудження шлуночків
Укорочений, <0,12 с, інтервал P–Q у поєднанні з ∆-хвилею і розширенням комплексу QRS є однією з характерних рис синдрому передчасного збудження шлуночків. Реєстрація під час холтерівського моніторування періодичного скорочення інтервалу P–Q <0,12 с може бути проявом:
1) інтермітуючого синдрому передчасного збудження шлуночків з періодичною блокадою додаткового шляху проведення;
2) підвищення тонусу симпатичного відділу вегетативної нервової системи і прискорення ритму серця під час фізичного та емоційного навантаження;
3) AV-дисоціації; при однаковій частоті обох інтермітуючих ритмів комплекс QRS ектопічного ритму може реєструватися безпосередньо після зубця Р синусового походження;
4) зміни водія ритму; зубець Р ектопічного ритму може бути позитивним у відведенні СМ-5; незначні зміни форми зубця Р можуть не враховуватися і бути розцінені як позиційні.
СУПРАВЕНТРИКУЛЯРНІ АРИТМІЇ
При холтерівському моніторуванні наявність суправентрикулярних аритмій оцінюється за:
1) кількістю і часом виникнення епізодів серцебиття, ймовірно пов’язаних із суправентрикулярною аритмією;
2) характеристикою аритмії;
3) функцією синусного вузла;
4) зв’язком тахікардії з фізичною активністю;
5) ефективністю терапевтичних або хірургічних методів лікування;
6) AV-провідністю.
Передсердна екстрасистолія
У разі реєстрації передсердних екстрасистол необхідно звернути увагу на морфологію зубця Р, що відрізняється від синусового Р. За зубцем Р передсердної екстрасистоли реєструється комплекс QRS, схожий на комплекс при синусовому ритмі з нормальним проведенням. Іноді складно розрізнити зубець Р передсердної екстрасистоли, оскільки він «захований» у попередньому зубці Т. Інтервал P–R передсердної екстрасистоли >0,11 с. Іноді зубець Р не проводиться, що супроводжується паузою. Блоковані передсердні екстрасистоли — це найбільш часта причина пауз. Якщо зубець Р предсердних екстрасистол відокремити не вдається, ритм може бути прийнятий за синусову брадикардію.
Передсердна тахікардія
При характеристиці надшлуночкових аритмій варто враховувати декілька факторів, що характеризують аритмію. Насамперед, необхідно охарактеризувати стійкість тахікардії. Пароксизмом тахікардії прийнято вважати ≥5 послідовних надшлуночкових комплексів з ЧСС ≥100 уд./хв. Серед надшлуночкових тахікардій прийнято виділяти пароксизмальну передсердну, що, як правило, характеризується нормальною AV-провідністю. Проте можлива пароксизмальна передсердна тахікардія з AV-блокадою I–II ступеня. Серед пароксизмальних форм передсердної тахікардії виявляють атипові форми, наприклад екстрасистолічну форму Gallаvardin. Ця форма відрізняється від класичної оборотно-рецидивуючим характером.
При аналізі тахікардії слід зазначити її тривалість, загальну кількість пароксизмів, аберантність шлуночкових комплексів і, за можливістю, циркадний характер аритмії.
Критерії діагностики тріпотіння передсердь
Це організований, регулярний, швидкий ритм передсердь (близько 300 уд./хв при типовій формі). Хвилі f, що вказують на тріпотіння, швидкі та регулярні й мають характерну конфігурацію у вигляді пилки. Частота таких зубців у типових випадках становить ≤200 уд./хв, особливо при застосуванні антиаритмічної терапії. При типовому тріпотінні з частотою 300 уд./хв одна із двох хвиль f звичайно блокується в ділянці AV-з’єднання, що призводить до виникнення регулярного ритму шлуночків у межах 150 уд./хв. Може також існувати більш високий ступінь блокади: 4:1; 6:1; 8:1 і вище, особливо при прийомі препаратів, що сповільнюють AV-провідність. Конфігурація комплексу QRS зазвичай така ж, як і при основному ритмі. Якщо шлуночковий комплекс широкий, то це відбувається внаслідок аберантної провідності.
Критерії діагностики фібриляції передсердь
Діагностика фібриляції передсердь за допомогою методу холтерівського моніторування ґрунтується на сукупності ряду критеріїв ЕКГ:
1) відсутність зубців Р, які замінені численними f-хвилями різної амплітуди та конфігурації з частотою 400–700 уд./хв (рис. 3.2);
2) різна тривалість інтервалів R–R;
3) комплекси QRS часто неоднакові за амплітудою;
4) ЧСС зазвичай становить 100–180 уд./хв, але може досягати ≥200 уд./хв. При ЧСС >210 уд./ хв і наявності комплексів QRS ≥0,12 с імовірно наявність WPW-синдрому.

Рис. 3.2. Передсердна екстрасистолія та пароксизм фібриляції передсердь
Постійна форма фібриляції передсердь
Більшості хворих із постійною формою фібриляції передсердь необхідне зниження частоти шлуночкових скорочень. Оптимальною є частота шлуночкових скорочень 60–80 уд./хв; проте на практиці у більшості пацієнтів зниження частоти шлуночкових скорочень у стані спокою <80 уд./хв виявляється недостатнім і навіть супроводжується погіршенням стану гемодинаміки.
Частота шлуночкових скорочень у хворих із фібриляцією передсердь розглядається як контрольована, коли:
1) середня частота шлуночкових скорочень у спокої не перевищує 80–90 уд./хв;
2) під час субмаксимального навантаження — 120 уд./хв;
3) при проведенні холтерівського моніторування ЕКГ середня частота шлуночкових скорочень протягом доби не більше 80 уд./хв;
4) немає епізодів, коли протягом 1 год середня частота шлуночкових скорочень перевищує 100 уд./ хв.
Критерії проаритмогенних ефектів антиаритмічних препаратів при лікуванні надшлуночкових аритмій за даними холтерівського моніторування ЕКГ:
1. При лікуванні пацієнтів з фібриляцією передсердь відновлення аритмії у вигляді тріпотіння передсердь з проведенням на шлуночки 1:1.
2. Двонаправлена тахікардія за типом «Torsade de pointes».
3. Поява чи посилення наявної дисфункції синусного вузла.
4. Поява чи підвищення ступеня AV-блокади.
5. Розвиток внутрішньошлуночкових блокад.
6. Збільшення кількості епізодів пароксизмів суправентрикулярної тахікардії, фібриляції передсердь, передсердної екстрасистолії.
ДІАГНОСТИКА ПЕРЕДЧАСНИХ ДЕФОРМОВАНИХ КОМПЛЕКСІВ QRS
Деформація комплексу QRS може бути зумовлена трьома основними причинами:
1) передчасна деполяризація шлуночків імпульсом із центра, розміщеного у провідній системі чи в міокарді шлуночків;
2) аберація порушення внутрішньошлуночкової провідності при суправентрикулярних екстрасистолах;
3) передчасна деполяризація шлуночків у разі минущого синдрому передзбудження, що проявляється лише в передсердних екстрасистолах або поодиноких комплексах синусового ритму.
Головною проблемою диференційної діагностики деформованих комплексів QRS є диференціювання суправентрикулярних екстрасистол з аберацією проведення від шлуночкових екстрасистол. Критерієм розпізнавання екстрасистол надшлуночкового походження є наявність зубця Р перед деформованим комплексом QRS. Якщо передчасний зубець Р важко розпізнати на відрізку ТР, то його варто шукати в зубці Т попереднього серцевого скорочення. Деформація зубця Т у вигляді його розширення, нерівномірності чи загострення з одночасним збільшенням амплітуди дозволяє розпізнати зубець Р, що накладається на зубець Т.
Якщо перед деформованим комплексом QRS не реєструється передчасний зубець Р, то його слід віднести до шлуночкових екстрасистол. Проте у цьому разі не можна виключити аберацію проведення екстрасистоли з AV-з’єднання з невидимим зубцем Р, прихованому в комплексі QRS. У диференційній діагностиці має значення оцінка запису в різний час доби. Зубці Р, приховані в комплексах QRS, можуть бути невидимими протягом дня і при цьому можуть з’являтися вночі у зв’язку із пригнічувальним впливом парасимпатичного відділу вегетативної нервової системи на проведення в AV-вузлі. При диференціації шлуночкових екстрасистол із суправентрикулярними діагностичне значення має оцінка залежності між ступенем деформації передчасних комплексів QRS та їх інтервалом зчеплення з попереднім комплексом синусового ритму. Аберація деформованого комплексу QRS зменшується одночасно із збільшенням інтервалу зчеплення, але періодично, при досить значній величині інтервалу зчеплення, з’являються екстрасистоли з недеформованим комплексом QRS. Водночас форма шлуночкових екстрасистол не залежить від величини інтервалу зчеплення і широкі деформовані комплекси QRS з’являються навіть при дуже великому інтервалі зчеплення (пізні шлуночкові екстрасистоли) (рис. 3.3).
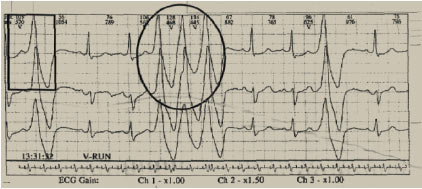
Рис. 3.3. Шлуночкова екстрасистолія та пробіжки шлуночкової тахікардії при холтерівському моніторуванні
Класифікація шлуночкових екстрасистол
При інтерпретації результатів холтерівського моніторування під загальною назвою «шлуночкові аритмії високих градацій» розуміють:
1) поодинокі екстрасистоли;
2) політопні екстрасистоли;
3) екстрасистоли за типом «R на T»;
4) ≥2 послідовних шлуночкових екстрасистол.
Реєстрація ≥3 послідовних шлуночкових екстрасистол з частотою ритму >100 уд./хв, що зникають самостійно за <30 с описується як «нестійка шлуночкова тахікардія». Шлуночковий ритм із частотою >100 уд./хв, що зберігається >30 с, називається стійкою шлуночковою тахікардією.
При інтерпретації результатів холтерівського моніторування зазвичай використовують класифікацію шлуночкових екстрасистол, запропоновану Lown і Wolff, яку раніше рекомендували для оцінки ступеня ризику раптової коронарної смерті у пацієнтів із гострим ІМ. Класифікація наведена в табл. 3.3.
Парасистолічний ритм
Парасистолічний, або подвійний, ритм позначає аритмію, що виникає за рахунок співіснування в міокарді хоча б двох незалежних водіїв ритму. На стандартних ЕКГ, зареєстрованих за досить короткий проміжок часу, розпізнається зазвичай лише класична форма шлуночкової парасистолії. Вона характеризується постійною активністю парасистолічного центру без блокади виходу. Якщо ритм парасистолічного центру більш повільний, ніж синусовий ритм, то на ЕКГ можна розпізнати класичні критерії парасистолії:
1) комплекс QRS шлуночкової екстрасистолії розширений і деформований;
2) періодично реєструються комплекси, що зливаються;
3) екстрасистоли характеризуються непостійним інтервалом зчеплення з комплексом основного ритму;
4) довгі проміжки між двома послідовними екстрасистолами кратні найкоротшому проміжку між ними.
Якщо ритм парасистолічного центра швидший, ніж синусовий ритм, то розпізнавання парасистолії можливе тоді, коли деполяризація шлуночків синусового походження, що періодично виникає, не впливає на парасистолічний центр.
Таблиця 3.3
Класифікація шлуночкових екстрасистол за Lown і Wolff
|
Клас |
Морфологічний опис |
|
0 |
Без екстрасистол |
|
1 |
<30 екстрасистол протягом 1 год* |
|
2 |
≥30 екстрасистол протягом 1 год |
|
3 |
Політопні екстрасистоли |
|
4а |
Парні екстрасистоли |
|
4в |
≥3 послідовні екстрасистоли |
|
5 |
Екстрасистоли типу «R на T» |
*Кількість екстрасистол <30 протягом 1 год дає підставу для розподілу на 1-й і 2-й класи і стосується частоти реєстрації екстрасистол у критичні години, а не середнього значення реєстрації екстрасистол протягом 1 год, розрахованого за даними всього добового моніторування.
ОЦІНКА ФУНКЦІЇ КАРДІОСТИМУЛЯТОРА
Для проведення оцінки функції кардіостимулятора необхідне створення технічних можливостей реєстрації та відтворення на ЕКГ екстрастимулу, що характеризується коротким періодом дії (0,25–1 мс) і малою, у разі двополюсних приладів, амплітудою. Використання системи запису на магнітну стрічку за багатьма параметрами виявилося неефективним.
Тепер можливість точної оцінки функції кардіостимулятора забезпечується завдяки використанню реєстраторів із цифровим аналізом імпульсів. У спеціальних типах реєстраторів, обладнаних так званими детекторами імпульсів стимулятора, ці імпульси постійно реєструються і описуються за тимчасовими параметрами. Одночасно описуються тимчасові залежності між імпульсами стимуляторів і зубцями R. У результаті оцінюється тривалість послідовних інтервалів R–R, R — імпульс стимулятора, імпульс стимулятора — імпульс стимулятора. У стаціонарному апараті обов’язково є функція оцінки вірогідності певних зразків імпульсів стимулятора і після корекції — нового аналізу даних. Кінцеві результати, зображені у графічному і статистичному вигляді, відображають значення і частоту вищенаведених інтервалів. Аналіз результатів дозволяє виявити деякі порушення в роботі стимулятора. Відсутність імпульсів стимулятора за заданою програмою більше максимально припустимої перерви (FTP — failure to pace) призводить до подовження інтервалу R–R більше запрограмованих значень. Порушення керування (FTS — failure to sense), тобто відсутність «чутливості» до імпульсів кардіостимулятора чи імпульсів серця знаходить своє відображення у значенні інтервалів R — імпульс стимулятора чи скороченні подовження до межі. Неефективна стимуляція (FTC — failure to capture) відображається в гістограмі імпульсів стимулятора. Межі значень оцінюваних інтервалів зазвичай встановлюються автоматично для стандартного стимулятора типу VVI, але можуть бути й вільно модифікованими. Дані, представлені графічно і статистично, потребують зіставлення з картиною ЕКГ.
Холтерівська техніка, що дозволяє оцінити функції стимулятора, істотно підвищує можливості виявлення порушень роботи стимулятора при короткочасному характері цих порушень.
ОЦІНКА ЕФЕКТИВНОСТІ Й БЕЗПЕКИ АНТИАРИТМІЧНОЇ ТЕРАПІЇ МЕТОДОМ ХОЛТЕРІВСЬКОГО МОНІТОРУВАННЯ
Оцінка ефективності антиаритмічної терапії
Порівняння результатів двох досліджень, з яких одне виконано до, а друге — після застосування антиаритмічних препаратів, дозволяє оцінити ефективність терапії, виявити проаритмогенні ефекти лікарських засобів. Проте слід зазначити, що порівняльна оцінка результатів моніторування утруднена у зв’язку з проявами індивідуальної варіабельності частоти шлуночкових порушень серцевого ритму.
Найбільш обґрунтовані критерії ефективності лікування шлуночкових аритмій запропоновані Gieca і співавторами. Згідно з цими критеріями ефективною антиаритмічна терапія вважається лише тоді, коли виконана кожна з нижченаведених умов:
1) зменшення кількості шлуночкових екстрасистол більше ніж на 75%;
2) зменшення кількості парних екстрасистол і екстрасистол типу «R на T» більше ніж на 90%;
3) при поліморфності екстрасистол зменшення кількості мономорфологічних типів максимально до 2;
4) повна відсутність епізодів шлуночкової тахікардії.
З урахуванням впливу часу на варіабельність добової кількості шлуночкових екстрасистол при холтерівському дослідженні розроблені критерії оцінки ефективності антиаритмічної терапії для різних проміжків часу (табл. 3.4).
Таблиця 3.4
Критерії оцінки ефективності антиаритмічної терапії залежно від періоду між двома дослідженнями
|
Період, днів |
Зменшення кількості екстрасистол, % |
||
|
взагалі |
парних |
>3 підряд |
|
|
1–7 |
63 |
90 |
95 |
|
8–90 |
79 |
94 |
98 |
|
91–365 |
92 |
98 |
98 |
|
>365 |
98 |
99 |
99 |
Холтерівська оцінка ефективності антиаритмічної терапії має обмеження. Її не проводять у пацієнтів із пароксизмами стійкої шлуночкової тахікардії в анамнезі, у яких кількість шлуночкових екстрасистол <60 протягом 24 год. У такій ситуації результат лікування можна оцінити за допомогою інвазивної стимуляції шлуночків, виконаної до і після застосування лікарських засобів. Отримані іншими методами дані про успішну терапію, що відповідають всім вищенаведеним критеріям, не є однозначними показниками ефективної профілактики стійкої шлуночкової тахікардії й раптової смерті. Класичні приклади цього — результати дослідження CAST, що свідчать про підвищення частоти раптової смерті у пацієнтів, які приймали флекаїнід або енкаїнід, незважаючи на їх достовірну ефективність, підтверджену на основі результатів холтерівського дослідження.
Виявлення проаритмогенної дії антиаритмічних засобів
Використання будь-якого з антиаритмічних препаратів може викликати посилення активності вже виявленої аритмії чи спровокувати появу нових порушень ритму серця. Про проаритмогенний вплив щодо шлуночкових порушень ритму можна говорити тоді, коли при холтерівському моніторуванні ЕКГ виявлено:
1) хоча б 4-кратне збільшення загальної добової кількості шлуночкових екстрасистол;
2) хоча б 10-кратне збільшення кількості парних екстрасистол та епізодів нестійкої шлуночкової тахікардії;
3) поява не зареєстрованої раніше стійкої шлуночкової тахікардії чи нової морфологічної форми стійкої шлуночкової тахікардії.
При виявленні порушень, що відповідають хоча б одному із цих 3 критеріїв, можна говорити про проаритмогенний вплив проведеної терапії. Проаритмогенний вплив одного препарату не означає, що інший препарат, навіть цієї ж групи, може викликати проаритмогенну реакцію. При виявленні проаритмогенного впливу препарату слід враховувати фактори, що спричиняють виникнення проаритмогенної реакції. До провокуючих факторів належать: пароксизми шлуночкової тахікардії чи фібриляція шлуночків в анамнезі, низька ФВ ЛШ, збільшення значення коригованого інтервалу Q–T >0,44 с, застосування в лікуванні серцевих глікозидів.
Частота проявів проаритмогенної реакції, за даними найбільш значних у цій галузі матеріалів Podrid і співавторів, які обстежили >400 пацієнтів, становила в середньому 9% і залежно від групи застосованих препаратів — 6–15%. Частота проявів проаритмогенних реакцій залежно від застосованого препарату наведена в табл. 3.5.

Найчастішою ознакою проаритмогенного впливу у цих пацієнтів були стійка шлуночкова тахікардія чи фібриляція шлуночків (63%). 10-кратне збільшення групових шлуночкових екстрасистол відзначали у 30% випадків, а 4-кратне збільшення загальної кількості шлуночкових екстрасистол — лише у 5%. Виявлення проаритмогенного впливу має важливе значення для прогнозування ризику раптової серцевої смерті при проведенні подальшої терапії іншими антиаритмічними препаратами.
Предиктори проаритмогенної дії для різних класів антиаритмічних препаратів за класифікацією Williams (1970) наведені в табл. 3.6.

ОЦІНКА ІНТЕРВАЛУ Q–T ЯК ПРЕДИКТОРА АРИТМІЙ
Інтервал Q–T відображає тривалість потенціалу дії клітин міокарда (електрична систола міокарда шлуночків). Подовження інтервалу Q–T є незалежним чинником ризику розвитку небезпечних шлуночкових аритмій і раптової кардіальної смерті як при вроджених формах синдрому подовженого інтервалу Q–T, так і при багатьох захворюваннях і клінічних станах, які призводять до його подовження. Виділяють такі стани:
- гостре подовження інтервалу Q–T внаслідок:
- отруєння речовинами, що проявляють кардіотоксичну дію і уповільнюють процес реполяризації шлуночків (фосфор, арсен, ртуть, антиаритмічні препарати (хінідин, дизопірамід, прокаїнамід, аміодарон, соталол, аймалін)), психотропними засобами (амітриптилін, хлорпромазин), еритроміцином, ко-тримоксазолом (при внутрішньовенному введенні);
- гостре порушення електролітного балансу (гіпокаліємія, гіпокальціємія, гіпомагніємія) внаслідок застосування діуретиків;
- черепно-мозкова травма;
- гострий ІМ;
- інфекційно-алергічне ураження міокарда;
- хронічне подовження інтервалу Q–T внаслідок:
- захворювань серцево-судинної системи (різні форми ІХС, систолічна АГ, ДКМП і ГКМП, застійна СН, пролапс мітрального клапана, вроджені вади серця);
- патологічних станів, не пов’язаних з первинним ураженням серця (цукровий діабет, ХОХЛ, термінальна стадія ХНН, хвороба Бехчета, нейрогенна анорексія).
Коректне вимірювання цього інтервалу — обов’язковий компонент дослідження, необхідний для встановлення діагнозу, визначення тактики лікування, оцінки ефективності проведеної терапії.
Ще в перших дослідженнях, на початку розвитку електрокардіографії, було відзначено варіабельність інтервалу Q–T залежно від ЧСС і проведено спроби знайти відповідні нормальні значення. Для розрахунку нормальних величин найбільше поширення одержала формула H. Bazett:
Q–Td = k√R–R,
де k — коефіцієнт, що становить 0,37 для чоловіків і 0,40 — для жінок.
На підставі формули H. Bazett запропоновано обчислювати коригований інтервал Q–T як відношення тривалості інтервалу Q–T (мс) до кореня квадратного величини інтервалу R–R (с):
Q–Tk=Q–Tu/√R–R,
де Q–Tu — вимірюваний інтервал Q–T.
Подовженим вважається інтервал Q–T, що перевищує нормальну розрахункову величину на 0,03 с, або якщо величина коригованого інтервалу Q–T >0,44 с.
У зв’язку з обмеженою кількістю відведень, постуральних змін, зміщення електродів, артефактів і маловивченого впливу добових коливань вегетативної регуляції ритму серця на динаміку інтервалу Q–T його оцінка при холтерівському моніторуванні є важчим завданням, ніж на ЕКГ у спокої. Проте багатьма авторами продемонстрована перевага холтерівського моніторування, що пов’язано з можливістю автоматичного аналізу близько 100 тис. інтервалів R–R і Q–T. У ряді досліджень продемонстрована висока кореляція між тривалістю інтервалу Q–T, вимірюваного одночасно на стандартній ЕКГ і при холтерівському моніторуванні. Так, у роботі J. Christiansen і співавторів вимірювання проводили «вручну» двома незалежними експертами у відведеннях V1 і V5 у 14 хворих віком 4–36 років при швидкості запису 25 мм·с-1. Всього проаналізовано 100 пар виміряних інтервалів Q–T. При порівнянні двох методів виміру, особливо у відведенні V5, відзначено високу кореляцію — від 0,872 до 0,988.
При аналізі результатів холтерівського моніторування інтервали Q–T максимальний (Q–Tmax), мінімальний (Q–Tmin), коригований (Q–Tcor) вимірюються в основному у відведенні СМ5. На підставі результатів багатьох досліджень значення цього інтервалу в нормі більше у жінок, ніж у чоловіків.
Крім того, при моніторуванні спостерігається послаблення взаємозв’язку між інтервалами Q–T і R–R у нічний час, що пов’язано із значним впливом коливань вегетативної регуляції серцевого ритму протягом доби. Слід зазначити, що у хворих із трансплантованим серцем і редукуванням вегетативних впливів на серце різниці між денною та нічною динамікою інтервалу Q–T не виявлено.
Згідно з рекомендаціями Українського товариства кардіологів з профілактики раптової серцевої смерті неінвазивними провісниками тахікардії типу «пірует» внаслідок проаритмогенної дії препаратів є:
1) тривалість інтервалу Q–T >600 мс;
2) подовження інтервалу Т–U, наявність T alternans (коливання конфігурації та амплітуди зубця Т);
3) зміна конфігурації TU у постекстрасистолічному комплексі;
4) наявність «маленьких піруетів» (torsadelets).
Аналіз та врахування особливостей добової динаміки інтервалу Q–T при холтерівському моніторуванні ЕКГ значно підвищує частоту виявлення хворих, у яких можливий розвиток загрозливих для життя шлуночкових тахіаритмій і раптової серцевої смерті.
ВИКОРИСТАННЯ ХОЛТЕРІВСЬКОГО МОНІТОРУВАННЯ ЕКГ У ДІАГНОСТИЦІ ІХС
Використання холтерівського моніторування, на думку його автора, надавало додаткові можливості для діагностики ішемії міокарда, що виникає в амбулаторних умовах. Критеріями ішемії були визнані динамічні зміщення сегмента ST, що супроводжують стенокардію. Проте дійсне визнання і широке використання у клініці метод холтерівського моніторування одержав через 20 років після публікації робіт D. Tzivoni, S. Stern (1974), а потім S. Schang, C. Pepine (1977). Використовуючи холтерівське моніторування, автори описали феномен безсимптомної міокардіальної ішемії у пацієнтів з ІХС. У хворих із стенокардією і нормальною ЕКГ спокою під час холтерівського моніторування дослідники виявили епізоди депресії сегмента ST, причому значна частина з них не супроводжувалася больовим синдромом. Поява названих публікацій викликала дискусію з приводу діагностичної значимості нового методу. Надалі зв’язок змін ЕКГ (депресії сегмента ST) з гіпоксією міокарда було доведено цілою серією робіт. Так, S. Galatius-Jensen і співавтори (1995) в 1-й тиждень гострого ІМ досліджували порушення ритму серця і епізоди депресії сегмента ST за даними холтерівського моніторування одночасно з проведенням пульсоксиметрії. Виявлено, що епізоди нічної десатурації були безпосередньо пов’язані з порушеннями ритму та ішемічних проявів на ЕКГ. S. Schang і С. Pepine (1977) у 20 пацієнтів з ангіографічно доведеною ІХС і позитивними результатами навантажувальних тестів проводили холтерівське моніторування по 10 год протягом 16 міс. Загальний час моніторування становив 2826 год. При цьому виявлено 411 епізодів транзиторних змін сегмента ST, серед яких 308 були безсимптомними. Депресія сегмента ST розвивалася під час сну, у положенні сидячи, при повільній ходьбі, коли ЧСС була значно нижчою, ніж під час навантажувальних тестів. Автори прийшли до однозначного висновку, що безбольові епізоди депресії сегмента ST були дійсно ішемічними, оскільки їх кількість значно зменшувалася на фоні терапії нітратами. В інших дослідженнях у пацієнтів з ІХС результати холтерівського моніторування зіставляли з даними коронароангіографії. Безсимптомні порушення регіонарного міокардіального кровотоку, поряд з аналогічними змінами, які супроводжувалися типовими ангінозними нападами, виявлені під час проведення позитронної томографії. Одночасне проведення сцинтиграфії з 201Тl і навантажувальної проби дозволило виявити минущі безбольові дефекти перфузії міокарда у поєднанні з депресією сегмента ST на ЕКГ.
У подальшому для визначення стану, при якому виявляються об’єктивні ознаки ішемії міокарда та відсутні прояви стенокардії чи її еквіваленти, були запропоновані такі терміни — безбольова, безсимптомна, чи німа ішемія міокарда. Завдяки використанню методу холтерівського моніторування безбольові ішемічні зміни виявлено у 50–100% пацієнтів зі стабільною стенокардією. A. Maseri описав безсимптомні елевації сегмента ST у пацієнтів із вазоспастичною стенокардією (до 70% загальної кількості змін на ЕКГ). Безсимптомні ішемічні епізоди реєстрували у хворих з нестабільною стенокардією, причому в деяких випадках німа ішемія переважала. У 2,5–10% пацієнтів з ІХС захворювання має безсимптомний перебіг. За результатами Фремінгемського дослідження, ІМ без симптомів випадково виявлений у 28% чоловіків і 35% жінок.
Застосування у клінічній практиці методу холтерівського моніторування дозволило документально підтвердити особливий вид безсимптомної ішемії міокарда, значно розширити уявлення про особливості перебігу ІХС, обґрунтувати необхідність усього спектра діагностичних і терапевтичних заходів, спрямованих на виявлення ішемії, виділити окрему форму захворювання — безсимптомну, або німу ІХС.
Використання холтерівського моніторигну у пацієнтів із ІХС найбільш обґрунтовано для діагностики безбольової ішемії міокарда і нападів вазоспастичної стенокардії (стенокардії Принцметала). За допомогою цього методу можлива об’єктивізація клінічного стану хворого за рахунок виявлення «тотального тягаря ішемії» та результатів терапії. Детальну інформацію з використання холтерівського моніторування у осіб із хронічними формами ІХС наведено в секції 8, розділ 3.
Помилки в автоматичному вимірюванні зсувів сегмента ST
Критерії ішемії міокарда наведені раніше. Вони повністю визначаються при візуальній оцінці ЕКГ. Проте при автоматичному аналізі ЕКГ під час холтерівського моніторування часто трапляються помилки в діагностиці ішемії. Помилки при автоматичному вимірюванні зміщень сегмента ST неминучі, тому для підвищення якості діагностики ішемії міокарда за результатами холтерівського моніторування необхідний обов’язковий візуальний контроль ЕКГ-змін при використанні апаратів з автоматичним аналізом запису. Найпоширеніші помилки бувають декількох видів.
1. Помилки, пов’язані з поганою якістю запису.
Ці помилки можливі як при автоматичному комп’ютерному аналізі, так і при візуальному аналізі ЕКГ лікарем. Вони виникають, зокрема, у випадках, коли кожен наступний комплекс записується на новому рівні і вся ЕКГ набуває вигляд хвилеподібної кривої. При цьому немає вираженого зв’язку з диханням. Такі помилки часто визначаються при проведенні фізичного навантаження під час холтерівського моніторування ЕКГ низької якості, з великою кількістю додаткових осциляцій, що реєструються при відриві електрода чи користуванні радіотелефоном, коли рівень артефактів дуже високий.
2. Комп’ютерні помилки, пов’язані з методикою аналізу сегмента ST.
При зміні форми шлуночкового комплексу стрибкоподібно змінюється точка відліку початку сегмента ST. Нестійке положення точки J при зміненій формі комплексу QRS найчастіше пов’язане зі змінами ЧСС. Зміщення сегмента ST оцінюється за правилом: точка J + 60 або 80 мс. Відносно ізоелектричної лінії ця точка може бути дуже непостійною, оскільки будь-яка зміна форми сегмента ST і зубця S призводить до зміни кута між зубцем S і сегментом ST, що відразу відображається на визначенні точки J. Тому частіше визначають не точку J, а точку, що відстає від вершини зубця R на 40 мс, і цю точку приймають за початок відліку зміщення сегмента ST. Тривалість сегмента ST (мс) залежить від ЧСС. При тахікардії практично неможливо визначити кінець шлуночкового комплексу (зубець Т). Одним із прийомів подолання цих труднощів є використання формули Базетта для визначення моменту закінчення шлуночкового комплексу. При такому визначенні тривалість депресії сегмента ST є деякою заданою частиною ділянки ЕКГ від R + 40 мс до кінця зубця Т, наприклад частина від 1/8 до 1/4 цієї ділянки. При тахікардії тривалість депресії сегмента ST перебуває в межах 50–70 мс, а при брадикардії — 70–90 мс від кінця комплексу QRS.
3. Помилка, пов’язана з «прив’язкою» точки J до вершини зубця R.
При динамічній зміні форми шлуночкового комплексу, наприклад, із комплексу із високим зубцем R у комплекс із малим зубцем r або комплекс QS, визначення точки J стає неможливим, оскільки її «прив’язка» здійснюється по верхівці максимально позитивного чи по верхівці максимально негативного зубця шлуночкового комплексу. Найчастіше такі помилки відбуваються при позиційних змінах.
4. Помилки при визначенні ізоелектричної лінії.
Ізоелектричною лінією прийнято вважати відрізок Т–Р. При тахікардії зубець Т часто нашаровується на зубець Р, тому точка відліку виявляється на зубці Р, або ця точка «наїжджає» на наступний комплекс QRS, на зубець Q або R, що не дозволяє правильно орієнтуватися щодо рівня відліку початкової ізоелектричної точки. З’являються стійкі помилки у визначенні ізоелектричної лінії. Внаслідок цього невірно визначається величина зміщення сегмента ST. На тренді сегмента ST майже завжди наявні явища такого роду. При тахікардії навіть за відсутності дійсної зміни сегмента ST визначається його зниження. Рівнем відліку на тренді приймається зміна положення точки J щодо рівня відліку, прийнятого за ізоелектричну лінію. У таких випадках нульова точка виявляється або на зубці Т, або на зубці Р. І те, й інше збільшує позитивне значення точки відліку та призводить до оцінки помилкової депресії сегмента ST.
Клінічну інтерпретацію змін сегмента ST, зареєстрованих протягом доби, слід проводити з урахуванням певних критеріїв. Проводиться аналіз таких параметрів:
1) величина депресії;
2) тип зміщення;
3) тривалість зміни сегмента ST.
Гострий ІМ
F. Zanchi та співавтори (1995) при моніторуванні ЕКГ у перші 12 днів після перенесеного ІМ у 30% хворих виявили епізоди ішемії. Кількість епізодів транзиторної ішемії міокарда зменшувалася з 20% (на 2-й день) до 5% до 12-го дня спостереження. Серед загальної кількості епізодів ішемії до 80% доводилося на безбольову форму і лише 20% відхилень ST супроводжувалися болем. При гострому ІМ частіше відзначають транзиторну елевацію сегмента ST — до 60% епізодів, депресію сегмента ST виявляють у 40% випадків. Елевація визначається, як правило, у відведеннях із зубцем Q або зі зниженим зубцем R. У гострий період ІМ наявність транзиторної ішемії міокарда не впливає на перебіг і прогноз захворювання. Близько 20% хворих як зі змінами сегмента ST, так і без них, входять у групу з ускладненим перебігом захворювання. У підострій стадії ІМ зміщення сегмента ST є чинником високого ризику розвитку таких ускладнень, як повторний ІМ, набряк легень, шлуночкова тахікардія, фібриляція шлуночків, серцева смерть. За даними H. Mickley і співавторів (1995), при тривалому спостереженні (до 5 років) хворих, які перенесли ІМ і мали елевацію сегмента ST при холтерівському моніторуванні, зберігався зв’язок між фактом наявності епізодів елевації та ризиком смерті й розвитком нефатального ІМ. Таким чином, транзиторна ішемія міокарда, особливо німа, часто розвивається в гостру фазу ІМ, проте її прогностичне значення залишається не до кінця з’ясованим. Поява ішемії міокарда у більш пізній строк пов’язана з підвищенням ризику розвитку ускладнень незалежно від наявності больового синдрому, що визначає тактику терапевтичного втручання. Стратифікація ризику у хворих після гострого ІМ з урахуванням комбінованого показника за результатами холтерівського моніторування (варіабельність серцевого ритму, наявність шлуночкової тахікардії та елевації сегмента ST), виявила його високу прогностичну значимість.
Що стосується порушень ритму, які виявляють у гостру фазу ІМ методом холтерівського моніторування ЕКГ, встановлено, що кількість екстрасистол перебуває у прямій лінійній залежності від зменшення ФВ, тобто залежить від скоротної функції міокарда ЛШ. На розвиток аритмії, мабуть, впливає безпосередньо й ішемія міокарда, хоча, за даними P. Dorian і співавторів (1995), реперфузія артерії, що зумовила інфаркт, не впливає на кількість екстрасистол.
ОЦІНКА АКТИВНОСТІ ВЕГЕТАТИВНОЇ НЕРВОВОЇ СИСТЕМИ МЕТОДОМ ХОЛТЕРІВСЬКОГО МОНІТОРУВАННЯ
На стандартній ЕКГ у 12 відведеннях можна виділити ознаки гіперсимпатикотонії та гіперпарасимпатикотонії. Характерні симптоми переваги тонусу симпатичного відділу вегетативної нервової системи — прискорення синусового ритму, збільшення амплітуди зубця Р, сплощення зубця Т, рідше — зниження сегмента ST. Підвищення тонусу парасимпатичного відділу проявляється уповільненням синусового ритму, часом появою суправентрикулярних ритмів, уповільненням AV-провідності аж до блокади II ступеня типу Венкебаха та збільшенням амплітуди зубця Т. Впровадження і поширення 24-годинної реєстрації ЕКГ методом Холтера дозволило виявити частоту виникнення вищезгаданих змін у різні фази добової активності у здорових осіб і вивчити реакцію електричної активності серця на стрес.
Вплив вегетативної нервової системи на електричну активність серця:
1) зміни варіабельності синусового ритму;
2) симпатикотонічні та ваготонічні порушення ритму;
3) депресія сегмента ST;
4) інші порушення реполяризації.
Варіабельність серцевого ритму визначають як вираженість коливань ЧСС щодо її середнього значення. Послідовний ряд кардіоінтервалів не є набором випадкових чисел, а має складну структуру, що відображає регуляторний вплив на синусний вузол серця вегетативної нервової системи й різних гуморальних факторів. Тому аналіз структури варіабельності серцевого ритму надає важливу інформацію про стан вегетативної регуляції серцево-судинної системи і організму в цілому.
Значний вплив на варіабельність серцевого ритму мають циркадні коливання (день-ніч) ритму серця. Крім того, на варіабельність серцевого ритму впливають такі фактори, як фізична активність пацієнта, різні стресові впливи, прийом їжі, сон. Тому при добовому моніторуванні ЕКГ бажано вносити у протокол дію різних факторів, що впливають на ритм серця. При патології необхідно відзначати час і вираженість різних симптомів, особливо болю.
Більш детальну інформацію про методи оцінки варіабельності серцевого ритму наведено в главі 4 секції 5.
Порушення ритму та провідності як прояви вегетативної дисрегуляції
Часто при холтерівському моніторуванні виявляють недостатність, залежну від підвищеного тонусу блукаючого нерва. При цьому реєструють заміщаючі ритми, в тому числі з надшлуночкових водіїв ритму, що сполучаються з уповільненням AV-провідності, а також з AV-блокадою, не перевищуючи ступеня блокади типу Венкебаха. Ця недостатність з’являється у пацієнтів молодого віку із здоровим серцем і не потребує лікування. Проблема полягає в диференційній діагностиці цього стану зі слабістю синусного вузла, особливо у осіб літнього віку або у разі значно виражених змін, наприклад гальмування автоматизму синусного вузла, >2 с або AV-блокади типу Мобітц, особливо якщо ця недостатність проявляється не лише вночі, але й вдень.
Депресія сегмента ST як прояв вегетативної дистонії
До інших змін ЕКГ, зумовлених порушенням тонусу вегетативної нервової системи, слід віднести депресію сегмента ST, що відзначають при гіперсимпатикотонії. При диференційній діагностиці враховується характерна клінічна картина; депресія сегмента ST, виявлена у осіб молодого віку, особливо жінок, часто із супутньою тахікардією, без типових стенокардитичних проявів. Ця картина може бути розцінена як «неспецифічні» зміни сегмента ST або ще більш однозначно — «ознаки гіперсимпатикотонії».
На рис. 3.4 наведено приклад депресії сегмента ST за ішемічним типом у відведенні СМ-5 під час синусової тахікардії з ЧСС 115 уд./хв (а) і неспецифічні зміни ST–T у нічний час (б) у 34-річної жінки.

Рис. 3.4. Депресія сегмента ST за ішемічним типом у відведенні СМ-5 під час синусової тахікардії з ЧСС 115 уд./хв (а) і неспецифічні зміни ST–T у нічний час (б) у 34-річної жінки
Патогенез симпатикотонічної депресії сегмента ST не встановлений; у цьому разі діагностується німа недостатність кровопостачання, але лише у пацієнтів із підтвердженою ІХС — перенесеним ІМ або за даними коронаровентрикулографії, що свідчить про звуження коронарних артерій. Водночас можливо, що депресія сегмента ST, викликана підвищеним тонусом симпатичного відділу вегетативної нервової системи, також відображає недостатність кровообігу, зумовлену звуженням малих коронарних артерій. Можливо, причиною їх звуження під час стресу є не катехоламіни, а, наприклад, нейропептид Y, що вивільняється закінченнями симпатичних нервів під впливом сильного адренергічного впливу, що і викликає звуження малих коронарних артерій.
Інші зміни періоду реполяризації на ЕКГ, зумовлені вегетативною дистонією
З гіперсимпатикотонією пов’язують виникнення на ЕКГ зубця U з амплітудою >1 мм. Зубець U перебуває на спадному коліні зубця Т, а іноді й перевищує його. У стані гіперсимпатикотонії зубці U і T характеризуються мінливістю протягом годин і навіть хвилин реєстрації. Слід пам’ятати, що зубець U дещо іншої конфігурації, який реєструється за високим зубцем Т, частіше у відведеннях V2–V3, є характерною ознакою ваготонії.
Вплив вегетативної нервової системи на тривалість інтервалу Q–T різноплановий: стимуляція β-адренергічних рецепторів вкорочує його, α-адренергічних і мускаринових рецепторів — подовжує. Різниця між найдовшим і найкоротшим інтервалом протягом доби зазвичай не перевищує 3% або 0,01–0,02 с.
ЗВІТ ПРО ПРОВЕДЕННЯ ХОЛТЕРІВСЬКОГО МОНІТОРУВАННЯ
З огляду на різні можливості апаратів, що використовують для реєстрації ЕКГ протягом доби, необхідна єдина схема висновку, яка б відображала всі аспекти, необхідні для ведення хворих.
У звіт про проведення холтерівського дослідження необхідно включати такі обов’язкові блоки:
1) загальна частина;
2) динаміка ЧСС (тобто нормальних комплексів QRS);
3) виявлення порушень ритму і провідності;
4) зміна кінцевої частини шлуночкового комплексу (ST–T);
5) крім того, по можливості, взаємозв’язок цих характеристик між собою та зв’язок виявлених порушень із клінічною симптоматикою.
Загальна частина висновку має включати:
- паспортні дані хворого;
- умови, в яких проводилося спостереження (стаціонарне чи амбулаторне);
- терапію в день дослідження із зазначенням того, що дослідження проведене до призначення (або на фоні відміни) терапії — «фонове» спостереження;
- режим дня хворого, можливе включення в режим дня будь-яких проб;
- тривалість спостереження, використані відведення і якість сигналу (наприклад у вигляді тривалості проміжку часу, придатного для аналізу).
Максимально докладно мають бути описані клінічно значимі порушення ритму і провідності, такі як пароксизми тахікардії чи фібриляції/тріпотіння передсердь, епізоди асистолії, періоди порушення внутрішньошлуночкової провідності і дана оцінка їх характеристик:
- кількість і тривалість пароксизмів тахікардії, ЧСС цих пароксизмів, кількість і тривалість асистолії чи епізодів блокад;
- при частих аритміях підрахувати їх кількість за час спостереження вдень і вночі (може бути обчислений циркадний індекс), середня кількість за час спостереження і коливання;
- корисно доповнити кількісний опис аритмії не лише за період спостереження, але й розраховуючи на 1000 QRS-комплексів.
У разі проведення повторного моніторування ЕКГ обов’язковим блоком висновку є оцінка динаміки отриманих даних. Необхідно відзначити зміни ЧСС, а якщо при першому моніторуванні фіксували аритмію чи епізоди ішемії, то і зміни кількості та характеристик цих порушень. У висновках доцільно провести зіставлення числових значень виявлених змін порівняно з першим обстеженням.
За даним моніторування можна оцінювати ефективність антиаритмічної та антиангінальної (антиішемічної) терапії, а також можливі побічні ефекти препаратів, про що обов’язково зазначають у висновку.
БІФУНКЦІОНАЛЬНЕ МОНІТОРУВАННЯ ЕКГ ТА РІВНЯ АТ
Біфункціональне моніторування ЕКГ та рівня АТ — це метод, що включає визначення АТ протягом доби із синхронною реєстрацією ЕКГ.
Проведення біфункціонального моніторування АТ і ЕКГ показане пацієнтам із:
- ІХС і супутньою АГ: для визначення впливу підвищеного АТ на виникнення ішемічних змін на ЕКГ;
- АГ і порушеннями серцевого ритму, які не вдається виявити при звичайному обстеженні;
- АГ і супутньою ІХС і/чи порушеннями ритму для проведення оцінки адекватності терапії (як антигіпертензивної, так і антиішемічної та антиаритмічної);
- для проведення комплексної оцінки варіабельності АТ і ритму (до і на фоні терапії).
На сьогодні для реєстрації АТ у біфункціональних моніторах використовують аускультативний і осцилометричний методи. Перевага аускультативного методу — певна резистентність до рухів рукою під час моніторування: на виміри тиску практично не впливає виконання фізичної роботи. До недоліків методу відносять: високу чутливість до шуму і точності розміщення мікрофона щодо артерії (необхідно чітко фіксувати манжетку на руці без можливості її зміщення під час тривалого носіння). Крім того, метод потребує безпосереднього контакту мікрофона (поверхні манжетки) зі шкірою пацієнта. Аускультативне вимірювання АТ не забезпечує точності його виміру при аритмії.
В основі осцилометричного методу лежить аналіз пульсації тиску в манжетці, що виникає при передачі на неї пульсації артерії на фоні дозованого зниження тиску, повітря, що накачане в манжетку. Залежність амплітуди пульсації від тиску в манжетці має характерну форму звуку. За рівень САТ приймають тиск, при якому спостерігається найбільш різке збільшення амплітуди пульсації, середнього АТ — максимальної амплітуди пульсації, ДАТ — різке ослаблення амплітуди пульсації. У деяких приладах для більш точного визначення аналізується перша похідна від кривої пульсації (тахоосцилометрія). Перевагами осцилометричного методу є: висока стійкість до зовнішніх шумів (виміри можна проводити навіть у кабіні вертольота), значення тиску практично не залежить від розвороту манжетки та її положення на руці (поки манжетка не досягне ліктьового суглоба), виміри без втрати точності можна проводити через тонку тканину одягу. Крім того, осцилометричний метод дозволяє проводити виміри у випадках, коли аускультативний метод не застосовується — при феномені «аускультативного провалу», «нескінченних» або слабких тонах Короткова. До недоліків методу відносять малу стійкість до рухів рукою — неможливо забезпечити необхідну якість визначення АТ при навантаженні. Як і аускультативний, осцилометричний метод не забезпечує необхідної точності виміру АТ при нерегулярних серцевих скороченнях (аритмії), оскільки ще не існує прийнятої формалізованої методики визначення АТ в таких ситуаціях.
При біфункціональному моніторуванні АТ і ЕКГ визначають як вищезазначені показники холтерівського моніторування, так і показники добового моніторування АТ. До останнього відносять:
- величину середньодобового АТ. Більшість дослідників і програм, закладених в апарати для добового моніторування АТ, використовують середньоарифметичні значення АТ і обчислюють середнє САТ і ДАТ протягом доби, а також окремо в денний (середньоденне АТ) і нічний (середньонічне АТ) періоди моніторування. У найсучасніших програмах, що супроводжують прилади добового моніторування АТ, закладена корекція на різний інтервал виміру АТ вдень і вночі, а також на деякі високоамплітудні артефакти, що значно підвищує точність одержаних середніх величин. У ряді апаратів приводяться гістограми розподілу величин АТ протягом періоду моніторування:
- часовий індекс — відсоток вимірів, під час яких рівень АТ перевищує нормальні величини. Цей показник обчислюють для САТ, середнього і ДАТ, вдень і вночі окремо;
- величину напруження площі підвищеного АТ, що відображає площу під кривою добового графіка АТ, який вище нормальних або «безпечних» величин. Індекс обчислюють окремо як для САТ, так і для ДАТ; для всього періоду моніторування і для денного та нічного періодів окремо;
- добовий індекс, який є важливим і надійним показником добового ритму АТ і який становить ступінь нічного зниження АТ, виражений у відсотках від середньої денної величини;
- варіабельність АТ, що є стандартним відхиленням АТ від середньої величини (STD). Обчислюється індекс варіабельності окремо для денного та нічного періодів добового моніторування АТ.
Нормальні значення цих показників наведені в табл. 3.7.
Таблиця 3.7
Нормальні значення показників добового моніторування АТ
|
Показник |
Нормальні значення |
|
Середньодобове АТ, мм рт. ст. |
<125/80 |
|
Середньоденне АТ, мм рт. ст. |
<135/85 |
|
Середньонічне АТ, мм рт. ст. |
<120/75 |
|
Часовий індекс для АТ, % САТ ДАТ |
<20 <15 |
|
Індекс напруження площі АТ (мм. рт. ст.) · год |
Нормальних значень не існує, індекс оцінюється в динаміці |
|
Добовий індекс, % |
10–20 |
|
Денна варіабельність АТ, мм рт. ст. САТ ДАТ |
15 14 |
|
Нічна варіабельність АТ, мм рт. ст. САТ ДАТ |
15 12 |
Приклади використання методу біфункціонального моніторування АТ і ЕКГ, одержані у відділі симптоматичних артеріальних гіпертензій ННЦ «Інститут кардіології ім. М.Д. Стражеска» (керівник — професор Ю.М. Сіренко), наведені на рис. 3.5–3.8.

Рис. 3.5. Поява депресії сегмента ST на фоні підвищеного АТ у пацієнта з ІХС та АГ

Рис. 3.6. Поява депресії сегмента ST на фоні надмірного медикаментозного зниження рівня АТ у пацієнта з АГ та ІХС

Рис. 3.7. Виникнення передсердної екстрасистолії на фоні підвищеного АТ у хворого з АГ та скаргами на перебої в роботі серця, які не виявлені при рутинній ЕКГ
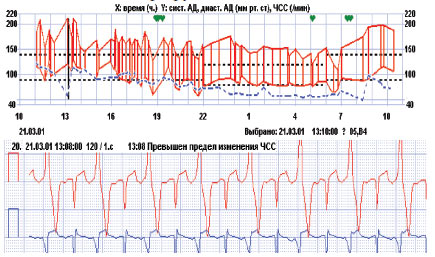
Рис. 3.8. Виявлення ознак інтермітуючого WPW-синдрому при підвищенні АТ у хворого з АГ та скаргами на епізоди серцебиття
ЛІТЕРАТУРА
- Домбровски А., Домбровски Б., Пиотрович Р. (2000) Суточное мониторирование ЭКГ. Медпрактика, Москва.
- ACC/AHA Practice Guidelines ACC/AHA Guidelines for Ambulatory Electrocardiography.
- Ambulatory Monitoring (1983) Cardiovascular System and Allied Applications. C. Marchesi (Ed.) Martinus Nijhoff. Publ., Pisa.
- Armstrong W.F., Jordan J.W., Morris S.N. et al. (1982) Prevalence and magnitude of ST segment and Т wave abnormalities in normal during continuons ambulatory electrocardiography. Am. J. Cardiol., 99: 1638–1642.
- BiaginiA. et al. (1983) In Acute transient myocardial ischemia. Ambulatory Monitoring. Cardiovascular System and Allied Applications. C. Marchesi (Ed.). Martinus Nijhoff Publ. Pisa, p. 105–113.
- Bjerregaard N. (1982) ST—Т changes in the ambulatory ECG on healthy adult subjects. In: Proceedings 9th World Congress of Cardiol. M: 0133.
- Crawford M.H., Mendoza C.A., O’Rourke R.A. et al. (1978) Limitations of continuous ambulatory electrocardiogram monitorings for detecting coronary artery disease. Ann. Intern. Med., 89: 1.
- Deanfeild J.E. et al. (1983) Myocardial ischemia during daily life in patient with stable angina: its relation to symptoms and heart rate changes. Lancet, 2: 753.
- Deedwania P., Pepine C.J., Cohn P. et al. (1993) For ASIST Study Group The monitoring increase in myocardial ischemia is effectively suppressed by atenolol. Circulation., 88: 1594.
- Dellborg M. et al. (1995) Dynamic on-line vector cardiography improves and simplifies in-hospital ischemia monitoring of patients with unstable angina. J. Am. Coll Cardiol., 26: 1501–1507.
- Djiane P., Eqre A., Bory M. et al. (1977) L’enregistrement electrocardiographique continueriez 50 subjects normaux. In: Fuel P. (Ed.) Troubles du rythme et electrostimulation. Toulouse, p. 161–167.
- Dorian P., Langer A., Morgan C. et al. (1994) Importance of ST-segment depression as a determinant of ventricular premature complex frequency after thrombolysis for acute myocardial infarction. Am. J. Cardiol., 74: 419–423.
- Ellestad M.H., Lerman S., Thomas L.V. (1989) The limitations of the diagnostic power of exercise testing. Am. J. Noninvas Cardiol., 3: 139–146.
- Engel U.R., Burckhardt D. (1975) Heufigkeitundart von herzrhythmusstörungen wowie Ekg. Schweiz. Med. Wschr., 105: 1467–1469.
- Galatius-Jensen S. et al. (1995) Nocturnal hypoxemia after myocardial infarction and arrhythmias. Br. Heart J., 73: 488.
- Holier N. (1961) New method for heart studies: continuous electrocardiography of active subjects. Science, 134: 1214–1220.
- Kodama Y. (1995) Evaluation of myocardial ischemia using Holter monitoring. Fukuoka-Igaku-Zasshi, 86: 304–316.
- Mayet J., Shahi M., Poulter N.R. et al. (1995) Ventricular arrhythmias in hypertension: in which patient do they occur? J. Hypertens, 13: 269–276.
- Mickley H., Nielsen J.R., Berning J. et al. (1995) Characteristics and prognostic importance of ST-segment elevation on Holter monitoring early after acute myocardial infarction. Am. J. Cardiol., 76: 537–542.
- Osterhues H.H., Eggeling T., Kochs M., Hombach V. (1994) Improved detection of transient myocardial ischemia by a new lead combination: value of bipolar Nehb D for Holter monitoring. Am. Heart J., 127: 559–566.
- Palatini P., Maraglino G., Accurso V. et al. (1995) Impaired left ventricular filling in hypertensive left ventricular hypertrophy as a marker of the presence of an arrhythmogenic substrate. Br. Heart J., 73: 258–262.
- Schang S.J., Pepine C.G. (1977) Transient asymptomatic ST segment depression during daily activity. Am. J. Cardiol., 39: 396.
- Scheler S., Motz W., Strauer B.E. (1994) Mechanism of angina pectoris in patients with systemic hypertension and normal epicardial coronary arteries by arteriogram. Am. J. Cardiol., 73: 478–482.
- Stern S., Tzivoni D. (1974) Early detection of silent ischémie heart disease by 24-hour ECG monitoring active subjects. Br. Heart J., 36: 481–486.
- Tannenbaum O., Vesell H., Schack J.A. (1967) Comparison of good orthogonal lead system and the one additional chest lead with the conventional 12-lead electrocardiogram. Circulation, 35: 146–157.
- Tzivoni P., Stern S. (1973) Electrocardiographic pattern during sleep in healthy subjects and in pattern with ischémie heart disease. J. Electrocardiol., 6: 25–229.
- Zanchi F., Piazza V., Prati F. et al. (1995) Transient myocardial ischemia detected by Holter monitoring during the early post-infarction period. Coron. Artery Dis., 6: 389–396.