Шлуночкові порушення ритму серця та раптова серцева смерть
Содержание
- СУЧАСНА КЛІНІЧНА ТЕРМІНОЛОГІЯ РАПТОВОЇ СЕРЦЕВОЇ СМЕРТІ
- ЕПІДЕМІОЛОГІЯ
- ШЛЯХИ ЗАПОБІГАННЯ ЗАХВОРЮВАНЬ СЕРЦЯ, ЩО ЗМЕНШУЮТЬ СХИЛЬНІСТЬ ДО ВИНИКНЕННЯ РАПТОВОЇ СЕРЦЕВОЇ СМЕРТІ
- ФАКТОРИ РИЗИКУ РАПТОВОЇ СЕРЦЕВОЇ СМЕРТІ У ПОПУЛЯЦІЇ
- ОЦІНКА КЛІНІЧНОГО ТА ПРОГНОСТИЧНОГО ЗНАЧЕННЯ ШЛУНОЧКОВИХ АРИТМІЙ, МЕТОДИ ДОСЛІДЖЕННЯ АРИТМОГЕННОГО СУБСТРАТУ
- ПРОФІЛАКТИКА РАПТОВОЇ СЕРЦЕВОЇ СМЕРТІ: ЗАГАЛЬНІ ПІДХОДИ
- ПРОФІЛАКТИКА РАПТОВОЇ СЕРЦЕВОЇ СМЕРТІ ПРИ РІЗНИХ КЛІНІЧНИХ СТАНАХ
- Профілактика раптової серцевої смерті у період вагітності
- Профілактика раптової серцевої смерті у людей похилого віку
- Раптова смерть у дітей
- ПЕРВИННА ПРОФІЛАКТИКА РАПТОВОЇ СЕРЦЕВОЇ СМЕРТІ ПРИ «ІСТИННО ЕЛЕКТРИЧНИХ» ЗАХВОРЮВАННЯХ СЕРЦЯ
- Синдром подовженого інтервалу Q–T
- Синдром Бругадa
- Ідіопатична фібриляція шлуночків
- Алгоритми диференційованого ведення хворих зі шлуночковими порушеннями ритму
- ТАХІКАРДІЯ ІЗ ШИРОКИМИ КОМПЛЕКСАМИ (СТІЙКА ШЛУНОЧКОВА ТАХІКАРДІЯ)
- НЕВІДКЛАДНА ДОПОМОГА ПРИ РАПТОВІЙ ЗУПИНЦІ КРОВООБІГУ
- Догоспітальний етап
- Госпітальний етап
- Дефібриляція
- Вентиляція
- Прекардіальний удар
- Доступ до судин
- Насичувальна інфузія
- Додаткова інфузія
- Можливі оборотні причини неефективності серцево-легеневої реанімації
- АВТОМАТИЧНІ ЗОВНІШНІ ДЕФІБРИЛЯТОРИ І ДЕФІБРИЛЯТОРИ-КАРДІОВЕРТЕРИ: ЗНАЧЕННЯ ТА ПЕРСПЕКТИВИ ШИРОКОГО ЗАСТОСУВАННЯ
- Впровадження автоматичних зовнішніх дефібриляторів у країнах Європи та США
- Сучасні автоматичні зовнішні дефібрілятори
- Рекомендовані напрямки застосування зовнішніх дефібриляторів
- Оснащення автоматичними дефібриляторами-кардіовертерами реанімаційних, кардіореанімаційних відділень і палат інтенсивної терапії
- ВИСНОВКИ
- ЛІТЕРАТУРА
Незважаючи на безумовні досягнення в лікуванні захворювань серця, розробку нових і сучасних технологій діагностики та лікування, проблема раптової серцевої смерті навіть у розвинених країнах дотепер залишається невирішеною. Близько 13% випадків смерті від усіх причин виникають раптово, а 88% з них зумовлені раптовою серцевою смертю. У розвинених країнах щорічно раптово помирає 1 з 1 тис. дорослих осіб.
Причиною звернення експертів до цієї проблеми стала поява та накопичення великої кількості нових даних (за результатами великих рандомізованих і проспективних досліджень) про раптову смерть як у пацієнтів із гострим ІМ і СН, так і в осіб із більш нечастими захворюваннями, при яких раптова смерть також є частим ускладненням. Рекомендації щодо лікування шлуночкових аритмій і профілактики раптової серцевої смерті були запропоновані Європейським товариством кардіологів (ЄТК) у 2006 р. у якості базових для розробки національних рекомендацій товариствами — членами ЄТК. Запропоновані методи як первинної, так і вторинної профілактики базуються на чіткій стратифікації факторів ризику, що підтверджені результатами проведених за останній час міжнародних мультицентрових досліджень.
Звичайно, співвідношення вартість/ефективність, а також можливості реального впровадження існуючих підходів до профілактики раптової серцевої смерті залежать від рівня суспільного розвитку та медичних технологій. Тому використовувати рекомендації в повному обсязі в Україні сьогодні неможливо (особливо щодо застосування імплантованих штучних кардіовертерів-дефібриляторів). Але, з огляду на сучасні тенденції інтеграції України з європейськими країнами, вітчизняні фахівці повинні бути ознайомлені з усіма новітніми технологіями, щоб мати можливість обговорювати з пацієнтом усі існуючі можливості для запобігання смерті.
СУЧАСНА КЛІНІЧНА ТЕРМІНОЛОГІЯ РАПТОВОЇ СЕРЦЕВОЇ СМЕРТІ
Термін «раптова серцева смерть» використовували протягом декількох сторіч і стільки ж часу проводилася полеміка щодо його визначення. Приводом для дебатів завжди було питання, коли несподівану смерть слід називати раптовою і яким чином встановити її кардіальне походження. Було запропоновано кілька критеріїв для того, щоб пов’язати раптову серцеву смерть з певним видом такої. Ключові концепції, що є основними при визначенні раптової смерті — нетравматичний характер випадку і той факт, що раптова смерть несподівана та миттєва. Щоб уточнити термін «раптова серцева смерть», було введено слово «кардіальна». Подальша субкласифікація була створена з метою розмежування коронарного і некоронарного генезу раптової серцевої смерті. Спочатку було запропоновано вважати раптовою смертю випадок із клінічними проявами до 24 год, але надалі цей строк був зменшений до 1 год або навіть миті, щоб пояснити найбільш імовірний аритмічний механізм раптової смерті. Внаслідок цього з’явилася велика невідповідність у визначеннях, які використовують у різних клінічних дослідженнях. Проблеми, пов’язані з визначенням способу смерті були предметом дебатів для багатьох авторів. Дуже складно класифікувати випадки смерті, які відбуваються без свідків, як, наприклад, «знайдений мертвим у ліжку». Більшість авторів помилково зараховували такі події до раптової серцевої смерті, навіть тому, що часто неможливо визначити, скільки часу пацієнт залишався живим або протягом якого періоду він відчував симптоми, що передують смерті.
У рекомендаціях ЄТК раптову серцеву смерть визначають як «природну смерть внаслідок серцевих причин, якій передує раптова втрата свідомості протягом 1 год від початку гострих симптомів; можливе діагностування попереднього захворювання серця, але час і спосіб настання смерті несподівані».
У класифікації серцево-судинних захворювань Асоціації кардіологів України раптова серцева смерть знайшла своє відображення і погоджена з МКХ 10-го перегляду:
Раптова серцева смерть (аритмічна) — I46.1 (смерть, що настала протягом 1 год після появи перших симптомів захворювання або істотного погіршення стану хворого на фоні стабільного хронічного перебігу захворювання):
- з відновленням серцевої діяльності:
— фібриляція шлуночків;
— асистолія;
— електромеханічна дисоціація (відзначається по можливості);
- раптова серцева смерть (необоротна):
— фібриляція шлуночків;
— асистолія;
— електромеханічна дисоціація (відзначається по можливості).
Зупинка серця (смерть, що наступила пізніше, ніж через 1 год після появи або збільшення вираженості симптомів захворювання):
- з відновленням серцевої діяльності 145.0;
- зупинка серця (необоротна) 146.9.
Як приклад — клінічний діагноз: аритмогенна дисплазія ПШ, стійка мономорфна шлуночкова тахікардія, раптова серцева смерть (аритмічна), необоротна (фібриляція шлуночків, асистолія, 06.12.2002).
У багатьох випадках раптова серцева смерть є першим, але разом з тим фатальним проявом захворювання серця, і тому основний напрямок досліджень — пошук маркерів ризику та шляхів ефективної профілактики раптової серцевої смерті.
Клінічні прояви раптової серцевої смерті залежать від наявності певного механізму. Відповідно до результатів одного із досліджень серед загальної кількості 157 амбулаторних хворих, які перенесли раптову серцеву смерть під час проведення холтерівського моніторування, смертельні випадки були внаслідок шлуночкових фібриляцій — 62,4%, брадиаритмії — 16,5%, пірует-тахікардії — 12,7%, первинної шлуночкової тахікардії — 8,3%. Зміна сегмента ST відзначена у 12,6%. Чим більш точно встановлений механізм, тим ефективніше можуть бути профілактичні заходи. Хоча і доведено, що в більшості випадків раптової смерті після ІМ основною причиною є тахіаритмії, є й інші механізми, які можуть призводити до раптової смерті, наприклад розрив аорти, розрив субарахноїдальної аневризми, розрив серця і його тампонада, масивна легенева емболія та ін. З іншого боку, смерть може все-таки бути аритмогенною за природою, але не виникає раптово, наприклад, пацієнт, що вмирає в лікарні від гемодинамічного колапсу та ускладнень при стійкій шлуночковій тахікардії.
ЕПІДЕМІОЛОГІЯ
Найбільш важливою причиною смерті серед дорослого населення промислового світу є раптова серцева смерть при ІХС. Біля 5–10% випадків раптової серцевої смерті виникає при відсутності ІХС і СН. Частота випадків виникнення раптової серцевої смерті в різних дослідженнях коливається в діапазоні 0,36–1,28 на 1 тис. жителів/рік. У цих дослідженнях були розглянуті тільки хворі, що були реанімовані службою невідкладної допомоги, або факт раптової смерті був констатований свідками, тому наведені дані нижчі реальних показників раптової серцевої смерті в загальній популяції.
Випадки виникнення раптової серцевої смерті поза лікарнею залежать від віку, статі та наявності або відсутності в анамнезі серцево-судинних захворювань. У чоловіків віком 60–69 років з попереднім анамнезом захворювання серця рівень виникнення раптової серцевої смерті становить 8 на 1 тис. населення/рік. Були вивчені випадки зупинки серця поза лікарнею у осіб віком 20–75 років. 21% усіх летальних результатів були раптовими і несподіваними у чоловіків і 14,5% — у жінок. 80% негоспітальних випадків смерті виникло вдома і близько 20% — на вулиці або в громадських місцях. При дослідженні 300 тис. випадків раптової смерті в США відзначено, що їх серед населення було дещо >1 на 1 тис. на рік.
Найпоширенішою причиною раптової серцевої смерті є гострий коронарний синдром; у 25% пацієнтів з ІХС, що померли раптово, раптова серцева смерть є першим і єдиним проявом захворювання. На раптову серцеву смерть доводиться також 40–50% випадків смерті хворих із СН. У пацієнтів у постінфарктний період при високому ризику (дані досліджень EMIAT, CAMIAT, TRACE, SWORD, DINAMIT) сукупна раптова аритмічна смертність досягла орієнтовно 5% за 1 рік і 9% за 2 роки, у той час як кардіальна смерть неаритмічного генезу склала відповідно 4 і 7%. Формуванню раптової серцевої смерті сприяє ГЛШ.
Разом з тим майже в 12% випадків причина раптової серцевої смерті залишається невстановленою, з огляду на те, що при аутопсії або після всебічного медичного обстеження пацієнтів, які перенесли зупинку серця, ознак серцевого захворювання не виявляють. Відсоток пацієнтів, що вмирають раптово без діагностованого захворювання серця, найбільший у молодому віці. Час від часу з’являються повідомлення про випадки раптової серцевої смерті серед відомих спортсменів, здавалося б, осіб з відмінним станом здоров’я. З епідеміологічної точки зору раптова серцева смерть у молодому віці, насамперед у осіб без клінічних ознак захворювання серця, має обмежене значення, оскільки на неї доводиться лише незначна частина випадків раптової серцевої смерті, що реєструються у загальній популяції. Втім, жертвами раптової серцевої смерті стають практично здорові люди, передчасна смерть яких має трагічні наслідки для родини та суспільства. Захворювання й стани, при яких найчастіше розвивається раптова серцева смерть, наведені в табл. 6.1.
Таблиця 6.1. Захворювання і стани, при яких найчастіше розвивається раптова серцева смерть
|
ШЛЯХИ ЗАПОБІГАННЯ ЗАХВОРЮВАНЬ СЕРЦЯ, ЩО ЗМЕНШУЮТЬ СХИЛЬНІСТЬ ДО ВИНИКНЕННЯ РАПТОВОЇ СЕРЦЕВОЇ СМЕРТІ
З метою профілактики значному контингенту населення необхідно рекомендувати загальні поради щодо способу життя (з огляду на співвідношення вартість/користь лікування). Основна можливість зменшити кількість раптової серцевої смерті в популяції складається в зменшенні поширеності ІХС. Групи високого ризику серед населення слід ідентифікувати окремо. Ідентифікація та лікування таких пацієнтів — основне завдання сучасної кардіології.
Типи профілактики раптової серцевої смерті по-різному розглядають в епідеміологічних та клінічних дослідженнях. З погляду епідеміологів первинна профілактика полягає у запобіганні виникнення захворювання та факторів ризику, вторинна — у виявленні безсимптомного захворювання та застосуванні відповідних терапевтичних заходів з метою запобігання його прогресування. Епідеміологи використовують також термін «третинна профілактика», позначаючи їм заходи, спрямовані на запобігання подальшого погіршення стану хворого або виникнення ускладнень після того, як захворювання вже проявилося певними ознаками.
З клінічної точки зору первинна профілактика раптової серцевої смерті повинна бути спрямована на попередження гострого коронарного синдрому (основної причини раптової серцевої смерті) та інших станів, що сприяють формуванню стійкого або динамічного аритмогенного субстрату в міокарді шлуночків. На відміну від епідеміологічних досліджень, де запобігання раптової смерті аритмічного генезу в осіб, що перенесли ІМ, або у пацієнтів з дисфункцією ЛШ розглядають як третинну профілактику, в клінічній практиці термін «третинна профілактика» не застосовують. Під первинною профілактикою клініцисти мають на увазі терапевтичні заходи з метою попередження раптової серцевої смерті у пацієнтів, у яких, незважаючи на структурне захворювання серця, ніколи раніше не виявляли злоякісних шлуночкових тахіаритмій, а під вторинною профілактикою — заходи по запобіганню раптової серцевої смерті у осіб, реанімованих після епізоду раптової серцевої смерті або після перенесених епізодів життєво небезпечних аритмій серця.
Профілактика раптової серцевої смерті включає заходи, які здійснюються на різних рівнях (етапах):
- запобігання захворювань серця, що підвищують схильність до виникнення раптової серцевої смерті;
- раннє виявлення й усунення станів, що підвищують схильність до виникнення раптової серцевої смерті;
- стратифікація ризику у пацієнтів із захворюваннями серця, у тому числі зі шлуночковими порушеннями ритму, з метою виявлення та захисту осіб з найвищим ступенем ризику;
- негайна та ефективна реанімація у випадку раптової серцевої смерті;
- лікування осіб, які перенесли епізод раптової серцевої смерті і були успішно реанімовані.
Безумовно, на кожному наступному етапі коло пацієнтів, яким можуть бути проведені відповідні лікувально-профілактичні заходи, стає все більш вузьким. З іншого боку, підвищується показник абсолютного ризику і тому поліпшується співвідношення вартості й ефективності профілактичних заходів.
ФАКТОРИ РИЗИКУ РАПТОВОЇ СЕРЦЕВОЇ СМЕРТІ У ПОПУЛЯЦІЇ
Популяційні дослідження в багатьох промислових країнах продемонстрували, що фактори ризику раптової серцевої смерті — переважно такі ж, як і ІХС: підвищення рівня загального ХС і ЛПНЩ, АГ, тютюнопаління і цукровий діабет. У багатьох дослідженнях намагалися ідентифікувати фактори ризику, які допомогли б вірогідно прогнозувати раптову серцеву смерть на противагу гострому ІМ і/або іншим проявам коронарної хвороби в підгрупах населення без діагностованої хвороби серця. У деяких дослідженнях також згадується як специфічний фактор ризику — підвищення ритму серця і велика кількість споживання алкоголю.
Раптова серцева смерть при відсутності ознак структурного захворювання серця
При наявності адекватних діагностичних засобів і достатньої наполегливості дослідників навіть у випадках раптової серцевої смерті без наявності серцевої патології, можна виявити порушення структурно-функціонального стану міокарда. Незалежними механізмами патогенезу раптової серцевої смерті у молодих людей є минуща дія тригерів (запускаючих факторів), вроджені або набуті порушення реполяризації, а також тяжко діагностовані доступними інструментальними дослідженнями зміни міокарда (табл. 6.2).
Таблиця 6.2. Фактори формування раптової серцевої смерті у пацієнтів без ознак структурного захворювання серця
|
Основні групи факторів формування раптової серцевої смерті |
Фактори і клінічні синдроми |
| I. Перехідні тригерні події | Токсичні, метаболічні, електролітний дисбаланс
Вегетативні і нейрофізіологічні порушення Ішемія або реперфузія Гемодинамічні зміни |
| II. Порушення реполяризації високого ризику | Вроджений синдром подовженого інтервалу Q–T
Набутий синдром подовженого інтервалу Q–T Аритмогенна дія препаратів; взаємодія лікарських речовин |
| III. Клінічно приховане захворювання серця | Не діагностовано
Яке не вдається діагностувати |
| IV. Ідіопатична фібриляція шлуночків | Не встановлені |
Очевидно, у міру виявлення цих механізмів діапазон випадків ідіопатичної фібриляції шлуночків буде поступово зменшуватися, а можливості індивідуалізованої профілактики раптової серцевої смерті розширюватися.
Частота, з якою відзначаються випадки раптової серцевої смерті залежно від віку пацієнтів
Співвідношення етіологічних факторів і поширеність раптової серцевої смерті, безумовно, залежать від віку. Провідні причини раптової серцевої смерті у осіб віком до 35 років — міокардит, ГКМП, вроджений синдром подовженого інтервалу Q–T, аритмогенна дисплазія ПШ, синдром Бругада, ідіопатична фібриляція шлуночків. В осіб віком старше 40 років поширеність раптової серцевої смерті в популяції стрімко підвищується, а серед причин раптової серцевої смерті домінують ІХС і кардіоміопатії. У пацієнтів, які раніше перенесли гострий коронарний синдром, імовірність раптової серцевої смерті становить 5% на рік, з ФВ ЛШ <35% і/або СН — 20%, після перенесеної зупинки серця або небезпечних для життя порушень ритму з успішною реанімацією — 25%, у пацієнтів з групи високого ризику після перенесеного ІМ >30% на рік. Ще раз підкреслимо, що в загальній популяції дорослих осіб імовірність раптової серцевої смерті становить у середньому 1 випадок на 1 тис. на рік, і раптова серцева смерть є однією з основних причин смерті в розвинених країнах. Ці дані свідчать про важливість профілактики раптової серцевої смерті як глобальної медико-соціальної проблеми.
Гіпертензія і ГЛШ
Гіпертензія — відомий фактор ризику ІХС, але кілька епідеміологічних досліджень показали, що вона відіграє непропорційну роль у підвищенні ризику раптової серцевої смерті. Ефект зниження АТ при виникненні раптової серцевої смерті чітко не був встановлений за допомогою рандомізованих досліджень у зв’язку з невеликою кількістю досліджених і недостатньо високим ризиком кардіальної смерті. Основний механізм, за допомогою якого АГ призводить до раптової серцевої смерті — це ГЛШ. Інші детермінанти ГЛШ включають вік, ожиріння, високий рівень глюкози в крові та генетичні фактори.
Ліпіди
Епідеміологічний зв’язок між підвищеним рівнем ХС (ХС ЛПНЩ) і ризиком усіх проявів ІХС, включаючи раптову серцеву смерть, добре відомі. Тому одна зі стратегій оцінки ймовірності раптової серцевої смерті — популяційний підхід з метою кращого виявлення ІХС та субклінічних структурних змін міокарда. У цьому випадку стратифікація ризику раптової серцевої смерті є невід’ємною частиною оцінки загального ризику у пацієнтів з ІХС. Проведення скринінгового обстеження і особливе втручання з метою корекції факторів ризику ІХС у всій популяції пов’язані з природними труднощами. Більш реальне і перспективне обстеження та втручання у чітко визначених контингентів. Прикладом такого скринінгу можуть бути оцінка ліпідного профілю та реєстрація ЕКГ у спортсменів високої кваліфікації. Очевидно, вибір того або іншого контингенту для скринінгового обстеження, а також його обсяг залежать від співвідношення вартості й очікуваної ефективності.
Оскільки найпоширенішою причиною раптової смерті є ІХС, логічно припустити, що у запобіганні раптової серцевої смерті найбільший ефект може дати корекція ішемії і пов’язаних з нею станів, зокрема приголомшеного, внаслідок реперфузійного ушкодження або гібернованого міокарда. У цих випадках профілактика раптової серцевої смерті не може розглядатися як самостійний напрямок лікування ІХС, а є одним із позитивних наслідків адекватної протиішемічної терапії. За даними ряду досліджень реваскуляризація серцевого м’яза методами АКШ або перкутанної транслюмінальної коронарної ангіопластики дозволяє не тільки поліпшити функціональний стан і якість життя, але й зменшити кількість різних кінцевих точок у хворих з ІХС і критичними стенозами коронарних артерій, у тому числі ймовірність розвитку у них раптової серцевої смерті. Наявність міокарда, що погано скорочується, але залишається життєздатним (гібернованим), є незалежним чинником ризику раптової серцевої смерті, відновлення ж коронарного кровопостачання дозволяє знизити чутливість шлуночків. Встановлено, що адекватна корекція ішемії міокарда особливо ефективна для попередження раптової серцевої смерті у пацієнтів з такими клінічними показниками:
1) функція ЛШ відносно збережена (ФВ ЛШ 40–45%), без аневризми;
2) під час перенесеного раніше епізоду раптової серцевої смерті була зареєстрована фібриляція шлуночків;
3) при внутрішньосерцевому ЕФД нестійка мономорфна шлуночкова тахікардія, але була індукована фібриляція шлуночків;
4) при навантаженні відтворювалася ішемія міокарда;
5) під час коронарографії виявлений критичний стеноз судини, що живить ішемізований або гібернований міокард.
У випадку, якщо пацієнтам з ІХС не може бути проведена повна реваскуляризація або є виражені зміни функції або геометрії шлуночків, так само як при кардіоміопатіях, переважно проводять заходи, спрямовані на лікування основного захворювання. Слід зазначити, що частота виникнення раптової серцевої смерті протягом останніх років є однією з кінцевих точок контрольованих досліджень ефективності медикаментозних і немедикаментозних засобів лікування кардіологічних захворювань, зокрема ІХС і СН. У цих дослідженнях, що відповідають критеріям доказової медицини, здатність знижувати ризик раптової серцевої смерті у пацієнтів після ІМ переконливо доведена для блокаторів β-адренорецепторів, інгібіторів АПФ і статинів, а у пацієнтів із СН — для інгібіторів АПФ (еналаприл, каптоприл, лізиноприл та ін.), блокаторів β-адренорецепторів (метопролол, бізопролол і карведилол) і антагоністів рецепторів альдостерону (спіронолактон). З урахуванням маркерів ризику небезпечних для життя аритмій вирішується питання про імплантацію автоматичного внутрішнього штучного кардіовертера-дефібрилятора.
Дієтичні фактори
Вивчення американськими лікарями 20 551 чоловіка віком 40–84 років без ІМ в анамнезі показало, що у пацієнтів, що вживають рибу не менше 1 разу на тиждень, відносний ризик раптової серцевої смерті становив 0,48 (р=0,04) порівняно з тими, які вживали рибу <1 разу на місяць. Цей ефект не залежав від інших факторів ризику. Доведено, що вживання морських продуктів, що містять омега-3 жирні кислоти, було також пов’язане зі зниженням ризику раптової серцевої смерті.
Фізична активність
Зв’язок між значним навантаженням і раптовою серцевою смертю добре відомий, але основні механізми не встановлені. Оскільки ризик раптової серцевої смерті й ІМ, як відомо, значно зростає під час фізичного навантаження, важливим для охорони здоров’я є питання про те, чи знижує ризик раптової серцевої смерті регулярне виконання помірного фізичного навантаження. Після корекції інших коронарних факторів ризику було встановлено, що частота раптової серцевої смерті у суб̓єктів, що регулярно виконують помірне фізичне навантаження (наприклад робота в саду або прогулянка) або вправи підвищеної інтенсивності протягом >60 хв на тиждень, була приблизно на 70% нижчою, ніж у осіб, що не виконують нічого з перерахованого вище. Ці дані свідчать на користь регулярної фізичної активності з метою профілактики раптової серцевої смерті.
Вживання алкоголю
Так само, як у випадку з фізичними вправами, існує залежність між вживанням алкоголю і ризиком раптової серцевої смерті. Надмірне вживання алкоголю, особливо тривале, підвищує ризик раптової серцевої смерті. Цей взаємозв’язок можна пояснити виявленням подовженого інтервалу Q–T у алкоголіків. Проте ряд робіт, присвячених цій темі, свідчать про позитивний ефект помірного (до 30–40 мл/добу в перерахунку на етиловий спирт) вживання алкоголю для профілактики раптової серцевої смерті.
ЧСС і її варіабельність
Підвищення ЧСС і низька варіабельність серцевого ритму були доведені як незалежні фактори ризику раптової серцевої смерті в проведених численних дослідженнях. Взаємозв’язок між підвищеною ЧСС і раптовою серцевою смертю відзначений у осіб з/без хвороб серця, з підвищеним ІМТ. Зниження варіабельності ритму серця свідчить про дисбаланс вегетативної регуляції серцевого ритму зі зниженням активності парасимпатичного відділу вегетативної нервової системи й подальшим зниженням порога формування шлуночкових порушень ритму високих градацій. Відомо, що низькі показники добової варіабельності серцевого ритму після гострого ІМ (стандартна погрішність інтервалів R–R через добу — <40–50 мс) є високочутливим провісником зменшення тривалості життя внаслідок розвитку в майбутньому шлуночкової тахікардії та фібриляції шлуночків, навіть порівняно з такими важливими прогностичними факторами, як ФВ ЛШ і реєстрація шлуночкових порушень ритму високих градацій при холтерівському моніторуванні ЕКГ.
Тютюнопаління
Доведено, що тютюнопаління — незалежний фактор ризику раптової серцевої смерті та ІМ. Це стосується і пацієнтів без ІХС. Тривале тютюнопаління є також незалежним фактором ризику для повторної раптової серцевої смерті у пацієнтів, які вже перенесли негоспітальну зупинку серця.
Цукровий діабет
У літературі висловлюються протилежні думки щодо того, чи є зниження толерантності до глюкози або цукровий діабет незалежним фактором ризику раптової серцевої смерті. Результати Австралійського і Паризького проспективного досліджень свідчать, що цукровий діабет в анамнезі є значимим чинником ризику раптової серцевої смерті. Навпаки, Американське дослідження вважає діабет фактором ризику раптової серцевої смерті тільки у хворих з доведеною ІХС. В інших дослідженнях, проведених у Фінляндії та Великобританії, цукровий діабет не був визначений як незалежний фактор ризику раптової серцевої смерті.
Зміни ЕКГ
12-канальна ЕКГ — простий неінвазивний метод, який можна широко застосовувати під час первинного обстеження пацієнта для оцінки серцево-судинного ризику. Розвиток комп’ютеризованих алгоритмів аналізу робить інтерпретацію ЕКГ доступною для лікарів некардіологічного профілю. Проведені дослідження підтвердили прогностичну цінність депресії сегмента ST або інверсії зубця Т як маркерів ризику серцево-судинної смерті й раптової серцевої смерті зокрема.
Інтервал Q–T
Цінним неінвазивним маркером підвищеного ризику небезпечних для життя шлуночкових порушень ритму є збільшення тривалості інтервалу Q–T, причому не тільки як прояв вродженого синдрому подовження реполяризації шлуночків. За даними холтерівського моніторування ЕКГ раптовій аритмічній смерті в ряді випадків безпосередньо передує нетривале подовження інтервалу Q–T. Дослідники звертають увагу також на дисперсію Q–T — різницю між найбільшою та найменшою тривалістю інтервалу Q–T у різних відведеннях на поверхневій ЕКГ, зареєстрованій на 12-канальному електрокардіографі. У деяких хворих з дисфункцією або ГЛШ дисперсія інтервалу Q–T зростає до 85–100 мс і більше, що може свідчити про електричну негомогенність міокарда, збільшення неоднорідності реполяризації та схильності до розвитку шлуночкових порушень ритму високих градацій, особливо при поєднанні з іншими маркерами аритмогенезу. Дотепер немає однозначних рекомендацій з оптимального методу дослідження дисперсії реполяризації шлуночків у повсякденній клінічній практиці та її нормальних показниках. Тому цей параметр не враховували як предиктор розвитку раптової серцевої смерті.
ОЦІНКА КЛІНІЧНОГО ТА ПРОГНОСТИЧНОГО ЗНАЧЕННЯ ШЛУНОЧКОВИХ АРИТМІЙ, МЕТОДИ ДОСЛІДЖЕННЯ АРИТМОГЕННОГО СУБСТРАТУ
Шлуночкові порушення ритму
Проблема шлуночкових порушень ритму займає особливе місце в сучасній кардіології, що зумовлено як високою частотою шлуночкових порушень ритму, так і труднощами оцінки необхідності їх подолання. Багато десятиріч зусилля дослідників були зосереджені на розробці засобів для усунення спонтанних шлуночкових порушень ритму на підставі глибокого вивчення електрофізіологічних механізмів формування аритмії. Надалі в 70-ті роки ХХ ст. з’явилися нові й надзвичайно ефективні антиаритмічні засоби, були введені нові методи підбору та оцінки ефективності терапії, зокрема холтерівське моніторування ЕКГ і внутрішньосерцеве ЕФД. Вони забезпечили можливість точної кількісної оцінки шлуночкових порушень ритму, характеристики морфологічних особливостей і субстрату аритмії (табл. 6.3), цілеспрямованого підбору лікування не тільки при шлуночковій екстрасистолії, але й при небезпечних для життя шлуночкових тахікардіях.
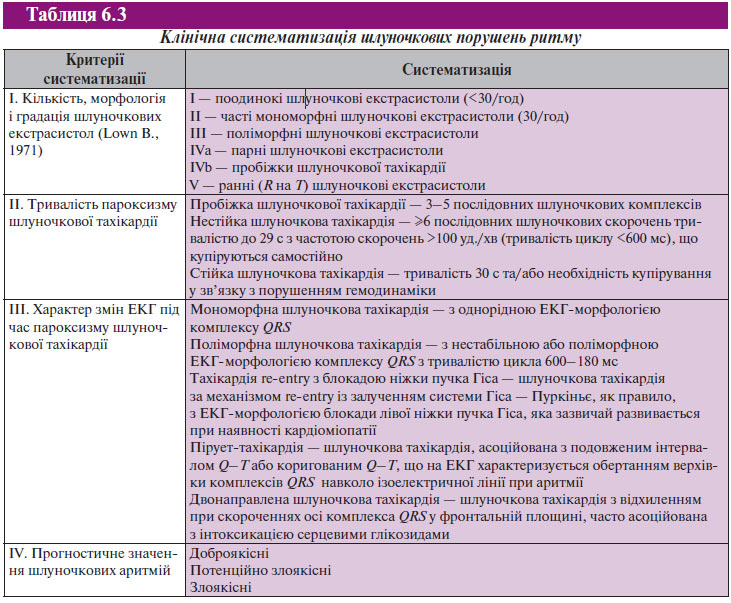
Переломною подією для клінічної аритмології стало наприкінці 1980-х років узагальнення результатів багатоцентрових досліджень CAST. Виявилося, що усунення шлуночкової екстрасистолії потужними й ефективними антиаритмічними засобами I класу не дозволяло запобігти раптовій смерті і, більше того, супроводжувалося погіршенням довгострокового прогнозу хворих з постінфарктною дисфункцією міокарда, насамперед за рахунок підвищення небезпеки проявів аритмогенної дії. Тому в 90-х роках ХХ ст. кардинально змінилася стратегія лікування шлуночкових порушень ритму, були переглянуті показання до застосування антиаритмічних препаратів у різних категорій хворих на підставі прогностичного аспекту оцінки ефективності терапії.
До найважливіших завдань ведення хворих зі шлуночковими порушеннями ритму належать:
1) усунення гемодинамічних змін і симптомів, викликаних аритмією (у тих випадках, коли аритмія симптоматична);
2) запобігання шлуночкових порушень ритму високих градацій, раптової серцевої смерті та поліпшення довгострокового прогнозу (у тих випадках, коли є маркери ризику раптової серцевої смерті).
У багатьох випадках шлуночкові порушення ритму не супроводжуються клінічними симптомами, а усунення аритмії далеко не завжди доцільне з огляду на ризик раптової серцевої смерті. Отже, призначенню терапевтичних заходів повинна передувати оцінка клініко-гемодинамічного й прогностичного значення аритмії у конкретного хворого.
Клініко-гемодинамічне значення шлуночкових порушень ритму полягає у можливості ставати причиною симптомів і синдромів, які або безпосередньо пов’язані з порушеннями гемодинаміки (синкопальні стани, стенокардія, СН, артеріальна гіпотензія і колапс), або, не погіршуючи стану гемодинаміки, негативно впливають на якість життя хворого (запаморочення, нудота, тривога, іноді страх і передсинкопе). Проте дуже часто шлуночкові порушення ритму мають безсимптомний перебіг.
Ретельний збір анамнезу та обстеження хворого дають можливість встановити прогностичне значення шлуночкових порушень ритму, які деякою мірою пов’язані з клініко-гемодинамічними порушеннями, але не завжди відповідають виявленим симптомам. Зокрема, в окремих випадках прогностично незначущі шлуночкові порушення ритму можуть супроводжуватися інвалідизуючими симптомами. З іншого боку, безсимптомні шлуночкові порушення ритму у хворих з тяжким структурним ураженням міокарда (насамперед постінфарктним кардіосклерозом і/або СН) значно погіршують прогноз. У хворих із систолічною дисфункцією міокарда і СН прогноз виживаності залежить від градації аритмії: поява шлуночкової екстрасистолії відображає тяжкість ураження серцевого м’яза і є своєрідним маркером помираючого серця, а шлуночкові порушення ритму високих градацій — ще й свідченням підвищення імовірності раптової аритмічної смерті.
Сучасна комплексна оцінка прогнозу хворих зі шлуночковими порушеннями ритму вимагає синтезу всієї наявної інформації не тільки про характер самого порушення ритму, але й про основне захворювання — етіологічний фактор шлуночкових порушень ритму. Це починається вже при опитуванні та об’єктивному огляді і є одним з основних завдань подальшого інструментального обстеження хворих зі шлуночковими порушеннями ритму (табл. 6.4).

Обов’язковим елементом обстеження хворих та оцінки прогностичного значення аритмії є ехоКГ-дослідження, що надає важливу інформацію про структурне ураження серця, наявність рубцевих змін міокарда і його гіпертрофії, а також про ступінь дисфункції ЛШ (табл. 6.5).

Шлуночкові порушення ритму вважають доброякісними, якщо вони не викликають порушень гемодинаміки, не пов’язані зі структурним ураженням серцевого м’яза і мають низьку градацію (поодинокі шлуночкові екстрасистоли). Шлуночкові порушення ритму розцінюють як доброякісні приблизно у 30% усіх хворих із симптоматичними шлуночковими аритміями.
Потенційно злоякісні шлуночкові порушення ритму пов’язані зі структурною патологією міокарда, дисфункцією серцевого м’яза, але також не викликають істотних гемодинамічних симптомів. Потенційно злоякісними можуть бути шлуночкові порушення ритму будь-яких градацій, за винятком стійкої шлуночкової тахікардії. До цього класу належать близько 65% усіх випадків шлуночкових порушень ритму.
Злоякісні шлуночкові порушення ритму майже завжди виникають на фоні тяжкої структурної патології та дисфункції міокарда, викликають значимі гемодинамічні порушення і є шлуночковими порушеннями високої градації (зазвичай це пароксизми стійкої шлуночкової тахікардії). До злоякісних належать до 5% усіх випадків шлуночкових порушень ритму.
З метою встановлення частоти і градації аритмії у хворих зі шлуночковими порушеннями ритму досить зареєструвати звичайну ЕКГ спокою. Показанням для здійснення холтерівського моніторування ЕКГ з діагностичною метою є періодична поява нападів сильного серцебиття, синкопальних станів невизначеної етіології та інших симптомів, імовірно зумовлених тахіаритмією, не зареєстрованою на ЕКГ. Холтерівський моніторинг використовують не тільки для верифікації ризику раптової серцевої смерті, а й для оцінки ефекту антиаритмічної терапії. Найчастіше в клінічній практиці використовують критерії ефективності антиаритмічної терапії, які були запропоновані Хоровицем і Лауном:
- зменшення на 50% загальної кількості шлуночкових екстрасистол;
- зниження на 90% парних шлуночкових екстрасистол;
- повне зникнення пробіжок шлуночкової тахікардії.
Проведення проби з дозованим фізичним навантаженням повинно бути рекомендовано дорослим пацієнтам зі шлуночковою аритмією, що має помірну або високу вірогідність наявності ІХС (з урахуванням віку, статі й симптоматики), що може ініціювати розвиток ішемічних змін або шлуночкову аритмію.
Проведення ехоКГ рекомендується хворим зі шлуночковими порушеннями з підозрою на органічне захворювання серця або родичам хворих зі спадковими порушеннями, асоційованими з раптовою серцевою смертю. Рекомендується проведення стрес-тестів з фармакологічними пробами або проби з дозованим фізичним навантаженням із будь-яким методом візуалізації (ехоКГ або однофотонна емісійна КТ з перфузією міокарда) для виявлення німої ішемії у хворих зі шлуночковими аритміями, у яких відзначають помірну вірогідність наявності ІХС.
Проведення МРТ, КТ серця або радіоізотопної ангіографії може бути необхідним у пацієнтів зі шлуночковими аритміями у випадках, коли ехоКГ не дозволяє точно оцінити функцію ЛШ або ПШ серця і/або виявити характер його структурних змін.
Проведення коронарної ангіографії допомагає встановити або виключити наявність ІХС з вираженою оклюзією коронарних артерій у пацієнтів із загрозливими для життя шлуночковими аритміями або у осіб, що перенесли раптову серцеву смерть, у яких відзначають помірну вірогідність наявності ІХС (з урахуванням віку, статі і симптоматики). Візуалізація ЛШ може бути доцільна у пацієнтів, яким планують встановити бівентрикулярний кардіостимулятор.
Сигнал-усереднена ЕКГ високого розрізнення
З метою виявлення аритмогенного субстрату у хворих з нападами серцебиття і короткочасною втратою свідомості невстановленої етіології, особливо при наявності структурного ураження міокарда, здійснюють дослідження ППШ. В ураженому міокарді ППШ — низькоамплітудні високочастотні електричні сигнали наприкінці комплексу QRS або на початку сегмента ST є відображенням зони сповільненого проведення, що може стати субстратом для повторного входу збудження і виникнення пароксизмальної шлуночкової тахікардії. Виявлення ППШ дозволяє передбачати підвищений ризик фатальних аритмій після перенесеного ІМ і полегшити відбір хворих для проведення внутрішньосерцевого ЕФД.
Внутрішньосерцеве ЕФД
Програмоване внутрішньосерцеве ЕФД є еталонним (хоча й не рутинним) методом діагностики шлуночкових порушень ритму у хворих з нападами серцебиття й синкопальними станами невизначеної етіології. Проте внаслідок зміни стратегії лікування злоякісних шлуночкових порушень ритму, коли не так часто використовують антиаритмічні засоби I класу, а в основному емпірично призначають аміодарон і блокатори β-адренорецепторів (у розвинених країнах, крім того, імплантують кардіовертер-дефібрилятор), внутрішньосерцеве ЕФД з послідовною оцінкою ефективності антиаритмічних засобів проводять рідко. Разом з тим зросло значення внутрішньосерцевого ЕФД для картування міокарда й визначення локалізації джерела тахіаритмії перед виконанням процедури катетерної радіочастотної абляції ектопічних вогнищ, імплантації штучного кардіовертера-дефібрилятора.
Генетична база раптової серцевої смерті
Раптова кардіальна смерть може виникати як результат спадкової генетичної патології, що впливає на ключові білки серця. Хвороби типу синдрому подовженого інтервалу Q–T, синдрому Бругада, ГКМП, аритмогенної дисплазії ПШ, катехоламінергічної поліморфної шлуночкової тахікардії або ДКМП — приклади ймовірних факторів раптової серцевої смерті. Свідчення щодо підтримки існування генетичного фактора схильності до раптової серцевої смерті було виявлено після великих епідеміологічних досліджень, що продемонстрували зв’язок раптової серцевої смерті зі спадковістю. Наявність у сімейному анамнезі зупинки серця і генетичної патології (синдром подовженого інтервалу Q–T, синдром Бругада, ГКМП) слід обов’язково всебічно оцінювати, особливо якщо мова йде про зупинку серця в молодому віці. У цих випадках необхідно активно запобігати розвитку ІХС.
ПРОФІЛАКТИКА РАПТОВОЇ СЕРЦЕВОЇ СМЕРТІ: ЗАГАЛЬНІ ПІДХОДИ
Первинна профілактика раптової серцевої смерті у хворих з ІХС. Відповідно до концепції трикутника П. Кумеля умовами формування раптової серцевої смерті у пацієнтів з ІХС є взаємозалежні фактори:
1) наявність чутливого міокарда (компоненти якого — залишкова ішемія, електрична нестабільність і дисфункція ЛШ);
2) дія різних тригерів (тахікардія, екстрасистолія);
3) на фоні впливу відповідних модуляторів (дисфункція вегетативної нервової системи, найчастіше — зниження активності її парасимпатичного відділу та порога виникнення фібриляції шлуночків).
Сучасні уявлення про аритмогенний шлуночок включають поєднання механічної дисфункції (внаслідок розтягання волокон, із структурним і електричним ремоделюванням камер серця та кардіоміоцитів), порушення функції іонних каналів, ішемію і наявність рубця або іншого ураження тканини міокарда, а також порушення провідності. Враховуючи наведені фактори, найкраще розроблені методи оцінки ризику раптової серцевої смерті саме у пацієнтів зі структурним захворюванням серця, особливо у тих, які були реанімовані після раптової серцевої смерті або перенесли раніше епізоди небезпечних для життя порушень ритму.
Принципи індивідуалізованої оцінки ризику раптової аритмічної смерті у пацієнтів, що перенесли епізод раптової серцевої смерті останнім часом значно змінилися. З одного боку, комплекс інформативних методів, таких як холтерівське моніторування ЕКГ, ЕФД, реєстрація ППШ і варіабельності ритму серця, у поєднанні з ФВ ЛШ і ФК СН, дозволив найбільш точно визначати приналежність пацієнтів до групи високого ризику раптової серцевої смерті і пароксизмальної шлуночкової тахікардії. Зареєстровані при холтерівському моніторуванні ЕКГ-параметри, такі як кількість, градація і морфологія шлуночкових аритмій, дисбаланс варіабельності ритму серця й коливання тривалості інтервалу Q–T, залишаються важливими провісниками високого ризику при вирішенні питання про доцільність здійснення первинної профілактики раптової серцевої смерті шляхом імплантації кардіовертера-дефібрилятора або призначення антиаритмічної терапії. Особливо інформативним параметром для прогнозування раптової серцевої смерті за результатами багатьох досліджень виявилася знижена варіабельність ритму серця, що відображає втрату адекватного парасимпатичного захисту серця від фібриляції шлуночків. Але найбільш потужним провісником ризику небезпечної для життя аритмії, виходячи з результатів дослідження ATRAMI, було поєднання низької варіабельності ритму серця зі зниженою ФВ ЛШ і порушеною чутливістю барорефлексу.
Утім, аналіз ЕКГ у пацієнтів, реанімованих після зупинки серця, свідчить, що безпосередніми механізмами раптової серцевої смерті найбільш часто є фібриляція або тріпотіння шлуночків, а також поліморфна шлуночкова тахікардія з високою частотою, а не мономорфна шлуночкова тахікардія. На частку пацієнтів з попередньо документованою стійкою шлуночковою тахікардією доводиться менше 1% (!) із числа осіб, у яких щорічно реєструється раптова смерть у західних країнах. При інвазивному позасерцевому ЕФД більш ніж у 80% пацієнтів відтворювали стійку мономорфну шлуночкову тахікардію, що виникає за механізмом re-entry, у той час як у 50% хворих, реанімованих після раптової серцевої смерті, вдавалося індукувати небезпечну для життя поліморфну шлуночкову тахікардію або фібриляцію шлуночків. Можна припустити, що механізм виникнення фатальних аритмій відрізняється і значно складніше від простого кільця macro re-entry — провідного механізму формування мономорфної шлуночкової тахікардії. У дослідженнях встановлено, що групу пацієнтів, що перенесли епізод раптової серцевої смерті, слід чітко відрізняти від пацієнтів, у яких індукується мономорфна шлуночкова тахікардія, а ризик небезпечних для життя аритмій серця не можна повністю oтотожнювати з ризиком раптової серцевої смерті. З іншого боку, неіндукована мономорфна шлуночкова тахікардія на фоні лікування антиаритмічними засобами має обмежене діагностичне значення як критерій ефективності антиаритмічної терапії для індивідуальної профілактики раптової серцевої смерті, особливо при наявності тяжкого структурного захворювання серця.
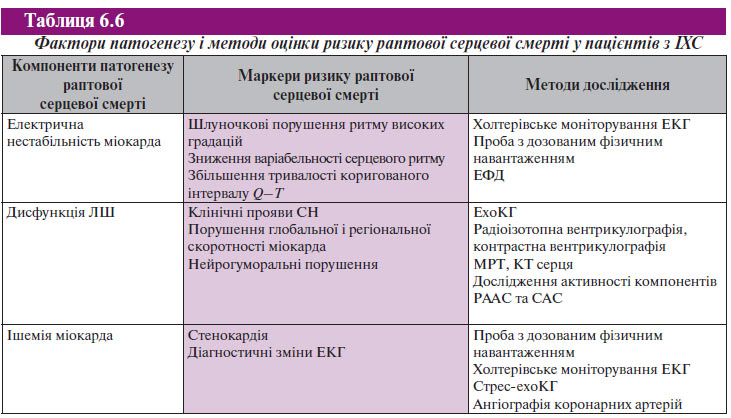
Виникнення на фоні фіксованого аритмогенного субстрату шлуночкових тахіаритмій з переходом у фібриляцію шлуночків не є єдиним безпосереднім механізмом формування раптової серцевої смерті. Зокрема, у значної кількості пацієнтів з гострим коронарним синдромом формується динамічний аритмогенний субстрат і виникає первинна фібриляція шлуночків, у той час як у багатьох пацієнтів із ХСН безпосереднім механізмом раптової серцевої смерті є брадиаритмії. З огляду на це сучасна стратегія стратифікації ризику раптової серцевої смерті у осіб зі структурним захворюванням серця не обмежується визначенням критеріїв наявності стійкого аритмогенного субстрату. Вона насамперед пов’язана з пошуком маркерів електричної нестабільності міокарда, залишкової ішемії і дисфункції ЛШ (табл. 6.6 і 6.7).

Визначальними клінічними факторами оцінки прогнозу виживаності у більшості хворих з ІХС і СН є ФВ ЛШ і ФК СН за класифікацією NYHA. Серед пацієнтів із СН I–II ФК загальний ризик смерті відносно низький, але 67% летальних результатів були раптовими; у той час як при значно гіршому загальному прогнозі виживаності тільки 29% пацієнтів із СН IV ФК помирали раптово. Отже, при визначенні показань для специфічної профілактики раптової серцевої смерті слід використовувати існуючі провісники ризику раптової серцевої смерті і передбачати потенційну ймовірність смерті від різних причин. Це дозволяє більш точно розробити стратегію лікування.
Слід зазначити, що з огляду на результати ряду контрольованих досліджень протягом останнього десятиріччя були переглянуті принципи оцінки ефективності антиаритмічної терапії методом холтерівського моніторування ЕКГ. Незважаючи на значну кореляцію між ризиком раптової серцевої смерті і кількістю та градацією зареєстрованих шлуночкових екстрасистолій у пацієнтів зі структурним захворюванням серця, цей метод не став надійним індикатором ефективного усунення аритмії, для якої характерні істотні спонтанні коливання. Як показали результати дослідження ESVEM, у пацієнтів, що перенесли ІМ, навіть при нібито ефективному подоланні злоякісної шлуночкової тахікардії антиаритмічними засобами в 50% випадків вона відновлювалася уже протягом наступних 2 років. Але ще більш небезпечним було те, що поряд з успішним пригніченням шлуночкових порушень ритму певними препаратами класу IC підвищувався ризик раптової серцевої смерті у віддалений термін від початку лікування. Ці дані отримані в дослідженнях CAST, CAST-II і ESVEM.
Отже, розповсюджена у 80-ті роки ХХ ст. гіпотеза про можливість запобігання раптової серцевої смерті у пацієнтів зі шлуночковими порушеннями ритму шляхом усунення тригерів — передчасних шлуночкових скорочень не була підтверджена. З іншого боку, препарати групи блокаторів β-адренорецепторів, антиаритмічна ефективність яких по подоланню шлуночкової екстрасистолії відносно слабка, показали здатність знижувати ризик раптової серцевої смерті у різних категорій пацієнтів і запобігати аритмогенній дії препаратів I класу (табл. 6.8).

Результати холтерівського моніторування ЕКГ не відображають реальних змін ризику ранньої серцевої смерті і обмежено інформативні для оцінки ефективності антиаритмічної терапії. Саме тому в багатьох клінічних ситуаціях антиаритмічні засоби, насамперед аміодарон і/або блокатори β-адренорецепторів, призначають емпірично і без врахування власне антиаритмічної ефективності терапії.
У групах доведеного високого ризику раптової серцевої смерті (насамперед у пацієнтів, що перенесли ІМ зі шлуночковими порушеннями ритму) протягом останнього десятиріччя було проведено декілька великих багатоцентрових рандомізованих досліджень, що дозволили визначити місце різних антиаритмічних препаратів і пристроїв у первинній і вторинній профілактиці раптової серцевої смерті. Єдиним антиаритмічним засобом, відносно якого були отримані докази доцільності застосування для первинної профілактики раптової серцевої смерті, залишається аміодарон. Найбільш відомим став метааналіз ATMA — сукупний аналіз 13 рандомізованих досліджень, проведених у 90-ті роки ХХ ст., у яких оцінювали ефект аміодарону порівняно з плацебо у пацієнтів після перенесеного ІМ (8 досліджень), з СН (5 досліджень) і шлуночковими порушеннями ритму. Всього було проаналізовано результати лікування 6553 пацієнтів. Установлено, що ризик раптової серцевої смерті при тривалому (протягом 2 років) застосуванні аміодарону вірогідно знизився на 29%, а загальна смертність — на 13%. Серед побічних ефектів аміодарону найчастіше (до 4% випадків тривалого застосування препарату) виявляли порушення з боку щитовидної залози, значно рідше — нейропатії, появу легеневих інфільтратів, брадикардію або порушення функції печінки. З огляду на це аміодарон показаний для первинної профілактики раптової серцевої смерті насамперед тим пацієнтам зі структурним захворюванням серця, у яких є критерії високого ризику небезпечних для життя аритмій серця, і користь застосування препарату безумовно перевищує ризик побічних ефектів (табл. 6.9).
Таблиця 6.9. Доцільність застосування аміодарону для попередження раптової серцевої смерті
|
Рекомендації |
Категорії пацієнтів і тип профілактики раптової серцевої смерті |
| Докази або думка експертів на користь застосування препарату | Пацієнти, що перенесли ІМ (первинна)
Пацієнти, що перенесли ІМ, реанімовані після шлуночкової тахікардії/фібриляції шлуночків, спонтанна шлуночкова тахікардія (вторинна) Аортальний стеноз (первинна) |
| Аргументи на користь застосування препарату більш слабкі | ГКМП (первинна)
ДКМП (первинна) Аритмогенна дисплазія ПШ (первинна) WPW-синдром (первинний) |
Що стосується блокаторів β-адренорецепторів, то необхідно підкреслити, що ефективність у плані попередження раптової серцевої смерті доведена для метопрололу, бізопрололу і карведилолу.
Одним із сучасних методів запобігання раптової серцевої смерті з найбільш переконливими доказами ефективності у пацієнтів із груп високого ризику є імплантація штучного кардіовертера-дефібрилятора. Наприклад, у дослідження MADIT включили 196 пацієнтів із ФВ ЛШ (35% після перенесеного ІМ), з нестійкою шлуночковою тахікардією, документованою за допомогою холтерівського моніторування ЕКГ або проби з фізичним навантаженням, а також стійкою шлуночковою тахікардією, індукованою при ЕФД. Рандомізовано здійснювали імплантацію штучного кардіовертера-дефібрилятора або продовжували звичайне медикаментозне лікування. Протягом 27 міс спостереження смертність у групі хворих з імплантованим штучним кардіовертером-дефібрилятором склала 15%, у групі медикаментозного лікування — 38% (хоча слід зазначити, що частина хворих у цій групі приймала антиаритмічні препарати I класу). У цьому дослідженні була вперше доведена доцільність імплантації штучного кардіовертера-дефібрилятора у пацієнтів, що перенесли ІМ, з високим ризиком раптової аритмічної смерті.
Разом з тим застосування специфічних засобів профілактики фібриляції шлуночків недоцільно у пацієнтів із високим ризиком смерті від інших причин. Зокрема, у пацієнтів з ФВ ЛШ <25% і СН III—IV ФК найгірший загальний прогноз виживаності і найвищий ризик смерті внаслідок СН. Втручання, які спрямовані тільки на запобігання раптової серцевої смерті у таких хворих і не впливають на перебіг основного захворювання (такі як імплантація штучного кардіовертера-дефібрилятора), дозволяють значно знизити ймовірність фатальної фібриляції шлуночків і показник раптової серцевої смерті серед можливих причин смерті, але практично не поліпшують загальний прогноз. Хворі з високим загальним ризиком смерті (аритмічної і неаритмічної) після імплантації штучного кардіовертера-дефібрилятора помирають приблизно в ті ж строки з інших причин, зокрема внаслідок гострої СН або тромбоемболії.
Звичайно, питання про доцільність імплантації кардіовертера-дефібрилятора вирішується по-різному залежно від можливості придбання цих приладів. За останній час отримані дані, що дозволяють розширити показання для застосування імплантації штучного кардіовертера-дефібрилятора. Мета дослідження MADIT-II — встановити, чи дозволить профілактична імплантація кардіовертера-дефібрилятора підвищити виживаність хворих з ІХС і систолічною дисфункцією ЛШ порівняно з медикаментозною терапією. Це дослідження включало пацієнтів із хронічною ІХС і хоча б одним перенесеним раніше ІМ, ФВ ЛШ ≤30% і кількістю шлуночкових екстрасистол >10 на 1 год при холтерівському моніторуванні ЕКГ без вікових обмежень. У дослідження не включали пацієнтів із пароксизмами нестійкої шлуночкової тахікардії або у яких під час внутрішньосерцевого ЕФД індукували стійку шлуночкову тахікардію. До листопада 2001 р. у дослідження встигли включити 1232 пацієнта, серед яких більшість отримували оптимальну медикаментозну терапію — інгібітори АПФ і блокатори β-адренорецепторів, частина — антиаритмічні засоби. Дослідження припинили передчасно у зв’язку з отриманими переконливими даними про вищу виживаність пацієнтів, яким імплантували штучний кардіовертер-дефібрилятор за рахунок зниження ризику раптової серцевої смерті. Профілактичне застосування імплантації кардіовертера-дефібрилятора протягом 3 років асоціювалося зі статистично достовірним зниженням смертності на 31%. Причому користь імплантації штучного кардіовертера-дефібрилятора була очевидною у різних категорій пацієнтів, серед яких у 75% діагностували СН II–III ФК.
Які саме категорії пацієнтів можуть бути кандидатами для первинної профілактики раптової серцевої смерті за допомогою антиаритмічних препаратів або пристроїв? До них насамперед належать пацієнти з неінвазивними маркерами високого ризику раптової серцевої смерті після перенесеного ІМ, а також пароксизмами нестійкої шлуночкової тахікардії при застійній СН або ГКМП.
Рекомендації зі стратифікації ризику та профілактики раптової серцевої смерті у хворих з ІМ і СН наведені в табл. 6.10 і 6.11.
Таблиця 6.10. Рекомендації для стратифікації ризику розвитку раптової серцевої смерті у хворих з ІМ і СН
|
Дуже важливо |
Важливо |
Менш важливо |
| ФВ ЛШ
Варіабельність серцевого ритму або барорефлекторна чутливість Об’єм ЛШ |
Шлуночкові екстрасистоли
Нестійка шлуночкова тахікардія ЧСС спокою |
ППШ
Інтервал Q–T Альтерація зубця T Турбулентність серцевого ритму Програмована стимуляція шлуночків Прохідність ураженої коронарної артерії |

ПРОФІЛАКТИКА РАПТОВОЇ СЕРЦЕВОЇ СМЕРТІ ПРИ РІЗНИХ КЛІНІЧНИХ СТАНАХ
Зважаючи на те що більшість випадків раптової серцевої смерті відбувається за межами клінік, у яких можуть бути забезпечені відповідні умови для проведення реанімаційних заходів, імовірність порятунку цих пацієнтів дуже низька. Крім того, навіть після успішної реанімації можливість повторного епізоду раптової серцевої смерті протягом року у пацієнтів, що не отримують адекватної терапії, становить не менше 30%. Проте зміна стратегії антиаритмічної терапії, що відбулася після дослідження CAST, і особливо широке впровадження в розвинених країнах імплантації штучного кардіовертера-дефібрилятора дозволили поліпшити перспективи вторинної профілактики раптової серцевої смерті.
Необхідно повторно акцентувати увагу на отриманих безумовних доказах за результатами декількох рандомізованих контрольованих багатоцентрових досліджень (САSH, AVID, CIDS) про переваги імплантації штучного кардіовертера-дефібрилятора порівняно з будь-якими антиаритмічними засобами у хворих, що перенесли епізод небезпечного для життя порушення ритму або реанімованих після раптової серцевої смерті. На жаль, висока вартість і недоступність імплантації штучного кардіовертера-дефібрилятора не дозволяють ввести цю інновацію в тактику лікування більшості наших пацієнтів. При цих умовах засобом вибору вторинної профілактики раптової аритмічної смерті є аміодарон поєднано з блокаторами β-адренорецепторів, а при наявності систолічної дисфункції ЛШ і/або СН — інгібіторами АПФ. Поєднане застосування аміодарону та блокаторів β-адренорецепторів (обов’язково без внутрішньої симпатоміметичної активності, наприклад метопролол або карведилол) проявляє синергічний ефект, значно поліпшує результати вторинної (у деяких випадках і первинної) профілактики раптової серцевої смерті та прогноз виживаності хворих.
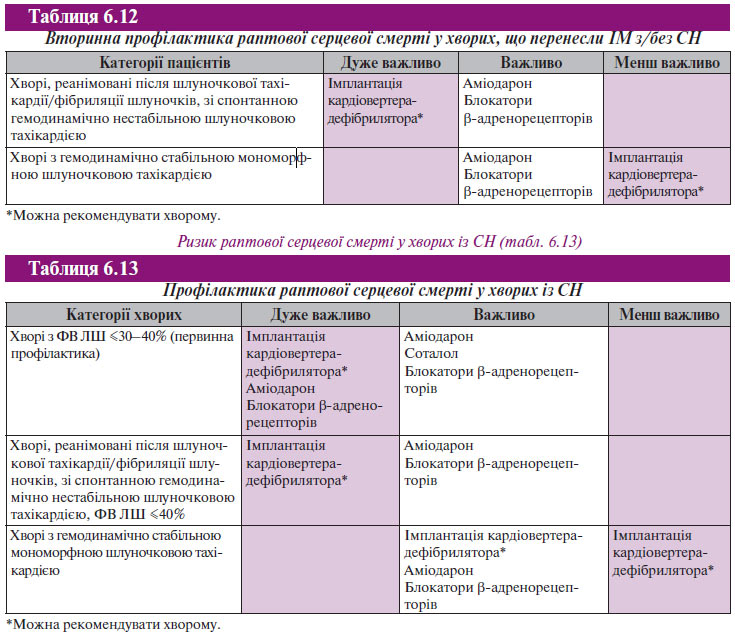
Рекомендації щодо вторинної профілактики раптової серцевої смерті у хворих, що перенесли ІМ з/без СН, наведені в табл. 6.12.
Ризик раптової серцевої смерті у хворих із нестабільною стенокардією
В Україні 1997–2001 рр. в Інституті кардіології ім. Н.Д. Стражеска АМН України було проведено проспективне 4-річне дослідження з метою виявлення незалежних факторів ризику раптової серцевої смерті у хворих, що перенесли нестабільну (прогресуючу) стенокардію. Під час спостереження у 44 із 392 хворих розвинулася раптова серцева смерть. Після проведення мультифакторного регресійного аналізу 150 клініко-інструментальних показників незалежними предикторами розвитку раптової серцевої смерті виявилися фактори, наведені в табл. 6.14.
Таблиця 6.14. Незалежні фактори розвитку раптової серцевої смерті у хворих, що перенесли нестабільну стенокардію
|
Фактор |
Відношення шансів (OR) з 95% довірчим інтервалом |
| Епізоди безбольової (німої) ішемії міокарда ≥3 на добу при холтерівському моніторуванні | OR=3,02 (0,23–5,80), p=0,0351 |
| Кількість уражених коронарних артерій ≥2 | OR=2,94 (0,92–4,92), p=0,0214 |
| Депресія сегмента ST на 1 мм і більше в ≥3 відведеннях при ВЕМ | OR=2,1 (1,37–4,49), p=0,0032 |
| СН I–IIА стадії | OR=2,10 (1,37–4,49), p=0,0032 |
| Сумарна тривалість ішемії через добу ≥40 хв | OR=1,91 (1,51–3,21), p=0,0034 |
| Пробіжки шлуночкової тахікардії ≥3 через добу при холтерівському моніторуванні | OR=1,53 (0,52–2,56), p=0,0034 |
Крім того, у цьому дослідженні була оцінена прогностична значимість різних методів дослідження з метою стратифікації ризику розвитку раптової серцевої смерті у хворих, що перенесли нестабільну стенокардію. Ці дані наведені в табл. 6.15.
Найбільш інформативним методом дослідження (із застосованих) для прогнозування раптової серцевої смерті у хворих, що перенесли нестабільну стенокардію, виявилося холтерівське моніторування ЕКГ (OR=66,0 χ2=26,6; p<0,0001), що практично в 2 рази перевершує цінність такого загальновизнаного методу дослідження, як коронароангіографія, що вважається золотим стандартом діагностики ІХС.
Таблиця 6.15. Інформативність застосованих дослідницьких методів для прогнозування раптової серцевої смерті у хворих, що перенесли нестабільну стенокардію
|
Дослідницькі прийоми |
Інформативність |
p |
| Холтерівське моніторування ЕКГ | OR=66,0 χ2=26,6 | <0,0001 |
| Коронароангіографія | OR=33,4 χ2=23,0 | <0,001 |
| ЕхоКГ | OR=30,5 χ2=23,0 | <0,001 |
| Черезстравохідна електрокардіостимуляція | OR=29,0 χ2=23,6 | <0,0001 |
| ВЕМ | OR=27,0 χ2=36,6 | <0,0001 |
| Клінічні показники | OR=20,5 χ2=58,0 | <0,0001 |
Цей факт можна пояснити тим, що холтерівське моніторування характеризує вираженість відразу двох найважливіших факторів ризику розвитку раптової серцевої смерті — наявність ішемії і ознак електричної нестабільності міокарда, в той час як метод коронарної ангіографії оцінює тільки наявність анатомічного субстрату ішемії і не дає інформації щодо функціонального характеру коронарних ушкоджень.
Необхідно враховувати те, що ці дані отримані в єдиному дослідженні, проведеному у зв’язку з цією проблемою, тому мають деякі обмеження для широкого використання.
Профілактика раптової серцевої смерті при ГКМП
ГКМП — захворювання серця, що часто виявляють, поширеність якого серед дорослого населення становить 1:500. Раптова несподівана смерть при цьому захворюванні є найбільш загрозливим наслідком, що відзначається в різні періоди життя, але особливо часто в молодому віці і у пацієнтів без симптомів захворювання. Основне завдання кардіологів спрямоване на ідентифікацію невеликої кількості пацієнтів із ГКМП, що мають високий ризик розвитку раптової серцевої смерті. Анамнез ГКМП різноманітний, але перебіг захворювання «м’який» для більшості пацієнтів. Раптову серцеву смерть найчастіше відзначають у молодому віці (до 30 років), але вона може виникати і в інших вікових групах зі щорічною частотою 2,4%. Раптова серцева смерть при ГКМП вірогідно є наслідком взаємодії численних механізмів. Важливість кожного фактора як пускового механізму або тільки детермінанти зазвичай складно встановити ретроспективно. Імплантація кардіовертера-дефібрилятора для запобігання розвитку раптової серцевої смерті найбільш показана пацієнтам, які перенесли зупинку серця або з наявністю двох і більше факторів ризику. Лікування аміодароном може становити фармакологічну альтернативу імплантації штучного кардіовертера-дефібрилятора, якщо імплантація кардіовертера за різними причинами неможлива.
Рекомендації зі стратифікації ризику раптової серцевої смерті та засобів її первинної і вторинної профілактики наведені в табл. 6.16.

Профілактика раптової серцевої смерті при ДКМП
ДКМП — хронічне захворювання серцевого м’яза, що характеризується дилатацією ЛШ і погіршенням систолічної функції. В епідеміологічних дослідженнях встановлено, що частота виявлення — близько 20 випадків/100 тис. населення на рік, поширеність — 38 випадків/100 тис. населення на рік. У 40% випадків можливий сімейний анамнез з перевагою аутосомно-домінантного типу успадкування, хоча є повідомлення про зміни, пов’язані з Х-хромосомою (2–5%). При ДКМП паралельно з покращанням у лікуванні СН поступово знижується 5-річна смертність із 70% у 1981 р. до близько 20% — на сьогодні. Раптова серцева смерть при ДКМП становить не менше 30% усіх смертей і може виникати у пацієнтів із вираженим, а також помірним ступенем хвороби, і навіть у пацієнтів із клінічним і ехокардіографічним покращанням.
Предикторами загальної смертності при ДКМП є зміни ФВ і КДО, чоловіча стать, похилий вік, гіпонатріємія, постійний III тон, синусова тахікардія, підвищений капілярний тиск у легенях, системна гіпотензія та фібриляція передсердь. ФВ не є основним предиктором раптової серцевої смерті при ДКМП. Виникнення синкопальних епізодів або фібриляції/тріпотіння шлуночків — інші, більш точні, індикатори ризику раптової серцевої смерті при цьому захворюванні.
Терапевтичні стратегії, націлені на зниження ризику раптової серцевої смерті у пацієнтів із ДКМП і зареєстрованими шлуночковими аритміями, включають інгібітори АПФ, блокатори β-адренорецепторів, аміодарон і імплантацію штучного кардіовертера-дефібрилятора. Засоби стратифікації ризику раптової серцевої смерті і їх профілактики при хронічному міокардиті такі самі, як і при ДКМП.
Запропоновані рекомендації із профілактики раптової серцевої смерті при цьому захворюванні базуються на результатах невеликої кількості проведених досліджень і ґрунтуються на думці експертів (табл. 6.17).

Профілактика раптової серцевої смерті при аритмогенній дисплазії ПШ
Аритмогенна дисплазія ПШ або правошлуночкова кардіоміопатія — захворювання міокарда, що характеризується вогнищевими або глобальними фіброзними змінами міокарда ПШ з/без залучення ЛШ і зі збереженням товщини міжшлуночкової перегородки. Поширеність цього захворювання зовсім невідома, орієнтовно перебуває в межах 1:1 тис.–1:10 тис. населення.
Для цієї патології характерна графіка ЕКГ у вигляді перевернених зубців Т і розповсюджених QRS комплексів з епсило-хвилями в правих грудних відведеннях. Хворобу виявляють у підлітків і осіб молодого віку зі шлуночковими аритміями, в той же час клінічні прояви у дітей визначають рідко. Початковою ознакою захворювання може бути втрата свідомості (29%) або зупинка серця (7–23%). Мономорфна шлуночкова тахікардія з блокадою лівої ніжки пучка Гіса — найбільш часта (70–92%) аритмія, що відзначають при аритмогенній дисплазії ПШ, проте її прояви можуть бути й іншими: від безсимптомної шлуночкової екстрасистолії до погано переносимої поліморфної шлуночкової тахікардії.
Аритмогенна дисплазія є однією з основних причин раптової серцевої смерті у віковій групі без захворювань коронарних артерій. Хоча прогностичні маркери раптової серцевої смерті ще не були визначені у великих проспективних дослідженнях, раптова серцева смерть виникає частіше у пацієнтів із розповсюдженими змінами у ПШ із залученням ЛШ. Вважають, що у пацієнтів зі стійкою мономорфною шлуночковою тахікардією прогноз більш сприятливий.
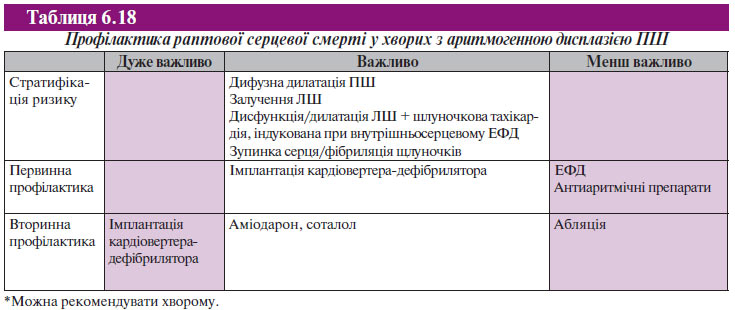
Докази, які призвели до цих рекомендацій, ґрунтуються на невеликих дослідженнях або на думці експертів (табл. 6.18).
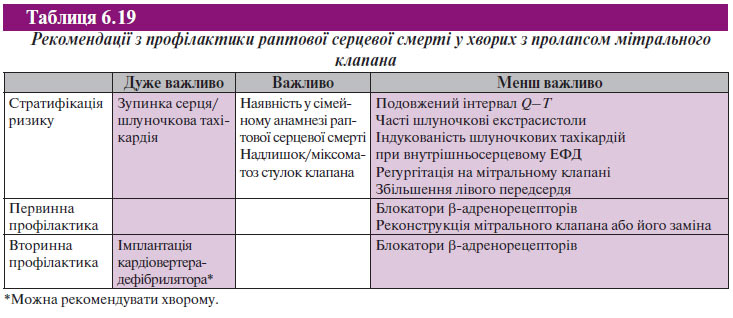
Профілактика раптової серцевої смерті при пролапсі мітрального клапана
Пролапс мітрального клапана — досить розповсюджена патологія стулок клапана, що має нечіткі ехоКГ-критерії. Після уточнення її ехоКГ-критеріїв поширеність цієї патології помітно зменшилася. Останні дані Фремінгемського дослідження продемонстрували, що в нерандомізованій групі амбулаторних пацієнтів поширеність пролапса мітрального клапана становила 1–3% на 3491 суб’єкт. Пролапс мітрального клапана в основному не є невідкладним станом, хоча раптова серцева смерть і була відзначена поєднано із пролапсом мітрального клапана.
Вважається, що в основі раптової серцевої смерті при пролапсі мітрального клапана лежать аритмії, а фібриляція шлуночків у більшості випадків, імовірно, є безпосередньою причиною раптової серцевої смерті. L. Zuppiroli і співавтори повідомили про результати проспективного дослідження, у якому спостерігали 316 хворих протягом 102 міс. Протягом дослідження тільки 6 пацієнтів померли внаслідок причин, пов’язаних із захворюваннями серця, з них у 3 зафіксована раптова серцева смерть, 1 пацієнтові проведена корекція мітрального клапана за 14 міс до смерті. Проте слід підкреслити, що у зв’язку з відносно високою поширеністю пролапса мітрального клапана в загальній популяції навіть при низькому рівні ускладнень можуть відзначати велику кількість випадків смерті.
Надлишкові і міксоматозні стулки — найважливіші ехоКГ-«знахідки», пов’язані з раптовою серцевою смертю. У дослідженні Nishimuri і співавторів у всіх 6 пацієнтів з пролапсом мітрального клапана, що померли раптово, виявляли надлишкові стулки. Взаємозв’язок між наявністю і тяжкістю регургітації на мітральному клапані й раптовій серцевій смерті не встановлена. Н. Boudoulas і співавтори і Kampbal і співавтори встановили, що зміни сегмента ST у задньобокових відділах були пов’язані з виникненням шлуночкової тахікардії або фібриляції шлуночків. Дані інших досліджень дозволили припустити, що подовження інтервалу Q–T і збільшення дисперсії Q–T може стати маркером аритмічної смертності. Часті або групові шлуночкові екстрасистоли, як і припускали, виявилися фактором ризику раптової серцевої смерті, але їх прогностична роль все-таки не була доведена. ЕКГ високого розрізнення може бути інформативна при ідентифікації пацієнтів з пролапсом мітрального клапана без схильності до злоякісних аритмій. Виникнення шлуночкової тахікардії при внутрішньосерцевому ЕФД у той же час не вважається достовірною прогностичною ознакою. Найбільш інформативними прогностичними маркерами раптової серцевої смерті в цій групі пацієнтів є наявність в анамнезі попередньої зупинки серця, раптової серцевої смерті в сімейному анамнезі в молодому віці і надлишок мітральної стулки.
Проспективні дослідження, що вивчали ефективність блокаторів β-адренорецепторів і інших антиаритмічних препаратів по запобіганню раптової серцевої смерті не проводили. Проте блокатори β-адренорецепторів, імовірно, повинні бути основними препаратами вибору у хворих з клінічними симптомами пролапса мітрального клапана. Пацієнти, що мають в анамнезі зупинку серця підлягають імплантації штучного кардіовертера-дефібрилятора. Ці висновки базуються тільки на даних невеликих оглядових досліджень і думці експертів і наведені у вигляді рекомендацій у табл. 6.19.
Профілактика раптової серцевої смерті при аортальному стенозі
Аортальний стеноз може бути вродженою патологією, а також набутою після гострої ревматичної атаки або внаслідок вікового дегенеративного процесу (сенильний аортальний стеноз). Зазвичай анамнез аортального стенозу характеризується тривалим безсимптомним періодом, протягом якого підвищується ступінь стенозу. В 1968 р. Ross і Braunwald показали, що ризик раптової серцевої смерті у пацієнтів без клінічних проявів — низький (3–5%). Пізніше проспективне дослідження продемонструвало, що раптової серцевої смерті не відзначали в жодному з 123 випадків безсимптомного перебігу у хворих, яких спостерігали протягом 2–5 років. Клінічна маніфестація аортального стенозу включає втрату пам’яті, стенокардію та/або диспное. З появою клінічної картини прогноз пацієнтів драматично погіршується й частота раптової серцевої смерті коливається в межах 8–34% за даними різних досліджень. Механізми раптової серцевої смерті при аортальному стенозі досить не вивчені, хоча за наявним даними значна роль приділяється рефлексу Бецольда — Яриша, шлуночковим тахіаритміям або порушенням проведення через AV-з’єднання. Аналіз холтерівського моніторування у 7 пацієнтів, що померли раптово, показали наявність шлуночкової тахіаритмії в 6 випадках, але тільки в одному випадку смерть була пов’язана з брадиаритмією. Втрату свідомості й раптову серцеву смерть відзначали у багатьох пацієнтів, але не встановлено, чи є втрата свідомості предиктором раптової серцевої смерті. Аортальний стеноз також пов’язаний з порушенням провідності в AV-вузлі і трипучковій системі, які виявляють найчастіше при кальцифікації клапана.
Складність полягає в тому, щоб припустити наявність аортального стенозу у хворого без клінічних проявів, коли ризик раптової серцевої смерті ще низький. Ступінь стенозу (систолічний градієнт, площа відкриття клапана), рівень кальцифікації і тяжкість ГЛШ можна використовувати для прогнозування швидкості прогресування стенозу та необхідності хірургічного втручання. Проте предиктори раптової серцевої смерті, що базуються на виникненні частих і/або комплексних шлуночкових аритмій, пізніх потенціалах або зниженій варіабельності серцевого ритму все ще обговорюються, поки що відсутні досить точні прогностичні фактори щодо рекомендацій щодо заміни аортального клапана.
Після заміни аортального клапана у пацієнтів залишається деякий ризик раптової серцевої смерті, викликаної аритмією серця, блокадою ніжок пучка Гіса, повною блокадою серця, порушенням функції ЛШ, залишковою ГЛШ, фіброзом, що супроводжує ІХС або дисфункцією протезованого клапана. У цій групі пацієнтів раптова серцева смерть проявлялася з частотою 2–4% протягом 7 років. Більш висока частота раптової серцевої смерті була виявлена в ранній період відновлення (3 тиж) після заміни клапана. Минуща повна AV-блокада в післяопераційний період не є предиктором повторних порушень провідності. Прогностичні фактори відносно AV-блокади, що вимагає імплантації постійного водія ритму, такі: існуючі раніше порушення провідності, низька ФВ і кальциноз субаортального відділу міжшлуночкової перегородки.
Обмеження фізичної активності повинно бути рекомендовано пацієнтам із помірним і особливо тяжким аортальним стенозом. Запобігання раптової серцевої смерті — одна із цілей хірургічного лікування аортального стенозу. Проте якщо операція виконується з метою зниження ризику раптової серцевої смерті, ризик імовірних ускладнень у цьому випадку повинен бути співставлений зі смертністю при хірургічному втручанні і відомими ускладненнями при протезуванні клапанів. Більшість клініцистів відкладають хірургічне втручання до появи клінічних ознак. Пацієнти повинні знати про типові симптоми захворювання і необхідність раннього оперативного втручання до виникнення симптомів захворювання. Якщо пацієнтові проводять АКШ, рекомендується паралельно заміняти аортальний клапан для попередження ранньої повторної операції. Пацієнти зі шлуночковими тахікардіями або фібриляцією, що спровокована внутрішньосерцевим ЕФД, повинні розглядатися як претенденти на імплантацію кардіовертера-дефібрилятора. Роль антиаритмічної терапії аміодароном поки не встановлена. Пацієнтам із наявними шлуночковими тахіаритміями показана імплантація кардіовертера-дефібрилятора. Ці рекомендації ґрунтуються на результатах проведених невеликих досліджень і на думці експертів (табл. 6.20).

Профілактика раптової серцевої смерті при WPW-синдромі
Поширеність WPW-синдрому становить 0,1–0,2%. Його наявність може призводити до раптової кардіальної смерті. Це трапляється, якщо пароксизм фібриляції передсердь викликає дуже швидку активацію шлуночків через додатковий AV-шлях з коротким антероградним періодом рефрактерності і провокує фібриляцію шлуночків. Раптова серцева смерть при WPW-синдромі — рідкісний, але драматичний випадок у практично здорової людини. У пацієнтів із клінічними проявами, виявленими третинними водіями ритму, поширеність раптової серцевої смерті з успішною реанімацією становить 2–11%. Результати популяційних досліджень свідчать про нижчу частоту раптової серцевої смерті (0,15% на рік).
У невеликій кількості досліджень, що включали хворих, які вижили після раптової серцевої смерті, встановлена висока частота наступних маркерів: анамнез симптоматичної тахікардії, короткі інтервали R–R між передзбудженими скороченнями в період фібриляції передсердь; множинні додаткові шляхи; шляхи, розміщені задньосептально; сімейний характер захворювання і підвищена частота аномалії Ебштейна. Нестійкий характер преекзитації і різка втрата феномену преекзитації при навантажувальному тестуванні вказують на низький ризик раптової серцевої смерті. Втрата преекзитації після внутрішньовенної інфузії препаратів, наприклад аймаліну або прокаїнаміду, також є свідченням низького ризику раптової серцевої смерті. Проте додаткові впливи (навантаження, стрес, алкоголь) можуть скорочувати рефрактерний період додаткового шляху. Часте проведення через додатковий шлях при фібриляції передсердь розглядається як чутливий маркер ризику, але його специфічність і прогностична цінність є низькими. Проте передзбуджений інтервал R–R <250 мс має прогностичну цінність раптової серцевої смерті >95%.
В анамнезі у близько 50% хворих з ЕКГ-WPW-синдромом немає аритмій. У більшості таких пацієнтів прогноз хороший. Втрата свідомості не має прогностичної цінності щодо раптової серцевої смерті. Але в той же час раптова серцева смерть може бути першим проявом хвороби. При внутрішньосерцевому ЕФД близько 20% хворих без клінічних симптомів мали прискорений шлуночковий ритм при індукованій фібриляції передсердь. Проте специфічність і позитивна прогностична цінність цього інвазивного предиктора занадто низькі для скринінгового застосування при безсимптомному WPW-синдромі. Таким чином, внутрішньосерцеве ЕФД для стратифікації ризику слід застосовувати у хворих, що мають в анамнезі раптову серцеву смерть у родині, або у осіб, спосіб життя або професійні дії яких потребують оцінки ризику. Детальне внутрішньосерцеве ЕФД доцільне, якщо планується абляція додаткових провідних шляхів у хворих із клінічними проявами.
Вдала реанімація хворого з документованою фібриляцією шлуночків або фібриляцією передсердь із клінічними проявами та швидкою відповіддю шлуночків через додатковий шлях — безсумнівне показання для абляції додаткового шляху проведення. У хворих із клінічно значимими аритміями лікувальна тактика залежить від їх особливостей. Пацієнтам із безсимптомним WPW-синдромом можна рекомендувати катетерну абляцію тільки при особливих обставинах, таких як анамнез раптової серцевої смерті в родині, високий професійний ризик (у пілотів, шахтарів, операторів складних індустріальних устаткувань і т.п., а також у спортсменів).
Показання для проведення терапії ґрунтуються на консенсусі експертів і клінічному досвіді. Рекомендації наведені в табл. 6.21.

Профілактика раптової серцевої смерті при порушеннях провідної системи серця
Раптова серцева смерть може бути результатом брадиаритмій у 15–20% випадків. Якщо порушення провідності викликане необоротною структурною аномалією у пацієнтів із порушенням провідності, то раптова серцева смерть може бути викликана шлуночковою тахіаритмією. Водій серцевого ритму, безумовно, поліпшує стан пацієнтів із брадиаритміями і може знижувати смертність.
Рекомендації по стратифікації ризику і профілактиці раптової серцевої смерті при порушеннях провідної системи серця наведені в табл. 6.22.

Профілактика раптової серцевої смерті при катехоламінергічній поліморфній шлуночковій тахікардії
Катехоламінергічна поліморфна шлуночкова тахікардія як клінічний синдром уперше описаний Кумелем у 1978 р. і більш докладно Ліндхардтом у 1995 р. Це захворювання характеризується адренергічно викликаною поліморфною шлуночковою тахікардією при структурно нормальному серці. Пацієнти, як правило, звертаються до кардіолога у зв’язку з виникненням синкопальних станів, сімейним анамнезом (втрата свідомості і раптова серцева смерть), які відзначаються приблизно у третини пацієнтів. ЕКГ-картина при катехоламінергічній поліморфній шлуночковій тахікардії характеризується наявністю поліморфної шлуночкової тахікардії, що часто має двонаправлений вид QRS-комплексів. Аритмія може бути виявлена при проведенні навантажувального стрес-тесту або інфузії ізопротеренолу до підвищення ЧСС >120 уд./хв. Відсутність структурних змін серця була показана в дослідженні Ліндхардт і співавторів із середньою тривалістю спостереження 7 років. Такі ж дані отримані і в інших роботах з цієї проблеми, що таким чином дозволяє припустити наявність первинної електричної нестабільності міокарда.
У ранніх дослідженнях генетичний аналіз при катехоламінергічній поліморфній шлуночковій тахікардії не проводили, проте є підтвердження відносно аутосомного успадкування, що припускає наявність генетичного успадкування в основі патогенезу цього захворювання. Пізніше ця концепція була підтримана Сваном і колегами, які продемонстрували взаємозв’язок між фенотипом катехоламінергічної поліморфної шлуночкової тахікардії та ділянкою хромосоми Iq42–q43 у двох великих, уражених захворюванням, родинах. В останніх дослідженнях Пріорі та співавтори продемонстрували присутність мутацій hRyR2 у 4 родинах, де виявлено хворих з катехоламінергічною поліморфною шлуночковою тахікардією, демонструючи таким чином зв’язок між зміненим hRyR 2-білком і катехоламінергічною поліморфною шлуночковою тахікардією. Ці дані підтверджують концепцію, відповідно до якої катехоламінергічна поліморфна шлуночкова тахікардія залежить від генетично закладеного надлишку внутрішньоклітинного кальцію, можливо, шляхом прослизання іонів кальцію із саркоплазматичного ретикулума.
На сьогодні через недолік контрольованих клінічних досліджень інформація про стратифікацію ризику пацієнтів із катехоламінергічною поліморфною шлуночковою тахікардією обмежена. Найбільше дослідження наведено Ліндхартом і співавторами в 1995 р. У ньому демонстрували дані сімейного анамнезу раптової серцевої смерті в 33% випадків і виникнення першого епізоду втрати свідомості в середньому на 7,8±4,0 роки життя. При цьому відзначена чітка кореляція між строком першого синкопального епізоду і ступенем тяжкості захворювання (вважається, що більш ранній початок можна розглядати як предиктор несприятливого прогнозування). Оцінка ризику розвитку тяжкої клінічної маніфестації повинна базуватися на результатах клінічної оцінки, анамнезу захворювання, наявності в анамнезі раптової непоясненої серцевої смерті серед родичів. Більшість випадків смерті відзначають у другому десятиріччі життя у зовні здорових осіб. Проте відносно висока смертність у пацієнтів з використанням блокаторів β-адренорецепторів (5–10%) може стати показанням для імплантації штучного водія ритму тим з них, у яких відзначали ранній початок захворювання і наявність у сімейному анамнезі раптової серцевої смерті.
Досвід фармакологічного лікування хворих із катехоламінергічною поліморфною шлуночковою тахікардією обмежений. На сьогодні найбільш ефективна антиадренергічна терапія з використанням блокаторів β-адренорецепторів. Ця концепція базується на ретроспективному аналізі опублікованих випадків з частотою раптової серцевої смерті 4 з 38 (10,5%) і 10 з 21 (48%) пацієнта і без терапії блокатором β-адренорецепторів відповідно.
Проте великі проспективні дослідження не проводили, тому рекомендації базуються на думці експертів і наведені в табл. 6.23.

Профілактика раптової серцевої смерті при аномальному відходженні коронарних артерій
Аномалії коронарних артерій виявляють не часто. Поширеність цих аномалій у загальній популяції невідома. За різним даними їх виявляють у 0,3–1,2% пацієнтів, що пройшли коронарографію. Найбільш часта коронарна аномалія — a. circumflexa (як правило, судина відходить від правого коронарного синуса). У цій групі не відзначали несприятливих подій. Проте початок лівої коронарної артерії від правого або некоронарного аортального синуса Вальсальви вірогідно пов’язаний із підвищенням ризику раптової серцевої смерті, особливо коли артерія проходить між аортою і ЛА. Аномальне відходження правої коронарної артерії від лівого синуса Вальсальви відповідно отриманим даним пов’язане з раптовою серцевою смертю, але не має того ж рівня ризику, як аномальне відходження лівої коронарної артерії. Раптова серцева смерть є також основною причиною смерті у хворих з аномальним відходженням лівої коронарної артерії від ЛА, які дожили до зрілого віку.
Раптова серцева смерть зазвичай виникає у чоловіків при фізичній активності. На жаль, дані літератури показують, що діагностувати подібні аномалії прижиттєво можна лише приблизно у 20% випадків. Наявність аномально розміщеної коронарної артерії слід запідозрити у молодих пацієнтів, переважно чоловіків із загрудинним болем при навантаженнях, синкопальними станами в поєднанні з непоясненими змінами QRS і ST–T. Стрес-тести, допплєрівське кольорове картування і трансезофагеальна ехоКГ — неінвазивні методи діагностики аномального відходження лівої коронарної артерії, що часто застосовуються. Проте коронарна ангіографія повинна бути рекомендована навіть при негативному навантажувальному тесті всім молодим пацієнтам, які перенесли зупинку серця.
У пацієнтів з аномальним відходженням лівої коронарної артерії від ЛА реімплантація судини в аорту знижує смертність і тривалість захворювання. Пацієнтам з аберантним відходженням лівої або правої коронарної артерії, які сприятливо перенесли епізод шлуночкової фібриляції, може бути рекомендоване хірургічне втручання (як правило, шунтування). У хворих з ознаками ішемії міокарда доцільне проведення хірургічного лікування.
Ці рекомендації базуються на невеликих оглядових дослідженнях і думці експертів (табл. 6.24).
Таблиця 6.24. Профілактика раптової серцевої смерті при аномальному розвитку коронарних артерій
|
Дуже важливо |
Важливо |
Менш важливо |
|
| Стратифікація ризику | Зупинка серця | Пацієнти молодого віку зі стенокардією
Позитивний тест під час стрес-ехоКГ |
|
| Первинна профілактика | Хірургічне лікування* | ||
| Вторинна профілактика | Хірургічне лікування* |
*Можна рекомендувати хворому.
Профілактика раптової серцевої смерті при міокардіальних «містках»
Міокардіальні «містки» складаються з фіброзно-м’язових ніжок, які покривають епікардіальні коронарні артерії на різному рівні. Наявність міокардіальних «містків» за даними ангіографії відзначають у 0,5–4,5% випадків. Ліва передня низхідна артерія уражується практично завжди. Типова ангіографічна ознака — систолічне звуження судини через минущу міокардіальну компресію. Хоча багато з міокардіальних «містків» шкоди не роблять, вони також можуть бути причиною ішемії міокарда, ІМ, злоякісних шлуночкових аритмій, АV-блокад і раптової серцевої смерті.
Верифікація і оцінка тяжкості міокардіального «містка» — важливе клінічне завдання. Для оцінки його гемодинамічної значимості застосовують навантажувальний ЕКГ-тест, добутамінову стрес-ехоКГ або міокардіальну перфузійну сцинтиграфію. В окремих випадках проводиться внутрішньокоронарне допплєрівське дослідження швидкості потоків або коронарографія при добутаміновому стрес-дослідженні для оцінки стану всередині судини під впливом міокардіального «містка». Міокардіальні «містки» виявляють у 30–50% пацієнтів із ГКМП і розглядають як імовірну причину раптової серцевої смерті у цих пацієнтів.
Позитивний ефект виявляють у пацієнтів з наявністю міокардіальних «містків» із клінічними проявами при проведенні терапії блокаторами β-адренорецепторів. Ефект блокаторів β-адренорецепторів у цьому випадку зумовлений негативною інотропною та хронотропною дією. Нітрати підвищують ЧСС і можуть призводити до погіршення стану пацієнтів. Пацієнтам з рефрактерністю до медикаментозної терапії проводять оперативне лікування (міотомія або коронарне шунтування). Доцільною також може бути ангіопластика або стентування. Довгостроковий прогноз ізольованих міокардіальних «містків» сприятливий, але в деяких випадках вони можуть викликати шлуночкові тахіаритмії і раптову серцеву смерть.
Рекомендації щодо стратифікації ризику раптової серцевої смерті при міокардіальних «містках» ґрунтуються на обмеженій кількості невеликих оглядових спостережень і думці експертів і наведені в табл. 6.25.

Профілактика раптової серцевої смерті при «спортивному серці»
Аномалії серцево-судинної системи у багатьох спортсменів полягають у збільшенні маси ЛШ, порожнини, товщини стінки або поєднанні цих факторів. Серцево-судинні причини раптової серцевої смерті у спортсменів істотно змінюються залежно від віку. Переважною причиною смерті в осіб віком старше 35 років є ІХС. І навпаки, у спортсменів віком молодше 35 років основна причина — серцева патологія у вигляді вроджених захворювань (аномалій), що рідко виявляються у загальній популяції. Результати декількох досліджень вказують на те, що ГКМП є найбільш частою причиною раптової серцевої смерті у молодих тренованих атлетів, що складає близько ⅓ частини фатальних подій. Другі за важливістю та частотою — вроджені аномалії коронарних артерій, такі як неправильне відходження судини від синуса Вальсальви. Аналіз аутопсій молодих спортсменів, що померли внаслідок раптової серцевої смерті, показує, що кардіоміопатію ПШ відзначають не часто. Скринінг у безсимптомних нормальних популяціях спортсменів дозволяє виявити деякі порушення, особливо при поєднанні 12-канальної ЕКГ і ехоКГ. Відсторонення від змагань і тренувань атлетів із серцево-судинними захворюваннями для проведення повної оцінки патології серцево-судинної системи знижує ризик виникнення раптової серцевої смерті.
Оцінку стану спортсменів з порушеннями ритму серця, органічними захворюваннями серця або іншими ознаками і симптомами, що вказують на імовірність наявності серцево-судинного захворювання, слід проводити так само, як і в інших пацієнтів, але з урахуванням специфічності їх занять спортом.
Ці рекомендації були складені на основі неконтрольованих, ретроспективних і логічно обґрунтованих спостережень.
Профілактика раптової серцевої смерті у період вагітності
Вагітним, у яких розвинулася гемодинамічно нестабільна шлуночкова тахікардія або фібриляція шлуночків, необхідно провести кардіоверсію або дефібриляцію. У пацієнток з наявністю подовженого інтервалу Q–T, у яких раніше відзначали симптоми захворювання, необхідне продовження терапії блокаторами β-адренорецепторів протягом усього періоду вагітності та після пологів, за винятком наявності протипоказань до такої терапії.
Профілактика раптової серцевої смерті у людей похилого віку
Не слід використовувати штучний кардіовертер-дефібрилятор у людей похилого віку, у яких прогнозована тривалість життя у зв’язку з основним або супутнім захворюваннями <1 року. Для зниження загальної смертності у людей похилого віку необхідно більш активно застосовувати блокатори β-адренорецепторів.
Раптова смерть у дітей
У літературі останніх років велика увага приділяється синдрому раптової смерті у дітей грудного віку, причому цей синдром виділений в окрему педіатричну проблему. Цей синдром характеризується несподіваною смертю практично здорової дитини віком від 7 днів до 1 року, при якій ретельно проведена аутопсія не дозволяє пояснити причину смерті. Існуючі дотепер дві основні гіпотези — порушення дихання у вигляді апное і порушення серцевої діяльності не пояснюють усіх аспектів цієї проблеми.
ПЕРВИННА ПРОФІЛАКТИКА РАПТОВОЇ СЕРЦЕВОЇ СМЕРТІ ПРИ «ІСТИННО ЕЛЕКТРИЧНИХ» ЗАХВОРЮВАННЯХ СЕРЦЯ
У пацієнтів із «істинно електричними» феноменами, при яких підвищується ймовірність раптової серцевої смерті, доцільність первинної профілактики викликає значно менше сумнівів і дискусій, ніж у пацієнтів з ІХС, ускладненою шлуночковими аритміями.
Синдром подовженого інтервалу Q–T
Особливою формою життєво небезпечних порушень серцевого ритму є поліморфні шлуночкові тахікардії, які виникають у пацієнтів із вродженим або набутим синдромом подовженого інтервалу Q–T (Q–T-синдром). Зазвичай у осіб із вродженим Q–T-синдромом не відзначають ніяких проблем у дитинстві. Але в підлітковому або молодому віці у них з’являються передсинкопальні стани, зумовлені епізодами поліморфної шлуночкової тахікардії — пірует-тахікардії. При відсутності відповідного лікування один з таких епізодів може закінчитися раптовою серцевою смертю. Перше повідомлення про вроджений Q–T-синдром зробили A. Jervell і F. Lange-Nielsen у 1957 р. У декількох членів однієї родини вони помітили поєднання глухонімоти, подовження інтервалу Q–T і раптової смерті в молодому віці. У 1963 р. Романо, a в 1964 р. Уорд повідомили про аутосомно-домінантний характер успадкування подовження Q–T і раптової серцевої смерті, на відміну від аутосомно-рецесивного типу синдрому Джервелла — Ланге-Нільсена (Jervell — Lange-Nielsen). Хоча випадків вродженого Q–T-синдрому описано не так багато (у міжнародному реєстрі 1994 р. — близько 500 родин), його справжня поширеність імовірно значно більша, а клінічне значення зумовлене появою синкопальних станів, небезпечних для життя аритмій і раптовою серцевою смертю. Близько 21% пацієнтів із симптомами захворювання, що не отримують лікування, помирають протягом року після першого синкопального епізоду, а протягом 10 років смертність становить 50%.
Утім, здійснення первинної профілактики раптової серцевої смерті пов’язане із рядом труднощів, зумовлених як розмаїтістю механізмів, так і гетерогенністю зовнішніх проявів (фенотипу) у пацієнтів з генетичними порушеннями, типовими для Q–T-синдрому. Зокрема, у 5–10% носіїв генетичних дефектів узагалі не відзначають подовження інтервалу Q–T; приблизно у 5% членів родин з типовим Q–T-синдромом пароксизми небезпечних для життя поліморфних шлуночкових тахікардій або епізоди синкопе виникають на фоні нормального інтервалу Q–T.
Довгий час вважали, що ключове значення в процесі «запуску» нападів, що призводять до раптової серцевої смерті, має раптово виражена активація САС. Адже напади часто починаються після значного фізичного навантаження або психоемоційного збудження або, наприклад, після того, як у повній тиші голосно включається будильник. Тому з метою попередження впливу провокуючих факторів, тригерів, небезпечних для життя аритмій традиційно базисними засобами лікування Q–T-синдрому є блокатори β-адренорецепторів у високих дозах. Їх постійне застосування дозволяє попереджати синкопальні епізоди в 75% випадків. Пацієнтам, у яких ефективність блокаторів β-адренорецепторів обмежена, виконують хірургічне втручання — денервацію лівого серцевого симпатичного ганглія. Якщо аритмія виникає на фоні вираженої брадикардії або можливість підвищення дози блокаторів β-адренорецепторів обмежена внаслідок брадикардії, застосовують постійну кардіостимуляцію. 5-річна смертність на фоні впровадження цих методів лікування знизилася і склала <5%.
Проте останнім часом стало ясно, що наші уявлення про Q–T-синдром далеко не вичерпані, а методи лікування не завжди відповідають його справжнім патогенетичним механізмам. Здивування викликають не тільки різноманітні ЕКГ-прояви синдрому, наприклад, той факт, що успішне лікування Q–T-синдрому блокаторами β-адренорецепторів не супроводжувалося нормалізацією тривалості інтервалу Q–T. Складно пояснити також повідомлення про окремі випадки раптової серцевої смерті під час сну. Існує не менше трьох генетичних форм вродженого Q–T-синдрому, що характеризуються різними механізмами запуску пароксизмів пірует-тахікардії. Більш того, в одному з варіантів активність симпатичного відділу вегетативної нервової системи навіть відіграє захисну роль. Отже, не у всіх випадках виникає потреба в призначенні блокаторів β-адренорецепторів. При певних генетичних варіантах вродженого Q–T-синдрому ефективними також можуть бути блокатори натрієвих каналів, у першу чергу мексилетин, що зменшує тривалість реполяризації; дискутують також про доцільність імплантації штучного кардіовертера-дефібрилятора.
Значно частіше в клінічній практиці відомі випадки набутого Q–T-синдрому, виникненню якого сприяє застосування антиаритмічних засобів IА і III класів, високих доз антидепресантів, деяких антибактеріальних і антигістамінних препаратів. Неінвазивними провісниками високого ризику пірует-тахікардії внаслідок аритмогенної дії ліків є тривалість інтервалу Q–T >600 мс, подовження інтервалу T–U, наявність T-alternans (коливання конфігурації й амплітуди зубця T), зміна конфігурації TU у постекстрасистолічному комплексі, а також наявність маленьких піруетів (torsadelets). Існує цілий ряд методів попередження тахікардії за типом пірует. Це, зокрема, корекція електролітних порушень, особливо гіпокаліємії і гіпомагніємії, профілактика вираженої брадикардії на фоні антиаритмічної терапії (у тому числі шляхом постійної кардіостимуляції), виключення препаратів IА і III класів (крім аміодарону) у хворих із низькою ФВ ЛШ, зниження дози антиаритмічних засобів при тривалості коригованого інтервалу Q–T >480 мс або дисперсії Q–T >60 мс, тривале моніторування пацієнтів із груп високого ризику на початку застосування антиаритмічних засобів, початок лікування в стаціонарних умовах.
Рекомендації щодо профілактики раптової серцевої смерті у хворих із синдромом подовженого інтервалу Q–T наведені в табл. 6.26.
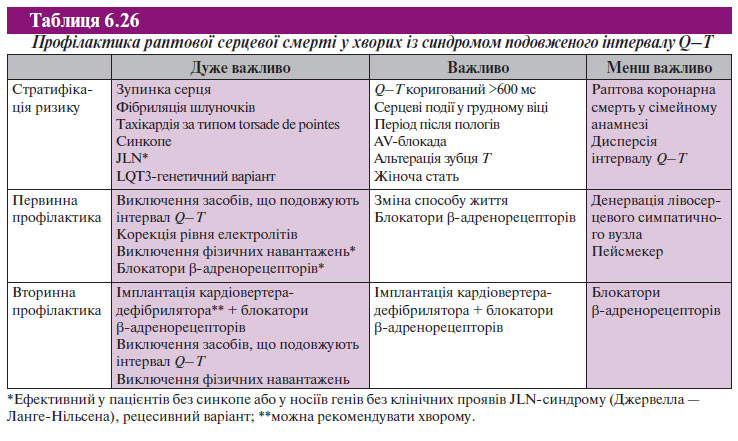
Тактика припинення пароксизму поліморфної тахікардії, асоційованої з набутим подовженням інтервалу Q–T ( пірует-тахікардія), має деякі особливості порівняно з лікуванням звичайного нападу шлуночкової тахікардії. Обов’язковим першим кроком є відміна провокуючого препарату, далі здійснюють корекцію рівня електролітів, внутрішньовенно вводять препарати магнію, призначають препарати або кардіостимуляцію з метою підвищення частоти серцевого ритму. Антиаритмічні препарати в цьому випадку не тільки неефективні, але й можуть протидіяти припиненню пароксизму внаслідок ще більшого підвищення тривалості реполяризації. Навпаки, при нормальній тривалості інтервалу Q–T послідовно внутрішньовенно вводять блокатори β-адренорецепторів, лідокаїн і аміодарон (табл. 6.27).
Таблиця 6.27 Особливості ведення пацієнтів з поліморфною шлуночковою тахікардією залежно від тривалості інтервалу Q–T (за Kowey P.R. et al., 1999)
|
Подовжений Q–T |
Нормальний Q–T |
| 1. Відмінити препарат, що зумовив подовження Q–T
2. Коригувати рівень електролітів 3. Магнію сульфат внутрішньовенно 4. Кардіостимуляція для підвищення ЧСС |
1. Внутрішньовенно блокатори β-адренорецепторів
2. Внутрішньовенно лідокаїн 3. Внутрішньовенно аміодарон |
Синдром Бругадa
У 1992 р. брати Педро, Хосе і Рамон Бругада, що працюють у різних клініках у Бельгії, Іспанії та США, описали новий синдром, що викликає раптову серцеву смерть у осіб без структурного захворювання серця. Цей синдром характеризується особливим типом ЕКГ (блокада правої ніжки пучка Гіса, підйоми сегмента ST) (рис. 6.1), а також епізодами шлуночкової тахікардії, які можуть призвести до раптової серцевої смерті. Автори повідомлення відразу припустили, що це захворювання має спадковий характер. Наявність генетичного дефекту, що служить причиною синдрому Бругада, було доведено вже у 1997 р. Дефект локалізований у 3-й хромосомі й вражає один із натрієвих каналів. Порушення складу каналу, що зумовлені цими вродженими змінами, призводять до порушень електричної функції серця і летальних серцевих аритмій.

Рис. 6.1. ЕКГ пацієнта з синдромом Бругада
Синдром Бругада виявляють у чоловіків і жінок, а також у дітей. У дітей, у яких хворий один з батьків, імовірність захворювання становить 50%. Випадки цього синдрому були зареєстровані в усьому світі, але особливо часто — в Японії та Південній Азії. За оцінкою братів Бругада, у Європі та Америці частота випадків раптової серцевої смерті внаслідок цього синдрому становить близько 1 на 10 тис. жителів на рік. Причому в середньому раптова серцева смерть виникає в осіб віком 40 років.
При розпізнаванні цього синдрому проводять скринінгове обстеження всіх членів родини. Обов’язково реєструють ЕКГ і аналізують склад ДНК, а при необхідності проводять ЕФД. Єдиним ефективним методом лікування є імплантація штучного кардіовертера-дефібрилятора, що розпізнає аритмію і негайно припиняє її електричним розрядом 700 В. На жаль, жоден з антиаритмічних препаратів не забезпечує адекватного захисту при цьому синдромі. Якщо не імплантований штучний кардіовертер-дефібрилятор, 30% пацієнтів помирають протягом 3 років після першого виникнення симптомів. Розробляються засоби генної терапії для корекції генетичного дефекту і повернення нормальної електричної активності серця. Дуже близьким за клінічними проявами до синдрому Бругада є феномен раптової смерті невизначеної етіології у Південно-Східній Азії. Його вивчення почалося задовго до появи першої публікації про синдром Бругада. Добре відомо, що наприкінці війни у В’єтнамі багато біженців з Лаосу, Камбоджі і В’єтнаму прибули до США. Уже у 1976–1977рр. американські центри по контролю і запобіганню захворювань відзначали досить високий рівень смертності серед молодих чоловіків, що прибули з Південно-Східної Азії. Синдром так і назвали — синдром незрозумілої раптової смерті (sudden unexplained death syndrome). Усього тоді був зареєстрований 121 випадок. Більшість смертей відбулася вночі під час сну. Середній вік жертв склав 32 роки. Але фактично цей синдром був відомий ще раніше: на Філіппінах його називали «бангунгут», у Японії — «поккури», у Таїланді — «лай тай». Ці терміни перекладають як «смерть людей уночі уві сні», що настає переважно у молодих чоловіків. Синдром особливо поширений у Таїланді, де в окремих регіонах є другим за частотою після автомобільних катастроф причиною смерті молодих чоловіків: щорічна смертність становить близько 40 на 100 тис.
У декількох обстежених пацієнтів із цим синдромом, реанімованих після епізоду зупинки серця, були інтактні коронарні артерії, нормальна функція ЛШ і ПШ при проведенні ехоКГ або ангіографії ПШ. Усі вони адекватно виконували пробу з фізичним навантаженням на тредмілі. Під час навантаження не було змін інтервалу Q–T; при ехоКГ-дослідженні не виявляли структурних змін міокарда, зокрема ГЛШ. Утім, на ЕКГ, так само як і при синдромі Бругада, зареєстрували тип блокади правої ніжки пучка Гіса зі значним збільшенням інтервалу S–T у декількох відведеннях. У всіх пацієнтів на сигнал-усередненої ЕКГ знаходили ППШ, а фібриляція шлуночків легко викликалася одним або двома передчасними стимулами при інвазивному ЕФД.
Цілком імовірно, що зі збільшенням кількості зареєстрованих пацієнтів синдром незрозумілої серцевої смерті виявиться однієї із клінічних форм синдрому Бругада, оскільки останній має більш широкий діапазон клінічних проявів. Таким чином, імплантація штучного кардіовертера-дефібрилятора є єдиним методом ефективної первинної профілактики раптової серцевої смерті.
Рекомендації щодо стратифікації ризику, первинної і вторинної профілактики раптової серцевої смерті у хворих із синдромом Бругада наведені в табл. 6.28.
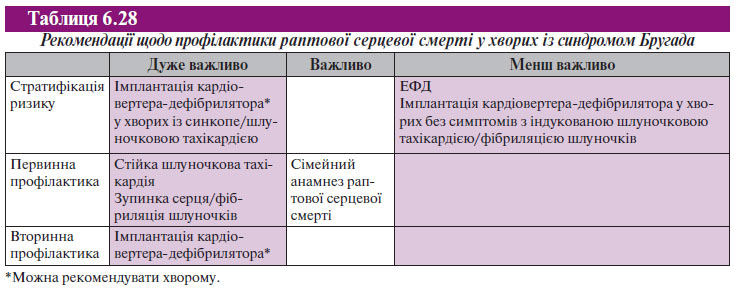
Ідіопатична фібриляція шлуночків
До цієї категорії належать пацієнти, що пережили зупинку серця внаслідок фібриляції шлуночків, але у яких не виявлені зміни структурно-функціонального стану міокарда. Перспектива досліджень патогенезу ідіопатичної фібриляції шлуночків пов’язана з виявленням генетичних маркерів раптової серцевої смерті, а також структурних порушень на молекулярному рівні. У країнах Західної Європи та США з цією метою створений ряд реєстрів для узагальнення даних тривалого спостереження пацієнтів, реанімованих після ідіопатичної фібриляції шлуночків, а також тим, кому імплантували штучний кардіовертер-дефібрилятор. Можна сподіватися, що ці дослідження дозволять уточнити механізми раптової серцевої смерті і краще оцінювати прогноз виживаності цих пацієнтів.
Алгоритми диференційованого ведення хворих зі шлуночковими порушеннями ритму
Ведення хворих зі шлуночковими порушеннями ритму обов’язково передбачає корекцію способу життя, дієтичні заходи, лікування основного захворювання, а також спроби усунення всіх імовірних факторів, що сприяють появі аритмії, в тому числі препаратів, які в певних умовах можуть призвести до виникнення й посилення аритмій (табл. 6.29). Тільки при неефективності цих заходів починають антиаритмічну терапію (табл. 6.30).

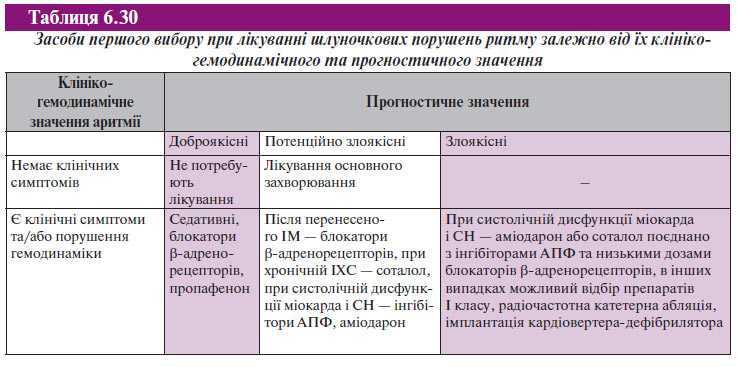
У хворих із доброякісними шлуночковими порушеннями ритму єдиною метою лікування є усунення симптомів, що негативно впливають на якість життя хворих; тому якщо хворий не пред’являє скарг, призначення антиаритмічної терапії недоцільно. У протилежному випадку препаратами вибору насамперед є седативні засоби і блокатори β-адренорецепторів (пропранолол 60–80 мг/добу або метопролол 50–100 мг/добу), терапія якими пов’язана з мінімальним ризиком кардіальних побічних ефектів. Критерієм подальшого вибору при їх неефективності, з огляду на відносно незначний ризик аритмогенних проявів у цієї категорії хворих, є ризик розвитку екстракардіальних побічних ефектів. Надалі доцільно застосовувати пропафенон (450–600 мг/добу), що поєднує властивості класу IС і блокаторів β-адренорецепторів або морацизин (400–800 мг/добу). Ці препарати ефективні і менш токсичні, ніж препарати класів IA і IB.
Мета лікування при потенційно злоякісних шлуночкових порушеннях ритму — не тільки усунення аритмії, але й поліпшення прогнозу хворих. У багатьох хворих із СН зменшення кількості шлуночкових порушень ритму, за даними холтерівського моніторування ЕКГ, досягають уже при традиційному лікуванні інгібіторами АПФ, які вірогідно поліпшують довгостроковий прогноз. Певне значення має також корекція рівня калію та магнію в крові, особливо на фоні терапії петльовими або тіазидними діуретиками. При неефективності цих заходів обережно використовують блокатори β-адренорецепторів або аміодарон. При відсутності протипоказань блокатори β-адренорецепторів обов’язково рекомендують хворим, що перенесли гострий ІМ, оскільки ці препарати запобігають раптовій серцевій смерті та підвищують виживаність хворих. Але в цьому випадку їх доза вища, ніж при лікуванні доброякісних аритмій (пропранолол 80–120 мг/добу). При частих клінічно виражених шлуночкових порушеннях ритму у хворих після перенесеного ІМ при недостатній ефективності блокаторів β-адренорецепторів найбільш безпечним, з огляду на ризик аритмогенних проявів, є застосування соталолу (160–240 мг/добу, іноді 320 мг/добу) та аміодарону. Зазвичай доза аміодарону при тривалому застосуванні не повинна перевищувати 200–300 мг/добу, що дозволяє істотно знизити ризик екстракардіальних побічних ефектів препарату. Тільки при неефективності цього засобу оцінюють ефективність антиаритмічних лікарських засобів I класу, причому перевагу віддають менш аритмогенним препаратам класів IА і IВ. Засобами вибору для припинення пароксизму мономорфної шлуночкової тахікардії є новокаїнамід або аміодарон внутрішньовенно. При злоякісних шлуночкових порушеннях ритму у хворих з тяжкою дисфункцією ЛШ безперечним препаратом вибору є аміодарон, можливо, в комбінації з низькими дозами блокаторів β-адренорецепторів (метопролол 6,25–25,0, іноді 50 мг/добу) і, звичайно, поєднано з інгібіторами АПФ. Доза аміодарону в період насичення становить 600–1200 мг/добу, надалі її знижують до мінімально ефективної. При відсутності ознак тяжкої дисфункції міокарда і/або СН можна застосувати соталол у терапевтичній дозі (160–320 мг/добу). При неефективності або протипоказаннях до застосування цих препаратів оцінюють ефективність антиаритмічних засобів класу IA або IB (лідокаїн, мексилетин, новокаїнамід, дизопірамід, хінідин) і тільки потім — препаратів класу IC. Підкреслимо, що дотепер у жодному з виконаних досліджень антиаритмічні препарати I класу не поліпшили довгостроковий прогноз хворих зі злоякісними шлуночковими порушеннями ритму.
При пароксизмах шлуночкової тахікардії, які супроводжуються вираженими порушеннями гемодинаміки (набряк легень, кардіогенний шок, втрата свідомості) засобом вибору є електрична кардіоверсія. Алгоритм, рекомендований ЄТК, визначає тактику лікування пароксизму стійкої шлуночкової тахікардії залежно від наявності проявів порушення гемодинаміки, рівня електролітів крові, ефективності лікарських засобів і електричної кардіоверсії (схема 6.1).

Схема 6.1. Алгоритм лікування стійкої шлуночкової тахікардії
ТАХІКАРДІЯ ІЗ ШИРОКИМИ КОМПЛЕКСАМИ (СТІЙКА ШЛУНОЧКОВА ТАХІКАРДІЯ)
У розвинених країнах широко застосовують радикальні немедикаментозні методи лікування злоякісних шлуночкових порушень ритму: радіочастотну абляцію ектопічних вогнищ і імплантацію штучного кардіовертера-дефібрилятора.
Чи доцільно застосовувати антиаритмічні засоби для підвищення ефективності реанімаційних заходів при зупинці серця, особливо у випадках, коли після дефібриляції не вдається відновити синусовий ритм серця? Безперечно, недостатність переконливих даних щодо ефективності антиаритмічних препаратів при умовах серцево-легеневої реанімації зумовлена особливостями клінічної ситуації і труднощами організації контрольованих досліджень. Проблема полягає також у тому, що препарати можуть бути ефективними, але не досягати клітинних мембран, де реалізується їх фармакологічна дія, у зв’язку з неадекватним кровопостачанням життєво важливих органів. Першим препаратом, для якого отримані адекватні докази ефективності при зупинці серця, став аміодарон. У 1999 р. у США закінчилося унікальне плацебо-контрольоване дослідження ARREST, що здійснювалося в «польових» умовах, поза стаціонаром. Пацієнтам із зупинкою серця внаслідок фібриляції шлуночків або шлуночкової тахікардії після триразової дефібриляції ще до надходження в клініку рандомізовано внутрішньовенно вводили аміодарон 300 мг (n=246) або плацебо (n=258). Застосовували також усі стандартні заходи серцево-легеневої реанімації, включаючи при необхідності введення інших антиаритмічних засобів.
Первинною кінцевою точкою дослідження була виживаність пацієнтів при надходженні в госпіталь. Цей показник становив 44% пацієнтів після парентерального введення аміодарону і 34% — в групі плацебо. Отже, відносне поліпшення прогнозу виживаності становило майже 30%, абсолютне — 10%, що було статистично достовірним (р=0,03). Це означає, що при застосуванні аміодарону у 10 пацієнтів із зупинкою серця, рефрактерною до повторних електричних дефібриляцій, вдалося додатково врятувати до надходження в госпіталь ще одного пацієнта. Підкреслимо, що призначення аміодарону було ефективним, незважаючи на більш часте виникнення гіпотензії і брадикардії у групі активного лікування порівняно з плацебо. До цього часу не встановлено, чи дозволяє введення аміодарону поліпшувати довгостроковий прогноз виживаності пацієнтів, які перенесли зупинку серця. Втім, з огляду на результати дослідження ARREST, у 2000 р. в алгоритми серцево-легеневої реанімації при фібриляції шлуночків включили рекомендацію вводити аміодарон на додаток до стандартних реанімаційних засобів. Аміодарон — єдиний антиаритмічний препарат, рекомендований на сьогодні для внутрішньовенного застосування при рефрактерності до повторних процедур електричної дефібриляції серця.
НЕВІДКЛАДНА ДОПОМОГА ПРИ РАПТОВІЙ ЗУПИНЦІ КРОВООБІГУ
Догоспітальний етап
Єдиною найбільш важливою детермінантою виживаності пацієнтів після раптової смерті є час від початку зупинки кровообігу до проведення електричної дефібриляції. У нормі міокард скорочується одночасно, єдиним м’язовим шаром, кожне його волокно вчасно одержує за допомогою провідної системи електричний імпульс. Фібриляції шлуночків — несинхронізовані скорочення окремих волокон і м’язових груп. Цей процес вкрай енергоємний, використання кисню дуже високе, в умовах гіпоксії міокард нечутливий до імпульсів, які генеруються в синусному вузлі, тому умов для самостійного відновлення ефективного ритму практично немає.
В розвитку фібриляції шлуночків виділяють 4 стадії:
А — тріпотіння шлуночків, що триває 2 с, при якому відбуваються координовані скорочення, а на ЕКГ реєструють високоамплітудні ритмічні хвилі з частотою 250–300/хв.
Б — судомна стадія (1 хв), при якій відбуваються хаотичні некоординовані скорочення окремих ділянок міокарда з появою на ЕКГ високоамплітудних хвиль із частотою до 600/хв.
В — стадія фібриляції шлуночків (дрібнохвильова фібриляція шлуночків) тривалістю близько 3 хв. Хаотичне збудження окремих груп кардіоміоцитів проявляється на ЕКГ хаотичними низькоамплітудними хвилями з частотою >1000/хв.
Г — атонічна стадія — загасаючі збудження окремих ділянок міокарда, на ЕКГ наростає тривалість і знижується амплітуда хвиль при їх частоті <400/хв.
Механізми фібриляції шлуночків такі: підвищення автоматизму в одній або декількох ділянках міокарда, повторний вхід хвилі збудження (re-entry) і поєднання цих механізмів.
Через 15–30 с від початку фібриляції шлуночків хворий непритомніє, через 40–50 с розвиваються характерні судоми — одночасне тонічне скорочення скелетних м’язів. Розширюються зіниці, досягаючи максимального розміру через 1,5 хв. Шумне і часте дихання припиняється на 2-й хвилині клінічної смерті.
Таким чином, час, відпущений на проведення реанімації зі значними шансами на успіх мізерний — не набагато більше 1 хв (цей період відповідає крупнохвильовій фібриляції: тріпотіння й судомна стадії). У цей період необхідне проведення електричної дефібриляції. Електричний розряд при кардіоверсії викликає короткочасну асистолію і повну деполяризацію міокарда, що дає можливість власним центрам автоматизму відновити гемодинамічно значиму електричну активність. У цьому полягає мета дефібриляції.
Використання дефібриляторів з пристроєм для негайної реєстрації ЕКГ з електродів дефібрилятора забезпечує швидке визначення механізму зупинки кровообігу і дозволяє прискорити проведення кардіоверсії.
До впровадження автоматичних зовнішніх дефібриляторів спонтанне відновлення кровообігу відзначали тільки у 15% хворих із раптовою смертю поза стаціонаром. З них тільки 50% доживало до виписки (тобто 5–7%). Якщо розглядати тільки фібриляції шлуночків, то виживаність до виписки становила 15–20%. Якщо амбулаторний персонал швидко прибував на місце події і мав зовнішні дефібрилятори, виживаність підвищувалася до 25–28%.
Зупинка кровообігу частіше трапляється вдома (⅔ випадків), у чоловіків старше 50 років (¾ випадків), протягом дня (8–18 год), при свідках (⅔ випадків). Особи, які зазвичай перебувають у цей час поруч із потенційною жертвою раптової серцевої смерті — це домогосподарки, члени родини, родичі. Відповідно навчальні програми по наданню невідкладної допомоги при раптовій зупинці серця повинні бути спрямовані насамперед на них.
Запропонований так званий ланцюжок виживання для найбільш ефективного надання допомоги пацієнтам з раптовою зупинкою кровообігу:
- перша ланка — ранній напад, що включає розпізнавання цієї ситуації, виклик і доставку досвідченого персоналу до пацієнта;
- друга — рання серцево-легенева реанімація, якої зазвичай досить для підтримки пацієнта до приїзду досвідченої бригади (алгоритм BLS, схема 6.2). Слід зазначити, що за даними літератури будь-яка серцево-легенева реанімація, навіть тільки компресія грудної клітки, значно краще, ніж її відсутність;
- третя — рання дефібриляція;
- четверта — найбільш раннє надання кваліфікованої і спеціалізованої медичної допомоги (алгоритм Advanced Cardiac Life Support, схема 6.3).

Схема 6.2. Алгоритм первинних заходів при зупинці серця

Схема 6.3. Алгоритм ACLS лікування зупинки серця
Якщо причиною раптової зупинки кровообігу є фібриляція передсердь шлуночків, то невідкладна допомога зводиться до негайного проведення дефібриляції. Якщо відновити серцевий ритм не вдалося, необхідно негайно почати закритий масаж серця і штучну вентиляцію легень (ШВЛ) відповідно до алгоритму АCLS. Наведений алгоритм BLS багато в чому збігається з відомим переліком реанімаційних заходів, які входять у реанімаційний алфавіт П. Сафара, відомий також як система АВС:
А — Airway — забезпечення прохідності дихальних шляхів.
B — Breath — ШВЛ нападоподібним методом, наприклад при диханні способом рот у рот.
C — Circulation — забезпечення гемоциркуляції — непрямий масаж серця.
D — Drugs — введення лікарських препаратів.
E — Electrocardiography — реєстрація ЕКГ.
F — Fibrillation — проведення при необхідності електричної дефібриляції (кардіоверсії).
G — Gauge — оцінка первинних результатів.
H — Hypothermy — охолодження голови.
I — Inxensive care — проведення інтенсивної терапії постреанімаційних синдромів.
Донедавна рекомендації по серцево-легеневій реанімації розглядали відсутність пульсу на каротидних артеріях як діагностичний крок, що є визначальним для початку проведення непрямого масажу серця. Останні дослідження показали, що час, необхідний для визначення наявності або відсутності пульсації сонних артерій, значно більший, ніж рекомендовані 5–10 с. У результаті цих досліджень з’явилися рекомендації про те, що визначення каротидного пульсу повинно виконуватися тільки медичними працівниками, а критерієм для початку компресії грудної клітки повинні бути ознаки відсутності кровообігу, що включають відсутність рухів, кашлю, дихання, появу паралітичного мідріазу. Час, що приділяється на їх визначення — 10 с. Компресію грудної клітки слід проводити з частотою 100 за 1 хв як у дорослих, так і у дітей, при положенні рук на грудині на 2 поперечних пальці вище мечоподібного відростка, суворо по середній лінії.
При комбінації вентиляції легень способом з рота в рот з непрямим масажем серця рекомендоване співвідношення 15 компресій грудної клітки на 2 вдихи.
Госпітальний етап
На госпітальному етапі рекомендується дотримуватися наведеного алгоритму ACLS.
Дефібриляція
У дорослих пацієнтів з аритміями, що призводять до зупинки кровообігу, найчастішими є фібриляція шлуночків і шлуночкова тахікардія без пульсу. Під шлуночковою тахікардією без пульсу розуміють тривалий пароксизм шлуночкової тахікардії з вираженими порушеннями гемодинаміки, аж до аритмічного шоку, на відміну від шлуночкової тахікардії з пульсом, до якої належать усі інші короткочасні або тривалі пароксизми шлуночкової тахікардії без порушень гемодинаміки).
Заходи, що поліпшують віддалену виживаність після зазначених станів — це, насамперед, дефібриляція і наступна серцево-легенева реанімація. Успіх проведеної дефібриляції прямо пропорційний часу її початку. Розряди слід наносити групами по 3, з енергією 200–200–360 Дж (раніше рекомендували режим — 200–300–360 Дж). Для проведення 3 послідовних кардіоверсій дається 1 (!) хв.
Вентиляція
Трахеальна інтубація дотепер є найбільш оптимальним способом вентиляції. ШВЛ без неї викликає високий ризик ускладнень: перерозтягання шлунка, регургітацію, легеневу аспірацію. Раніше рекомендований об’єм одного вдмухування становив, як правило, 800–1200 мл кожні 1–1,5 с. Нещодавно було встановлено, що для вентиляції досить застосування меншого об’єму, тому що продукція СО2 під час зупинки серця вкрай незначна. Виходячи з цих рекомендацій — це об’єм 10 мл/кг маси тіла (700–1000 мл) або 7 мл/кг маси тіла (400–600 мл), якщо до повітря додається кисень. Якщо ШВЛ проводиться шляхом інтубації, то при її проведенні немає необхідності синхронізації з компресією грудної клітки, тому що безперервна компресія краще забезпечує коронарну перфузію. Дослідження, присвячені оцінці ефективності запропонованих за останнє десятиріччя нових методів спеціалізованого реанімаційного комплексу показали, що такі способи, як активна компресія-декомпресія з використанням кардіонасоса, вставлена абдомінальна компресія (стискування живота відразу після стискання грудної клітки), кашльова аутореанімація не довели переваги перед традиційними способами реанімації. У той же час прискорення стискування (до 100 за 1 хв), а також одночасна компресія грудної клітки і вдмухування повітря в легені (через інтубаційну трубку) довели свій достовірний вплив на підвищення виживаності і включені в сучасні алгоритми серцево-легеневої реанімації. У першому випадку підвищення частоти компресії грудної клітки асоціюється зі збільшенням штучного кровотоку, в другому — зростання внутрішньолегеневого тиску призводить до більш активного надходження крові з легень у системний кровообіг.
Прекардіальний удар
Одноразовий прекардіальний удар (наноситься кулаком у ділянку нижньої третини грудини) може проводитися медичними працівниками, якщо фібриляція трапляється при свідках або фіксується на моніторі (тобто фібриляція шлуночків документована або проведена клінічна оцінка ситуації професіоналом, що відповідає класичному опису фібриляції шлуночків). При раптовій зупинці кровообігу, що триває >30 с, прекардіальний удар неефективний!
Доступ до судин
Центральна вена — оптимальний шлях швидкого введення лікарських препаратів у центральний кровообіг. Катетеризація периферичної вени швидша, простіша, безпечніша, проте такий шлях введення препарату, без сумніву, менш ефективний. Введення лікарських препаратів у цьому випадку повинно здійснюватися струминно в 10–20 мл 0,9% розчину натрію хлориду. Кінцівці з катетеризованою веною в цьому випадку необхідно надати припідняте положення. При неможливості забезпечити венозний доступ рекомендується ендотрахеальне введення лікарських препаратів. Препарат, що вводиться (наприклад епінефрин) у підвищеній у 2–3 рази дозі, розводять в 10 мл розчину натрію хлориду, вводять через інтубаційну трубку або транстрахеально через голку. Для забезпечення швидкого всмоктування препарату після його введення, в ендотрахеальну трубку кілька разів нагнітають повітря, стимулюючи утворення аерозолю.
Специфічна медикаментозна терапія
Вазопресори. Епінефрин поліпшує кровообіг у коронарних, церебральних судинах під час непрямого масажу серця, забезпечуючи тим самим так звану централізацію кровообігу. Крім того, епінефрин сприяє переведенню дрібнохвильової фібриляції шлуночків у крупнохвильову, яку легше припинити за допомогою кардіоверсії. Щодо дозування препарату думки були різні. В експериментах на тваринах з метою покращання коронарного і церебрального кровотоку доведена ефективність епінефрину у високих дозах порівняно зі стандартними. Але на сьогодні в проведених дослідженнях клінічних доказів цього факту стосовно людей не отримано. Встановлено, що при підвищенні частоти відновлення спонтанної циркуляції під час роботи з епінефрином у високих дозах не виявлено зростання виживаності пацієнтів з раптовою зупинкою кровообігу. Тому показання, інтервал між введеними дозами епінефрину, як і самі дози, залишаються колишніми: 1 мг епінефрину кожні 3 хв. Звертаємо увагу, що при умові відновлення рефрактерної фібриляції шлуночків реанімаційні заходи складаються з чергування повторних дефібриляцій, введення епінефрину, проведення основних реанімаційних (комплекс первинної швидкої серцево-легеневої реанімації) і додаткових спеціалізованих заходів (повторне використання медикаментозних антиаритмічних засобів). Вищезгадані дії тривають до відновлення серцевої діяльності або розвитку стійкої асистолії.
За даними літератури в експерименті вазопресин (40 ОД) займає провідне місце серед інших препаратів, що застосовуються для відновлення коронарної перфузії. На сьогодні вазопресин розглядається як можлива альтернатива епінефрину.
Аміодарон. Вважається препаратом вибору у пацієнтів із фібриляцією шлуночків/шлуночковою тахікардією, рефрактерних до трьох початкових розрядів дефібрилятора. 300 мг аміодарону, розведені в 20 мл 5% розчину глюкози, введені болюсно, є стартовою дозою. Додатково рекомендують забезпечити інфузію цим препаратом 1 мг/хв протягом 6 год, а потім зі швидкістю 0,5 мг/хв. На цьому фоні можливе додаткове введення 150 мг аміодарону (у такому ж розведенні), якщо фібриляції шлуночків/шлуночкова тахікардія повторюються, аж до досягнення максимальної дози — 2 мг. Лідокаїн або прокаїнамід на сьогодні можуть розглядатися як альтернатива аміодарону тільки при його недоступності (відсутності), але не повинні (!) вводитися разом з ним. При одночасному введенні 2 (тим більше 3) згаданих антиаритмічних препаратів існує реальна загроза як потенціювання серцевої слабкості, так і прояву їх проаритмічної дії. Крім того, необхідно пам’ятати про небажане поєднання аміодарону з іншими препаратами (табл. 6.31).
Таблиця 6.31. Небажана взаємодія аміодарону з іншими препаратами
|
Препарат |
Розчинник |
Аміодарон |
Примітка |
| Амінофілін | 5% розчин глюкози | 4 мг/мл | Преципітація |
| Цефамандол | 5% розчин глюкози | 4 мг/мл | Преципітація |
| Цефазолін | 5% розчин глюкози | 4 мг/мл | Преципітація |
| Мезлоцилін | 5% розчин глюкози | 4 мг/мл | Преципітація |
| Гепарин | 5%розчин глюкози | 4 мг/мл | Преципітація |
| Натрію гідрокарбонат | 5% розчин глюкози | 4 мг/мл | Преципітація |
Насичувальна інфузія
Початкова швидка: розчинити 150 мг аміодарону в 100 мл 5% розчину глюкози, вводити повільно протягом 15 хв (15 мг/хв).
Примітка: у випадку зупинки серця внаслідок стійкої до електроімпульсної терапії фібриляції/тріпотіння шлуночків з відсутністю пульсу, початкова доза повинна становити 300 мг внутрішньовенно струйно, відповідно до вказівок АСLC 2000 р.
Полівінілова1 або скляна ємність.
Наступна повільна: розчинити 900 мг в 500 мл 5% розчину глюкози, вводити повільно зі швидкістю 33,3 мл/год (1 мг/хв) протягом наступних 6 год.
Скляна2 або поліолефінова ємність.
Підтримувальна інфузія.
Зменшити швидкість до 0,5 мг/хв, вводити зі швидкістю 16,6 мл/год протягом 18 год, що залишилися.
Додаткова інфузія
Розчинити 150 мг в 100 мл 5% розчину глюкози, вводити повільно протягом 10 хв (15 мг/хв).
Полівінілова1 або скляна2 ємність:
- під час внутрішньовенного введення аміодарону слід застосовувати інфузійний насос, рекомендується використання вбудованого фільтра;
- зберігати ампули в картонній упаковці до моменту готування розчину з метою захисту від потрапляння світла;
- приготований розчин не слід зберігати довше 24 год;
- використання концентрації >3 мг/мл у 5% розчині глюкози призводить до підвищення ризику виникнення флебітів периферичних вен.
Для інфузії тривалістю >1 год концентрація аміодарону не повинна перевищувати 2 мг/мл, якщо інфузія не проводиться через центральний катетер.
Встановлено, що для внутрішньовенного введення аміодарону непридатні пластикові ємності, включаючи полівінілові трубки (ефект прилипання до пластикової стінки). Ступінь цього процесу збільшується при інфузії аміодарону в більш високих концентраціях і при нижчій швидкості введення.
Після перших 24 год необхідно дотримуватися швидкості підтримувальної інфузії 0,5 мг/хв (720 мл за 24 год) при концентрації 1–6 мг/мл. Препарат у концентрації, що перевищує 2 мг/мл, необхідно вводити в центральний катетер. Можливість проведення інфузії >3 тиж не вивчали. Перехід на пероральний прийом рекомендовано здійснювати якнайшвидше.
Лідокаїн вводять у дозі 80 мг внутрішньовенно струминно, потім проводять інфузію препарату зі швидкістю 2 мг/хв. Болюсне введення прокаїнаміду на сьогодні не розглядається, рекомендується інфузія препарату — 30 мг/хв до досягнення загальної дози — 17 мг/ кг. Необхідність такої відносно повільної інфузії робить введення прокаїнаміду менш значимим. Магнію сульфат (8 ммоль) рекомендується при рефрактерній фібриляції шлуночків, особливо якщо підозрюється гіпомагніємія у пацієнтів, що тривалий час отримують тіазидні або петльові діуретики (салуретики), а також при поліморфній веретеноподібній шлуночковій тахікардії (типу пірует). Бретилію тозилат на сьогодні використовувати не рекомендується. Також немає даних про ефективне застосування блокаторів β-адренорецепторів (пропранололу) з метою купірування шлуночкової тахіаритмії.
Антиаритмічні засоби, що використовуються при рефрактерній фібриляції шлуночків, за ефективністю можуть бути розміщені в такому порядку: аміодарон, лідокаїн, прокаїнамід. Підтверджена ефективність атропіну в лікуванні гемодинамічно значимих брадиаритмій. У той же час рекомендації щодо кратності введення препарату дещо змінилися: у зв’язку з можливими побічними ефектами пропонується обмежити його введення однократною дозою 3 мг внутрішньовенно. Ця доза достатня для блокування вагусної активності у дорослих пацієнтів. Алгоритм дій лікаря при розвитку зупинки кровообігу у зв’язку з асистолією або електромеханічною дисоціацією в попередніх рекомендаціях пропонував введення атропіну кожні 3 хв по 1 мг внутрішньовенно до досягнення загальної дози 0,4 мг/кг. Неважко підрахувати, що наведена методика «розтягувала» середню загальну дозу атропіну на 10 хв, у той же час запропонований нині протокол передбачає її повне введення вже в перші хвилини реанімації.
Можливі оборотні причини неефективності серцево-легеневої реанімації
- гіпоксія;
- гіповолемія;
- гіпотермія;
- напружений пневмоторакс;
- тампонада серця;
- тромбоемболічна або механічна обструкція;
- токсичні або терапевтичні ефекти при передозуванні лікарських засобів;
- гіпер-/гіпокаліємія, гіпокальціємія, ацидоз (визначення цих станів і їх корекція можливі тільки при контролі кислотно-основного стану за показниками сироватки крові).
Кожна з цих причин потребує проведення спеціальної корекції.
Дотепер збереглося рутинне та помилкове часте використання під час зупинки кровообігу хлористого кальцію і гідрокарбонату натрію. Відмова від застосування хлориду кальцію зумовлена документованим збільшенням кількості реперфузійних ускладнень, розвитком кальцієвого перевантаження і контрактури кардіоміоцитів. Цей препарат показаний тільки (!) при реанімації пацієнтів з передозуванням блокаторів повільних кальцієвих каналів і при наявності вихідної гіперкаліємії. Препарат вводиться в дозі 500–1000 мг внутрішньовенно струминно повільно у вигляді 5–10% розчину.
Підтверджується недоцільність і потенційна шкідливість раннього (з першої хвилини реанімації) і безконтрольного (неможливість визначення показників кислотно-основного стану) введення гідрокарбонату натрію. Організм значно гірше адаптований до алкалозу, ніж до помірного ацидозу, який, до того ж, відразу після зупинки кровообігу має респіраторний характер і може бути з успіхом коригований за допомогою ШВЛ. Перехід до метаболічного ацидозу відзначають через 10–15 хв з моменту початку серцево-легеневої реанімації, а необхідність введення розчину гідрокарбонату натрію актуальна при зниженні pH до рівня ≤7,1–7,2. При тривалій зупинці кровообігу (протягом 15–20 хв) і відсутності інтубації трахеї та відповідно недостатній ефективності ШВЛ, розвиток гіпоксичного лактацидозу є протипоказанням для введення бікарбонату натрію. В умовах неефективної ШВЛ на фоні введення гідрокарбонату натрію відзначають посилення ацидозу всередині клітини за рахунок накопичення двоокису вуглецю, що інтенсивно утворюється в процесі розщеплення натрію гідрокарбонату при відсутності дихання. СО2 легко проникає через клітинну мембрану, тоді як гідроксильна група затримується.
Досвід сучасної медицини підтверджує, що чітке негайне та усвідомлене проведення комплексу невідкладних лікувальних заходів (виконання розроблених алгоритмів надання реанімаційної допомоги при раптовій серцевій смерті) дає шанс для порятунку людського життя.
АВТОМАТИЧНІ ЗОВНІШНІ ДЕФІБРИЛЯТОРИ І ДЕФІБРИЛЯТОРИ-КАРДІОВЕРТЕРИ: ЗНАЧЕННЯ ТА ПЕРСПЕКТИВИ ШИРОКОГО ЗАСТОСУВАННЯ
Своєчасна дефібриляція (розряд, електрошок) — це дефібриляція, що здійснена протягом перших 5 хв від початку кардіальної катастрофи. Кожна хвилина затримки знижує шанс на виживання на 10–15%. Після 7–10 хв з моменту появи фібриляції повернути пацієнта до життя стає практично неможливим (рис. 6.2).
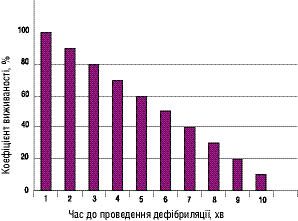
Рис. 6.2. Залежність коефіціента виживаності від часу, що пройшов до початку проведення дефібриляції (зниження виживаності на 10% кожну хвилину затримки, США, 1994)
Згідно з морфологічними даними при раптовій серцевій смерті в серці відсутні несумісні з життям морфологічні порушення. Тому своєчасне проведення реанімаційних заходів, в першу чергу дефібриляції (протягом перших 5 хв), може сприяти поверненню до життя.
З огляду на підтверджений практичний досвід США та країн Європи, проведення своєчасної дефібриляції за межами лікувальної установи можна забезпечити тільки при наявності в громадських місцях (аеропорти, вокзали, школи, вищі навчальні заклади, аудиторії, підприємства, державні установи і т.п.) автоматичних зовнішніх дефібриляторів. Користуватися цими приладами може будь-яка людина, що пройшла короткий курс навчання (тривалість 2 год), навіть дитина.
Впровадження автоматичних зовнішніх дефібриляторів у країнах Європи та США
АНА з 2001 р. рекомендує обов’язкове розміщення автоматичних зовнішніх дефібриляторів в публічних громадських місцях, установах, офісах, підприємствах. Європейська спілка кардіологів і Європейська рада реаніматологів у 2002 р. спільно підтвердили основну роль автоматичного зовнішнього дефібрилятора в рішенні проблеми раптової серцевої смерті. В країнах Європи розроблені та реалізуються програми впровадження автоматичних зовнішніх дефібриляторів, навчання дефібриляції і прийомам серцево-легеневої реанімації немедичного персоналу — людей, що не мають медичної освіти, які можуть опинитися біля потенційної жертви раптової зупинки серця. Урядами країн Європи і Америки проголошено рішення проблеми раптової серцевої смерті стратегічно важливим завданням 2002–2005 рр. Підтвердженням цього є розробка і законодавче затвердження урядами ряду країн Європи та США рекомендацій щодо оснащення автоматичними зовнішніми дефібриляторами різних установ і громадських місць. У травні 2004 р. Федеральні агентства органів самоврядування (США) наказали встановити на всіх внутрішніх авіалініях автоматичні зовнішні дефібрилятори. З грудня 2004 р. жоден міжнародний літак будь-якої країни без дефібрилятора на борту не має права приземлитися на території США. Відповідно до Рекомендацій АНА 40% патрульних поліцейських машин у США оснащено автоматичними зовнішніми дефібриляторами. Кожний автомобіль швидкої допомоги, парамедиків, рятувальників оснащений автоматичними зовнішніми дефібриляторами. З 2002 р. автоматичні зовнішні дефібрилятори обов’язково встановлюються в кожній державній школі штату Нью-Йорк. У США >50% державних установ оснащені автоматичними зовнішніми дефібриляторами.
Уряд Англії виступив з ініціативою реалізації програми встановлення автоматичних зовнішніх дефібриляторів у громадських місцях і навчання персоналу їх ефективному використанню. Устаткування заплановано встановити в залах торгових центрів, залізничних і автовокзалів, аеропортів, готелів, концертних залах, школах. На думку британських експертів, ініціатива уряду дозволить зберегти тисячі життів протягом найближчих 10 років. В Угорщині всі приватні лікарі мають автоматичні зовнішні дефібрилятори. Прийнято закон щодо оснащення автоматичними зовнішніми дефібриляторами кожного будівлі всіх лікувальних установ. У Німеччині всі великі підприємства оснащені автоматичними зовнішніми дефібриляторами.
Статистичні дані виживаності пацієнтів з раптовою кардіальною смертю за межами медичних установ*.
В установах і публічних місцях без оснащення автоматичними зовнішніми дефібриляторами — 5%.
В установах, оснащених автоматичними зовнішніми дефібриляторами: місцях для відпочинку (концертні зали, казино, ресторани та ін.) — 74%, на борту літаків і в аеропортах — 40–60%, на робочих місцях (в офісах, міністерствах, відомствах та ін.) — 52%.
*За інформацією компанії «Cardiac Science» (США).
Таблиця 6.32. Час реакції і відсоток виживаності
|
Вид першої допомоги |
Час до першого розряду, хв |
Частка виживаності, % |
| Традиційна швидка допомога | 10 | <10 |
| Пожежні служби | 6 | 40 |
| Поліція | 5 | 50 |
| Дефібриляція на місці | 3 | >70 |
Згідно з табл. 6.32 середній час прибуття швидкої допомоги в такій економічно розвиненій країні, як США, 8–12 хв. Таким чином, тільки наявність автоматичних зовнішніх дефібриляторів може врятувати від раптової серцевої смерті.
Американські експерти вважають реальним порятунок 15 тис. життів на рік з 20 млн населення країни при достатньому оснащенні автоматичними зовнішніми дефібриляторами публічних громадських місць і немедичних установ, а також при широкому оснащенні і дооснащенні медичних установ.
Таким чином, в Україні орієнтовний прогноз порятунку життів при виникненні раптової серцевої смерті в громадських місцях може становити близько 30–50 тис. чоловік на рік, при достатньому оснащенні автоматичними зовнішніми дефібриляторами громадських місць, установ та медичних установ.
Сучасні автоматичні зовнішні дефібрілятори
Поєднання детального вивчення патогенетичних механізмів раптової серцевої смерті та можливостей сучасних медичних технологій дозволяє принципово вирішувати проблему раптової серцевої смерті.
Сучасні передові можливості дефібриляції у вигляді автоматичних зовнішніх дефібриляторів 3-го покоління (типи «FirstSave AED G3», «PowerHeart AED G3» і «PowerHeart AED G3 pro», «PowerHeart CRM»), які перевірені в клінічних і практичних умовах США і країнах Європи, зареєстровані в Україні.
Сучасні можливості автоматичних зовнішніх дефібриляторів:
- 98% — ефективність першого розряду (здійсненого в перші хвилини кардіальної катастрофи);
- портативність, захист від ударів, падінь, вібрації — необмежені можливості використання дефібриляторів у будь-яких екстремальних ситуаціях;
- постійна готовність до використання — відсутність необхідності постійної підзарядки приладу, система та індикація автоматичного щоденного самоконтролю;
- біфазна форма розряду забезпечує найбільш ефективну та найменш травматичну дефібриляцію;
- автоматичний вибір потужності розряду залежно від імпедансу тканин пацієнта, його маси й зросту, тобто вибирається максимально ефективний і найбільш безпечний розряд, що найбільш ефективно впливає на серце;
- простота і комфортність використання — керування приладом здійснюється за допомогою однієї кнопки;
- голосові підказки дій для персоналу — мінімізація помилок і оптимізація здійснення успішної дефібриляції;
- інтегровані електроди — електроди на клейовій основі, з низьким рівнем перехідного опору дозволяють здійснювати індивідуально ефективну вільну дефібриляцію (руки персоналу звільняються для здійснення інших додаткових маніпуляцій, необхідних для проведення успішної реанімації);
- електроди неполяризовані — не потрібно гаяти час на вирішення питання: «куди накладати електроди». Прилад самостійно встановлює розташування і поляризацію електродів;
- можливість візуалізації, архівації, протоколювання всіх подій дефібриляції в цифровому форматі на комп’ютері;
- можливість проведення приладом повної автоматичної самостійної дефібриляції (при її необхідності) без участі персоналу;
- безпека використання, тому що здійснити несанкціонований розряд неможливо, оскільки при наявності нормального ритму серця дефібрилятор не активує (блокує) кнопку розряду.
Особи, які найімовірніше можуть виявитися поруч з потенційною жертвою раптової серцевої смерті, — родичі, міліціонери, служба охорони, працівники ДАІ, водії, працівники супермаркетів, шкіл, офісів, банків, готелів, пожежники, бортпровідники, офіціанти, інші фахівці. Вони повинні бути навчені використанню автоматичних зовнішніх дефібриляторів. Існують розроблені методики навчання по їх використанню: тренувальні дефібрилятори, муляжі, дистанційні імітатори моделювання серцевого ритму, відеоматеріали, інструкції та ін.
Рекомендовані напрямки застосування зовнішніх дефібриляторів
- Амбулаторії сімейних лікарів, фельдшерсько-акушерські пункти, прийомні відділення, травмпункти, рентгенологічні кабінети, операційні та інші медичні установи і карети швидкої медичної допомоги (оптимально з розрахунку 1 дефібрилятор на кожний корпус і/або поверх і кожну карету швидкої медичної допомоги).
- Школи, вищі навчальні заклади, інші навчальні заклади (оптимально з розрахунку: 1 дефібрилятор на кожний поверх і/або на кожний корпус).
- Міністерства й відомства, офіси, банки та ін. (оптимально з розрахунку: 1 дефібрилятор на 100 осіб).
- Стоматологічні кабінети і поліклініки державного та приватного секторів.
- Аеропорти, залізничні і автовокзали, станції метрополітену (оптимально з розрахунку: відстань між дефібриляторами — не більше 100 м).
- Літаки міжнародних і внутрішніх авіарейсів.
- Поїзди залізничного транспорту та метрополітену (кожен).
- Автобуси міжнародного і міжміського напрямків (кожен).
- Комерційні, пасажирські та військові кораблі і пароплави (кожен).
- Усі установи відпочинку, готелі та ін.
- Пожежно-рятувальна служба (оптимально з розрахунку: 1–2 одиниці на кожну виїзну бригаду).
- Суспільні й державні установи, торговельні центри (із розрахунку: 1 дефібрилятор на 1000 людино/відвідувань на день).
- Об’єкти підвищеної небезпеки (нафтопереробні підприємства, атомні електростанції, вибухонебезпечні підприємства, склади та інші).
Оснащення автоматичними дефібриляторами-кардіовертерами реанімаційних, кардіореанімаційних відділень і палат інтенсивної терапії
Проблема раптової серцевої смерті від фібриляції шлуночків у лікувальних установах є актуальною. За статистикою виживаність пацієнтів при виникненні фібриляції шлуночків під час знаходження пацієнтів у лікувальних установах США становить тільки 10–15% при використанні звичайних технологій зовнішньої фібриляції та при достатньому оснащенні медичних установ.
Цю проблему можна вирішити за допомогою впровадження в практику приладів догляду за пацієнтами, які постійно здійснюють моніторування ЕКГ пацієнта, і при потребі (при виникненні фібриляції шлуночків або стійкої шлуночкової тахікардії) самостійно автоматично виконують дефібриляцію без участі медичного персоналу протягом перших 30–40 с з моменту виникнення фібриляції.
Ефективність першого розряду дефібриляції, виконаного протягом 1-ї хвилини фібриляції, становить 98%. Дефібрилятор-кардіовертер має функцію проведення 5 (серії) розрядів протягом 1 хв, якщо попередні розряди були неефективними. Така функція приладу значно підвищує ефективність дефібриляції протягом 1-ї хвилини раптової серцевої смерті.
У дефібриляторі-кардіовертері поєднано 3 важливі функції:
1. Функція дефібрилятора-монітора.
2. Функція зовнішнього водія ритму.
3. Функція автоматичного зовнішнього дефібрилятора.
Наявність функції автоматичного кардіовертера в дефібриляторі-кардіовертері дозволяє автоматично провести дефібриляцію без участі медичного персоналу протягом 30–40 с після виникнення у пацієнта фібриляції шлуночків.
Проведені дослідження дозволили встановити, що в умовах стаціонару середній часовий проміжок до моменту проведення першого розряду дефібриляції медичним персоналом звичайним дефібрилятором-монітором становить 3–4 хв. Необхідно враховувати, що перший розряд, виконаний у такий строк, уже є ефективним тільки на 50–60%. Тому для успішної дефібриляції в такому випадку необхідне проведення додаткових 3–5 розрядів. При такому тривалому процесі реанімації виникає необхідність проведення інтубації пацієнта, зовнішнього масажу серця, ШВЛ. Такий тривалий період реанімації часто призводить до появи у пацієнта неврологічних ускладнень (аж до розвитку декортикації). Таким чином, проведення дефібриляції в перші (1–2) хвилини фібриляції значно підвищує шанси на виживання пацієнта.
Досвід використання автоматичних дефібриляторів-кардіовертерів у клініках США і Європи свідчить, що достатнє оснащення лікувальних установ дефібриляторами-кардіовертерами дозволяє значно знизити смертність від фібриляції шлуночків у медичних установах. Так, використання таких дефібриляторів-кардіовертерів у медичному центрі Маймонідес у м. Нью-Йорк призвело до істотного підвищення виживаності пацієнтів із фібриляцією шлуночків і стійкою шлуночковою тахікардією (з 15 до 90%).
Є потреба в розробці програми широкого проведення навчання з користування автоматичними зовнішніми дефібриляторами осіб, які можуть опинитися біля хворого з епізодом раптової серцевої смерті — родичів, міліції, пожежників, служби охорони, працівників ДАІ, водіїв, працівників супермаркетів, вокзалів, шкіл, офісів, банків, готелів, бортпровідників, офіціантів, інших фахівців. Необхідно рекомендувати поступове і реальне, виходячи з економічних можливостей, оснащення автоматичними дефібриляторами громадських місць і дефібриляторами-кардіовертерами стаціонарів.
ВИСНОВКИ
Протягом останніх років уперше на підставі вивчення патогенетичних механізмів раптової серцевої смерті, завдяки встановленню найбільш інформативних критеріїв ризику та розвитку сучасних медичних технологій з’явився новий напрямок сучасної кардіології — первинна профілактика раптової серцевої смерті. Частота виникнення раптової серцевої смерті стала однією з первинних кінцевих точок найбільших досліджень по лікуванню кардіологічних захворювань, зокрема ІМ і СН. Відзначений значний прогрес у встановленні механізмів формування раптової серцевої смерті в осіб без очевидних ознак порушень структурно-функціонального стану міокарда. Протягом останнього десятиріччя проведена велика кількість контрольованих досліджень, що дозволили встановити місце антиаритмічних препаратів, пристроїв, у яких доведена, зокрема, перевага блокаторів β-адренорецепторів, аміодарону та автоматичних внутрішніх штучних кардіовертерів-дефібриляторів у первинній і вторинній профілактиці раптової серцевої смерті пацієнтів з кардіологічними захворюваннями, насамперед з ІМ і СН. Була значно вдосконалена стратегія лікування шлуночкових аритмій на підставі ретельної індивідуалізованої оцінки клініко-гемодинамічного та прогностичного значення порушень ритму, порівняння потенційної користі лікування та ймовірного ризику кардіальних і екстракардіальних побічних ефектів, даних щодо здатності антиаритмічних препаратів покращувати довгостроковий прогноз виживаності хворих і викликати небезпечну аритмогенну дію.
Проте, незважаючи на ці видатні досягнення експериментальної і клінічної медицини, реальний рівень пізнання стану проблеми залишає цілий ряд невирішених питань. Можливості оцінки ризику і профілактики раптової серцевої смерті у пацієнтів зі структурними серцевими захворюваннями і при первинних електричних захворюваннях серця відрізняються, значною мірою залежать від рівня суспільного розвитку та медичних технологій, що існують у різних країнах. Ці рекомендації є документом, погодженим провідними дослідниками нашої держави, відомими фахівцями в області кардіології й організаторами охорони здоров’я. Вони призначені для використання практикуючими лікарями і як посібник навчального процесу у вищих медичних навчальних закладах.
ЛІТЕРАТУРА
- Abella B.S., Alvarado J.P., Myklebust H. et al. (2005) Quality of cardiopulmonary resuscitation during in-hospital cardiac arrest. JAMA, 293: 305–310.
- Abella B.S., Sandbo N., Vassilatos P. et al. (2005) Chest compression rates during cardiopulmonary resuscitation are suboptimal: a prospective study during in-hospital cardiac arrest. Circulation, 111: 428–434.
- Aguiar C., Ferreira J., Seabra-Gomes R. (2002) Prognostic value of continuous ST-segment monitoring in patients with non-ST-segment elevation acute coronary syndromes. Ann. Noninvasive Electrocardiol., 7(1): 29–39.
- American Heart Association (2004) Heart Disease and Stroke Statistics-2005 Update. Dallas, Tex: American Heart Association.
- American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care (2005) Circulation, 112: IV-1–IV-203.
- Cappato R. (1999) Secondary prevention of sudden death: the Dutch study, the antiarrhythmics versus implantable defibrillator trial, the cardiac arrest study Hamburg and the Canadian implantable defibrillator study (review). Am. J. Cardiol., Mar 11, 83(5B): 68D–73D.
- Chevalier P., Kirkorian G., Touboul P. (2002) Arrhythmic sudden cardiac death due to coronary artery spasm. Card. Electrophysiol. Rev., 6(1–2): 104–106.
- Chiang W.C., Chen W.J., Chen S.Y. et al. (2005) Better adherence to the guidelines during cardiopulmonary resuscitation through the provision of audio-prompts. Resuscitation, 64: 297–301.
- Cohen M., Stinett S.S., Weatherley B.D. еt al. (2000) Predictors of recurrent ischemic events and death in unstable coronary artery disease after treatment with combination antithrombotic therapy. Am. Heart J.,139: 962–970.
- de Vries W., van Alem A.P., de Vos R. еt al. (2005) Trained first-responders with an automated external defibrillator: how do they perform in real resuscitation attempt Resuscitation, 64: 157–161.
- Elliott P.M., Poloniecki J., Dickie S. et al. (2000) Sudden death in hypertrophic cardiomyopathy: identification of high risk patients. J. Am. Coll. Cardiol., 36: 2212–2218.
- Florenciano-Sanchez R., Castillo-Moreno J.A., Molina-Laborda E. еt al. (2001) The exercise test that indicates a low risk of events. Differences in prognostic significance between patients with chronic stable angina and patients with unstable angina. J. Am. Coll. Cardiol., 38(7): 1974–1979.
- Goldstein M.R. (2001) Sudden death due to cardiac arrhythmias. N. Engl. J. Med., 15: 1473–1482.
- Hajbaghery M.A., Mousavi G., Akbari H. (2005) Factors influencing survival after inhospital cardiopulmonary resuscitation. Resuscitation, 66: 317–321.
- Hazinski M.F., Idris A.H., Kerber R.E. et al. (2005) Lay rescuer automated external defibrillator («public access defibrillation») programs: lessons learned from an international multicenter trial: advisory statement from the American Heart Association Emergency Cardiovascular Committee; the Council on Cardiopulmonary, Perioperative, and Critical Care; and the Council on Clinical Cardiology. Circulation, 111: 3336–3340.
- Herlitz J., Aune S., Bеng A. et al. (2005) Very high survival among patients defibrillated at an early stage after in-hospital ventricular fibrillation on wards with and without monitoring facilities. Resuscitation, 66: 159–166.
- Hohnloser S.H., Klingenheben T., Zabel M. (1999) Identification of patients after myocardial infarction at risk of life-threatening arrhythmias. Eur. Heart J., 1(Suppl. C): C11–C20.
- Huikuri H.V., Castellanos A., Myerburg R.J. (2001) Sudden death due to cardiac arrhythmias. N. Engl. J. Med., 15, 345(20): 1473–1482.
- Jouven X., Desnos M., Guerot C. et al. (1999) Predicting Sudden Death in the Population. The Paris Prospective Study I. Circulation, 99: 1978–1983.
- Lanza G.A., Guido V., Galeazzi M.M. et al. (1998) Prognostic role of heart rate variability in patients with a recent acute myocardial infarction. Am. J. Cardiol., 82: 1323–1328.
- Lombardi F. (2001) Arrhythmia risk stratification in patients with heart failure: prognostic evaluation of arrhythmia risk. Ital. Heart J., 2(12 Suppl.): 1284–1290.
- Mark Estes N.A. 3rd, Homoud M.K., Link M.S. еt al. (2002) Assessment of risk for sudden cardiac death. Curr. Probl. Cardiol., Jun, 27(6): 246–266.
- Moncrieff J., McGavigan A.D., Dunn (2002) Arrhythmias, sudden death and syncope in hypertensive cardiovascular disease. FG. Card Electrophysiol Rev., 6(1–2): 36–41.
- Monsieurs K.G., Vogels C., Bossaert L.L. еt al. (2005) A study comparing the usability of fully automated automatic versus semi-automatic defibrillation by untrained nursing students. Resuscitation, 64: 41–47.
- Priori S.G., Aliot E., Blomstrom-Lundqvist C. et al. (2001) Task force on sudden cardiac death of the European Society of cardiology. Eur. Heart J., 22: 1374–1450.
- Rea T.D., Shah S., Kudenchuk P.J. еt al. (2005) Automated external defibrillators: to what extent does the algorithm delay CPR. Ann. Emerg. Med., 46: 132–141.
- Runquist L., Hendrix G. (2001) Survival and prognosis following sudden cardiac death. JSC Med. Assoc., 97(10): 439–441.
- Sabatine M.S., McCabe C.H., Morrow D.A. еt al. (2002) Identification of patients at high risk for death and cardiac ischemic events after hospital discharge. Am. Heart J., 143(6): 966–970.
- Saeed M., Homoud M.K., Wang P.J. (2001) Role of invasive electrophysiologic testing in risk stratification for sudden cardiac death. J. Invasive Cardiol., 11: 758–762.
- Snyder D., Morgan C. (2004) Wide variation in cardiopulmonary resuscitation interruption intervals among commercially available automated external defibrillators may affect survival despite high defibrillation efficacy. Crit. Care Med., 32: S421–424.
- Spirito P., Bellone P., Harris K.M. еt al. (2000) Magnitude of left ventricular hypertrophy and risk of sudden death in hypertrophic cardiomyopathy. N. Engl. J. Med., 342: 1778–1785.
- Whitfield R., Colquhoun M., Chamberlain D. еt al. (2005) The Department of Health National Defibrillator Programme: analysis of downloads from 250 deployments of public access defibrillators. Resuscitation, 64: 269–277.
- Wik L., Kramer-Johansen J., Myklebust H. et al. (2005) Quality of cardiopulmonary resuscitation during out-of-hospital cardiac arrest. JAMA, 293: 299–304.
- Wong S.H., Mulvihill N.T., Norton M. (2001) Assessing the risk of sudden cardiac death. Heart, 86(6): 624–625.
- Zareba W.J. (2001) New electrocardiographic indices of risk stratification. Electrocardiol., 34(4): 332–339.
- Zheng Z.J., Croft J.B., Giles W.H. еt al. (2001) Sudden cardiac death in the United States, 1989 to 1998. Circulation, 30, 104(18): 2158–2163.
1Втрата <10% протягом 2 год.
2Використання пустого скляного флакона для приготування розчину аміодарону не рекомендується, оскільки несумісність із буфером, який знаходився у флаконі, може викликати преципітацію.