Діагностика та лікування суправентрикулярних тахікардій
Содержание
Пароксизмальні порушення серцевого ритму — одна з найбільш гострих проблем сучасної кардіології. За даними ACC вони щорічно забирають від 300 до 600 тис. життів, що становить 1 смерть щохвилини. Більшість хворих — особи працездатного віку. Як правило, до такого фатального результату, як зупинка кровообігу, призводять шлуночкова фібриляція (75%), асистолія (20%) і електромеханічна дисоціація (5%), причому частка пацієнтів, що вижили, і які перенесли хоча б одноразово епізод із вищевказаних ситуацій, досить невелика — 19% загальної кількості. З іншого боку, відносно більш сприятливий перебіг пароксизмальних порушень серцевого ритму може ускладнювати безліч захворювань. Пароксизмальні суправентрикулярні тахіаритмії становлять 4/5 загального числа тахікардій. Вони займають проміжне місце між потенційно летальними аритміями і доброякісними порушеннями серцевого ритму.
Пароксизмальні суправентрикулярні тахіаритмії мають наступні характеристики:
- раптовий початок і закінчення нападу;
- звичайно регулярний ритм з незначними коливаннями частоти;
- ЧСС 100–250 уд./хв, зазвичай — 140–220 уд./хв;
- частота скорочень шлуночків відповідає частоті скорочень передсердь або нижча при наявності АV-блокади;
- комплекси QRS, як правило, вузькі, але при аберантному проведенні можуть розширюватися. Основні механізми розвитку пароксизмальних аритмій включають re-entry, ектопічний автоматизм і тригерну активність.
Тахікардії з вузькими комплексами QRS
В основі тахіаритмій лежить один або кілька механізмів, включаючи порушення формування імпульсу і порушення проведення імпульсу (циркуляція хвилі збудження — re-entry). Тканини з аномальним автоматизмом, який є основою механізму надшлуночкових тахіаритмій, можуть перебувати у передсердях, AV-з’єднанні або в м’язових муфтах судин, які безпосередньо вступають у контакт із передсердями, таких як верхня і нижня порожнисті вени або легеневі вени. Клітини з підвищеним автоматизмом мають більш високу швидкість 4-ї фази діастолічної деполяризації і, отже, підвищену швидкість формування імпульсу порівняно з основним водієм ритму — синусним вузлом. Якщо швидкість формування імпульсу в ектопічному вогнищі перевищує таку в синусному вузлі, то ектопічне вогнище стає домінуючим вогнищем автоматизму серця, пригнічуючи активність синусного вузла. Активність ектопічного вогнища може бути стійкою (домінує більшу частину часу протягом доби) або нестійкою.
Пусковий (тригерний) механізм тахікардії пов’язаний з порушенням фази реполяризації. Тригерні ритми виникають у результаті переривання фази реполяризації серцевої клітини, це явище називається постдеполяризацією. Якщо величина постдеполяризації досягає граничного значення, то виникає ранній ПД у фазу реполяризації.
Найпоширеніший механізм аритмії — повторний вхід імпульсу в ту саму ділянку міокарда, що може проявлятися в різних формах. Найпростіша форма — це циркуляція електричного імпульсу навколо певної ділянки міокарда. Цей механізм виникнення повторного входу збудження називають re-entry. Для виникнення та підтримки re-entry потрібно ряд умов. Для виникнення кругового руху тахікардії необхідний односпрямований блок проведення в одній із ділянок кола re-entry. Односпрямований блок може бути наслідком підвищення ЧСС або виникнення передчасного імпульсу (екстрасистоли), що змінює рефрактерний період однієї з ділянок петлі re-entry. Сповільнення проведення необхідно як для ініціації, так і для підтримки кругового руху імпульсу. У випадку ортодромної АV-реципрокної тахікардії (тобто антероградне проведення імпульсу відбувається через АV-вузол, а ретроградне проведення — по додатковому шляху), сповільнення проведення через АV-вузол дає можливість додатковому шляху відновитися, тобто вийти з періоду рефрактерності.
Тахікардія з вузькими комплексами QRS (комплекс QRS <120 мс) може бути викликана формуванням імпульсів у синусному вузлі (синусова тахікардія), петлею re-entry у синусному вузлі або прилягаючій ділянці передсердя (синусова реципрокна тахікардія), в передсерді (передсердна тахікардія, тріпотіння та фібриляція передсердь, в області АV-вузол — пучок Гіса (тахікардія АV-з’єднання), а також в результаті re-entry, що виникає в АV-вузлі або в перехідній зоні по периметру АV-вузла — АV-вузлова реципрокна тахікардія або re-entry, при якому АV-вузол і пучок Гіса утворюють шлях антероградної АV-провідності, а додатковий АV-шлях забезпечує ретроградне проведення — ортодромна АV-реципрокна тахікардія. Іноді сповільнення проведення імпульсу у внутрішньошлуночковій спеціалізованій провідній системі може призводити до формування шлуночкової тахікардії з комплексами тривалістю <120 мс (фасцикулярна тахікардія). Досить часто ретельний аналіз ЕКГ у 12 відведеннях, особливо якщо вдається зареєструвати її в ході масажу каротидного синуса або іншої вагусної проби, полегшує встановлення правильного діагнозу. Правильна ідентифікація місця виникнення передсердної активності, її частоти та зв’язку зі шлуночковим ритмом має важливе значення.
У ході типової передсердної тахікардії передсердна активність передує кожному комплексу QRS. Оскільки інтервал P–R може змінюватися відповідно до здатності АV-вузла до проведення і частоти передсердної тахікардії, зазвичай хвиля Р розміщена в другій половині циклу тахікардії, при цьому інтервал P–R коротший, ніж інтервал R–Pʹ. Важливо, що передсердна тахікардія може тривати, незважаючи на розвиток АV-блокади, оскільки активація шлуночків не є обов’язковою частиною петлі тахікардії. Чотири інших види тахікардії з вузькими комплексами QRS, при яких інтервал R–Pʹ зазвичай перевищує інтервал P–R, включають синусову реципрокну тахікардію, неправильну синусову тахікардію, атипову АV-реципрокну тахікардію, а також перманентну (непароксизмальну) форму реципрокної тахікардії АV-з’єднання. АV-блокада при тахікардії, що триває, може виникати у випадку re-entry в синусному вузлі, синусовій тахікардії і атиповому АV-вузловому re-entry. Антероградне проведення через швидкий провідний шлях АV-вузла і ретроградне проведення через повільний провідний шлях АV-вузла утворюють петлю повторного входу для атипового АV-вузлового re-entry, у той час як антероградне проведення через АV-вузол і ретроградне проведення через повільний додатковий провідний шлях забезпечують петлю для непароксизмальної АV-реципрокної тахікардії. У деяких пацієнтів, у яких хвиля Рʹ розміщена в середині серцевого циклу, відзначається АV-вузлове re-entry з двома повільними провідними шляхами, один антероградний, а інший pетроградний, так зване повільно-повільне (slow-slow) АV-вузлове проведення.
При типовій тахікардії АV-вузлового re-entry передсердя та шлуночки активуються одночасно у зв’язку з антероградним проведенням через повільний провідний шлях і ретроградним проведенням через швидкий провідний шлях. Ретроградна хвиля Рʹ «приховується» комплексом QRS або вимальовується в кінцевій частині комплексу QRS. Може відзначатися АV-блокада при тахікардії, що триває. При ортодромній АV-реципрокній тахікардії петля тахікардії формується антероградним проведенням через АV-вузол і ретроградним проведенням через додатковий АV-шлях. Ретроградна активація передсердь визначається за комплексом QRS, а хвиля Рʹ розміщена на сегменті ST. Тахікардія не може тривати при наявності АV-блокади. В обох випадках, при АV-вузловому re-entry і АV-реципрокній тахікардії, ретроградні хвилі Рʹ відзначаються в першій половині циклу тахікардії, так що інтервал R–P коротше інтервалу P–R.
При тахікардії з вузькими комплексами QRS може відзначатися АV-дисоціація. Якщо цього не відбувається, тахікардія найчастіше виходить з АV-вузла — пучка Гіса або дистальних відділів пучка Гіса.
Диференціальна діагностика тахікардії з вузькими комплексами QRS
Пацієнтам необхідно виконати ЕКГ у 12 стандартних відведеннях в стані спокою. Виявлення синдрому передзбудження шлуночків (дельта-хвилі) на ЕКГ у пацієнтів з анамнезом пароксизмів ритмічного серцебиття досить для постановки діагнозу WPW-синдрому, і немає необхідності реєстрації спонтанних епізодів тахікардії для призначення терапії (схема 5.1).
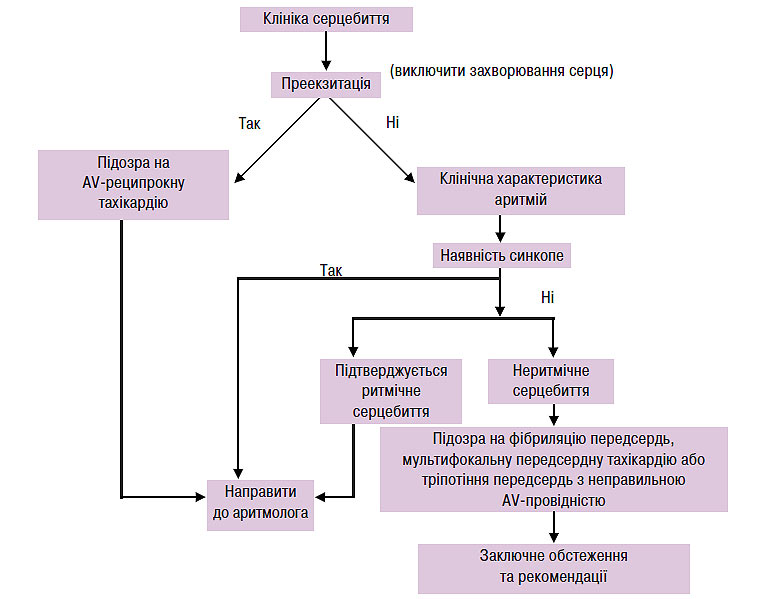
Схема. 5.1. Первинна оцінка хворих з підозрою на AV-реципрокну тахікардію
Клінічний анамнез ритмічного і неритмічного серцебиття у пацієнтів із встановленим синдромом передзбудження шлуночків вказує на епізоди фібриляції передсердь, що вимагає проведення ЕФД, оскільки у цих пацієнтів відзначають високий ризик раптової смерті. В інших випадках діагноз встановлюють на підставі ретельного аналізу ЕКГ (у 12 відведеннях), знятої під час тахікардії. Тому пацієнтам з тривалою аритмією в анамнезі доцільно мати принаймні одну ЕКГ в 12 відведеннях, зняту під час пароксизму аритмії. Автоматичні системи аналізів ЕКГ ненадійні, що утруднює встановлення точного аритмічного діагнозу.
При вузьких комплексах QRS (<120 мс) тахікардія майже завжди є надшлуночковою (схема 5.2). Якщо відсутні зубці Р або є явні ознаки передсердної активності, а інтервали R–R однакові, то найімовірніше це АV-вузлова реципрокна тахікардія. Зубець Рʹ при АV-вузловій реципрокній тахікардії може частково ховатися всередині комплексу QRS або деформувати комплекс QRS, імітуючи псевдозубець R у відведенні V1 і/або псевдозубець S у нижніх відведеннях. Якщо зубець Рʹ виявляється на сегменті ST і відстоїть від комплексу QRS >70 мс, то швидше за все, це АV-реципрокна тахікардія. Якщо при тахікардії інтервал R–P довший, ніж інтервал P–R, то найбільш імовірний діагноз — «атипова АV-вузлова реципрокна тахікардія» (постійна форма вузлової реципрокної тахікардії або АV-реципрокна тахікардія через додатковий шлях з повільним проведенням) або «передсердна тахікардія».
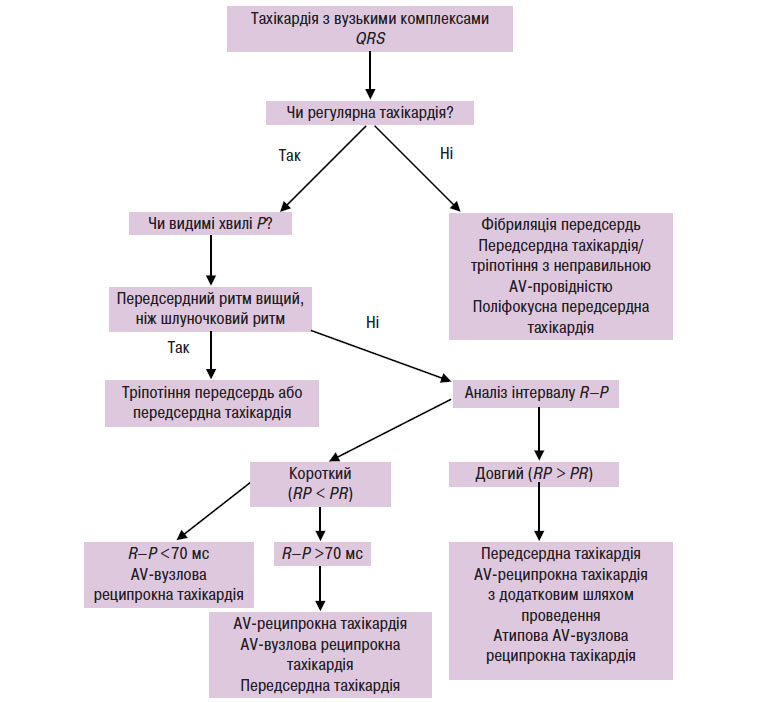
Схема 5.2. Диференціальний діагноз тахікардії з вузькими комплексами QRS
У диференціальній діагностиці можуть допомогти реакції тахікардії з вузькими комплексами QRS на аденозинфосфат або масаж каротидного синуса. При введенні аденозинфосфату та масажі каротидного синуса бажано проводити запис ЕКГ у 12 відведеннях. Якщо зубці Рʹ не видно, то може бути корисним використання стравохідних електродів.
Фокусна вузлова тахікардія у пацієнтів може імітувати зразок АV-вузлової реципрокної тахікардії і може демонструвати АV-дисоціацію та/або при цьому відзначається регулярний ритм.
Невідкладна терапія при тахікардії з вузькими комплексами QRS
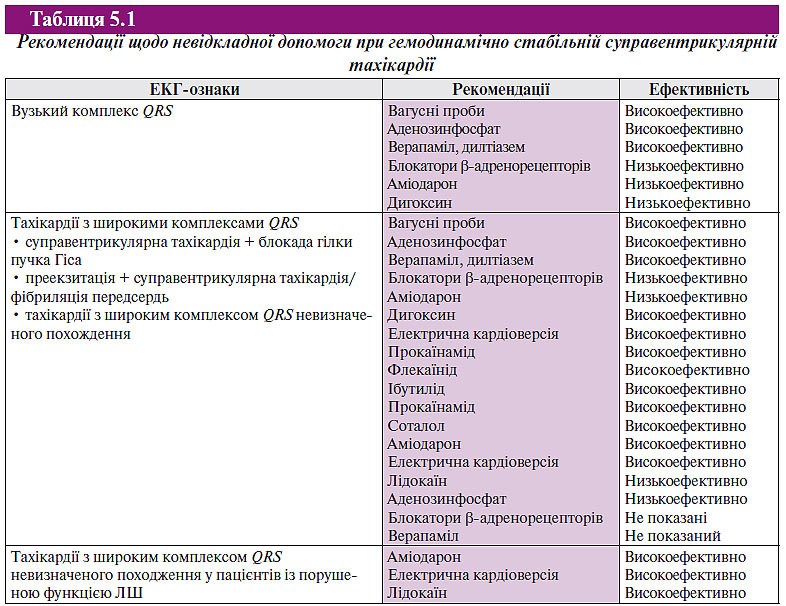
Для купірування тахікардії з вузькими комплексами QRS слід почати з вагусних прийомів (проба Вальсальви, масаж каротидного синуса, занурення обличчя в холодну воду і т.д.), що впливають на АV-провідність. При відсутності позитивного ефекту пацієнтам зі стабільною гемодинамікою слід почати внутрішньовенне введення протиаритмічних лікарських засобів. Препаратами вибору є аденозинфосфат або антагоністи кальцієвих каналів негідропіридинового ряду. Перевага аденозинфосфату порівняно з блокаторами кальцієвих каналів або блокаторами β-адренорецепторів при внутрішньовенному введенні — у швидкому початку дії та короткому періоді напіввиведення. Тому найчастіше перевага віддається внутрішньовенному введенню аденозинфосфату, крім пацієнтів з тяжкою формою БА. Хворим, що одержують теофілін, для досягнення ефекту може знадобитися застосування аденозинфосфату в більш високих дозах, а дипіридамол потенціює дію аденозинфосфату. Крім того, може зростати ступінь АV-блокади в тих випадках, коли аденозинфосфат призначають пацієнтам, що приймають карбамазепін. Надається перевага застосуванню препаратів тривалої дії (блокатори кальцієвих каналів або блокатори β-адренорецепторів) у пацієнтів з частими передсердними або шлуночковими екстрасистолами, які є пусковим механізмом непароксизмальних шлуночкових тахікардій. Аденозинфосфат або електроімпульсна терапія (кардіоверсія) є методом вибору у осіб з гемодинамічно значимою непароксизмальною шлуночковою тахікардією. Аденозинфосфат може спровокувати фібриляцію передсердь у 1–15% випадків, що зазвичай носить тимчасовий характер, але може бути загрозливою для життя у пацієнтів із синдромом передзбудження шлуночків. Необхідно дотримуватись крайньої обережності при одночасному внутрішньовенному призначенні блокаторів кальцієвих каналів і блокаторів β-адренорецепторів, оскільки існує небезпека появи гіпотензії та/або брадикардії. Під час виконання вагусних прийомів або введення препаратів доцільна реєстрація ЕКГ, оскільки реакція на них може допомогти в діагностиці, навіть якщо аритмія не припинилася. Купірування тахікардії із зубцем Рʹ, розміщеним після комплексу QRS, припускає діагноз АV-реципрокної тахікардії або АV-вузлової реципрокної тахікардії. Передсердна тахікардія часто нечутлива до аденозинфосфату. Трансформація в тахікардію з АV-блокадою фактично вказує на передсердну тахікардію або тріпотіння передсердь (залежно від інтервалу Р–Р або F–F), виключає АV-реципрокну тахікардію і робить АV-вузлову реципрокну тахікардію малоймовірною (табл. 5.1).
Синоатріальна тахікардія виникає за механізмом re-entry з циркуляцією хвилі збудження в синоатріальній зоні (синусний вузол, міокард правого передсердя). Являє собою напади підвищення частоти ритму з ЧСС 100–200 уд./хв, характеризується раптовим початком і раптовим припиненням.
Критеріями синоатріальної тахікардії є:
1) правильний ритм з ЧСС 100–200 уд./хв;
2) зубець Р на ЕКГ практично не відрізняється від синусового Р.
Передсердна тахікардія — це порушення ритму, що виникає за механізмом ектопічного автоматизму.
ЕКГ-критерії:
1) правильний ритм з частотою скорочення передсердь 150–250 уд./хв;
2) зубці Р за конфігурацією відрізняються від синусових;
3) початок тахікардії характеризується в ряді випадків поступовим підвищенням частоти ритму.
Найбільше клінічне значення мають АV-вузлові реципрокні тахікардії. Електрофізіологічною основою пароксизмальної АV-вузлової тахікардії є наявність усередині вузла двох шляхів проведення, що мають різні функціональні властивості. Один із цих шляхів (швидкий) проводить імпульси від передсердь до шлуночків з більшою швидкістю і має більшу тривалість ефективного рефрактерного періоду. Інший шлях (повільний) проводить імпульс з нижчою швидкістю і має меншу тривалість ефективного рефрактерного періоду. Ці два шляхи замикають кільце циркуляції хвилі збудження. При нормальному синусовому ритмі імпульс зазвичай проводиться через швидкий шлях, тому функціонування повільного шляху АV-вузла на ЕКГ не проявляється. При виникненні пароксизмальної АV-вузлової тахікардії імпульс проводиться повільним шляхом до шлуночків і повертається до передсердь по швидкому шляху. У зв’язку з тим, що збудження шлуночків і передсердь під час пароксизму тахікардії настає майже одночасно, на ЕКГ рідко вдається зареєструвати зубці Р. Вони, як правило, зливаються зі шлуночковими комплексами. Якщо зубці Р все-таки вдається визначити, то вони негативні в II, III і aVF-відведеннях, що вказує на ретроградне збудження передсердь.
Пароксизмальна АV-реципрокна тахікардія за участю додаткових шляхів проведення виникає на фоні синдромів преекзитації і розглядається в аритмології як класична природна модель тахікардії, що має перебіг за електрофізіологічним механізмом re-entry. Синдром преекзитації полягає в тому, що під час одного серцевого циклу шлуночки збуджуються як імпульсом, проведеним з передсердь по додатковому (аномальному) шляху, так і по нормально функціонуючій провідній системі, причому при проведенні імпульсу по додатковому шляху проведення частина міокарда або весь шлуночок збуджується раніше, тобто передчасно. ЕКГ-прояви синдрому преекзитації на фоні синусового ритму широко варіюють, що залежить від ступеня преекзитації і сталості проведення по додатковому шляху проведення. Можливі наступні варіанти:
- на ЕКГ постійно є ознаки преекзитації (маніфестний синдром преекзитації);
- на ЕКГ ознаки преекзитації мають минущий характер (інтермітуючий або минущий синдром преекзитації);
- ЕКГ у звичайних умовах нормальна, ознаки преекзитації з’являються тільки в період пароксизму або при провокаційних пробах — навантаженні, вагусних або медикаментозних пробах, ЕФД (прихований синдром преекзитації).
ЕКГ-реєстрація пароксизму тахікардії є однією з найважливіших умов верифікації синдрому преекзитації та правильного вибору лікування. У той же час кардіологам нерідко доводиться зустрічатися з клінічними випадками захворювання, коли ЕКГ-реєстрація пароксизму тахікардії утруднена з тих або інших причин. У такій ситуації об’єктивну інформацію можна одержати з використанням ЕФД як неінвазивного (черезстравохідна електрокардіостимуляція), так і інвазивного (ендокавітарне ЕФД).
Особливо часто виявляють варіант АV-реципрокної тахікардії, при якій хвиля збудження поширюється антероградно через АV-вузол у систему Гіса — Пуркіньє, ретроградно — через додаткові шляхи проведення до передсердя. Цю тахікардію називають ортодромною. Значно рідше відзначають варіант АV-реципрокної тахікардії, при якому хвиля збудження робить круговий рух по тій самій петлі: антероградно через додатковий шлях проведення, ретроградно через систему Гіса — Пуркіньє і АV-вузол до передсердя. Цю тахікардію називають антидромною.
Пароксизм ортодромної суправентрикулярної тахікардії характеризується частими (140–250 уд./хв), позбавленими ознак преекзитації, нормальними (вузькими) комплексами QRS. У ряді випадків після комплексу QRS спостерігаються інвертовані зубці Р, що вказує на ретроградну активацію передсердь.
Антидромна суправентрикулярна тахікардія проявляється на ЕКГ частим регулярним ритмом (150–200 уд./хв), шлуночковими комплексами за типом максимально вираженої преекзитації (QRS >0,1 с), після яких іноді виявляються інвертовані зубці Р.
Уточнення діагнозу «пароксизмальна АV-вузлова тахікардія», як правило, вимагає застосування методу клінічного ЕФД. Пароксизмальна надшлуночкова тахікардія при прихованому WPW-синдромі має певну подібність з АV-вузловою тахікардією, але відрізняється структурою ланцюга re-entry. Тому диференціальна діагностика між ними будується на ознаках, що виявляють участь різних структур у ланцюзі re-entry. Найбільш корисна інформація при диференціації АV-вузлової тахікардії і реципрокної тахікардії за участю додаткових шляхів проведення може бути отримана на черезстравохідній електрограмі при пароксизмі тахікардії. Величина інтервалу V–А за даними стравохідного відведення <100 мс у 90% випадків вказує на АV-вузлову тахікардію. При цьому зубець Р на зовнішній ЕКГ не видно, оскільки він накладається на комплекс QRS або початок сегмента ST.
СИНУСОВІ ТАХІКАРДІЇ
Синусова тахікардія, як правило, виникає у відповідь на відповідний фізіологічний (наприклад фізичне навантаження) або патологічний (наприклад гіпертиреоз) стимул. Порушення механізмів контролю синусового ритму може призвести до синусової тахікардії. Синусова тахікардія може також виникати при переході тіла з горизонтального положення у вертикальне (синдром постуральної ортостатичної тахікардії). Петлі re-entry можуть перебувати всередині або поруч з синусним вузлом, що призводить до так званої реципрокної синусової тахікардії, яку іноді називають синоатріальне re-entry.
У нормі синусний вузол генерує приблизно від 60 до 90 імпульсів за хвилину і відповідає на автономні впливи. Синусний вузол — складна структура, на яку мають вплив багато факторів, включаючи гіпоксію, ацидоз, температуру та гормони (наприклад трийодтиронін, серотонін).
Синусова тахікардія визначається як підвищення частоти синусового ритму >100 уд./хв у відповідь на відповідний ступінь фізичного, емоційного, патологічного або фармакологічного стресу. До патологічних причин синусової тахікардії належить гіпертермія, гіповолемія або анемія, які можуть бути результатом інфекції, злоякісних процесів, ішемії міокарда, застійної СН, емболії легень, шоку і тиреотоксикозу. До провокуючих факторів синусової тахікардії належать стимулятори: кофеїн, алкоголь, нікотин; лікарські засоби (сальбутамол, амінофілін, атропін, катехоламіни та ін.), а також певні наркотичні препарати (амфетаміни, кокаїн, екстазі та ін.). Протиракові препарати, особливо антрациклінового ряду, такі як доксорубіцин і даунорубіцин, можуть також викликати синусову тахікардію як результат гострого або відстроченого кардіотоксичного ефекту, індукованого катехоламінами і гістаміном. Синусова тахікардія може сигналізувати про серйозні патологічні стани і часто вимагає ретельної оцінки. Передсердну і синусову тахікардію досить важко диференціювати.
Синусова тахікардія виникає в результаті нейрогуморальних впливів на пейсмейкерні клітини та морфологічних змін у самому синусному вузлі.
У нормі при синусовому ритмі зубець Р на ЕКГ у 12 відведеннях позитивний у відведеннях I, II і aVF і негативний у aVR. Його вісь у фронтальній площині лежить між кутом 0° і +90°; у горизонтальній площині вісь спрямована вперед і дещо вліво, і тому зубець Р може бути негативним у відведеннях V1 і V2, але позитивним — у відведеннях V3–V6. При зростанні амплітуди зубець Р може стати загостреним. Синусова тахікардія — непароксизмальна, що відрізняє її від інших re-entry.
Патологічна (аномальна) синусова тахікардія
Патологічна синусова тахікардія — це персистувальне підвищення ЧСС у стані спокою, що не відповідає рівню фізичного, емоційного, патологічного або фармакологічного стресу.
Патологічна основа аномальної синусової тахікардії ймовірно включає багато факторів, проте передбачається два основних механізми:
1. Підвищений автоматизм синусного вузла;
2. Порушення автономної регуляції синусного вузла з підвищенням симпатичного та зниженням парасимпатичного тонусу.
Більша частина хворих з аномальною синусовою тахікардією — жінки. Середній вік хворих — 38±12 років. Хоча найбільш частою скаргою є прискорене серцебиття, можуть бути й такі симптоми, як біль у грудній клітці, затруднення дихання, запаморочення; описуються також переднепритомні стани. Ступінь непрацездатності може значно варіювати — від повної відсутності симптомів під час медичного обстеження до випадків, коли пацієнти повністю непрацездатні. Клінічні та інструментальні методи обстеження, проведені в загальному порядку, дозволяють усунути вторинну причину — тахікардію, проте рідко допомагають встановити діагноз.
Синусову тахікардію діагностують на підставі критеріїв, одержаних за допомогою інвазивних і неінвазивних досліджень:
1. Персистуюча синусова тахікардія (ЧСС >100 уд./хв) протягом дня з надмірним підвищенням частоти пульсу у відповідь на фізичну активність і нормалізацією ЧСС у нічний час, підтверджений результатами 24-годинного холтерівського моніторування.
2. Тахікардія і симптоми носять непароксизмальний характер.
3. Морфологія зубця Р на ЕКГ і ендокардіальних ЕКГ при тахікардії ідентична такій при синусовому ритмі.
4. Виключення вторинних причин (наприклад гіпертиреоз, феохромоцитома, фізична нетренованість).
Лікування при аномальній синусовій тахікардії в основному симптоматичне. Немає даних про розвиток аритмогенної кардіоміопатії, що викликана такою тахікардією у пацієнтів, яким не проводилося лікування. Найімовірніше ризик розвитку аритмогенної кардіоміопатії невисокий.
Хоча рандомізовані, плацебо-контрольовані клінічні дослідження не проводили, блокатори β-адренорецепторів можуть бути ефективні і повинні призначатися як терапія першої лінії більшості пацієнтам з цією тахікардією (табл. 5.2). Є дані, на підставі яких можно вважати, що блокатори кальцієвих каналів, такі як верапаміл і дилтіазем, також ефективні.
Таблиця 5.2 Рекомендації щодо лікування синусової тахікардії
| Методи терапії | Рекомендації | Ефективність |
| Медикаментозний (неінвазивний) | Блокатори β-адренорецепторів
Верапаміл, дилтіазем |
Високоефективно
Ефективно |
| Інвазивний | Катетерна абляція — модификація/усунення синусного вузла | Низькоефективно |
Модифікація синусного вузла методом катетерної абляції потенційно може бути використана при лікуванні більшості рефракторних випадків аномальної синусової тахікардії. Можливими ускладненнями процедури катетерної абляції є перикардит, ушкодження діафрагмального нерва, синдром верхньої порожнистої вени, деструкція синусного вузла з необхідністю імплантації системи постійної електрокардіостимуляції. У ряді випадків повідомлялося про успішну радіочастотну модифікацію синусного вузла. Перед тим як виконати радіочастотну абляцію, необхідно виключити діагноз «синдром постуральної ортостатичної тахікардії». За даними ретроспективного аналізу 29 випадків модифікації синусного вузла з приводу аномальної синусової тахікардії позитивний ефект був досягнутий у 22 (76%) випадках. Віддалена ефективність склала 66%.
Синусно-передсердна вузлова re-entry тахікардія
В основі синусової re-entry тахікардії лежить виникнення петлі re-entry всередині синусного вузла з індукцією пароксизмальних, часто нестійких залпів тахікардії із зубцями Р, які схожі, якщо не ідентичні, з аналогічними при синусовому ритмі. Вона зазвичай запускається і переривається передсердною екстрасистолою.
Гетерогенність провідності всередині синусового вузла сприяє виникненню re-entry, проте дотепер невідомо, чи виникає петля re-entry ізольовано всередині самого синусного вузла, чи залучена перинодальна передсердна тканина, а також чи може існувати re-entry навколо ділянки crista terminalis. Проте той факт, що ця форма аритмії, як і АV-вузлова реципрокна тахікардія, відповідає на вагусні прийоми та аденозинфосфат, дає можливість припустити, що тканина синусного вузла залучена в коло re-entry.
Поширеність синусової re-entry тахікардії серед пацієнтів, яким проводили ЕФД у зв’язку із суправентрикулярною тахікардією, коливається в межах 1,8–16,9% і до 27% у пацієнтів з вогнищевою передсердною тахікардією. Відзначається висока частота випадків органічних захворювань серця у пацієнтів із синусовою re-entry тахікардією. Пацієнти пред’являють скарги на серцебиття, легке запаморочення і переднепритомний стан. Непритомності виникають вкрай рідко, частота тахікардії зазвичай не більше 180 уд./хв. Важливе значення в діагностиці має пароксизмальний характер тахікардії.
Діагноз синусової re-entry тахікардії встановлюється на підставі критеріїв, отриманих за допомогою інвазивних і неінвазивних досліджень.
Наступні клінічні характеристики дозволяють запідозрити діагноз цієї форми аритмії:
- Тахікардія і пов’язані з нею симптоми — пароксизмальні;
- Морфологія зубця Рʹ ідентична такій при синусовому ритмі, при цьому його вектор має напрямок зверху вниз і справа наліво;
- Ендокардіальна передсердна активація має вигляд зверху вниз і справа наліво, а послідовність активації подібна такій при синусовому ритмі;
- Індукція та/або купірування аритмії викликається передчасними передсердними стимулами;
- Купіруванння відбувається при виконанні вагусних прийомів або введенні аденозинфосфату;
- Індукція аритмії не залежить від часу синоатріального проведення або часу проведення через АV-вузол.
Контрольованих досліджень з медикаментозної профілактики синусової re-entry тахікардії не проводилося. Клінічні симптоми, що дозволяють запідозрити синусову re-entry тахікардію, можуть відповідати на вагусні прийоми, аденозинфосфат, аміодарон, блокатори β-адренорецепторів, блокатори кальцієвих каналів і навіть на дигоксин. У пацієнтів, які переносять тахіаритмію і що добре контролюється вагусними прийомами та/або іншою терапією, проведення ЕФД не показане. ЕФД показане особам з частими нападами тахікардії або такими, що погано переносяться, які не піддаються медикаментозній терапії, а також пацієнтам, у яких точна природа тахікардії невідома, а ЕФД може допомогти у виборі відповідної лікарської терапії. Радіочастотна катетерна абляція персистувальної синусової re-entry тахікардії, виявленої під час ЕФД, зазвичай ефективна.
AV-вузлова реципрокна тахікардія
AV-реципрокна тахікардія — найчастіша форма непароксизмальних шлуночкових тахікардій. Частіше виявляють у жінок; супроводжується серцебиттям, запамороченням, пульсацією в області шиї і звичайно не пов’язана зі структурним захворюванням серця. Пульс при тахікардії, як правило, в межах 140–250 уд./хв.
Спочатку вважали, що коло re-entry обмежується компактною частиною AV-вузла, але пізніше з’явилися дані про те, що перинодальна передсердна тканина є складовою петлі re-entry. Проте встановлено, що АV-вузлова реципрокна тахікардія може існувати і без участі передсердної тканини. Для виникнення АV-вузлової реципрокної тахікардії необхідно два функціонально та анатомічно різних канали. У більшості випадків швидкий шлях (fast pathway) розміщується поруч з верхівкою трикутника Коха. Повільний шлях розміщений ззаду і нижче компактної частини АV-вузла і проходить вздовж септального края фіброзного кільця тристулкового клапана на рівні або дещо вище коронарного синуса.
Під час типової АV-вузлової реципрокної тахікардії повільний шлях (slow pathway) виступає у якості антероградної ділянки петлі, в той час як швидкий (fast) канал — це ретроградне коліно (тобто slow-fast re-entry AV-вузла). Імпульс повільним каналом проводиться через пучок Гіса до шлуночків, а по швидкому каналу проведення йде назад до передсердь, у результаті чого з’являється зубець Р тривалістю 40 мс, що накладається на комплекс QRS або виникає відразу після нього (<70 мс), що часто призводить до появи псевдо-rʹ у відведенні V1. Рідко (5–10%) петля тахікардії має зворотний напрямок, тобто проведення здійснюється антероградно по швидкому каналу і ретроградно по повільному каналу (fast-slore-entry AV-вузла або атипова АV-вузлова реципрокна тахікардія), що приводить до появи довгого інтервалу R–P. Зубець Р, негативний у відведеннях III і aVF, реєструється перед комплексом QRS. Бувають випадки, коли обидві ділянки кола тахікардії складаються із шляху з повільним проведенням (slow-slow re-entry АV-вузла), зубець Рʹ реєструється після QRS (тобто інтервал R–P ≥70 мс). Для лікування пацієнтів з частими і стійкими нападами АV-вузлової реципрокної тахікардії, які віддають перевагу постійній пероральній терапії і відмовляються від катетерної абляції, може використовуватися ряд протиаритмічних препаратів. Стандартна терапія включає блокатори кальцієвих каналів, блокатори β-адренорецепторів і дигоксин. При лікуванні пацієнтів без структурної патології міокарда, з резистентністю до препаратів, що сповільнюють АV-провідність, перевагу надають антиаритмічним препаратам класу IС — флекаїніду і пропафенону. В більшості випадків препарати класу III, такі як соталол або аміодарон, не застосовують; препарати класу IА — хінідин, прокаїнамід і дизопірамід використовують обмежено, оскільки вони вимагають тривалого застосування, мають помірну ефективність і володіють проаритмогенною дією.
Значно обмежує оцінку ефективності протиаритмічних препаратів при лікуванні АV-вузлової реципрокної тахікардії відсутність великих багатоцентрових, рандомізованих, плацебо-контрольованих досліджень.
Профілактична фармакологічна терапія
Блокатори кальцієвих каналів, блокатори β-адренорецепторів і дигоксин. Коментарі щодо ефективності тривалого перорального прийому блокаторів кальцієвих каналів, блокаторів β-адренорецепторів і дигоксину при лікуванні АV-вузлової реципрокної тахікардії обмежені невеликою кількістю рандомізованих досліджень цієї групи пацієнтів. Результати рандомізованого плацебо-контрольованого дослідження невеликої групи з 11 пацієнтів свідчать, що пероральний прийом верапамілу зменшує кількість і тривалість нападів (як за повідомленнями пацієнтів, так і згідно з даними ЕФД). Ці дані були отримані при застосуванні верапамілу в дозі 360–480 мг/добу. Тенденція до більш вираженого позитивного ефекту відзначалася при застосуванні препарату в більш високих дозах.
Дигоксин (0,375 мг/добу), верапаміл (480 мг/добу) і пропранолол (240 мг/добу), що призначалися перорально 11 пацієнтам (за даними рандомізованого дослідження), мали однакову ефективність. При цьому не одержано розходжень за частотою виникнення або тривалістю непароксизмальних шлуночкових тахікардій при застосуванні цих препаратів.
Препарати I класу
Дані, що свідчать про ефективність прокаїнаміду, хінідину і дизопіраміду, взяті зі старих літературних джерел і обмежені невеликою кількістю досліджень. На сьогодні ці препарати рідко застосовують при лікуванні пацієнтів з АV-вузловою реципрокною тахікардією. Віддалений ефект перорального застосування флекаїніду при АV-вузловій реципрокній тахікардії спочатку був показаний у відкритому дослідженні. Флекаїнід у дозах 200–300 мг/добу повністю пригнічує пароксизми тахікардії у 65% пацієнтів. Декілька рандомізованих подвійних сліпих досліджень підтвердили ефективність флекаїніду у запобіганні пароксизмів. Порівняно з плацебо кількість нападів зменшилася, при цьому збільшився середній час до виникнення першого пароксизму і міжнападовий інтервал. Відкриті тривалі дослідження свідчать про хорошу переносимість та безпеку препарату. Серед пацієнтів без структурних захворювань серця 7,6% припинили застосування препарату у зв’язку з відсутністю скарг, а 5% — у зв’язку з побічними діями флекаїніду (як правило, з боку ЦНС). Препарати класу IС (флекаїнід і пропафенон) протипоказані пацієнтам зі структурними захворюваннями серця. Крім того, препарати класу IС часто призначають поєднано з блокаторами β-адренорецепторів, з метою підвищення ефективності і зниження ризику АV-провідності 1:1 у випадку виникнення тріпотіння передсердь.
Флекаїнід ефективніший при постійній терапії, ніж верапаміл. Незважаючи на те що обидва препарати (середні дози 200 і 240 мг/добу відповідно) показали однакове зниження частоти нападів, у 30% пацієнтів, що одержували флекаїнід, повністю була відсутня клінічна симптоматика, тоді як при застосуванні верапамілу — тільки у 13%. Частка пацієнтів, що припинили застосування препаратів через побічні реакції, була майже однаковою — 19 і 24% відповідно.
Пропафенон також ефективний при профілактиці АV-вузлової реципрокної тахікардії. У подвійному сліпому плацебо-контрольованому дослідженні аналізували тимчасові періоди, при яких лікування ставало неефективним. Відносний ризик неефективності лікування для плацебо порівняно з пропафеноном становив 6,8. В іншому дослідженні показано, що пропафенон (300 мг 3 рази/добу) знижує частоту виникнення пароксизмів на 1/5 порівняно з плацебо.
Препарати III класу
Існують тільки вірогідні дані щодо застосування препаратів III класу (аміодарон, соталол, дофетилід). Хоча багато з них були ефективними при застосуванні для профілактики пароксизмів, проте рутинного застосування цих препаратів слід уникати в зв’язку з проаритмогенною дію (torsades de pointes — веретеноподібна шлуночкова тахікардія). Результати плацебо-контрольованого дослідження свідчать про те, що соталол порівняно з плацебо збільшує міжнападний період АV-вузлової реципрокної тахікардії. За даними наступного багатоцентрового дослідження, у пацієнтів з непароксизмальними шлуночковими тахікардіями, що одержували дофетилід (500 мкг 2 рази на добу), в 50% випадків повністю зникали симптоми при 6-місячному динамічному спостереженні, в той час як у контрольній групі усунення симптомів склало 6% (р<0,001). Проаритмічних ефектів не спостерігали. У цьому ж дослідженні встановлено, що дофетилід має таку саму ефективність, як і пропафенон (150 мг 3 рази на добу). Є обмежені дані щодо ефектів аміодарону при АV-вузловій реципрокній тахікардії. За даними одного відкритого дослідження, проведеного в ході ендокавітарного ЕФД, внутрішньовенне введення аміодарону (5 мг/кг маси тіла протягом >5 хв) купірувало тахікардію у 7 з 9 пацієнтів. Пероральне застосування аміодарону (в підтримувальній дозі 200–400 мг/добу) протягом 66±24 дні попереджувало пароксизми у всіх пацієнтів; при цьому його основною дією було сповільнення провідності по швидкому шляху в ретроградному напрямку. Слід зазначити, що застосування аміодарону безпечно у пацієнтів з структурною патологією серця, особливо при зниженні ФВ ЛШ.
Вогнищева (фокусна) АV-вузлова тахікардія
Патологічний прискорений ритм із АV-вузла позначався різними термінами, кожний з яких має свої недоліки. Наприклад, деякі називають це порушення ритму вузловою ектопічною тахікардією. Неточність цього терміна в тому, що всі вогнища автоматизму поза синусним вузлом фактично є ектопічними. Термін «автоматична вузлова тахікардія» припускає, що основним механізмом є порушення автоматизму; проте ця тахікардія може виникати і за іншими механізмами.
Відмінна риса вогнищевих вузлових тахікардій — їх походження з АV-вузла або пучка Гіса. Це місцезнаходження початку аритмії призводить до виникнення різних ЕКГ-ознак, оскільки для існування аритмії не потрібно участі ні передсердь, ні шлуночків. До ЕКГ-ознак вогнищевої вузлової тахікардії належать ЧСС 110–250 уд./хв, вузькі комплекси QRS або морфологія типової блокади ніжок пучка Гіса. Часто відзначається АV-дисоціація, хоча транзиторно може спостерігатися ретроградне проведення у співвідношенні 1:1. Іноді вузловий ритм буває зовсім неправильний, нагадуючи фібриляцію передсердь. Нарешті, ізольовані приховані вузлові екстрасистоли, які не проводяться на шлуночки, можуть викликати епізоди АV-блокади, призводячи до інтермітуючої рефрактерності АV-вузла.
При ЕФД кожному шлуночковому потенціалу передує потенціал пучка Гіса. Вважається, що електрофізіологічним механізмом такої аритмії є або порушення автоматизму, або тригерна активність, зумовлені β-адренергічною стимуляцією і блокадою кальцієвих каналів.
Вогнищева вузлова тахікардія, відома також як автоматична або пароксизмальна вузлова тахікардія, — дуже рідкісна форма аритмії. Вона рідко розвивається у дітей і ще рідше — у дорослих. Поняття «вогнищева вузлова тахікардія» включає кілька окремих клінічних синдромів. Найпоширеніші серед них — «вроджена вузлова ектопічна тахікардія» і «післяопераційна вузлова ектопічна тахікардія», які розвиваються винятково у дітей і тому не будуть розглядатися в даному посібнику.
Вогнищева вузлова тахікардія, як правило, розвивається в ранньому юнацькому віці. Вважається, що ця форма аритмії — прояв патології, що дебютує в дитячому віці і звичайно називається вродженою вузловою ектопічною тахікардією. Характер цієї аритмії у дорослих більш доброякісний, ніж у дітей. Ця форма аритмії, як правило, провокується фізичним навантаженням або емоційним стресом і може розвиватися в осіб без патології серця і у хворих з вродженими вадами, такими як дефект міжпередсердної або міжшлуночкової перегородки. У випадку, якщо не проводити лікування, може розвинутися СН, особливо якщо тахікардія носить постійний характер.
Є відносно мало інформації щодо реакції вогнищевої вузлової тахікардії на медикаментозну терапію (табл. 5.3). Деякі пацієнти чутливі до блокаторів β-адренорецепторів. Тахікардія може бути сповільнена або купірована внутрішньовенним введенням флекаїніду; деякий позитивний ефект досягається при тривалому прийомі препарату внутрішньо. Медикаментозна терапія не завжди ефективна, для лікування тахікардії показана процедура радіочастотної абляції. Катетерна абляція призводить до деструкції вогнищ, що прилягають до АV-вузла, але пов’язана з ризиком розвитку АV-блокади (у 5–10% випадків).
Таблиця 5.3 Рекомендації щодо лікування при синдромах ектопічної і непароксизмальної вузлової тахікардії
| Тахікардія | Рекомендації | Ефективність |
| Ектопічна вузлова тахікардія | Блокатори β-адренорецепторів
Катетерна абляція |
Ефективно
Ефективно Ефективно Ефективно Ефективно Ефективно |
| Непароксизмальна вузлова тахікардія | Усунення інтоксикації препаратами наперстянки
Корекція гіпокаліємії Лікування ішемії міокарда Блокатори β-адренорецепторів Блокатори кальцієвих каналів |
Високоефективно
Високоефективно Високоефективно Ефективно Ефективно |
Непароксизмальна вузлова тахікардія
Непароксизмальна вузлова тахікардія — доброякісна форма аритмії, що характеризується тахікардією з вузькими комплексами з ЧСС 70–120 уд./хв. Механізми аритмії — підвищення автоматизму з верхніх відділів АV-вузла або тригерний механізм. Тахікардія має період «розігріву» і «охолодження» і не може бути купірована при електричній стимуляції. Характерною рисою цієї форми тахікардії є те, що вона може бути проявом серйозного патологічного стану, такого як дигіталісна інтоксикація, стан після операції на серці, гіпокаліємія або ішемія міокарда. Часто ця тахікардія розвивається при ХОХЛ з гіпоксією та при міокардиті. На відміну від вогнищевої вузлової тахікардії з частішим ритмом при цій формі зазвичай спостерігається АV-асоціація із співвідношенням 1:1. У деяких випадках, особливо при інтоксикації препаратами наперстянки, може з’являтися антероградна АV-блокада з періодами Самойлова — Венкебаха.
Необхідно проводити диференціальну діагностику з іншими видами тахікардії з вузькими комплексами, включаючи передсердну тахікардію, АV-вузлову реципрокну тахікардію, АV-реципрокну тахікардію. Як правило, дані ЕКГ дозволяють клініцистові припустити вірогідний механізм аритмії. Проте у деяких випадках його вдається визначити тільки за допомогою інвазивного ЕФД.
Основний принцип лікування при непароксизмальній вузловій тахікардії — корекція основної патології. Якщо вузлова тахікардія є проявом інтоксикації препаратами наперстянки, то досить відмінити препарати наперстянки. Проте у випадку виникнення шлуночкової аритмії або АV-блокади високого ступеня показано призначення антидота наперстянки. Досить часті випадки, коли автоматизм АV-вузла перевищує автоматизм синусного вузла, призводячи до втрати АV-синхронізації. До цього явища треба ставитися як до фізіологічного стану, ніякої специфічної терапії при цьому не потрібно. Персистувальна вузлова тахікардія може бути купірована застосуванням блокаторів β-адренорецепторів або блокаторів кальцієвих каналів. Рідко виникнення вузлового ритму є результатом дисфункції синусного вузла. Симпатична стимуляція АV-з’єднання може викликати прискорений вузловий ритм, що перевищує за частотою синусовий ритм. У таких випадках симптоми імітують «пейсмейкерний синдром», у зв’язку з ретроградним проведенням з АV-з’єднання на передсердя, що призводить до скорочення передсердь на фоні закритих АV-клапанів. з’являються хвилі А, і можлива гіпотензія. Ефективним лікуванням при такому стані є електрична стимуляція передсердь.
АV-реципрокна тахікардія (додаткові передсердно-шлуночкові з’єднання)
Додатковими передсердно-шлуночковими з’єднаннями є екстранодальні шляхи, які з’єднують міокард передсердя і міокард шлуночка через АV-борозну. Дельта-хвиля на ЕКГ визначається у 0,15–0,20% загальної популяції. Проведення по додатковому передсердно-шлуночковому з’єднанню може бути переривчастим. Додаткові АV-з’єднання можна класифікувати на підставі їх розміщення щодо фіброзних кілець мітрального або трикуспідального клапана, типу провідності (декрементне — наростаюче сповільнення проведення по додатковому шляху у відповідь на підвищення частоти стимуляції або недекрементне — без істотного зменшення величини проведення), а також залежно від того, чи здатні вони на антероградне, ретроградне проведення або їх поєднання. Зазвичай додаткові передсердно-шлуночкові з’єднання мають швидке недекрементне проведення, таке як у нормальної тканини системи Гіса — Пуркіньє та міокарда передсердь або шлуночків. Приблизно 8% додаткових шляхів мають декрементне антероградне або ретроградне проведення. Термін «постійна форма вузлової реципрокної тахікардії» належить до рідкісного клінічного синдрому, що припускає сповільнене приховане проведення, як правило, по задньосептальному (нижньосептальному) додатковому передсердно-шлуночковому з’єднанню. Цей синдром характеризується постійною надшлуночковою тахікардією, зазвичай з негативними зубцями Р1 у відведеннях II, III aVF, подовженим інтервалом R–P′ (R–P′ > P–R).
Додаткові шляхи, здатні тільки на ретроградне проведення, вважаються «прихованими», а ті додаткові передсердно-шлуночкові з’єднання, які здатні на антероградне проведення, — «маніфестуючими», з виникненням передзбудження шлуночків на ЕКГ у стандартних відведеннях. Ступінь передзбудження визначається співвідношенням проведення на шлуночки через АV-вузол і систему Гіса — Пуркіньє. У деяких пацієнтів антероградне проведення виявляється тільки при передсердній стимуляції з ділянок, близьких до додаткового передсердно-шлуночкового з’єднання, наприклад при лівих латеральних додаткових передсердно-шлуночкових з’єднаннях. «Маніфестуючі» додаткові передсердно-шлуночкові з’єднання зазвичай можуть проводити імпульси в обох напрямках — антероградному і ретроградному. Додаткові шляхи тільки з антероградною провідністю виявляють рідко, а з ретроградною — навпаки, часто.
Діагноз «WPW-синдром» діагностують у пацієнтів при наявності поєднання синдрому передзбудження шлуночків з тахіаритмією. Серед пацієнтів із WPW-синдромом найпоширеніша аритмія — АV-реципрокна тахікардія, що складає 95% реципрокних тахікардій за участю додаткового передсердно-шлуночкового з’єднання.
АV-тахікардія за механізмом re-entry поділяється на ортодромну і антидромну АV-реципрокну тахікардію. Під час ортодромної АV-реципрокної тахікардії імпульси проводяться антероградно по АV-вузлу і спеціалізованій провідній системі з передсердя в шлуночки, а ретроградно — з шлуночків на передсердя по додатковому передсердно-шлуночковому з’єднанню. Під час антидромної АV-реципрокної тахікардії імпульси йдуть у зворотному напрямку з антероградним проведенням з передсердь у шлуночки через додаткове передсердно-шлуночкове з’єднання та ретроградним проведенням через АV-вузол або друге додаткове передсердно-шлуночкове з’єднання. Антидромну АV-реципрокну тахікардію виявляють лише у 5–10% пацієнтів з WPW-синдромом. Тахікардії з передзбудженням шлуночків можуть виникати і у осіб з передсердною тахікардією, тріпотінням передсердь, фібриляцією передсердь або АV-вузловою реципрокною тахікардією, при цьому додатковий шлях виступає в якості «свідка» (тобто не є критичною частиною кола тахікардії).
Фібриляція передсердь є життєвонебезпечною для пацієнтів із WPW-синдромом. Якщо додатковий шлях має короткий антероградний рефрактерний період, то проведення імпульсів на шлуночки з високою частотою під час фібриляції передсердь може призвести до фібриляції шлуночків. Приблизно у 1/3 пацієнтів з WPW-синдромом відзначають фібриляцію передсердь. Додаткові передсердно-шлуночкові з’єднання відіграють патофізіологічну роль у розвитку фібриляції передсердь у цієї категорії хворих; більшість із них особи молодого віку без структурної патології серця. АV-реципрокна тахікардія з високою частотою ритму може відігравати певну роль в індукції фібриляції передсердь. Хірургічні методи лікування та катетерна абляція додаткових шляхів здатні усунути фібриляцію передсердь так само, як і АV-реципрокну тахікардію.
Частота випадків раптової смерті серед пацієнтів із WPW-синдромом коливається в межах 0,15–0,39% протягом періоду динамічного спостереження від 3 до 10 років. Зупинка серця рідко є першим симптоматичним проявом WPW-синдрому. На противагу майже в половині випадків зупинка серця у пацієнтів із WPW-синдромом є першим проявом АV-реципрокної тахікардії. З метою попередження розвитку фібриляції передсердь у пацієнтів з WPW-синдромом і ризику раптової смерті в результаті фібриляції передсердь має значення проведення катетерної абляції.
У дослідженнях пацієнтів з WPW-синдромом, що перенесли зупинку серця, ретроспективно визначили ряд критеріїв, за допомогою яких можна виявити пацієнтів із підвищеним ризиком раптової смерті. До них належать:
1) укорочений R–R <250 мс при передзбудженні шлуночків під час спонтанної або індукованої фібриляції передсердь;
2) симптоматична тахікардія в анамнезі;
3) множинні додаткові шляхи;
4) аномалія Ебштейна.
Повідомлялося про високу частоту випадків раптової смерті при сімейному WPW-синдромі, хоча сімейні форми WPW-синдрому виявляють дуже рідко. Пропонувався ряд неінвазивних та інвазивних досліджень, що допомагають стратифікувати ризик раптової смерті. Виявлення інтермітуючого синдрому передзбудження шлуночків, що характеризується раптовим зникненням дельта-хвилі і нормалізацією комплексу QRS, свідчить про те, що додатковий шлях має відносно довгий рефрактерний період і виникнення фібриляції шлуночків малоймовірно. Зникнення передзбудження після введення антиаритмічного препарату прокаїнаміду також використовували для того, щоб визначити підгрупу низького ризику. Вважається, що неінвазивні методи дослідження поступаються інвазивній електрофізіологічній оцінці ризику раптової смерті. Тому на сьогодні неінвазивні методи не мають великого значення при дослідженні пацієнтів.
Медикаментозна антиаритмічна терапія може використовуватись при лікуванні аритмій за участю додаткового передсердно-шлуночкового з’єднання, проте катетерна абляція стала методом вибору при лікуванні цих аритмій. До антиаритмічних препаратів, що безпосередньо модифікують проведення по АV-вузлу, належать дигоксин, верапаміл, блокатори β-адренорецепторів, аденозинфосфат і дилтіазем. Протиаритмічні препарати, що пригнічують проведення через додатковий шлях, включають препарати I класу, такі як прокаїнамід, дизопірамід, пропафенон і флекаїнід, а також препарати III класу — ібутилід, соталол і аміодарон (табл. 5.4).
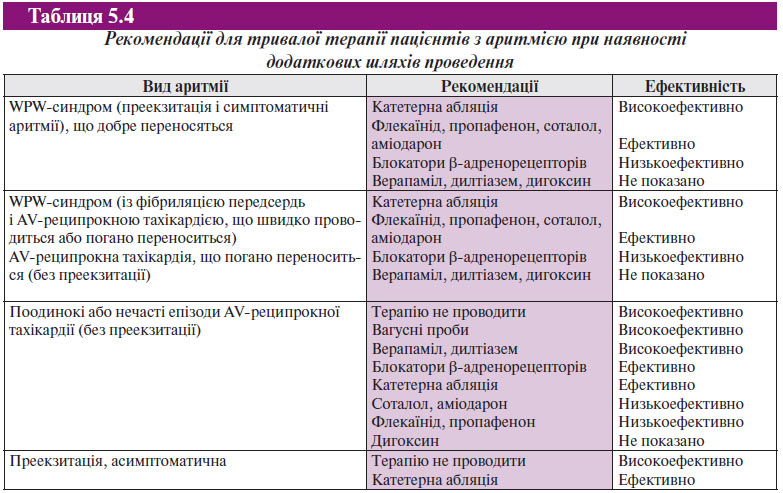
Великі рандомізовані дослідження з медикаментозної профілактики у пацієнтів з АV-реципрокною тахікардією не проводили, проте є дані ряду невеликих нерандомізованих досліджень (у кожне з яких ввійшло <50 пацієнтів), що показують безпеку та ефективність медикаментозної терапії з підтримки синусового ритму у пацієнтів з непароксизмальними шлуночковими тахікардіями. У цих дослідженнях в одну з підгруп увійшли пацієнти з АV-реципрокною тахікардією. Отримані дані не дозволяють провести порівняння ефективності цих препаратів між собою. Препарати, що застосовуються для лікування АV-реципрокної тахікардії, включають будь-які лікарські засоби, які або змінюють проведення через АV-вузол (блокатори кальцієвих каналів, блокатори β-адренорецепторів, дигоксин), або проведення по передсердях, шлуночках або додатковому передсердно-шлуночковому з’єднанню (протиаритмічні препарати класів IА, IС або III) (табл. 5.5). Важливо, що в жодному з досліджень не вивчали ефективність постійного перорального застосування блокаторів β-адренорецепторів при лікуванні АV-реципрокної тахікардії та/або WPW-синдрому. Відсутність досліджень, що спеціально вивчають роль блокаторів β-адренорецепторів у профілактиці пароксизмів тахікардії при WPW-синдромі, пов’язана з тим, що для таких пацієнтів методом вибору є катетерна абляція. Незважаючи на відсутність даних клінічних досліджень, можна стверджувати, що постійну пероральну терапію блокаторами β-адренорецепторів можна використовувати при лікуванні хворих з WPW-синдромом, особливо якщо в результаті ЕФД виявлена нездатність додаткового шляху до швидкого проведення в антероградному напрямку.
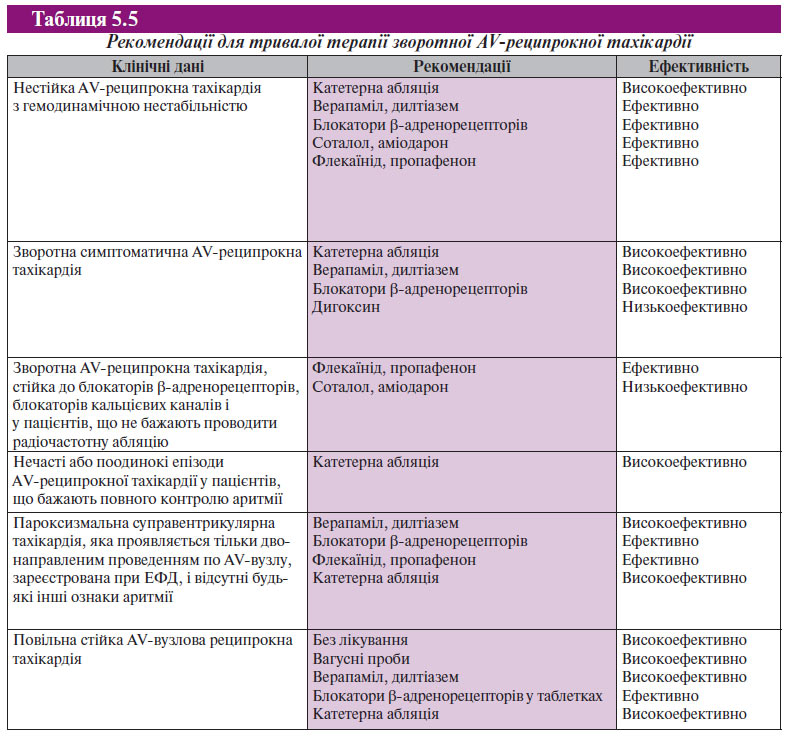
ЕКТОПІЧНА (ВОГНИЩЕВА) ПЕРЕДСЕРДНА ТАХІКАРДІЯ
Вогнища передсердної тахікардії локалізуються в передсердях і характеризуються ритмічністю поширення імпульсів у відцентровому напрямку. Вогнищева передсердна тахікардія, як правило, виникає з частотою 100–250 уд./хв, рідко — до 300 уд./хв. Ні синусовий, ні AV-вузол не приймають участі в ініціації та підтримці тахікардії.
Нестійка передсердна тахікардія часто реєструється під час холтерівського моніторування ЕКГ і рідко проявляється клінічною симптоматикою. Стійкі вогнища передсердної тахікардії відносно нечасті; вони діагностуються приблизно у 10–15% пацієнтів з непароксизмальною шлуночковою тахікардією під час ендоскопічної ЕФД і радіочастотної абляції. Поширеність вогнищевої передсердної тахікардії невелика; вона визначається у 0,34% пацієнтів без симптомів і у 0,46% пацієнтів із симптомами.
У пацієнтів з вогнищевою передсердною тахікардією зазвичай сприятливий прогноз, крім постійно рецидивуючих форм, які можуть призвести до аритмогенної кардіоміопатії. Вогнищева передсердна тахікардія може виникнути як у пацієнтів з гострим ІМ, так і у пацієнтів з органічним ураженням серця. Передсердна тахікардія, часто в поєднанні з АV-блокадою, може бути викликана передозуванням серцевих глікозидів. Гіпокаліємія зумовлює розвиток аритмії. Вогнищеві передсердні тахікардії можуть носити або пароксизмальний, або постійний характер.
При передсердній тахікардії зубці Р зазвичай з’являються в другій половині циклу тахікардії. Тому зубці Р часто приховані всередині хвилі Т попереднього комплексу QRS. Тривалість інтервалу P–R залежить від частоти тахікардії. Поява АV-блокади під час тахікардії виключає АV-реципрокну тахікардію і робить малоймовірним діагноз «АV-вузлова реципрокна тахікардія». Під час передсердної тахікардії ізоелектрична лінія чітко визначається між зубцями Р, що допомагає диференціювати передсердну тахікардію від типового або атипового тріпотіння передсердь. Проте, якщо передсердна тахікардія має високу частоту та/або при наявності порушення внутрішньопередсердної провідності, зубці Р можуть бути дуже широкими, що призводить до зникнення ізоелектричної лінії імітації тріпотіння передсердь. Слід підкреслити, що модель ЕКГ при передсердній тахікардії з дискретними зубцями Р і чіткою ізоелектричною лінією не дозволяє виключити тахікардію за механізмом macro-re-entry, особливо у пацієнтів з поєднаною структурною патологією серця та/або після хірургічної корекції вродженої вади серця. Точний діагноз «передсердна тахікардія» може бути встановлений тільки в процесі ендокавітарного ЕФД, що включає картування тахікардії і входження в цикл тахікардії (entrainment).
Точна локалізація фокуса передсердної тахікардії визначається при інтракардіальному картуванні. Проте поверхнева ЕКГ у 12 стандартних відведеннях дозволяє за морфологією відрізнити зубці Р синусового походження від зубців Р фокусного походження, що також дає можливість локалізувати вогнище передсердної тахікардії. При негативних зубцях Р у відведеннях I або aVL або позитивних зубцях Р у відведенні V1 вогнище розміщується в лівому передсерді. Крім того, негативні зубці Р у нижніх відведеннях припускають нижньопередсердне походження фокуса, у той час як позитивні зубці Р у цих відведеннях — його верхньопередсердну локалізацію. Відзначимо, що зубці Р під час синусового ритму можуть бути схожі за конфігурацією на зубці Р, що виходять з верхньої частини crista terminalis або правої верхньої легеневої вени. В останньому випадку зубці Р найчастіше позитивні у відведенні V1, що дозволяє припустити локалізацію вогнища передсердної тахікардії у правій верхній легеневій вені. Отже, визначення полярності зубця Р у різних відведеннях дає можливість припустити локалізацію вогнища передсердної тахікардії. Поверхневе ЕКГ-картування також може допомогти локалізувати вогнище тахікардії.
Вогнища передсердної тахікардії виникають у певних анатомічних зонах. Більшість правобічних передсердних тахікардій локалізуються в області crista terminalis, між синоатріальним і АV-вузлами. У лівому передсерді вогнища часто виявляють у легеневих венах, передсердній перегородці або фіброзному кільці мітрального клапана; у багатьох випадках вони є пусковим чинником фібриляції передсердь.
Вогнищеві передсердні тахікардії характеризуються радіальним поширенням збудження з вогнища, при цьому активація ендокарда завершується раніше передсердного циклу. Рутинними клінічними методами встановити механізм вогнищевих передсердних тахікардій важко. Ймовірними механізмами цієї аритмії є аномальний або підвищений автоматизм, тригерна активність або micro-re-entry. При передсердній тахікардії, в основі якої лежить механізм підвищеного автоматизму, відзначається поступове наростання частоти передсердного ритму спочатку тахікардії (період «розігріву»), перед закінченням пароксизму передсердної тахікардії спостерігається поступове зниження частоти інтервалів Р–Р (період «охолодження»). Автоматичні передсердні тахікардії носять, як правило, безперервно рецидивуючий характер, особливо у дітей, у той час як тригерні передсердні тахікардії можуть мати як безперервно рецидивуючий, так і пароксизмальний характер.
Дигоксин найбільш часто викликає індукцію вогнищевої передсердної тахікардії, при цьому відзначається розвиток АV-блокади. Тому частота шлуночкових скорочень не буває високою. Визначення концентрації дигоксину в сироватці крові допомагає встановити діагноз. Лікування полягає у відміні препаратів наперстянки. У випадку персистувальної АV-блокади може знадобитися призначення специфічного антидота.
Ефективність протиаритмічних препаратів невисока, оскільки вогнищеву передсердну тахікардію діагностують рідко. Нами не виявлено жодного великого дослідження з визначення ефективності фармакологічної терапії у пацієнтів з вогнищевими передсердними тахікардіями, проте слід зазначити, що як пароксизмальні, так і безперервно рецидивуючі передсердні тахікардії важко піддаються медикаментозній корекції.
Рідко передсердні тахікардії можна купірувати вагусними прийомами. Значна частина передсердних тахікардій купірується аденозинфосфатом, при цьому часто після введення аденозинфосфату відзначається її трансформація в передсердну тахікардію з АV-блокадою. Аденозинчутливі передсердні тахікардії, як правило, мають фокусне походження. Повідомлялося, що передсердні тахікардії можуть бути чутливі до верапамілу або блокаторів β-адренорецепторів при їх внутрішньовенному введенні. Очевидно, що механізм передсердної тахікардії у таких пацієнтів пов’язаний або з micro-re-entrу, або з тригерною активністю. Антиаритмічні препарати класу IА або IС, що пригнічують автоматизм або збільшують тривалість ПД, можуть бути ефективними у деяких пацієнтів з передсердною тахікардією.
Передсердна стимуляція (або введення аденозинфосфату) може призвести до транзиторного постстимуляційного сповільнення частоти передсердної тахікардії, в основі якої лежить аномальний автоматизм, але не до повного її купірування. Це стосується електричної кардіоверсії, яка теж рідко купірує автоматичну передсердну тахікардію. Але у пацієнтів з передсердною тахікардією за механізмом micro-re-entrу або тригерною активністю — кардіоверсія ефективна. Електрична кардіоверсія може бути почата у пацієнтів з аритмією, резистентною до лікарських препаратів.
Як правило, екстрена терапія передсердної тахікардії включає парентеральне введення блокаторів β-адренорецепторів або блокаторів кальцієвих каналів, які хоч і рідко купірують її, але знижують ЧСС унаслідок розвитку АV-блокади. Безпосереднього пригнічення вогнища тахікардії можна досягти шляхом внутрішньовенного введення препаратів класу IА та IС або III (соталол, аміодарон). Протипоказанням для призначення антиаритмічних препаратів класів IА або IС є СН, при якій перевага надається застосуванню аміодарону.
Існує складність точного диференціювання вогнищевої передсердної тахікардії від тахікардії, що розвивається за іншими механізмами (АV-реципрокна тахікардія або АV-вузлова реципрокна тахікардія) або від інших форм передсердної тахікардії. Огляд наявних даних підтримує рекомендації про те, що терапію слід починати із застосування блокаторів кальцієвих каналів або блокаторів β-адренорецепторів, оскільки ці препарати можуть виявитися ефективними і мають мінімальні побічні дії. При їх неефективності слід застосовувати препарати класу IА та IС (флекаїнід, пропафенон) поєднано з блокаторами кальцієвих каналів або блокаторами β-адренорецепторів або препарати класу III (соталол і аміодарон). При призначенні цих препаратів слід пам’ятати про потенційний ризик їх проаритмогенної дії та побічних ефектів. Оскільки передсердні тахікардії найчастіше виявляють у осіб похилого віку зі структурною патологією серця, препарати класу IС слід призначати тільки після виключення ІХС.
Політопна (поліморфна) передсердна тахікардія
Діагноз «політопна передсердна тахікардія» встановлюють, якщо на ЕКГ при аритмічній тахікардії реєструють зубці Р трьох (і більше) видів морфології при різних інтервалах зчеплення. Ритм серцевих скорочень завжди неправильний, проте частота тахікардії не занадто висока. Цей вид порушень ритму найчастіше визначається при хронічних захворюваннях легень, але може бути пов’язаний також з метаболічними або електролітними порушеннями. Передозування серцевих глікозидів рідко призводить до розвитку політопної передсердної тахікардії. Антиаритмічна терапія малоефективна; описана незначна ефективність блокаторів кальцієвих каналів, блокатори β-адренорецепторів зазвичай протипоказані внаслідок наявності у пацієнта тяжкого легеневого захворювання. Метою терапії є компенсація патології легень або корекція електролітних порушень. Блокатори кальцієвих каналів часто призначають як постійну терапію, оскільки електрична кардіоверсія, протиаритмічні препарати і катетерна абляція неефективні.
Тріпотіння передсердь
Тріпотіння передсердь характеризується регулярним ритмом із частотою скорочень передсердь 250–350 уд./хв. За даними ЕФД по поверхневій ЕКГ можна припустити різні кола re-entry. Часто кола re-entry займають значні області міокарда передсердь і тому називаються macro-re-entry. Класичний тип тріпотіння передсердь (тобто типове тріпотіння) залежить від області кавотрикуспідального перешийка, розміщеного між нижньою порожнистою веною і кільцем трикуспідального клапана. Залежність типу тріпотіння від конкретного перешийка — важливі дані для катетерної абляції, проте вона не змінює підходів до медикаментозної терапії.
Ознаки істмусзалежного тріпотіння
Основою патофізіології істмусзалежного тріпотіння є циркуляція збудження навколо тристулкового кільця. Сrista terminalis і венозний синус, тобто область між верхньою і нижньою порожнистою веною, очевидно, є функціональним бар’єром для формування кола re-entry. При типовому тріпотінні передсердь порушення циркулює навколо істмус-зони проти годинникової стрілки, рідше відзначають тріпотіння, при яких рух збудження відбувається за годинниковою стрілкою. Тріпотіння передсердь із re-entry проти годинникової стрілки на ЕКГ характеризується негативними хвилями f у нижніх відведеннях, позитивними хвилями f у V1 і негативним у V6 при частоті 250–350 уд./хв. При тріпотінні передсердь за годинниковою стрілкою спостерігається протилежна ЕКГ-картина. Періодично картина ЕКГ може бути нетиповою, тому наявність істмусзалежного тріпотіння може бути встановлено тільки за допомогою інвазивного ЕФД.
Істмусзалежне тріпотіння може розвиватися за так званим механізмом двохвильового та нижньопетльового re-entry. Двохвильове re-entry являє собою коло, по якому одночасно рухаються два фронти збудження. Така аритмія носить тимчасовий характер і зазвичай припиняється в межах 3–6 комплексів, рідко переходить у фібриляцію передсердь. При нижньопетльовому re-entry циркуляція фронту хвилі відбувається навколо нижньої порожнистої вени внаслідок можливості проведення імпульсів через crista terminalis. Петля re-entry, що утворюється в результаті, може дати незвичайну ЕКГ-картину; але оскільки в одному з колін фронт re-entry проходить через кавотрикуспідальний перешийок, доцільно виконання абляції нижнього перешийка.
Клініка
Пацієнти з тріпотінням передсердь скаржаться на задишку, швидку стомлюваність, біль у грудях. У той же час ця аритмія може характеризуватися більш серйозними симптомами, наприклад різкою слабкістю, відчуттям зупинки серця або набряком легень. Тріпотіння передсердь буває у 25–30% пацієнтів із фібриляцією передсердь і може бути пов’язане з більш вираженими симптомами, внаслідок більш частих шлуночкових скорочень. У більшості випадків тріпотіння передсердь характеризується AV-провідністю 2:1. Частота скорочень передсердь — приблизно 300 уд./хв, шлуночків — 150 уд./хв (тріпотіння з неправильною AV-провідністю може проявлятися надзвичайно нерегулярним ритмом). Рідко при навантаженнях може реєструватися AV-провідність 1:1, що може призводити до загрозливого для життя стану. Антиаритмічні препарати класу IС можуть сповільнювати передсердну частоту, але не сприяти покращанню AV-провідності. Тому антиаритмічні препарати класу IС слід застосовувати поєднано з препаратами, що сповільнюють АV-провідність. Пацієнти з додатковими AV-провідними шляхами схильні до AV-провідності 1:1, що є небезпечним для життя. Пацієнти з СН, при якій скоординоване передсердне скорочення є гемодинамічно значимим, можуть відчувати погіршення навіть при невисокій частоті шлуночкових скорочень.
Тріпотіння передсердь із неконтрольованою частотою шлуночкових скорочень може самостійно поглиблювати кардіоміопатію. Порушення гемодинаміки через тріпотіння передсердь часто є пізнім ускладненням оперативного лікування за методикою Senning і Fontan вродженої вади серця. У таких пацієнтів тріпотіння є маркером поганого прогнозу.
Лікування
Клас IА антиаритмічних препаратів показаний із метою зниження швидкості проведення в ланцюзі re-entry, а в цілому ці засоби мають властивості скорочувати період збудливості; клас IС знижує проведення та сповільнює тріпотіння. І, навпаки, III клас антиаритмічних препаратів (аміодарон) збільшує період рефрактерності і може купірувати тріпотіння, оскільки фронт імпульсу натрапляє на рефрактерну тканину. Часта передсердна стимуляція може купірувати тріпотіння при утворенні функціонального блоку в ортодромному або антидромному плечі кола re-entry. Крім того, ефективність стимуляції може бути підвищена антиаритмічною терапією, що полегшує утворення зони абсолютної рефрактерності. Електрична кардіоверсія дуже ефективна через моментальну гомогенну деполяризацію венозного синуса. Практичні значення цих ефектів висвітлюються у відповідних розділах терапії.
Невідкладна терапія при тріпотінні передсердь
Невідкладна терапія для пацієнтів з тріпотінням передсердь залежить від клінічного стану. Якщо у хворого гемодинамічний колапс або застійна СН, то показана синхронізована електрична кардіоверсія (схема 5.3). Успішне відновлення синусового ритму можливе розрядом <50 Дж при використанні однофазних розрядів і навіть меншою енергією при використанні двофазних розрядів. У більшості випадків пацієнти з тріпотінням 2:1 або з більш сильною AV-блокадою гемодинамічно стабільні. Тому лікар може застосовувати препарати, що сповільнюють AV-провідність для контролю частоти ритму. Адекватного контролю частоти особливо важливо досягти, якщо відновлення синусового ритму відкладається, наприклад, для проведення антикоагулянтної терапії. Черезстравохідна або передсердна стимуляція є методом вибору для відновлення синусового ритму, оскільки медикаментозна кардіоверсія низькоефективна при тріпотінні передсердь. Незалежно від методу відновлення після 48 год тріпотіння передсердь необхідне застосування антикоагулянтів. Якщо запланована гостра фармакологічна кардіоверсія, то контроль частоти скорочення шлуночків необхідний. Антиаритмічні препарати класу IС можуть сповільнити частоту передсердних скорочень і покращити AV-провідність, що призведе до парадоксального збільшення шлуночкових скорочень. У 60% пацієнтів тріпотіння передсердь відбувається як ускладнення основного захворювання, при гострих захворюваннях легень, у післяопераційний період після хірургічних втручань на легенях і серці, на фоні ІМ. Якщо тріпотіння передсердь є ускладненням основного захворювання, то в більшості випадків після відновлення ритму немає необхідності в проведенні підтримувальної терапії. У випадках невідкладної терапії тріпотіння передсердь методом вибору є стимуляція передсердь, електрична або фармакологічна кардіоверсія і препарати, що сповільнюють АV-провідність.
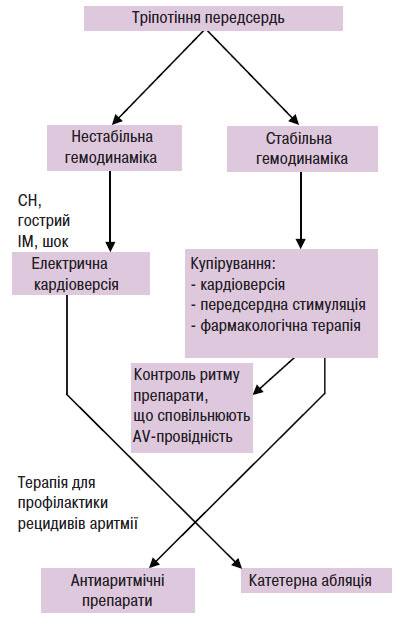
Схема 5.3. Лікування тріпотіння передсердь залежно від стабільності гемодинаміки
Проведені дослідження по застосуванню препаратів, що сповільнюють АV-провідність, включають пацієнтів і з тріпотінням передсердь, і з фібриляцією передсердь. Із них неможливо виділити дані тільки для тріпотіння передсердь, але, на думку більшості авторів, контроль ЧСС складніше здійснювати при тріпотінні передсердь. У двох рандомізованих плацебо-контрольованих подвійних сліпих дослідженнях оцінювали застосування дилтіазему у хворих з тріпотінням і фібриляцією передсердь. Обидва дослідження показали зниження частоти скорочення шлуночків, але дилтіазем показав більш високу ефективність у пацієнтів з фібриляцією передсердь. Артеріальна гіпотензія була основним побічним ефектом, що виявляється у 10% хворих. У проспективному відкритому рандомізованому клінічному дослідженні порівнювали дилтіазем і дигоксин за ефективністю контролю ЧСС. Контроль ЧСС був досягнутий протягом 30 хв у результаті застосування дилтізему і більше ніж через 4 год при застосуванні дигоксину.
У великому дослідженні з порівняння дії дигоксину з аміодароном встановлена перевага внутрішньовенного введення аміодарону при застосуванні його для контролю частоти ритму. Внутрішньовенне введення аміодарону виявилося менш ефективним, ніж застосування антагоністів кальцію або блокаторів β-адренорецепторів, оскільки адекватний контроль ЧСС не був досягнутий протягом 6 год. Проте застосування блокаторів β-адренорецепторів, аміодарону і антагоністів кальцію рідко зумовлювало відновлення ритму.
Нефармакологічна невідкладна терапія
Ефективність електричної кардіоверсії становить 95–100%. Відновлення ритму може бути досягнуто розрядом від 5 до 50 Дж, особливо при використанні двофазних хвиль. У хворих з нестабільною гемодинамікою рекомендуються вищі розряди. Електроімпульсна терапія рекомендована для швидкого відновлення синусового ритму.
Використання та ефективність передсердної або трансезофагеальної понадчастої стимуляції для купірування тріпотіння передсердь давно доведені, її ефективність становить в середньому 82%. Передсердна стимуляція більш ефективна у випадку тріпотіння передсердь після операції на серці, оскільки ці пацієнти найчастіше мають епікардіальні провідники для стимуляції. Крім того, доведено, що прокаїнамід, ібутилід, пропафенон підвищують ефективність електрокардіостимуляції. Ще ефективніша стимуляція екстрастимулами. Ця стимуляція використовується в сучасних штучних водіях ритму. Стимуляція може закінчуватися фібриляцією передсердь, що передує відновленню синусового ритму.
Роль антикоагулянтної терапії для пацієнтів із тріпотінням передсердь
Роль антикоагулянтної терапії для пацієнтів із фібриляцією передсердь доведена в багатьох рандомізованих дослідженнях, але такі дослідження не проводилися для хворих з тріпотінням передсердь. Ґрунтуючись на даних спостережень, первинно вважали, що ризик розвитку емболії при тріпотінні передсердь невисокий. Результати досліджень свідчать, що ризик виникнення емболії при тріпотінні передсердь значний (у межах 1,7–7%). Крім того, у багатьох дослідженнях доведено, що частота внутрішньосерцевого тромбу варіює від 0 до 34% у пацієнтів без застосування антикоагулянтної терапії при тріпотінні передсердь тривалістю >48 год. Іншою причиною для занепокоєння є утворення тромбів у порожнині серця після кардіоверсії, ризик якого зберігається протягом декількох тижнів. За результатами проведених декількох досліджень тріпотіння передсердь коефіцієнти ризику розвитку емболії подібні таким при фібриляції передсердь. Узагалі ризик виникнення емболії у хворих з тріпотінням передсердь під час кардіоверсії становить 2,2%, що значно нижче, ніж при фібриляції передсердь (5–7%). Рандомізовані дослідження з тріпотіння передсердь не проводилися. На нашу думку, ведення хворих з тріпотінням передсердь повинно бути подібне веденню пацієнтів з фібриляцією передсердь.
Катетерна абляція при істмусзалежному тріпотінні передсердь
Ефективність застосування катетерної абляції при істмусзалежному тріпотінні передсердь становить 90–100%. Рецидив фібриляції передсердь після катетерної абляції залежить від наявності фібриляції передсердь перед абляцією. Після катетерної абляції фібриляція передсердь виникає у 8% пацієнтів, у яких перед абляцією було тільки тріпотіння передсердь. Навпаки, у тих хворих, у яких до абляції тріпотіння передсердь домінувало над їх фібриляцією, рецидив фібриляції передсердь після абляції становив до 38%. Якщо до катетерної абляції фібриляція передсердь переважала, то протягом 14–20 міс після її проведення фібриляція передсердь рецидивувала у 86%. Отже, слід вважати більш ефективною катетерну абляцію для пацієнтів, у яких було тільки тріпотіння передсердь, або воно домінувало над фібриляцією передсердь.
Фібриляція передсердь є найбільш частим порушенням ритму після операцій на серці й легенях. Частота розвитку фібриляції передсердь після операції на серці становить 20–50% залежно від виду операції, найвища вона при операціях на легеневому стовбурі і трикуспідальному клапані.
Істмуснезалежне тріпотіння передсердь найчастіше пов’язане з післяопераційним рубцем на стінках передсердь, що створює умови для циркуляції збудження. Зазвичай такому порушенню ритму передує операція на серці, що відновлює порожнину, за типом протезування мітрального клапана при вродженій його ваді або процедура проведення операції за типом лабіринт на передсердях. Ці аритмії припиняються при руйнуванні кола macro-re-entry. Тріпотіння передсердь після операцій на серці може супроводжуватися наявністю кількох кругів re-entry, для виявлення яких необхідне проведення ЕФД. Абляція істмуснезалежного тріпотіння більш складна, ніж при істмусзалежному тріпотінні. У табл. 5.6 і 5.7 викладено рекомендації щодо купірування тріпотіння передсердь.

ТАХІКАРДІЯ З ШИРОКИМИ КОМПЛЕКСАМИ QRS
За широкими комплексами QRS (>120 мс) важливо диференціювати надшлуночкові тахікардії від шлуночкової тахікардії (схема 5.4). При лікуванні пацієнтів із надшлуночковими тахікардіями препарати, що призначаються парентерально, особливо верапаміл або дилтіазем, є потенційно небезпечними, оскільки можуть зумовити розвиток колапсу у хворих зі шлуночковими тахікардіями. Стійкі симптоми тахікардії не дозволяють відрізнити надшлуночкову тахікардію від шлуночкової. Якщо діагноз «надшлуночкова тахікардія» неможливо підтвердити або заперечити, то тахіаритмію слід розцінювати як шлуночкову тахікардію і лікувати відповідно.
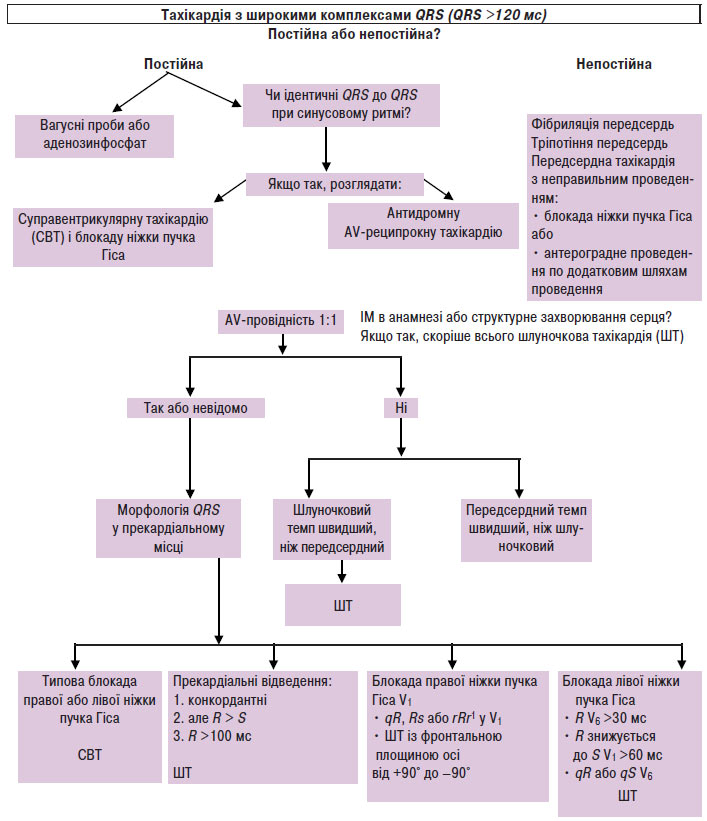
Схема 5.4. Диференціація надшлуночкової тахікардії і шлуночкової тахікардії
Тахікардія з широкими комплексами QRS може бути поділена на 3 групи:
- надшлуночкова тахікардія з блокадою ніжок пучка Гіса;
- надшлуночкова тахікардія з проведенням по додатковому передсердно-шлуночковому з’єднанню;
- шлуночкова тахікардія.
Надшлуночкова тахікардія з блокадою ніжок пучка Гіса
Блокада ніжок пучка Гіса може визначатися первинно або виникати тільки під час тахікардії, коли одна з гілок пучка Гіса перебуває в рефрактерному періоді в зв’язку з частим ритмом. Виникнення більшості блокад ніжок пучка Гіса залежить не тільки від частоти ритму, але також від послідовності інтервалів R–R — «довгий–короткий». Блокада ніжок пучка Гіса може виникнути при будь-якій надшлуночковій тахікардії. Якщо під час ортодромної АV-реципрокної тахікардії розвивається блокада ніжок пучка Гіса, то частота тахікардії може знизитися у випадку, якщо блокована ніжка пучка Гіса розміщена на тому ж боці (іпсилатеральна блокада), що й додаткове передсердно-шлуночкове з’єднання.
Надшлуночкова тахікардія з проведенням по додатковому передсердно-шлуночковому з’єднанню
Надшлуночкова тахікардія за участю додаткового передсердно-шлуночкового з’єднання може виникнути під час передсердної тахікардії, тріпотіння передсердь, фібриляції передсердь, АV-вузлової реципрокної тахікардії або антидромної АV-реципрокної тахікардії. Остання виникає при антероградному проведенні по додатковому передсердно-шлуночковому з’єднанню і ретроградному проведенню по АV-вузлу або другому додатковому передсердно-шлуночковому з’єднанню. Широкий комплекс QRS з морфологією блокади лівої ніжки пучка Гіса можливий при антероградному проведенні по інших видах додаткових шляхів, таких як атріофасцикулярний, нодофасцикулярний або нодовентрикулярний.
Шлуночкова тахікардія
Існують деякі ЕКГ-критерії, що дозволяють диференціювати основний механізм тахікардії з широким комплексом QRS (див. схему 5.4).
Тахікардії з широкими комплексами QRS >120 мс у дорослих можуть бути зумовлені надшлуночковими аритміями з постійним або частотнозалежним аберантним внутрішньошлуночковим проведенням, надшлуночковими аритміями з антероградним передзбудженням, а також шлуночковими аритміями. Незважаючи на запропоновані багатьма авторами ЕКГ-критерії для диференціації надшлуночкової тахікардії з аберантним проведенням і шлуночкової тахікардії, ці розходження можуть викликати труднощі, навіть якщо для аналізу доступні повні записи ЕКГ. Аритмії з антероградним передзбудженням можуть викликати особливі труднощі при диференціації зі шлуночковою тахікардією на підставі тільки морфологічних критеріїв комплексів QRS. При деяких аритміях, таких як re-entry, із залученням гілок пучка Гіса, або тахікардії при наявності атріофасцикулярних трактів, конфігурація QRS не відрізняється від більш розповсюджених форм надшлуночкової тахікардії з аберантним проведенням. Нарешті деякі види шлуночкової тахікардії можуть мати комплекси QRS тривалістю 120 мс при аномальній морфології QRS, а у дітей тривалість комплексів QRS при шлуночкових тахікардіях може становити <120 мс. ЕФД дозволяє точно діагностувати практично всі тахікардії з широкими комплексами, а також визначити послідовність і взаємозв’язок між активацією передсердь і шлуночків. При цьому можна зареєструвати електрограми від структур, що не відображаються на стандартній ЕКГ (таких як пучок Гіса або додаткові шляхи проведення), а також можуть бути проаналізовані відповіді на різні проби зі стимуляцією. Оскільки знання механізму аритмії зазвичай має критичне значення для вибору належної терапії, ЕФД часто займають важливе місце в клінічній діагностиці у пацієнтів з тахікардіями з широкими комплексами.
Невідкладна терапія тахікардії із широкими комплексами QRS
Екстрена електроімпульсна терапія показана при гемодинамічно значимих тахікардіях. Якщо тахікардія не призводить до гемодинамічних порушень і є надшлуночковою, то лікування таке ж, як і при тахікардії з вузькими комплексами QRS (схема 5.5). Для купірування тахікардії з широкими QRS-комплексами при відсутності порушень гемодинаміки можна застосовувати прокаїнамід або соталол у парентеральних формах (рекомендації дані на підставі нечисленних рандомізованих досліджень). Також може бути використаний аміодарон, якому надають перевагу порівняно з прокаїнамідом і соталолом при лікуванні пацієнтів зі зниженої ФВ ЛШ або з ознаками СН. В окремих випадках може знадобитися альтернативна терапія (наприклад при тахікардії з передзбудженням шлуночків і шлуночковій тахікардії при дигіталісній інтоксикації). Для купірування тахікардії з широким комплексом QRS (фібриляція передсердь з проведенням по додатковому передсердно-шлуночковому з’єднанню) рекомендується електроімпульсна терапія. Якщо у пацієнта немає гемодинамічних порушень, можна вдатися до фармакологічної кардіоверсії з внутрішньовенним введенням ібутиліду або флекаїніду.
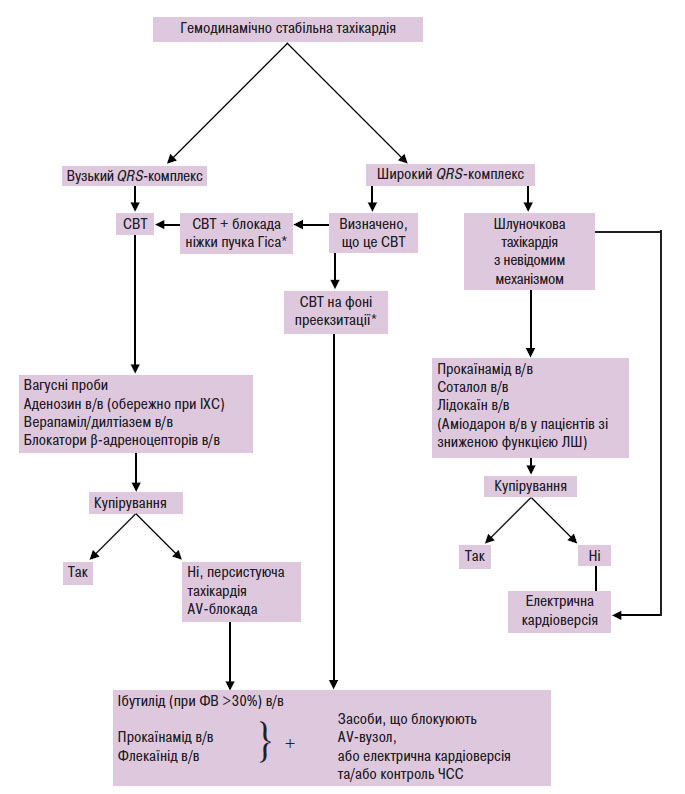
Схема 5.5. Невідкладна допомога пацієнтам з гемодинамічно стабільною тахікардією
*Для діагностики необхідно 12 відведень ЕКГ. СВТ — суправентрикулярна тахікардія; в/в — внутрішньовенно.
Після успішного купірування тахікардії з широкими комплексами QRS невідомої етіології пацієнта необхідно направити до аритмолога. Пацієнтам з гемодинамічно незначимою тахікардією з вузькими комплексами QRS, збереженою функцією ЛШ і нормальною ЕКГ під час синусового ритму (відсутність синдрому передзбудження шлуночків) специфічна терапія може не знадобитися. Консультація лікаря-фахівця показана у пацієнтів із резистентністю до медикаментозної терапії або поганою її переносимістю, а також у осіб, які не бажають постійно приймати антиаритмічні препарати. При необхідності лікування повинен бути зроблений вибір: катетерна абляція або медикаментозна терапія. У зв’язку з ризиком летального результату у всіх хворих з WPW-синдромом (синдром передзбудження шлуночків у поєднанні з аритмією) показано проведення подальшого обстеження.
ДОПОМОГА ПАЦІЄНТАМ З ГЕМОДИНАМІЧНО СТАБІЛЬНОЮ ТАХІКАРДІЄЮ
Суправентрикулярна тахікардія у вагітних
Передсердні екстрасистоли реєструються в період вагітності у 50% пацієнток і досить добре переносяться. Пароксизми суправентрикулярних тахікардій виявляють відносно рідко, реєструються в 3–4 випадках на 10 тис. спостережень. Збільшення випадків пароксизмальної суправентрикулярної тахікардії відбувається у 20% пацієнток у період вагітності.
Основний ризик при лікуванні суправентрикулярної тахікардії у вагітних зумовлений несприятливим впливом антиаритмічних препаратів на плід, оскільки всі антиаритмічні препарати проникають через ГЕБ. Перші 8 тиж вагітності — найбільш тератогенний період. Прийом антиаритмічних препаратів у II і III триместр вагітності можуть викликати порушення росту та розвитку плода, а також проаритмогенний ефект у матері.
До погіршення клініки аритмії у період вагітності призводять наступні фізіологічні зміни:
- підвищується навантаження на серце;
- збільшується ОЦК;
- зменшується кількість білка в сироватці крові;
- змінюється шлункова секреція і моторика кишечнику;
- змінюється активність ферментів печінки;
- змінюється біоеквівалентність антиаритмічних препаратів.
У 1994 р. у США розроблена класифікація US Food and Drug Administration (FDA) антиаритмічних засобів за ступенем ризику їх застосування у вагітних: А — при адекватних добре контрольованих дослідженнях у вагітних ризик для плода не встановлено; В — відомостей про ризик у вагітних немає; С — ризик не визначений (при відсутності відповідних даних у людини, у дослідженнях на тваринах зареєстровано як наявність, так і відсутність негативного впливу на плід); D — наявність достовірного ризику для плода (виявлено ризик при проведенні спеціальних маркетингових досліджень, проте у ряді спостережень позитивний ефект препарату перевищує можливий ризик його застосування); X — призначення препаратів при вагітності протипоказане.
Відповідно до цієї класифікації всі антиаритмічні препарати необхідно розглядати як потенційно небезпечні для плода, застосування яких необхідно уникати в I триместр вагітності. На сьогодні антиаритмічні засоби, що застосовуються при купіруванні суправентрикулярної тахікардії, належать до класу С і тільки соталол — до класу В, а аміодарон і атенолол — до класу D.
Катетерну абляцію необхідно проводити до настання вагітності. Наявний досвід по проведенню катетерної абляції в період вагітності не дає однозначної відповіді, хоча потенційно небезпечна доза опромінення для плода розрахована. Проведення катетерної абляції показане при неефективності антиаритмічної терапії і повинно бути виконане в II триместр вагітності. У зв’язку з потенційною ймовірністю рецидивів аритмії не слід переривати застосування антиаритмічних засобів у період вагітності, крім окремих ситуацій.
Невідкладна терапія при AV-вузловій тахікардії
Терапію по купіруванню АV-вузлової реципрокної тахікардії слід починати з вагусних проб, при їх неефективності препаратом вибору є аденозинфосфат. Його успішно застосовують у вагітних у II і III триместр вагітності. Якщо аденозинфосфат неефективний, слід використовувати блокатори β-адренорецепторів (пропранолол або метопролол). Внутрішньовенне введення верапамілу ризиковане у зв’язку з можливим розвитком гіпотензії у матері з наступною гіпоксією плода. Є повідомлення в літературі про те, що електрична кардіоверсія — найбільш безпечне відновлення ритму в будь-який період вагітності.
Профілактична терапія
При необхідності профілактичної терапії засобами першої лінії є дигоксин, блокатори β-адренорецепторів (пропранолол, метопролол). Великий досвід застосування дигоксину у вагітних вказує на його безпеку протягом вагітності порівняно з іншими антиаритмічними препаратами. Пропранолол і метопролол більш ефективні та безпечні, але їх призначення необхідно уникати в I триместр вагітності. Серед відомих несприятливих впливів блокаторів β-адренорецепторів (а саме брадикардія, гіпоглікемія, передчасні пологи) найчастіше відзначають метаболічні порушення і гіпотрофію плода. Проте результати великих досліджень свідчать, що частота ускладнень при застосуванні блокаторів β-адренорецепторів ідентична плацебо. Пропранолол при застосуванні в I триместр затримує внутрішньоутробний розвиток плода. Кардіоселективні блокатори β-адренорецепторів більш безпечні, оскільки менше впливають на периферичну вазодилатацію й тонус матки й сприяють вищій ефективності і тривалості дії. Якщо блокатори β-адренорецепторів неефективні, слід застосовувати соталол. Його успішно використовують при інших порушеннях ритму (фібриляції передсердь і шлуночкових аритміях) у період вагітності. Досвід його застосування недостатній, тому застосування його повинне бути суворо за показаннями і в мінімально ефективних дозах.
Флекаїнід належить до препаратів, які протипоказані в період вагітності, і застосування його при суправентрикулярних порушеннях ритму недоцільно. Пропафенон протипоказаний до застосування в I триместр вагітності, проте несприятливі ефекти на плід не зареєстровані при застосуванні його в II і III триместр. Хінідин є препаратом, що відносно добре переноситься, але з ним пов’язують ряд несприятливих ефектів: тромбоцитопенію у плода, токсичне ураження VIII пари черепно-мозкових нервів. Прокаїнамід застосовують тільки для надання невідкладної допомоги. Аміодарон належить до класу D і його застосування в період вагітності обмежується аритміями, що не купіруються іншими медикаментозними засобами та становлять загрозу для життя пацієнтки. Можливе застосування його короткими курсами до стабілізації стану пацієнтки. Табл. 5.8 містить рекомендації щодо лікування суправентрикулярної тахікардії у вагітних.
Таблиця 5.8 Рекомендації щодо стратегії лікування суправентрикулярної тахікардії у вагітних
| Стратегія лікування | Рекомендації | Ефективність |
| Невідкладне відновлення пароксизмальної суправентрикулярної тахікардії |
Вагусні проби
Аденозинфосфат Електрична кардіоверсія Метопролол, пропранолол Верапаміл |
Високоефективно
Високоефективно Високоефективно Ефективні Низькоефективно |
| Профілактичне лікування | Дигоксин
Метопролол Пропранолол Соталол, флекаїнід Хінідин, пропафенон Верапаміл Прокаїнамід Катетерна абляція Атенолол Аміодарон |
Високоефективно
Високоефективно Ефективно Ефективно Низькооефективно Низькоефективно Низькоефективно Низькоефективно Не показаний Не показаний |
ТАХІКАРДІЇ У ПАЦІЄНТІВ ІЗ ВРОДЖЕНОЮ ВАДОЮ СЕРЦЯ
З кожним роком все більше пацієнтів із вродженою вадою серця доживають до повноліття. У пацієнтів, яким не проводили оперативне лікування, найбільш частими порушеннями ритму є тріпотіння та фібриляція передсердь. Причиною аритмії може бути підвищення тиску в передсердях. У пацієнтів, яким проведено оперативне лікування, післяопераційний рубець на стінці передсердя може призводити до рубцевозалежного тріпотіння передсердь у пізній післяопераційний період. Поява аритмії може свідчити про погіршення гемодинаміки, така ситуація вимагає ретельного обстеження, а іноді й наступного оперативного лікування. Виникнення суправентрикулярної тахікардії погіршує гемодинаміку. Посилена або спровокована антиаритмічними препаратами, хірургічним лікуванням дисфункція синусного вузла потребує імплантації стимулятора. Вроджені кардіальні вади утруднюють встановлення штучного водія ритму та катетерну абляцію. Дефекти перегородок створюють ризик розвитку системної емболії тромбами, які можуть формуватися при стимуляції, навіть якщо електроди перебувають тільки в правих відділах серця.
Дефект міжпередсердної перегородки
Фібриляція і тріпотіння передсердь відбуваються приблизно у 20% повнолітніх пацієнтів з неоперованим дефектом міжпередсердної перегородки. Фібриляцію передсердь виявляють частіше, ніж тріпотіння передсердь, частота випадків пароксизмів підвищується з віком пацієнтів. Хірургічна або ендокардіальна корекція вади серця при співвідношенні легеневого і системного кровотоку >1,5 у пацієнтів віком молодше 40 років може викликати передсердні порушення ритму, а старше 40 років — неефективна.
Лікування при тріпотінні передсердь проводять відповідно до рекомендацій, викладених у попередніх розділах. У неоперованих пацієнтів тріпотіння, мабуть, є істмусзалежним, а відповідно і чутливим до катетерної абляції. Якщо лікування вади оперативним шляхом не показане у зв’язку зі станом гемодинаміки, то показана абляцію, що напевно припинить тріпотіння передсердь, на відміну від оперативного лікування. У пацієнтів після оперативного лікування може бути як істмусзалежне, так і істмуснезалежне, зумовлене рубцем тріпотіння. Обидві ці форми можуть поєднуватися у одного пацієнта. При цьому лікувальна тактика — як і в попередніх випадках: якщо показана катетерна абляція, то необхідно розглядати можливість того, що тріпотіння може залишитися після абляції. У подібних випадках абляція повинна виконуватися після проведення попереднього тривимірного ЕФД.
Транспозиція магістральних судин
Передсердні тахікардії дуже часто бувають після оперативного лікування з приводу транспозиції магістральних судин. Після оперативної корекції вади за методом Mustard&Senning венозна кров потрапляє в морфологічно ЛШ. Він сполучається з ЛА, по якій кров потрапляє в морфологічний ПШ, що сполучається з аортою. Хірургічне втручання на передсердях значне, тому дуже часто відзначають післяопераційну дисфункцію синусного вузла. Втрата передсердного викиду та підвищення частоти скорочення шлуночків може дестабілізувати гемодинаміку у цих пацієнтів. Розвиток передсердної аритмії завжди супроводжується порушенням ФВ. Подібні аритмії часто рецидивують, і утримувати синусовий ритм не рекомендовано, тому за даними більшості досліджень розвиток передсердних аритмій завжди пов’язаний з ризиком раптової смерті. Порушення ФВ, ризик раптової смерті і дисфункція синусного вузла обмежують вибір антиаритмічного препарату. Катетерна абляція зазвичай ефективна, але виконати її складніше, ніж у пацієнтів без вади серця. Проводити її слід у спеціалізованому центрі.
Тетрада Фалло
Передсердні розрізи, проведені під час оперативного лікування, призводять до виникнення рубцевозалежного тріпотіння передсердь. У більшості пацієнтів на ЕКГ синусовий ритм супроводжується повною блокадою правої ніжки пучка Гіса. Отже, суправентрикулярна тахікардія виникає при сповільненні проведення імпульсу по правій ніжці пучка Гіса. Тріпотіння передсердь погіршує гемодинаміку у деяких пацієнтів. Невідкладну допомогу проводять залежно від стабільності гемодинаміки пацієнта. Правильна діагностика порушення ритму дуже важлива для підбору терапії. Показані ЕФД і консультація аритмолога. Тріпотіння передсердь може бути істмус- і рубцевозалежним. Розвиток тріпотіння передсердь може бути ознакою мітральної і трикуспідальної функціональної регургітації. У такому випадку рекомендоване повторне оперативне лікування. Постійну антиаритмічну терапію проводять так само, як і у вищевикладених випадках.
Аномалія Ебштейна
Наявність додаткових шляхів проведення діагностують у 25% хворих, найчастіше вони розміщуються справа. При цій патології реєструються АV-реципрокна тахікардія, передсердна тахікардія, фібриляція передсердь і ектопічна передсердна тахікардія. Блокада правої ніжки пучка Гіса вказує на наявність додаткового провідного шляху в правих відділах, але також може й маскувати наявність передзбудження на ЕКГ. Ознаки блокади правої ніжки пучка Гіса можуть бути при антидромній тахікардії за участю додаткових шляхів проведення, при шлуночковій тахікардії, АV-реципрокній тахікардії або тріпотінні передсердь. Вада може бути незначною і не проявлятися симптоматикою. Навпаки, регургітація на трикуспідальному клапані може бути причиною ціанозу і погіршення гемодинаміки, що може збільшувати порушення ритму. Залежно від значимості вади і виду аритмії порушення ритму можуть призводити до смерті. Раптова смерть може бути наслідком частих шлуночкових скорочень при фібриляції передсердь на фоні додаткових шляхів проведення. Якщо ця вада вимагає оперативного лікування, а у пацієнта зареєстрована суправентрикулярна тахікардія, хірургічне лікування аритмії слід розглядати як етап корекції вади. Показане передопераційне ЕФД. Невдалий перетин додаткових шляхів проведення може бути причиною реципрокної тахікардії і нестабільності пацієнта в періопераційний період, тому катетерна абляція показана перед операцією. Наявність вродженої вади серця і додаткових шляхів проведення утруднюють діагностику і точне визначення локалізації додаткових шляхів проведення. За даними Pediatric Radiofriguency Ablation Registry з 65 пацієнтів лише в 75–89% абляція була успішною залежно від локалізації додаткових шляхів проведення (на перегородці, на вільній стінці). Рецидиви аритмії реєстрували після абляції у 32%.
Реконструкції передсердно-легеневого шунта за методом Fontan
Рубцевозалежне тріпотіння або фібриляція передсердь бувають у 57% пацієнтів залежно від специфіки операції. Передсердні порушення ритму можуть викликати швидке погіршення гемодинаміки та призводити до зупинки серця. Засоби невідкладної допомоги при тріпотінні передсердь викладені вище. Катетерна абляція може бути ефективною, але при наявності декількох ланцюгів обертання збудження, проведення її утруднено. Операцію необхідно виконувати тільки у високоспеціалізованих центрах. На додаток до низької ефективності самої катетерної абляції при реконструкції передсердно-легеневого шунта за методом Fontan досить висока частота рецидивів після спочатку успішної абляції, що знижує ефективність цього виду лікування. Табл. 5.9 містить рекомендації щодо лікування суправентрикулярних тахікардій при вроджених вадах серця у повнолітніх пацієнтів.
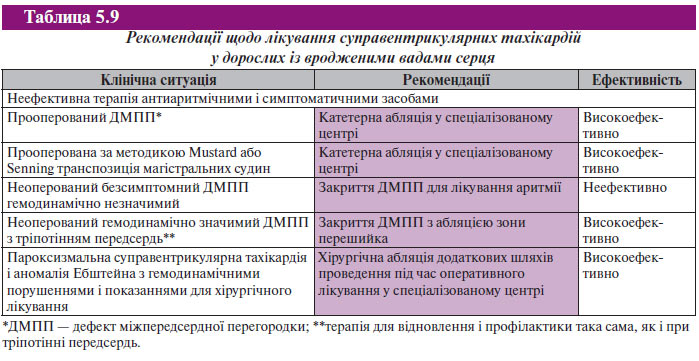
ЛІТЕРАТУРА
- Ардашев В.Н., Стеклов В.И. (1998) Лечение нарушений сердечного ритма. Москва, 165 с.
- Бунин Ю.А. (2003) Лечение тахиаритмий сердца. Москва, 114 с.
- Ди Марко Дж. (1996) Нарушения ритма и проводимости сердца. Кардиология в таблицах и схемах. Под ред. М. Фрида и С. Грайнса. Практика, Москва, с. 201–235.
- Дощицин В.Л. (1993) Лечение аритмий сердца. Медицина, Москва, 320 с.
- Дощицин В.Л., Чернова Е.В. (1996) Неотложная помощь больным с нарушениями сердечного ритма. Рос. кардиол. журн., 6: 13–17.
- Кушаковский М.С. (1992) Аритмии сердца. Гиппократ, Санкт-Петербург, 544 с.
- Кушаковский М.С. (1998) Аритмии сердца. 2-е изд., Фолиант, Санкт-Петербург, 640 с.
- Мазур Н.А. (1992) Пароксизмальные тахикардии. Медицина, Москва, 205 с.
- Мандел В.Дж. (1996) Аритмии сердца. Медицина, Москва, т. 1, с. 453–507.
- Миклашевич И.М., Школьников М.А., Сыркин А.Л. (2002) Естественное течение суправентрикулярных тахиаритмий, манифестировавших в детском возрасте. Вестн. аритмол., 12(15): 60–65.
- Прохорович Е.А., Талибов О.Б., Тополянский А.В. (2002) Лечение нарушений ритма и проводимости на догоспитальном этапе. Леч. врач, 3: 56–60.
- Рекомендации Всероссийского научного общества специалистов по клинической электрофизиологии, аритмологии и кардиостимуляции по проведению клинических электрофизиологических исследований, катетерной абляции и имплантации антиаритмических устройств. Золотой абрикос, Москва, 238 с.
- Руда М.Я., Меркулова И.Н., Драгнев А.Г. и др. (1996) Клиническое изучение нового антиаритмического препарата ІІІ класса нибентана. Сообщение 2: эффективность у больных с суправентрикулярными нарушениями ритма. Кардиология, 6: 28–37.
- Фомина И.Г. (2003) Нарушения сердечного ритма. Рус. врач, 192 с.
- Фролов А.И. (1997) Пароксизмальные суправентрикулярные тахикардии. Лікування та діагностика, 3: 55.
- ACC/AHA/ESC guidelines for management of patients with atrial fibrillation (2001) European Heart J., 22: 1852–1923.
- Blomstrm-Lundqvist and Scheinman М.М. et al. ACC/AHA/ESC Guidelines for the Мanagement of Patients With Supraventricular Arrhythmias — Executive Summary. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Supraventricular Arrhythmias).