Некласифіковані кардіоміопатії
Содержание
КАРДІОМІОПАТІЯ ТАКОТСУБО
Визначення
Кардіоміопатія такотсубо — транзиторне балоноподібне розширення середньої частини верхівки серця (apical ballooning), що супроводжується минущою регіональною систолічною дисфункцією з одночасною гіперкінезією базальних сегментів ЛШ при відсутності стенозуючого ураження коронарних артерій.
Уперше кардіоміопатія такотсубо описана в 1990 р. японськими дослідниками H. Satoh і співавторами. Назву виявленого ними явища визначила форма розширення серця, що нагадувала tako-tsubo — глиняний горщик для лову восьминогів. У світовій літературі застосовують кілька синонімів кардіоміопатії такотсубо: минуще кулеподібне розширення верхівки ЛШ, ампульна кардіоміопатія, амфороподібна кардіоміопатія.
Епідеміологія
Кардіоміопатію такотсубо діагностують у 1% пацієнтів з підозрою на гострий коронарний синдром.
Етіологія і патогенез
Згідно з сучасними поглядами домінуючим причинним фактором у виникненні кардіоміопатії такотсубо є емоційний і фізичний стрес. Захворювання виникає переважно у осіб жіночої статі похилого та старечого віку (91% — у жінок віком 62–76 років). Гіпотеза, що пояснює розвиток ампульної кардіоміопатії у жінок похилого та старечого віку, висунута T. Ueyama і співавторами (2007), які встановили зниження експресії матричної РНК кардіопротективних чинників і розвиток подібної з такотсубо кардіоміопатії у самок лабораторних пацюків, які піддаються стресу, і при цьому не отримували естрогени на відміну від групи тварин, що отримувала естрогени; в групі останніх розвиток такотсубоподібної кардіоміопатії був вірогідно нижче.
До розвитку кардіоміопатії такотсубо можуть призводити шкідливі звички — зловживання алкоголем, наркоманія (вживання кокаїну, опіатів).
Серед інших причинних чинників обговорюються особливості будови серця (S-подібна будова міжшлуночкової перегородки, малий діаметр вихідного тракту ЛШ). Описано розвиток захворювання при деяких гострих станах: пневмотораксі, пароксизмі шлуночкової тахікардії та фібриляції шлуночків.
Вважається, що в основі розвитку захворювання лежить гострий викид катехоламінів і підвищення чутливості адренорецепторів, порушення симпатичної іннервації верхівки серця, а також порушення вегетативної функції на рівні ядер гіпоталамуса як прояв загальної реакції організму на стрес.
Серед інших механізмів виникнення захворювання обговорюється теорія багатосудинного спазму коронарних артерій в епікардіальному відділі коронарного русла з порушенням мікроциркуляції, що виникає, внаслідок підвищеної концентрації катехоламінів у плазмі крові, що в 74,3% випадків відзначають у гостру фазу ампульної кардіоміопатії. При цьому не зовсім зрозуміло, чому коронароспазм виникає в одній і тій самій апікальній ділянці ЛШ. Хоча деякі автори припускають наявність в базальних відділах більшої кількості симпатичних нервових закінчень, що може сприяти розвитку балоноподібної асинергії в апікальних відділах з гіперскоротністю базальних відділів.
Патологічна анатомія
Патоморфологічні зміни при кардіоміопатії такотсубо, отримані за допомогою ендоміокардіальної біопсії та наступній електронній мікроскопії препаратів, характеризуються структурним ушкодженням кардіоміоцитів, вакуолізацією, порушенням цитоскелета клітин, деградацією контрактильних білків, фокальним інтерстиціальним фіброзом, у деяких випадках відзначається наявність дисемінованого фіброзу з інфільтрацією мононуклеарними клітинами. У гостру фазу захворювання в міокарді нерідко реєструються глибокі регіонарні порушення перфузії, проте більша частина кардіоміоцитів в цих зонах зберігає цілісність мембрани і потім повністю відновлює свою функцію.
Застосування імуногістохімічних методів в гострій фазі захворювання дає можливість виявити зменшення кількості актину, порушення структури дистрофіна і коннексина-43, значну активацію колагену 1-го типу і, як наслідок, фібротичні зміни позаклітинного простору. Слід зазначити, що правошлуночкова та лівошлуночкова ендоміокардіальна біопсія є однаково важливими для виявлення морфологічних змін кардіоміоцитів при кардіоміопатії такотсубо.
Клінічна картина
Клінічні прояви кардіоміопатії такотсубо характеризуються в основному приступоподібним болем за грудиною (у 80–86% пацієнтів) та задишкою, які з’являються в стані спокою або після фізичного перенавантаження. Біль триває 20–30 хв, не купірується прийомом нітратів. Зрідка відзначається зниження АТ.
При аускультації серця може визначатися додатковий тон і систолічний шум вигнання.
Діагностика
На ЕКГ у гострій фазі захворювання реєструють інфарктоподібний підйом сегмента ST (90% випадків), інверсію Т (до 97%), утворення патологічного зубця Q (27%). Описано подовження інтервалу Q–T і появу зубця U. Нерідко виявляються синусова брадикардія, AV-блокада, фібриляція передсердь, шлуночкова тахікардія.
Вважається, що у 0,7–2,5% випадків кардіоміопатія такотсубо є причиною неправильного встановлення діагнозу ІМ. Усі відхилення нормалізуються через 8–10 тиж.
ЕхоКГ-обстеження, виконане в період маніфестації симптомів, дозволяє виявити розширення в ділянці верхівки з базальною гіперкінезією та обструкцією виносного тракту ЛШ, акінезію передньої стінки міжшлуночкової перегородки. Градієнт внутрішньошлуночкового тиску може досягати 45 мм рт. ст. і вище. Скорочувальна функція ЛШ у гостру фазу знижується (фракція викиду зменшується до 15–20%), надалі її нормалізація відбувається в середньому за 12–20 днів.
Вентрикулографія та МРТ при кардіоміопатії такотсубо дають можливість виявити акінезію антеролатеральних, апікальних, діафрагмальних і септальних відділів ЛШ з одночасним підвищенням скоротності в його базальних відділах (рис. 13.1). Дисфункція ПШ характеризується гіпокінезією або акінезією переважно апіко-латерального сегмента (рис. 13.2).
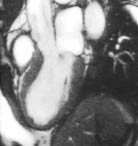
Рис. 13.1. Кардіоміопатія такотсубо. МРТ-обстеження
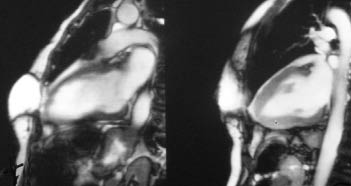
Рис. 13.2. Ураження ЛШ при кардіоміопатії такотсубо. МРТ-обстеження, сагітальний зріз
При проведенні коронароангіографії відсутній гемодинамічно значимий стеноз коронарних артерій. За даними P. Наghi і співавторів (2007 ) у осіб з остаточно встановленим діагнозом «кардіоміопатія такотсубо» максимальна обструкція коронарних артерій не перевищувала 50–65%.
Підтвердженням теорії мікросудинної дисфункції також являються результати застосування однофотонної емісійної КТ, що свідчать про зниження міокардіальної перфузії при відсутності обструктивних змін коронарних судин, і помірне зниження скоротності в ділянці верхівки, причому практично повне відновлення перфузії відзначають через 3–5 днів від початку захворювання.
Для хворих з кардіоміопатією такотсубо характерно мінімальне підвищення активності кардіоспецифічних ферментів — рівня тропоніну I (у 85% обстежуваних), МВ-фракції КФК у крові (у 73,9% випадків), що не відповідає об’єму ураженого міокарда.
Найбільш частим ускладненням кардіоміопатії такотсубо прийнято вважати помірно виражену СН, проте описано кілька випадків ускладнення перебігу захворювання набряком легень у результаті тяжкої лівошлуночкової недостатності, вираженій обструкції виносного тракту ЛШ з тяжкою мітральною регургітацією. Вкрай рідко — кардіогенний шок, розрив міокарда, описаний одиничний випадок раптової смерті. Можливий перикардит і пристіночне апікальне тромбоутворення.
Незважаючи на виражені клінічні симптоми, високий ризик розвитку аритмії, СН із кардіогенним шоком, смертність в умовах стаціонару становить близько 1,7%, а повне клінічне видужання — 95,9% випадків. Як правило, рецидиви захворювання бувають досить рідко. Так, тільки у 2 (2,7%) з 72 пацієнтів у серії, описаної K. Tsushikashi і співавторами (2001), повторний емоційний стрес супроводжувався появою клінічної картини ампульної кардіоміопатії.
Лікування
Спеціальних методів лікування кардіоміопатії такотсубо на сьогодні не розроблено. Схема лікування стандартна для систолічної дисфункції ЛШ і включає інгібітори АПФ, блокатори β-адренорецепторів, ацетилсаліцилову кислоту, діуретики і блокатори кальцієвих каналів при необхідності.
НЕКОМПАКТНА КАРДІОМІОПАТІЯ ЛШ
Визначення
Некомпактна кардіоміопатія ЛШ (ізольована некомпактність ЛШ, підвищена трабекулярність ЛШ, губчатий міокард) — вроджене захворювання, що характеризується вираженою трабекулярністю міокарда ЛШ із глибокими міжтрабекулярними щілинами, пов’язаними з порожниною шлуночка. Вперше описана R. Engberding і F. Bender у 1984 р.
Епідеміологія
Достеменна поширеність захворювання невідома, проте його ознаки при послідовних ехоКГ-дослідженнях визначаються в 0,014% випадків. Захворювання превалює у жінок.
Етіологія
В етіології некомпактної кардіоміопатії провідну роль відіграють генетичні фактори, в основному мутації в генах, що кодують саркомерні білки. У літературі описані як сімейні, так і спорадичні форми некомпактної кардіоміопатії. Дотепер не знайдено загальних генетичних детермінант для цього захворювання. Захворювання генетично гетерогенне, сімейні форми можуть передаватися спадково як аутосомно-домінантне, аутосомно-рецесивне або пов’язане з Х-хромосомою захворювання. У деяких родинах з Х-хромосомою, пов’язаною з некомпактною кардіоміопатією, знайдений зв’язок з мутаціями гена TAZ. Деякі сімейні аутосомно-домінантні кардіоміопатії можуть бути пояснені мутаціями генів, що кодують протеїни цитоскелета або клітинних з’єднань, ламіну A/C, α-дистробревіну. Додаткові локуси ідентифіковані в хромосомах 1q43, 5q та 11p15. У результаті молекулярного скринінгу генів саркомерних білків у двох родинах з аутосомно-домінантним успадкуванням некомпактної кардіоміопатії ідентифіковані мутації в гені важкого ланцюга β-міозину серцевого саркомера. Ідентифіковано мутації генів MYH7 у двох великих родинах з некомпактною кардіоміопатією ЛШ.
Патогенез
Некомпактна кардіоміопатія ЛШ виникає внаслідок внутрішньоутробної зупинки ембріонального розвитку серця (на 5–8-му тижні ембріогенезу) з персистуванням ембріональної морфології міокарда та відсутністю компактності його структури.
Клінічна картина
Захворювання може проявлятися в ранньому дитинстві, однак також може маніфестувати в дорослому віці.
Клінічна маніфестація некомпактної кардіоміопатії ЛШ включає застійну СН із прогресуючою задишкою і набряками, суправентрикулярні та шлуночкові аритмії і системні тромбоемболії. Патомеханізм СН невідомий.
Шлуночкову тахікардію реєструють у 41% хворих. Частота виникнення тромбоемболічних подій коливається від 4 до 24%, найбільш часто виникають у відносно молодому віці. Не встановлено, чи відбувається це внаслідок тромбоутворення в міжтрабекулярних щілинах.
Діагностика
На ЕКГ визначаються неспецифічні зміни, можуть бути синусова тахікардія, ознаки ГЛШ, порушення реполяризації, двофазний Р, суправентрикулярні і шлуночкові аритмії, а також ознаки порушення провідності — блокада лівої ніжки пучка Гіса і AV-блокади.
Діагноз некомпактної кардіоміопатії ЛШ встановлюють шляхом візуалізації стінки шлуночка і його порожнини за допомогою двомірної трансторакальної ехоКГ і колірної допплєрографії, ангіографії ЛШ, КТ або МРТ.
ЕхоКГ має центральне значення в діагностиці некомпактної кардіоміопатії. При дослідженні може визначатися помірна дилатація ЛШ з порушенням систолічної функції. При колірному допплєрівському дослідженні підтверджуються потоки в щілинах і з’єднання їх з порожниною шлуночка.
Хворих можуть тривалий час спостерігати з діагнозом обструктивної гіпертрофічної або ДКМП.
Для діагностики некомпактної кардіоміопатії найбільш зручні діагностичні критерії, запропоновані R. Jenni і співавторами (2001), що включають:
1) сегментарне патологічне надлишкове стовщення стінок шлуночка з двошаровою структурою, що складається зі стовщеного внутрішнього ендокардіального некомпактного шару міокарда і тонкого компактного епікардіального шару міокарда (максимальне кінцево-систолічне співвідношення некомпактного/компактного міокарда ≥2 у парастернальній позиції по короткій осі) з характерною множинною надмірною трабекулярністю і глибокими міжтрабекулярними щілинами (рис. 13.3).
2) документована перфузія глибоких міжтрабекулярних щілин за допомогою потоку колірного допплєра;
3) домінуюча локалізація стовщення ЛШ в апікальній, середньолатеральній і середньозадній зонах його стінки;
4) відсутність супутніх аномалій серця.
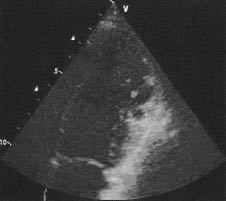
Рис. 13.3. Некомпактна кардіоміопатія. В-режим, апікальна двокамерна позиція
Клінічний діагноз вимагає наявності всіх чотирьох критеріїв.
МРТ і КТ мають важливе значення в діагностиці некомпактної кардіоміопатії ЛШ, для цих методів співвідношення некомпактного/компактного міокарда повинне перевищувати 2,3. Методи дозволяють виявити більшу кількість сегментів ЛШ, залучених у патологічний процес (чутливість 86%, специфічність 99%).
Лікування
Оптимальна концепція лікування некомпактної кардіоміопатії ЛШ не розроблена. Застосовують стандартні підходи лікування СН, включаючи діуретики, інгібітори АПФ, блокатори β-адренорецепторів.
У хворих з ризиком розвитку тромбоемболії ефективне застосування антикоагулянтів.
При тяжкій шлуночковій аритмії вирішується питання про імплантацію кардіовертера-дефібрилятора.
У прогресуючій стадії захворювання та при вираженій систолічній дисфункції ЛШ важливим підходом є пересадка серця.
Прогноз
Прогноз визначають прогресуюча СН і шлуночкові аритмії.
ЛІТЕРАТУРА
- Дупляков Д.В. (2004) Шарообразное расширение верхушки левого желудочка или «takotsubo» кардиомиопатия. Кардиология, 44(11): 97–99.
- Коваленко В.Н. (ред.) (2008) Руководство по кардиологии. Морион, Киев, 1424 с.
- Осовська Н.Ю., Сєркова В.К., Іванів Ю.А. (2008) Порівняльний аналіз клініко-фенотипних та ехокардіографічних ознак при некомпактності лівого шлуночка, дилатаційній кардіоміопатії та множинних аномальних хордах. Укр. кардіол. журн., 4: 82–89.
- Хорикова Е.Н., Артемова Е.В., Остроумов Е.Н. и др. (2006) Диагностика ампульной кардиомиопатии с помощью томосцинтиграфии миокарда. РМЖ, 3: 5–8.
- Abe Y., Kondo M., Matsuoka R. (2003) Assessment of clinical features in transient apical ballooning. J. Am. Coll. Cardiol., 41: 737–742.
- Akashi Y.J., Barbaro G., Sakurai T. et al. (2007) Cardiac autonomic imbalance in patients with reversible ventricular dysfunction takotsubo cardiomyopathy. Quart. J. Med., 100(6): 335–343.
- Arora S., Alfayomi F., Srinivasan V. (2006) Transient left ventricular apical ballooning after cocaine use. Mayo Clin. Proc., 81(6): 732–735.
- Chandrasegaram M.D., Celermajer D.S., Wilson N.K. (2007) Apical ballooning syndrome complicated by acute severe mitral regurgitation with left ventricular outflow obstruction. J. Cardiothorac. Serg., 2: 14.
- Chun S.G., Kwok V., Pang D.K. et al. (2007) Transient left ventricular apical ballooning syndrome as a complication of permanent pacemaker implantation. J. Cardiol., 117(1): 27–30.
- Del Pace S., Salvadori K., Carrabba N. et al. (2007) Left ventricular apical ballooning syndrome as a novel cause of acute mitral regurgitation. J. Am. Coll. Cardiol., 50(7): 647–649.
- Elesber A.A., Prasad A., Bybee K.A. et al. (2006) Transient cardiac apical ballooning syndrome: prevalence and clinical implications of right ventricular involvement. J. Am. Coll. Cardiol., 47: 1082–1083.
- Elliott P., Andersson B., Arbustini E. et al. (2008) Classification of the cardiomyopathies: a position statement from the european society of cardiology working group on myocardial and pericardial diseases. Eur. Heat J., 29: 270–276.
- Galderisi M., Mondillo S. (2007) Echocardiography in clinical practice. One Way S.r.l., 120 p.
- Gianni M., Dentali F., Grandi A.M. et al. (2006) Apical ballooning syndrome or takotsubo cardiomyopathy: a systematic review. Eur. Heart J., 27: 1523–1529.
- Guevara R., Hazin M.I., McCord J. (2007) Takotsubo cardiomyopathy complicated with acute pericarditis and cardiogenic shock. J. Nat. Med. Assoc., 99(3): 281–283.
- Haghi D., Athanasiadis A., Papavassiliu T. et al. (2006) Right ventricular involvement in Takotsubo cardiomyopathy. Eur. Heart J., 27: 2433–2439.
- Haghi D., Papavassiliu T., Hamm K. et al. (2007) Coronary artery disease in takotsubo cardiomyopathy. Circ. J., 71(7): 1092–1094.
- Hoedemaekers Y.M., Caliskan K., Majoor-Krakauer D. et al. (2007) Cardiac β-myosin heavy chain defects in two families with non-compaction cardiomyopathy: linking non-compaction to hypertrophic, restrictive, and dilated cardiomyopathies. Eur Heart J., 28: 2732–2737.
- Jenni R., Oechslin E., Schneider J. (2001). Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction: a step towards classification as a distinct cardiomyopathy. Heart, 86: 599–600.
- Maron B.J., Towbin J.A., Thiene G. et al. (2006) Contemporary definitions and classification of the cardiomyopathies: An American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention. Circulation, 113: 1807–1816.
- Mitchell J.H., Hadden T.B., Wilson J.M. et al. (2007) Clinical features of cardiac magnetic resonance imaging in assessing myocardial viability and prognosis in Tackotsubo cardiomyopathy. J. Cardiol., 100: 296–301.
- Mitsuma W., Kodama M., Ito M. et al. (2007) Serial electrocardiographic findings in women with Takotsubo cardiomyopathy. J. Cardiol., 100: 106–109.
- Murphy R.T., Thaman R., Blanes J.G. (2005) Natural history and familial characteristics of isolated left ventricular non-compaction. Eur. Heart J., 26: 187–192.
- Nanda S., Pamula J., Bhatt S.P. et al. (2007) Takotsubo cardiomyopathy — a new variant and widening disease spectrum. Int. J. Cardiol., 120: 34–36.
- Nef H.M., Molman H., Kostin S. et al. (2007) Tako-tsubo cardiomyopathy: intraindividual structural analysis in the acute phase and after structural recovery. Eur. Heart J., 28: 2456–2464.
- Santos W., Pereira S., Cacodcar S. et al. (2007) Apical ballooning syndrome. Rev. Port Cardiol., 26: 843–852.
- Sasaki O., Nishioka T., Akima T. et al. (2006) Association of takotsubo cardiomyopathy and long QT syndrome. Circ. J., 70(9): 1220–1222.
- Satoh H., Tateishi H., Uchida T. et al. (1990) Takotsubo-type cardiomyopathy due to multivessel spasm. In: Kodama K., Haze K. Hom M., eds. Clinical aspect of myocardial injury: from ischemia to heart failure [in Japanese]. Kagakuhyouronsya Co, Tokyo, 56–64.
- Schoen S.P., Strasser R.H., Kappert U. (2008) Non-compaction cardiomyopathy with low-gradient aortic valve stenosis. Eur. Heart J., 29: 1624.
- Tsushikashi K., Ueshima K., Uchida T. (2001) Transient left ventricular apical ballooning syndrome without coronary artery stenosis; a novel heart syndrome mimicking acute myocardial infarction. J. Am. Coll. Cardiol., 38(1): 11–18.
- Ueyama I., Ishikura F., Matsuda A. et al. (2007) Chronic estrogen supplementation improves stress induced cardiovascular responses. Circ. J., 71(4): 565–573.
- Weiford B.C., Subbarao V.D., Mulhern K.M. (2004) Noncompaction of the ventricular myocardium. Circulation, 109: 2965–2971.
- Wieneke H., Neumann T., Breuckmann F. et al. (2005) Non-compaction cardiomyopathy. Herz., 6: 571–574.
- Yoshida T., Hibino T., Kako N. et al. (2007) A pathophysyologic study of tako-tsubo cardiomyopathy with F-18 fluorodeoxyglucose positron emission tomography. Eur. Heart J., 21: 2598–2604.