Синджарди таблетки, покрытые пленочной оболочкой 12,5 мг + 1000 мг блистер №60
Синджарди инструкция по применению
Состав
Эмпаглифлозин - 12,5 мг
Метформина гидрохлорид - 1000 мг
Фармакологические свойства
фармакодинамика.
Механизм действия. В препарате Синджарди объединено два гипогликемических лекарственных средства, предназначенных для улучшения гликемического контроля у пациентов с сахарным диабетом (СД) 2-го типа, механизм действия которых дополняет друг друга: эмпаглифлозин, ингибитор натрий-глюкозного котранспортера 2-го типа (SGLT2), и метформина гидрохлорид, представитель класса бигуанидов.
Эмпаглифлозин. Эмпаглифлозин является обратимым сильнодействующим (IC50 1,3 нмоль) селективным и конкурентным ингибитором натрий-глюкозного котранспортера 2-го типа (SGLT2). Эмпаглифлозин не ингибирует другие переносчики глюкозы, которые играют важную роль в доставке глюкозы к периферическим тканям, его селективность в 5000 раз выше по сравнению с SGLT1, основным переносчиком, ответственным за абсорбцию глюкозы в кишечнике. SGLT2 в высокой степени экспрессируется в почках, тогда как его экспрессия в других тканях отсутствует или очень низкая. Он отвечает как основной переносчик за реабсорбцию глюкозы из просвета канальцев в кровоток. У пациентов с СД 2-го типа и гипергликемией фильтруется и поглощается большее количество глюкозы.
Эмпаглифлозин улучшает гликемический контроль у пациентов с СД 2-го типа за счет уменьшения реабсорбции глюкозы в почках. Количество глюкозы, выделяемое почками с помощью этого механизма, зависит от концентрации глюкозы в крови и скорости клубочковой фильтрации (СКФ). Ингибирование SGLT2 у пациентов с СД 2-го типа и гипергликемией способствует выделению избытка глюкозы почками.
У пациентов с СД 2-го типа выведение глюкозы увеличивалось сразу после применения первой дозы эмпаглифлозина, данный эффект сохранялся в течение 24 ч. Увеличение выделения глюкозы почками сохранялось до конца 4-недельного периода лечения и в среднем составило около 78 г/сут на фоне приема эмпаглифлозина в дозе 25 мг. Увеличение выделения глюкозы почками способствовало немедленному снижению уровня глюкозы в плазме крови у пациентов с СД 2-го типа. Кроме того, эмпаглифлозин увеличивает экскрецию натрия, что ведет к осмотическому диурезу и уменьшению внутрисосудистого объема.
Эмпаглифлозин снижает уровень глюкозы в плазме крови как натощак, так и после приема пищи. Механизм действия эмпаглифлозина не зависит от функционального состояния β-клеток и метаболизма инсулина, что способствует снижению риска развития гипогликемии. Был отмечен позитивный эффект в отношении маркеров функции β-клеток, в том числе гомеостатической модели оценки функции β-клеток (HOMA-β). Кроме того, выделение глюкозы почками вызывает потерю калорий, что сопровождается уменьшением объема жировой ткани и уменьшением массы тела. Глюкозурия, которая наблюдается при применении эмпаглифлозина, сопровождается умеренным диурезом, что может способствовать долговременному умеренному снижению АД. Глюкозурия, натрийурез и осмотический диурез, которые наблюдаются при применении эмпаглифлозина, могут способствовать улучшению сердечно-сосудистых прогнозов.
Метформин. Метформин относится к группе бигуанидов, обладает гипогликемическими свойствами и способствует снижению уровня глюкозы в крови как натощак, так и после приема пищи. Он не стимулирует выработку инсулина, поэтому не приводит к развитию гипогликемии.
Действие метформина обусловлено тремя механизмами:
- сокращение продукции глюкозы в печени за счет угнетения глюконеогенеза и гликогенолиза;
- повышение чувствительности мышц к инсулину, улучшение захвата глюкозы периферическими тканями и ее утилизации;
- замедление всасывания глюкозы в кишечнике.
Метформин стимулирует внутриклеточный синтез гликогена за счет воздействия на гликогенсинтетазу. Метформин улучшает функциональную активность всех известных на сегодня видов транспортеров глюкозы.
Независимо от своего влияния на гликемию, метформин оказывает благоприятное воздействие на обмен жиров у человека. Это было продемонстрировано в ходе контролируемых средне- и долгосрочных клинических исследований применения метформина в терапевтических дозах: метформин снижает уровень общего ХС, ХС ЛПНП и ТГ.
Клиническая эффективность и безопасность. Улучшение гликемического контроля и снижение уровня сердечно-сосудистых заболеваний и смертности является неотъемлемой частью лечения СД 2-го типа.
Терапия эмпаглифлозином в комбинации с метформином и другими антидиабетическими препаратами (пиоглитазоном, сульфонилмочевиной, ингибиторами DPP-4 и инсулином) или без таковых приводила к клинически значимому снижению уровня HbAlc, глюкозы в плазме крови натощак, массы тела, систолического и диастолического АД. При применении эмпаглифлозина в дозе 25 мг увеличилась доля пациентов, достигших целевого уровня HbA1c <7%, и уменьшилось количество пациентов, нуждающихся в гликемической терапии, по сравнению с применением эмпаглифлозина в дозе 10 мг и плацебо. Чем выше был исходный уровень HbA1c, тем в большей степени происходило его снижение под действием препарата. Кроме того, эмпаглифлозин в качестве дополнения к стандартной терапии снижает уровень сердечно-сосудистой смертности и сердечно-сосудистых заболеваний у пациентов с СД 2-го типа.
Сердечно-сосудистые прогнозы. В двойном слепом плацебо-контролируемом исследовании EMPA-REG OUTCOME сравнивали эффективность применения эмпаглифлозина в дозе 10 мг и 25 мг и плацебо в качестве дополнения к стандартной терапии у пациентов с СД 2-го типа и установленными сердечно-сосудистыми заболеваниями.
Эмпаглифлозин продемонстрировал преимущество по сравнению с плацебо относительно основного критерия оценки: снижения частоты случаев смерти в результате сердечно-сосудистых заболеваний, нефатального инфаркта миокарда или нефатального инсульта. Эффект был обусловлен значительным снижением сердечно-сосудистой смертности без существенных изменений в отношении нефатального инфаркта миокарда или нефатального инсульта. Снижение сердечно-сосудистой смертности было сопоставимым для эмпаглифлозина в дозе 10 и 25 мг (см. график ниже) и подтверждено улучшением общей выживаемости (табл. 1).
Эффективность предотвращения сердечно-сосудистой смертности не была окончательно установлена у пациентов, принимавших ингибиторы DPP-4, или у пациентов негроидной расы, поскольку представленность этих групп в исследовании EMPA-REG OUTCOME была ограниченной.
Таблица 1. Эффект терапии согласно основным критериям оценки, их компонентами и смертностиа
| N | Плацебо | Эмпаглифлозинb |
|---|---|---|
| 2333 | 4687 | |
| Время до возникновения первого летального исхода вследствие сердечно-сосудистых заболеваний, нефатального инфаркта миокарда или нефатального инсульта, N (%) | 282 (12,1) | 490 (10,5) |
| Соотношение рисков по сравнению с плацебо (95,02% ДИ)* | 0,86 (0,74; 0,99) | |
| P-значение | 0,0382 | |
| Смерть в результате сердечно-сосудистых заболеваний, N (%) | 137 (5,9) | 172 (3,7) |
| Соотношение рисков по сравнению с плацебо (95% ДИ) | 0,62 (0,49; 0,77) | |
| P-значение | <0,0001 | |
| Нефатальный инфаркт миокарда, N (%) | 121 (5,2) | 213 (4,5) |
| Соотношение рисков по сравнению с плацебо (95% ДИ) | 0,87 (0,70; 1,09) | |
| P-значение | 0,2189 | |
| Нефатальный инсульт, N (%) | 60 (2,6) | 150 (3,2) |
| Соотношение рисков по сравнению с плацебо (95% ДИ) | 1,24 (0,92; 1,67) | |
| P-значение | 0,1638 | |
| Общая смертность, N (%) | 194 (8,3) | 269 (5,7) |
| Соотношение рисков по сравнению с плацебо (95% ДИ) | 0,68 (0,57; 0,82) | |
| P-значение | <0,0001 | |
| Смертность, не связанная с сердечно-сосудистыми заболеваниями, N (%) | 57 (2,4) | 97 (2,1) |
| Соотношение рисков по сравнению с плацебо (95% ДИ) | 0,84 (0,60; 1,16) | |
aДанные, полученные у пациентов, проходивших лечение (то есть пациентов, получивших хотя бы одну дозу исследуемого лекарственного средства).
bОбъединенные дозы эмпаглифлозина 10 и 25 мг.
*Поскольку результаты исследования были включены в промежуточный анализ, применяется двусторонний доверительный интервал 95,02%, который соответствует значениям p<0,0498 для значимости.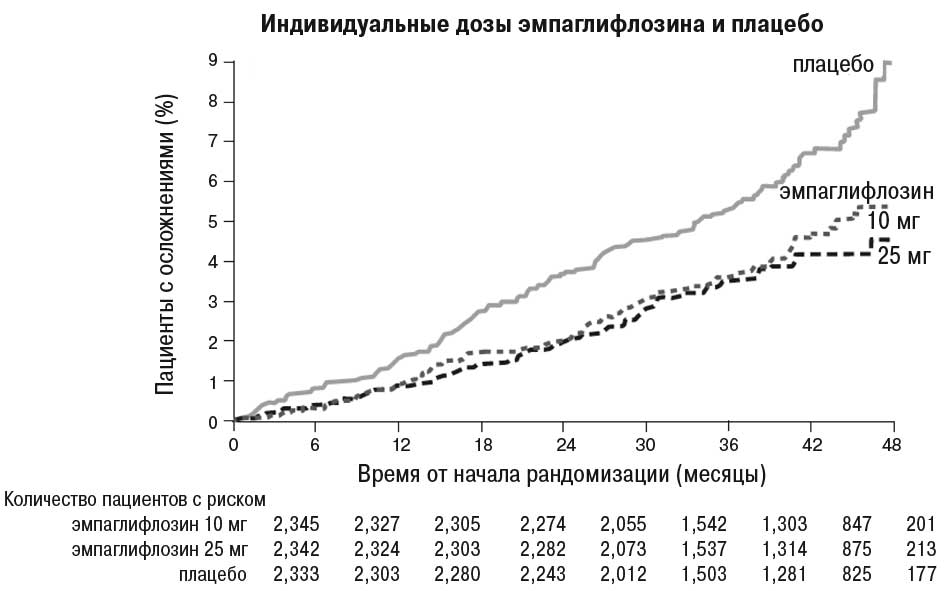
Рис. 1. Время до наступления летального исхода в результате сердечно-сосудистых заболеваний в исследовании EMPA-REG OUTCOME
Фармакокинетика
Препарат Синджарди. Результаты исследований биоэквивалентности с участием здоровых добровольцев свидетельствуют о том, что таблетки комбинированного препарата Синджарди (эмпаглифлозин/метформина гидрохлорид) в дозе 5 мг/850 мг, 5 мг/1000 мг, 12,5 мг/850 мг и 12,5 мг/1000 мг являются биоэквивалентными соответствующим дозам эмпаглифлозина и метформина в виде отдельных таблеток, которые принимают одновременно.
Применение эмпаглифлозина/метформина в дозе 12,5 мг/1000 мг после приема пищи приводило к снижению значений AUC на 9% и Сmax на 28% в группе приема эмпаглифлозина по сравнению с приемом натощак. В группе приема метформина значение AUC уменьшалось на 12%, Cmax на 26% по сравнению с приемом натощак. Наблюдаемое влияние приема пищи на эмпаглифлозин и метформин не считается клинически значимым. Однако поскольку метформин рекомендуется применять вместе с едой, препарат Синджарди также предлагается принимать во время приема пищи.
Эмпаглифлозин
Всасывание. Фармакокинетика эмпаглифлозина подробно описана у здоровых добровольцев и пациентов с СД 2-го типа. После приема эмпаглифлозин быстро всасывался, Cmax в плазме крови достигалась при среднем tmax 1,5 ч после приема препарата. Затем концентрация в плазме крови двухфазно снижалась: с быстрой фазой распределения и относительно медленной конечной фазой. При приеме 1 раз в сутки средние показатели AUC в период устойчивой концентрации в плазме крови составляли 1870 нмоль/ч и Cmax 259 нмоль/л для эмпаглифлозина в дозе 10 мг и 4740 нмоль/ч и 687 нмоль/л для эмпаглифлозина в дозе 25 мг. Выраженность системного действия эмпаглифлозина увеличивалась пропорционально дозе. Фармакокинетические параметры эмпаглифлозина после введения однократной дозы и в период устойчивой концентрации в плазме крови были подобными, что указывает на линейность фармакокинетики во времени. Клинически достоверной разницы в фармакокинетике эмпаглифлозина между здоровыми добровольцами и пациентами с СД 2-го типа не отмечалось.
Фармакокинетика эмпаглифлозина, применявшегося в дозе 5 мг 2 раза в сутки, и эмпаглифлозина, применявшегося в дозе 10 мг 1 раз в сутки, сравнивалась с таковой у здоровых добровольцев. Общее воздействие (AUCSS) эмпаглифлозина в течение 24 ч при приеме в дозе 5 мг 2 раза в сутки и при приеме в дозе 10 мг 1 раз в сутки было подобным. Как и ожидалось, значения Cmax при приеме эмпаглифлозина в дозе 5 мг 2 раза в сутки были ниже по сравнению с приемом эмпаглифлозина в дозе 10 мг 1 раз в сутки, но при более высокой минимальной концентрации в плазме крови (Cmin) эмпаглифлозина в первом случае.
Введение эмпаглифлозина в дозе 25 мг после приема высококалорийной пищи с высоким содержанием жиров обусловило некоторое ослабление его действия; значения AUC снизились примерно на 16%, а Cmax — примерно на 37% по сравнению с приемом натощак. Это влияние приема пищи на фармакокинетику эмпаглифлозина нельзя считать клинически значимым. Эмпаглифлозин можно принимать независимо от приема пищи. Аналогичные результаты были получены при приеме комбинированных таблеток препарата Синджарди (эмпаглифлозин/метформин) с высококалорийной пищей и пищей с высоким содержанием жира.
Распределение. Объем распределения в равновесном состоянии составляет 73,8 л, исходя из анализа фармакокинетики у субъектов. После введения перорального р-ра [14C]-эмпаглифлозина здоровым добровольцам связывание с эритроцитами составляло около 37%, а связывание с белками плазмы крови — 86%.
Биотрансформация. Основные метаболиты эмпаглифлозина в плазме крови человека не выявляли. Наиболее часто определяемые метаболиты — три конъюгата глюкуронида (2-, 3- и 6-O-глюкуронид). Системное воздействие каждого метаболита составляет <10% общего воздействия препарата. Исследования in vitro указывают, что основным путем метаболизма эмпаглифлозина у человека является глюкуронидация с участием уридин-5'-дифосфоглюкуроносилтрансфераз UGT2B7, UGT1A3, UGT1A8 и UGT1A9.
Выведение. Исходя из анализа фармакокинетики у субъектов, конечный Т½ эмпаглифлозина составляет 12,4 ч, а очевидный пероральный клиренс — 10,6 л/ч. Межсубъектная и остаточная вариабельность клиренса эмпаглифлозина при пероральном введении составляла 39,1 и 35,8% соответственно. При применении 1 раз в сутки устойчивая концентрация эмпаглифлозина в плазме крови достигалась к 5-й дозе. Соответственно Т½, в период устойчивой концентрации наблюдалось до 22% накопления (относительно AUC в плазме крови). После введения перорального р-ра [14C]-эмпаглифлозина здоровым добровольцам около 96% меченного вещества выводилось с калом (41%) или мочой (54%). Большая часть меченого вещества в неизмененном виде выводилась с калом и примерно половина меченого вещества в неизмененном виде — с мочой.
Особые категории пациентов
Нарушение функции почек. У пациентов с почечной недостаточностью легкой, средней и тяжелой степени тяжести (клиренс креатинина <30–<90 мл/мин) и у пациентов с почечной недостаточностью/терминальной стадией почечной недостаточности (ТСПН) значения AUC эмпаглифлозина увеличились примерно на 18; 20; 66 и 48% соответственно по сравнению с субъектами с нормальной функцией почек. Cmax эмпаглифлозина в плазме крови у пациентов с умеренным нарушением функции почек и почечной недостаточностью/ТСПН была подобной таковой у субъектов с нормальной функцией почек. Cmax эмпаглифлозина в плазме крови была примерно на 20% выше у пациентов с почечной недостаточностью легкой и тяжелой степени тяжести по сравнению с субъектами с нормальной функцией почек. Исходя из анализа фармакокинетики у субъектов, очевидный пероральный клиренс эмпаглифлозина уменьшается со снижением клиренса креатинина, что обусловливает усиление действия препарата.
Нарушение функции печени. У пациентов с нарушением функции печени легкой, умеренной и тяжелой степени тяжести согласно классификации Чайлда — Пью значения AUC эмпаглифлозина увеличились примерно на 23; 47 и 75%, а Cmax — примерно на 4; 23 и 48% соответственно по сравнению с субъектами с нормальной функцией печени.
Индекс массы тела. Индекс массы тела (ИМТ) не оказывает клинически значимого влияния на фармакокинетику эмпаглифлозина. Значения AUC были на 5,82; 10,4 и 17,3% меньше у пациентов с ИМТ 30, 35 и 45 кг/м2 соответственно по сравнению с пациентами с ИМТ 25 кг/м2.
Пол. Пол не оказывает клинически значимого влияния на фармакокинетику эмпаглифлозина.
Раса. Значения AUC были на 13,5% больше у пациентов монголоидной расы с ИМТ 25 кг/м2 по сравнению с пациентами других рас с ИМТ 25 кг/м2.
Пациенты пожилого возраста. Возраст не оказывает клинически значимого влияния на фармакокинетику эмпаглифлозина.
Дети. В исследовании изучали фармакокинетику и фармакодинамику эмпаглифлозина (5 мг, 10 мг и 25 мг) у детей и подростков в возрасте ≥10–<18 лет с СД 2-го типа. Полученные фармакокинетические и фармакодинамические данные соответствовали таковым у взрослых.
Метформин
Всасывание. После приема дозы метформина время достижения Cmax (Тmax) составляет 2,5 ч. Абсолютная биодоступность таблеток метформина гидрохлорида 500 мг или 850 мг у здоровых добровольцев составляет около 50–60%. После приема доля невсосавшегося метформина, выведенного с калом, составляет 20–30%. Процесс всасывания метформина гидрохлорида характеризуется насыщаемостью и является неполным. Фармакокинетика всасывания метформина гидрохлорида считается нелинейной. При соблюдении рекомендуемых доз и режима приема равновесная концентрация метформина в плазме крови достигается в течение 24–48 ч и в целом составляет <1 мкг/мл. По данным контролируемых клинических исследований, Cmax метформина в плазме крови не превышает 5 мкг/мл, даже при приеме максимальных доз.
Прием пищи уменьшает степень и несколько замедляет абсорбцию метформина. После приема метформина гидрохлорида в дозе 850 мг наблюдалось уменьшение значений Cmax на 40%, AUC на 25% и увеличение на 35 мин периода достижения Cmax в плазме крови. Клиническая значимость этих изменений неизвестна.
Распределение. Связывание с белками плазмы крови незначительно. Метформин проникает в эритроциты. Значения Cmax в крови меньше, нежели Cmax в плазме крови, и достигаются за одинаковый период времени. Эритроциты, вероятнее всего, представляют собой вторичный компартмент распределения. Средний объем распределения (Vd) варьировал от 63 л до 276 л.
Биотрансформация. Метформин выводится с мочой в неизмененном виде. Метаболиты у людей не выявлены.
Выведение. Почечный клиренс метформина составляет >400 мл/мин, это указывает на то, что метформин выводится путем клубочковой фильтрации и канальцевой секреции. После приема дозы конечный Т½ составляет примерно 6,5 ч.
При ухудшении функции почек почечный клиренс уменьшается пропорционально клиренсу креатинина, и таким образом конечный Т½ удлиняется, что приводит к повышению содержания метформина в плазме крови.
Особые категории пациентов
Дети. После однократного приема метформина гидрохлорида в дозе 500 мг фармакокинетический профиль у детей был сопоставим с таковым у здоровых взрослых.
При применении метформина в дозе 500 мг 2 раза в сутки в течение 7 дней значения Cmax в плазме крови и системное воздействие (AUC0-t) у детей уменьшались примерно на 33 и 40% соответственно по сравнению со взрослыми больными СД, которые получали метформин в дозе 500 мг 2 раза в сутки в течение 14 дней. Поскольку доза определяется индивидуально на основании показателей гликемического контроля, клиническая значимость этих данных считается ограниченной.
Показания Синджарди
лечение СД 2-го типа у взрослых в качестве дополнения к диетотерапии и режиму физических нагрузок:
- если применения максимально переносимой дозы одного только метформина недостаточно;
- если применение метформина в комбинации с другими лекарственными средствами для лечения СД не обеспечивает достаточного гликемического контроля;
- если пациенты уже получают терапию с применением комбинации эмпаглифлозина и метформина в виде отдельных препаратов.
Информацию по результатам исследования применения комбинаций, влияния на гликемический контроль и сердечно-сосудистые заболевания см. в разделах ОСОБЫЕ УКАЗАНИЯ, ВЗАИМОДЕЙСТВИЯ и ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА.
Применение Синджарди
дозы. Взрослые с нормальной функцией почек (СКФ ≥90 мл/мин). Рекомендованная доза — 1 таблетка 2 раза в сутки. Дозу подбирают индивидуально на основе текущего режима пациента, эффективности и переносимости рекомендованной суточной дозы эмпаглифлозина 10 мг или 25 мг, при этом не превышая максимальную рекомендованную суточную дозу метформина.
Для пациентов с неудовлетворительным контролем гликемии на фоне монотерапии метформином или применения метформина в комбинации с другими лекарственными средствами для лечения СД. Для пациентов, у которых не обеспечивается достаточный контроль при монотерапии метформином или применении метформина в комбинации с другими лекарственными средствами для лечения СД, рекомендуемая доза Синджарди составляет 5 мг эмпаглифлозина 2 раза в сутки (суточная доза 10 мг) и текущую дозу метформина. Для пациентов, которые хорошо переносят общую суточную дозу эмпаглифлозина 10 мг, при необходимости улучшения гликемического контроля дозу можно повысить до 25 мг эмпаглифлозина в сутки (максимальная суточная доза эмпаглифлозина — 25 мг).
Если препарат Синджарди применяют в комбинации с сульфонилмочевиной и/или инсулином, для снижения риска гипогликемии следует рассмотреть возможность применения сульфонилмочевины и/или инсулина в низких дозах (см. ВЗАИМОДЕЙСТВИЯ, ПОБОЧНЫЕ ЭФФЕКТЫ).
Для пациентов, ранее получавших комбинированную терапию эмпаглифлозином и метформином в качестве отдельных препаратов. Для пациентов, ранее получавших комбинацию эмпаглифлозина (общая суточная доза 10 мг или 25 мг) и метформина в качестве отдельных препаратов, переход на препарат Синджарди рекомендуется начинать с текущей суточной дозы эмпаглифлозина и метформина или с ближайшей соответствующей терапевтической дозы метформина.
Препарат Синджарди выпускается в таких дозах:
- 5 мг эмпаглифлозина и 850 мг метформина гидрохлорида;
- 5 мг эмпаглифлозина и 1000 мг метформина гидрохлорида;
- 12,5 мг эмпаглифлозина и 850 мг метформина гидрохлорида;
- 12,5 мг эмпаглифлозина и 1000 мг метформина гидрохлорида.
Особые группы пациентов
Почечная недостаточность. Пациентам с почечной недостаточностью легкой степени тяжести коррекции дозы не требуется. Необходимо оценить величину СКФ перед началом терапии препаратами, содержащими метформин. В дальнейшем оценку следует проводить по меньшей мере ежегодно. У пациентов с повышенным риском прогрессирования почечной недостаточности и у пациентов пожилого возраста функцию почек следует оценивать чаще, например каждые 3–6 мес.
Если адекватное дозирование Синджарди отсутствует, следует использовать отдельно монокомпоненты вместо фиксированной комбинации.
Таблица 2. Дозировка для больных с почечной недостаточностью
| СКФ, мл/мин | Метформин | Эмпаглифлозин |
|---|---|---|
| 60−89 | Максимальная суточная доза — 3000 мг. Возможно снижение дозы при снижении функции почек | Максимальная суточная доза — 25 мг |
| 45−59 | Максимальная суточная доза — 2000 мг. Начальная доза не должна превышать половины максимальной дозы | Начинать терапию эмпаглифлозином не следует. Максимальную суточную дозу нужно откорректировать или поддерживать на уровне 10 мг |
| 30−44 | Максимальная суточная доза — 1000 мг. Начальная доза не должна превышать половины максимальной дозы | Применение эмпаглифлозина не рекомендовано |
| <30 | Применение метформина противопоказано | Применение эмпаглифлозина не рекомендовано |
Печеночная недостаточность. Данное лекарственное средство не следует применять у пациентов с печеночной недостаточностью (см. ПРОТИВОПОКАЗАНИЯ, ОСОБЫЕ УКАЗАНИЯ, ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА. Фармакодинамика).
Пациенты пожилого возраста. Учитывая механизм действия, снижение эффективности эмпаглифлозина является следствием нарушения функции почек. Поскольку метформин выделяется почками, а пациенты пожилого возраста более склонны к нарушению функции почек, у этой категории пациентов применять препарат Синджарди следует с осторожностью. Для профилактики лактоацидоза, вызванного метформином, необходим контроль функции почек, в частности у пациентов пожилого возраста (см. ПРОТИВОПОКАЗАНИЯ, ОСОБЫЕ УКАЗАНИЯ). У пациентов в возрасте старше 75 лет следует учитывать повышенный риск гиповолемии (см. ОСОБЫЕ УКАЗАНИЯ, ПОБОЧНЫЕ ЭФФЕКТЫ). Пациентам в возрасте старше 85 лет применять препарат не рекомендуется из-за ограниченного опыта применения эмпаглифлозина (см. ОСОБЫЕ УКАЗАНИЯ).
Способ применения. Препарат СИНДЖАРДИ применяют 2 раза в сутки во время приема пищи для уменьшения выраженности побочных реакций со стороны ЖКТ, связанных с применением метформина. Все пациенты должны продолжать соблюдать диету с надлежащим распределением потребления углеводов в течение дня. Пациентам с избыточной массой тела следует продолжать соблюдать низкокалорийную диету.
В случае пропуска приема дозы ее следует принять как можно скорее. Не следует принимать двойную дозу препарата в один и тот же день.
Дети. Безопасность и эффективность препарата Синджарди для детей (в возрасте до 18 лет) не установлена, поэтому препарат не применяется у этой категории пациентов.
Противопоказания
- гиперчувствительность к действующим веществам или любому из вспомогательных веществ;
- любой тип метаболического ацидоза (лактоацидоз, диабетический кетоацидоз);
- диабетическая кома;
- тяжелая почечная недостаточность (СКФ <30 мл/мин);
- острые состояния, сопровождающиеся риском развития нарушения функции почек, такие как дегидратация, тяжелые инфекционные заболевания, шок;
- острые или хронические заболевания, которые могут приводить к развитию тканевой гипоксии: сердечная или дыхательная недостаточность, недавно перенесенный инфаркт миокарда, шок;
- печеночная недостаточность, острая алкогольная интоксикация, алкоголизм (см. ВЗАИМОДЕЙСТВИЯ).
Побочные эффекты
наиболее частыми побочными реакциями в клинических исследованиях были гипогликемия (при применении с инсулином и/или сульфонилмочевиной), инфекции мочевыводящих путей, инфекции половых органов и частое мочеиспускание (см. Описание отдельных побочных реакций). В ходе клинических исследований не выявлено каких-либо дополнительных побочных реакций при применении эмпаглифлозина в качестве дополнения к метформину по сравнению с побочными реакциями при применении каждого компонента в отдельности.
Побочные реакции представлены по системам органов и частоте возникновения: очень часто (≥1/10), часто (≥1/100–<1/10), нечасто (≥1/1000–<1/100), редко (≥1/10 000–<1/1000), очень редко (<1/10 000), частота неизвестна (частоту невозможно оценить по имеющимся данным).
Таблица 3. Побочные реакции, возникавшие в ходе плацебо-контролируемых исследований и постмаркетингового применения
| Системы органов | Очень часто | Часто | Нечасто | Редко | Очень редко | Неизвестно |
|---|---|---|---|---|---|---|
| Инфекции и инвазии | Вагинальный кандидоз, вульвовагинит, баланит и другие инфекции половых органов1,2, инфекции мочевыводящих путей (включая пиелонефрит и уросепсис)1,2 | |||||
| Со стороны обмена веществ и системы пищеварения | Гипогликемия (при применении одновременно с сульфонилмочевиной или инсулином)1 | Жажда2 | Диабетический кетоацидозa | Лактоацидоз3, дефицит витамина В123,4 | ||
| Со стороны нервной системы | Нарушения вкуса3 | |||||
| Со стороны сосудистой системы | Уменьшение объема межклеточной жидкости1,2 | |||||
| Со стороны ЖКТ | Желудочно-кишечные симптомы3,5 | |||||
| Со стороны гепатобилиарной системы | Отклонения в функциональных печеночных пробах3, гепатит3 | |||||
| Со стороны кожи и подкожной клетчатки | Зуд (генерализованный)2,3, сыпь | Крапивница | Эритема3 | Ангионевротический отек | ||
| Со стороны почек и мочевыводящих путей | Повышенное выделение мочи1,2 | Дизурия2 | ||||
| Исследования | Повышение уровня липидов сыворотки крови2,b | Повышение уровня креатинина в крови/снижение СКФ, увеличение гематокрита2,c | ||||
1См. ниже.
2Выявлены побочные реакции при монотерапии эмпаглифлозином.
3Выявлены побочные реакции при монотерапии метформином.
4Длительное лечение метформином ассоциировано со снижением всасывания витамина В12, что может в очень редких случаях приводить к клинически значимому дефициту витамина В12 (например мегалобластной анемии).
5Желудочно-кишечные симптомы, а именно: тошнота, рвота, диарея, боль в животе и потеря аппетита, чаще возникают в начале лечения и, как правило, спонтанно исчезают.
aСм. ОСОБЫЕ УКАЗАНИЯ.
bСредняя доля увеличивается относительно базового уровня для эмпаглифлозина в дозе 10 мг и 25 мг по сравнению с плацебо; соответственно для общего ХС — 5,0 и 5,2% по сравнению с 3,7%; ХС ЛПВП — 4,6 и 2,7% по сравнению с 0,5%; ХС ЛПНП — 9,1 и 8,7% по сравнению с 7,8%; ТГ — 5,4 и 10,8% по сравнению с 12,1%.
cСредние изменения гематокрита относительно базового уровня для эмпаглифлозина в дозе 10 мг и 25 мг по сравнению с плацебо составляли соответственно 3,6 и 4,0% по сравнению с 0%. В ходе клинических исследований значение гематокрита возвращалось к базовому уровню в течение 30 дней наблюдения после прекращения лечения.
Описание отдельных побочных реакций
Гипогликемия. Во время соответствующих исследований частота развития гипогликемии зависела от базисной терапии и была подобной при применении эмпаглифлозина и плацебо в случае добавления к метформину, в случае добавления к линаглиптину и метформину, а также при применении комбинации эмпаглифлозина с метформином у пациентов, впервые получавших лечение, по сравнению с пациентами, которые применяли эмпаглифлозин и метформин в качестве отдельных компонентов раньше и как добавление к стандартной терапии. Повышение частоты наблюдалось в случае добавления эмпаглифлозина к метформину и сульфонилмочевине (эмпаглифлозин в дозе 10 мг: 16,1%, эмпаглифлозин в дозе 25 мг: 11,5%, плацебо: 8,4%) или в случае добавления к метформину и инсулину (эмпаглифлозин в дозе 10 мг: 31,3%, эмпаглифлозин в дозе 25 мг: 36,2% и плацебо: 34,7%).
Тяжелая гипогликемия (гипогликемия, требующая медицинского вмешательства). Общая частота возникновения тяжелой гипогликемии у пациентов была низкой (<1%) и подобной при применении эмпаглифлозина и плацебо в случае добавления к метформину, а также при применении комбинации эмпаглифлозина с метформином у пациентов, впервые получавших лечение, по сравнению с пациентами, которые применяли эмпаглифлозин и метформин как отдельные компоненты раньше, и в случае добавления к стандартной терапии. Тяжелая гипогликемия наблюдалась у 0,5; 0 и 0,5% пациентов, принимавших эмпаглифлозин в дозе 10 мг, эмпаглифлозин в дозе 25 мг и плацебо в случае добавления к метформину и инсулину соответственно. При применении комбинации с метформином и сульфонилмочевиной, а также в случае добавления к линаглиптину и метформину развития тяжелой гипогликемии не отмечалось.
Инфекции мочевыводящих путей. Общая частота инфекций мочевыводящих путей была выше в группе пациентов, принимавших метформин на фоне приема эмпаглифлозина в дозе 10 мг (8,8%), по сравнению с группой пациентов, принимавших эмпаглифлозин в дозе 25 мг (6,6%) или плацебо (7,8%). Подобно группе плацебо, инфекции мочевыводящих путей наблюдались чаще на фоне приема эмпаглифлозина у пациентов с хроническими или рецидивирующими инфекциями мочевыводящих путей в анамнезе. Степень тяжести (легкая, умеренная, тяжелая) инфекций мочевыводящих путей была подобной у пациентов, получавших плацебо. Инфекции мочевыводящих путей наблюдались чаще у женщин на фоне приема эмпаглифлозина в дозе 10 мг по сравнению с плацебо, но не отмечались на фоне приема эмпаглифлозина в дозе 25 мг. Частота инфекций мочевыводящих путей была ниже у мужчин.
Вагинальный кандидоз, вульвовагинит, баланит и другие инфекции половых органов. Вагинальный кандидоз, вульвовагинит, баланит и другие инфекции половых органов отмечались чаще в группе пациентов, принимавших метформин на фоне приема эмпаглифлозина в дозе 10 мг (4,0%) и в дозе 25 мг (3,9%), по сравнению с пациентами в группе приема плацебо (1,3%), чаще у женщин на фоне приема эмпаглифлозина по сравнению с приемом плацебо. Разница в частоте возникновения была менее выраженной у мужчин. Степень тяжести инфекций половых органов была слабой или умеренной. Случаев тяжелых инфекций не отмечено.
Повышенное выделение мочи. Учитывая механизм действия, повышенное выделение мочи (оценивались такие симптомы, как поллакиурия, полиурия и никтурия) отмечали с большей частотой у пациентов, принимавших метформин на фоне приема эмпаглифлозина в дозе 10 мг (3,0%) и в дозе 25 мг (2,9%), по сравнению с принимавшими плацебо (1,4%) в дополнение к метформину. Частое мочеиспускание было преимущественно слабым или умеренным. Частота зарегистрированных случаев никтурии была сопоставимой в группе приема плацебо и эмпаглифлозина (<1%).
Уменьшение объема межклеточной жидкости. Общая частота уменьшения объема межклеточной жидкости (которое выражалось снижением АД (амбулаторно), систолического АД, обезвоживанием, артериальной гипотензией, гиповолемией, ортостатической гипотензией и обмороком) у пациентов, принимавших метформин на фоне приема эмпаглифлозина, была низкой: 0,6% в группе приема эмпаглифлозина в дозе 10 мг, 0,3% в группе приема эмпаглифлозина в дозе 25 мг и 0,1% в группе приема плацебо. Влияние эмпаглифлозина на выделение глюкозы почками связано с осмотическим диурезом, что может повлиять на состояние гидратации пациентов в возрасте старше 75 лет. Среди пациентов в возрасте старше 75 лет дегидратация отмечалась у одного пациента, который применял эмпаглифлозин в дозе 25 мг в дополнение к метформину.
Повышение уровня креатинина в крови/снижение СКФ. Общая частота повышения уровня креатинина в крови и снижение СКФ были подобными при применении эмпаглифлозина и плацебо в дополнение к метформину (повышение уровня креатинина в крови: эмпаглифлозин в дозе 10 мг: 0,5%, эмпаглифлозин в дозе 25 мг: 0,1%, плацебо: 0,4%, снижение СКФ: эмпаглифлозин в дозе 10 мг: 0,1%, эмпаглифлозин в дозе 25 мг: 0%, плацебо: 0,2%).
Как правило, у пациентов, получавших эмпаглифлозин в качестве дополнения к метформину, при длительном лечении начальное повышение уровня креатинина и снижение СКФ были временными или обратимыми после прекращения терапии.
Сообщения о побочных реакциях. Сообщения о побочных реакциях после регистрации лекарственного средства являются важными. Это позволяет вести мониторинг соотношения польза/риск лекарственного средства. Просим медицинских работников сообщать о любых возможных побочных реакциях через национальную систему отчетности.
Особые указания
препарат Синджарди не следует применять у пациентов с СД 1-го типа.
Диабетический кетоацидоз. При применении ингибиторов SGLT2 (включая эмпаглифлозин) сообщали о редких случаях диабетического кетоацидоза (ДКА), в том числе представлявших угрозу для жизни и летальных. В нескольких случаях ДКА проявлялся атипично, только умеренным повышением уровня глюкозы в крови (<14 ммоль/л (250 мг/дл)). Неизвестно, влияет ли повышение дозы эмпаглифлозина на вероятность возникновения ДКА.
Необходимо учитывать риск ДКА в случае появления таких неспецифических симптомов, как тошнота, рвота, отсутствие аппетита, боль в животе, чрезмерная жажда, затруднение дыхания, спутанность сознания, необычная усталость или сонливость. При возникновении этих симптомов пациентов нужно немедленно обследовать на наличие кетоацидоза независимо от уровня глюкозы в крови.
Если у пациента подозревается или диагностирован ДКА, следует немедленно прекратить применение эмпаглифлозина.
В случае госпитализации пациента для проведения значительных хирургических процедур или при серьезных острых заболеваниях лечение следует прекратить. В обоих случаях терапию эмпаглифлозином можно возобновить после стабилизации состояния пациента.
Перед началом применения эмпаглифлозина следует установить наличие в анамнезе пациента факторов, которые могут свидетельствовать о склонности к кетоацидозу.
Высокий риск кетоацидоза отмечают у пациентов с ослаблением функции β-клеток (например в случае СД 2-го типа с низким уровнем С-пептида, латентного аутоиммунного СД у взрослых или панкреатита в анамнезе); пациенты с состояниями, которые приводят к ограничению приема пищи или сильному обезвоживанию; пациенты, которым снижают дозу инсулина, и пациенты с повышенной потребностью в инсулине в связи с острым заболеванием, хирургическим вмешательством или злоупотреблением алкоголем. У этих пациентов ингибиторы SGLT2 следует применять с осторожностью.
Восстановление терапии ингибиторами SGLT2 для пациентов с ДКА, который наблюдался ранее во время лечения ингибиторами SGLT2, не рекомендуется, если точно не установлен и не устранен другой фактор, провоцирующий ДКА.
Безопасность и эффективность применения эмпаглифлозина для пациентов с СД 1-го типа не установлены. Эмпаглифлозин не следует применять в лечении пациентов с СД 1-го типа. Некоторые данные клинических исследований позволяют предположить, что ДКА часто возникает при лечении ингибиторами SGLT2 у пациентов с СД 1-го типа.
Лактоацидоз. Лактоацидоз — очень редкое, но серьезное расстройство обмена веществ, чаще всего возникает в случае острого нарушения функции почек, кардиореспираторной болезни или сепсиса. Накопление метформина происходит при остром нарушении функции почек и повышает риск развития лактоацидоза.
В случае дегидратации (вследствие тяжелой диареи или рвоты, лихорадки или уменьшения приема жидкости) следует временно прекратить применение метформина и обратиться к врачу.
Лекарственные средства, которые могут вызвать острое нарушение функции почек (например антигипертензивные препараты, диуретики, НПВП), нужно применять с осторожностью у пациентов, получающих метформин. К другим факторам риска развития лактоацидоза относятся злоупотребление алкоголем, печеночная недостаточность, плохо контролируемый СД, кетоз, длительное голодание, любые состояния, связанные с гипоксией, а также одновременное применение лекарственных средств, которые могут способствовать развитию лактоацидоза (см. ПРОТИВОПОКАЗАНИЯ и ВЗАИМОДЕЙСТВИЯ).
Пациентов и/или лиц, осуществляющих уход за ними, следует проинформировать о риске развития лактоацидоза. Лактоацидоз характеризуется ацидотической одышкой, болью в животе, мышечными спазмами, астенией и гипотермией с последующим развитием комы. В случае перечисленных симптомов пациенты должны прекратить применение метформина и немедленно обратиться к врачу. Диагностические лабораторные признаки лактоацидоза включают снижение pH крови (<7,35), повышение уровня лактата в плазме крови (>5 ммоль/л), а также увеличение дефицита анионов и повышение соотношения лактат/пируват.
Применение йодосодержащих контрастных веществ. Внутрисосудистое введение йодосодержащих контрастных веществ может вызвать развитие контраст-индуцированной нефропатии. Это может привести к кумуляции метформина и повысить риск развития лактоацидоза. Таким образом, лечение метформином следует прекратить до начала или на период проведения исследований. Лечение следует возобновлять не ранее чем через 48 ч после окончания исследования и только при оценке функции почек с подтверждением ее стабильности (см. ПРИМЕНЕНИЕ и ВЗАИМОДЕЙСТВИЯ).
Функция почек. Следует оценить СКФ до начала терапии, а затем регулярно (см. Способ применения и дозы). Препарат Синджарди противопоказан пациентам с СКФ <30 мл/мин. Применение препарата следует временно прекратить при наличии условий, которые изменяют функцию почек (см. ПРОТИВОПОКАЗАНИЯ).
Сердечная функция. У пациентов с сердечной недостаточностью отмечают более высокий риск развития гипоксии и почечной недостаточности. Пациентам со стабильной хронической сердечной недостаточностью препарат Синджарди можно применять при мониторинге функций сердца и почек. Препарат Синджарди противопоказан пациентам с острой и нестабильной сердечной недостаточностью из-за содержания метформина (см. ПРОТИВОПОКАЗАНИЯ).
Поражение печени. Во время клинических исследований отмечались сообщения о поражении печени при применении эмпаглифлозина. Причинно-следственная связь между применением эмпаглифлозина и поражением печени не установлена.
Хирургические вмешательства. Лечение метформином следует прекратить на время проведения пациенту хирургических вмешательств с применением общей, спинномозговой или эпидуральной анестезии. Лечение препаратом можно возобновить не ранее чем через 48 ч после операции или восстановления перорального питания и только после повторной оценки функции почек и подтверждения ее стабильности.
Риск уменьшения объема межклеточной жидкости. В результате действия ингибиторов SGLT2 осмотический диурез, сопровождающий лекарственную глюкозурию, может привести к незначительному снижению АД (см. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА, Фармакодинамика). Следует применять с осторожностью у пациентов, для которых снижение АД, обусловленное действием эмпаглифлозина, может представлять опасность, например у пациентов с сердечно-сосудистыми заболеваниями в анамнезе, у пациентов (с артериальной гипотензией в анамнезе), которые получают терапию антигипертензивными препаратами, или у пациентов в возрасте старше 75 лет.
В случае развития состояний, которые могут привести к потере жидкости (например желудочно-кишечные заболевания), у пациентов, получающих препарат Синджарди, рекомендуется тщательный мониторинг степени гиповолемии (например проведение физического осмотра, измерение АД, лабораторные тесты, включая уровень гематокрита) и применения электролитов. Следует рассмотреть необходимость временного прекращения лечения Синджарди до восполнения потери жидкости.
Инфекции мочевыводящих путей. Согласно данным объединенных плацебо-контролируемых исследований, продолжавшихся от 18 до 24 нед, общая частота инфекций мочевых путей, зарегистрированных как нежелательные явления, была выше у пациентов, получавших эмпаглифлозин в дозе 10 мг на фоне применения метформина, по сравнению с пациентами, получавшими плацебо или эмпаглифлозин в дозе 25 мг на фоне применения метформина (см. ПОБОЧНЫЕ ЭФФЕКТЫ). В постмаркетинговых исследованиях наблюдались случаи осложнений в виде инфекций мочеполовых путей, включая пиелонефрит и уросепсис, у пациентов, получавших лечение эмпаглифлозином. Следует рассмотреть необходимость временного прекращения лечения эмпаглифлозином для пациентов с осложненными инфекциями мочевыводящих путей.
Ампутации нижних конечностей. Увеличение количества случаев ампутации нижних конечностей (в первую очередь, пальцев на ноге) наблюдалось в текущих долгосрочных клинических исследованиях с другим ингибитором SGLT2. Неизвестно, характерен ли этот эффект для всех препаратов данного класса. Всем пациентам с СД важно предоставлять консультации по регулярному профилактическому уходу за нижними конечностями.
Повышенный гематокрит. Повышение гематокрита наблюдалось во время лечения эмпаглифлозином (см. ПОБОЧНЫЕ ЭФФЕКТЫ).
Пациенты пожилого возраста. Влияние эмпаглифлозина на выведение глюкозы почками связано с осмотическим диурезом, что может повлиять на состояние гидратации. У пациентов в возрасте старше 75 лет отмечают повышенный риск гиповолемии. Поэтому необходимо обратить особое внимание на объем межклеточной жидкости в случае одновременного применения лекарственных средств, которые могут привести к его уменьшению (таких как диуретики, ингибиторы АПФ). Терапевтический опыт применения у пациентов в возрасте старше 85 лет ограничен. Применение эмпаглифлозина у этой категории пациентов не рекомендуется (см. ПРИМЕНЕНИЕ).
Сердечная недостаточность. Существует ограниченный опыт применения эмпаглифлозина у пациентов с сердечной недостаточностью I–II класса по классификации NYHA. Опыт клинических исследований применения эмпаглифлозина у пациентов с сердечной недостаточностью класса ІІI–IV по NYHA отсутствует. В ходе клинических исследований сообщалось о 10,1% пациентов с сердечной недостаточностью в начальной стадии. Снижение сердечно-сосудистой смертности у этих пациентов было сопоставимо с таковым в общей популяции исследования.
Лабораторные анализы мочи. Ожидается, что у пациентов, принимающих препарат Синджарди, тест на определение глюкозы в моче будет положительным.
Применение в период беременности и кормления грудью
Беременность. Данные по применению лекарственного средства или эмпаглифлозина у беременных отсутствуют. Некоторые данные указывают на то, что применение метформина у беременных не связано с повышенным риском врожденных аномалий.
Если пациентка планирует забеременеть или забеременела, рекомендуется не применять этот препарат для лечения СД. Таких больных необходимо перевести на введение инсулина для поддержания по возможности близкого к норме уровня глюкозы в крови, чтобы снизить риск пороков развития у плода, ассоциированных с отклонениями от нормы уровня глюкозы в крови.
Период кормления грудью. Метформин проникает в грудное молоко. Какого-либо неблагоприятного воздействия на новорожденных/детей грудного возраста, матери которых принимали препарат, не выявлено. Нет данных о том, что эмпаглифлозин проникает в грудное молоко. Риск для новорожденных/детей грудного возраста не может быть исключен.
Указанное лекарственное средство не следует применять в период кормления грудью.
Фертильность. Исследования влияния данного лекарственного средства или эмпаглифлозина на фертильность у людей не проводились.
Способность влиять на скорость реакции при управлении транспортными средствами или другими механизмами. Препарат Синджарди оказывает незначительное влияние на скорость реакции при управлении транспортными средствами или работе с другими механизмами. Пациентам следует рекомендовать принимать меры по предотвращению развития гипогликемии при управлении транспортными средствами или работе с другими механизмами, в частности при применении препарата Синджарди в комбинации с сульфонилмочевиной и/или инсулином.
Взаимодействия
многократное одновременное применение эмпаглифлозина и метформина значительно не изменяет фармакокинетику как эмпаглифлозина, так и метформина у здоровых добровольцев.
Исследования взаимодействия препарата Синджарди с другими препаратами не проводили. Приведенные данные отражают известную информацию о каждом активном действующем веществе в отдельности.
Эмпаглифлозин
Фармакодинамические взаимодействия
Диуретики. Поскольку препарат Синджарди содержит эмпаглифлозин, он может усиливать мочегонный эффект тиазидных и петлевых диуретиков и повышает риск дегидратации и артериальной гипотензии (см. ОСОБЫЕ УКАЗАНИЯ).
Инсулин и стимуляторы секреции инсулина. Инсулин и стимуляторы секреции инсулина, такие как сульфонилмочевина, повышают риск гипогликемии. Таким образом, может потребоваться снижение дозы инсулина или стимуляторов секреции инсулина для снижения риска гипогликемии при применении в сочетании с эмпаглифлозином (см. ПРИМЕНЕНИЕ, ПОБОЧНЫЕ ЭФФЕКТЫ).
Фармакокинетические взаимодействия
Влияние других лекарственных средств на эмпаглифлозин. Данные іn vitro указывают, что основным путем метаболизма эмпаглифлозина у человека является глюкуронидация с участием уридин-5-дифосфоглюкуроносилтрансфераз UGT1A3, UGT1A8, UGT1A9 и UGT2B7. Эмпаглифлозин является субстратом транспортеров поглощения у человека OAT3, OATP1B1 и OATP1B3, но не OAT1 и OCT2. Эмпаглифлозин является субстратом Р-гликопротеина (P-gp) и белка резистентности рака молочной железы.
Одновременное применение эмпаглифлозина с пробенецидом, ингибитором ферментов уридиндифосфат-глюкуронилтрансферазы (UGT) и OAT3, привело к увеличению значений Cmax в плазме крови на 26% и AUC на 53%. Эти изменения не считались клинически значимыми.
Влияние индукции UGT на эмпаглифлозин не изучали. Одновременное применение с известными индукторами ферментов UGT не рекомендуется вследствие потенциального риска снижения эффективности.
Исследование in vitro взаимодействия с гемфиброзилом, ингибитором транспортеров OAT3 и OATP1B1/1B3, показало, что после сочетанного применения значения Cmax эмпаглифлозина увеличивались на 15%, а AUC уменьшались на 59%. Эти изменения не считались клинически значимыми.
Ингибирование транспортеров OATP1B1/1B3 при одновременном применении с рифампицином обусловило увеличение значений Cmax на 75% и AUC эмпаглифлозина на 35%. Эти изменения не считались клинически значимыми.
Влияние эмпаглифлозина при одновременном применении с верапамилом, ингибитором P-gp, и в отдельности было подобным. Это указывает на то, что ингибирование P-gp не оказывает клинически значимого влияния на эмпаглифлозин.
Исследования взаимодействия указывают на то, что на фармакокинетику эмпаглифлозина не влияет сопутствующее введение метформина, глимепирида, пиоглитазона, ситаглиптина, линаглиптина, варфарина, верапамила, рамиприла, симвастатина, торасемида и гидрохлоротиазида.
Влияние эмпаглифлозина на другие лекарственные средства. По данным исследований in vitro, эмпаглифлозин не ингибирует, не инактивирует и не индуцирует изоформы CYP 450. Эмпаглифлозин не ингибирует UGT1A1, UGT1A3, UGT1A8, UGT1A9 или UGT2B7. Межлекарственные взаимодействия с участием основных изоформ CYP 450 или UGT с эмпаглифлозином и параллельно введенными субстратами этих ферментов считаются маловероятными.
Эмпаглифлозин не ингибирует P-gp в терапевтических дозах. По данным исследований in vitro, маловероятна способность эмпаглифлозина вступать во взаимодействия с препаратами, которые являются субстратами P-gp. Одновременное применение дигоксина, субстрата P-gp, и эмпаглифлозина обусловило увеличение на 6% значений AUC и на 14% Cmax дигоксина. Эти изменения не считались клинически значимыми.
Эмпаглифлозин не ингибирует in vitro транспортеры поглощения человека, такие как OAT3, OATP1B1 и OATP1B3, в клинически значимых концентрациях, то есть межлекарственное взаимодействие с субстратами этих транспортеров поглощения считается маловероятным.
Результаты исследований взаимодействия, проведенных с участием здоровых добровольцев, указывают на то, что эмпаглифлозин не оказывает клинически значимого эффекта в отношении фармакокинетики метформина, глимепирида, пиоглитазона, ситаглиптина, линаглиптина, симвастатина, варфарина, рамиприла, дигоксина, диуретиков и пероральных контрацептивов.
Метформин
Комбинации, которые применять не рекомендуется
Алкоголь. Алкогольная интоксикация связана с повышенным риском развития лактоацидоза (особенно в случаях голодания, недостаточного питания или печеночной недостаточности).
Органические катионные транспортеры (ОКТ). Метформин является субстратом двух транспортеров — ОКТ1 и ОКТ2.
Одновременное применение метформина:
- с ингибиторами ОКТ1 (такими как верапамил) может снизить эффективность метформина;
- с индукторами ОКТ1 (такими как рифампицин) может усиливать всасывание в ЖКТ и эффективность метформина;
- с ингибиторами OКТ2 (такими как циметидин, долутегравир, ранолазин, триметоприм, вандетаниб, исавуконазол) может снизить элиминацию почками метформина и, следовательно, привести к повышению его концентрации в плазме крови;
- с ингибиторами ОКТ1 и ОКТ2 (такими как кризотиниб, олапариб) может изменить эффективность и элиминацию почками метформина.
Концентрация метформина в плазме крови может повышаться при одновременном приеме указанных препаратов с метформином, поэтому необходима осторожность при применении, особенно у пациентов с нарушением функции почек. При необходимости дозу метформина можно регулировать, поскольку ингибиторы/индукторы ОКТ могут изменять эффективность метформина.
Йодосодержащие контрастные вещества. Применение метформина следует прекратить до начала или на период исследований. Лечение не следует возобновлять ранее, чем через 48 ч после окончания исследования, при подтвержденной стабильной функции почек, см. ПРИМЕНЕНИЕ и ОСОБЫЕ УКАЗАНИЯ.
Комбинации, которые следует применять с осторожностью. Некоторые лекарственные средства могут негативно влиять на функцию почек, что может привести к повышению риска лактоацидоза (например НПВП, включая ингибиторы ЦОГ-2, ингибиторы АПФ, антагонисты рецепторов ангиотензина II и диуретики, в частности петлевые). При применении таких препаратов в комбинации с метформином следует тщательно контролировать функцию почек.
Глюкокортикоиды (системного и местного действия), агонисты β2-адренорецепторов и диуретики обладают гипергликемическими свойствами. Пациента следует проинформировать об этом и чаще проверять уровень глюкозы в крови, особенно в начале лечения указанными лекарственными средствами. При необходимости дозу антигипергликемического лекарственного средства следует скорректировать при терапии другим препаратом, а также при его отмене.
Инсулин и стимуляторы секреции инсулина. Инсулин и стимуляторы секреции инсулина, такие как сульфонилмочевина, повышают риск гипогликемии. Таким образом, может потребоваться снижение дозы инсулина или стимуляторов секреции инсулина для снижения риска гипогликемии при одновременном применении с метформином (см. ПРИМЕНЕНИЕ, ПОБОЧНЫЕ ЭФФЕКТЫ).
Передозировка
симптомы
Эмпаглифлозин. В ходе контролируемых клинических исследований разовые дозы эмпаглифлозина до 800 мг (эквивалентно 32-кратной максимальной рекомендуемой суточной дозе) у здоровых добровольцев и несколько ежедневных доз эмпаглифлозина до 100 мг (эквивалентно 4-кратной наивысшей рекомендуемой суточной дозе) у пациентов с СД 2-го типа не вызвали каких-либо токсических явлений. Эмпаглифлозин усиливал выделение глюкозы почками, что обусловило увеличение объема мочи. Выявленное увеличение объема мочи не зависело от дозы и не было клинически значимым. Опыт применения доз выше 800 мг у людей отсутствует.
Метформин. При приеме метформина в дозе до 85 г гипогликемии не отмечено, хотя при этом наблюдались случаи лактоацидоза. Значительная передозировка метформина или сопутствующие риски могут привести к развитию лактоацидоза. Лактоацидоз — это состояние, требующее срочной медицинской помощи и лечения в стационаре.
Лечение. В случае передозировки лечение следует начинать в соответствии с клиническим состоянием пациента. Самым эффективным методом выведения лактата и метформина является гемодиализ. Выведение эмпаглифлозина путем гемодиализа не изучалось.
Условия хранения
при температуре не выше 25 °С.
