Энбрел раствор для инъекций 25 мг шприц 0.5 мл №4
Энбрел инструкция по применению
Состав
Этанерцепт - 50 мг/мл
Фармакологические свойства
иммунологические и биологические свойства. Этанерцепт — химерный белок рецептора фактора некроза опухоли (ФНО) человеческий и p75Fc, полученный по технологии рекомбинантной ДНК с использованием клеток млекопитающих (клеток яичника китайского хомячка (СНО)) в качестве системы экспрессии. Этанерцепт представляет собой димер химерного белка, который получают методом генной инженерии путем присоединения внеклеточного лигандсвязывающего домена рецептора-2 ФНО человека (TNFR2/p75) в Fс домена человеческого IgGl. Компонент Fс содержит шарнирную область, участки СН2 и СН3, но не содержит участка СН1 IgGl. Этанерцепт содержит 934 аминокислоты и имеет кажущуюся молекулярную массу ≈150 кДа. Специфическая активность этанерцепта составляет 1,7 · 106 ЕД/мг.
ФНО — цитокин, играющий основную роль в развитии воспалительного процесса при ревматоидном артрите. Повышенный уровень ФНО также определятся в синовиальной оболочке и псориатических бляшках пациентов с псориатическим артритом, а также в плазме крови и синовиальной ткани пациентов с анкилозирующим спондилитом. Инфильтрация псориатической бляшки воспалительными клетками, включая Т-клетки, приводит к повышению уровня ФНО в местах псориатического поражения по сравнению с непораженными участками кожи. Этанерцепт является конкурентным ингибитором связывания ФНО с его поверхностными клеточными рецепторами, а следовательно, он подавляет биологическую активность ФНО. ФНО и лимфотоксин — провоспалительные цитокины, которые связываются с двумя клеточными поверхностными рецепторами ФНО: 55 кДа (р55) и 75 кДа (р75). Оба рецептора ФНО существуют в организме в мембранносвязанной и растворимой формах. Растворимые рецепторы ФНО регулируют биологическую активность ФНО.
ФНО и лимфотоксин существуют преимущественно в виде гомотримеров, а их биологическая активность зависит от перекрестного сшивания рецепторов ФНО, находящихся на поверхности клетки. Димерные растворимые рецепторы, такие как этанерцепт, имеют большую аффинность к ФНО, чем мономерные рецепторы, а потому являются значительно мощными конкурентными ингибиторами связывания ФНО с его клеточными рецепторами. Кроме того, использование области Fc иммуноглобулина как элемента связывания в структуре димерного рецептора удлиняет T½ препарата из плазмы крови.
Значительная часть патологических изменений в суставах при ревматоидном артрите и анкилозирующем спондилите, а также патологии кожи при бляшечном псориазе возникают вследствие воздействия провоспалительных молекул, которые являются частью системы, которую контролирует ФНО. Считается, что механизм действия этанерцепт заключается в конкурентном ингибировании связывания ФНО с рецепторами ФНО на поверхности клетки. Таким образом, этанерцепт препятствует возникновению клеточного ответа, опосредованной ФНО, за счет биологической инактивации ФНО. Этанерцепт также способен модулировать биологические ответы, контролируемые дополнительными молекулами, передающими сигнал в нисходящем направлении (например цитокины, адгезивные молекулы или протеиназы), стимулируемые и регулируемые ФНО.
Взрослые пациенты с ревматоидным артритом
Эффективность препарата Энбрел оценивали в рандомизированном двойном слепом плацебо-контролируемом исследовании. В исследовании участвовали 234 взрослых с ревматоидным артритом, у которых лечение минимум одним, но не более чем четырьмя базисными противоревматическими препаратами (БПРП), было неэффективным. 10 или 25 мг Энбрел или плацебо вводили п/к 2 раза в неделю в течение 6 мес подряд. Результаты этого контролируемого исследования были представлены как доля улучшения состояния при ревматоидном артрите с применением критериев ответа на терапию, разработанных Американской коллегией ревматологов (АКР).
На 3-м и 6-м месяце лечения ответ АКР 20 и 50 чаще наблюдали у пациентов, получавших Энбрел, по сравнению с пациентами, получавшими плацебо (АКР 20: Энбрел — 62 и 59%, плацебо — 23 и 11%; АКР 50: Энбрел — 41 и 40%, плацебо — 8 и 5% на 3-м и 6-м месяце соответственно; р<0,01 для препарата Энбрел плацебо во всех контрольных временных точках как для показателя АКР 20, так и для АКР 50).
Примерно 15% участников исследования, получавших Энбрел, достигли ответа АКР 70, на 3-м и 6-м месяце исследования по сравнению с <5% участников исследования в группе плацебо. У пациентов, получавших Энбрел, клинические эффекты, как правило, отмечались в течение 1–2 нед от начала терапии и практически всегда возникали до 3-го месяца лечения. Наблюдалась зависимость доза/эффект: результаты, полученные при введении дозы 10 мг, были выше тех, которые получены при применении плацебо, и ниже тех, которые получены при применении дозы 25 мг. Энбрел имел достоверно лучшие результаты, чем плацебо, по всем критериям АКР, а также по всем показателям определения активности ревматоидного артрита, не вошедшим в АКР критерия ответа на терапию, например утренней скованности. Опросник оценки состояния здоровья (Health Assessment Questionnaire — HAQ), который содержит такие разделы, как инвалидизация, жизненная энергия, психическое здоровье, общее состояние здоровья и состояние здоровья с учетом артрита, заполняли каждые 3 мес на протяжении всего исследования. По сравнению с контрольной группой на 3-м и 6-м месяце исследования у пациентов, получавших Энбрел, наблюдали улучшение показателей по всем разделам HAQ.
Обычно после отмены препарата Энбрел симптомы артрита появлялись снова в течение 1 мес. Согласно результатам открытых исследований, интенсивность ответа на лечение препаратом Энбрел после перерыва продолжительностью до 24 мес была подобной таковой, наблюдаемой у пациентов, получавших непрерывное лечение. В открытых расширенных исследованиях, в которых пациенты непрерывно получали препарат Энбрел, длительный устойчивый ответ на терапию отмечали в течение 48 мес; опыта длительного применения препарата нет.
Эффективность препарата Энбрел сравнивали с эффективностью метотрексата в рандомизированном исследовании с активным контролем и с замаскированными радиографическими определениями первичной конечной точки, которые проводили с участием 632 взрослых пациентов с ревматоидным артритом (продолжительностью <3 лет), никогда не получавших лечение метотрексатом. Энбрел вводили п/к по 10 или 25 мг 2 раза в неделю в течение до 24 мес. Дозу метотрексата в течение первых 8 нед исследования повышали с 7,5 до 20 мг/нед и продолжали вводить в течение 24 мес. Клиническое улучшение, в том числе начало действия, при применении препарата Энбрел 25 мг в течение 2 нед, было подобным тем, которые наблюдали в предыдущих исследованиях, и сохранялось в течение 24 мес. Перед началом исследования у пациентов была умеренная степень инвалидизации со средним показателем суммы баллов по опроснику HAQ от 1,4 до 1,5. Лечение препаратом Энбрел в дозе 25 мг привело к значительному улучшению состояния через 12 мес, при этом почти 44% пациентов достигли нормальных показателей по опроснику HAQ (<0,5). Полученный эффект от лечения сохранялся и на 2-й год этого исследования.
В указанном исследовании структурное повреждение суставов оценивалось рентгенологически и выражалось как изменение общего показателя Шарпа (Total Sharp Score (TSS)) и его компонентов: показателя эрозивного поражения в баллах и сужение суставной щели (JSN). Рентгенограммы руки/запястья и стопы были получены перед началом исследования и через 6; 12 и 24 мес. Энбрел в дозе 10 мг всегда оказывал менее выраженное влияние на структурное повреждение суставов, чем в дозе 25 мг. Энбрел в дозе 25 мг имел достоверное преимущество перед метотрексатом относительно показателя эрозивного поражения через 12 и 24 мес. Различия в показателях TSS и JSN при применении метотрексата и препарата Энбрел 25 мг не были статистически достоверными. Результаты этого исследования представлены на рис. 1.
Рис. 1. Рентгенологические изменения: сравнение препарата Энбрел и метотрексата у пациентов с ревматоидным артритом, который длится <3 лет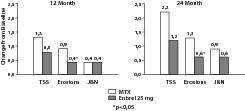
В другом двойном слепом рандомизированном исследовании с активным контролем сравнивали клиническую эффективность, безопасность и рентгенологические изменения у пациентов с ревматоидным артритом, получавших монотерапию препаратом Энбрел (по 25 мг 2 раза в неделю), монотерапию метотрексатом (от 7,5 до 20 мг 1 раз неделю, средняя доза — 20 мг) и комбинированное лечение препаратами Энбрел и метотрексат, применение которых было начато одновременно. Исследования проводили с привлечением 682 взрослых пациентов, больных ревматоидным артритом от 6 мес до 20 лет (в среднем — 5 лет) и у которых эффект от лечения не менее одним БПРП, кроме метотрексата, был менее чем удовлетворительным.
В группе пациентов, получавших Энбрел в комбинации с метотрексатом, наблюдали достоверно более высокие показатели АКР 20; 50; 70 и улучшение результатов по шкале активности заболевания (DAS) и опроснику HAQ как на 24-й, так и 52-й неделе по сравнению с пациентами любой из групп, где проводили монотерапию (табл. 1). Достоверные преимущества применения комбинации этанерцепта с метотрексатом по сравнению с монотерапией одним из этих препаратов также наблюдали и по окончании 24 мес лечения.
Таблица 1
Результаты изучения клинической эффективности через 12 мес: сравнение препарата Энбрел с метотрексатом и с комбинацией препарата Энбрел с метотрексатом у пациентов, больных ревматоидным артритом от 6 мес до 20 лет
| Конечная точка | Метотрексат (n=228) | Энбрел (n=223) | Энбрел + метотрексат (n=231) |
| Показатели АКРа | |||
| АКР 20, % | 58,8 | 65,5 | 74,5*, φ |
| АКР 50, % | 36,4 | 43,0 | 63,2*, φ |
| АКР 70, % | 16,7 | 22,0 | 39,8*, φ |
| DAS | |||
| Выходной баллb | 5,5 | 5,7 | 5,5 |
| Балл в 52 недb | 3,0 | 3,0 | 2,3*, φ |
| Ремиссия, %с | 14 | 18 | 37*, φ |
| HAQ | |||
| Исходный показатель | 1,7 | 1,7 | 1,8 |
| 52-я неделя | 1,1 | 1,0 | 0,8*, φ |
| aПациенты, не завершие 12-месячное лечение в исследовании, считались такими, у которых ответ на лечение отсутствует; bпоказатели активности заболевания в баллах (DAS) являются средними значениями; cремиссия определялась как DAS<1,6. Значение р при попарном сравнении: *p<0,05 для сравнения комбинации Энбрел + метотрексат с метотрексатом и φ=p<0,05 для сравнения комбинации Энбрел + метотрексат с препаратом Энбрел. | |||
Рентгенологические изменения через 12 мес в группе пациентов, получавших Энбрел, были достоверно менее выраженными по сравнению с группой метотрексата, в то время как комбинация этих препаратов была достоверно эффективнее, чем каждый из этих препаратов в монотерапии, относительно замедления рентгенологических изменений (рис. 2).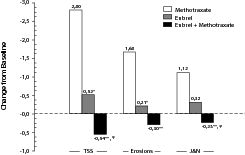
Рис. 2. Рентгенологические изменения: сравнение препарата Энбрел с метотрексатом и с комбинацией препарата Энбрел с метотрексатом у пациентов с ревматоидным артритом от 6 мес до 20 лет (результаты за 12 мес)
Достоверное преимущество применения комбинации препарата Энбрел с метотрексатом, по сравнению с монотерапией метотрексатом и монотерапии препаратом Энбрел также наблюдали и по окончании 24 мес лечения. Аналогично по истечению 24 мес наблюдали достоверное преимущество монотерапии препаратом Энбрел по сравнению с монотерапией метотрексатом.
При анализе, в котором все пациенты, выбывшие из исследования по любой причине, считались такими, которые имели прогресс, доля пациентов без прогресса (изменения показателя TSS ≤0,5) на 24-м месяце была больше в группе пациентов, получавших Энбрел в комбинации с метотрексатом, по сравнению с группами пациентов, получавших монотерапию препаратом Энбрел и метотрексатом (62; 50 и 36% соответственно; р<0,05). Разница между монотерапией препаратом Энбрел и метотрексатом также была статистически достоверной (р<0,05). Среди пациентов, прошедших полный 24-месячный курс терапии в этом исследовании, доля пациентов, у которых не наблюдался прогресс, составила 78; 70 и 61% соответственно.
Безопасность и эффективность препарата Энбрел в дозе 50 мг (2 п/к инъекции по 25 мг) 1 раз в неделю оценивали в двойном слепом плацебо-контролируемом исследовании с участием 420 пациентов с активным ревматоидным артритом. В этом исследовании 53 пациента получали плацебо, 214 — Энбрел в дозе 50 мг 1 раз в неделю и 153 пациента — Энбрел в дозе 25 мг 2 раза в неделю. На 8-й неделе лечения профили безопасности и эффективности двух режимов терапии препаратом Энбрел были сопоставимыми с точки зрения их влияния на симптоматику ревматоидного артрита; однако данные, полученные на 16-й неделе, не продемонстрировали сопоставимости (отсутствие преимуществ) этих двух режимов терапии. Значение р при попарном сравнении: *p<0,05 для сравнения Энбрел с метотрексатом; **p<0,05 для сравнения комбинации Энбрел + метотрексат с метотрексатом; φ=p<0,05 для сравнения комбинации Энбрел + метотрексат с препаратом Энбрел.
Взрослые пациенты с псориатическим артритом
Эффективность препарата Энбрел оценивали в одном рандомизированном двойном слепом плацебо-контролируемом исследовании с привлечением 205 пациентов с псориатическим артритом. Все участники были в возрасте от 18 до 70 лет и имели активный псориатический артрит (≥3 суставов с отеком и ≥3 суставов с болью) по крайней мере одной из следующих форм: артрит с поражением дистальных межфаланговых суставов (1), полиартикулярный артрит (отсутствие ревматоидных узлов и наличие псориаза) (2), мутилирующий артрит (3); асимметричный псориатический артрит (4); анкилозирующий спондилит (5). Также пациенты имели бляшечный псориаз (для включения пациента в исследование диаметр бляшки должен был составить >2 см). Пациенты, ранее получавшие НПВП (86%), БПРП (80%), а также ГКС (24%). Пациенты, находившиеся на терапии метотрексатом (которая была стабильной на протяжении ≥2 мес), могли продолжать эту терапию с применением стабильной дозы метотрексата не более 25 мг/нед. Энбрел в дозе 25 мг (определенной в исследованиях по установлению оптимальной дозы у пациентов с ревматоидным артритом) или плацебо вводили п/к 2 раза в неделю в течение 6 мес. По завершении этого двойного слепого исследования пациенты могли принять участие в долгосрочном открытом расширенном исследовании общей продолжительностью до 2 лет.
Клинические ответы были выражены в доле пациентов, достигших показателя АКР 20; 50 и 70, и доле пациентов, у которых наблюдалось улучшение состояния согласно критериям ответа на лечение при псориатическом артрите (PsARC). Обобщенные результаты приведены в табл. 2.
Таблица 2
Ответ на лечение у пациентов с псориатическим артритом, полученный в плацебо-контролируемом исследовании
| Ответ на лечение при псориатическом артрите | Доля пациентов, % | |
| Плацебо (n=104) | Энбрелa (n=101) | |
| АКР 20 | ||
| 3-й месяц | 15 | 59 b |
| 6-й месяц | 13 | 50 b |
| АКР 50 | ||
| 3-й месяц | 4 | 38 b |
| 6-й месяц | 4 | 37 b |
| АКР 70 | ||
| 3-й месяц | 0 | 11 b |
| 6-й месяц | 1 | 9 c |
| PsARC | ||
| 3-й месяц | 31 | 72 b |
| 6-й месяц | 23 | 70 b |
| а25 мг Энбрел п/к 2 раза в неделю; bp<0,001 Энбрел по отношению к плацебо; cp<0,01, Энбрел по отношению к плацебо. | ||
У пациентов с псориатическим артритом, получавших Энбрел, клинический ответ был очевиден уже во время первого визита (через 4 нед) и сохранялся в течение 6 мес лечения. Энбрел по всем показателям, характеризующим активность заболевания, был достоверно лучше плацебо (р<0,001), а ответ на лечение — подобный как при одновременном применении метотрексата, так и без него. Качество жизни пациентов с псориатическим артритом оценивали в каждой контрольной временной точке с использованием индекса инвалидизации опросника HAQ. У пациентов с псориатическим артритом, получавших Энбрел, наблюдали достоверное улучшение показателя индекса инвалидизации в баллах во всех контрольных временных точках по сравнению с плацебо (р<0,001).
Оценку рентгенологических изменений проводили в ходе исследования среди пациентов с псориатическим артритом. Рентгенограммы руки/запястья и стопы получены перед началом исследования и через 6; 12 и 24 мес. Модифицированные показатели TSS через 12 мес представлены в табл. 3. Во время анализа, в котором все пациенты, выбывшие из исследования по любой причине, считались такими, которые имели прогресс, доля пациентов без прогресса (изменения показателя TSS≤0,5) на 12-м месяце была больше в группе пациентов, получавших Энбрел, по сравнению с группой плацебо (73% против 47% соответственно; р≤0,001). Положительное влияние препарата Энбрел на динамику рентгенологических изменений сохранялось у пациентов, продолжавших лечение в течение 2-го года. У лиц с симметричным полиартикулярным поражением суставов наблюдали замедление динамики повреждения периферических суставов.
Таблица 3
Средняя стандартная ошибка ежегодного изменения общего показателя Шарпа по сравнению с исходным уровнем
| Время | Плацебо (n=104) | Этанерцепт (n=101) |
| 12-й месяц | 1,00 (0,29) | –0,03 (0,09)а |
| аp=0,0001 | ||
Терапия препаратом Энбрел в течение периода двойного слепого исследования привела к улучшению функциональной активности, и такой результат лечения сохранялся при более долгосрочной фазе исследования, продолжавшейся до 2 лет.
Данных, подтверждающих эффективность препарата Энбрел у пациентов с такой псориатической артропатией, как артрит по типу анкилозирующего спондилита и мутилирующего артрита, недостаточно из-за небольшого количества участников исследования.
Исследовании режима дозирования 50 мг 1 раз в неделю у пациентов с псориатическим артритом не проводили. Данные, свидетельствующие об эффективности введения препарата 1 раз в неделю для этой группы пациентов, основываются на результатах исследования, проведенного у пациентов с анкилозирующим спондилитом.
Взрослые пациенты с анкилозирующим спондилитом
Эффективность препарата Энбрел у лиц с анкилозирующим спондилитом оценена в трех рандомизированных двойных слепых исследованиях, в ходе которых сравнивали применение 25 мг Энбрела 2 раза в неделю и плацебо. В эти исследования был привлечен 401 пациент, из которых 203 пациента получали Энбрел. В самое масштабное из этих исследований (n=277) были включены пациенты в возрасте от 18 до 70 лет с активным анкилозирующим спондилитом, признаками которого были: >30 баллов для показателей средней продолжительности заболевания и степени утренней скованности по визуальной аналоговой шкале (ВАШ) плюс >30 баллов (по шкале ВАШ) по крайней мере для 2 из 3 следующих параметров: общая оценка состояния пациента, средние значения по шкале ВАШ интенсивности ночной боли в спине и общего показателя боли в спине, среднее значение по результатам 10 ответов на вопросы, которые определяют функциональный индекс при анкилозирующем спондилите (Bath Ankylosing Spondylitis Functional Index — BASFI). Пациенты, применявшие БПРП, НПВП или ГКС, могли продолжать принимать их в стабильной дозе. Пациенты с полным анкилозом позвоночника не были включены в это исследование. Энбрел в дозе 25 мг (определенной в результате исследований по установлению оптимальной дозы у пациентов с ревматоидным артритом) или плацебо вводили п/к 2 раза в неделю в течение 6 мес 138 пациентам.
Основным критерием эффективности (ASAS 20) было улучшение на ≥20% по крайней мере в 3 из 4 категорий, лценки анкилозирующего спондилита (Аssessment in ankylosing spondylitis — ASAS), общая оценка состояния пациента, интенсивность боли в спине, BASFI и воспаление и отсутствие ухудшения в оставшейся категории. В показателях ASAS 50 и 70 использовали те же критерии, но улучшения должны составить 50 или 70% соответственно. По сравнению с плацебо, применение препарата Энбрел обусловило достоверное улучшение показателей ASAS 20; 50 и 70 уже через 2 нед после начала терапии.
Таблица 4
Ответ на лечение пациентов с анкилозирующим спондилитом, полученный в плацебо-контролируемом исследовании
| Ответ на лечение при анкилозирующем спондилите | Доля пациентов, % | |
| Плацебо (n=139) | Энбрел (n=138) | |
| ASAS 20 | ||
| 2 нед | 22 | 46а |
| 3 мес | 27 | 60а |
| 6 мес | 23 | 58а |
| ASAS 50 | ||
| 2 нед | 7 | 24а |
| 3 мес | 13 | 45а |
| 6 мес | 10 | 42а |
| ASAS 70 | ||
| 2 нед | 2 | 12b |
| 3 мес | 7 | 29b |
| 6 мес | 5 | 28b |
| ap<0,001 Энбрел по отношению к плацебо; bp=0,002, Энбрел по отношению к плацебо. | ||
У пациентов с анкилозирующим спондилитом, получавших Энбрел, клинический ответ был очевиден уже во время первого визита (через 2 нед) и сохранялся в течение 6 мес лечения. Ответы на терапию были аналогичными у пациентов, получавших или не получавших сопутствующую терапию на момент начала исследования.
Аналогичные результаты получены в двух небольших исследованиях у пациентов с анкилозирующим спондилитом.
В четвертом двойном слепом плацебо-контролируемом исследовании с участием 356 пациентов с активным анкилозирующим спондилитом оценивали безопасность и эффективность препарата Энбрел в дозе 50 мг (2 п/к инъекции по 25 мг), вводимого 1 раз в неделю, по сравнению с введением препарата Энбрел в дозе 25 мг 2 раза в неделю. Профили безопасности и эффективности режимов дозирования 50 мг 1 раз в неделю и 25 мг 2 раза в неделю были аналогичными.
Взрослые пациенты с бляшечным псориазом
Энбрел рекомендуется назначать пациентам, указанным в разделе ПОКАЗАНИЯ. Пациенты, у которых отсутствует эффект от лечения, в целевой популяции характеризуются недостаточным клиническим ответом (индекс площади поражения тела и тяжести псориаза (PASI) <50 или общая оценка состояния пациента врачом (PGA) «менее чем хорошо»), или обострением заболевания во время лечения, которое проводилось в надлежащих дозах в течение достаточного периода, чтобы можно было оценить ответ, с применением по меньшей мере каждого из трех основных имеющихся методов системной терапии.
Эффективность препарата Энбрел по отношению к другим системным методам лечения у пациентов со средним и тяжелым псориазом (чувствительным к применению других системных методов лечения) не оценивали в ходе исследований непосредственного сравнения препарата Энбрел с другими системными методами лечения. Зато безопасность и эффективность препарата Энбрел оценивали в четырех рандомизированных двойных слепых плацебо-контролируемых исследованиях. Первичным критерием эффективности во всех четырех исследованиях была часть пациентов в каждой группе исследования, достигших PASI 75 (то есть не менее 75% улучшения индекса PASI по сравнению с исходным показателем) через 12 нед.
Исследование 1 было II фазой исследования с привлечением пациентов в возрасте ≥18 лет с активным, но клинически стабильным бляшечным псориазом с поражением не менее 10% площади поверхности тела. 112 пациентов были рандомизированы для получения препарата Энбрел в дозе 25 мг (n=57) или плацебо (n=55) 2 раза в неделю в течение 24 нед.
В исследовании 2 участвовали 652 пациента с хроническим бляшечным псориазом. Для включения в исследование использовали те же критерии, что и в исследовании 1, дополнительно индекс PASI на момент скрининга должен был составить минимум 10. Энбрел вводили по 25 мг 1 раз в неделю, по 25 мг 2 раза в неделю или 50 мг 2 раза в неделю в течение 6 мес подряд. В течение первых 12 нед лечения (двойной маскируемый период исследования) пациенты получали плацебо или препарат Энбрел в одной из трех вышеуказанных дозах. Через 12 нед лечения пациенты с плацебо начинали получать маскированное лечение Энбрелом (25 мг 2 раза в неделю); пациенты групп активного лечения продолжали получать ту же дозу, что и была назначена им сначала по результатам рандомизации, до 24-й недели.
Исследование 3, в котором участвовали 583 пациента, имело такие же критерии включения в испытания, как и исследование 2. В ходе исследования пациенты получали по 25 или 50 мг Энбрела или плацебо 2 раза в неделю в течение 12 нед, затем в течение следующих 24 нед все пациенты открыто получали препарат Энбрел в дозе 25 мг 2 раза в неделю.
Исследование 4, в котором участвовали 142 пациента, имело такие же критерии включения в испытание, что и исследования 2 и 3. Пациенты получали по 50 мг препарата Энбрел или плацебо 1 раз в неделю в течение 12 нед, а затем все пациенты открыто получали Энбрел в дозе 50 мг 1 раз в неделю в течение 12 нед.
В исследовании 1 группа пациентов, получавших Энбрел, имела достоверно большую (30%) долю пациентов с показателем PASI 75 на 12-й неделе по сравнению с группой плацебо (2%) (р<0,0001). Через 24 нед 56% пациентов в группе, получавшей Энбрел, достигли PASI 75, по сравнению с 5% пациентов, получавших плацебо. Основные результаты исследований 2; 3 и 4 приведены в табл. 5.
Таблица 5
Ответы на лечение пациентов с псориазом, полученные в исследовании 2; 3 и 4
| Ответы (%) | Исследование 2 | Исследование 3 | Исследование 4 | ||||||||
| Плацебо | Энбрел | Плацебо | Энбрел | Плацебо | Энбрел | ||||||
| 25 мг 2 раза в неделю | 50 мг 1 раз в неделю | 25 мг 2 раза в неделю | 50 мг 1 раз в неделю | 50 мг 1 раз в неделю | 50 мг 1 раз в неделю | ||||||
| n=166 | n=162 | n=162 | n=164 | n=164 | n=193 | n=196 | n=196 | n=46 | n=96 | n=90 | |
| 12 нед | 12 нед | 24 недa | 12 нед | 24 недa | 12 нед | 12 нед | 12 нед | 12 нед | 12 нед | 24 нед a | |
| PASI 50 | 14 | 58* | 70 | 74* | 77 | 9 | 64* | 77* | 9 | 69* | 83 |
| PASI 75 | 4 | 34* | 44 | 49* | 59 | 3 | 34* | 49* | 2 | 38* | 71 |
| DSGAb чистая или почти чистая | 5 | 34* | 39 | 49* | 55 | 4 | 39* | 57* | 4 | 39* | 64 |
*р≤0,0001 по отношению к плацебо;aв исследованиях 2 и 4 на 24-й неделе статистические сравнения по отношению к плацебо не проводились, поскольку группа плацебо начала получать Энбрел 25 мг 2 раза в неделю или 50 мг 1 раз в неделю с 13-й по 24-ю неделю; bобщая статическая дерматологическая оценка. Полная очистка кожи (0 баллов) или почти полное очищение кожи (от 0 до 1 балла) определяется по 5-балльной шкале.
Среди пациентов с бляшечным псориазом, получавших Энбрел, статистически достоверные ответы по сравнению с плацебо были очевидными уже во время первого визита (через 2 нед) и сохранялись в течение 24 нед лечения.
Также в исследовании 2 был предусмотрен период отмены препарата, в течение которого пациенты, которые на 24-й неделе испытания достигли улучшения показателя PASI минимум на 50%, прекращали лечение. При отсутствии лечения пациентов наблюдали с целью выявления «синдрома рикошета» (PASI ≥150% исходного уровня) и определения времени возникновения рецидива заболевания (потеря по крайней мере половины улучшения, достигнутого на 24-й неделе по сравнению с исходным уровнем). При отмене лечения симптомы псориаза постепенно возвращались, при этом медиана времени до рецидива заболевания составляла 3 мес. Не наблюдалось ни «синдрома рикошета», ни связанных с псориазом серьезных побочных явлений. Получены данные, свидетельствующие о пользе повторного применения препарата Энбрел у пациентов, у которых наблюдали эффект от лечения.
В исследовании 3 большинство (77%) пациентов, которые изначально были отнесены к группе, получавшей препарат Энбрел по 50 мг 2 раза в неделю, а затем на 12-й неделе его доза была снижена до 25 мг 2 раза в неделю, сохранили достигнутые ими показатели PASI 75 до 36-й недели. У больных, получавших 25 мг препарата 2 раза в неделю в течение всего исследования, показатель PASI 75 продолжал улучшаться в течение 12–36 нед.
В исследовании 4 доля пациентов, достигших PASI 75, на 12-й неделе (38%) была больше в группе, получавшей Энбрел, по сравнению с таковой у плацебо (2%) (р<0,0001). Для больных, получавших 50 мг 1 раз в неделю в течение всего исследования, показатели эффективности продолжали улучшаться, при этом показателя PASI 75 на 24-й неделе достиг 71% пациентов.
В долгосрочных (продолжительностью до 34 мес) открытых исследованиях, в ходе которых Энбрел применяли непрерывно, клинический ответ был стабильным, а безопасность была сопоставима с таковой, отмечаемой в краткосрочных исследованиях.
Анализ результатов клинических исследований не выявил каких-либо характеристик заболевания, которые бы смогли помочь врачам в выборе нужного варианта дозирования (периодического или непрерывного). Итак, выбор периодического или непрерывного варианта лечения должен основываться на решении врача и индивидуальных потребностях пациента.
Антитела к препарату Энбрел
В плазме крови некоторых пациентов, получавших этанерцепт, выявлены антитела к нему. Все эти антитела не были нейтрализующими антителами и, как правило, со временем исчезали. Похоже, что корреляция между образованием антител и клиническим ответом или побочными явлениями отсутствует.
Совокупные показатели образования антител к этанерцепту у пациентов, получавших этанерцепт в назначенных дозах во время клинических испытаний в течение до 12 мес, составляли ≈6% у пациентов с ревматоидным артритом, 7,5% — с псориатическим артритом, 2% — с анкилозирующим спондилитом, 7% — с псориазом, 9,7% — у детей с псориазом и 3% — пациентов с ювенильным идиопатическим артритом.
Как и ожидалось, во время долгосрочных исследований (продолжительностью до 3,5 года) количество участников исследования, у которых возникли антитела к этанерцепту, увеличивалось со временем. Однако из-за их преходящего характера частота выявления антител в каждый момент определения, как правило, была <7% у пациентов с ревматоидным артритом и у лиц с псориазом.
В долгосрочном исследовании среди пациентов с псориазом, во время которого они получали дозу 50 мг 2 раза в неделю в течение 96 нед, частота выявления антител в каждый момент проведения оценки достигала ≈9%.
Дети с ювенильным идиопатическим полиартритом
Безопасность и эффективность препарата Энбрел оценивали в исследовании, состоявшем из двух частей и проводившемся с привлечением 69 детей с ювенильным идиопатическим полиартритом и различными типами начала этого заболевания. В него были включены пациенты в возрасте от 4 до 17 лет со средним и тяжелым активным ювенильным идиопатическим полиартритом, нечувствительные к метотрексату или с непереносимостью этого препарата; пациенты продолжали получать стабильную дозу одного НПВП и/или преднизолона (<0,2 мг/кг массы тела в сутки или максимум 10 мг). Во время первой части этого исследования у всех пациентов применяли Энбрел из расчета 0,4 мг/кг (максимальная разовая доза — 25 мг) п/к 2 раза в неделю. Во время второй части этого исследования проведена оценка обострения заболевания после рандомизированного распределения всех пациентов, у которых на 90-й день наблюдался клинический ответ на лечение, на две группы для продолжения лечения препаратом Энбрел или получения плацебо в течение 4 мес. Ответы на лечение оценивали по определению улучшения состояния при ювенильном ревматоидном артрите (ЮРА), который характеризуется улучшением не менее чем на 30% по крайней мере 3 из 6 и ухудшения не более чем на 30% и не более чем 1 из 6 основных критериев оценки ЮРА, к которым относятся количество суставов с признаками активного воспаления, ограничение подвижности, общая оценка состояния врачом и пациентом/родителями, оценка функционального состояния и СОЭ. Обострение заболевания определялось как ухудшение не менее чем на 30% 3 из 6 основных критериев оценки ЮРА и улучшения не более чем на 30% не более чем 1 из 6 основных критериев оценки ЮРА, а также как минимум 2 сустава с признаками активного воспаления.
В первой части исследования 51 (74%) из 69 пациентов продемонстрировал клинический ответ на лечение и перешел ко второй части исследования. Во второй части исследования обострение заболевания возникло у 6 (24%) из 25 пациентов, продолжавших получать Энбрел, по сравнению с 20 (77%) из 26 пациентов, получавших плацебо (р=0,007). Медиана времени от начала проведения второй части исследования и до возникновению обострения составляла ≥116 дней у пациентов, получавших Энбрел, и 28 дней у пациентов, получавших плацебо. У участников, у которых наблюдался клинический ответ через 90 дней и которые вошли во вторую часть исследования, некоторые пациенты, далее принимавшие препарат Энбрел, продолжали чувствовать улучшение состояния с 3-го по 7-й месяц, в то время как состояние тех, кто получал плацебо, не улучшилось.
Не проводились исследования с целью оценки эффекта длительного лечения препаратом Энбрел у тех пациентов с ювенильным идиопатическим полиартритом, у которых не был получен ответ на лечение в течение 3 мес от начала терапии препаратом Энбрел. Также не проводили оценку эффективности отмены или снижения рекомендованной дозы Энбрела при длительном лечении препаратом пациентов с ювенильным идиопатическим полиартритом.
Оценку длительного применения (в течение до 3 лет) монотерапии препаратом Энбрел (n=103), комбинации Энбрел и метотрексат (n=294), монотерапии метотрексатом (n=197) проводили с привлечением зарегистрированных 594 детей в возрасте от 2 до 18 лет с ювенильным идиопатическим полиартритом, из которых 39 детей были в возрасте от 2 до 3 лет. Чаще о возникновении инфекции сообщалось при проведении лечения этанерцептом, чем метотрексатом (3,8 и 2% соответственно), к тому же инфекции, связанные с применением этанерцепта, были более тяжолого характера.
Европейское агентство по лекарственным средствам отложило обязательства представлять результаты исследований препарата Энбрел среди одной или более подгрупп пациентов детского возраста с ювенильным идиопатическим полиартритом (см. ПРИМЕНЕНИЕ, Дети и подростки).
Дети с бляшечным псориазом
Эффективность препарата Энбрел оценивали в рандомизированном двойном слепом плацебо-контролируемом исследовании с участием 211 детей в возрасте от 4 до 17 лет с псориазом умеренной и тяжелой степени (который характеризовался следующими показателями: индекс sPGA не менее 3 баллов, пораженная площадь поверхности тела не менее 10%, индекс PASI не менее 12). Для удовлетворения критериев пригодности участия в исследовании пациенты должны были в прошлом получать фототерапию или системную терапию или не достигнуть надлежащего контроля над заболеванием при проведении местного лечения.
Пациентам вводили Энбрел из расчета 0,8 мг/кг (максимум — 50 мг) или плацебо 1 раз в неделю в течение 12 нед. На 12-й неделе исследования пациентов, с положительным ответом на лечение было больше среди участников, которые по результатам рандомизации применяли Энбрел (например PASI 75), чем среди рандомизированных для применения плацебо.
Таблица 6
Результаты лечения детей с бляшечным псориазом через 12 нед
| Показатель | Энбрел 0,8 мг/кг 1 раз в неделю (n=106) | Плацебо (n =105) |
| PASI 75, n (%) | 60 (57)a | 12 (11) |
| PASI 50, n (%) | 79 (75)a | 24 (23) |
| sPGA «чисто» или «минимум», n (%) | 56 (53) | 14 (13) |
| sPGA — статическая общая оценка состояния пациента врачом; ap<0,0001 по сравнению с плацебо. | ||
По окончании 12-недельного двойного слепого периода лечения все пациенты получали Энбрел из расчета 0,8 мг/кг (максимум — 50 мг) 1 раз в неделю в течение 24 дополнительных недель. Ответы на лечение, наблюдаемые во время открытого периода, были аналогичны тем, которые отмечали во время двойного слепого периода.
Во время рандомизированного периода отмены препарата у достоверно большего количества пациентов, которые по результатам повторной рандомизации получали плацебо, возник рецидив заболевания (потеря PASI 75) по сравнению с пациентами, которые по результатам повторной рандомизации получали Энбрел. При продолжении терапии ответ на лечение сохранялся в течение 48 нед.
Долгосрочная безопасность и эффективность препарата Энбрел в дозировке 0,8 мг/кг (максимальная доза — 50 мг) 1 раз в неделю была оценена в открытом продолжающемся исследовании с привлечением 181 ребенка с бляшечным псориазом продолжительностью до 2 лет вне 48 нед исследования, описанных выше. Долгосрочные исследования применения препарата Энбрел в целом сравнивали с оригинальными 48-недельными исследованиями. Различий в безопасности не выявлено.
Концентрацию этанерцепта в плазме крови определяли методом иммуноферментного анализа (ELISA), который может выявлять ELISA-химически активные продукты распада, а также исходное соединение.
Этанерцепт медленно абсорбируется из места п/к инъекции, достигая Сmax через ≈48 ч после введения однократной дозы. Абсолютная биодоступность составляет 76%. При введении препарата 2 раза в неделю ожидается, что равновесные концентрации будут вдвое выше наблюдаемых после введения разовых доз. После однократного п/к введения 25 мг этанерцепта средняя Сmax в плазме крови здоровых добровольцев составляла (1,65±0,66) мкг/мл, AUC — 235±96,6 мкг • ч/мл. Пропорциональность дозы формально не изучали, однако явного насыщения клиренса в пределах этого диапазона доз не наблюдалось.
Зависимость концентрации этанерцепта от времени описывается биэкспоненциальной кривой. Центральный объем распределения составляет 7,6 л, в то время как объем распределения в равновесном состоянии — 10,4 л. Этанерцепт медленно выводится из организма. T½ является длительным и составляет ≈70 ч. У пациентов с ревматоидным артритом клиренс составляет ≈0,066 л/ч, что несколько ниже этого показателя у здоровых добровольцев (0,11 л/ч). Фармакокинетика этанерцепта у пациентов с ревматоидным артритом, анкилозирующим спондилитом и бляшечным псориазом подобна.
При введении 50 мг препарата Энбрел 1 раз в неделю (n=21) и 25 мг препарата Энбрел 2 раза в неделю (n=16) показатели средних концентрации в плазме крови при равновесном состоянии у пациентов с ревматоидным артритом, получавших лечение, составляли: Cmax — 2,4 мг/л против 2,6 мг/л, Cmin — 1,2 мг/л против 1,4 мг/л и частичная AUC — 297 мг • ч/л против 316 мг • ч/л соответственно. В открытом перекрестном исследовании однократной дозы с двумя видами лечения, проводившемся с участием здоровых добровольцев, однократная инъекция 50 мг/мл этанерцепта была биоэквивалентна двум одновременным инъекциям препарата по 25 мг/мл.
По данным популяционного фармакокинетического анализа, проведенного у пациентов с анкилозирующим спондилитом, AUC этанерцепта в равновесном состоянии равнялась 466 и 474 мкг • ч/мл при введении препарата Энбрел в дозе 50 мг 1 раз в неделю (n=154) и 25 мг 2 раза в неделю (n=148) соответственно.
Хотя выведение радиоактивного вещества после введения радиоактивно меченного этанерцепта пациентам и здоровым добровольцам происходит с мочой, у пациентов с ОПН или острой печеночной недостаточностью повышение концентрации этанерцепта в плазме крови не наблюдалось. Нарушение функции почек или печени не требует коррекции дозы. Явных различий фармакокинетики этанерцепта у мужчин и женщин нет.
Метотрексат не влияет на фармакокинетику этанерцепта. Влияние Энбрела на фармакокинетику метотрексата у человека не исследовали.
Пациенты пожилого возраста
В популяционном фармакокинетическом анализе исследовано влияние пожилого возраста на фармакокинетику препарата. Рассчитанные показатели клиренса и объема распределения у пациентов в возрасте 65–87 лет были подобны пациентам моложе 65 лет.
Дети с ювенильным идиопатическим полиартритом
В исследовании с привлечением 69 детей в возрасте от 4 до 17 лет с ювенильным идиопатическим полиартритом препарат Энбрел вводили из расчета 0,4 мг/кг массы тела 2 раза в неделю в течение 3 мес. Профили концентрации в плазме крови были аналогичными таковым у взрослых пациентов с ревматоидным артритом. У детей младшего возраста (4 года) клиренс был пониженным (при стандартизации по массе тела клиренс был повышен) по сравнению с детьми старшего возраста (12 лет) и взрослыми. Моделирование дозирования позволяет предположить, что у детей старшего возраста (10–17 лет) и взрослых пациентов концентрации этанерцепта в плазме крови примерно одинаковые, а у детей младшего возраста они будут существенно ниже.
Дети с псориазом
Дети с бляшечным псориазом (в возрасте 4–17 лет) получали этанерцепт из расчета 0,8 мг/кг (максимальная доза — 50 мг/нед) 1 раз в неделю в течение 48 нед. Средние равновесные концентрации этанерцепта в плазме крови были в пределах 1,6–2,1 мкг/мл на 12; 24 и 48-й неделе. Вышеуказанные средние концентрации у детей с бляшечным псориазом были подобны тем, которые наблюдали у детей с ювенильным идиопатическим полиартритом при применении этанерцепта из расчета 0,4 мг/кг 2 раза в неделю (максимальная доза — 50 мг/нед). Эти значения были сходными с таковыми у взрослых пациентов с бляшечным псориазом, получавших этанерцепт в дозе 25 мг 2 раза в неделю.
Показания Энбрел
ревматоидный артрит
Энбрел в комбинации с метотрексатом показан для лечения при активном ревматоидном артрите от умеренной до тяжелой степени у взрослых в случаях, когда ответа на БПРП, включая метотрексат (при отсутствии противопоказаний), недостаточно.
Препарат можно назначать в монотерапии в случае непереносимости метотрексата или в случаях, когда длительное лечение метотрексатом нецелесообразно.
Также Энбрел показан для лечения при тяжелом активном и прогрессирующем ревматоидном артрите у взрослых пациентов, ранее не получавших терапию метотрексатом.
Доказано, что Энбрел, как в монотерапии, так и в комбинации с метотрексатом, замедляет динамику прогрессирования поражения суставов (по данным рентгенографии) и улучшает их функциональное состояние.
Полиартикулярный ювенильный идиопатический артрит
Лечение при активном полиартикулярном ювенильном идиопатическом артрите у детей и подростков в возрасте от 2 лет, у которых наблюдается недостаточная эффективность или непереносимость метотрексата. Применение Энбрел в возрасте младше 2 лет не исследовалось.
Псориатический артрит
Лечение при активном и прогрессирующем псориатическом артрите у взрослых в случаях недостаточного ответа на терапию БПРП. Энбрел продемонстрировал способность улучшать физическое состояние пациентов с псориатическим артритом и замедлять динамику прогрессирования поражения периферических суставов (по данным рентгенографии) у пациентов с полиартикулярными симметричными подтипами заболевания.
Анкилозирующий спондилит
Лечение взрослых с тяжелым активным анкилозирующим спондилитом в случаях недостаточной эффективности традиционной терапии.
Бляшечный псориаз
Лечение взрослых пациентов с бляшечным псориазом средней или тяжелой степени и противопоказанием к применению или непереносимостью другой системной терапии, включающей циклоспорин, метотрексат, псорален и ультрафиолетовое облучение А (PUVA-терапия), или если это лечение было неэффективным.
Бляшечный псориаз у детей
Лечение хронического тяжелого бляшковидного псориаза у детей и подростков в возрасте от 6 лет, у которых при применении других методов системной терапии или фототерапии не достигнуто достаточного контроля над заболеванием или наблюдалась непереносимость такого лечения.
Применение Энбрел
препарат вводят п/к.
Лечение препаратом Энбрел должно назначаться и контролироваться врачом, который имеет опыт в диагностике и лечении ревматоидного артрита, ювенильного идиопатического артрита, псориатического артрита, анкилозирующего спондилита, бляшковидного псориаза у взрослых и у детей.
Пациентам, получающим лечение препаратом Энбрел, необходимо выдать предупредительную карточку пациента (Patient Alert Card).
Перед введением препарат необходимо нагреть до комнатной температуры (оставить при комнатной температуре на 15–30 мин). Колпачок с иглы не следует снимать, пока предварительно наполненный шприц (ручка) не нагреется до комнатной температуры. Р-р должен быть прозрачным, бесцветным или бледно-желтым и практически не содержать видимых частиц.
Дозировка
Ревматоидный артрит
Рекомендуемая доза составляет 25 мг 2 раза в неделю. Альтернативно можно применять дозу 50 мг 1 раз в неделю, которая имеет доказанную безопасность и эффективность.
Псориатический артрит и анкилозирующий спондилит
Рекомендуемая доза составляет 25 мг 2 раза в неделю или 50 мг 1 раз в неделю.
Бляшечный псориаз
Рекомендуемая доза составляет 25 мг 2 раза в неделю или 50 мг 1 раз в неделю. Альтернативно Энбрел можно применять по 50 мг 2 раза в неделю в течение не более 12 нед. В дальнейшем при необходимости можно применять дозу 25 мг 2 раза в неделю или 50 мг 1 раз в неделю.
Терапию Энбрел следует продолжать до достижения ремиссии, на протяжении не более 24 нед. Для взрослых пациентов может быть целесообразным лечение на протяжении 24 нед (см. ФАРМАКОДИНАМИКА ). Терапию следует отменить при отсутствии эффекта лечения через 12 нед после начала применения препарата Энбрел. При необходимости повторного назначения препарата следует придерживаться рекомендаций относительно продолжительности лечения, указанных выше. Доза составляет 25 мг 2 раза в неделю или 50 мг 1 раз в неделю.
Особые группы пациентов
Пациенты с нарушением функции почек и печени
Потребности в коррекции дозы нет.
Пациенты пожилого возраста (>65 лет)
Потребности в коррекции дозы нет. Дозировка и способ применения такие же, как и для взрослых в возрасте 18–64 лет.
Дети и подростки
Полиартикулярний ювенильный идиопатический артрит (дети в возрасте ≥2 лет)
Рекомендуемая доза составляет 0,4 мг/кг массы тела (максимальная разовая доза — 25 мг) 2 раза в неделю в виде п/к инъекции с интервалом между дозами 3–4 дня. При отсутствии эффекта от лечения через 4 мес после начала применения препарата следует рассмотреть целесообразность его отмены.
Официальные клинические исследования применения препарата Энбрел в возрасте от 2 до 3 лет не проводились. Однако ограниченные данные по безопасности, полученные из реестра пациентов, позволяют предположить, что профиль безопасности у детей в возрасте от 2 до 3 лет подобный профилю безопасности у взрослых пациентов и детей в возрасте старше 4 лет при применении препарата каждую неделю п/к в дозе 0,8 мг/кг.
Обычно Энбрел не назначают детям в возрасте младше 2 лет при полиартикулярном ювенильном идиопатическом артрите.
Бляшечный псориаз у детей (дети в возрасте ≥6 лет)
Рекомендуемая доза составляет 0,8 мг/кг (максимальная разовая доза — 50 мг) 1 раз в неделю в течении не более 24 нед. При отсутствии эффекта от терапии через 12 нед лечение следует прекратить.
При необходимости повторного назначения препарата необходимо придерживаться вышеуказанных рекомендаций относительно продолжительности лечения. Рекомендуемая доза составляет 0,8 мг/кг (максимальная разовая доза — 50 мг) 1 раз в неделю.
Обычно Энбрел не назначают детям в возрасте младше 6 лет при бляшечном псориазе.
Противопоказания
повышенная чувствительность к действующему веществу или к любому из вспомогательных веществ. Сепсис или риск возникновения сепсиса. Не следует начинать лечение препаратом Энбрел пациентов с активными инфекционными процессами, включая хронические или локализованные инфекции.
Побочные эффекты
чаще сообщалось о развитии таких побочных реакций: реакции в месте введения (такие как кровотечение в месте прокалывания, покраснение, зуд, отек, боль), инфекции (такие как инфекции верхних дыхательных путей, бронхит, инфекции кожи, инфекции мочевого пузыря), аллергические реакции, образование антител, зуд и лихорадка.
Также сообщалось о возникновении тяжелых побочных реакций. Антагонисты ФНО, такие как Энбрел, влияют на иммунную систему, и их применение может воздействовать на иммунную защиту против инфекций и злокачественных опухолей. Тяжелые инфекции на фоне применения препарата Энбрел возникали у <1 пациента из 100. Отчеты включали сообщения о возникновении сепсиса, летальных инфекций и инфекций, угрожающих жизни. При применении препарата Энбрел сообщалось о возникновении различных злокачественных опухолей, включая злокачественные опухоли молочной железы, легких, кожи, лимфатических узлов (лимфома).
Сообщалось о развитии тяжелых гематологических, неврологических и аутоиммунных реакций, включая информацию о панцитопении (редко) и апластической анемии (очень редко). При применении Энбрела сообщалось о случаях центральной и периферической демиелинизации (редко и очень редко соответственно). Имеются сообщения о развитии системной красной волчанки, патологических состояний, связанных с ней, васкулита.
Нижеприведенный перечень побочных реакций основывается на результатах клинических испытаний у взрослых, а также на данных послерегистрационного надзора.
В каждом классе органов и систем побочные реакции приведены в соответствии с частотой их возникновения (количества пациентов, у которых ожидается развитие этой реакции) по следующим категориям: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10 000, <1/1000); очень редко (<1/10 000), неизвестно (нельзя рассчитать по имеющимся данным).
Инфекции и инвазии
Очень часто: инфекции (включая инфекции верхних дыхательных путей, бронхит, цистит, кожные инфекции)*. Нечасто: тяжелые инфекции (включая пневмонию, воспаление подкожной клетчатки, септический артрит, сепсис)*. Редко: туберкулез, оппортунистические инфекции (включая инвазивные грибковые, протозойные, бактериальные и атипичные микобактериальные инфекции)*.
Нарушения со стороны крови и лимфатической системы
Нечасто: тромбоцитопения. Редко: анемия, лейкопения, нейтропения, панцитопения*. Очень редко: апластическая анемия*.
Доброкачественные, злокачественные и неспецифические новообразования (включая кисты и полипы)
Нечасто: немеланомные злокачественные опухоли кожи (см. ОСОБЫЕ УКАЗАНИЯ). Редко: лимфома, меланома (см. ОСОБЫЕ УКАЗАНИЯ). Неизвестно: лейкемия, карцинома клеток Меркеля (см. ОСОБЫЕ УКАЗАНИЯ).
Нарушения со стороны иммунной системы
Часто: аллергические реакции (см. Нарушения со стороны кожи и подкожных тканей), образование аутоантител*. Нечасто: системный васкулит (включая васкулит, положительный к антинейтрофильным цитоплазматическим антителам). Редко: тяжелые аллергические/анафилактические реакции (включая ангионевротический отек, бронхоспазм), саркоидоз. Частота неизвестна: синдром активации макрофагов*.
Нарушения со стороны нервной системы
Редко: судороги; явления демиелинизации ЦНС, подобные наблюдаемым при рассеянном склерозе или состояниях локализованной демиелинизации, таких как неврит зрительного нерва и поперечный миелит (см. ОСОБЫЕ УКАЗАНИЯ). Очень редко: случаи периферической демиелинизации, включая синдром Гийена — Барре и мультифокальную моторную нейропатию (см. ОСОБЫЕ УКАЗАНИЯ).
Нарушения со стороны органа зрения
Нечасто: увеит.
Нарушения со стороны сердца
Редко: ухудшение течения застойной сердечной недостаточности (см. ОСОБЫЕ УКАЗАНИЯ).
Респираторные, торакальные и медиастинальные нарушения
Нечасто: интерстициальное заболевание легких (включая пневмонит и фиброз легких)*.
Нарушения со стороны гепатобилиарной системы
Редко: повышение уровней печеночных ферментов, аутоиммунный гепатит.
Нарушения со стороны кожи и подкожных тканей
Часто: зуд. Нечасто: ангионевротический отек, крапивница, сыпь, псориазоформные сыпь, псориаз (включая возникновение или ухудшение заболевания и пустулезный псориаз, преимущественно на ладонях и подошвах). Редко: кожные формы васкулита (включая лейкоцитокластический васкулит), синдром Стивенса — Джонсона, мультиформная эритема. Очень редко: токсический эпидермальный некролиз.
Нарушения со стороны костно-мышечной и соединительной ткани
Редко: подострая кожная красная волчанка, дискоидная красная волчанка, волчаночноподобный синдром.
Общие нарушения и реакции в месте введения
Очень часто: реакции в месте введения (включая кровотечение, образование подкожной гематомы, эритему, зуд, боль, отек *). Часто: лихорадка.
*Описание побочных реакции приведено ниже.
Злокачественные образования и лимфопролиферативные нарушения
129 случаев образования новых злокачественных опухолей различного типа выявлено у 4114 пациентов с ревматоидным артритом, получавших препарат Энбрел в ходе клинических испытаний в течение до ≈6 лет, в том числе у 231 пациента, получавшего Энбрел в комбинации с метотрексатом в течение 2 лет клинического исследования с активным контролем. Частота возникновения таких явлений и их распространенность в вышеуказанных клинических исследованиях были подобны ожидаемым для популяции, которая принимала участие в исследованиях.
В клинических испытаниях продолжительностью ≈2 года с участием 240 пациентов с псориатическим артритом, получавших препарат Энбрел, зафиксировано 2 случая возникновения злокачественных новообразований. В клинических исследованиях применения препарата Энбрел длительностью >2 лет с участием 351 пациента с анкилозирующим спондилитом зарегистрировано 6 случаев возникновения злокачественных новообразований. Сообщалось о 30 случаях развития злокачественных новообразований и 43 случаях немеланомного рака кожи во время двойных слепых и открытых исследований продолжительностью до 2,5 года с привлечением 2711 пациентов с бляшечным псориазом, получавших лечение препаратом Энбрел.
Сообщалось о 18 случаях возникновения лимфомы в ходе клинических исследований применения препарата Энбрел с привлечением 7416 пациентов с ревматоидным артритом, псориатическим артритом, анкилозирующим спондилитом и псориазом.
Также получены сообщения о случаях возникновения различных злокачественных новообразований (в том числе карциномы молочной железы, легких и лимфомы) в постмаркетинговый период (см. ОСОБЫЕ УКАЗАНИЯ).
Реакции в месте введения
В сравнении с плацебо у пациентов с ревматическими заболеваниями, у которых применяли препарат Энбрел, частота возникновения реакций в месте инъекции была значительно выше (36% против 9%). Реакции в месте инъекции, как правило, возникали в течение 1-го месяца. Средняя продолжительность составляла ≈3–5 дней. В большинстве случаев лечение реакций в месте инъекции не проводилось; большинство пациентов, получавших лечение, применяли препараты для местного применения, такие как ГКС или пероральные антигистаминные препараты. Кроме того, у некоторых участников возникали рецидивы реакций в месте инъекции, которые характеризовались появлением кожной реакции в месте осуществления последней инъекции с одновременным возникновением реакций на участках, где проводились предыдущие инъекции. Эти реакции, как правило, носили временный характер и не возникали повторно во время дальнейшего лечения.
Во время контролируемых исследований с привлечением пациентов с бляшечным псориазом в течение первых 12 нед лечения реакции в месте инъекции возникли у ≈13,6% пациентов, получавших Энбрел, по сравнению с 3,4% пациентов, получавших плацебо.
Тяжелые инфекции
В плацебо-контролируемых исследованиях не наблюдалось повышения частоты возникновения тяжелых инфекций (летальных, угрожающих жизни или требующих госпитализации или в/в введения антибиотиков). Тяжелые инфекции возникали у 6,3% пациентов с ревматоидным артритом, получавших Энбрел в течение 48 мес. К ним относились абсцесс (различной локализации), бактериемия, бронхит, бурсит, воспаление подкожной клетчатки, холецистит, диарея, дивертикулит, эндокардит (подозреваемый), гастроэнтерит, гепатит В, опоясывающий лишай, трофические язвы нижних конечностей, инфекции ротовой полости, остеомиелит, отит , перитонит, пневмония, пиелонефрит, сепсис, септический артрит, синусит, инфекции кожи, язвенные поражения кожи, инфекции мочевыводящих путей, васкулит и раневая инфекция. Частота возникновения серьезных инфекций во время 2-летнего исследования с активным контролем во всех группах была аналогичной (пациенты получали лечение препаратом Энбрел или метотрексатом в качестве монотерапии либо препаратом Энбрел в комбинации с метотрексатом). Однако нельзя исключать, что применение комбинации препарата Энбрел с метотрексатом может ассоциироваться с повышением частоты возникновения инфекций.
Во время плацебо-контролируемых испытаний продолжительностью до 24 нед не выявлено разницы в частоте возникновения инфекционных заболеваний у пациентов с бляшечным псориазом, которым применяли препарат Энбрел или плацебо. Тяжелые инфекции, отмеченные у пациентов, применявших Энбрел, включали воспаление подкожной клетчатки, гастроэнтерит, пневмонию, холецистит, остеомиелит, гастрит, аппендицит, асцит, обусловленный стрептококками, миозит, септический шок, дивертикулит и абсцесс. Один пациент сообщил о возникновении тяжелой инфекции (пневмонии) при проведении двойных слепых и открытых исследований применения этого препарата при псориатическом артрите.
Во время применения препарата Энбрел зарегистрированы тяжелые и летальные инфекции бактериальной, микобактериальной (включая микобактерии туберкулеза), вирусной и грибковой этиологии. Некоторые из них возникали в течение нескольких недель после начала применения препарата Энбрел у пациентов, которые, кроме ревматоидного артрита, имели основные заболевания (например сахарный диабет, застойную сердечную недостаточность, активные или хронические инфекции в анамнезе) (см. ОСОБЫЕ УКАЗАНИЯ). Применение Энбрел может повысить смертность у пациентов с диагностированным сепсисом.
Сообщалось о возникновении оппортунистических инфекций, в том числе инвазивных грибковых, протозойных, бактериальных (включая вызванных такими возбудителями, как Listeria и Legionella ) и атипичных микобактериальных инфекций, связанных с применением препарата Энбрел. Согласно совокупным данным, полученным в клинических испытаниях, для 15 402 участников исследований, получавших Энбрел, общая частота возникновения оппортунистических инфекций составляла 0,09%. Этот показатель, скорректированный с учетом экспозиции, составил 0,06 случая на 100 пациенто-лет. По данным постмаркетингового наблюдения, примерно половина сообщений со всего мира о развитии оппортунистических инфекций составили сообщения об инвазивных грибковых инфекциях, наиболее распространенными из которых были инфекции, вызванные Pneumocystis и Aspergillus .
Причиной более половины всех случаев смерти пациентов, у которых развились оппортунистические инфекции, были инвазивные грибковые инфекции. Большинство случаев с летальным исходом происходили у пациентов с пневмоцистной пневмонией, неустановленной системной грибковой инфекцией и аспергиллезом (см. ОСОБЫЕ УКАЗАНИЯ).
Аутоантитела
Образцы плазмы крови взрослых пациентов исследовали на наличие аутоантител в нескольких контрольных временных точках. Среди пациентов с ревматоидным артритом, у которых оценивали наличие антинуклеарных антител (АНА), доля пациентов, которые впервые стали положительными относительно образования АНА (≥1:40), была больше среди пациентов, получавших Энбрел (11%), по сравнению с пациентами, получавших плацебо (5%). Доля пациентов, которые впервые стали положительными относительно образованию антител к нативной двухцепочечной ДНК, также была больше среди лиц, получавших Энбрел (по данным радиоиммунного анализа: 15% пациентов, получавших Энбрел, и 4% — получавших плацебо; по данным теста с Crithidia luciliae — 3 и 0% соответственно). Аналогично количество пациентов, получавших лечение препаратом и у которых образовались антикардиолипиновые антитела, было больше, по сравнению с получавшими плацебо. Влияние длительного лечения Энбрелом на развитие аутоиммунных заболеваний неизвестно.
Поступали отдельные сообщения о пациентах, в том числе с положительным ревматоидным фактором, у которых образовались другие аутоантитела с одновременным возникновением волчаночноподобного синдрома или сыпи, которые по своей клинической картине и результатам биопсии напоминали подострую кожную волчанку или дискоидную волчанку.
Панцитопения и апластическая анемия
В постмаркетинговый период получены сообщения о случаях возникновения панцитопении и апластической анемии, некоторые — с летальным исходом (см. ОСОБЫЕ УКАЗАНИЯ).
Интерстициальное заболевание легких
В постмаркетинговый период получены сообщения о случаях возникновения интерстициального заболевания легких (включая пневмонит и фиброз легких), некоторые — с летальным исходом.
Сопутствующее лечение препаратом анакинры
В исследованиях, в ходе которых взрослые пациенты одновременно получали препараты Энбрел и анакинры, частота возникновения тяжелых инфекций была выше по сравнению с таковой при монотерапии препаратом Энбрел. У 3 (2%) пациентов из 139 развилась нейтропения (абсолютное число нейтрофилов <1000/мм3 ). На фоне нейтропении у одного пациента развилось воспаление подкожной клетчатки, которое было излечено в условиях стационара (см. ОСОБЫЕ УКАЗАНИЯ и ВЗАИМОДЕЙСТВИЯ).
Дети
Побочные эффекты у детей с ювенильным полиартикулярним идиопатическим артритом
В целом побочные эффекты у детей с ювенильным полиартикулярним идиопатическим артритом были подобными по частоте и типу наблюдаемым у взрослых пациентов. Отличия от взрослых и другие специфические данные, которые требуется учитывать, приведены ниже.
Типы инфекций, наблюдавшиеся в ходе клинических исследований с участием пациентов с ювенильным идиопатическим артритом в возрасте 2–18 лет, как правило, были легкой и средней степени тяжести и соответствовали тем, что, как правило, отмечаются у детей, которые лечатся амбулаторно. К зафиксированным тяжелым побочным реакциям принадлежали ветряная оспа с признаками и симптомами асептического менингита, которые проходили без всяких осложнений (см. ОСОБЫЕ УКАЗАНИЯ), аппендицит, гастроэнтерит, депрессия/расстройство личности, язвенные поражения кожи, эзофагит/гастрит, септический шок, вызванный стрептококком группы А, сахарный диабета 1-го типа и инфекция мягких тканей и послеоперационных ран.
В одном исследовании с привлечением детей с ювенильным идиопатическим артритом в возрасте 4–17 лет при применении препарата Энбрел в течение 3 мес (первая открытая часть исследования) инфекция возникла у 43 (62%) детей из 69. Частота возникновения и тяжесть инфекций у 58 пациентов, завершивших ранее начатое лечение во время 12-месячного открытого клинического исследования, были аналогичными. Виды и соотношение побочных явлений у пациентов с ювенильным идиопатическим артритом были подобны отмеченным в исследованиях препарата Энбрел с привлечением взрослых пациентов с ревматоидным артритом. Большинство из них были легкими. Некоторые побочные реакции наблюдали чаще у 69 пациентов с ювенильным идиопатическим артритом, получавших лечение препаратом Энбрел в течение 3 мес, по сравнению с 349 взрослыми пациентами с ревматоидным артритом. К ним относятся головная боль (19% пациентов, 1,7 случая на 1 пациента в год), тошнота (9%, 1,0 случай на 1 пациента в год), боль в животе (19%, 0,74 случая на 1 пациента в год) и рвота (13%, 0,74 случая на 1 пациента в год).
При проведении клинических испытаний у пациентов с ювенильным идиопатическим артритом зарегистрировано 4 сообщения о возникновении синдрома активации макрофагов.
В постмаркетинговый период получены сообщения о случаях развития воспаления кишечника у пациентов с ювенильным идиопатическим артритом, применявших Энбрел, включая незначительное количество случаев восстановления побочной реакции при повторном назначении препарата (см. ОСОБЫЕ УКАЗАНИЯ).
Побочные эффекты у детей с бляшечным псориазом
В 48-недельном исследовании с участием 211 детей с бляшечным псориазом в возрасте 4–17 лет побочные эффекты были подобны тем, которые наблюдались в предыдущих исследованиях с привлечением взрослых пациентов с бляшечным псориазом.
Особые указания
Инфекции
Пациентов необходимо обследовать на наличие инфекций до назначения препарата Энбрел, во время лечения и после окончания курса терапии, учитывая, что средний T½ этанерцепта составляет ≈70 ч (7–300 ч).
При применении препарата Энбрел сообщалось о развитии тяжелых инфекций, сепсиса, туберкулеза и оппортунистических инфекций, включая инвазивные грибковые инфекции (см. ПОБОЧНЫЕ ЭФФЕКТЫ). Эти инфекции были вызваны бактериями, микобактериями, грибами и вирусами. В некоторых случаях специфический вид грибковой или другой оппортунистической инфекции не был определен, что приводило к задержке назначения необходимого лечения, а иногда к летальному исходу. При обследовании пациентов на наличие инфекций следует принимать во внимание риск наличия у пациента определенных оппортунистических инфекций (например влияние эндемичных микозов).
Пациенты, у которых на фоне лечения препаратом Энбрел возникают новые инфекционные заболевания, должны находиться под тщательным наблюдением. В случае развития тяжелой инфекции применение препарата Энбрел следует отменить. Эффективность и безопасность применения препарата Энбрел у лиц с хроническими инфекционными заболеваниями не оценивали. Врачи должны с осторожностью назначать Энбрел пациентам с рецидивирующими или хроническими инфекциями в анамнезе или лицам, основные заболевания которых могут способствовать развитию инфекции (например прогрессирующий или плохо контролируемый диабет).
Туберкулез
Сообщалось о случаях возникновения активного туберкулеза, в том числе милиарного туберкулеза и туберкулеза внелегочной локализации у пациентов, получавших Энбрел.
Перед началом терапии препаратом Энбрел все пациенты должны быть обследованы относительно наличия как активного, так и неактивного (латентного) туберкулеза. Это обследование должно включать детальное изучение медицинского анамнеза, в том числе индивидуального анамнеза заболевания туберкулезом или возможных контактов с больными туберкулезом в прошлом, и данных по проведенной ранее или текущей иммуносупрессивной терапии. Всем пациентам следует провести необходимые скрининговые тесты, то есть туберкулиновую кожную пробу и рентгенографию легких (можно применять местные рекомендации). Рекомендуется занести информацию о проведении этих обследований в предупредительную карточку пациента ( Patient Alert Card). Врачам следует помнить о риске получения ложноотрицательных результатов туберкулиновой кожной пробы, особенно у тяжелобольных или у лиц с ослабленным иммунитетом.
В случае диагностирования активного туберкулеза не следует начинать лечение препаратом Энбрел. В случае диагностирования неактивного (латентного) туберкулеза перед началом применения Энбрела необходимо провести противотуберкулезную терапию латентного туберкулеза в соответствии с местными рекомендациями. В такой ситуации следует тщательно проанализировать соотношение польза/риск лечения.
Все пациенты должны быть проинформированы о необходимости обратиться к врачу в случае появления во время или после лечения препаратом Энбрел признаков или симптомов, характерных для туберкулеза (например постоянный кашель, истощение/потеря массы тела, субфебрильная температура тела).
Реактивация вируса гепатита В
Сообщалось о случаях реактивации вируса гепатита В у его хронических носителей, получавших ингибиторы ФНО, в том числе Энбрел. Перед началом лечения препаратом Энбрел пациентам, относящимся к группе риска заболевания гепатитом В, необходимо провести соответствующие диагностические тесты с целью выявления признаков инфицирования вирусом гепатита В. Пациентам, которые являются носителями вируса гепатита В, следует с особой осторожностью назначать препарат Энбрел. Если Энбрел применяют у таких пациентов, то необходимо контролировать появление признаков и симптомов активной инфекции гепатита В и при необходимости — начать соответствующее лечение.
Обострение гепатита С
Зарегистрированы случаи обострения гепатита С у пациентов, получающих Энбрел. Поэтому его с осторожностью назначают пациентам с гепатитом С в анамнезе.
Сопутствующее лечение препаратом анакинры
Одновременное применение препаратов Энбрел и анакинры сопровождалось повышенным риском возникновения тяжелых инфекций и нейтропении по сравнению с монотерапией препаратом Энбрел. Такая комбинация не продемонстрировала увеличение клинических преимуществ, поэтому применение такой комбинации не рекомендуется (см. ПОБОЧНЫЕ ЭФФЕКТЫ и ВЗАИМОДЕЙСТВИЯ).
Сопутствующее лечение препаратом абатацепт
В клинических исследованиях одновременное применение препаратов абатацепт и Энбрел привело к повышению частоты возникновения серьезных побочных реакций. Эта комбинация не показала увеличения клинических преимуществ, поэтому такое применение не рекомендуется (см. ВЗАИМОДЕЙСТВИЯ).
Аллергические реакции
Колпачок иглы предварительно наполненного шприца/ручки содержит латекс (сухую натуральную резину), который может вызвать реакции повышенной чувствительности у лиц с известной или предполагаемой чувствительностью к латексу.
Введение препарата Энбрел часто сопровождалось возникновением аллергических реакций.
Аллергические реакции включали ангионевротический отек и крапивницу; были случаи возникновения тяжелых реакций. При возникновении любых тяжелых аллергических или анафилактических реакций терапию препаратом Энбрел следует немедленно прекратить и начать соответствующее лечение.
Иммуносупрессия
Не исключена возможность того, что антагонисты ФНО, включая Энбрел, влияют на защитные механизмы организма человека против инфекций и злокачественных новообразований, поскольку ФНО участвует в процессах воспаления и модулирует клеточный иммунный ответ. В исследовании с участием 49 взрослых пациентов с ревматоидным артритом, которые применяли Энбрел, не выявлено случаев угнетения реакций гиперчувствительности замедленного типа, снижения уровня иммуноглобулина или изменения численности популяции клеток-эффекторов.
У двух пациентов с ювенильным идиопатическим артритом возникла ветряная оспа, признаки и симптомы асептического менингита, которые прошли без осложнений. Пациентам, которые были в контакте с больными ветряной оспой, следует временно прекратить терапию препаратом Энбрел и назначить профилактическое лечение иммуноглобулином против вируса Varicella Zoster.
Эффективность и безопасность препарата Энбрел у пациентов с подавленным иммунитетом или хроническими инфекциями не оценивали.
Злокачественные и лимфопролиферативные заболевания
Солидные и онкогематологические злокачественные новообразования (за исключением рака кожи)
В постмаркетинговый период (см. ПОБОЧНЫЕ ЭФФЕКТЫ) получены сообщения о возникновении различных злокачественных новообразований (включая карциному молочной железы и легкого, а также лимфому).
Во время контролируемых клинических исследований антагонистов ФНО среди пациентов, получавших ингибиторы ФНО, наблюдалось больше случаев развития лимфомы, по сравнению с контрольной группой. Однако эти случаи были единичными, а период наблюдения пациентов, получавших плацебо, был короче, чем лиц, получавших лечение ингибиторами ФНО. В постмаркетинговый период сообщалось о случаях развития лейкемии у пациентов, получавших терапию антагонистами ФНО. У пациентов с ревматоидным артритом и с длительным высокоактивным воспалительным заболеванием существует повышенный исходный риск возникновения лимфомы или лейкемии, что затрудняет оценку риска.
Согласно актуальной на сегодняшний день информации, нельзя исключать риск развития лимфом, лейкемии или других солидных и онкогематологических злокачественных новообразований у пациентов, получающих антагонисты ФНО. Необходимо проявлять осторожность, анализируя необходимость терапии антагонистами ФНО у пациентов со злокачественными новообразованиями в анамнезе или продолжения терапии у пациентов, у которых возникли злокачественные новообразования.
В постмаркетинговый период получены сообщения о возникновении злокачественных новообразований, иногда с летальным исходом, у детей, подростков и взрослых пациентов молодого возраста (до 22 лет), получавших лечение антагонистами ФНО (лечение было начато в возрасте младше 18 лет), включая Энбрел. Примерно в половине случаев сообщалось о развитии лимфомы. Другие полученные сообщения касались возникновения ряда различных злокачественных новообразований и включали единичные случаи типичных злокачественных новообразований, связанных с иммунитетом. Риск развития злокачественных новообразований у детей и подростков, получающих лечение антагонистами ФНО, не может быть исключен.
Рак кожи
У пациентов, получавших лечение антагонистами ФНО, включая Энбрел, зарегистрированы случаи развития меланомы и немеланомного рака кожи. В постмаркетинговый период получены сообщения (очень редко) о развитии карциномы клеток Меркеля у пациентов, применявших препарат Энбрел. Рекомендуется периодически проводить обследование кожи всем пациентам, особенно с факторами риска возникновения рака кожи.
Объединенные результаты контролируемых клинических испытаний показали, что случаев развития немеланомного рака кожи наблюдалось больше у пациентов, получавших Энбрел, сравнению с контрольной группой, особенно у больных псориазом.
Вакцинации
Не следует применять живые вакцины одновременно с препаратом Энбрел. Нет данных по вторичной передачи инфекции через живую вакцину пациентам, которых лечат препаратом Энбрел. В двойном слепом плацебо-контролируемом рандомизированном клиническом исследовании с привлечением взрослых пациентов с псориатическим артритом 184 пациента на 4-й неделе исследования получили пневмококковую поливалентную полисахаридную вакцину. У большинства больных, применявших Энбрел, смог сформироваться эффективный гуморальный иммунный ответ на введение пневмококковой полисахаридной вакцины, но титры в целом были несколько ниже, и только у нескольких пациентов титры антител были вдвое выше тех, что наблюдались у пациентов, не получавших Энбрел. Клиническое значение этого факта неизвестно.
Образование аутоиммунных антител
Лечение препаратом Энбрел может вызвать образование аутоиммунных антител (см. ПОБОЧНЫЕ ЭФФЕКТЫ).
Гематологические реакции
У пациентов, получавших Энбрел, зафиксированы случаи панцитопении (редко) и случаи апластической анемии (очень редко), в том числе с летальным исходом. Следует с осторожностью назначать препарат Энбрел пациентам, имеющим в анамнезе гематологические нарушения (дискразию крови). Всех пациентов и лиц, ухаживающих за больным, следует проинформировать о необходимости немедленного обращения за медицинской помощью, если во время лечения Энбрелом у пациента возникают признаки и симптомы, характерные для патологических изменений крови или инфекций (например стойкое повышение температуры тела, боль в горле, образование гематом, кровотечение, бледность кожных покровов). Необходимо немедленно провести обследование таких пациентов, включая полный анализ крови; в случае подтверждения гематологического нарушения терапию следует прекратить.
Нарушения со стороны ЦНС
У пациентов, получавших Энбрел, отмечали случаи возникновения демиелинизирующих заболеваний ЦНС (см. ПОБОЧНЫЕ ЭФФЕКТЫ). Также очень редко сообщалось о возникновении периферической демиелинизирующей полинейропатии (включая синдром Гийена — Барре, хроническую воспалительную демиелинизирующую полинейропатию, демиелинизирующую полинейропатию и мультифокальную моторную нейропатию). Хотя клинические исследования по применению препарата Энбрел больным рассеянным склерозом не проводились, клинические испытания других ингибиторов ФНО показали повышение активности заболевания (рассеянного склероза). Перед назначением препарата Энбрел пациентам с существующим или с недавно диагностированным демиелинизирующим заболеванием, а также лицам группы повышенного риска развития такого заболевания, рекомендуется тщательно оценить соотношение польза/риск, включая неврологический статус.
Комбинированная терапия
В контролируемом клиническом исследовании применение комбинации препаратов Энбрел и метотрексат на протяжении 2 лет, проведенном с привлечением пациентов с ревматоидным артритом, не получено неожиданных результатов безопасности. Профиль безопасности препарата Энбрел был подобен профилям, наблюдаемым в исследованиях препаратов Энбрел и метотрексат отдельно. Долгосрочные исследования по изучению безопасности этой комбинации все еще продолжаются. Безопасность длительного применения препарата Энбрел в комбинации с другими БПРП не установлена.
Применение этанерцепта в комбинации с другими системными методами лечения псориаза или фототерапией не исследовано.
Нарушение функции почек и печени
Фармакокинетические данные свидетельствуют о том, что необходимости корректировать дозу у пациентов с нарушением функции почек или печени нет; опыт клинического применения препарата у таких пациентов ограничен.
Застойная сердечная недостаточность
Врач должен с осторожностью назначать препарат Энбрел пациентам с застойной сердечной недостаточностью. В постмаркетинговый период поступали сообщения об ухудшении течения застойной сердечной недостаточности у пациентов, получавших Энбрел, при этом провоцирующие факторы не всегда были выявлены. Два больших клинических исследования, оценивающих применение препарата Энбрел в лечении при застойной сердечной недостаточности, были досрочно прекращены из-за недостаточной эффективности. Данные, полученные в одном из этих испытаний, хотя и не являются убедительными, позволяют предположить возможность ухудшения течения застойной сердечной недостаточности у пациентов, применявших препарат Энбрел.
Алкогольный гепатит
Во II фазе рандомизированного плацебо-контролируемого исследования с привлечением 48 госпитализированных пациентов, получавших Энбрел или плацебо для лечения при средней и тяжелой степени алкогольного гепатита, Энбрел оказался неэффективным, и через 6 мес смертность среди пациентов, получавших Энбрел, была значительно выше. Таким образом, Энбрел не следует применять пациентам в качестве средства для лечения при алкогольном гепатите. Врач должен с осторожностью применять Энбрел у пациентов со средней и тяжелой степенью алкогольного гепатита.
Гранулематоз Вегенера
Плацебо-контролируемое исследование, в котором 89 взрослых пациентов получали Энбрел дополнительно к стандартной терапии (в том числе циклофосфамидом или метотрексатом и ГКС) в течение в среднем 25 мес, не продемонстрировало эффективности Энбрела при лечении гранулематоза Вегенера. Частота развития злокачественных опухолей различного типа некожной локализации была значительно выше у пациентов, получавших Энбрел, по сравнению с контрольной группой. Поэтому Энбрел не рекомендуется применять для лечения гранулематоза Вегенера.
Гипогликемия у пациентов, получающих лечение от диабета
Сообщалось о случаях развития гипогликемии после начала применения препарата Энбрел пациентам, получающим препараты для лечения сахарного диабета, что приводило к необходимости снижать дозу противодиабетических препаратов некоторым из них.
Особые популяции
Пациенты пожилого возраста (>65 лет)
В III фазе исследований c привлечением больных ревматоидным артритом, псориатическим артритом и анкилозирующим спондилитом в целом не наблюдалось разницы в развитии побочных реакций, тяжелых побочных реакций и тяжелых инфекций у пациентов пожилого возраста (>65 лет), которые применяли препарат Энбрел, и были подобны таковым, наблюдавшимся у пациентов более молодого возраста. Однако необходимо соблюдать осторожность при лечении лиц пожилого возраста и особое внимание следует проявлять относительно возникновения инфекций.
Дети
Вакцинации
Рекомендуется, по возможности, до начала лечения препаратом Энбрел пациентам детского возраста сделать все прививки, в соответствии с действующим Национальным календарем прививок (см. Вакцинации).
Воспалительные заболевания пищеварительного тракта у пациентов с ювенильным идиопатическим артритом
Сообщалось о возникновении воспалительных заболеваниях пищеварительного тракта у пациентов с ювенильным идиопатическим артритом на фоне применения препарата Энбрел (см. ПОБОЧНЫЕ ЭФФЕКТЫ).
Применение в период беременности и кормления грудью
Беременность. Исследования применения препарата Энбрел у беременных не проводились, поэтому его не рекомендуется применять в период беременности.
В исследованиях токсического воздействия на развитие, которые проводили у крыс и кроликов, не выявили признаков вредного влияния этанерцепта на плод или потомство.
Женщинам детородного возраста следует использовать надлежащие способы контрацепции во избежание беременности во время применения препарата Энбрел и в течение 3 нед после окончания терапии.
Доклинические данные по пре- и постнатальной токсичности этанерцепта или влияния этанерцепта на фертильность и общую репродуктивную способность отсутствуют.
Кормление грудью. Неизвестно, выделяется ли этанерцепт с грудным молоком человека. После п/к введения крысам в период лактации этанерцепт проникал в грудное молоко и определялся в плазме крови крыс. Поскольку иммуноглобулины, как и многие другие лекарственные средства, могут выделяться с молоком человека, следует принять решение о прекращении кормления грудью или об отмене препарата Энбрел. При принятии решения следует принимать во внимание соотношение пользы от грудного кормления для ребенка и пользы от терапии для матери.
Способность влиять на скорость реакции при управлении транспортными средствами и работе с другими механизмами
Исследования по изучению влияния препарата на способность управлять транспортными средствами и работать с механизмами не проводились.
Взаимодействия
одновременное применение препарата анакинры
У пациентов на фоне одновременного лечения препаратами Энбрел и анакинры наблюдалось повышение частоты возникновения тяжелых инфекций по сравнению с пациентами, получавшими только Энбрел или препараты анакинры (по данным анамнеза ).
Кроме этого, в двойном слепом плацебо-контролируемом исследовании, проведенном с участием взрослых пациентов, которые на фоне лечения метотрексатом получали препараты Энбрел и анакинры, наблюдалось повышение частоты возникновения тяжелых инфекций (7%) и нейтропении по сравнению с пациентами, получавшими только Энбрел ( см. ОСОБЫЕ УКАЗАНИЯ и ПОБОЧНЫЕ ЭФФЕКТЫ).
Комбинация препаратов Энбрел и анакинры не продемонстрировала повышенной клинической пользы, поэтому она не рекомендуется к применению.
Одновременное применение препарата абатацепт
В клинических исследованиях одновременное применение абатацепта и препарата Энбрел приводило к повышению частоты возникновения тяжелых побочных реакций. Такая комбинация не продемонстрировала повышенной клинической пользы и поэтому не рекомендуется к применению.
Одновременное применение препарата Энбрел и сульфасалазина
В клиническом исследовании с привлечением взрослых пациентов, которые на фоне лечения стандартными дозами сульфасалазина получали Энбрел, наблюдалось статистически значимое уменьшение среднего количества лейкоцитов у пациентов, применявших эту комбинацию, по сравнению с пациентами, получавшими только Энбрел или сульфасалазин. Клиническое значение этой комбинации неизвестно. Врач должен соблюдать осторожность при назначении вышеуказанной комбинации.
Отсутствие взаимодействия
В клинических исследованиях не наблюдалось никаких взаимодействий при одновременном применении Энбрела с ГКС, салицилатами (за исключением сульфасалазина), НПВП, анальгетиками или метотрексатом. О рекомендациях по вакцинации см. ОСОБЫЕ УКАЗАНИЯ. Не наблюдалось никаких клинически значимых фармакокинетических взаимодействий при исследованиях с дигоксином или варфарином.
Несовместимость
Не следует смешивать Энбрел с другими лекарственными средствами, поскольку исследования совместимости этанерцепта не проводились.
Передозировка
при проведении клинических испытаний с привлечением пациентов с ревматоидным артритом не зарегистрировано никаких токсических явлений, требовавших ограничения дозы. Наивысшей дозой среди оцениваемых была доза нагрузки 32 мг/м2 поверхности тела (в/в), с последующим введением 16 мг/м2 (п/к) 2 раза в неделю. Один пациент с ревматоидным артритом ошибочно самостоятельно вводил по 62 мг препарата Энбрел п/к 2 раза в неделю в течение 3 нед, при этом никаких побочных эффектов у него не возникло. Специфический антидот для препарата Энбрел неизвестен.
Условия хранения
при температуре от 2 до 8 °С. Не замораживать.
