Пролиа® (Prolia®)
Пролиа инструкция по применению
Состав
Деносумаб - 60 мг/мл
Фармакологические свойства
фармакодинамика. Деносумаб — это моноклональное антитело человека (IgG2), произведенное на клеточной линии млекопитающих (CHO) с помощью технологии рекомбинантной ДНК, мишенью для которого является RANKL, с последним препарат связывается с высокой аффинностью и специфичностью, предотвращая активацию его рецептора RANK на поверхности прекурсоров, остеокластов и остеобластов. Предотвращение взаимодействия RANKL/RANK угнетает образование остеокластов, ухудшает их функционирование и жизнеспособность, таким образом уменьшая резорбцию как трубчатых, так и губчатых костей.
Фармакодинамические эффекты. Лечение препаратом Пролиа быстро снижает уровень костного ремоделирования, достигая наиболее низкого уровня сывороточного маркера резорбции костей — С-телопептидов коллагена 1-го типа (СТХ) (снижение на 85%) — через 3 дня и сохраняясь на протяжении всего интервала между дозами. В конце каждого периода после введения дозы препарата выраженность эффекта снижения уровня СТХ была частично уменьшена: с максимального снижения на >87% до снижения приблизительно на >45% (в диапазоне 45–80%), что отображает обратимость эффектов деносумаба относительно ремоделирования костной ткани после снижения уровня препарата в сыворотке крови. При продолжении терапии эти эффекты сохранялись.
Маркеры ремоделирования костной ткани в целом достигали уровней, которые отмечали до начала лечения препаратом, на протяжении 9 мес после введения последней дозы. После повторной инициации лечения уровень ингибирования СТХ деносумабом был подобен таковому у пациентов, которые впервые начали лечение этим препаратом.
Иммуногенность. По данным клинических исследований, во время применения препарата Пролиа не отмечена выработка нейтрализующих антител. Менее 1% пациентов, применявших деносумаб не более 5 лет, имели положительные тесты (по данным чувствительного иммунологического метода) на нейтрализующие связывающие антитела без признаков влияния на фармакокинетику, токсичность или клинический эффект.
Лечение остеопороза у женщин в постменопаузальный период. Эффективность и безопасность препарата Пролиа, который применяли 1 раз каждые 6 мес в течение 3 лет, исследовали у женщин в постменопаузальный период (7808 женщин в возрасте 60 лет–91 год, из которых у 23,6% отмечали распространенные переломы позвонков) с исходными Т-показателями минеральной плотности костей (МПК) в поясничном отделе позвоночника или тазобедренном сочленении между –2,5 и –4,0 и средней абсолютной 10-летней вероятностью перелома 18,60% (децили: 7,9–32,4%) в отношении основных остеопоротических переломов и 7,22% (децили: 1,4–14,9%) относительно перелома шейки бедра. Женщины с другими заболеваниями или лечившиеся препаратами, которые могут влиять на костную ткань, были исключены из исследования. Женщины получали добавки кальция (по крайней мере 1000 мг) и витамина D (по крайней мере 400 МЕ) ежедневно.
Влияние на переломы позвонков. Пролиа значительно снижает риск возникновения новых переломов позвонков на 1-, 2- и 3-м году применения препарата (р <0,0001) (табл. 1).
Таблица 1. Влияние Пролиа на риск новых переломов позвонков
| Период применения | Доля женщин с переломом, % | Снижение абсолютного риска, % (95% ДИ) | Снижение относительного риска, % (95% ДИ) | |
|---|---|---|---|---|
| Плацебо, n=3906 | Пролиа, n=3902 | |||
| 0–1 год | 2,2 | 0,9 | 1,4 (0,8–1,9) | 61 (42–74)** |
| 0–2 года | 5,0 | 1,4 | 3,5 (2,7–4,3) | 71 (61–79)** |
| 0–3 года | 7,2 | 2,3 | 4,8 (3,9–5,8) | 68 (59–74)* |
*p<0,0001, **p<0,0001 — информационный анализ.
Влияние на переломы шейки бедра. Препарат Пролиа продемонстрировал относительное снижение на 40% (0,5% снижение абсолютного риска) риска перелома шейки бедра в течение 3 лет (р<0,05). Частота переломов шейки бедра составила 1,2% в группе плацебо по сравнению с 0,7% в группе Пролиа через 3 года.
При апостериорном анализе у женщин в возрасте >75 лет снижение относительного риска на 62% наблюдалось при применении препарата Пролиа (1,4% снижение абсолютного риска; р<0,01).
Влияние на все клинические переломы. Применение препарата Пролиа значительно уменьшило количество переломов всех типов (табл. 2).
Таблица 2. Влияние Пролиа на риск клинических переломов в течение 3 лет
| Типы переломов | Доля женщин с переломом, %+ | Снижение абсолютного риска, % (95% ДИ) | Снижение относительного риска, % (95% ДИ) | |
|---|---|---|---|---|
| Плацебо, n=3906 | Пролиа, n=3902 | |||
| Любой клинический перелом1 | 10,2 | 7,2 | 2,9 (1,6–4,2) | 30 (19–41)*** |
| Клинический вертебральный перелом | 2,6 | 0,8 | 1,8 (1,2–2,4) | 69 (53–80)*** |
| Невертебральный перелом2 | 8,0 | 6,5 | 1,5 (0,3–2,7) | 20 (5–33)** |
| Главный невертебральный перелом3 | 6,4 | 5,2 | 1,2 (0,1–2,2) | 20 (3–34)* |
| Главный остеопоротический перелом4 | 8,0 | 5,3 | 2,7 (1,6–3,9) | 35 (22–45)*** |
*p≤0,05; **p=0,0106 (вторичная конечная точка включена в регулирование кратности); ***р≤0,0001.
+Частота событий базируется на расчете по методу Каплана — Мейера в течение 3 лет.
1Включает клинические вертебральные и невертебральные переломы.
2Исключает переломы позвонков, черепа, лица, нижней челюсти, кисти и фаланг пальцев рук и ног.
3Включает таз, дистальный отдел бедра, проксимальный отдел большеберцовой кости, ребра, проксимальный отдел плечевой кости, предплечья и бедра.
4Включает клинические вертебральные переломы, переломы шейки бедра, предплечья и плечевой кости, как это определено ВОЗ.
У женщин с исходным уровнем МПК шейки бедра ≤–2,5 препарат Пролиа снижает риск невертебральных переломов (35% снижение относительного риска, 4,1% снижение абсолютного риска (р<0,001), информационный анализ).
Снижение частоты новых вертебральных переломов, переломов шейки бедра и невертебральных переломов из-за применения Пролиа течение 3 лет были последовательными независимо от 10-летнего исходного риска переломов.
Влияние на МПК. По сравнению с плацебо на 1-, 2- и 3-м году препарат Пролиа значительно повысил МПК: на 9,2% в поясничном отделе позвоночника, на 6,0% — в тазобедренном сочленении, на 4,8% — в шейке бедренной кости, на 7,9% — в вертеле бедренной кости, на 3,5% — в дистальном отделе лучевой кости и на 4,1% — во всем организме в течение 3 лет (все р<0,0001).
В клинических исследованиях эффектов отмены препарата Пролиа МПК вернулась примерно до уровней, наблюдаемых перед лечением, и оставалась выше, чем в группе плацебо, в течение 18 мес после последней дозы. Эти данные указывают на то, что дальнейшее лечение препаратом Пролиа необходимо для поддержания эффекта лекарственного средства. Повторное применение препарата Пролиа привело к повышению МПК, подобному тому, как при первом применении Пролиа.
Открытое расширенное исследование лечения при постменопаузальном остеопорозе. В целом 4550 женщин (2343 из которых применяли Пролиа и 2207 — плацебо), пропустивших не более одной дозы препарата в базовом вышеописанном исследовании и завершивших визит, предусмотренный исследованием на 36 мес, участвовали в 7-летнем многонациональном многоцентровом открытом несравнительном расширенном исследовании долгосрочной безопасности и эффективности препарата Пролиа. Все женщины в расширенном исследовании должны были получать 60 мг Пролиа каждые 6 мес, а также ежедневно кальций (по крайней мере 1 г) и витамин D (как минимум 400 МЕ). В целом 2626 пациенток (58% женщин, включенных в расширенное исследование, то есть 34% женщин, включенных в базовое исследовании) завершили расширенное исследование.
У пациентов, получавших Пролиа в течение периода продолжительностью до 10 лет, МПК повысилась от исходных данных основного исследования на 21,7% в поясничном отделе позвоночника, на 9,2% — в тазобедренном сочленении, на 9,0% — в шейке бедренной кости, на 13,0% — в вертеле и на 2,8% — в дистальном отделе лучевой кости. В конце исследования у пациентов, лечившихся в течение 10 лет, средний Т-показатель МПК поясничного отдела позвоночника составил –1,3.
Частоту переломов оценивали как конечную точку безопасности, однако эффективность предотвращения переломов оценить нельзя вследствие большого количества случаев прекращения лечения и открытого формата исследования. У пациентов, принимавших деносумаб в течение 10 лет (n=1278), суммарное количество новых случаев вертебральных и невертебральных переломов составляла примерно 6,8 и 13,1% соответственно. У пациентов, которые по каким-либо причинам не завершили исследования, частота возникновения переломов в течение периода лечения была более высокой.
В ходе расширенного исследования установлено 13 случаев остеонекроза челюсти (ОНЧ) и 2 случая атипичных переломов бедренной кости.
Лечение остеопороза у мужчин. Эффективность и безопасность препарата Пролиа, который применяли 1 раз в 6 мес в течение 1 года, исследовали у 242 мужчин в возрасте 31 год–84 лет. Лица с рСКФ<30 мл/мин/1,73 м2 были исключены из исследования. Все мужчины получали добавки кальция (по крайней мере 1000 мг) и витамина D (как минимум 800 МЕ) ежедневно.
Основным показателем эффективности было процентное изменение МПК поясничного отдела позвоночника, эффективность в отношениии переломов не оценивали. По сравнению с плацебо препарат Пролиа значительно повысил МПК в течение 12 мес: на 4,8% в поясничном отделе позвоночника, на 2,0% — в тазобедренном сочленении, на 2,2% — в шейке бедренной кости, на 2,3% — в вертеле бедренной кости и на 0,9% — в дистальном отделе лучевой кости (все р<0,05). Показатель МПК поясничного отдела позвоночника повысился от исходных данных у 94,7% мужчин на конец 1-го года. Значительное повышение МПК в поясничном отделе позвоночника, тазобедренном сочленении, шейке бедренной кости и вертеле бедренной кости наблюдалось через 6 мес (р<0,0001).
Гистология костей. Гистологию костей оценивали у 62 женщин в постменопаузальный период с остеопорозом или низкой костной массой, ранее не получавших терапии по поводу остеопороза или перешедших с предшествующей терапии алендронатом и после 1 года–3 лет лечения с применением Пролиа. 59 женщин приняли участие в подисследовании костной биопсии 24 мес (n=41) и/или 84 мес (n=22) расширенного исследования, проведенного с участием женщин в постменопаузальный период с остеопорозом. Гистологию костей также оценивали у 17 мужчин с остеопорозом после 1 года лечения препаратом Пролиа. Результаты биопсии костей показали кость нормальной формы и качества без признаков дефектов минерализации, незрелой кости или фиброза костного мозга. Результаты гистоморфометрии в расширенном исследовании свидетельствуют о том, что у женщин в постменопаузальный период с остеопорозом антирезорбтивные эффекты препарата Пролиа, которые измеряли с частотой активации и скорости формирования костей, поддерживались в течение длительного времени.
Лечение при потере костной ткани, связанной с андрогенной депривацией. Эффективность и безопасность препарата Пролиа, который применяли 1 раз в 6 мес в течение 3 лет, исследовали у мужчин с гистологически подтвержденным неметастатическим раком предстательной железы, получавших андрогендепривационную терапию (1468 мужчин в возрасте 48–97 лет). Эти пациенты были подвержены повышенному риску перелома (определяется как возраст ≥70 лет или возраст <70 лет и Т-показатель МПК в поясничном отделе позвоночника, тазобедренном сочленении или шейке бедренной кости <1,0 или наличие остеопоротического перелома в анамнезе). Все мужчины получали добавки кальция (по крайней мере 1000 мг) и витамина D (как минимум 400 МЕ) ежедневно.
По сравнению с плацебо препарат Пролиа значительно повысил МПК в течение 3 лет на 7,9% в поясничном отделе позвоночника, на 5,7% — в тазобедренном сочленении, на 4,9% — в шейке бедренной кости, на 6,9% — в вертеле бедренной кости, на 6,9% — в дистальном отделе лучевой кости и на 4,7% — во всем организме (все р<0,0001). В проспективном запланированном разведывательном анализе наблюдали значительное повышение МПК в поясничном отделе позвоночника, тазобедренном сочленении, шейке бедренной кости и вертеле бедренной кости через 1 мес после применения начальной дозы.
Препарат Пролиа продемонстрировал значительное снижение относительного риска новых переломов позвонков: 85% (1,6% — снижение абсолютного риска) через 1 год, 69% (2,2% — снижение абсолютного риска) через 2 года и 62% (2,4% — снижение абсолютного риска) через 3 года (все р<0,01).
Лечение при потере костной массы, связанной с адъювантной терапией ингибитором ароматазы. Эффективность и безопасность препарата Пролиа, который применяли 1 раз каждые 6 мес в течение 2 лет, исследовали у женщин с неметастатическим раком молочной железы (252 женщины в возрасте 35–84 лет) и с базовым уровнем Т-показателя МПК между 1,0 и –2,5 в поясничном отделе позвоночника, тазобедренном сочленении или шейке бедренной кости. Все женщины получали добавки кальция (по крайней мере 1000 мг) и витамина D (как минимум 400 МЕ) ежедневно.
Основным показателем эффективности было процентное изменение показателя МПК поясничного отдела позвоночника, эффективность при переломах не оценивали. По сравнению с плацебо препарат Пролиа значительно повысил МПК в течение 2 лет на 7,6% в поясничном отделе позвоночника, на 4,7% — в тазобедренном сочленении, на 3,6% — в шейке бедренной кости, на 5,9% — в вертеле бедренной кости, на 6,1% — в дистальном отделе лучевой кости и на 4,2% — во всем организме (все р <0,0001).
Детская популяция. Европейское агентство по лекарственным средствам отменило обязательства предоставлять результаты исследований препарата Пролиа во всех подмножествах педиатрической популяции при лечении потери костной массы, связанной с аблятивной терапией половыми гормонами, и в подмножествах педиатрической популяции в возрасте до 2 лет при лечении остеопороза (см. ПРИМЕНЕНИЕ для получения информации по применению в педиатрии).
Фармакокинетика
Абсорбция. После п/к введения в дозе 1,0 мг/кг массы тела, что приблизительно соответствует дозе 60 мг, концентрация препарата, базируясь на показателях AUC, составляла 78% уровня, полученного при в/в введении этой же дозы препарата. После п/к введения 60 мг деносумаба его Сmax в сыворотке крови, составляющая в среднем 6 мкг/мл (диапазон — 1–17 мкг/мл), достигается в среднем за 10 дней (диапазон — 2–28 дней).
Биотрансформация. Деносумаб состоит исключительно из аминокислот и углеводов, как и природный иммуноглобулин. Поэтому маловероятно, что он выводится путем печеночного метаболизма. Считается, что его метаболизм и выведение происходят теми же путями, что и клиренс иммуноглобулина, после распада препарата на небольшие пептиды и отдельные аминокислоты.
Выведение. После достижения Cmax уровни препарата в сыворотке крови снижаются на протяжении 3 мес (диапазон — 1,5–4,5 мес) в связи с Т½ препарата продолжительностью 26 дней (диапазон — 6–52 дня). У 53% пациентов через 6 мес после применения препарата деносумаб не выявлен.
При многократном применении деносумаба в режиме 60 мг п/к 1 раз каждые 6 мес не выявлено ни кумуляции препарата, ни изменений его фармакокинетики со временем. На фармакокинетику деносумаба не влияло формирование связей антител с деносумабом, и фармакокинетика препарата была одинаковой у женщин и мужчин. Возраст (28–87 лет), расовая принадлежность, течение заболевания (уменьшение костной массы или остеопороз, рак предстательной железы или рак молочной железы) не оказывали существенного влияния на фармакокинетику деносумаба.
Выявлена тенденция к увеличению массы тела и уменьшению экспозиции препарата, базируясь на показателях AUC и Cmax. Однако такая тенденция не считается клинически значимой, поскольку фармакодинамический эффект оценивается по маркерам ремоделирования костей и повышения МПК, которые были постоянными в разных по массе тела категориях больных.
Линейность/нелинейность. В ходе исследований дозозависимости установлена нелинейная связь фармакокинетики препарата с его дозой и снижением клиренса препарата при повышении его дозы, но приблизительное пропорциональное дозозависимое увеличение экспозиции препарата наблюдается при применении доз 60 мг.
Данные доклинических исследований. В исследованиях токсичности однократной и многократных доз у яванских макак дозы деносумаба, которые приводили к системному ответу, выше в 100–150 раз от рекомендуемых для человека, не влияли на физиологию сердечно-сосудистой системы, репродуктивную функцию самцов или самок или на возникновение специфической токсичности для органов-мишеней.
В исследовании у макак, которым вводили деносумаб в I триместр беременности, при дозировании на уровне AUC в 99 раз выше дозы для человека (60 мг каждые 6 мес), не выявлено отрицательного влияния на организм матери и плода. В этом исследовании лимфатические узлы плода не изучались.
В другом исследовании у макак, которым вводили деносумаб в течение беременности при дозировании на уровне AUC в 119 раз выше дозы для человека (60 мг каждые 6 мес), выявлено: повышение уровня мертворождения и постнатальной летальности; нарушения роста костей, которые проявлялись снижением прочности костей, снижением гематопоэза и задержкой прорезывания зубов; отсутствие периферических лимфатических узлов и снижение неонатального роста плода. Развитие молочных желез макак не отличалось от нормы.
В доклинических исследованиях, проведенных на нокаутных мышах, лишенных RANK или RANKL, наблюдалось ухудшение формирования лимфатических узлов у плода. Отсутствие лактации за счет подавления созревания молочной железы (дольчато-альвеолярное развитие железы в период беременности) наблюдалось также у нокаутных мышей, лишенных RANK или RANKL.
Специальные группы больных
Почечная недостаточность. В исследовании с участием 55 пациентов с разными стадиями почечной недостаточности, включая лиц, которым требуется диализ, степень почечной недостаточности не влияла на фармакокинетику деносумаба.
Печеночная недостаточность. Специальных исследований при участии пациентов с печеночной недостаточностью не проводили. В целом моноклональные антитела не выводятся путем печеночного метаболизма, поэтому можно ожидать, что печеночная недостаточность не будет влиять на фармакокинетику деносумаба.
Детская популяция. Фармакокинетический профиль в педиатрической популяции не оценивался.
Показания Пролиа
лечение при остеопорозе у женщин в постменопаузальный период и у мужчин с повышенным риском переломов. У женщин в постменопаузальный период препарат Пролиа значительно снижает риск переломов позвонков, переломов непозвоночной локализации и переломов бедра.
Лечение при потере костной массы у мужчин с повышенным риском возникновения переломов позвонков, которые получают гормоносупрессивную терапию в связи с раком предстательной железы.
У мужчин с раком предстательной железы, получающих гормоносупрессивную терапию, Пролиа значительно снижает риск переломов позвонков.
Применение Пролиа
препарат применяют п/к.
Дозирование. Рекомендуемая доза Пролиа — 1 п/к инъекция 60 мг препарата 1 раз каждые 6 мес, которая вводится в бедро, живот или наружную поверхность плеча.
Во время терапии пациенты как дополнение к лечению должны получать препараты и пищевые добавки, содержащие кальций и витамин D (см. ОСОБЫЕ УКАЗАНИЯ).
Оптимальная общая продолжительность лечения остеопороза путем применения препаратов с антирезорбтивными действием (включая как деносумаб, так и бисфосфонаты) не определена. Необходимо периодически пересматривать вопрос о потребности в непрерывном лечении, учитывая пользу и потенциальный риск от применения деносумаба для каждого отдельного пациента, особенно через ≥5 лет лечения (см. ОСОБЫЕ УКАЗАНИЯ).
Способ применения. Препарат для п/к введения. Препарат следует применять пациентам, прошедшим инструктаж по технике инъекционного введения.
Особые меры предосторожности при обращении с препаратом и его утилизации. Перед применением р-р Пролиа необходимо осмотреть на наличие твердых частиц или изменение цвета. Р-р нельзя использовать, если он помутнел или изменил свой цвет. Не встряхивать. Для предотвращения дискомфорта в месте инъекции необходимо дать предварительно заполненному шприцу нагреться до комнатной температуры (до 25 °С) перед инъекцией и вводить препарат медленно. Необходимо ввести все содержимое предварительно заполненного шприца. Любое количество лекарственного средства, оставшееся в предварительно заполненном шприце после инъекции, следует уничтожить согласно действующему законодательству.
Почечная недостаточность. Изменять дозу препарата для лечения больных с почечной недостаточностью не требуется.
Печеночная недостаточность. Безопасность и эффективность деносумаба для лечения пациентов с печеночной недостаточностью не изучались, поэтому препарат не применяют у данной группы пациентов.
Больные пожилого возраста (≥65 лет). Изменять дозу препарата для лечения пациентов пожилого возраста не требуется.
Дети. Препарат Пролиа не рекомендуется для применения у детей (возраст <18 лет), поскольку его безопасность и эффективность для пациентов детского возраста не установлены. В экспериментальных исследованиях на животных ингибирование рецептора-активатора ядерного фактора kB (RANK)/лиганда RANK (RANKL) сопровождалось ингибированием роста костей и задержкой прорезывания зубов.
Указания для пациента о проведении инъекции с помощью предварительно заполненного шприца с иглой, закрытой колпачком, с защитным устройством от случайного укола иглой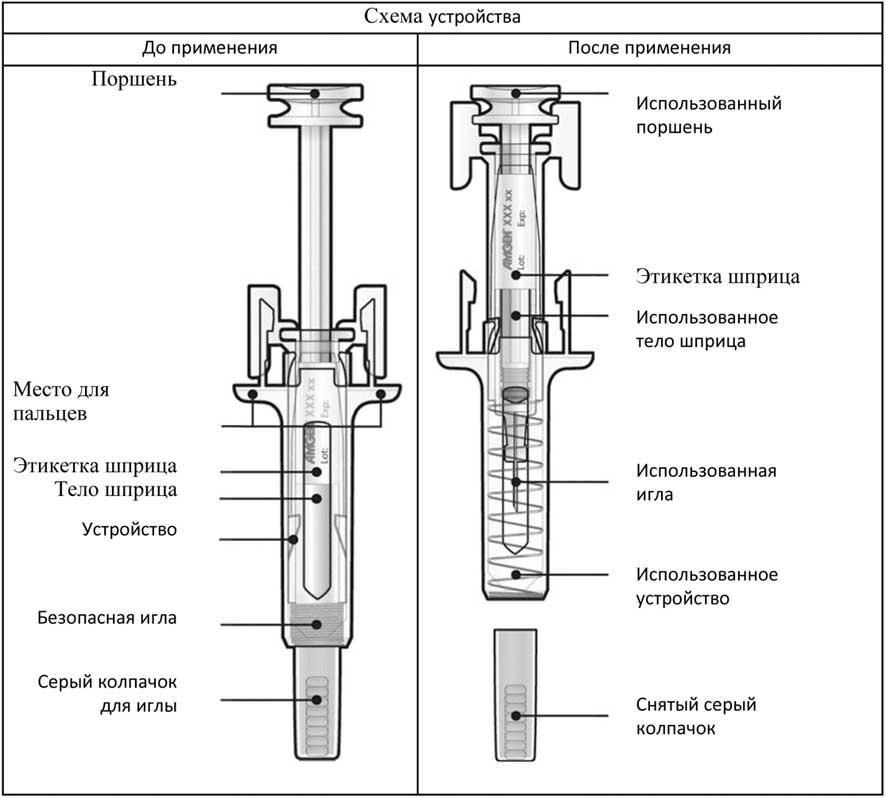
Перед применением предварительно заполненного шприца с иглой, закрытой колпачком, с защитным устройством против случайного укола иглой, прочитайте эту важную информацию:
- Не производите инъекции самостоятельно до получения инструкций от вашего врача или медицинского работника.
- Препарат Пролиа вводят путем инъекции в ткань, расположенную сразу под кожей (п/к инъекция).
- Сообщите врачу о наличии у вас аллергии на латекс (колпачок для иглы на предварительно заполненном шприце содержит производное латекса).
- Не удаляйте серый колпачок для иглы с предварительно заполненного шприца пока вы не будете готовы к инъекции.
- Не используйте предварительно заполненный шприц, если до этого он упал на твердую поверхность. Используйте новый предварительно заполненный шприц и обратитесь к врачу или медицинскому работнику.
- Не активируйте предварительно заполненный шприц, если вы не собираетесь выполнять инъекцию.
- Не снимайте прозрачное защитное устройство от случайного укола иглой с предварительно заполненного шприца.
В случае возникновения вопросов обратитесь к врачу или медицинскому работнику.
Шаг 1: Подготовка.
А. Вытяните контейнер с предварительно заполненным шприцем из упаковки и подготовьте необходимые для инъекции принадлежности.
Для комфортной инъекции выдержите предварительно заполненный шприц при комнатной температуре в течение 30 мин перед инъекцией. Тщательно вымойте свои руки с мылом.
Положите шприц на хорошо освещенный чистый стол. Приготовьте спиртовые салфетки, ватный тампон, марлевую салфетку или пластырь, а также контейнер для утилизации острых отходов (не входят в комплект).
- Не пытайтесь согреть шприц с помощью источника тепла, например горячей водой или в микроволновой печи.
- Не оставляйте предварительно заполненный шприц под прямыми солнечными лучами.
- Не встряхивайте предварительно заполненный шприц.
- Храните предварительно заполненные шприцы в местах, недоступных для детей и защищенных от света.
Б. Откройте контейнер шприца, удалив покрытия. Удалите предварительно заполненный шприц из контейнера.
В. Проведите осмотр лекарственного средства и предварительно заполненного шприца.
Не используйте предварительно заполненный шприц, если:
- Лекарственное средство непрозрачное или имеет твердые частицы. Р-р должен быть прозрачным, бесцветным или желтоватого цвета.
- Любая часть шприца имеет трещины или сломана.
- Серый колпачок для иглы отсутствует или игла ним не полностью прикрыта.
- Прошел последний день месяца, который указан на этикетке как конечный срок использования.
Во всех указанных случаях обратитесь к врачу или медицинскому работнику.
Шаг 2: Готовность.
А. Тщательно вымойте руки. Подготовьте и очистите место инъекции.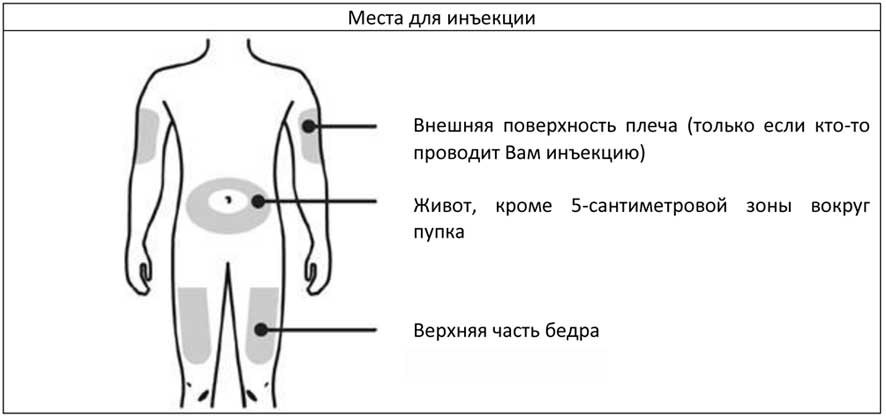
Обработайте место инъекции с помощью салфетки с этиловым спиртом. Дождитесь, чтобы кожа стала сухой.
- Не касайтесь места инъекции до ее проведения.
- Не проводите инъекции в местах, где кожа тонкая, необычного цвета, напряженная или нарушена ее целостность. Избегайте инъекции в места шрамов и растяжек.
Б. Осторожно снимите серый колпачок с иглы в направлении, противоположном от вашего тела.
В. Зажмите место инъекции, чтобы создать прочную поверхность.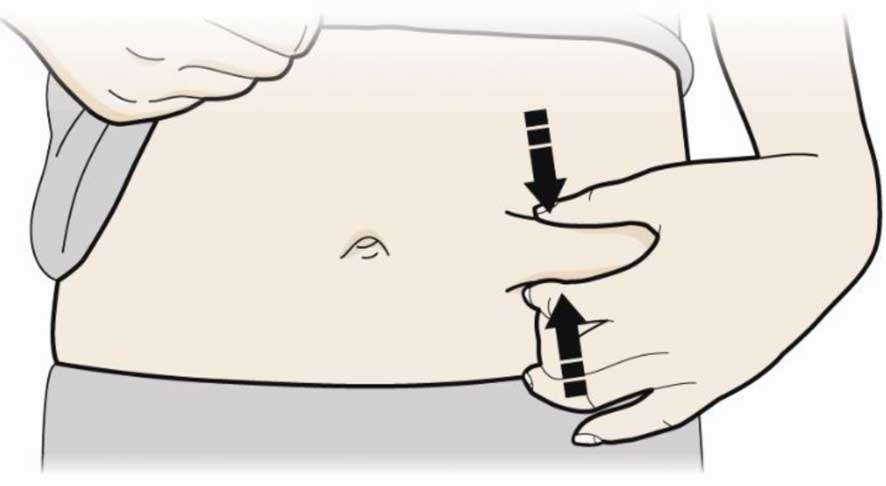
- Важно держать кожу зажатой при введении.
Шаг 3: Инъекция.
А. Держа кожу зажатой, введите иглу в кожу.
- Не прикасайтесь обработанного участка кожи.
Б. Медленно и постоянно давите на поршень, продвигая его, пока не почувствуете или не услышите звук «треска». Дожмите поршень вниз.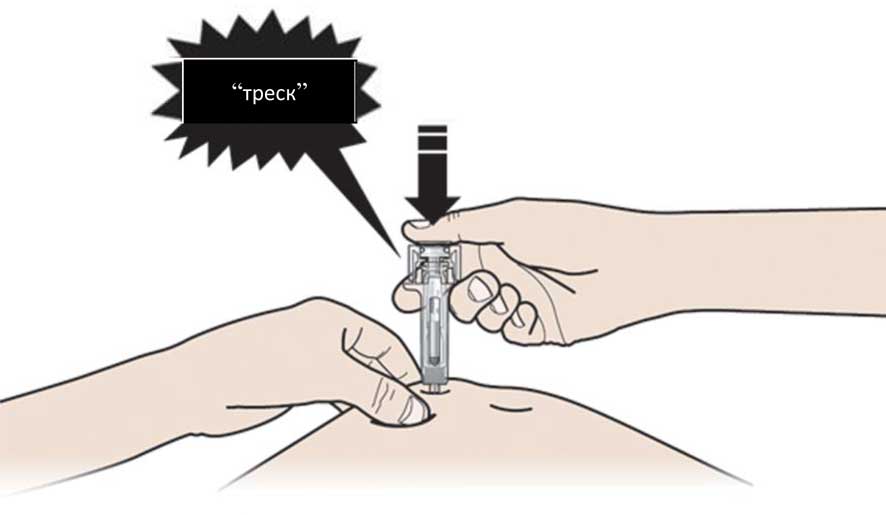
Важно нажать на поршень до конца до появлению треска для введения полной дозы.
В. Отпустите большой палец. Затем поднимите шприц над кожей.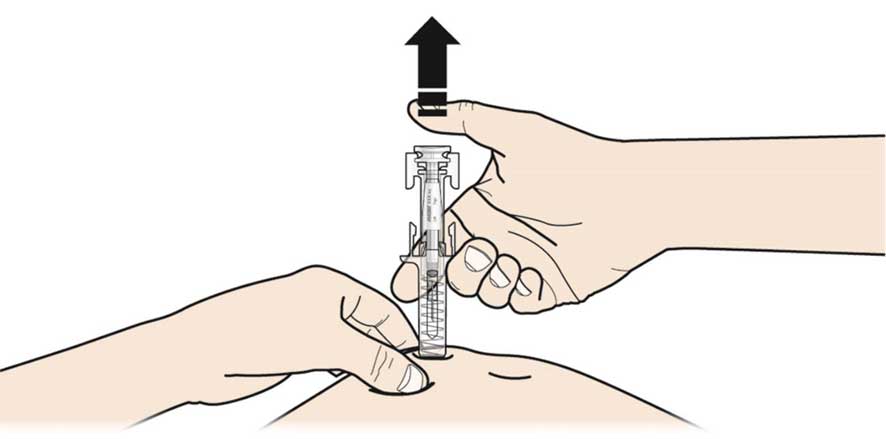
После того как вы отпустили поршень, защитное устройство от случайного укола иглой накроет иглу.
- Не проворачивайте колпачок на шприц, который был предварительно заполнен.
Шаг 4: Завершение.
А. Утилизируйте использованный шприц и другие материалы в контейнер для утилизации острых отходов.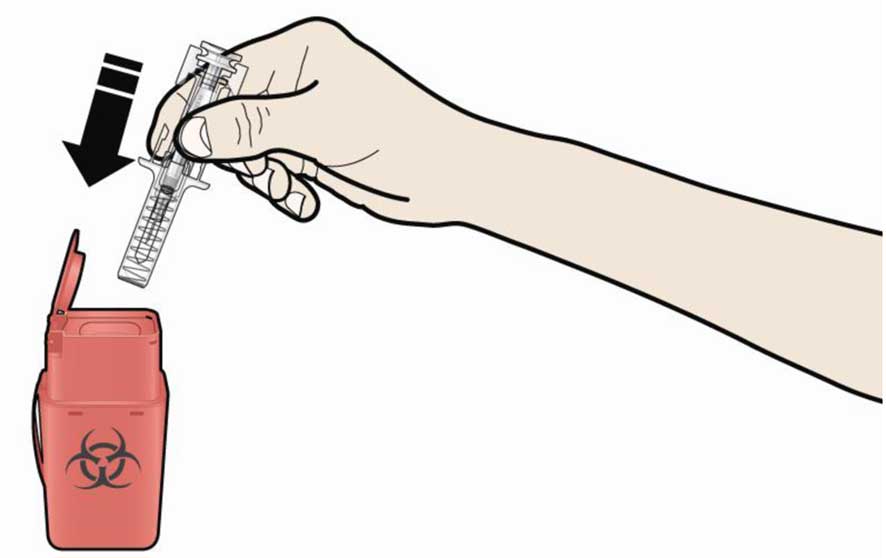
Лекарства должны быть утилизированы в соответствии с местными требованиями. Не допускайте их попадания в окружающую среду.
Хранить шприц и контейнер для острых отходов в недоступном для детей и защищенном от света месте.
- Повторно не используйте шприц, который был предварительно заполнен.
- Не перерабатывать предварительно заполненные шприцы и не выбрасывайте их в бытовые отходы.
Б. Проведите осмотр места инъекции.
При появлении крови прижмите ватный или марлевый тампон к месту инъекции. Не трите место инъекции. Нанесите пластырь, если это необходимо.
При утилизации использованных шприцев
- Не устанавливайте колпачок для иглы на использованный шприц.
- Держите использованные шприцы в недоступном для детей месте.
Использованные шприцы необходимо утилизировать в соответствии с местными требованиями. Не допускайте их попадания в окружающую среду.
Противопоказания
гиперчувствительность к действующему веществу или любому из вспомогательных компонентов препарата. Гипокальциемия.
Побочные эффекты
резюме профиля безопасности
Общий профиль безопасности препарата Пролиа был одинаковым у пациентов с остеопорозом и у больных раком молочной железы или раком предстательной железы, получающих гормоносупрессивную терапию, в пяти плацебо-контролируемых клинических исследованиях III фазы.
Наиболее распространенными побочными эффектами при применении препарата Пролиа (которые наблюдались у более чем одного пациента из десяти) является скелетно-мышечная боль и боль в конечностях. Редкие случаи целлюлита; редкие случаи гипокальциемии, гиперчувствительности,ОНЧ и атипичных переломов бедренной кости (см. ОСОБЫЕ УКАЗАНИЯ и ПОБОЧНЫЕ ЭФФЕКТЫ, Описание отдельных побочных реакций) отмечали у пациентов, принимающих препарат Пролиа.
Табличный список побочных реакций. В табл. 3 описаны побочные реакции, по которым были сообщения в ходе клинических испытаний II и III фазы при применении у больных с остеопорозом и раком молочной железы или раком предстательной железы, получающих гормональную терапию и/или спонтанные сообщения.
Побочные реакции классифицированы в следующие группы в соответствии с частотой их возникновения (см. табл. 3): очень часто (≥1/10), часто (≥1/100 и <1/10), нечасто (≥1/1000 и <1/100), редко (≥1/10 000 и <1/1000), очень редко (<1/10 000) и неизвестна.
В рамках каждой группы побочные реакции указаны по частоте и системой и представлены в порядке убывания частоты.
Таблица 3. Побочные реакции у пациентов с остеопорозом и раком молочной железы или раком предстательной железы, получающих гормоносупресивну терапию
| Класс системы органов по MedDRA | Категория частоты | Побочный эффект |
|---|---|---|
| Инфекционные и паразитарные заболевания | Часто Часто Нечасто Нечасто Нечасто | Инфекции мочевыделительной системы Инфекции верхних отделов дыхательной системы Дивертикулит1 Целлюлит1 Инфекции уха |
| Нарушения со стороны иммунной системы | Редко Редко | Медикаментозная гиперчувствительность1 Анафилактическая реакция1 |
| Метаболические и алиментарные нарушения | Редко | Гипокальциемия1 |
| Нарушения со стороны нервной системы | Часто | Ишиас |
| Нарушения со стороны пищеварительного тракта | Часто Часто | Запор Дискомфорт в животе |
| Нарушения со стороны кожи и подкожной клетчатки | Часто Часто | Сыпь Экзема |
| Нарушения со стороны опорно-двигательного аппарата и соединительной ткани | Очень часто Очень часто | Боль в конечностях Боль в мышцах и костях1 |
| Редко Редко Неизвестно | Боль в мышцах и костях1 Атипичные переломы бедра1 Остеонекроз наружного слухового канала2 | |
1См. ОСОБЫЕ УКАЗАНИЯ
2См. ОСОБЫЕ УКАЗАНИЯ
В общем анализе данных всех плацебо-контролируемых исследований II и III фазы сообщалось о заболеваемости гриппом, которая составила 1,2% для деносумаба и 0,7% — для плацебо. Однако этот дисбаланс был установлен в обобщенном анализе данных и не выявлен при стратифицированном анализе.
Описание отдельных побочных реакций
Гипокальциемия
В двух плацебо-контролируемых клинических исследованиях III фазы у женщин в постменопаузальный период с остеопорозом примерно 0,05% (2 из 4050) имели снижение уровня кальция (<1,88 ммоль/л) в сыворотке крови после введения препарата Пролиа. О снижении уровня кальция (<1,88 ммоль/л) в сыворотке крови не сообщалось ни в двух плацебо-контролируемых клинических исследованиях III фазы у пациентов, получающих гормональную терапию, ни в плацебо-контролируемом клиническом исследовании III фазы у мужчин с остеопорозом.
По данным постмаркетингового наблюдения, сообщалось о редких случаях тяжелой симптоматической гипокальциемии, преимущественно у пациентов с повышенным риском возникновения гипокальциемии, которые принимали препарат Пролиа, и преимущественно в первые недели после начала терапии. Случаи клинических проявлений тяжелой симптоматической гипокальциемии включали пролонгацию интервала Q–T, тетанию, судороги и изменения психического состояния (см. ОСОБЫЕ УКАЗАНИЯ). Симптомы гипокальциемии, отмеченные в ходе клинических исследований с применением деносумаба, включали парестезии или жесткость мышц, подергивание, спазмы и мышечные судороги.
Кожные инфекции. В плацебо-контролируемых клинических исследованиях III фазы общая частота инфекций кожи была подобной в группе плацебо и в группе применявших препарат Пролиа: у женщин в постменопаузальный период с остеопорозом (плацебо [1,2%, 50 из 4041] по сравнению с препаратом Пролиа [ 1,5%, 59 из 4050]); у мужчин с остеопорозом (плацебо [0,8%, 1 из 120] по сравнению с препаратом Пролиа [0%, 0 из 120]) у больных раком молочной железы или предстательной железы, получающих гормональную терапию (плацебо [1,7%, 14 из 845] по сравнению с препаратом Пролиа [1,4%, 12 из 860]). Кожные инфекции, которые привели к госпитализации, составили 0,1% (3 из 4041) среди женщин в постменопаузальный период с остеопорозом, получавших плацебо по сравнению с 0,4% (16 из 4050) среди женщин, принимавших препарат Пролиа. В большинстве случаев это был целлюлит. Инфекции кожи, о которых сообщали как о серьезных побочных реакциях, были подобными в группе плацебо (0,6%, 5 из 845) и группе, в которой принимали Пролиа (0,6%, 5 из 860) в исследованиях рака молочной железы и предстательной железы.
ОНЧ. О случаях возникновения ОНЧ сообщалось редко, у 16 больных, в клинических испытаниях при остеопорозе и при раке молочной железы или раке предстательной железы у пациентов, получавших гормональную терапию, с общим количеством 23 148 пациентов (см. ОСОБЫЕ УКАЗАНИЯ). 13 из этих случаев произошли у женщин в постменопаузальный период с остеопорозом во время клинического испытания III фазы с продолжением дальнейшего лечения Пролиа до 10 лет. Частота случаев возникновения ОНЧ составила 0,04% через 3 года, 0,06% — через 5 лет и 0,44% — через 10 лет лечения Пролиа. Риск возникновения остеопороза челюсти возрастал с увеличением периода лечения Пролиа.
Атипичные переломы бедра. У пациентов, которые применяли препарат Пролиа по программе клинических испытаний лечения остеопороза, редко сообщалось об атипичных переломах бедра (см. ОСОБЫЕ УКАЗАНИЯ).
Дивертикулит. В III фазе одного плацебо-контролируемого клинического исследования больных раком предстательной железы, получавших андрогенную депривационную терпию, выявлен дисбаланс в побочных реакциях относительно дивертикулита (1,2% — в группе деносумаба, 0% — в группе плацебо). Заболеваемость дивертикулитом была сопоставима между группами лечения у женщин в постменопаузальный период или мужчин с остеопорозом и у женщин с лечением неметастатического рака молочной железы ингибитором ароматазы.
Медикаментозная гиперчувствительность. Во время постмаркетинговых наблюдений у пациентов, получавших лечение препаратом Пролиа, отмечали редкие явления медикаментозной гиперчувствительности, включая сыпь, крапивницу, отек лица, эритему и анафилактические реакции.
Мышечно-скелетная боль. При постмаркетинговых наблюдениях у больных, получавших препарат Пролиа, сообщали о мышечно-скелетной боли, включая тяжелые случаи. В клинических испытаниях мышечно-скелетная боль отмечена очень часто в обеих группах исследования — лечения деносумабом и плацебо. Нечасто сообщали о мышечно-скелетной боли, приводившей к прекращению лечения в клиническом исследовании.
Другие специальные группы пациентов. В клинических исследованиях пациенты с тяжелой почечной недостаточностью (клиренс креатинина <30 мл/мин) или лица, получающие диализ, подвергаются большему риску гипокальциемии при отсутствии добавок кальция. Адекватное потребление кальция и витамина D имеет важное значение у пациентов с тяжелой почечной недостаточностью или лиц, находящихся на диализе (см. ОСОБЫЕ УКАЗАНИЯ).
Сообщение о подозреваемых побочных реакциях. Важно сообщать о подозреваемых побочных реакциях после регистрации лекарственного средства. Это позволяет продолжать контролировать баланс польза/риск лекарственного средства. Специалистов в области здравоохранения просят сообщать о любых подозреваемые побочных реакциях через национальную систему отчетности.
Особые указания
восполнение кальция и витамина D. Для всех пациентов очень важным является адекватное употребление кальция и витамина D.
Меры предосторожности при применении
Гипокальциемия. Важно идентифицировать пациентов с риском возникновения гипокальциемии и скорригировать гипокальциемию с помощью адекватного употребления кальция и витамина D до начала лечения препаратом. Рекомендуемый клинический мониторинг уровня кальция в крови пациентов, склонных к развитию гипокальциемии, в первые 2 нед после начальной дозы. Если у любого пациента на фоне лечения препаратом можно заподозрить симптомы гипокальциемии (см. ПОБОЧНЫЕ РЕАКЦИИ), следует определить уровень кальция. Пациентам следует рекомендовать сообщать о симптомах, указывающих на гипокальциемию.
В условиях постмаркетингового наблюдения получены сообщения о тяжелой симптоматической гипокальциемии (см. ПОБОЧНЫЕ РЕАКЦИИ), которая в большинстве случаев возникала в первые недели после начала лечения, но может также появляться позже.
Инфекции кожи. У пациентов, применяющих препарат Пролиа, могут возникнуть инфекции кожи (в основном целлюлит), приводящие к госпитализации (см. ПОБОЧНЫЕ РЕАКЦИИ). Пациентам необходимо немедленно обратиться за медицинской помощью при появлении симптомов целлюлита.
ОНЧ. Получены редкие сообщения об ОНЧ у пациентов, находящихся на лечении остеопороза препаратом Пролиа (см. ПОБОЧНЫЕ РЕАКЦИИ).
Лицам с поражениями мягких тканей ротовой полости, которые не заживают, следует на 1 мес отложить начало/новый курс лечения.
Перед лечением Пролиа больным с сопутствующими факторами риска необходима предварительная консультация стоматолога с проведением соответствующих профилактических мероприятий и индивидуальной оценки соотношения риск/польза.
Факторы, которые следует принять во внимание при оценке риска развития у пациента ОНЧ
- сила лекарственного средства, тормозит резорбцию кости (больший риск для более мощных соединений), путь введения (больший риск для парентерального введения) и кумулятивная доза препарата для лечения при резорбции кости;
- рак, сопутствующие состояния (например анемия, коагулопатии, инфекции), курение;
- сопутствующая терапия: кортикостероиды, химиотерапия, ингибиторы ангиогенеза, радиотерапия головы и шеи;
- плохая гигиена полости рта, заболевания периодонта, несоответствующее протезирование зубов, болезнь зубов в анамнезе, инвазивные стоматологические процедуры, например экстракции зубов.
Все пациенты должны соблюдать соответствующие правила гигиены полости рта, проходить регулярные профилактические осмотры у стоматолога и немедленно сообщать о любых симптомах со стороны ротовой полости, включая подвижность зубов, боль или отеки, не заживающие раны или выделения из ран во время лечения препаратом Пролиа.
Если после внимательного рассмотрения принято решение о необходимости проведения инвазивных стоматологических процедур, их следует проводить в дни непосредственно перед или сразу после введения препарата Пролиа.
Возникновение ОНЧ во время лечения требует проведения врачом пациента вместе со стоматологом или хирургом клинической оценки и составления плана лечения пациента, основанного на индивидуальной оценке соотношения риск/польза от временной остановки терапии Пролиа, пока ОНЧ не будет устранен и факторы риска не будут смягчены.
Остеонекроз наружного слухового канала. Сообщалось о случаях остеонекроза наружного слухового канала, возникавшего при лечении деносумабом. К возможным факторам риска возникновения остеонекроза наружного слухового канала принадлежат применение стероидов и химиотерапия и/или локальные факторы риска, такие как инфекция или травма. Вероятность возникновения остеонекроза наружного слухового канала необходимо учитывать при лечении деносумабом пациентов с нарушениями со стороны уха, включая хронические инфекции уха.
Атипичные переломы бедра. У больных, лечившихся препаратом Пролиа, сообщалось о случаях атипичных переломов бедра (см. ПОБОЧНЫЕ РЕАКЦИИ). Атипичные переломы бедра могут возникать при незначительных травмах или при отсутствии травм в подвертлюжной или диафизальной области бедра и могут быть двусторонними. Эти переломы характеризуются специфическими радиографическими показателями. Об атипичных переломах бедра также сообщалось у пациентов с определенными коморбидными состояниями (например дефицитом витамина D, ревматоидным артритом, гипофосфатазией) и при применении определенных лекарственных средств (например бисфосфонатов, глюкокортикоидов, ингибиторов протонной помпы). Такие явления также возникали без антирезорбтивной терапии. Подобные переломы, о которых сообщалось в связи с приемом бисфосфонатов, часто являются билатеральными; таким образом, в течение терапии препаратом Пролиа необходимо обследовать противоположное бедро у пациентов с подтвержденным переломом тела бедренной кости.
Необходимо рассмотреть отмену препарата Пролиа для пациентов с подозрением на атипичный перелом бедра при оценке больного на основе индивидуального соотношения польза/риск.
Во время лечения препаратом Пролиа пациентов следует предупредить о необходимости сообщать о новых или необычных случаях боли в бедренной кости, бедре или в паховой области. Пациентов с подобными симптомами необходимо обследовать на наличие неполных переломов бедра.
Длительное лечение препаратами с антирезорбтивным действием
Длительное лечение препаратами с антирезорбтивным действием (включая как деносумаб, так и бисфосфонаты) может приводить к повышению риска возникновения побочных эффектов, таких как ОНЧ и атипичные переломы бедра, в результате существенного подавления процесса ремоделирования костной ткани (см. ПРИМЕНЕНИЕ).
Сухой природный каучук. Колпачок иглы на предварительно заполненном шприце одноразового использования содержит сухой природный каучук (производная латекса), что может привести к аллергической реакции.
Сочетанное лечение с другими лекарственными средствами, содержащими деносумаб. Пациенты, которые лечатся препаратом Пролиа, не должны одновременно принимать другие лекарственные средства, содержащие деносумаб (для профилактики поражений костной системы у взрослых больных с метастазами в костях из солидных новообразований).
Почечная недостаточность. У пациентов с тяжелой почечной недостаточностью (клиренс креатинина <30 мл/мин) или у находящихся на диализе повышается риск развития гипокальциемии. Риск развития гипокальциемии и сопутствующего повышения уровней паратгормона растет с увеличением степени почечной недостаточности. Для этих пациентов особенно важны адекватное потребление кальция, витамина D и регулярный мониторинг уровня кальция (см. начало раздела).
Предостережение относительно вспомогательных веществ. Это лекарственное средство содержит сорбит.
Пациенты с редкой врожденной непереносимостью фруктозы не должны применять препарат Пролиа.
Препарат содержит <1 ммоль натрия (23 мг) в 60 мг, то есть по сути является свободным от натрия.
Применение в период беременности и кормления грудью
Беременность. Данных о безопасности применения препарата у беременных в настоящее время нет. В исследовании на макаках, которым вводили деносумаб в течение беременности при дозировке на уровне AUC в 119 раз выше дозы у человека, выявлено репродуктивную токсичность (см. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА). Препарат Пролиа не рекомендуется для применения в период беременности.
Кормление грудью. Неизвестно, экскретируется ли деносумаб в грудное молоко человека. Исследования на нокаутных мышах (генетически модифицированные мыши, у которых RANKL, которое является мишенью для деносумаба, отключено из-за удаления гена (см. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА)) позволяют предположить, что отсутствие RANKL влияет на созревание молочных желез, что приводит к нарушению кормления грудью после родов (см. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА). Решение об отказе от грудного вскармливания или от лечения препаратом Пролиа необходимо принимать, взвешивая преимущества грудного вскармливания для ребенка и лечения препаратом Пролиа для матери. При необходимости терапии следует отказаться от грудного вскармливания.
Фертильность. Данных о влиянии деносумаба на фертильность человека нет. Исследования на животных не указывают на наличие прямых или косвенных негативных эффектов применения препарата Пролиа на фертильность (см. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА).
Дети. Препарат Пролиа не рекомендуется для применения у детей (возраст <18 лет), поскольку его безопасность и эффективность для пациентов детского возраста не установлены. В экспериментальных исследованиях на животных ингибирование рецептора — активатора ядерного фактора kB (RANK)/лиганда RANK (RANKL) сопровождалось ингибированием роста костей и задержкой прорезывания зубов.
Способность влиять на скорость реакции при управлении транспортными средствами или работе с другими механизмами. Препарат Пролиа не оказывает или оказывает очень незначительное влияние на скорость реакции при управлении транспортными средствами или работе с другими механизмами.
Взаимодействия
клинических данных относительно взаимодействия деносумаба и гормональной заместительной терапии (эстрогенов) нет, однако потенциальную возможность фармакодинамического взаимодействия считают низкой.
По данным исследования женщин в постменопаузальный период, которые были переведены с предыдущей терапии алендронатом на лечение деносумабом, фармакокинетика и фармакодинамика деносумаба не изменились после предыдущего применения алендроната.
В исследовании взаимодействий установлено, что препарат Пролиа (60 мг п/к) не влияет на фармакокинетику мидазолама, который метаболизируется с помощью цитохрома Р450 3А4 (CYP 3A4). Это свидетельствует об отсутствии влияния препарата на фармакокинетику лекарственных средств, которые метаболизируются этим ферментом.
Передозировка
не получено данных относительно передозировки препарата. При дозах до 180 мг каждые 4 нед (кумулятивная доза — до 1080 мг за 6 мес) не выявлено других, кроме уже приведенных побочных эффектов.
Условия хранения
в холодильнике при температуре 2–8 °С в оригинальной упаковке. После извлечения из холодильника хранить при температуре не выше 25 °С в оригинальной упаковке. Не замораживать. Не встряхивать. Срок пригодности после изъятия из холодильника — 30 дней.
