Триксео аеросфера (Trixeo aerosphere)
Триксео аеросфера інструкція із застосування
Склад
1 інгаляція (доставлена доза) містить 5 мкг формотеролу фумарату дигідрату мікронізованого у перерахунку на 4,8 мкг формотеролу фумарату безводного; 9 мкг глікопіронію броміду мікронізованого у перерахунку на 7,2 мкг глікопіронію та 160 мкг будесоніду мікронізованого;
це відповідає відміряній дозі 5,3 мкг формотеролу фумарату дигідрату мікронізованого у перерахунку на 5,1 мкг формотеролу фумарату безводного; 9,6 мкг глікопіронію броміду мікронізованого у перерахунку на 7,7 мкг глікопіронію та 170 мкг будесоніду мікронізованого;
допоміжні речовини: 1,2-дистеароїл-сн-гліцеро-3-фосфохолін, кальцію хлориду дигідрат, норфлуран (HFA-134a).
Формотеролу фумарат дигідрат - 5 мкг
Глікопіроній - 7,2 мкг
Будесонід - 160 мкг
Фармакологічні властивості
фармакодинаміка. Механізм дії. Лікарський засіб Триксео Аеросфера містить будесонід, глюкокортикостероїд, і два бронхолітики — глікопіроній, антагоніст мускаринових рецепторів тривалої дії (антихолінергічний лікарський засіб), і формотерол, β2-агоніст тривалої дії.
Будесонід — це глюкокортикостероїд, який у разі інгаляційного застосування чинить швидку (протягом кількох годин) та дозозалежну протизапальну дію в дихальних шляхах.
Глікопіроній — це антагоніст мускаринових рецепторів тривалої дії, який часто називають антихолінергічним лікарським засобом. Основними мішенями для антихолінергічних лікарських засобів є мускаринові рецептори, що містяться в дихальних шляхах. В дихальних шляхах глікопіроній виявляє фармакологічні ефекти за рахунок пригнічення М3-холінорецепторів у гладких мя’зах, що приводить до бронходилатації. Антагонізм має конкурентний і оборотний характер. У дослідженні профілактика бронхоконстрикторних ефектів, спричинених метилхоліном і ацетилхоліном, була дозозалежною та тривала понад 12 год.
Формотерол — це селективний агоніст β2-адренорецепторів, що в разі інгаляційного застосування приводить до швидкої та тривалої релаксації гладких м’язів бронхів у пацієнтів зі оборотною обструкцією дихальних шляхів. Бронхолітичний ефект залежить від дози; настання ефекту відбувається протягом 1–3 хв після інгаляції. Тривалість ефекту після застосування однієї дози становить не менше 12 год.
Клінічна ефективність. Ефективність і безпеку застосування лікарського засобу Триксео Аеросфера оцінювали у пацієнтів з ХОЗЛ помірного, тяжкого або дуже тяжкого ступеня в ETHOS і KRONOS, двох рандомізованих дослідженнях із паралельними групами. Обидва дослідження були багатоцентровими та подвійно сліпими. Пацієнти мали бал симптомів ≥10 відповідно до тесту щодо оцінювання ХОЗЛ (CAT) та щоденно застосовували два або більше підтримуючі лікарські засоби протягом принаймні 6 тиж до скринінгу.
ETHOS являло собою 52-тижневе дослідження (N=8588 рандомізованих учасників; 60% становили чоловіки, середній вік 65 років), в якому порівнювали дві інгаляції двічі на добу лікарського засобу Триксео Аеросфера, ДАІ формотеролу фумарату дигідрату/глікопіронію (ФОРМ/ГЛІ) 5/7,2 мкг та ДАІ формотеролу фумарату дигідрату/будесоніду (ФОРМ/БУД) 5/160 мкг. Пацієнти мали ХОЗЛ помірного, тяжкого або дуже тяжкого ступеня (ОФВ1 після застосування бронхолітика від ≥25% до <65% від прогнозованого значення); вони повинні були мати в анамнезі одне або кілька загострень ХОЗЛ помірного або тяжкого ступеня протягом року, що передував скринінгу. Частка пацієнтів із помірним, тяжким або дуже тяжким ХОЗЛ становила 29%, 61% та 11% відповідно. Середній вихідний ОФВ1 в усіх групах дорівнював 1,021–1,066 мл; на момент скринінгу середнє значення ОФВ1 після застосування бронхолітика становило 43% від прогнозованого, а середній бал за тестом CAT дорівнював 19,6. Первинною кінцевою точкою дослідження ETHOS була частота загострень ХОЗЛ помірного або тяжкого ступеня на тлі застосування лікарського засобу Триксео Аеросфера у порівнянні із ДАІ ФОРМ/ГЛІ та ДАІ ФОРМ/БУД.
KRONOS — це 24-тижневе дослідження (N=1902 рандомізовані учасники; 71% становили чоловіки, середній вік 65 років), в якому порівнювали дві інгаляції двічі на добу лікарського засобу Триксео Аеросфера, ДАІ ФОРМ/ГЛІ 5/7,2 мкг, ДАІ ФОРМ/БУД 5/160 мкг та у відкритому режимі порівняння з турбухалером формотеролу фумарату дигідрату/будесоніду (ТБХ ФОРМ/БУД) 6/200 мкг. У пацієнтів було ХОЗЛ помірного, тяжкого або дуже тяжкого ступеня (ОФВ1 після застосування бронхолітика від ≥25% до <80% від прогнозованого значення). Частка пацієнтів із помірним, тяжким або дуже тяжким ХОЗЛ становила 49%, 43% та 8%, відповідно. Середній вихідний ОФВ1 у всіх групах становив 1,050–1,193 мл, а на момент скринінгу середнє значення ОФВ1 після застосування бронхолітика становило 50% від прогнозованого; понад 26% пацієнтів повідомили про одне або кілька загострень ХОЗЛ помірного або тяжкого ступеня впродовж останнього року та середній бал оцінки симптомів за тестом CAT становив 18,3. У підгрупі учасників лікування було продовжено на 28 тиж, тобто до 52 тиж. Первинними кінцевими точками дослідження KRONOS були значення ОФВ1 від моменту часу 0 до 4 год після застосування лікарського засобу (згідно площі під фармацевтичною кривою концентрація/час AUC0–4 ОФВ1) для групи застосування лікарського засобу Триксео Аеросфера у порівнянні із групою ДАІ ФОРМ/БУД та зміна ранкового мінімального ОФВ1, що вимірюється до застосування препарату, в порівнянні з вихідним значенням для групи застосування лікарського засобу Триксео Аеросфера у порівнянні із групою ДАІ ФОРМ/ГЛІ за 24 тиж.
На момент зарахування у дослідження найпоширенішими застосовуваними видами лікування проти ХОЗЛ, про які повідомлялося у дослідженнях ETHOS та KRONOS, були інгаляційний глюкокортикостероїд (ІГКС) + агоніст β2-адренорецепторів тривалої дії (БАТД)+антагоніст мускаринових рецепторів тривалої дії (МХТД) (39%, 27% відповідно), ІГКС+БАТД (31%, 38% відповідно) та МХТД+БАТД (14%, 20% відповідно).
Вплив на загострення
Загострення помірного або тяжкого ступеня. У 52-тижневому дослідженні ETHOS у пацієнтів, що застосовували лікарський засіб Триксео Аеросфера, було зафіксовано значуще зниження річного показника загострень помірного/тяжкого ступеня під час лікування на 24% (95% ДІ: 17; 31; p<0,0001) у порівнянні з ДАІ ФОРМ/ГЛІ (частота; 1,08 проти 1,42 події на пацієнта на рік) та на 13% (95% ДІ: 5; 21; p=0,0027) у порівнянні із ДАІ ФОРМ/БУД (частота; 1,08 проти 1,24 події на пацієнта на рік).
Спостережена користь за річним показником загострень ХОЗЛ помірного/тяжкого ступеня протягом 24 тиж у дослідженні KRONOS загалом відповідала такій, що була відзначена в дослідженні ETHOS. У групі лікарського засобу Триксео Аеросфера поліпшення у порівнянні із ДАІ ФОРМ/ГЛІ були статистично значущими, проте у порівнянні із ДАІ ФОРМ/БУД та ТБХ ФОРМ/БУД не досягли статистичної значущості.
Тяжкі загострення (що призвели до госпіталізації або смерті). У дослідженні ETHOS у пацієнтів, що застосовували лікарський засіб Триксео Аеросфера, було зафіксовано чисельне зниження річного показника тяжких загострень під час лікування на 16% (95% ДІ: −3; 31; p=0,0944) у порівнянні із ДАІ ФОРМ/ГЛІ (частота; 0,13 проти 0,15 події на пацієнта на рік) та значуще зниження річного показника тяжких загострень під час лікування на 20% (95% ДІ: 3; 34; p=0,0221) у порівнянні із ДАІ ФОРМ/БУД (частота; 0,13 проти 0,16 події на пацієнта на рік).
В обох дослідженнях у разі застосування лікарського засобу Триксео Аеросфера користь у впливі на загострення спостерігалася у пацієнтів із помірним, тяжким або дуже тяжким ХОЗЛ.
Вплив на функцію легень. У дослідженні ETHOS та KRONOS у пацієнтів, що застосовували лікарський засіб Триксео Аеросфера, було зафіксовано покращення функції легень (ОФВ1) під час лікування у порівнянні із ДАІ ФОРМ/ГЛІ та ДАІ ФОРМ/БУД (див. табл. 1 для ETHOS і табл. 2 для KRONOS). В обох дослідженнях спостерігався стійкий ефект протягом 24-тижневого періоду лікування та впродовж 52 тиж у ETHOS.
Таблиця 1
Аналіз функції легень — ETHOS (спірометричне піддослідження)
| Показник | Триксео Аеросфера (N=747) | ДАІ ФОРМ/ ГЛІ (N=779) | ДАІ ФОРМ/ БУД (N=755) | Середня різниця, 95% ДІ | |
| Порівняння Триксео Аеросфера та ДАІ ФОРМ/ГЛІ | Порівняння Триксео Аеросфера та ДАІ ФОРМ/БУД | ||||
| Мінімальний ОФВ1 (мл) за 24 тижні, зміна середнього значення, обчисленого за МНК, у порівнянні з вихідним рівнем (СП) | 129 (6,5) | 86 (6,6) | 53 (6,5) | 43 мл (25; 60) р<0,0001 | 76 мл (58; 94) р<0,0001# |
| ОФВ1 AUC0–4 за 24 тиж; зміна середнього значення, обчисленого за МНК, у порівнянні з вихідним рівнем (СП) | 294 (6,3) | 245 (6,3) | 194 (6,3) | 49 мл (31; 66) р<0,0001# | 99 мл (82; 117) р<0,0001 |
# p-значення не скориговано з урахуванням множинності у ієрархічному плані тестування.
МНК — метод найменших квадратів, СП — стандартна похибка, ДI — довірчі інтервали, N — кількість осіб у вибірці «усі рандомізовані пацієнти відповідно до призначеного лікування» (ІТТ-популяція).
Таблиця 2
Аналіз функції легень — KRONOS
| Показник | Триксео Аеросфера (N=639) | ДАІ ФОРМ/ГЛІ (N=625) | ДАІ ФОРМ/БУД (N=314) | ТБХ ФОРМ/БУД (N=318) | Середня різниця, 95% ДІ | ||
| Порівняння Триксео Аеросфера та ДАІ ФОРМ/ГЛІ | Порівняння Триксео Аеросфера та ДАІ ФОРМ/БУД | Порівняння Триксео Аеросфера та ТБХ ФОРМ/БУД | |||||
| Мінімальний ОФВ1 (мл) за 24 тиж, зміна середнього значення, обчисленого за МНК, у порівнянні з вихідним рівнем (СП) | 147 (6,5) | 125 (6,6) | 73 (9,2) | 88 (9,1) | 22 мл (4; 39) р=0,0139 | 74 мл (52; 95) р<0,0001 | 59 мл (38; 80) р<0,0001# |
| ОФВ1 AUC0–4 за 24 тиж, зміна середнього значення, обчисленого за МНК, у порівнянні з вихідним рівнем (СП) | 305 (8,4) | 288 (8,5) | 201 (11,7) | 214 (11,5) | 16 мл (−6; 38) р=0,1448# | 104 мл (77; 131) р<0,0001 | 91 мл (64; 117) р<0,0001 |
# p-значення не скориговано з урахуванням множинності у ієрархічному плані тестування.
МНК — метод найменших квадратів, СП — стандартна похибка, ДI — довірчі інтервали, N — кількість осіб у вибірці «усі рандомізовані пацієнти відповідно до призначеного лікування» (ІТТ-популяція).
Полегшення вираженості симптому. У дослідженні ETHOS вихідні середні показники задишки коливалися в межах 5,8–5,9 у групах лікування. У пацієнтів, що застосовували лікарський засіб Триксео Аеросфера, було зафіксовано значуще зменшення вираженості задишки (виміряне за допомогою динамічного індексу задишки (TDI) за 24 тиж) у порівнянні з ДАІ ФОРМ/ГЛІ (0,40 одиниці; 95% ДІ: 0,24; 0,55; p<0,0001) та у порівнянні із ДАІ ФОРМ/БУД (0,31 одиниці; 95% ДІ: 0,15; 0,46; р<0,0001). Поліпшення підтримувалося протягом 52 тиж. У дослідженні KRONOS вихідні середні бали задишки коливалися в межах 6,3–6,5 у групах лікування. У пацієнтів, що застосовували лікарський засіб Триксео Аеросфера, було зафіксовано значне зменшення вираженості задишки за 24 тиж у порівнянні із ТБХ ФОРМ/БУД (0,46 одиниці; 95% ДІ: 0,16; 0,77; р=0,0031). Поліпшення у порівнянні із ДАІ ФОРМ/ГЛІ та ДАІ ФОРМ/БУД не досягли статистичної значущості.
Якість життя, обумовлена станом здоров’я. У дослідженні ETHOS у пацієнтів, що застосовували лікарський засіб Триксео Аеросфера, було зафіксовано значуще покращення стану здоров’я, пов’язаного з хворобою (відповідно до загального бала за опитувальником госпіталю Святого Георгія для пацієнтів із респіраторними захворюваннями (SGRQ)) за 24 тиж у порівнянні із ДАІ ФОРМ/ГЛІ (покращення −1,62; 95% ДІ: −2,27; −0,97; p<0,0001) та у порівнянні з ДАІ ФОРМ/БУД (покращення −1,38; 95% ДІ: −2,02; −0,73]; р<0,0001). Покращення підтримувалося протягом 52 тиж. У дослідженні KRONOS покращення у порівнянні із ДАІ ФОРМ/ГЛІ, ДАІ ФОРМ/БУД та ТБХ ФОРМ/БУД не досягли статистичної значущості.
Частота застосування лікарського засобу для невідкладної допомоги. У дослідженні ETHOS у пацієнтів, що застосовували лікарський засіб Триксео Аеросфера, було зафіксовано значуще зниження частоти застосування лікарського засобу для невідкладної допомоги під час лікування за 24 тиж у порівнянні із ДАІ ФОРМ/ГЛІ (різниця між видами терапії: −0,51 інгаляції/добу; 95% ДІ: −0,68; −0,34; p<0,0001) та ДАІ ФОРМ/БУД (різниця між видами терапії: −0,37 інгаляції/добу; 95% ДІ: −0,54; −0,20; р<0,0001). Зниження підтримувалося протягом 52 тиж. У дослідженні KRONOS відмінності у порівнянні із ДАІ ФОРМ/ГЛІ, ДАІ ФОРМ/БУД та ТБХ ФОРМ/БУД не були статистично значущими.
Фармакокінетика. Після інгаляції комбінації формотеролу, глікопіронію та будесоніду фармакокінетика кожного компонента була подібною до фармакокінетики, що спостерігається під час введення кожної діючої речовини окремо.
Використання зі спейсером. Після застосування здоровими добровольцями цього лікарського засобу зі спейсером Aerochamber Plus Flow-Vu збільшувалася загальна системна експозиція (виміряна за AUC0–t) будесоніду та глікопіронію на 33% та 55% відповідно, тоді як експозиція формотеролу залишалася незміненою.
Всмоктування
Будесонід. Після інгаляційного застосування цього лікарського засобу пацієнтами з ХОЗЛ Cmax будесоніду спостерігалась протягом 20–40 хв. Рівноважний стан досягається приблизно через 1 добу повторного застосування цього лікарського засобу, а ступінь експозиції приблизно в 1,3 раза вищий, ніж після першої дози.
Глікопіроній. Після інгаляційного застосування цього лікарського засобу пацієнтами з ХОЗЛ Cmax глікопіронію наставала за 6 хв. Рівноважний стан досягається за 3 доби повторного застосування цього лікарського засобу, а ступінь експозиції приблизно в 1,8 раза вищий, ніж після першої дози.
Формотерол. Після інгаляційного застосування цього лікарського засобу пацієнтами з ХОЗЛ Cmax формотеролу спостерігалась протягом 40–60 хв. Рівноважний стан досягається за 2 доби повторного приймання цього лікарського засобу, а ступінь експозиції приблизно в 1,4 раза вищий, ніж після першої дози.
Розподіл
Будесонід. Згідно з популяційним фармакокінетичним аналізом розрахунковий уявний об’єм розподілу будесоніду в рівноважному стані становить 1200 л. Зв’язування будесоніду з білками плазми крові становить приблизно 90%.
Глікопіроній. Згідно з популяційним фармакокінетичним аналізом розрахунковий уявний об’єм розподілу глікопіронію в рівноважному стані становить 5500 л. У діапазоні концентрацій 2–500 нмоль/л зв’язування глікопіронію з білками плазми крові коливалося в межах 43–54%.
Формотерол. Згідно із популяційним фармакокінетичним аналізом розрахунковий уявний об’єм розподілу формотеролу в рівноважному стані становить 2400 л. У діапазоні концентрацій 10–500 нмоль/л зв’язування формотеролу з білками плазми крові коливалося в межах 46–58%.
Біотрансформація
Будесонід зазнає значної (приблизно до 90%) біотрансформації під час першого проходження через печінку з утворенням метаболітів з низькою глюкокортикостероїдною активністю. Глюкокортикостероїдна активність основних метаболітів, 6-β-гідрокси-будесоніду та 16-α-гідрокси-преднізолону, становить менше ніж 1% від глюкокортикостероїдної активності будесоніду.
Глікопіроній. Згідно з даними наукової літератури та дослідженнями гепатоцитів людини in vitro метаболізм відіграє незначну роль у загальному виведенні глікопіронію. Було виявлено, що CYP 2D6 є переважним ферментом, який бере участь у метаболізмі глікопіронію.
Формотерол. Основний метаболізм формотеролу здійснюється шляхом прямого глюкуронування та О-деметилювання з подальшою кон’югацією з неактивними метаболітами. Вторинні метаболічні шляхи охоплюють деформілювання та кон’югацію із сульфатами. Було встановлено, що CYP 2D6 та CYP 2C в першу чергу відповідальні за О-деметилювання.
Виведення
Будесонід виводиться шляхом метаболізму, переважно під дією каталізатора, яким виступає фермент CYP 3A4. Метаболіти будесоніду виводяться з сечею в чистому вигляді або в кон’югованій формі. У сечі були виявлені лише незначні кількості незміненого будесоніду. Ефективний кінцевий Т½ будесоніду, визначений за допомогою фармакокінетичного популяційного аналізу, становив 5 год.
Глікопіроній. Після в/в введення 0,2 мг глікопіронію, міченого радіоактивним ізотопом, 85% дози виводилося із сечею за 48 год після введення; певна частина радіоактивності також виводилося із жовчю. Ефективний термінальний Т½ глікопіронію, визначений за допомогою популяційного фармакокінетичного аналізу, становив 15 год.
Формотерол. Виведення формотеролу вивчалося у шести здорових осіб після одночасного перорального та в/в введення формотеролу, міченого радіоактивним ізотопом. У цьому дослідженні 62% радіоактивності виводилося із сечею, а 24% — із калом. Ефективний Т½ формотеролу, визначений за допомогою популяційного фармакокінетичного аналізу, становив 10 год.
Особливі групи пацієнтів
Вік, стать, раса/етнічна приналежність і маса тіла. Корекція дози не потрібна у зв’язку з відсутністю впливу віку, статі або маси тіла пацієнта на фармакокінетичні параметри будесоніду, глікопіронію й формотеролу. Серед здорових учасників японського, китайського та європейського/американського походження не було виявлено значущих відмінностей у загальній системній експозиції (AUC) всіх компонентів препарату. Недостатньо фармакокінетичних даних для інших етнічних груп чи рас.
Печінкова недостатність. Фармакокінетичні дослідження цього лікарського засобу в пацієнтів із печінковою недостатністю не проводились. Проте, оскільки будесонід і формотерол виводяться переважно за участю печінкового метаболізму, то в пацієнтів із тяжким цирозом печінки можна очікувати зростання концентрації лікарського засобу в плазмі крові. Глікопіроній здебільшого виводиться із системного кровотоку шляхом ниркової екскреції, тому не очікується, що печінкова недостатність вплине на його системну експозицію.
Ниркова недостатність. Дослідження щодо оцінювання впливу ниркової недостатності на фармакокінетику будесоніду, глікопіронію та формотеролу не проводилися.
Вплив ниркової недостатності на експозицію будесоніду, глікопіронію та формотеролу протягом періоду до 24 тиж оцінювали в популяційному фармакокінетичному аналізі. Розрахункова швидкість клубочкової фільтрації (рШКФ) коливалася в межах 31–192 мл/хв, що відповідає діапазону від помірної ниркової недостатності до повної відсутності ниркової недостатності. Моделювання системної експозиції (AUC0–12) у пацієнтів з ХОЗЛ із помірною нирковою недостатністю (рШКФ 45 мл/хв) вказує на приблизне підвищення рівня глікопіронію на 68% в порівнянні з пацієнтами з ХОЗЛ із нормальною функцією нирок (рШКФ >90 мл/хв). Виявлено, що функція нирок не впливає на експозицію будесоніду або формотеролу. У пацієнтів з ХОЗЛ з низькою масою тіла та із помірною або тяжкою нирковою недостатністю системна експозиція глікопіронію може бути приблизно вдвічі більшою.
Показання Триксео аеросфера
Триксео Аеросфера показаний як підтримуюча терапія для дорослих пацієнтів із ХОЗЛ помірного та тяжкого ступеня, які не відповідають достатньою мірою на терапію комбінацією інгаляційного кортикостероїду та агоніста β2-адренорецепторів тривалої дії або комбінацією агоніста β2-адренорецепторів тривалої дії та антагоністів мускаринових рецепторів тривалої дії (інформацію про вплив на контроль симптомів та профілактику загострень див. у розділі Фармакодинаміка).
Застосування Триксео аеросфера
дозування
Рекомендована та максимальна доза становить дві інгаляції двічі на добу (дві інгаляції вранці та дві інгаляції ввечері).
У разі пропуску дози її треба прийняти якнайшвидше, а наступну дозу прийняти у звичайний час. Не потрібно приймати додаткову дозу лікарського засобу для компенсації пропущеної дози.
Особливі групи пацієнтів
Пацієнти літнього віку. Пацієнтам літнього віку корекція дози не потрібна (див. Фармакокінетика).
Ниркова недостатність. Цей лікарський засіб можна призначати в рекомендованій дозі пацієнтам із легкою та помірною нирковою недостатністю. Його також можна призначати в рекомендованій дозі пацієнтам із тяжкою нирковою недостатністю або термінальною стадією ниркової недостатності, які потребують діалізу, тільки якщо очікувана користь перевищує потенційні ризики (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ та Фармакокінетика).
Печінкова недостатність. Цей лікарський засіб можна призначати в рекомендованій дозі пацієнтам з легкою та помірною печінковою недостатністю. Його також можна призначати в рекомендованій дозі пацієнтам з тяжкою печінковою недостатністю, тільки якщо очікувана користь перевищує потенційні ризики (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ та Фармакокінетика).
Спосіб застосування
Для інгаляційного застосування.
Вказівки щодо застосування. Для забезпечення правильного введення лікарського засобу Триксео Аеросфера лікар або інший медичний працівник має показати пацієнтові, як правильно користуватись інгалятором; цей фахівець також повинен регулярно перевіряти правильність техніки проведення інгаляції пацієнтом. Треба рекомендувати пацієнту уважно прочитати інструкцію для медичного застосування та дотримуватися вказівок щодо застосування, наведених у ній.
Примітка. Важливо проінформувати пацієнта:
– Не використовувати інгалятор, якщо вологопоглинач, що знаходиться всередині мішечка з фольги, висипався зі своєї упаковки. Для досягнення найкращих результатів перед використанням інгалятор повинен певний час перебувати при кімнатній температурі.
– Підготувати інгалятор, струснувши його та, спрямовуючи розпилення в повітря, натиснувши на контейнер під тиском чотири рази перед першим застосуванням або двічі, якщо інгалятор не використовувався довше як сім днів, після щотижневого миття або якщо інгалятор падав на підлогу.
– Прополоскати ротову порожнину водою після інгаляції, щоб мінімізувати ризик розвитку орофарингеального кандидозу. Не ковтати.
Під час інгаляції лікарського засобу Триксео Аеросфера частина суспензії виштовхується з аерозольного контейнера. Коли пацієнт вдихає повітря через мундштук, одночасно натискаючи на інгалятор, доза лікарського засобу переміщається за вдихуваним повітрям у дихальні шляхи.
Пацієнти, яким тяжко скоординувати дії натискання на інгалятор з вдиханням, можуть використовувати лікарський засіб Триксео Аеросфера зі спейсером, щоб забезпечити правильне введення лікарського засобу. Триксео Аеросфера можна використовувати зі спейсерними пристроями, включно з Aerochamber Plus Flow-Vu (див. Фармакокінетика).
Прочитайте перед використанням інгалятора.
Уважно прочитайте цю інструкцію.
Ваш інгалятор Триксео Аеросфера (далі — інгалятор) може відрізнятися від інгаляторів, які ви використовували раніше.
Важлива інформація
Тільки для інгаляційного застосування.
Підготуйте інгалятор до першого використання.
Промивайте жовтий дозатор щотижня.
Застосовуйте 2 інгаляції лікарського засобу вранці та 2 інгаляції ввечері.
Частини інгалятора
 | Індикатор кількості інгаляцій Прикріплений до верхньої частини контейнера під тиском. |
Контейнер під тиском (всередині) Містить лікарський засіб | |
Дозатор Містить контейнер під тиском | |
Мундштук Розпилює лікарський засіб | |
Ковпачок мундштука Захищає мундштук, коли інгалятор не використовується | |
Показання індикатором кількості інгаляцій
Індикатор кількості інгаляцій буде відраховувати 1 дозу кожен раз, коли ви розпилюєте лікарський засіб.
| Покажчик доз Вказує на кількість інгаляцій, що залишилися. | 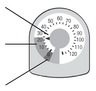 |
| Жовта зона Замовте новий інгалятор, коли покажчик знаходиться в жовтій зоні. | |
| Червона зона Викиньте інгалятор, коли покажчик знаходиться на відмітці 0 в червоній зоні | |
Не намагайтеся зробити інгаляцію, коли покажчик знаходиться на відмітці 0, оскільки ви не отримаєте повну дозу.
Замовлення нового інгалятора
Замовте новий інгалятор, коли покажчик індикатора кількості інгаляцій знаходиться в жовтій зоні.
Викидання інгалятора
Викиньте інгалятор, дотримуючись місцевих інструкцій, якщо:
– індикатор кількості інгаляцій показує 0
або
– через 3 міс після того, як інгалятор був витягнутий з мішечка із фольги.
Не використовуйте повторно та не використовуйте дозатор з контейнерами з лікарськими засобами від інших інгаляторів.
Не проколюйте та не кидайте контейнер під тиском у вогонь чи сміттєспалювач.
Перед першим використанням ̶
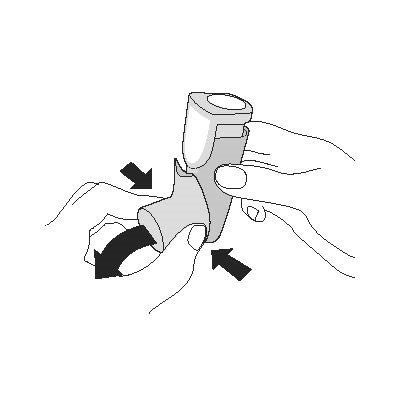
Перед першим використанням інгалятор необхідно активувати 4 рази
Перед першим використанням інгалятора активуйте його, щоб отримати потрібну кількість лікарського засобу під час його використання.
| Активація. Крок 1 |
| Зніміть ковпачок мундштука. |
 |
| Активація. Крок 2 | |
| Добре струсіть інгалятор і зробіть 1 тестове розпилення у повітря у напрямку від себе. Повторіть загалом 4 тестові розпилення, струшуючи інгалятор перед кожним тестовим розпиленням. | |
| ×4 загалом Струсіть інгалятор та зробіть тестові розпилення | 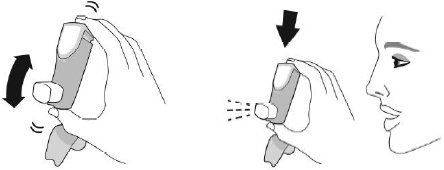 |
| Додаткові дози передбачені для підготовки інгалятора. Не пропускайте етап підготовки. | |
| Повторно підготуйте інгалятор до використання: після промивання дозатора якщо інгалятор впав якщо не використовували його більше ніж 7 днів | Для повторної підготовки розпиліть 2 тестових розпилення, струшуючи інгалятор перед кожним тестовим розпиленням. ×2 загалом Струсіть інгалятор та зробіть тестові розпилення |
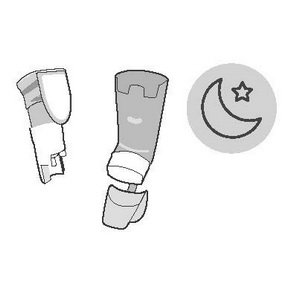
Щоденне використання. Вранці та ввечері застосовуйте лікарський засіб.
Добова доза: 2 інгаляції вранці та 2 інгаляції ввечері.
Прополощіть ротову порожнину водою після 2 інгаляцій, щоб запобігти грибковій інфекції.
| Крок 1 |
| Зніміть ковпачок мундштука. Перевірте мундштук на наявність сторонніх предметів і видаліть предмети перед використанням. |
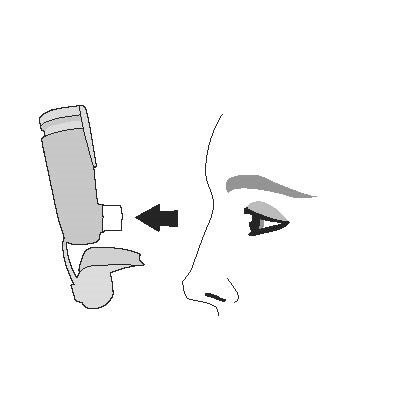 |
| Крок 2 | ||||
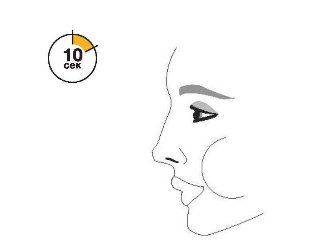
| Перед кожною інгаляцією добре струсіть інгалятор. | Повністю видихніть. | Помістіть мундштук у рот і зімкніть губи навколо мундштука. Нахиліть голову назад, утримуючи язик під мундштуком. | Почніть глибоко і повільно вдихати, роблячи 1 інгаляцію. Продовжуйте вдихати, поки більше не зможете вдихнути. | Затримайте дихання якомога довше, до 10 с. |
 |  |  |  |  |
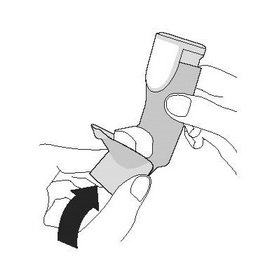
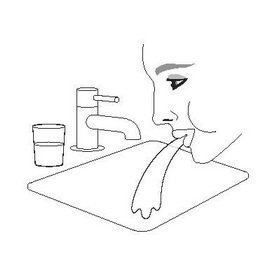
| Крок 3 | Крок 4 | Крок 5 |
 | Знову надіньте ковпачок на мундштук. | Прополощіть ротову порожнину водою. Виплюньте воду. Не ковтайте. |
 |  | |
Щотижневе промивання. Промивайте дозатор раз на тиждень.
Щотижня промивайте жовтий дозатор, щоб лікарський засіб не накопичувався і не блокував розпилення через мундштук.
Не допускайте намокання контейнера.
Повторно підготуйте інгалятор до використання після промивання.
| Промивання. Крок 1 | Промивання. Крок 2 |
| Зніміть контейнер та відкладіть. Не допускайте намокання контейнера. | Зніміть ковпачок мундштука. |
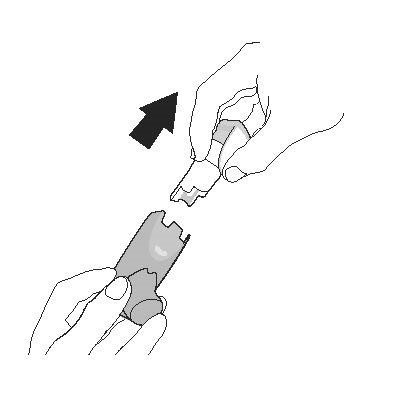 | 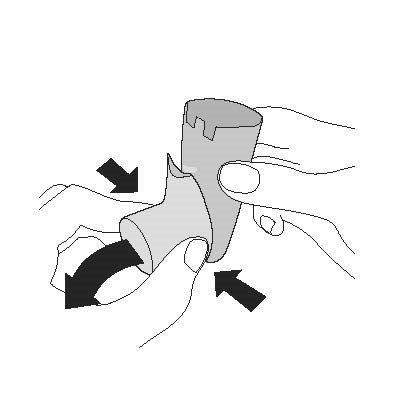 |
| Промивання. Крок 3 | Промивання. Крок 4 |
Пропустіть теплу воду через мундштук протягом 30 с, а потім через верхню частину дозатора протягом 30 с. Промивайте загалом 60 с. | Струсіть стільки води, скільки зможете. Не сушіть рушником або серветкою. |
| Промивання. Крок 5 | Промивання. Крок 6 |
| Подивіться всередину дозатора і мундштука щодо накопичення лікарського засобу. Якщо є будь-які накопичення, повторіть кроки промивання з 3 по 5. | Висушіть на повітрі, бажано протягом ночі. Не вставляйте контейнер у дозатор, якщо він все ще вологий. |
 |  |
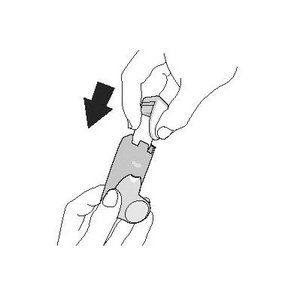
| Промивання. Крок 7 | Промивання. Крок 8 |
| Коли він висохне, спочатку встановіть ковпачок мундштука, а потім обережно вставте контейнер у дозатор. | Зробіть повторну підготовку шляхом проведення 2 тестових розпилень, струшуючи інгалятор перед кожним тестовим розпиленням. |
 | ×2 загалом Струсіть інгалятор та зробіть тестові розпилення |
Діти. Застосування лікарського засобу Триксео Аеросфера дітям (віком до 18 років) за показаннями ХОЗЛ не передбачене.
Протипоказання
гіперчутливість до діючих речовин або до будь-яких допоміжних речовин, перелічених у розділі Склад.
Побічна дія
резюме профілю безпеки
Профіль безпеки цього лікарського засобу характеризується ефектами, характерними для кортикостероїдів, антихолінергічних засобів та агоністів β2-адренорецепторів, тому що до таких класів лікарських засобів належать окремі компоненти цього комбінованого лікарського засобу. Найчастішими побічними реакціями у пацієнтів, які застосовували цей лікарський засіб, були пневмонія (4,6%), головний біль (2,7%) та інфекція сечовивідних шляхів (2,7%).
Перелік побічних реакцій у формі таблиці ґрунтується на досвіді застосування цього лікарського засобу в клінічних випробуваннях і досвіді застосування його окремих компонентів.
Представлені нижче побічні реакції наведено за класами систем органів та за частотою їх прояву: дуже часто (≥1/10), часто (≥1/100 до <1/10), нечасто (≥1/1000 до <1/100), рідко (≥1/10 000 до <1/1000), дуже рідко (<1/10 000), частота невідома (неможливо оцінити з огляду на наявні дані).
Таблиця 3
Побічні реакції, класифіковані в групи за частотою та класом системи органів
| Клас системи органів | Побічна реакція на застосування лікарського засобу | Частота |
| Інфекційні та паразитарні захворювання | Кандидоз ротової порожнини, пневмонія | Часто |
| З боку імунної системи | Гіперчутливість | Нечасто |
| Ангіоневротичний набряк | Частота невідома | |
| З боку ендокринної системи | Ознаки або симптоми системного впливу глюкокортикостероїдів, наприклад гіпофункція надниркових залоз | Дуже рідко |
| З боку обміну речовин і харчування | Гіперглікемія | Часто |
| Психічні порушення | Тривожність, безсоння | Часто |
| Депресія, збудження, занепокоєння, підвищена збудливість | Нечасто | |
| Ненормальна поведінка | Дуже рідко | |
| З боку нервової системи | Головний біль | Часто |
| Запаморочення, тремор | Нечасто | |
| З боку органа зору | Затуманений зір (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ), катаракта, глаукома | Частота невідома |
| З боку серця | Посилене серцебиття | Часто |
| Стенокардія, тахікардія, порушення ритму серця (наприклад фібриляція передсердь, надшлуночкова тахікардія та екстрасистолія) | Нечасто | |
| З боку органів дихання, грудної клітки та середостіння | Дисфонія, кашель | Часто |
| Подразнення горла, бронхоспазм | Нечасто | |
| З боку ШКТ | Нудота | Часто |
| Сухість у роті | Нечасто | |
| З боку шкіри та підшкірної клітковини | Утворення синців | Нечасто |
| З боку скелетно-м’язової та сполучної тканини | М’язові спазми | Часто |
| З боку нирок і сечовивідних шляхів | Інфекції сечовивідних шляхів | Часто |
| Затримка сечі | Нечасто | |
| Порушення загального характеру та реакції в місці введення | Біль у грудній клітці | Нечасто |
Опис окремих побічних реакцій. Пневмонія
KRONOS — це 24-тижневе дослідження, в якому взяли участь 1896 пацієнтів з ХОЗЛ помірного, тяжкого або дуже тяжкого ступеня (на момент скринінгу середній ОФВ1 після застосування бронхолітика становив 50% від прогнозованого значення, стандартне відхилення (СВ) 14%), 26% з яких перенесли загострення ХОЗЛ впродовж року, що передував зарахуванню в дослідження. Частота підтверджених випадків пневмонії, зареєстрованих за 24 тиж, дорівнювала 1,9% (12 пацієнтів) в групі Триксео Аеросфера (n=639), 1,6% (10 пацієнтів) в групі дозувального інгалятора (ДАІ) формотеролу фумарату дигідрату/глікопіронію (ФОРМ/ГЛІ) 5/7,2 мкг (n=625), 1,9% (6 пацієнтів) в групі ДАІ формотеролу фумарату дигідрату/будесоніду (ФОРМ/БУД) 5/160 мкг (n=314) та 1,3% (4 пацієнти) в групі турбухалера формотеролу фумарату дигідрату/будесоніду (ФОРМ/БУД) 6/200 мкг (n=318). У дослідженні KRONOS не було смертельних випадків пневмонії під час застосування лікарського засобу Триксео Аеросфера.
ETHOS — це 52-тижневе дослідження, в якому взяли участь 8529 пацієнтів (в популяції для оцінювання безпеки) з ХОЗЛ помірного, тяжкого або дуже тяжкого ступеня або тяжкими загостреннями в анамнезі протягом попередніх 12 міс (на момент скринінгу середній ОФВ1 після застосування бронхолітика становив 43% від прогнозованого значення, СВ 10%). Частота підтверджених випадків пневмонії дорівнювала 4,2% (90 пацієнтів) у групі Триксео Аеросфера (n=2144), 3,5% (75 пацієнтів) у групі ДАІ формотеролу фумарату дигідрату/глікопіронію/будесоніду (ФОРМ/ГЛІ/БУД) 5/7,2 /80 мкг (n=2124), 2,3% (48 суб’єктів) у групі ДАІ ФОРМ/ГЛІ 5/7,2 мкг (n=2125) та 4,5% (96 суб’єктів) у групі ДАІ ФОРМ/БУД 5/160 мкг (n=2136). У дослідженні ETHOS було зареєстровано п’ять смертельних випадків пневмонії під час етапу лікування (два в групі ДАІ ФОРМ/ГЛІ/БУД 5/7,2/80 мкг, три в групі ДАІ ФОРМ/ГЛІ та жодного в групі Триксео Аеросфера).
Повідомлення про побічні реакції. Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їх законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
Особливості застосування
цей лікарський засіб не призначений для лікування гострих станів.
Цей лікарський засіб не показаний для лікування гострих епізодів бронхоспазму, тобто для невідкладної допомоги.
Парадоксальний бронхоспазм. Застосування формотеролу/глікопіронію/будесоніду може спричинити парадоксальний бронхоспазм із раптовим свистячим диханням і задишкою після введення дози; такий стан може бути небезпечним для життя. Терапію цим лікарським засобом треба негайно припинити у разі виникнення парадоксального бронхоспазму. Пацієнта, в якого виник парадоксальний бронхоспазм, потрібно обстежити та в разі потреби призначити альтернативну терапію.
Погіршення перебігу захворювання. Не рекомендується різко припиняти терапію цим лікарським засобом. Якщо пацієнти вважають лікування неефективним, треба продовжити лікування, водночас звернувшись за медичною допомогою. Якщо пацієнту доводиться все частіше застосовувати бронхолітик для полегшення симптомів, це вказує на погіршення перебігу основного захворювання та необхідність перегляду схеми лікування. Раптове та прогресуюче погіршення симптомів ХОЗЛ потенційно загрожує життю, тому пацієнту треба терміново пройти медичне обстеження.
Вплив на серцево-судинну систему. Після введення антагоністів мускаринових рецепторів та симпатоміметиків, включно з глікопіронієм і формотеролом, можуть спостерігатися серцево-судинні ефекти, такі як порушення серцевого ритму, наприклад фібриляція передсердь і тахікардія. Цей лікарський засіб потрібно застосовувати з обережністю пацієнтам з клінічно значущими неконтрольованими й тяжкими серцево-судинними захворюваннями, такими як нестабільна ІХС, гострий інфаркт міокарда, кардіоміопатія, порушення ритму серця та тяжка серцева недостатність.
Треба також бути обережними, лікуючи пацієнтів з відомим або підозрюваним подовженням інтервалу Q–Tc (Q–Tc >450 мс у чоловіків або >470 мс у жінок), незалежно від того, є це порушення вродженим чи викликаним лікарськими засобами.
Системні ефекти кортикостероїдів. Системні ефекти можуть виникати під час застосування будь-яких інгаляційних кортикостероїдів, особливо у високих дозах протягом тривалого періоду. Ймовірність виникнення таких ефектів набагато менша у разі застосування інгаляційних форм кортикостероїдів у порівнянні з пероральними. До можливих системних ефектів належать синдром Кушинга, кушингоїдні ознаки, пригнічення функції надниркових залоз, зниження мінеральної щільності кісткової тканини, катаракта та глаукома. Потрібно враховувати можливий вплив лікарського засобу на мінеральну щільність кісткової тканини, особливо у пацієнтів, які застосовують лікарський засіб у високих дозах протягом тривалого періоду та які мають супутні фактори ризику остеопорозу.
Порушення зору. Під час системного та місцевого застосування кортикостероїдів можуть бути зареєстровані випадки порушення зору. Якщо у пацієнта наявні такі симптоми, як розмитість зору або інші порушення зору, його варто направити на консультацію до офтальмолога для встановлення можливої причини, якою може бути катаракта, глаукома або рідкісні захворювання, зокрема центральна серозна хоріоретинопатія; такі порушення зору були зареєстровані після застосування системних і місцевих кортикостероїдів (див. ПОБІЧНА ДІЯ).
Перехід з пероральної терапії. Особлива увага потрібна в разі лікування пацієнтів, які переходять з перорального застосування кортикостероїдів, оскільки у них впродовж значного часу може зберігатися ризик порушення функції надниркових залоз. Пацієнти, які потребують високодозової терапії кортикостероїдами або тривалого лікування інгаляційними кортикостероїдами в найвищій рекомендованій дозі, також можуть бути у групі ризику. У таких пацієнтів у разі сильного стресу можуть виникати симптоми наднирникової недостатності. Під час періодів стресу або у разі планових хірургічних втручань треба розглянути можливість додаткового лікування системними кортикостероїдами.
Пневмонія у пацієнтів з ХОЗЛ. У пацієнтів з ХОЗЛ, які отримують інгаляційні кортикостероїди, спостерігалося підвищення частоти випадків пневмонії, включно з пневмонією, що потребує госпіталізації. Існує низка доказів підвищеного ризику виникнення пневмонії у разі підвищення дози кортикостероїду, проте це не було остаточно продемонстровано в жодному з досліджень.
Для інгаляційних кортикостероїдів відсутні вичерпні клінічні докази розбіжностей щодо величини ризику розвитку пневмонії.
Лікарям потрібно бути уважними щодо можливого розвитку пневмонії у пацієнтів з ХОЗЛ, оскільки клінічні ознаки цього інфекційного захворювання збігаються із симптомами загострення ХОЗЛ.
Фактори ризику розвитку пневмонії у пацієнтів з ХОЗЛ включають куріння, літній вік, низький індекс маси тіла та тяжке ХОЗЛ.
Гіпокаліємія. Під час застосування терапії агоністами β2-адренорецепторів можливий розвиток потенційно серйозної гіпокаліємії. Вона може призвести до побічних реакцій з боку серцево-судинної системи. Особлива обережність рекомендується у разі тяжкого ХОЗЛ, оскільки цей ефект може посилюватися гіпоксією. Гіпокаліємія також може посилюватися у разі одночасного застосування цього лікарського засобу з іншими лікарськими засобами, які можуть спричиняти гіпокаліємію, такими як похідні ксантину, стероїди та діуретики (див. ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ).
Гіперглікемія. Інгаляція агоністів β2-адренорецепторів у високих дозах може призводити до підвищення рівня глюкози в плазмі крові. Тому під час лікування потрібно контролювати рівень глюкози в крові відповідно до встановлених рекомендацій для пацієнтів з цукровим діабетом.
Супутні захворювання. Цей лікарський засіб треба з обережністю застосовувати пацієнтам із тиреотоксикозом.
Антихолінергічна активність. Через його антихолінергічну активність цей лікарський засіб потрібно з обережністю застосовувати пацієнтам із симптоматичною гіперплазією передміхурової залози, затримкою сечі або закритокутовою глаукомою. Пацієнти повинні бути поінформовані про ознаки та симптоми гострої закритокутової глаукоми, а також про необхідність припинення застосування цього лікарського засобу та негайне звернення до лікаря в разі появи будь-яких із таких ознак чи симптомів.
Одночасне застосування цього лікарського засобу з іншими лікарськими засобами, що містять антихолінергічні препарати, не рекомендується (див. ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ).
Ниркова недостатність. Оскільки глікопіроній виводиться переважно нирками, пацієнтам із тяжкою нирковою недостатністю (кліренс креатиніну <30 мл/хв), в тому числі пацієнтам із термінальною стадією ниркової недостатності, що потребує діалізу, потрібно призначати цей лікарський засіб тільки в тому разі, якщо очікувана користь перевищує потенційні ризики (див. Фармакокінетика).
Печінкова недостатність. Пацієнтам з тяжкою печінковою недостатністю потрібно призначати цей лікарський засіб тільки в тому разі, якщо очікувана користь перевищує потенційні ризики (див. Фармакокінетика). Такі пацієнти мають перебувати під наглядом щодо можливих побічних реакцій.
Застосування у період вагітності або годування грудьми
Вагітність. Дані щодо застосування будесоніду, глікопіронію та формотеролу вагітними жінками відсутні або обмежені.
Дані про застосування інгаляційного будесоніду більш ніж 2500 вагітними жінками вказують на відсутність підвищеного тератогенного ризику, пов’язаного з будесонідом. Клінічні дослідження разової дози показали, що дуже невелика кількість глікопіронію долає плацентарний бар’єр.
Відсутній досвід або дані щодо проблем безпеки під час використання пропеленту норфлурану (HFA 134a) в період вагітності або годування грудьми. Проте дослідження впливу HFA 134a на репродуктивну функцію та ембріофетальний розвиток у тварин не виявили клінічно значущих побічних реакцій.
Дослідження репродуктивної токсичності цього лікарського засобу на тваринах не проводилися. Було показано, що будесонід спричиняє ембріофетальну токсичність у щурів і кролів; цей ефект притаманний лікарським засобам класу глюкокортикоїдів. У дуже високих дозах/за дуже високих рівнів системної експозиції формотерол спричиняв викидні, а також зниження маси тіла немовляти при народженні та постнатальної виживаності у ранніх термінах, тоді як глікопіроній суттєво не впливав на репродуктивну функцію.
Призначення цього лікарського засобу вагітним жінкам треба розглядати тільки у разі, якщо очікувана користь для матері виправдовує потенційний ризик для плода.
Годування грудьми. Клініко-фармакологічне дослідження показало, що будесонід виводиться з грудним молоком. Проте він не був виявлений в плазмі крові немовлят. На підставі фармакокінетичних параметрів концентрація будесоніду в плазмі крові немовляти становить менше ніж 0,17% від концентрації в плазмі крові матері. Таким чином, при годуванні грудьми дітей, матері яких отримують терапевтичні дози цього лікарського засобу, не очікується жодних ефектів від будесоніду. Невідомо, чи виводиться глікопіроній та формотерол з грудним молоком. Є дані про проникнення глікопіронію та формотеролу в материнське молоко у щурів.
Призначення цього лікарського засобу жінкам, які годують грудьми, треба розглядати тільки у разі, якщо очікувана користь для матері переважає будь-який можливий ризик для дитини.
Фертильність. Дослідження на щурах показали несприятливий вплив формотеролу на фертильність тільки у дозах, що перевищують максимальні дози для людини. Будесонід і глікопіроній окремо не чинили несприятливого впливу на фертильність щурів. Малоймовірно, що цей лікарський засіб, призначений у рекомендованих дозах, вплине на фертильність у людей.
Здатність впливати на швидкість реакції при керуванні транспортними засобами або іншими механізмами. Лікарський засіб Триксео Аеросфера не впливає або має незначний вплив на здатність керувати транспортними засобами та працювати з іншими механізмами. Проте запаморочення є нечастою побічною реакцією, на яку треба зважати при керуванні транспортними засобами або роботі з іншими механізмами.
Взаємодія з іншими лікарськими засобами
фармакокінетичні взаємодії
Клінічні дослідження взаємодії цього лікарського засобу з іншими лікарськими засобами не проводилися, проте ймовірність метаболічних взаємодій вважається низькою на підставі досліджень in vitro (див. Фармакокінетика).
Формотерол не пригнічує ферменти CYP 450 у терапевтично значущих концентраціях (див. Фармакокінетика). Будесонід і глікопіроній не інгібують та не індукують ферменти CYP 450 у терапевтично значущих концентраціях.
Метаболізм будесоніду в першу чергу опосередковується дією ферменту CYP 3A4 (див. Фармакокінетика). Очікується, що в разі супутнього застосування потужних інгібіторів CYP 3A, таких як ітраконазол, кетоконазол, інгібітори протеази ВІЛ і лікарські засоби, що містять кобіцистат, підвищується ризик розвитку системних побічних реакцій; такого супутнього застосування варто уникати, якщо користь не переважає підвищений ризик розвитку системних побічних реакцій на кортикостероїди. Якщо все-таки приймається рішення про таке супутнє застосування, пацієнти мають перебувати під наглядом щодо системних побічних реакцій на кортикостероїди. Це спостереження має обмежене клінічне значення в разі короткострокового (1–2 тиж) лікування.
Обмежені дані стосовно зазначених вище видів взаємодії у разі застосування високих доз інгаляційної форми будесоніду вказують на те, що можливе значне підвищення плазмових рівнів (у середньому в 4 рази), якщо ітраконазол у дозі 200 мг 1 раз на добу застосовується разом з інгаляційною формою будесоніду (разова доза 1000 мкг).
Оскільки глікопіроній виводиться здебільшого нирками, можлива взаємодія цього препарату з лікарськими засобами, що впливають на механізми ниркової екскреції. In vitro глікопіроній є субстратом для ниркових транспортерів OCT2 та MATE1/2K. Дослідження впливу циметидину, маркерного інгібітора OCT2 й MATE1, на розподіл інгаляційної форми глікопіронію показало обмежене збільшення його загальної системної експозиції (AUC0–t) на 22% й незначне зниження ниркового кліренсу на 23% через одночасне введення циметидину.
Фармакодинамічні взаємодії
Інші антимускаринові засоби та симпатоміметики. Спільне застосування цього лікарського засобу з іншими лікарськими засобами, що містять антихолінергічні та/або агоністи β2-адренорецепторів тривалої дії, не вивчалося та не рекомендується, тому що воно може посилювати відомі побічні реакції на інгаляційні антагоністи мускаринових рецепторів або β2-адренорецепторів (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ та ПЕРЕДОЗУВАННЯ).
У разі одночасного застосування інших β-адренергічних лікарських засобів можуть відзначатися потенційно адитивні ефекти; тому потрібно бути обережними, призначаючи інші β-адренергічні лікарські засоби одночасно з формотеролом.
Гіпокаліємія, спричинена лікарськими засобами. Можлива початкова гіпокаліємія, яка може посилюватися в разі супутнього застосування лікарських засобів, включно з похідними ксантину, кортикостероїдами та діуретиками, що не є калійзберігаючими (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ). Гіпокаліємія може посилити схильність до аритмії у пацієнтів, які отримують глікозиди наперстянки.
Блокатори β-адренорецепторів (в тому числі очні краплі) можуть послаблювати або пригнічувати дію формотеролу. Треба уникати одночасного застосування блокаторів β-адренорецепторів, за винятком випадків, коли очікувана користь перевищує потенційні ризики. Якщо потрібні блокатори β-адренорецепторів, перевага віддається кардіоселективним засобам цього класу.
Інші фармакодинамічні взаємодії. У разі одночасного застосування хінідину, дизопіраміду, прокаїнаміду, антигістамінних лікарських засобів, інгібіторів МАО, трициклічних антидепресантів та фенотіазинів може подовжуватися інтервал Q–T і підвищуватися ризик виникнення шлуночкових аритмій. Крім того, L-допа, L-тироксин, окситоцин та алкоголь можуть погіршувати толерантність серця до β2-симпатоміметиків.
Супутнє застосування інгібіторів МАО, включно з лікарськими засобами з подібними властивостями, такими як фуразолідон і прокарбазин, може провокувати гіпертонічні реакції.
У пацієнтів, які отримують супутню анестезію з використанням галогенованих вуглеводнів, існує підвищений ризик виникнення аритмії.
Передозування
передозування лікарським засобом Триксео Аеросфера може призвести до посилення ознак і симптомів, що є побічними реакціями на антихолінергічні лікарські засоби та/або агоністи β2-адренорецепторів. Найчастішими з них є нечіткість зору, сухість у роті, нудота, м’язовий спазм, тремор, головний біль, посилене серцебиття та систолічна АГ. У разі тривалого застосування в надмірних дозах можливе виникнення системних ефектів глюкокортикостероїдів.
Специфічне лікування у разі передозування цим лікарським засобом відсутнє. У разі передозування пацієнту потрібно проводити підтримувальну терапію з належним контролем, якщо необхідно.
Умови зберігання
при температурі не вище 30 °С. Не піддавати впливу температури вище 50 °С. Не проколювати контейнер під тиском гострими предметами.
Зберігати у сухому місці.
Термін придатності. 24 міс.
Використати протягом 3 міс після відкриття мішечка з фольги.
