Соліква (Soliqua)
Соліква інструкція із застосування
Склад
Допоміжні речовини: гліцерин (85%); метіонін: метакрезол; цинку хлорид; кислота хлористоводнева, концентрована: натрію гідроксид; вода для ін’єкцій.
Інсулін гларгін - 100 ОД/мл
Ліксісенатид - 50 мкг/мл
Фармакологічні властивості
фармакодинаміка. Механізм дії. Препарат Соліква — це комбінація двох діючих речовин з взаємодоповнюючими механізмами дії для покращення контролю глікемії, а саме інсуліну гларгіну (аналог базального інсуліну, головною метою якого є контроль рівнів глюкози в плазмі крові натще) та ліксисенатиду (агоніст рецепторів до глюкагоноподібного пептиду-1 (ГПП-1), головною метою якого є контроль постпрандіальних рівнів глюкози).
Інсулін гларгін. Найважливішою дією інсуліну, в тому числі інсуліну гларгіну, є регуляція метаболізму глюкози. Інсулін та його аналоги знижують рівень глюкози в крові за рахунок стимуляції її захоплення периферичними тканинами, зокрема скелетними м’язами та жировою тканиною, а також пригнічення утворення глюкози в печінці. Інсулін пригнічує ліполіз та протеоліз, а також стимулює синтез білків.
Ліксисенатид є агоністом рецепторів до ГПП-1. Рецептори до ГПП-1 є мішенню природного ГПП-1 — ендогенного гормону інкретину, який потенціює глюкозозалежну секрецію інсуліну β-клітинами та пригнічує секрецію глюкагону α-клітинами підшлункової залози.
Ліксисенатид стимулює секрецію інсуліну при підвищенні рівня глюкози в крові, не впливаючи при цьому на секрецію інсуліну і виникнення гіпоглікемії. Паралельно пригнічується секреція глюкагону. У випадку виникнення гіпоглікемії рятувальний механізм у вигляді секреції глюкагону зберігається. Постпрандіальне введення ліксисенатиду також сповільнює випорожнення шлунка, знижуючи таким чином швидкість абсорбції та надходження в систему кровообігу глюкози, що міститься в їжі.
Фармакодинаміка. Комбінація інсуліну гларгіну та ліксисенатиду не впливає на фармакодинаміку інсуліну гларгіну. Вплив комбінації інсуліну гларгіну та ліксисенатиду на фармакодинаміку ліксисенатиду не вивчався в рамках досліджень І фази.
Враховуючи відносно постійний профіль «концентрація/час» інсуліну гларгіну впродовж 24 год без виражених піків при застосуванні його окремо, профіль «швидкість утилізації глюкози/час» був подібним при застосуванні комбінації інсуліну гларгіну та ліксисенатиду.
Період дії інсулінів, у тому числі препарату Соліква, може відрізнятися в різних осіб і навіть бути різним в однієї й тієї самої особи.
Інсулін гларгін. За результатами клінічних досліджень із застосуванням інсуліну гларгіну (100 ОД/мл), гіпоглікемічний ефект на молярній основі (тобто при застосуванні однакових доз) інсуліну гларгіну при його в/в введенні є приблизно таким самим, як людського інсуліну.
Ліксисенатид. За результатами 28-денного плацебо-контрольованого дослідження серед пацієнтів з цукровим діабетом 2-го типу застосування ліксисенатиду в дозі 5–20 мкг викликало статистично значуще зниження постпрандіальних рівнів глюкози після сніданку, обіду та вечері.
Випорожнення шлунка. Після прийому стандартної міченої досліджуваної їжі в рамках зазначеного вище дослідження підтверджено, що ліксисенатид сповільнює випорожнення шлунка, знижуючи таким чином швидкість постпрандіальної абсорбції глюкози. Ефект сповільнення випорожнення шлунка підтримувався до завершення дослідження.
Клінічна ефективність та безпека. Безпека та ефективність препарату Соліква стосовно контролю глікемії оцінювалися у трьох рандомізованих клінічних дослідженнях за участю пацієнтів із цукровим діабетом 2-го типу:
– додавання до метформіну (у пацієнтів, що не отримували інсулін);
– перехід з базального інсуліну;
– перехід з агоніста рецепторів ГПП-1.
У кожному з досліджень з активним контролем лікування лікарським засобом Соліква зумовлювало клінічно та статистично значуще покращення рівня глікованого гемоглобіну (HbA1c).
Досягнення нижчих рівнів HbA1c та більш значного зниження рівнів HbA1c не призводило до підвищення частоти виникнення гіпоглікемії при комбінованому лікуванні порівняно з монотерапією інсуліном гларгіном (див. ПОБІЧНА ДІЯ).
У рамках клінічного дослідження з додаванням препарату до метформіну лікування розпочиналося з 10 поділок дозування (10 ОД інсуліну гларгіну та 5 мкг ліксисенатиду). У рамках клінічного дослідження з переходом з базального інсуліну початкова доза становила 20 поділок дозування (20 ОД інсуліну гларгіну та 10 мкг ліксисенатиду) або 30 поділок дозування (30 ОД інсуліну гларгіну та 10 мкг ліксисенатиду) (див. ЗАСТОСУВАННЯ) залежно від попереднього дозування інсуліну. В обох дослідженнях титрування дози здійснювалося один раз на тиждень, враховуючи рівні глюкози в плазмі крові натще, що визначалися самостійно.
Додавання до метформіну (у пацієнтів, що не отримували інсулін). Клінічне дослідження серед пацієнтів із цукровим діабетом 2-го типу, у яких на фоні лікування пероральним протидіабетичним препаратом не відзначалося належного контролю захворювання. Усього в рамках відкритого 30-тижневого дослідження з активним контролем рандомізовано 1170 пацієнтів з цукровим діабетом 2-го типу для оцінки ефективності та безпеки препарату Соліква порівняно з окремими його компонентами — інсуліном гларгіном (100 ОД/мл) та ліксисенатидом (20 мкг).
Пацієнти з цукровим діабетом 2-го типу, які отримували лікування метформіном у вигляді монотерапії або метформіном в комбінації з іншим пероральним протидіабетичним препаратом, яким міг бути препарат сульфонілсечовини, глінід, інгібітор натрійзалежного котранспортера глюкози-2 (НЗКТГ-2) або інгібітор дипептидилпептидази-4 (ДПП-4), та у яких не відзначалося належного контролю захворювання на фоні даного лікування (рівні HbA1c коливалися в межах 7,5–10,0% у пацієнтів, які раніше отримували метформін у вигляді монотерапії, та в межах 7,0–9,0% у пацієнтів, які раніше отримували лікування метформіном в комбінації з іншим пероральним протидіабетичним препаратом), були включені у вступний період впродовж 4 тиж. Протягом цієї вступної фази здійснювалася оптимізація лікування метформіном, а прийом інших пероральних протидіабетичних препаратів припинявся. Наприкінці вступного періоду пацієнти, у яких продовжували відзначати неналежний контроль захворювання (рівні HbA1c коливались в межах 7–10%), були рандомізовані в групи, які отримували препарат Соліква, інсулін гларгін або ліксисенатид. З 1479 пацієнтів, які були включені у вступну фазу дослідження, 1170 були рандомізовані. Головними причинами, які не дозволяли включити пацієнтів у рандомізаційну фазу дослідження, були рівні глюкози в плазмі крові натще >13,9 ммоль/л та рівні HbA1c <7% або >10% наприкінці вступної фази дослідження.
Характеристики популяції рандомізованих пацієнтів з цукровим діабетом 2-го типу були наступними: середній вік становив 58,4 року, при цьому вік більшості пацієнтів (57,1%) становив 50–64 роки, 50,6% пацієнтів були чоловіками. Середній індекс маси тіла (ІМТ) на вихідному рівні становив 31,7 кг/м2, при цьому у 63,4% пацієнтів ІМТ становив >30 кг/м2. Середня тривалість цукрового діабету становила близько 9 років. Метформін був обов’язковою фоновою терапією, а 58% пацієнтів отримували на скринінгу також інший пероральний протидіабетичний препарат, яким у 54% пацієнтів був препарат сульфонілсечовини.
На 30-й тиждень лікування препаратом Соліква зумовлювало статистично значуще покращення рівнів HbA1c (р<0,0001) порівняно з окремими компонентами. За результатами попередньо визначеного аналізу цієї первинної кінцевої точки відзначені відмінності узгоджувалися стосовно вихідних рівнів HbA1c (<8% або ≥8%) або перорального протидіабетичного лікування на вихідному рівні (метформін у вигляді монотерапії або метформін у комбінації з іншим пероральним протидіабетичним препаратом).
Інформація щодо інших кінцевих точок дослідження наведена в табл. 1 та на рис. 1.
Таблиця 1.
Результати клінічного дослідження з додаванням препарату до метформіну на 30-й тиждень (популяція пацієнтів, які отримували лікування)
| Препарат Соліква | Інсулін гларгін | Ліксисенатид | |
| Кількість пацієнтів, які отримали лікування | 468 | 466 | 233 |
| Рівень HbA1c (%) | |||
| Вихідний рівень (середнє значення, після вступної фази) | 8,1 | 8,1 | 8,1 |
| Завершення дослідження (середнє значення) | 6,5 | 6,8 | 7,3 |
| Зміна порвняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення) | −1,6 | −1,3 | −0,9 |
| Відмінність порівняно з інсуліном гларгіном (95% довірчий інтервал) (р-значення) | −0,3 (−0,4; −0,2) (<0,0001) | ||
| Відмінність порівняно з ліксисенатидом (95% довірчий інтервал) (р-значення) | −0,8 (−0,9; −0,7) (<0,0001) | ||
| Кількість пацієнтів (%), у яких були досягнуті рівні HbA1c <7% на 30-й тиждень* | 345 (74%) | 277 (59%) | 77 (33%) |
| Рівень глюкози в плазмі крові натще (ммоль/л) | |||
| Вихідний рівень (середнє значення) | 9,88 | 9,75 | 9,79 |
| Завершення дослідження (середнє значення) | 6,32 | 6,53 | 8,27 |
| Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення) | −3,46 | −3,27 | −1,50 |
| Зміна порівняно з інсуліном гларгіном, визначена методом найменших квадратів (середнє значення) (95% довірчий інтервал) (р-значення) | −0,19 (−0,420: 0,0381) (0,1017) | ||
| Зміна порівняно з ліксисенатидом, визначена методом найменших квадратів (середнє значення) (95% довірчий інтервал) (р-значення) | −1.96 (−2,246; −1,682) (< 0,0001) | ||
| Постпрандіальний рівень глюкози через 2 год після прийому їжі (ммоль/л)** | |||
| Вихідний рівень (середнє значення) | 15,19 | 14.61 | 14.72 |
| Завершення дослідження (середнє значення) | 9,15 | 11,35 | 9.99 |
| Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів | −5,68 | −3,31 | −4,58 |
| Зміна порівняно з інсуліном гларгіном, визначена методом найменших квадратів (середнє значення) (95% довірчий інтервал) | −2,38 (−2,79; −1,96) | ||
| Зміна порівняно з ліксисенатидом, визначена методом найменших квадратів (середнє значення) (95% довірчий інтервал) | −1,10 (−1,63; −0,57) | ||
| Середня маса тіла, кг | |||
| Вихідний рівень (середнє значення) | 89,4 | 89,8 | 90,8 |
| Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення) | −0,3 | 1,1 | −2.3 |
| Порівняння з інсуліном гларгіном (95% довірчий інтервал) (р-значення) | −1,4 (−1,9; −0,9) (<0,0001) | ||
| Порівняння з ліксисенатидом (95% довірчий інтервал)* | 3,01 (1,4; 2,6) | ||
| Кількість пацієнтів (%), у яких були досягнуті рівні НЬА1с <7,0% без приросту маси тіла на 30-й тиждень | 202 (43,2%) | 117 (25,1%) | 65 (27,9%) |
| Пропорційна відмінність порівняно з інсуліном гларгіном (95% довірчий інтервал) (р-значення) | 18,1 (12,2; 24,0) (<0,0001) | ||
| Пропорційна відмінність порівняно з ліксисенатидом (95% довірчий інтервал)* | 15,2 (8,1; 22,4) | ||
| Добова доза інсуліну гларгіну | |||
| Доза інсуліну на 30-й тиждень, визначена методом найменших квадратів (середнє значення) | 39,8 | 40,5 | Не застосовано |
*Не включено в попередньо визначеній процедурі дослідження поступового зниження рівнів.
**Постпрандіальний рівень глюкози через 2 год після прийому їжі мінус рівень глюкози перед прийомом їжі.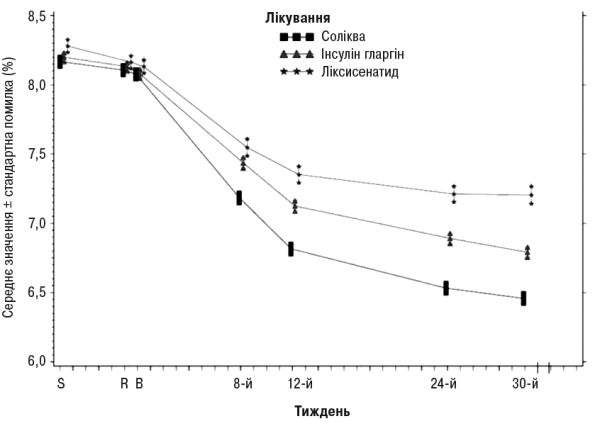
Рис. 1. Середні рівні HbA1c (%) під час візитів протягом 30 тиж лікування
У пацієнтів групи препарату Соліква відзначено статистично значимо вище зниження середнього профілю рівнів глюкози в плазмі крові, що визначалися самостійно у 7 часових точках, від вихідного рівня до 30-го тижня (–3,35 ммоль/л) порівняно з пацієнтами групи інсуліну гларгіну (–2.66 ммоль/л; відмінність –0,69 ммоль/л) та з пацієнтами групи ліксисенатиду (–1,95 ммоль/л; відмінність –1,40 ммоль/л) (р<0,0001 для обох порівнянь). На всіх часових точках на 30-й тиждень середні рівні глюкози в плазмі крові були нижчими в групі препарату Соліква порівняно як з групою інсуліну гларгіну, так і з групою ліксисенатиду, за винятком тільки рівнів глюкози перед сніданком, які були подібними в групі лікарського засобу Соліква та в групі інсуліну гларгіну.
Перехід з базального інсуліну. Клінічне дослідження серед пацієнтів з цукровим діабетом 2-го типу, у яких на фоні лікування базальним інсуліном не відзначалося належного контролю захворювання. Загалом 736 пацієнтів з цукровим діабетом 2-го типу взяли участь у рандомізованому 30-тижневому з активним контролем відкритому з 2 групами лікування в паралельних групах багатоцентровому дослідженні з оцінкою ефективності та безпеки препарату Соліква порівняно з інсуліном гларгіном (100 ОД/мл).
Пацієнти з цукровим діабетом 2-го типу, які підлягали скринінгу, отримували лікування базальним інсуліном впродовж щонайменше 6 міс в стабільній добовій дозі 15–40 МО у вигляді монотерапії або в комбінації з одним або двома пероральними протидіабетичними препаратами (метформін, препарат сульфонілсечовини, глінід, інгібітор НЗКТГ-2 або інгібітор ДПП-4). При цьому рівні HbA1c у них становили 7,5–10% (середній рівень НbАІс на скринінгу становив 8,5%), а рівні глюкози в плазмі крові натще становили ≤10,0 або ≤11,1 ммоль/л залежно від попереднього протидіабетичного лікування.
Після скринінгу пацієнти, які були визначені придатними для участі в дослідженні (n=1018), включалися в 6-тижневу вступну фазу, впродовж якої пацієнти продовжували отримувати інсулін гларгін або були переведені на лікування інсуліном гларгіном у випадку, якщо вони отримували інший базальний інсулін; при цьому здійснювалося титрування/стабілізація дози інсуліну на фоні продовження терапії метформіном (якщо його приймали раніше). Лікування будь-якими іншими пероральними протидіабетичними препаратами було припинено.
Після завершення вступного періоду пацієнти, у яких рівні HbA1c становили 7–10%, рівні глюкози в плазмі крові натще становили ≤7,77 ммоль/л, а добова доза інсуліну гларгіну становила 20–50 одиниць, були рандомізовані в групу препарату Соліква (n=367) або в групу інсуліну гларгіну (n=369).
Характеристики популяції даних пацієнтів з цукровим діабетом 2-го типу були наступними. Середній вік становив 60,0 років, при цьому вік більшості пацієнтів (56,3%) становив 50–64 роки, 53,3% пацієнтів були жіночої статі. Середній ІМТ на вихідному рівні становив 31,1 кг/м2, при цьому у 57,3% пацієнтів ІМТ становив ≥30 кг/м2. Середня тривалість цукрового діабету становила близько 12 років, а середня тривалість попереднього лікування базальним інсуліном — близько 3 років. На скринінгу 64,4% пацієнтів у якості базального інсуліну отримували інсулін гларгін, а 95,0% — принаймні один пероральний протидіабетичний препарат.
На 30-й тиждень лікування препаратом Соліква зумовлювало статистично значуще покращення рівнів НbА1с (р<0,0001) порівняно з інсуліном гларгіном.
Інформація щодо інших кінцевих точок дослідження наведена в табл. 2 та на рис. 2.
Таблиця 2.
Результати клінічного дослідження серед пацієнтів із цукровим діабетом 2-го типу, у яких не відзначався належний контроль захворювання на фоні лікування базальним інсуліном на 30-й тиждень (популяція пацієнтів, які отримували лікування)
| Препарат Соліква | Інсулін гларгін | |
| Кількість пацієнтів, які отримали лікування | 366 | 365 |
| Рівень НbА1с (%) | ||
| Вихідний рівень (середнє значення, після вступної фази) | 8,1 | 8,1 |
| Завершення лікування (середнє значення) | 6,9 | 7,5 |
| Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення) | −1,1 | −0,6 |
| Відмінність порівняно з інсуліном гларгіном [95% довірчий інтервал] (р-значення) | −0,5 (−0.6; −0,4) (<0,0001) | |
| Кількість пацієнтів (n (%)), у яких були досягнуті рівні НbА1с <7% на 30-й тиждень* | 201 (54,9%) | 108 (29,6%) |
| Рівень глюкози в плазмі крові натще, ммоль/л | ||
| Вихідний рівень (середнє значення) | 7,33 | 7,32 |
| Завершення дослідження (середнє значення) | 6,78 | 6,69 |
| Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення) | −0.35 | −0,46 |
| Відмінність порівняно з інсуліном гларгіном (95% довірчий інтервал) | 0,11 (−0,21; 0,43) | |
| Постпрандіальний рівень глюкози через 2 год після прийому їжі, ммоль/л** | ||
| Вихідний рівень (середнє значення) | 14,85 | 14,97 |
| Завершення дослідження (середнє значення) | 9,91 | 13,41 |
| Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення) | −4,72 | −1,39 |
| Зміна порівняно з інсуліном гларгіном, визначена методом найменших квадратів (середнє значення) [95% довірчий інтервал] | −3,33 (−3,89; −2,77) | |
| Середня маса тіла, кг | ||
| Вихідний рівень (середнє значення) | 87,8 | 87,1 |
| Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення) | −0,7 | 0,7 |
| Порівняння з інсуліном гларгіном (95% довірчий інтервал) (р-значення) | −1.4 (−1.8: −0,9) (<0,0001) | |
| Кількість пацієнтів (%), у яких були досягнуті рівні НbА1с <7,0% без приросту маси тіла на 30-й тиждень | 125 (34,2%) | 49 (13,4%) |
| Пропорційна відмінність порівняно з інсуліном гларгіном (95% довірчий інтервал) (р-значення) | 20,8 (15,0; 26,7) (<0,0001) | |
| Добова доза інсуліну гларгіну | ||
| Вихідний рівень (середнє значення) | 35,0 | 35,2 |
| Кінцева точка (середнє значення) | 46,7 | 46,7 |
| Зміна дози інсуліну на 30-й тиждень, визначена методом найменших квадратів (середнє значення) | 10,6 | 10,9 |
*Не включено в попередньо визначеній процедурі дослідження поступового зниження рівнів.
**Постпрандіальний рівень глюкози через 2 год після прийому їжі мінус рівень глюкози перед прийомом їжі.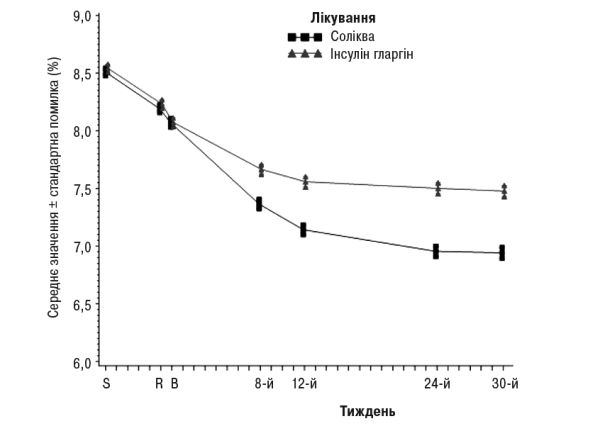
Рис. 2. Середні рівні HbA1c (%) під час візитів протягом 30 тиж лікування.
Перехід з агоніста рецепторів ГПП-1. Клінічне дослідження серед пацієнтів з цукровим діабетом 2-го типу, у яких на фоні лікування агоністом рецепторів ГПП-1 не відзначалося належного контролю захворювання. Ефективність та безпека препарату Соліква порівняно з незмінним попереднім лікуванням агоністом рецепторів ГПП-1 вивчали в 26-тижневому рандомізованому відкритому дослідженні. У дослідженні брали участь 514 пацієнтів із цукровим діабетом 2-го типу, в яких не відзначалося належного контролю (рівень HbA1c 7–9% включно) захворювання, та які отримували лікування ліраглутидом або ексенатидом протягом не менше 4 міс або дулаглутидом, албіглутидом, або ексенатидом з пролонгованим вивільненням протягом не менше 6 міс (усі препарати вводилися в максимально переносимій дозі) і метформіном у вигляді монотерапії або в поєднанні з піоглітазоном, інгібітором НЗКТГ-2 або з обома. Відібрані пацієнти були рандомізовані або для прийому препарату Соліква, або для продовження прийому попереднього агоніста рецепторів ГПП-1 на додаток до попереднього перорального протидіабетичного лікування.
На скринінгу 59,7% суб’єктів отримували агоніст рецепторів ГПП-1 один раз або двічі на добу, а 40,3% отримували агоніст рецепторів ГПП-1 один раз на тиждень. Під час скринінгу 6,6% суб’єктів отримували піоглітазон, а 10,1% — інгібітор НЗКТГ-2 в комбінації з метформіном. Характеристики популяції дослідження наступні: середній вік становив 59,6 року, 52,5% суб’єктів — чоловіки. Середня тривалість захворювання на цукровий діабет становила 11 років, середня тривалість попереднього лікування агоністами рецепторів ГПП-1 — 1,9 року, середній ІМТ — близько 32,9 кг/м2, середня рШКФ — 87,3 мл/хв/1,73 м2 і у 90,7% пацієнтів відмічено рШКФ ≥60 мл/хв.
На 26-й тиждень лікування препаратом Соліква зумовлювало статистично значуще покращення рівнів HbA1c (р<0,0001). Попередньо визначений аналіз підтипу агоніста рецепторів ГПП-1 (один/два рази на добу або щотижня), використаного під час скринінгу, показав, що зміна HbA1c на 26-й тиждень було аналогічною для кожної підгрупи та узгоджується з первинним аналізом для всієї популяції. Середня добова доза препарату Соліква на 26-й тиждень становила 43,5 поділки дозування.
Інформація щодо інших кінцевих точок дослідження наведена в табл. 3 та на рис. 3.
Таблиця 3.
Результати клінічного дослідження серед пацієнтів із цукровим діабетом 2-го типу, в яких не відзначався належний контроль захворювання на фоні лікування агоністами рецепторів ГПП-1 на 26-й тиждень (популяція пацієнтів, які отримали лікування)
| Препарат Соліква | Агоніст рецепторів ГПП-1 | |
| Кількість пацієнтів, які отримали лікування | 252 | 253 |
| Рівень HbA1c (%) | ||
| Вихідний рівень (середнє значення, після вступної фази) | 7,8 | 7,8 |
| Завершення лікування (середнє значення) | 6,7 | 7,4 |
| Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення) | −1,0 | −0,4 |
| Відмінність порівняно з агоністом рецепторів до ГПП-1 (95% довірчий інтервал) (р-значення) | −0.6 (−0.8; −0,5) (< 0,0001) | |
| Кількість пацієнтів (n (%)), у яких були досягнуті рівні НbА1с <7% на 26-й тиждень | 156 (61,9%) | 65 (25,7%) |
| Пропорційна відмінність порівняно з агоністом рецепторів ГПП-1 (95% довірчий інтервал) (р-значення) | 36,1% (28,1%: 44,0%) (<0,0001) | |
| Рівень глюкози в плазмі крові натще, ммоль/л | ||
| Вихідний рівень (середнє значення) | 9,06 | 9,45 |
| Завершення дослідження (середнє значення) | 6,86 | 8,66 |
| Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення) | −2,28 | −0,60 |
| Відмінність порівняно з агоністом рецепторів до ГПП-1 (95% довірчий інтервал) (р-значення) | −1,67 (−2.00; −1,34) (<0,0001) | |
| Постпрандіальний рівень глюкози через 2 год після прийому їжі, ммоль/л* | ||
| Вихідний рівень (середнє значення) | 13,60 | 13,78 |
| Завершення дослідження (середнє значення) | 9,68 | 12,59 |
| Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення) | −4,0 | −1,11 |
| Зміна порівняно з агоністом рецепторів до ГПП-1, визначена методом найменших квадратів (середнє значення) (95% довірчий інтервал) (р-значення) | −2,9 (−3,42; −2,28) (<0,0001) | |
| Середня маса тіла, кг | ||
| Вихідний рівень (середнє значення) | 93,01 | 95,49 |
| Зміна порівняно з вихідним рівнем, визначена методом найменших квадратів (середнє значення) | 1,89 | −1,14 |
| Порівняння з агоністом рецепторів ГПП-1 (95% довірчий інтервал) (р-значення) | −3,03 (2,417; 3,643) (<0,0001) | |
*Постпрандіальний рівень глюкози через 2 год після прийому їжі мінус рівень глюкози перед прийомом їжі.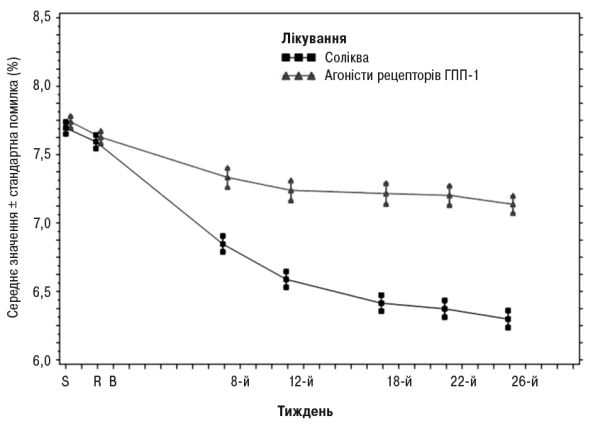
Рис. 3. Середні рівні HbA1c (%) під час візитів протягом 26 тиж лікування.
Одночасне застосування препарату Соліква з інгібіторами НЗКТГ-2 підтверджується аналізом підгруп із трьох рандомізованих клінічних досліджень фази 3 (119 пацієнтів, які отримували комбінацію інсуліну гларгіну/ліксисенатиду з фіксованим співвідношенням, які також отримували інгібітори НЗКТГ-2).
Одне дослідження, проведене в Європі й Північній Америці, включало дані 26 пацієнтів (10,1%), які одночасно отримували комбінацію інсуліну гларгіну та ліксисенатиду з фіксованим співвідношенням, метформін та інгібітори НЗКТГ-2. Ще два дослідження фази 3 зі спеціалізованої японської програми клінічного розвитку, проведені за участю пацієнтів, які не досягли достатнього контролю глікемії за допомогою пероральних протидіабетичних препаратів, надали дані щодо 59 пацієнтів (22,7%) і 34 пацієнтів (21,1%) відповідно, які одночасно отримували інгібітори НЗКТГ-2 й комбінацію інсуліну гларгіну та ліксисенатиду з фіксованим співвідношенням.
Дані цих 3 досліджень показують, що початок застосування препарату Соліква у пацієнтів із недостатнім контролем лікування, які отримували інгібітори НЗКТГ-2, призводить до більш значного покращення рівнів НbА1с, ніж препарати порівняння. У пацієнтів, які отримували інгібітори НЗКТГ-2, не виявлено підвищеного ризику гіпоглікемії і значущих відмінностей у загальному профілі безпеки порівняно з тими, хто не отримував інгібітори НЗКТГ-2.
Дослідження з вивченням впливу на серцево-судинні події. Безпека інсуліну гларгіну та ліксисенатиду стосовно серцево-судинних подій вивчалася в рамках клінічних досліджень ORIGIN та ELIXA відповідно. Окремого дослідження з вивченням впливу препарату Соліква на серцево-судинні події не проводилося.
Інсулін гларгін. Дослідження зниження частоти серцево-судинних ускладнень при ініціальному застосуванні інсуліну гларгіну (дослідження ORIGIN) було відкритим рандомізованим дослідженням, в яке включено 12 537 пацієнтів та в рамках якого порівнювалося лікування препаратом Лантус зі стандартним лікуванням на момент першого виникнення серйозного небажаного явища з боку серцево-судинної системи. Серйозне небажане явище з боку серцево-судинної системи включало смерть внаслідок серцево-судинної події, нефатальний інфаркт міокарда та нефатальний інсульт. Медіана тривалості контрольного спостереження в рамках дослідження становила 6,2 року. Частота серйозних небажаних явищ з боку серцево-судинної системи в рамках дослідження ORIGIN була подібною між групою, що отримувала препарат інсулін гларгін, та групою, що отримувала стандартне лікування (підношення ризиків (95% довірчий інтервал) щодо серйозних небажаних явищ з боку серцево-судинної системи: 1,02 (0,94: 1,11).
Ліксисенатид. Дослідження ELIXA було рандомізованим подвійно-сліпим плацебо-контрольованим багатонаціональним, у рамках якого здійснювалася оцінка серцево-судинних ускладнень під час лікування ліксисенатидом у пацієнтів з цукровим діабетом 2-го типу (п=6068) після нещодавно перенесеного гострого коронарного синдрому. Первинною комбінованою кінцевою точкою щодо ефективності був час до першого виникнення будь-якого з наступних небажаних явищ: смерть внаслідок серцево-судинної події, нефатальний інфаркт міокарда, нефатальний інсульт або госпіталізація з приводу нестабільної стенокардії. Медіана тривалості контрольного спостереження в рамках дослідження становила 25,8 та 25,7 міс в групі ліксисенатиду та плацебо відповідно.
Частота первинної кінцевої точки була подібною між групою ліксисенатиду (13,4%) та групою плацебо (13,2%): відношення ризиків для ліксисенатиду порівняно з плацебо становило 1,017 з асоційованим 2-стороннім 95% довірчим інтервалом 0,886–1,168.
Фармакокінетика. Абсорбція. Співвідношення інсулін гларгін/ліксисенатид суттєво не впливає на фармакокінетику інсуліну гларгіну та ліксисенатиду в препараті Соліква.
Після п/ш введення комбінації інсулін гларгін/ліксисенатид у пацієнтів з цукровим діабетом 1-го типу інсулін гларгін не демонстрував вираженого піку. Експозиція інсуліну гларгіну після введення комбінації інсулін гларгін/ліксисенатид становила 86–88% від експозиції, яка відзначалася при окремих одночасних ін’єкціях інсуліну гларгіну та ліксисенатиду. Така відмінність не вважається клінічно значущою.
Після п/ш введення комбінації інсулін гларгін/ліксисенатид у пацієнтів з цукровим діабетом 1-го типу медіана Тmax ліксисенатиду знаходилася в діапазоні 2,5–3,0 год. AUC була порівнянною, у той час як відзначалося незначне зниження Сmax ліксисенатиду на 22–34% порівняно з Сmax, яка виявлена при окремих одночасних ін’єкціях інсуліну гларгіну та ліксисенатиду; проте таке зниження малоймовірно може бути клінічно значущим.
Клінічно значущі відмінності в швидкості абсорбції ліксисенатиду при його застосуванні у вигляді монотерапії після п/ш введення в ділянку живота, дельтоподібного м’яза або стегна відсутні.
Розподіл. Ліксисенатид характеризується низьким (55%) рівнем зв’язування з білками плазми крові людини. Передбачуваний об’єм розподілу ліксисенатиду після п/ш введення комбінації інсулін гларгін/ліксисенатид (незв’язаний об’єм розподілу, Vz/F) становить близько 100 л. Передбачуваний об’єм розподілу інсуліну гларгіну після п/ш введення комбінації інсулін гларгін/ліксисенатид (об’єм розподілу в рівноважному стані, Vss/F) становить близько 1700 л.
Біотрансформація та елімінація. Результати дослідження з вивченням метаболізму в пацієнтів із цукровим діабетом, які отримували інсулін гларгін у вигляді монотерапії, свідчать про те, що інсулін гларгін швидко метаболізується на рівні карбоксильного кінця В-ланцюга з утворенням двох активних метаболітів — МІ (21А-гліцин-інсулін) та М2 (21А-гліцин-дез-30В-треонін-інсулін). У плазмі крові головною циркулюючою сполукою є метаболіт МІ. Фармакокінетичні та фармакодинамічні дані свідчать про те, що ефект п/ш ін’єкції інсуліну гларгіну головним чином залежить від експозиції метаболіту МІ.
Як і всі пептиди, ліксисенатид виводиться шляхом клубочкової фільтрації з наступною канальцевою реабсорбцією та подальшим метаболічним розщепленням до менших пептидів та амінокислот, які знову включаються в білковий метаболізм. Після багатократного введення у пацієнтів з цукровим діабетом 2-го типу середній термінальний Т½ становив близько 3 год, а середній уявний кліренс (CL/F) становив близько 35 л/год.
Особливі популяції пацієнтів. Пацієнти з порушенням функції нирок . У пацієнтів з легким (кліренс креатиніну, розрахований за формулою Кокрофта — Голта, 60–90 мл/хв), помірним (кліренс креатиніну 30–60 мл/хв) та тяжким (кліренс креатиніну 15–30 мл/хв) порушенням функції нирок AUC ліксисенатиду зростала на 46; 51 та 87% відповідно.
Застосування інсуліну гларгіну у пацієнтів з порушенням функції нирок не досліджувалося. Тим не менше, у пацієнтів з порушенням функції нирок потреба в інсуліні може бути знижена внаслідок зниження метаболізму інсуліну.
Пацієнти з порушенням функції печінки. Оскільки ліксисенатид виділяється головним чином нирками, у пацієнтів із гострою або хронічною печінковою недостатністю жодних фармакокінетичних досліджень не проводилося. Вплив порушення функції печінки на фармакокінетику ліксисенатиду не передбачається.
Застосування інсуліну гларгіну у пацієнтів із цукровим діабетом та з порушенням функції печінки не досліджувалося. У пацієнтів з порушенням функції печінки потреба в інсуліні може бути зменшена у зв’язку зі зниженням здатності до глюконеогенезу та зниженням метаболізму інсуліну.
Вік, расова приналежність, стать та маса тіла
Інсулін гларгін. Вплив віку, расової приналежності та статі на фармакокінетику інсуліну гларгіну не вивчався. За результатами аналізу підгруп, сформованих за віком, расовою приналежністю та статтю, в рамках контрольованих клінічних досліджень серед дорослих пацієнтів, які отримували інсулін гларгін (100 ОД/мл), жодних відмінностей стосовно безпеки та ефективності не виявлено.
Ліксисенатид. Вік не чинить клінічно значущого впливу на фармакокінетику ліксисенатиду. У рамках дослідження фармакокінетики серед осіб похилого віку без цукрового діабету введення ліксисенатиду в дозі 20 мкг приводило до середнього підвищення AUC ліксисенатиду в цих осіб на 29% (11 учасників дослідження були віком 65–74 років і 7 учасників дослідження віком ≥75 років) порівняно з 18 особами віком 18–45 років, що, ймовірно, пов’язано зі зниженням функції нирок у групі осіб похилого віку. Етнічна приналежність не зумовлює клінічно значущого впливу на фармакокінетику ліксисенатиду, про що свідчать результати фармакокінетичних досліджень, проведених за участю пацієнтів європейської, японської та китайської національності.
Стать не чинить клінічно значущого впливу на фармакокінетику ліксисенатиду.
Маса тіла не зумовлює клінічно значущого впливу на AUC ліксисенатиду.
Імуногенність. За наявності антитіл до ліксисенатиду його експозиція та варіабельність його експозиції суттєво підвищуються незалежно від дози.
Доклінічні дані з безпеки. Жодних досліджень на тваринах із застосуванням комбінації інсуліну гларгіну та ліксисенатиду для оцінки токсичності при багатократному введенні, канцерогенезу, генотоксичності чи токсичного впливу на репродуктивну систему не проводилося.
Інсулін гларгін. Доклінічні дані, отримані у стандартних дослідженнях фармакологічної безпеки, токсичності при багатократному введенні, генотоксичності, канцерогенного потенціалу та токсичного впливу на репродуктивну систему, свідчать про відсутність будь-яких специфічних ризиків для людини при застосуванні інсуліну гларгіну.
Ліксисенатид. У рамках 2-річних досліджень канцерогенності при п/ш введенні препарату у щурів та мишей спостерігалися нелетальні С-клітинні пухлини щитоподібної залози, які були розцінені як такі, що зумовлені негенотоксичним механізмом, опосередкованим рецепторами до GLP-1, до якого гризуни особливо чутливі. С-клітинна гіперплазія та аденома виявлені у щурів на фоні застосування всіх досліджуваних доз, а максимальну дозу, при якій не відзначалися небажані ефекти, визначити не вдалося. У мишей ці ефекти виникали при рівні експозиції, що у 9,3 раза перевищував експозицію в людей при застосуванні терапевтичних доз препарату. У мишей не відмічено С-клітинних карцином, а у щурів вони виникали при рівні експозиції, що приблизно у 900 разів перевищував експозицію у людей при застосуванні терапевтичних доз.
У рамках 2-річного дослідження канцерогенності при п/ш введенні препарату у мишей відзначено 3 випадки аденокарциноми ендометрія зі статистично значущим підвищенням частоти цього захворювання в групі застосування середніх доз препарату, які зумовлювали рівень експозиції, що перевищував експозицію в людей у 97 разів. Жодних ефектів, пов’язаних із застосуванням препарату, не відзначено.
Результати досліджень на тваринах не свідчать про будь-який безпосередній шкідливий вплив препарату на фертильність самців та самок щурів. У собак, яким вводився ліксисенатид, відмічали зворотні порушення в яєчках та придатках яєчок. У здорових чоловіків не відзначено жодного впливу препарату на сперматогенез, пов’язаного із застосуванням препарату.
У дослідженнях з вивченням впливу препарату на внутрішньоутробний розвиток у щурів на фоні всіх досліджуваних доз ліксисенатиду (при рівнях експозиції, що у 5 разів перевищували експозицію в людей) та у кролів при введенні високих доз препарату (при рівнях експозиції, що у 32 рази перевищували експозицію в людей) відмічали вади розвитку, сповільнення росту плода, затримку осифікації та побічні ефекти з боку скелета. В обох моделях досліджуваних тварин відзначалася незначна токсична дія на материнський організм, що виявлялася у вигляді зменшення споживання їжі та зменшення маси тіла. Ріст новонароджених щурят був сповільнений серед самців, які піддавалися дії високих доз ліксисенатиду впродовж пізнього гестаційного періоду та лактації, з невеликим підвищенням смертності щурят.
Показання Соліква
для лікування дорослих пацієнтів із недостатньо контрольованим цукровим діабетом 2-го типу з метою покращення контролю глікемії як доповнення до дієти і вправ на додаток до метформіну з інгібіторами НЗКТГ-2 або без них (результати досліджень щодо впливу на контроль глікемії та досліджені групи пацієнтів див. у ОСОБЛИВОСТІ ЗАСТОСУВАННЯ і Фармакодинаміка).
Застосування Соліква
препарат Соліква доступний у двох типах шприц-ручок з різними опціями дозування, а саме шприц-ручка Соліква (10–40) та шприц-ручка Соліква (30–60) відповідно. Відмінність між дозуваннями шприц-ручок пов’язана з їх діапазонами дозування.
Соліква 100 ОД/мл + 50 мкг/мл у попередньо наповненій шприц-ручці — діапазон дозування становить 10–40 ОД інсуліну гларгіну в комбінації з 5–20 мкг ліксисенатиду (шприц-ручка Соліква (10–40)).
Соліква 100 ОД/мл + 33 мкг/мл у попередньо наповненій шприц-ручці — діапазон дозування становить 30–60 ОД інсуліну гларгіну в комбінації з 10–20 мкг ліксисенатиду (шприц-ручка Соліква (30–60)).
Для уникнення помилок в застосуванні препарату лікар, що його призначає, повинен впевнитися, що в рецепті зазначено правильні дозування та діапазон поділок дозування шприц-ручки.
Дозування повинно підбиратися індивідуально з урахуванням індивідуальної відповіді хворого, а його титрування здійснюється відповідно до потреби пацієнта в інсуліні. Дозування ліксисенатиду підвищується або знижується разом з дозуванням інсуліну гларгіну і також залежить від того, яка шприц-ручка використовується.
Початкова доза. Терапію базальним інсуліном або агоністом рецепторів ГПП-1 або пероральним гіпоглікемічним лікарським засобом, за винятком метформіну та інгібіторів НЗКТГ-2, перед початком застосування препарату Соліква слід припинити.
Початкова доза препарату Соліква визначається на підставі попереднього протидіабетичного лікування, при цьому рекомендована початкова доза ліксисенатиду не повинна перевищувати 10 мкг.
Таблиця 4.
Початкова доза препарату Соліква
| Попередня терапія | ||||
| Пацієнти, які раніше не отримували інсулін (пероральні протидіабетичні препарати або агоніст рецептора ГПП-1 | Інсулін гларгін (100 ОД/мл)** >20 до <30 ОД | Інсулін гларгін (100 ОД/мл)** >30 до <60 ОД | ||
| Початкова доза і тип шприц-ручки | Шприц-ручка Соліква (10–40) | 10 поділок дозування (10 ОД/5 мкг) | 20 поділок дозування (20 ОД/10 мкг)* | |
| Шприц-ручка Соліква (30–60) | 30 поділок дозування (30 ОД/10 мкг)* | |||
*Одиниць інсуліну гларгіну (100 ОД/мл)/мікрограм ліксисенатиду.
**Якщо застосовувався інший базальний інсулін:
– при застосуванні базального інсуліну 2 рази на добу або інсуліну гларгіну (300 ОД/мл) попередня загальна добова доза повинна бути знижена на 20% при виборі початкової дози препарату Соліква;
– при застосуванні будь-якого іншого базального інсуліну повинно застосовуватися таке ж правило, як для інсуліну гларгіну (100 ОД/мл).
Максимальна добова доза становить 60 ОД інсуліну гларгіну та 20 мкг ліксисенатиду, що відповідає 60 поділкам дозування.
Ін’єкція препарату Соліква повинна здійснюватися один раз на добу в межах 1 год перед їдою. Бажано, щоб прандіальна ін’єкція виконувалася перед одним і тим самим прийомом їжі щодня, після того, як пацієнт обере найбільш зручний для себе прийом їжі.
Титрування дозування. Препарат Соліква повинен вводитися відповідно до індивідуальних потреб пацієнта в інсуліні. Контроль глікемії рекомендується оптимізувати шляхом корекції дози на підставі рівнів глюкози в плазмі крові натще (див. Фармакодинаміка). Під час переведення на цей препарат та впродовж перших тижнів після цього рекомендується здійснювати ретельний моніторинг рівнів глюкози.
Якщо пацієнт починає застосовувати шприц-ручку Соліква (10–40), тоді доза може бути титрована до 40 поділок дозування.
Для дозування >40 поділок дозування на добу титрування слід продовжувати з використанням шприц-ручки Соліква (30–60).
Якщо пацієнт починає застосовувати шприц-ручку Соліква (30–60), тоді доза може бути титрована до 60 поділок дозування.
Для загального добового дозування >60 поділок дозування препарат Cоліква нe повинен застосовуватися.
Пацієнти, які коригують кількість або час введення препарату, повинні здійснювати це тільки під медичним наглядом з відповідним моніторингом рівнів глюкози (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Особливі категорії пацієнтів
Пацієнти похилого віку (≥65 років). Препарат Соліква може застосовуватися у пацієнтів похилого віку. Доза повинна бути підібрана в індивідуальному порядку з урахуванням результатів моніторингу рівнів глюкози. У пацієнтів похилого віку прогресуюче погіршення функції нирок може стати причиною постійного зниження потреби в інсуліні. Корекція дози ліксисенатиду залежно від віку не вимагається. Досвід терапевтичного застосування препарату Соліква у пацієнтів віком ≥75 років є обмеженим.
Пацієнти з порушенням функції нирок. Препарат Соліква не рекомендується застосовувати у пацієнтів з тяжким порушенням функції нирок та при термінальній стадії хвороби нирок, оскільки досвід терапевтичного застосування ліксисенатиду в таких випадках є недостатнім.
У пацієнтів з легким або помірним порушенням функції нирок корекція дози ліксисенатиду не потрібна.
У пацієнтів з порушенням функції нирок потреба в інсуліні може бути зменшена у зв’язку зі зниженням метаболізму інсуліну.
У пацієнтів з легким або помірним порушенням функції нирок, що застосовують препарат Соліква, може виникати необхідність у частому моніторингу рівнів глюкози та у відповідній корекції дозування.
Пацієнти з порушенням функції печінки. У пацієнтів з порушенням функції печінки корекція дози ліксисенатиду не потрібна (див. Фармакокінетика). У пацієнтів з порушенням функції печінки потреба в інсуліні може бути зменшена у зв’язку зі зниженням здатності до глюконеогенезу та зниженням метаболізму інсуліну. У пацієнтів з порушенням функції печінки може виникати необхідність у частому моніторингу рівнів глюкози та відповідній корекції дози препарату Соліква.
Діти і підлітки. Препарат Соліква не передбачений для застосування у дітей.
Спосіб введення. Препарат Соліква слід вводити шляхом п/ш ін’єкції в ділянці живота, дельтоподібного м’яза або стегна.
Місця для ін’єкцій повинні змінюватися в межах однієї анатомічної ділянки (живота, дельтоподібного м’яза або стегна) від однієї ін’єкції до іншої з метою зниження ризику виникнення ліподистрофії та/або шкірного амілоїдозу (див. ПОБІЧА ДІЯ). Пацієнти повинні бути проінструктовані щодо постійної необхідності використання нової голки. Повторне використання голки інсулінової шприц-ручки підвищує ризик її блокування, що може призводити до введення недостатньої або надмірної дози препарату. Препарат Соліква не дозволяється відбирати з картриджа попередньо наповненої шприц-ручки у шприц, оскільки це може призвести до тяжкого передозування (див. Особливості застереження при застосуванні препарату).
Особливості застереження при застосуванні препарату. Перед першим застосуванням шприц-ручку слід витягнути з холодильника та потримати при температурі не вище 25 °С впродовж 1–2 год.
Перед використанням перевіряють картридж шприц-ручки. Його можна використовувати лише тоді, коли в ньому міститься прозорий безбарвний р-н, який за консистенцією нагадує воду, без видимих твердих частинок.
Препарат Соліква не можна змішувати з будь-яким іншим інсуліном або розводити. При змішуванні або розведенні може змінитися профіль дії препарату в часі; крім цього, змішування з іншими препаратами може призвести до утворення осаду.
Перед кожною ін’єкцією завжди необхідно під’єднувати нову голку. Повторно використовувати голки не можна. Пацієнт повинен утилізувати голку після кожної ін’єкції.
У випадку блокування голки пацієнтам необхідно дотримуватися інструкцій, описаних у Кроку 3 Інструкції з використання (див. нижче).
Порожні шприц-ручки в жодному разі не можна використовувати повторно, вони повинні бути належним чином утилізовані.
Якщо здається, що шприц-ручка пошкоджена, не слід використовувати її. Слід взяти нову. Не потрібно намагатися самостійно полагодити шприц-ручку.
Для запобігання можливій передачі захворювань кожна шприц-ручка повинна використовуватися тільки одним пацієнтом.
Перед кожною ін’єкцією слід завжди перевіряти етикетку, щоб уникнути плутанини між препаратом Соліква та іншими ін’єкційними протидіабетичними лікарськими засобами, включаючи два різні типи шприц-ручок з препаратом Соліква (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Перед застосуванням препарату Соліква слід уважно прочитати Інструкцію з використання шприц-ручки Соліква.
Важлива інформація щодо використання шприц-ручки Соліква
Шприц-ручка призначена особисто і не слід передавати її іншим особам.
Не можна використовувати шприц-ручку у разі її пошкодження або за наявності сумніву щодо правильності її функціонування.
Завжди слід проводити тест на безпеку.
Завжди необхідно мати запасну шприц-ручку і запасні голки на випадок втрати або пошкодження основного набору.
Що потрібно знати для проведення ін’єкції
Перед використанням шприц-ручки слід запитати свого лікаря або медсестру, як робиться ін’єкція.
Якщо є які-небудь складнощі з використанням шприц-ручки, наприклад через проблеми з боку зору, слід звернутися за допомогою.
Перед використанням шприц-ручки слід перечитати цю Інструкцію. У разі недотримання цих настанов можна отримати надто високу або низьку дозу препарату.
Додаткові речі, які будуть потрібні при введені цього препарату:
– нова стерильна голка (див. Крок 2);
– змочений спиртом тампон;
– стійкий для проколювання контейнер для використаних голок та шприц-ручок.
Інструкція з використання шприц-ручки Соліква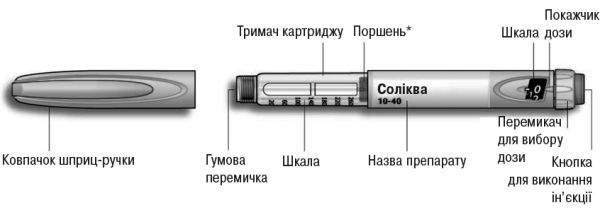
Рис. 4. Шприц-ручка Соліква.
*Поршень не буде видно, доки не буде введено декілька доз.
Крок 1. Перевірити свою шприц-ручку.
Щонайменше за 1 год до проведення ін’єкцій дістати нову шприц-ручку з холодильника. Введення холодного препарату є більш болісним.
А. Перевірити назву препарату і дату закінчення терміну придатності на етикетці шприц-ручки.
Переконатися в тому, що взято потрібний препарат. Ця шприц-ручка персикового кольору з коричневою кнопкою для виконання ін’єкції.
Не використовувати цю шприц-ручку, якщо потрібна добова доза менше ніж 10 кроків дози або якщо потрібно більше ніж 40 кроків дози. Слід обговорити з лікарем, яка шприц-ручка найкраще підходить для потреб.
Не використовувати шприц-ручку після закінчення її терміну придатності.
В. Зняти ковпачок зі шприц-ручки.
С. Впевнитися у тому, що препарат є прозорим.
Не використовувати шприц-ручку, якщо р-н препарату є мутним на вигляд, забарвленим або містить часточки.
Крок 2. Приєднати нову голку.
Не використовувати голки повторно. Для виконання кожної ін’єкції завжди використовувати нову стерильну голку. Це допомагає запобігати блокуванню голки, забрудненню та занесенню інфекції.
Завжди використовувати тільки такі голки, які є сумісними для використання з препаратом Соліква.
А. Взяти нову голку та відклеїти захисну плівку.
В. Тримати голку прямо і закрутити її на шприц-ручку до закріплення. Не закручувати голку занадто сильно.
С. Зняти зовнішній ковпачок з голки. Слід зберегти його — він знадобиться пізніше.
D. Зняти внутрішній ковпачок голки та викинути його.
Користування голками
Слід поводитися з голками з обережністю — це необхідно, щоб запобігти уколам голкою і перехресному інфікуванню.
Крок 3. Виконати тест на безпеку.
Завжди виконувати тест на безпеку перед кожною ін’єкцією — це необхідно, щоб:
– перевірити, що шприц-ручка і голка працюють правильно;
– впевнитися у тому, що буде отримана необхідна доза препарату .
А. Обрати 2 кроки дози, обертаючи перемикач для вибору дози, поки покажчик дози не буде вказувати на риску «2».
В. Натиснути кнопку для виконання ін’єкції до упору.
Якщо з кінчика голки буде виходити р-н препарату, шприц-ручка працює правильно. Перемикач для вибору дози повернеться у положення «0».
Якщо р-н препарату не виходить:
може знадобитися повторити цей крок до 3 разів, перш ніж буде можна побачити р-н препарату.
Якщо р-н препарату не виходитиме і після третього разу, голка може бути заблокована. Якщо таке станеться:
– слід замінити голку (див. Крок 6 і Крок 2);
– після цього виконати тест на безпеку повторно (Крок 3).
Якщо і після цього р-н препарату не виходитиме з кінчика голки, не слід використовувати шприц-ручку. Слід використовувати нову шприц-ручку.
Не використовувати шприц для відбору р-ну препарату з шприц-ручки.
Якщо буде видно бульбашки повітря. Можна побачити бульбашки повітря в р-ні препарату. Це нормальне явище, вони не зашкодять.
Крок 4. Обрати дозу.
Слід використовувати цю шприц-ручку лише для введення однократної щоденної дози об’ємом 10–40 кроків дози.
Ніколи не обирати дозу або не натискати на кнопку для виконання ін’єкції без приєднаної голки. Це може пошкодити шприц-ручку.
А. Впевнитися в тому, що голка приєднана до шприц-ручки і що покажчик дози вказує на «0».
В. Обертати перемикач для вибору дози, поки покажчик дози не буде вказувати на потрібну дозу.
Якщо повернути перемикач далі, ніж потрібно, можна повернути його у зворотному напрямку.
Якщо у шприц-ручці залишилося недостатньо одиниць для потрібної дози, перемикач для вибору дози зупиниться після набору тієї кількості одиниць, що залишилися в шприц-ручці.
Якщо не можна набрати повну дозу, яка призначена, слід використати нову шприц-ручку або ввести стільки кроків дози, скільки залишилося, а решту дози ввести з нової шприц-ручки. У цьому і тільки в цьому випадку дозволяється вводити часткову дозу менше ніж 10 кроків дози. Для того щоб завершити вибір потрібної дози, завжди слід використовувати іншу шприц-ручку з препаратом Соліква (10–40), а не будь-яку іншу шприц-ручку.
Як зчитувати дані у вікні відображення дози. Не використовувати шприц-ручку, якщо потрібна однократна доза становить менше 10 кроків дози — ці кроки дози позначені білими цифрами на чорному фоні.
Кількість одиниць препарату у шприц-ручці. Шприц-ручка містить загалом 300 кроків дози. Можна обирати свою дозу в 1 крок дози.
Не використовувати цю шприц-ручку, якщо потрібна однократна добова доза менше ніж 10 кроків дози, або якщо потрібно більше ніж 40 кроків дози.
Кожна шприц-ручка містить більше однієї добової дози.
Крок 5. Ввести необхідну дозу.
Якщо є відчуття, що важко натискати на кнопку для виконання ін’єкції, не слід докладати зусиль для її натискання, оскільки це може зламати шприц-ручку.
Замінити голку (див. Крок 6. Від’єднати голку і Крок 2. Приєднати нову голку), після чого виконати тест з безпеки (див. Крок 3).
Якщо все ще важко натискати на кнопку, слід взяти нову ручку.
Не використовувати шприц для відбору розчину препарату з шприц-ручки.
А. Обрати місце для виконання ін’єкції відповідно до рис. 5.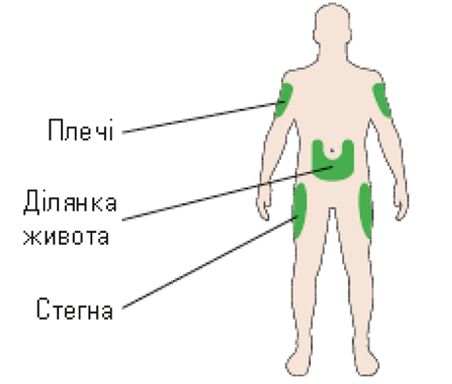
Рис. 5. Місце для виконання ін’єкції.
В. Ввести голку собі у шкіру так, як показував лікар або медична сестра.
При цьому поки що не слід торкатися кнопки для виконання ін’єкції.
С. Покласти великий палець руки на кнопку для виконання ін’єкції. Після цього натиснути її до упору й утримувати в такому положенні.
Не натискати на кнопку під кутом — великий палець може заблокувати обертання перемикача для вибору дози.
Утримувати кнопку для виконання ін’єкції в натисненому положенні і після того, як буде видно у вікні відображення дози «0», повільно порахувати до 10.
Це необхідно для того, щоб впевнитися в отриманні повної дози препарату.
Е. Після утримання кнопки і повільного рахування до 10 відпустити кнопку для виконання ін’єкції. Після цього витягнути голку зі шкіри.
Крок 6. Від’єднати голку.
Слід поводитися з голками з обережністю — це необхідно, щоб запобігти уколам голкою і перехресному інфікуванню.
Не надівати знову внутрішній ковпачок голки.
А. Взяти зовнішній ковпачок голки за його найширшу частину. Тримати голку прямо і ввести її назад, у зовнішній ковпачок голки. Після цього міцно притиснути їх один до одного.
Голка може проколоти ковпачок, якщо він надівається під кутом.
В. Взяти зовнішній ковпачок голки за його найширшу частину та стиснути його у цьому місці. Іншою рукою повернути шприц-ручку декілька разів для від’єднання голки.
Якщо голка не від’єдналася з першого разу, слід спробувати знову.
С. Викинути використану голку у стійкий до проколювань контейнер або відповідно до рекомендацій лікаря чи місцевого уповноваженого органу.
D. Надіти ковпачок шприц-ручки назад на шприц-ручку.
Не класти шприц-ручку назад у холодильник
Інструкції щодо зберігання. Перед першим використанням шприц-ручки зберігати у холодильнику при температурі 2–8 °С у захищеному від світла місці. Не заморожувати.
Після першого використання шприц-ручку слід зберігати не більше 28 днів при кімнатній температурі нижче 25 °С у захищеному від світла місці.
Не класти шприц-ручку назад у холодильник.
Після кожної ін’єкції на шприц-ручку слід знову надівати ковпачок з метою захисту від світла. Не можна зберігати шприц-ручку з прикріпленою до неї голкою.
Експлуатація. Зі шприц-ручкою слід поводитися з обережністю. Якщо здається, що шприц-ручку пошкоджено, не слід намагатися її полагодити, слід взяти нову.
Захистити шприц-ручку від пилу та бруду: зовнішню поверхню шприц-ручки можна очищувати, протираючи її вологою тканиною (змоченою лише водою). Не занурювати в рідину, не промивати і не змащувати шприц-ручку — це може її пошкодити.
Утилізація шприц-ручки: перед утилізацією шприц-ручки слід зняти з неї голку. Викидати шприц-ручку так, як рекомендовано місцевими регуляторними органами.
Діти. Безпека та ефективність препарату Соліква для лікування дітей віком до 18 років не встановлені. Дані з цього приводу відсутні.
Протипоказання
гіперчутливість до діючих речовин або будь-якої допоміжної речовини, що входить до складу препарату.
Побічна дія
побічними реакціями, про які найчастіше повідомлялося під час лікування препаратом Соліква, були гіпоглікемія та розлади з боку ШКТ (див. Опис окремих небажаних реакцій).
Побічні реакції, пов’язані із застосуванням препарату, що виявлені під час клінічних досліджень, наводяться у табл. 5 за категоріями «система — орган — клас» у порядку зниження частоти виникнення: дуже часто (≥1/10), часто (від ≥1/100 до <1/10), нечасто (від ≥1/1000 до <1/100), рідко (від ≥1/10 000 до <1/1000), дуже рідко (≥1/10 000), частота невідома (неможливо оцінити за наявними даними).
Таблиця 5.
Побічні реакції, пов’язані із застосуванням препарату, що відмічалися під час клінічних досліджень
| Категорії «система — орган — клас» MedDRA | Дуже часто | Часто | Нечасто | Частота невідома |
| Інфекційні та паразитарні захворювання | Назофарингіт, інфекція верхніх дихальних шляхів | |||
| Розлади з боку імунної системи | Кропив'янка | |||
| Метаболічні та аліментарні розлади | Гіпоглікемія | |||
| Розлади з боку нервової системи | Запаморочення | Головний біль | ||
| Розлади з боку ШКТ | Нудота, діарея, блювання | Диспепсія, біль у животі | ||
| Розлади з боку шкіри та підшкірних тканин | Шкірний амілоїдоз, ліподистрофія | |||
| Загальні розлади та реакції в місці введення препарату | Підвищена втомлюваність, реакції в місці ін’єкції | |||
Опис окремих побічних реакцій. Гіпоглікемія. В табл. 6 наведені дані про частоту задокументованої симптоматичної гіпоглікемії (<3,9 ммоль/л) та тяжкої гіпоглікемії при застосуванні препарату Соліква та препарату порівняння.
Таблиця 6.
Побічні реакції у вигляді задокументованої симптоматичної гіпоглікемії або тяжкої гіпоглікемії
| Пацієнти, які раніше не отримували інсулін | Перехід з базального інсуліну | Перехід з агоніста рецепторів ГПП-1 | |||||
| Препарат Соліква | Інсулін гларгін | Ліксисенатид | Препарат Соліква | Інсулін гларгін | Препарат Соліква | Агоніст рецепторів ГПП-1 | |
| n | 469 | 467 | 233 | 365 | 365 | 255 | 256 |
| Задокументована симптоматична гіпоглікемія* | |||||||
| Пацієнти, у яких виникла побічна реакція, n | 120 (25,6%) | 110 (23,6%) | 15 (6,4%) | 146 (40,0%) | 155 (42,5%) | 71 (27,8%) | 6 (2.3%). |
| Кількість побічних реакцій на пацієнто-рік, n | 1,44 | 1,22 | 0,34 | 3,03 | 4,22 | 1,54 | 0,08 |
| Тяжка гіпоглікемія** | |||||||
| Кількість побічних реакцій на пацієнто-рік, n | 0 | <0,01 | 0 | 0,02 | <0,01 | <0,01 | 0 |
*Задокументована симптоматична гіпоглікемія визначалася як подія, під час якої типові симптоми гіпоглікемії супроводжувалися визначеною концентрацією глюкози в плазмі крові <3,9 ммоль/л.
**Тяжка симптоматична гіпоглікемія визначалася як явище, що потребувало допомоги іншої особи для активного введення вуглеводів, глюкагону або проведення інших реанімаційних заходів.
**Тяжка симптоматична гіпоглікемія визначалася як явище, що потребувало допомоги іншої особи для активного введення вуглеводів, глюкагону або проведення інших реанімаційних заходів.
Розлади з боку ШКТ (нудота, блювання та діарея) були побічними реакціями, про які часто повідомлялося впродовж періоду лікування. У пацієнтів, які отримували лікування препаратом Соліква, частота пов’язаної нудоти, діареї та блювання становила 8,4; 2,2 та 2,2% відповідно. Побічні реакції у вигляді розладів з боку ШКТ переважно були легкого ступеня та мали транзиторний характер.
Розлади з боку імунної системи. Про алергічні реакції (кропив’янка), можливо пов’язані із застосуванням препарату Соліква, повідомляли у 0,3% пацієнтів. Про випадки генералізованих алергічних реакцій, включаючи анафілактичні реакції та ангіоневротичний набряк, повідомляли при післяреєстраційному застосуванні інсуліну гларгіну та ліксисенатиду.
Імуногенність. Застосування препарату Соліква може призводити до утворення антитіл до інсуліну гларгіну та/або ліксисенатиду.
Частота випадків утворення антитіл до інсуліну гларгіну становила 21,0 та 26,2%. Приблизно у 93% пацієнтів відзначалася перехресна реактивність антитіл до інсуліну гларгіну стосовно людського інсуліну. Частота утворення антитіл до ліксисенатиду становила близько 43%. Ні статус антитіл до інсуліну гларгіну, ні статус антитіл до ліксисенатиду не чинили клінічно значущого впливу на безпеку чи ефективність препарату.
Розлади з боку шкіри та підшкірних тканин. Ліподистрофія й шкірний амілоїдоз можуть виникати в місці ін’єкції інсулінів і призводити до затримки абсорбції інсуліну з нього. Постійне змінювання місця ін’єкції в межах однієї ділянки тіла може допомогти зменшити вираженість або запобігти цим реакціям.
Реакції в місці ін’єкції. У деяких пацієнтів (1,7%), що отримували терапію, яка включала введення інсуліну, у тому числі препарату Соліква, відзначалися почервоніння, місцевий набряк та свербіж в місці ін’єкції.
ЧСС. При застосуванні агоністів рецепторів до ГПП-1 повідомлялося про підвищення ЧСС; транзиторне зростання ЧСС відмічали також і в рамках деяких досліджень застосування ліксисенатиду. За результатами всіх досліджень фази 3 застосування препарату Соліква не призводило до підвищення середньої ЧСС.
Повідомлення про підозрювані побічні реакції після затвердження лікарського засобу є важливою процедурою. Це дозволяє продовжувати моніторинг співвідношення «користь/ризик» для даного лікарського засобу. Медичних працівників просять повідомляти про усі підозрювані побічні реакції у Державний експертний центр МОЗ України.
Особливості застосування
препарат Соліква не повинен застосовуватися у пацієнтів із цукровим діабетом 1-го типу або для лікування діабетичного кетоацидозу.
Гіпоглікемія була небажаною реакцією, про яку повідомлялося найчастіше при лікуванні препаратом Соліква (див. ПОБІЧНА ДІЯ). Гіпоглікемія може виникати, якщо доза препарату Соліква є вищою, ніж необхідна.
Фактори, які підвищують схильність до виникнення гіпоглікемії, потребують особливо ретельного моніторингу та можуть призводити до необхідності корекції дози препарату. До таких факторів належать наступні:
– зміна ділянки ін’єкції;
– підвищення чутливості до інсуліну (наприклад при усуненні стресових факторів);
– незвичне, надмірне або тривале фізичне навантаження;
– супутнє захворювання (наприклад таке, що супроводжується блюванням, діареєю);
– неадекватний прийом їжі;
– пропуск прийому їжі;
– вживання алкоголю;
– деякі некомпенсовані ендокринні розлади (наприклад гіпотиреоз та недостатність передньої частки гіпофіза чи кори надниркових залоз);
– одночасне застосування деяких інших лікарських засобів (див. ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ);
– при застосуванні ліксисенатиду та/або інсуліну в комбінації з препаратами сульфонілсечовини може підвищуватися ризик виникнення гіпоглікемії, у зв’язку з чим препарат Соліква не повинен застосовуватися в комбінації з препаратами сульфонілсечовини.
Дозу препарату Соліква слід підбирати індивідуально з урахуванням клінічної відповіді, а її титрування здійснюється відповідно до потреби пацієнта в інсуліні (див. ЗАСТОСУВАННЯ).
Гострий панкреатит. Застосування агоністів рецепторів до ГПП-1 асоціюється з ризиком розвитку гострого панкреатиту. Повідомлялося про невелику кількість випадків гострого панкреатиту на фоні застосування ліксисенатиду, хоча наявність причинно-наслідкового зв’язку з прийомом препарату не встановлена. Пацієнти повинні бути поінформовані про характерні симптоми гострого панкреатиту, такі як постійний сильний біль у животі. У разі підозри на панкреатит застосування препарату Соліква необхідно припинити: якщо гострий панкреатит підтверджується, ліксисенатид призначати більше не можна. У пацієнтів з наявністю панкреатиту в анамнезі слід дотримуватися обережності при призначенні препарату.
Тяжке захворювання ШКТ. Застосування агоністів рецепторів до ГПП-1 може бути асоційоване з небажаними реакціями з боку ШКТ. Застосування препарату Соліква не досліджувалося у пацієнтів з тяжкими шлунково-кишковими захворюваннями, включаючи тяжкий гастропарез, у зв’язку з чим застосування лікарського засобу Соліква у таких пацієнтів не рекомендується.
Тяжке порушення функції нирок. Терапевтичний досвід застосування препарату у пацієнтів з тяжким порушенням функції нирок (кліренс креатиніну <30 мл/хв) та при термінальній стадії хвороби нирок відсутній. Застосування препарату у пацієнтів з тяжким порушенням функції нирок та при термінальній стадії хвороби нирок не рекомендується (див. ЗАСТОСУВАННЯ і Фармакокінетика).
Одночасне застосування інших лікарських засобів. Сповільнення випорожнення шлунка, зумовлене застосуванням ліксисенатиду, може зменшувати швидкість абсорбції лікарських засобів, що застосовуються перорально. Препарат Соліква слід застосовувати з обережністю у пацієнтів, які отримують лікарські засоби, для яких є необхідною швидка абсорбція в ШКТ, що потребують ретельного клінічного моніторингу або мають вузький терапевтичний індекс. Конкретні рекомендації стосовно прийому таких лікарських засобів наведені в розділі ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ.
Дегідратація. Пацієнтам, які отримують препарат Соліква, необхідно повідомляти про потенційний ризик дегідратації, пов’язаний з небажаними реакціями з боку ШКТ, і у таких пацієнтів повинні вживатися заходи для запобігання гіповолемії.
Утворення антитіл. Застосування препарату Соліква може призводити до утворення антитіл до інсуліну гларгіну та/або ліксисенатиду. У рідкісних випадках наявність таких антитіл може зумовлювати необхідність в корекції дози препарату Соліква з метою усунення схильності до розвитку гіпер- або гіпоглікемії.
Уникнення помилок у застосуванні лікарського засобу. Пацієнти повинні бути проінструктовані щодо необхідності обов’язкової перевірки маркування шприц-ручки перед кожною ін’єкцією для уникнення випадкової плутанини між двома різними дозуваннями препарату Соліква та плутанини з іншими ін’єкційними протидіабетичними лікарськими засобами.
Для уникнення помилок в дозуванні та потенційного передозування ні пацієнти, ні медичні працівники ніколи не повинні використовувати шприц для забору лікарського засобу з картриджа шприц-ручки.
Ситуації, у яких застосування лікарського засобу не досліджувалося. Застосування препарату Соліква не досліджувалося в комбінації з інгібіторами ДПП-4, препаратами сульфонілсечовини, глінідами та піоглітазоном.
Допоміжні речовини. Цей лікарський засіб містить менше 1 ммоль натрію (23 мг) на одну дозу, тобто можна вважати, що він практично не містить натрію.
Цей лікарський засіб містить метакрезол, який може спричинити алергічні реакції.
Застосування у період вагітності або годування грудьми. Препарат Соліква не рекомендується застосовувати жінкам репродуктивного віку, які не використовують засоби контрацепції.
Вагітність. Не існує клінічного досвіду застосування препарату Соліква у вагітних. Не існує клінічних даних, отриманих у ході контрольованих клінічних досліджень, стосовно застосування препарату Соліква, інсуліну гларгіну аби ліксисенатиду у період вагітності. Великий обсяг даних щодо застосування інсуліну гларгіну у вагітних (більше 1000 випадків вагітності) вказує на те, що інсулін гларгін не спричиняє специфічних небажаних впливів на перебіг вагітності, а також не викликає ані вад розвитку у плода/новонародженого, ані токсичного впливу на нього. Дослідження на лабораторних тваринах не виявили ознак впливу інсуліну гларгіну на репродуктивну систему.
Не існує належних даних щодо застосування ліксисенатиду у вагітних. Результати досліджень на тваринах свідчать про наявність токсичного впливу ліксисенатиду на репродуктивну систему (див. ФАРМАКОЛОГІЧНІ ВЛАСТИВОСТІ. Доклінічні дані з безпеки).
Препарат Соліква не повинен застосовуватися у період вагітності. Якщо пацієнтка планує вагітність або вагітність вже настала, лікування препаратом Соліква слід припинити.
Годування грудьми. Невідомо, чи інсулін гларгін або ліксисенатид екскретуються в грудне молоко у людини. Препарат Соліква не повинен застосовуватися під час годування грудьми.
Репродуктивна функція. Дослідження на лабораторних тваринах не виявили безпосереднього шкідливого впливу ліксисенатиду чи інсуліну гларгіну на репродуктивну функцію.
Здатність впливати на швидкість реакції при керуванні транспортними засобами або роботі з іншими механізмами. Препарат Соліква не спричиняє або чинить незначний вплив на здатність керувати транспортними засобами або працювати з іншими механізмами. Здатність пацієнта до концентрації уваги та швидкість його реакції можуть порушуватися внаслідок виникнення гіпоглікемії чи гіперглікемії або, наприклад, внаслідок зорових розладів. Це може бути небезпечним у ситуаціях, коли ці якості є особливо важливими (наприклад під час керування транспортним засобом або роботи з іншими механізмами).
Пацієнтам необхідно порадити вживати необхідних запобіжних заходів з метою уникнення гіпоглікемії під час керування транспортним засобом або роботі з іншими механізмами. Це є особливо важливим для тих пацієнтів, у яких перші ознаки розвитку гіпоглікемії є слабко вираженими або взагалі відсутні, а також для тих хворих, у яких часто виникає гіпоглікемія. Необхідно ретельно зважувати, чи варто сідати за кермо або працювати з іншими механізмами у такому стані.
Взаємодія з іншими лікарськими засобами
жодних досліджень з вивченням взаємодії лікарського засобу Соліква з іншими лікарськими засобами не проводилося. Інформація, наведена нижче, ґрунтується на результатах досліджень, проведених з окремими компонентами препарату .
Фармакодинамічні взаємодії. Існує ряд речовин, які впливають на метаболізм глюкози, у зв’язку із чим їх застосування може призводити до необхідності корекції дози лікарського засобу Соліква.
До речовин, які можуть посилювати гіпоглікемічний ефект та підвищувати схильність до виникнення гіпоглікемії, належать протидіабетичні лікарські засоби, інгібітори АПФ, дизопірамід, фібрати, флуоксетин, інгібітори МАО, пентоксифілін, пропоксифен, саліцилати та сульфаніламідні антибіотики.
До речовин, які можуть послаблювати гіпоглікемічний ефект, належать кортикостероїди, даназол, діазоксид, діуретики, глюкагон, ізоніазид, естрогени та прогестини, похідні фенотіазину, соматропін, симпатоміметики (наприклад епінефрин, сальбутамол, тербуталін), гормони щитоподібної залози, атипові антипсихотичні лікарські засоби (наприклад клозапін та оланзапін) та інгібітори протеаз.
Блокатори β-адренорецепторів, клонідин, солі літію або алкоголь можуть як посилювати, так і послаблювати гіпоглікемічний ефект інсуліну. Пентамідин може спричинювати гіпоглікемію, після якої інколи може розвинутися гіперглікемія.
Крім того, під дією симпатолітичних засобів, таких як блокатори β-адренорецепторів, клонідин, гуанетидин та резерпін, ознаки адренергічної контррегуляції можуть послаблюватися або зовсім зникати.
Фармакокінетичні взаємодії. Ліксисенатид є пептидом та не метаболізується за участю цитохрому Р450. За результатами досліджень в умовах in vitro ліксисенатид не впливав на активність досліджуваних ізоферментів цитохрому Р450 та транспортерів людини.
Про жодні фармакокінетичні взаємодії інсуліну гларгіну невідомо.
Вплив випорожнення шлунка на пероральні лікарські засоби. Сповільнення випорожнення шлунка, зумовлене застосуванням ліксисенатиду, може зменшувати швидкість абсорбції лікарських засобів, що застосовуються перорально. За станом пацієнтів, які отримують лікарські засоби, що мають вузький терапевтичний індекс або потребують ретельного клінічного моніторингу, повинен здійснюватися ретельний нагляд, особливо на початку лікування ліксисенатидом. Ці лікарські засоби слід приймати у стандартизованому порядку відносно прийому ліксисенатиду. Якщо такі лікарські засоби необхідно приймати з їжею, то пацієнтам потрібно рекомендувати за можливості приймати їх з тим прийомом їжі, коли не вводиться ліксисенатид.
Що стосується пероральних лікарських засобів, ефективність яких особливо залежить від порогових концентрацій, наприклад антибіотиків, то пацієнтам потрібно рекомендувати приймати такі лікарські засоби принаймні за 1 год до або через 4 год після ін’єкції ліксисенатиду.
Кишково-розчинні лікарські форми, які містять речовини, чутливі до розщеплення в шлунку, необхідно приймати за 1 год до або через 4 год після ін’єкції ліксисенатиду.
Парацетамол використовувався у якості моделі лікарського засобу для оцінки впливу ліксисенатиду на випорожнення шлунка. Після однократного прийому парацетамолу в дозі 1000 мг AUC та Т½ парацетамолу залишалися незмінними, незалежно від часу прийому препарату (до або після ін’єкції ліксисенатиду). При застосуванні препарату через 1 год або через 4 год після введення 10 мкг ліксисенатиду Сmax парацетамолу знижувалася на 29 і 31% відповідно, а медіана Тmax збільшувалася на 2,0 і 1,75 год відповідно. Прогнозується, що при введенні ліксисенатиду в підтримувальній дозі 20 мкг відмічатиметься ще більше зростання Тmax і зниження Сmax парацетамолу. При прийомі парацетамолу за 1 год до введення ліксисенатиду Сmax і Тmax парацетамолу не змінювалися.
З огляду на наведені результати, необхідність у корекції дози парацетамолу відсутня, але подовження Тmax, яке відмічали, коли парацетамол приймали через 1–4 год після введення ліксисенатиду, слід враховувати у разі, коли для ефективності необхідний швидкий початок дії.
Пероральні контрацептиви. Однократний прийом перорального контрацептиву (етинілестрадіолу 0,03 мг/левоноргестрелу 0,15 мг) за 1 год до або через 11 год після введення 10 мкг ліксисенатиду не впливав на Сmax, AUC, Т½ і Тmax етинілестрадіолу та левоноргестрелу.
Прийом перорального контрацептиву через 1 год або через 4 год після введення ліксисенатиду не впливав на AUC і Т½ етинілестрадіолу та левоноргестрелу, хоча Сmax етинілестрадіолу знижувалася на 52 і 39% відповідно, Сmax левоноргестрелу знижувалася на 46 і 20% відповідно, а медіана Тmax збільшувалася на 1–3 год. Таке зниження Сmax має обмежену клінічну значущість і необхідність у корекції дози пероральних контрацептивів відсутня.
Аторвастатин. При одночасному застосуванні ліксисенатиду в дозі 20 мкг та аторвастатину в дозі 40 мг, які приймали вранці впродовж 6 днів, експозиція аторвастатину не змінювалася, у той час як Сmax знижувалась на 31%, a Тmax подовжувався на 3,25 год.
Такого збільшення Тmax не виявлено у випадку, коли аторвастатин приймали ввечері, а ліксисенатид вводився вранці, але AUC і Сmax аторвастатину при цьому збільшувалися на 27 і 66% відповідно.
Ці зміни не є клінічно значущими, тому необхідності у корекції дози аторвастатину при його одночасному застосуванні з ліксисенатидом немає.
Варфарин та інші похідні кумарину. При одночасному застосуванні варфарину в дозі 25 мг та багатократному введенні ліксисенатиду в дозі 20 мкг не відмічалося жодного впливу на AUC або міжнародне нормалізоване відношення, у той час як Сmax знижувалася на 19%, a Тmax подовжувався на 7 год.
З огляду на ці дані необхідності в корекції дози варфарину при його одночасному застосуванні з ліксисенатидом немає; однак на початку та при завершенні лікування ліксисенатидом у пацієнтів, які приймають варфарин та/або інші похідні кумарину, рекомендується здійснювати частий моніторинг міжнародного нормалізованого відношення.
Дигоксин. При одночасному застосуванні ліксисенатиду в дозі 20 мкг та дигоксину в дозі 0,25 мг у рівноважному стані AUC дигоксину не змінювалася. При цьому Тmax дигоксину збільшився на 1,5 год, а Сmax знизилася на 26%.
З огляду на ці дані, необхідності у корекції дози дигоксину при його одночасному застосуванні з ліксисенатидом немає.
Раміприл. При одночасному застосуванні ліксисенатиду в дозі 20 мкг і раміприлу в дозі 5 мг впродовж 6 днів AUC раміприлу збільшилася на 21%, у той час як Сmax знизилася на 63%. При цьому AUC і Сmax активного метаболіту (раміприлату) не змінювалися. Значення Тmax раміприлу і раміприлату збільшилося приблизно на 2,5 год.
З огляду на ці дані, необхідності у корекції дози раміприлу при його одночасному застосуванні з ліксисенатидом немає.
Несумісність. Цей лікарський засіб не можна змішувати з будь-яким іншим інсуліном або розводити.
Передозування
у випадку введення вищої дози препарату Соліква, ніж потрібно, можуть виникнути небажані реакції у вигляді гіпоглікемії та розладів з боку ШКТ. Епізоди гіпоглікемії легкого ступеня, як правило, можуть бути усунені пероральним прийомом вуглеводів. Може виникнути необхідність у корекції дози лікарського засобу та у внесенні змін у режим харчування чи фізичної активності.
Більш тяжкі епізоди гіпоглікемії, які супроводжуються комою, судомами або неврологічними порушеннями, потребують в/м або п/ш введення глюкагону, або в/в введення концентрованого р-ну глюкози. Оскільки гіпоглікемія може виникнути повторно навіть після очевидного покращення клінічного стану пацієнта, необхідними заходами можуть бути тривалий прийом вуглеводів та спостереження за станом пацієнта.
У випадку небажаних реакцій з боку ШКТ повинна бути розпочата відповідна підтримувальна терапія відповідно до клінічних ознак та симптомів, що виявлені у пацієнта.
Умови зберігання
шприц-ручки, що не перебувають у використанні. Зберігати у холодильнику (при температурі 2–8 °С). Не заморожувати та не допускати контакту з морозильним відділенням або накопичувачами холоду.
Зберігати шприц-ручку у зовнішній картонній упаковці з метою захисту від світла.
Шприц-ручки після першого використання. Термін придатності після першого використання шприц-ручки — 28 днів.
Зберігати при температурі нижче 25 °С. Не заморожувати. Не охолоджувати. Не зберігати з прикріпленою голкою. Зберігати шприц-ручку у місці, захищеному від джерел прямого тепла та світла. Після кожної ін’єкції на шприц-ручку слід знову надівати ковпачок з метою захисту від світла.


