Іксджева® розчин для ін'єкцій 70 мг/мл флакон 1.7 мл 120 мг №1
Іксджева інструкція із застосування
Склад
1 мл розчину містить 70 мг деносумабу; 1 флакон (1,7 мл) містить 120 мг деносумабу;
допоміжні речовини: сорбіт (E420), кислота оцтова льодяна, натрію гідроксид, полісорбат 20, вода для ін’єкцій.
Деносумаб - 70 мг/мл
Фармакологічні властивості
фармакодинаміка
Механізм дії. RANKL існує як трансмембранний або розчинний білок. RANKL необхідний для утворення, функціонування та виживання остеокластів — єдиного типу клітин, відповідальних за резорбцію кісток. Підвищена активність остеокластів, що стимулюється RANKL, є головним медіатором деструкції кісток при їх метастатичному ураженні та мієломній хворобі. Деносумаб — це моноклональне антитіло людини (IgG2), яке з високою афінністю та специфічністю направляється та зв’язується з RANKL, запобігаючи виникненню взаємодії RANKL/RANK і призводячи до зниження кількості та послаблення функції остеокластів, таким чином зменшуючи резорбцію та деструкцію кісток, індуковану раком.
Гігантоклітинні пухлини кісток характеризуються експресією ліганду RANK неопластичними стромальними клітинами та RANK остеокластоподібними гігантськими клітинами. У пацієнтів із гігантоклітинною пухлиною кісток деносумаб зв’язується з лігандом RANK, суттєво зменшуючи кількість або елімінуючи остеокластоподібні гігантські клітини. Як наслідок, зменшується остеоліз і проліферативна пухлинна строма заміщується непроліферативною диференційованою щільнотканинною новою кісткою.
Фармакодинамічні ефекти. У клінічних дослідженнях ІІ фази серед пацієнтів із пізньою стадією злоякісних пухлин, які вражають кістки, п/ш введення препарату Іксджева® кожні 4 тиж (Q4W) або кожні 12 тиж призводило до швидкого зниження маркерів резорбції кісток (uNTx/Cr, сироватковий CTx) із середнім зниженням на рівні приблизно 80% для uNTx/Cr, яке виникало протягом 1 тиж незалежно від попереднього лікування бісфосфонатом або від вихідного рівня uNTx/Cr. У клінічних дослідженнях III фази у пацієнтів із пізньою стадією злоякісних пухлин, які вражають кістки, середнє зниження uNTx/Cr на рівні приблизно 80% підтримувалося включно до 49-го тижня лікування препаратом Іксджева® (по 120 мг кожні 4 тижні (Q4W)).
Імуногенність. У клінічних дослідженнях не виявлено нейтралізуючих антитіл до деносумабу у пацієнтів із розвиненою стадією раку або гігантоклітинною пухлиною кісток. При застосуванні імуноферментного аналізу <1% пацієнтів, які отримували деносумаб до 3 років, були позитивними щодо ненейтралізуючих зв’язуючих антитіл без доказів порушеної фармакокінетики, токсичності або клінічної реакції.
Клінічна ефективність у пацієнтів з метастазами солідних пухлин в кістки. Ефективність та безпеку препарату Іксджева® в дозі 120 мг після п/ш введення кожні 4 тиж або золедронової кислоти в дозі 4 мг (корекція дози при погіршеній функції нирок) після в/в введення кожні 4 тиж порівнювали в трьох рандомізованих подвійних сліпих активно контрольованих дослідженнях у пацієнтів, які раніше не отримували в/в бісфосфонат і мали пізню стадію злоякісної пухлини з ураженням кісток: дорослі з раком молочної залози (дослідження 1), інші солідні пухлини або мієломна хвороба (дослідження 2) та рак передміхурової залози, резистентний до кастрації (дослідження 3). У цих активно контрольованих клінічних дослідженнях безпека оцінювалася у 5931 хворого. Пацієнти з остеонекрозом щелепи (ОНЩ) в анамнезі або остеомієлітом щелепи, пацієнти з активним захворюванням зубів або щелеп, яким необхідне стоматологічне хірургічне втручання, пацієнти, у яких не загоїлися рани після стоматологічного втручання/хірургічного втручання в ротовій порожнині, або пацієнти з будь-якими запланованими інвазивними процедурами не відповідали критеріям для включення в ці дослідження. Первинні та додаткові кінцеві точки оцінювали появу однієї або більше кісткових подій (КП). У дослідженнях, які демонструють більшу ефективність препарату Іксджева® порівняно із золедроновою кислотою, пацієнтам пропонувався відкритий режим застосування препарату Іксджева® в попередньо визначеній 2-річній розширеній фазі лікування. КП визначалися таким чином: патологічний перелом (вертебральний чи невертебральний), променева терапія кісток (у т.ч. із застосуванням радіоізотопів), хірургічне втручання на кістках чи компресія спинного мозку.
Препарат Іксджева® знижував ризик розвитку КП і розвиток множинних КП (перша та наступні) у пацієнтів із метастазами солідних пухлин в кістки (табл. 1).
Таблиця 1. Результати дослідження ефективності у пацієнтів з пізніми стадіями злоякісних пухлин, які уражають кістки
| Назва патології/показник | Дослідження 1 (рак молочної залози) | Дослідження 2 (інші солідні пухлини** або мієломна хвороба) | Дослідження 3 (рак передміхурової залози) | Поширений рак (комбіновані дані) | ||||
| Речовина | Іксджева® | Золедронова кислота | Іксджева® | Золедронова кислота | Іксджева® | Золедронова кислота | Іксджева® | Золедронова кислота |
| N | 1026 | 1020 | 886 | 890 | 950 | 951 | 2862 | 2861 |
| Перша КП | ||||||||
| Медіана часу, міс | НД | 26,4 | 20,6 | 16,3 | 20,7 | 17,1 | 27,6 | 19,4 |
| Різниця медіан часу, міс | ДВ | 4,2 | 3,5 | 8,2 | ||||
| ВР (95% ДІ)/ЗВР (%) | 0,82 (0,71; 0,95)/18 | 0,84 (0,71; 0,98)/16 | 0,82 (0,71; 0,95)/18 | 0,83 (0,76; 0,90)/17 | ||||
| p-значення не меншої ефективності/більшої ефективності | <0,0001†/0,0101† | 0,0007†/0,0619† | 0,0002†/0,0085† | <0,0001/<0,0001 | ||||
| Пропорція пацієнтів, % | 30,7 | 36,5 | 31,4 | 36,3 | 35,9 | 40,6 | 32,6 | 37,8 |
| Перша та наступні КП* | ||||||||
| Середня кількість пацієнти | 0,46 | 0,60 | 0,44 | 0,49 | 0,52 | 0,61 | 0,48 | 0,57 |
| Відношення ризиків (95% ДІ)/ЗВР (%) | 0,77 (0,66; 0,89)/23 | 0,90 (0,77; 1,04)/10 | 0,82 (0,71; 0,94)/18 | 0,82 (0,75; 0,89)/18 | ||||
| p-значення більшої ефективності | 0,0012† | 0,1447† | 0,0085† | <0,0001 | ||||
| ПКП в рік | 0,45 | 0,58 | 0,86 | 1,04 | 0,79 | 0,83 | 0,69 | 0,81 |
| Перша КП або ГКЗ | ||||||||
| Медіана часу, міс | НД | 25,2 | 19,0 | 14,4 | 20,3 | 17,1 | 26,6 | 19,4 |
| ВР (95% ДІ)/ЗВР (%) | 0,82 (0,70; 0,95)/18 | 0,83 (0,71; 0,97)/17 | 0,83 (0,72; 0,96)/17 | 0,83 (0,76; 0,90)/17 | ||||
| p-значення більшої ефективності | 0,0074 | 0,0215 | 0,0134 | <0,0001 | ||||
| Перше опромінення кісток | ||||||||
| Медіана часу, міс | НД | НД | НД | НД | НД | 28,6 | НД | 33,2 |
| ВР (95% ДІ)/ЗВР (%) | 0,74 (0,59; 0,94)/26 | 0,78 (0,63; 0,97)/22 | 0,78 (0,66; 0,94)/22 | 0,77 (0,69; 0,87)/23 | ||||
| p-значення більшої ефективності | 0,0121 | 0,0256 | 0,0071 | <0,0001 | ||||
НД — не досягнуто; ДВ — дані відсутні; ДІ — довірчий інтервал; ГКЗ — гіперкальціємія при злоякісній пухлині; ПКП — поширеність кісткових подій; ВР — відношення ризиків; ЗВР — зниження відносного ризику; † — скориговані р-значення, взяті з досліджень 1, 2 та 3 (перша КП, а також кінцеві точки першої та наступних КП).
*Враховує всі КП в динаміці; підраховуються тільки події, які виникли через ≥21 день після попередньої події.
**Включаючи недрібноклітинний рак легені, нирковоклітинний рак, колоректальний рак, дрібноклітинний рак легені, рак сечового міхура, рак голови та шиї, рак ШКТ/сечостатевої системи та інших локалізацій, за винятком раку молочної залози та раку передміхурової залози.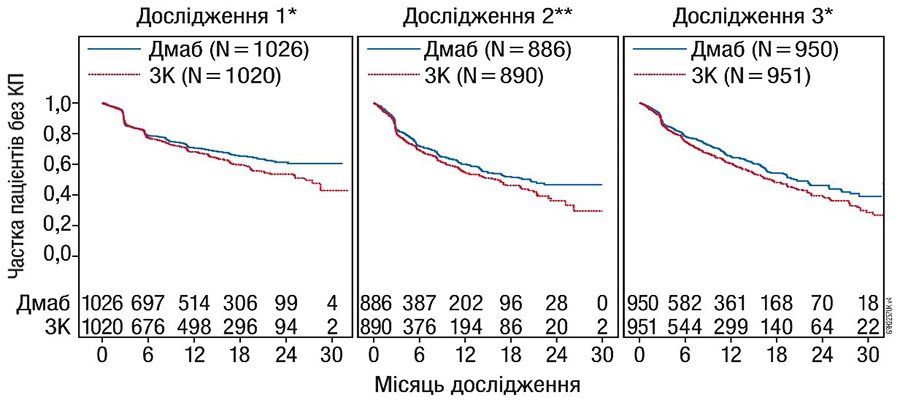
Рис. 1. Графіки Каплана — Мейєра для часу першої КП, яка виникла під час дослідження.
Примітки: N — кількість рандомізованих пацієнтів; * — статистично суттєво для більшої ефективності; ** — статистично суттєво для не меншої ефективності; ЗК — золедронова кислота 4 мг кожні 4 тиж (Q4W); Дмаб — деносумаб 120 мг кожні 4 тиж (Q4W).
Прогресування захворювання та загальна виживаність при метастазах солідних пухлин у кістки. Прогресування захворювання було аналогічним у групах препарату Іксджева® та золедронової кислоти в усіх трьох дослідженнях та в попередньо визначеному об’єднаному аналізі трьох досліджень.
В дослідженнях 1, 2 та 3 загальна виживаність була зіставною у групах препарату Іксджева® та золедронової кислоти у пацієнтів із поширеними стадіями злоякісних пухлин з ураженням кісток: пацієнти з раком молочної залози (відношення ризиків [95% ДІ] 0,95 [0,81; 1,11]), пацієнти з раком передміхурової залози (відношення ризиків [95% ДІ] 1,03 [0,91; 1,17]) та пацієнти з іншими солідними пухлинами або мієломною хворобою (відношення ризиків [95% ДІ] 0,95 [0,83; 1,08]). Post-hoc аналіз в дослідженні 2 (пацієнти з іншими солідними пухлинами або мієломною хворобою) визначав загальну виживаність при наявності однієї з 3 типів пухлин з використанням стратифікації (недрібноклітинний рак легені, мієломна хвороба та інші). Загальна виживаність була вищою у групі препарату Іксджева® при недрібноклітинному раку легені (відношення ризиків [95% ДІ] 0,79 [0,65; 0,95]; n=702), у групі золедронової кислоти при мієломній хворобі (відношення ризиків [95% ДІ] 2,26 [1,13; 4,50]; n=180) та аналогічною у групі препарату Іксджева® та золедронової кислоти при інших типах пухлин (відношення ризиків [95% ДІ] 1,08 (0,90; 1,30); n=894). Це дослідження не контролювалося щодо прогностичних факторів та протипухлинного лікування. В об’єднаному попередньо визначеному аналізі досліджень 1, 2 та 3 загальна виживаність була аналогічною у групі препарату Іксджева® та золедронової кислоти (відношення ризиків [95% ДІ] 0,99 [0,91; 1,07]).
Вплив на біль. Час до зменшення болю (тобто зниження на ≥2 бали від початкових значень за шкалою оцінки болю модифікованого короткого опитувальника оцінки болю BPI-SF) був аналогічним для деносумабу та золедронової кислоти в кожному дослідженні та в інтегрованих аналізах. У post-hoc аналізі комбінованих даних медіана часу до посилення болю (>4 балів посилення за шкалою болю) у пацієнтів з легким болем або без болю на вихідному рівні був більшим для препарату Іксджева® порівняно із золедроновою кислотою (198 проти 143 днів) (p=0,0002).
Клінічна ефективність у пацієнтів із мієломною хворобою
У міжнародному рандомізованому (1:1) подвійно сліпому активно контрольованому дослідженні препарат Іксджева® порівнювали із золедроновою кислотою у пацієнтів із вперше діагностованою мієломною хворобою (дослідження 4).
У цьому дослідженні 1718 пацієнтів із мієломною хворобою зі щонайменше одним кістковим вогнищем були рандомізовані для п/ш введення препарату Іксджева® у дозі 120 мг кожні 4 тиж (Q4W) чи в/в введення золедронової кислоти у дозі 4 мг кожні 4 тиж (корекція дози проводилася з урахуванням функції нирок). Первинною кінцевою точкою дослідження була демонстрація неменшої ефективності препарату Іксджева® щодо появи першої КП порівняно із золедроновою кислотою. До вторинних кінцевих точок належали більш висока ефективність щодо часу до першої КП, до першої та наступної КП і загальна виживаність. КП визначалися таким чином: патологічний перелом (вертебральний чи невертебральний), променева терапія кісток (у т. ч. із застосуванням радіоізотопів), хірургічне втручання на кістках чи компресія спинного мозку.
В обох групах дослідження 54,5% пацієнтів мали пройти автологічну трансплантацію стовбурових клітин пуповинної крові (PBSC), 95,8% використовували/планували використовувати новий протимієломний препарат (бортезоміб, леналідомід чи талідомід) як терапію першої лінії, а 60,7% вже мали КП раніше. В обох групах кількість пацієнтів із мієломною хворобою на І, ІІ та ІІІ стадії за Міжнародною системою стадіювання (ISS) на момент визначення діагнозу становила 32,4%, 38,2% та 29,3% відповідно.
Медіана кількості введених доз становила 16 для препарату Іксджева® та 15 — для золедронової кислоти.
Результати ефективності у дослідженні 4 представлено на рис. 2 та у табл. 2.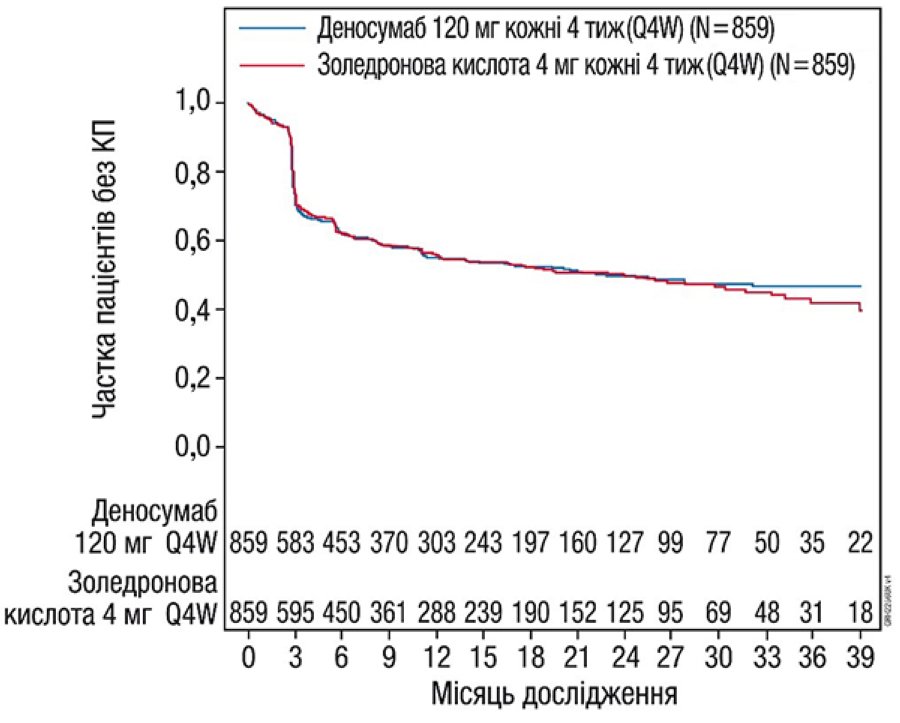
Рис. 2. Графіки Каплана — Мейєра для часу до першої КП, що виникла у пацієнтів із вперше діагностованою мієломною хворобою.
Примітки: N — кількість рандомізованих пацієнтів.
Таблиця 2. Результати ефективності для препарату Іксджева® порівняно із золедроновою кислотою у пацієнтів із вперше діагностованою мієломною хворобою
| Показник | Іксджева® (N = 859) | Золедронова кислота (N=859) |
| Перша КП | ||
| Кількість пацієнтів з КП (%) | 376 (43,8) | 383 (44,6) |
| Медіана часу до КП (міс) | 22,8 (14,7; НО) | 23,98 (16,56; 33,31) |
| Відношення ризиків (95% ДІ) | 0,98 (0,85; 1,14) | |
| Перша та наступні КП | ||
| Середня кількість подій/пацієнт | 0,66 | 0,66 |
| Коефіцієнт відношення (95% ДІ) | 1,01 (0,89; 1,15) | |
| Поширеність кісткових подій в рік | 0,61 | 0,62 |
| Перша КП або ГКЗ | ||
| Медіана часу (міс) | 22,14 (14,26; НО) | 21,32 (13,86; 29,7) |
| Відношення ризиків (95% ДІ) | 0,98 (0,85; 1,12) | |
| Перше опромінення кісток | ||
| Відношення ризиків (95% ДІ) | 0,78 (0,53; 1,14) | |
| Загальна виживаність | ||
| Відношення ризиків (95% ДІ) | 0,90 (0,70; 1,16) | |
Примітки: ГКЗ — гіперкальціємія при злоякісній пухлині, НО — непридатне для оцінювання
Клінічна ефективність для дорослих та підлітків із дозрілою кістковою системою, які мають гігантоклітинну пухлину кісток. що включали 554 пацієнтів, які мали гігантоклітинні нерезектабельні пухлини кісток або для яких хірургічне втручання пов’язувалося з тяжкою захворюваністю. Препарат Іксджева® вводили п/ш в дозі 120 мг кожні 4 тиж з навантажувальною дозою 120 мг на 8-й та 15-й дні. Після припинення лікування препаратом Іксджева® пацієнти переходили до наступної фази тривалістю щонайменше 60 міс щодо подальшого спостереження стану пацієнтів для оцінювання безпеки лікарського засобу. Відновлення лікування препаратом Іксджева® в період спостереження для оцінювання безпеки дозволялося проводити тим учасникам дослідження, у яких спостерігалася початкова відповідь на застосування препарату Іксджева® (наприклад, у разі рецидиву захворювання).
Дослідження 5 включало 37 дорослих пацієнтів із гістологічно підтвердженими нерезектабельними або рецидивуючими гігантоклітинними пухлинами кісток. Основною кінцевою точкою дослідження була об’єктивна відповідь у пацієнтів, яка визначалася як елімінація гігантських клітин принаймні на 90% порівняно з вихідним рівнем (або повна елімінація гігантських клітин, якщо їхня частка становила менше 5% пухлинних клітин), або як відсутність прогресування цільового пухлинного осередку, підтверджена результатами рентгенологічного дослідження в разі відсутності даних гістопатологічного дослідження. З 35 пацієнтів, включених в аналіз ефективності, 85,7% (95% ДІ: 69,7; 95,2) відповідали на лікування препаратом Іксджева®. Критерії відповіді на лікування задовольняли всі 20 пацієнтів (100%), у яких були отримані дані гістопатологічного дослідження. З 15 пацієнтів, які залишилися, 10 (67%) не показали прогресування цільового пухлинного осередку за результатами рентгенологічних досліджень.
Дослідження 6 включало 535 дорослих або підлітків з дозрілою кістковою системою, які мають гігантоклітинну пухлину кісток. Вік 28 пацієнтів із цієї групи становив від 12 до 17 років. Пацієнти були розподілені до однієї з трьох когорт: до когорти 1 входили пацієнти з неоперабельним захворюванням (наприклад, крижові, хребетні або множинні пухлинні осередки, зокрема з метастазами в легені); до когорти 2 входили пацієнти з операбельним захворюванням, у яких заплановане хірургічне втручання пов’язувалося з тяжкими наслідками (наприклад, резекція суглоба, ампутація кінцівки або геміпельвектомія); до когорти 3 входили пацієнти, які перейшли в це дослідження після участі в дослідженні 5. Головна мета полягала в оцінюванні профілю безпеки деносумабу у пацієнтів із гігантоклітинною пухлиною кісток. До вторинних кінцевих точок дослідження належали: для когорти 1 — час до прогресування захворювання (за оцінкою дослідника); для когорти 2 — частка пацієнтів, яким до 6-го місяця не проводили жодного хірургічного втручання.
За результатами заключного аналізу даних у когорті 1 прогресування захворювання зафіксовано у 28 із 260 пацієнтів, які отримали лікування (10,8%). У когорті 2 до місяця 6 не проводили хірургічне втручання у 219 з 238 (92,0% ДІ, 95% ДІ: 87,8%, 95,1%) пацієнтів, які підлягають оцінюванню і яким проводили лікування препаратом Іксджева®. У когорті 2 у 82 (34,3%) з 239 пацієнтів, у яких на вихідному рівні або в період участі в дослідженні цільовий пухлинний осередок локалізувався не в легенях і не в м’яких тканинах, хірургічне втручання під час дослідження не проводилося. Загалом отримані результати ефективності в підлітків із дозрілою кістковою системою і дорослих були схожими.
Вплив на біль. У заключному аналізі даних в об’єднаній групі з 1-ї та 2-ї когорт повідомлялося про клінічно суттєве зменшення вираженості сильного болю (тобто зниження на ≥2 бали від вихідного рівня) у 30,8% пацієнтів групи ризику (тобто у тих, хто мав найгірший бал за шкалою сильного болю ≥2 від вихідного рівня) протягом 1 тиж лікування та ≥50% на 5-му тижні. Це послаблення болю підтримувалося в усіх наступних оцінках.
Діти. Європейське агентство лікарських засобів тимчасово утрималося від зобов’язання передати результати досліджень препарату Іксджева® у всіх підгрупах дітей для запобігання КП у пацієнтів з метастазами в кістках та у підгрупах дітей віком до 12 років при лікуванні гігантоклітинних пухлин кісток (див. ЗАСТОСУВАННЯ для отримання інформації щодо застосування у дітей).
У дослідженні 6 препарат Іксджева® оцінювався в підгрупі з 28 підлітків (віком від 13 до 17 років) з гігантоклітинними пухлинами кісток з дозрілою кістковою системою. Зрілість визначалася за завершеним дозріванням щонайменше 1 трубчатої кістки (наприклад закрита пластинка епіфізарного росту плечової кістки) та маси тіла ≥45 кг. В одного підлітка з неоперабельним захворюванням (n=14) відбувся рецидив під час початкового лікування. До місяця 6 хірургічне лікування не проходили 13 із 14 пацієнтів з операбельним захворюванням, у яких заплановане хірургічне втручання пов’язувалося з тяжкими наслідками.
Фармакокінетика. Абсорбція. Після п/ш введення біодоступність становила 62%.
Біотрансформація. Деносумаб складається виключно з амінокислот та вуглеводів, як і природний імуноглобулін. Тому малоймовірно, що він буде виводитися шляхом печінкового метаболізму. Вважається, що його метаболізм та виведення відбуваються тими самими шляхами, що і кліренс імуноглобуліну, призводячи до розпаду невеликих білків до окремих амінокислот.
Виведення. У пацієнтів із поширеним раком при застосуванні багатократних доз по 120 мг кожні 4 тиж відмічалося підвищення сироваткової концентрації деносумабу майже в 2 рази, а рівноважний стан досягався через 6 міс відповідно до фармакокінетики, не залежної від часу. В осіб із мієломною хворобою, які отримували 120 мг кожні 4 тиж, медіани мінімальних залишкових концентрацій відрізнялися менш ніж на 8% на 6-му та 12-му місяцях. У пацієнтів з гігантоклітинними пухлинами кісток, які отримували 120 мг кожні 4 тиж з навантажувальною дозою на 8-й та 15-й день, рівноважні рівні досягалися протягом першого місяця лікування. На 9-му та 49-му тижнях медіани мінімальних залишкових концентрацій відрізнялися менше ніж 9%. У пацієнтів, які припинили отримувати 120 мг кожні 4 тиж, середній T½ становив 28 днів (діапазон 14–55 днів).
Аналіз популяційної фармакокінетики не вказав на клінічно суттєві зміни системного впливу деносумабу в рівноважному стані залежно від віку (18–87 років), раси/етнічної групи (досліджені пацієнти з темним кольором шкіри, вихідці з Латинської Америки, пацієнти азійського походження та представники європеоїдної раси), статі або типів солідних пухлин чи наявності у пацієнта мієломної хвороби. Збільшення маси тіла пов’язувалося зі зменшенням системного впливу і навпаки. Зміни не вважалися клінічно суттєвими, оскільки фармакодинамічні ефекти на основі маркерів кісткового ремоделювання були відповідними в широкому діапазоні показника маси тіла.
Лінійність/нелінійність. Деносумаб відображав нелінійну фармакокінетику в широкому діапазоні доз, але майже дозопропорційне збільшення впливу для доз 60 мг (або 1 мг/кг) та вище. Нелінійність, найімовірніше, пов’язана з важливим шляхом виведення, опосередкованим мішенню, яка насичується, при низьких концентраціях.
Ниркова недостатність. У дослідженнях деносумабу у пацієнтів (60 мг, n=55 та 120 мг, n=32) без пізньої стадії раку, але з різним ступенем функції нирок, включаючи пацієнтів на діалізі, ступінь ниркової недостатності не впливав на фармакокінетику деносумабу; таким чином, немає необхідності в корекції дози при нирковій недостатності. При лікуванні препаратом Іксджева® моніторинг ниркової функції не потрібен.
Печінкова недостатність. Не проводилося спеціальних досліджень за участю пацієнтів з печінковою недостатністю. Загалом моноклональні антитіла не виводяться шляхом печінкового метаболізму. Не очікується, що печінкова недостатність буде впливати на фармакокінетику деносумабу.
Пацієнти літнього віку. Між пацієнтами літнього віку та молодими пацієнтами загалом не спостерігалося відмінностей щодо безпеки або ефективності. Контрольовані клінічні дослідження препарату Іксджева® за участю пацієнтів віком від 65 років з пізніми стадіями злоякісних пухлин з ураженням кісток виявили аналогічну ефективність та безпеку як у старших, так і у молодших пацієнтів. Для пацієнтів літнього віку немає необхідності в корекції дози.
Діти. У підлітків із дозрілою кістковою системою (віком від 12 до 17 років) із гігантоклітинною пухлиною кісток, які отримували 120 мг кожні 4 тиж з навантажувальною дозою на 8-й та 15-й дні, фармакокінетика деносумабу не відрізнялася від аналогічних показників, отриманих у дорослих пацієнтів із гігантоклітинною пухлиною кісток.
Дані доклінічних досліджень із безпеки. Оскільки біологічна активність деносумабу у приматів специфічна, для оцінки фармакодинамічних властивостей деносумабу на моделях гризунів використовувались генно-модифіковані миші (технологія knockout) або інші біологічні інгібітори шляху RANK/RANKL, такі як OPG-Fc та RANK-Fc.
У моделях мишей із кістковими метастазами естроген рецепторпозитивного та негативного раку молочної залози, раку передміхурової залози та недрібноклітинного раку легені людини OPG-Fc зменшував остеолітичні, остеобластичні та остеолітичні/остеобластичні руйнування, затримував формування de novo кісткових метастазів та стримував ріст пухлин в кістках. Якщо OPG-Fc поєднувався з гормональною терапією (тамоксифен) або хіміотерапією (доцетаксел), відмічалося додаткове пригнічення росту кісткових осередків раку молочної залози, передміхурової залози або раку легень відповідно. У моделі миші з індукованою пухлиною молочної залози RANK-Fc знижував опосередковану гормоном проліферацію епітелію молочної залози та затримував формування пухлини.
Стандартні тести для визначення потенціалу генотоксичності деносумабу не виконувалися, оскільки такі тести не є релевантними для цієї молекули. Проте малоймовірно, що деносумаб має будь-який потенціал до генотоксичності.
Канцерогенний потенціал деносумабу не оцінювався в довготривалих дослідженнях на тваринах.
У дослідженнях токсичності однократної та багатократних доз на яванських макаках дози деносумабу, які призводили до системної відповіді, вищі в 2,7–15 разів, ніж рекомендована доза для людини, не мали впливу на фізіологію серцево-судинної системи, репродуктивну функцію самців або самок чи на виникнення специфічної токсичності для органів-мішеней.
У дослідженні на яванських макаках, які отримували деносумаб протягом періоду, еквівалентного I триместру вагітності, дози деносумабу, які викликали системну відповідь, вищі в 9 разів, ніж рекомендована доза для людини, не спричиняли токсичної дії у матері або плода протягом періоду, еквівалентного I триместру вагітності, хоча лімфатичні вузли плода не досліджувалися.
В іншому дослідженні на яванських макаках, які отримували деносумаб протягом вагітності з системним впливом, у 12 разів вищим, ніж доза для людини, відмічалося збільшення мертвонароджень та постнатальної смертності; патологічний ріст кісток, який призводив до зменшення міцності кісток, знижений гемопоез та неправильний прикус; відсутність периферичних лімфовузлів; сповільнення неонатального росту. Максимальна доза, яка не призводила до виникнення небажаних ефектів, що спостерігалися, не була встановлена. Через 6 міс після народження зміни, пов’язані з кістками, показали повернення до норми, не відмічалося впливу на прорізування зубів. Однак ефекти на лімфатичні вузли та прикус залишалися, а у однієї тварини спостерігалася мінімальна або середня мінералізація численних тканин (зв’язок з лікуванням не очевидний). Не було доказів шкоди для матері до пологів; небажані реакції у матері нечасто виникали під час пологів. Розвиток молочної залози матері був нормальним.
У доклінічних дослідженнях якості кісток на мавпах при тривалому лікуванні деносумабом уповільнення ремоделювання пов’язувалося з покращенням міцності кісток та нормальними гістологічними параметрами кісток.
У самців мишей, які шляхом генної модифікації мали експресію huRANKL (технологія knock-in mice) і піддавалися транскортикальному перелому, деносумаб затримував організацію хрящової тканини та ремоделювання кісткового мозоля порівняно з контролем, але біохімічна міцність не зазнавала небажаного впливу.
У доклінічних дослідженнях миші із заблокованим геном RANK або RANKL не мали лактації у зв’язку з пригніченням дозрівання молочних залоз (лобуло-альвеолярний розвиток залоз під час вагітності) та демонстрували порушення утворення лімфовузлів. Новонароджені миші із заблокованим геном RANK/RANKL демонстрували зменшення маси тіла, послаблення росту кісткової тканини, порушення зон росту та відсутність прорізування зубів. Ослаблення росту кісткової тканини, порушення зон росту та відсутність прорізування зубів також відмічалися в дослідженнях на новонароджених щурах, яким вводили інгібітори RANKL, і ці зміни були частково оборотними після відміни інгібітору RANKL. У приматів підліткового віку, які отримували деносумаб в дозі, в 2,7 та 15 разів (доза 10 та 50 мг/кг) вищій за клінічну дозу, були патологічно змінені зони росту. Таким чином, лікування деносумабом може порушувати ріст кісткової тканини у дітей з відкритими зонами росту та може пригнічувати прорізування зубів.
Показання Іксджева
запобігання КП (патологічний перелом, опромінення кісток, компресія спинного мозку або хірургічне втручання на кістках) у дорослих пацієнтів із пізньою стадією злоякісних пухлин, які вражають кістки (див. Фармакодинаміка).
Лікування дорослих та підлітків з дозрілою кістковою системою, які мають гігантоклітинну пухлину кісток, що не може бути видалена, або якщо хірургічна резекція, найімовірніше, призведе до тяжких наслідків.
Застосування Іксджева
препарат Іксджева® слід застосовувати під наглядом лікаря.
Дозування. Необхідне щоденне додавання до раціону харчування щонайменше 500 мг кальцію та 400 МО вітаміну D, за винятком випадків гіперкальціємії (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Запобігання КП у дорослих із пізньою стадією злоякісних пухлин, які вражають кістки. Рекомендована доза препарату Іксджева® становить 120 мг, яку вводять у вигляді п/ш ін’єкції 1 раз кожні 4 тиж в ділянку стегна, черевної стінки або плеча.
Гігантоклітинна пухлина кісток. Рекомендована доза препарату Іксджева® 120 мг, яку вводять у вигляді п/ш ін’єкції 1 раз кожні 4 тиж в ділянку стегна, черевної стінки або плеча, з додатковими дозами по 120 мг на 8-й та 15-й день лікування протягом першого місяця лікування.
Пацієнти в дослідженні ІІ фази, яким була проведена повна резекція гігантоклітинної пухлини кісток, отримували додаткове лікування протягом 6 міс після операції згідно з протоколом дослідження.
Необхідно регулярно оцінювати стан пацієнтів з гігантоклітинною пухлиною кісток, щоб визначити, чи продовжують вони отримувати користь від лікування. У пацієнтів із захворюванням, яке контролюється препаратом Іксджева®, ефект від переривання або тимчасового припинення лікування не оцінювався, проте обмежені дані для цих пацієнтів не свідчать про ефект рикошету після тимчасового припинення лікування.
Ниркова недостатність. У пацієнтів з нирковою недостатністю немає необхідності в корекції дози (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ для отримання рекомендацій щодо перевірки рівня кальцію, ПОБІЧНА ДІЯ, Фармакокінетика).
Печінкова недостатність. Безпека та ефективність деносумабу не досліджувалися у пацієнтів з печінковою недостатністю (див. Фармакокінетика).
Пацієнти літнього віку (≥65 років). Немає необхідності в корекції дози для пацієнтів літнього віку (див. Фармакокінетика).
Спосіб застосування. Для п/ш введення.
– Перед введенням препарату Іксджева® р-н необхідно візуально перевірити. Р-н може містити незначну кількість прозорих або білих білковоподібних часток. Не вводити р-н, якщо він помутнів або змінив колір.
– Не струшувати.
– Щоб уникнути дискомфорту в місці введення, флакон слід нагріти до кімнатної температури (до 25 °C). Вводити препарат повільно.
– Вводити весь вміст флакона.
– Для введення деносумабу рекомендується голка калібру 27.
– Не вводити голку у флакон повторно.
Будь-який невикористаний лікарський засіб або відходи необхідно утилізувати відповідно до місцевих вимог.
Діти. Безпека та ефективність застосування препарату Іксджева® дітям (віком до 18 років) не оцінювалися, за винятком підлітків з дозрілою кістковою системою (віком від 12 до 17 років), які мають гігантоклітинну пухлину кісток.
Препарат Іксджева® не рекомендується для застосування дітям (віком до 18 років), окрім підлітків з дозрілою кістковою системою (віком від 12 до 17 років), які мають гігантоклітинну пухлину кісток (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Лікування підлітків з дозрілою кістковою системою, які мають гігантоклітинну пухлину кісток, що не може бути видалена, або якщо хірургічна резекція, найімовірніше, призведе до тяжких наслідків: доза аналогічна дозі для дорослих.
Пригнічення ліганду RANK/RANK (RANKL) (ліганд рецептора — активатора нуклеарного фактора каппа В) в дослідженнях на тваринах поєднувалося з пригніченням росту кісток і відсутністю прорізування зубів; ці зміни були частково оборотними після припинення пригнічення RANKL (див. Дані доклінічних досліджень з безпеки).
Протипоказання
підвищена чутливість до діючої речовини або будь-якої допоміжної речовини, вказаних у розділі СКЛАД.
Нелікована гіпокальціємія тяжкого ступеня (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Ураження після стоматологічних або хірургічних втручань в ротовій порожнині, що не загоюються.
Побічна дія
резюме профілю безпеки
Загальний профіль безпеки є одноманітним при усіх затверджених показаннях для лікарського засобу Іксджева®.
Дуже часто повідомлялося про гіпокальціємію, що виникала після введення препарату Іксджева®, головним чином протягом перших 2 тиж. Гіпокальціємія могла бути тяжкою і симптоматичною (див. Опис окремих побічних реакцій). Як правило, зниження рівнів кальцію у сироватці крові ефективно усувалося шляхом додавання препаратів кальцію та вітаміну D. Найчастішою побічною реакцією при застосуванні препарату Іксджева® був скелетно-м’язовий біль. У пацієнтів, які отримували препарат Іксджева®, часто повідомлялося про випадки остеонекрозу щелепи (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ та Опис окремих побічних реакцій).
Зведена таблиця побічних реакцій
Класифікація частоти побічних реакцій, про які повідомлялося у чотирьох клінічних дослідженнях III фази та двох клінічних дослідженнях II фази, а також під час післяреєстраційного застосування (див. табл. 3): дуже часто (≥1/10), часто (≥1/100–<1/10), нечасто (≥1/1000–<1/100), рідко (≥1/10 000–<1/1000), дуже рідко (<1/10 000) та частота невідома (неможливо оцінити на основі наявних даних). У кожній групі за частотою виникнення та класом системи органів побічні реакції представлено в порядку зменшення тяжкості.
Таблиця 3. Побічні реакції, про які повідомлялося у пацієнтів із пізніми стадіями злоякісних пухлин, які уражають кістки, або з гігантоклітинною пухлиною кісток
| Клас системи органів за MedDRA | Категорія частоти виникнення | Побічні реакції |
|---|---|---|
| Доброякісні, злоякісні та невизначені новоутворення (у т. ч. кісти та поліпи) | Часто | Нове первинне злоякісне новоутворення1 |
| Порушення з боку імунної системи | Рідко | Підвищена чутливість до препарату1 Анафілактична реакція1 |
| Порушення з боку метаболізму та харчування | Дуже часто | Гіпокальціємія1,2 |
| Часто | Гіпофосфатемія | |
| Нечасто | Гіперкальціємія після припинення лікування у пацієнтів із гігантоклітинною пухлиною кісток3 | |
| Порушення з боку дихальної системи, органів грудної клітки та середостіння | Дуже часто | Диспное |
| Порушення з боку ШКТ | Дуже часто | Діарея |
| Часто | Видалення зубів | |
| Порушення з боку шкіри та підшкірних тканин | Часто | Гіпергідроз |
| Нечасто | Лишаєподібні висипання, викликані лікарським засобом1 | |
| Порушення з боку скелетно-м’язової та сполучної тканини | Дуже часто | Скелетно-м’язовий біль1 |
| Часто | ОНЩ1 | |
| Нечасто | Атиповий перелом стегна1 | |
| Частота невідома | Остеонекроз зовнішнього слухового проходу3, 4 | |
1 Див. Опис окремих побічних реакцій.
2 Див. Інші особливі групи пацієнтів.
3 Див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ.
4 Ефект, характерний для даного класу лікарських засобів.
Опис окремих побічних реакцій
Гіпокальціємія. Вища частота розвитку гіпокальціємії спостерігалася у клінічних дослідженнях попередження КП у пацієнтів, які отримували деносумаб, порівняно з пацієнтами, які отримували золедронову кислоту.
Найвища частота розвитку гіпокальціємії спостерігалася у ході дослідження ІІІ фази у пацієнтів із мієломною хворобою. Випадки гіпокальціємії траплялися у 16,9% хворих, які отримували препарат Іксджева®, та у 12,4% пацієнтів, які отримували золедронову кислоту. Зниження рівня сироваткового кальцію 3-го ступеня виникало у 1,4% та 0,6% пацієнтів, що застосовували препарат Іксджева® та золедронову кислоту відповідно, а 4-го ступеня — у 0,4% та 0,1% відповідно.
У трьох клінічних дослідженнях ІІІ фази з активним контролем за участю пацієнтів з пізніми стадіями злоякісних пухлин з ураженням кісток про гіпокальціємію повідомлялося у 9,6% пацієнтів, які отримували препарат Іксджева®, та у 5,0% пацієнтів, які отримували золедронову кислоту.
Зниження 3-го ступеня рівнів сироваткового кальцію виникало у 2,5% пацієнтів, які отримували препарат Іксджева®, та у 1,2% пацієнтів, які отримували золедронову кислоту. Зниження 4-го ступеня рівнів сироваткового кальцію виникало у 0,6% пацієнтів, які отримували препарат Іксджева®, та у 0,2% пацієнтів, які отримували золедронову кислоту (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
У двох клінічних дослідженнях ІІ фази з однією групою учасників про гіпокальціємію повідомлялося у 5,7% пацієнтів із гігантоклітинною пухлиною кісток. Жодна з побічних реакцій не вважалася серйозною.
У період післяреєстраційного застосування повідомлялося про тяжку симптоматичну гіпокальціємію (включаючи летальні випадки), при цьому більшість випадків виникали в перші тижні після початку лікування. Приклади клінічних проявів тяжкої симптоматичної гіпокальціємії включали пролонгацію інтервалу Q—T, тетанію, судоми та порушення психічного стану (включаючи кому) (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ). Симптоми гіпокальціємії в клінічних дослідженнях включали парестезію та ригідність м’язів, м’язові посмикування, спазми та м’язові судоми.
ОНЩ. В клінічних дослідженнях частота ОНЩ була вищою при більш тривалому впливі препарату; ОНЩ також діагностувався після припинення лікування препаратом Іксджева®, при цьому більшість випадків виникала протягом 5 міс після введення останньої дози. Пацієнти з ОНЩ або остеомієлітом щелепи в анамнезі, активними захворюваннями зубів або щелеп, які вимагають хірургічного втручання, ранами після стоматологічного/хірургічного втручання в ротовій порожнині, які не зажили, або пацієнти з будь-якими запланованими інвазивними стоматологічними втручаннями виключалися з клінічних досліджень.
Більш висока частота виникнення ОНЩ спостерігалася у ході клінічних досліджень попередження КП у пацієнтів, які отримували деносумаб, порівняно із золедроновою кислотою. Найвища частота виникнення ОНЩ була у дослідженні ІІІ фази у пацієнтів з мієломною хворобою. У подвійно сліпій фазі лікування цього дослідження ОНЩ був підтверджений у 5,9% пацієнтів, які отримували препарат Іксджева® (медіана застосування 19,4 міс; діапазон: 1–52), та у 3,2% пацієнтів, які отримували золедронову кислоту. На момент завершення подвійно сліпої фази терапії дослідження скоригована для показника пацієнт-рік частота виникнення підтверджених випадків ОНЩ у групі препарату Іксджева® (медіана застосування 19,4 міс; діапазон: 1–52) становила 2,0 на 100 пацієнто-років під час першого року лікування, 5,0 — другого року та 4,5 у наступні роки. Медіана часу до виникнення ОНЩ становила 18,7 міс (діапазон: 1–44).
У первинних фазах лікування трьох активно контрольованих клінічних досліджень III фази за участю пацієнтів з пізньою стадією злоякісних пухлин з ураженням кісток ОНЩ був підтверджений у 1,8% пацієнтів, які отримували препарат Іксджева® (середній вплив 12,0 міс; діапазон 0,1–40,5), та у 1,3% пацієнтів, які отримували золедронову кислоту. Клінічні характеристики цих випадків були аналогічними у групах лікування. У більшості пацієнтів із підтвердженим ОНЩ (81% в обох групах лікування) в анамнезі було видалення зубів, погана гігієна ротової порожнини та/або встановлення зубних протезів. Більшість пацієнтів отримували або вже пройшли хіміотерапію.
Дослідження за участю пацієнтів з раком молочної залози або передміхурової залози включали розширену фазу лікування препаратом Іксджева® (середній загальний вплив 14,9 міс; діапазон 0,1–67,2). ОНЩ був підтверджений у 6,9% пацієнтів з раком молочної залози або передміхурової залози під час розширеної фази лікування.
Скоригована для показника пацієнт-рік частота виникнення підтверджених випадків ОНЩ становила 1,1 на 100 пацієнто-років під час першого року лікування, 3,7 — під час другого року та 4,6 — у подальші роки. Медіана часу до виникнення ОНЩ становила 20,6 міс (діапазон: 4–53). Дані нерандомізованого ретроспективного обсерваційного дослідження за участю 2877 пацієнтів зі злоякісними пухлинами, які отримували лікування препаратом Іксджева® або золедроновою кислотою у Швеції, Данії та Норвегії, показали, що 5-річна частота виникнення підтвердженого ОНЩ становила 5,7% (95% ДІ: 4,4, 7,3; медіана часу спостереження: 20 міс (діапазон 0,2–60)) у когорті пацієнтів, які отримували Іксджева®, і 1,4% (95% ДІ: 0,8, 2,3; медіана часу спостереження: 13 міс (діапазон 0,1–60)) в окремій когорті застосування золедронової кислоти. П’ятирічна частота виникнення ОНЩ у пацієнтів, які перейшли на лікування Іксджева® після прийому золедронової кислоти, дорівнювала 6,6% (95% ДІ: 4,2, 10,0; медіана часу спостереження: 13 міс (діапазон 0,2–60)).
У клінічному дослідженні ІІІ фази у пацієнтів з неметастатичним раком передміхурової залози (пацієнти, для яких препарат Іксджева® не показаний для застосування) з тривалою експозицією протягом періоду до 7 років лікування скоригована для показника пацієнт-рік частота підтвердженого ОНЩ становила 1,1 на 100 пацієнто-років протягом першого року лікування, 3,0 — протягом другого року та 7,1 — у наступні роки.
У довгостроковому відкритому клінічному дослідженні II фази у пацієнтів із гігантоклітинною пухлиною кісток (дослідження 6, див. Фармакодинаміка) ОНЩ був підтверджений у 6,8% пацієнтів, зокрема в одного підлітка (медіана кількості доз: 34; діапазон: 4–116). На момент завершення дослідження медіана тривалості участі в дослідженні, зокрема у фазі подальшого спостереження, становила 60,9 міс (діапазон: 0–112,6). Скоригована для показника пацієнт-рік загальна частота підтвердженого ОНЩ становила 1,5 на 100 пацієнто-років (0,2 на 100 пацієнто-років протягом першого року лікування, 1,5 — протягом другого року, 1,8 — третього року, 2,1 — четвертого року, 1,4 — протягом п’ятого року та 2,2 — у подальші роки). Медіана часу до виникнення ОНЩ становила 41 міс (діапазон: 11–96).
Реакції підвищеної чутливості, пов’язані з прийомом препарату. В умовах післяреєстраційного застосування у пацієнтів, які отримували препарат Іксджева®, повідомлялося про явища підвищеної чутливості, включаючи рідкісні явища анафілактичних реакцій.
Атипові переломи стегна. У програмі клінічного дослідження у пацієнтів, які отримували препарат Іксджева®, нечасто повідомлялося про атипові переломи стегна, ризик виникнення яких зростав зі збільшенням тривалості лікування. Ці явища виникали під час лікування та до 9 міс після припинення лікування (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Скелетно-м’язовий біль. В умовах післяреєстраційного застосування про скелетно-м’язовий біль, включаючи тяжкі випадки, повідомлялося у пацієнтів, які отримували препарат Іксджева®. У клінічних дослідженнях про скелетно-м’язовий біль дуже часто повідомлялося в групах деносумабу та золедронової кислоти, однак до відміни препарату це призводило нечасто.
Нове первинне злоякісне новоутворення. На первинних фазах подвійного сліпого лікування з чотирьох активних контрольованих клінічних досліджень III фази за участю пацієнтів із пізньою стадією злоякісних пухлин, які вражають кістки, первинні злоякісні новоутворення спостерігалися у 54 з 3691 (1,5%) пацієнтів, що отримували препарат Іксджева® (медіана застосування 13,8 міс; діапазон: 1,0–51,7), та 33 з 3688 (0,9%) пацієнтів, які отримували золедронову кислоту (медіана застосування 12,9 міс; діапазон: 1,0–50,8).
Кумулятивна частота через один рік становила 1,1% для деносумабу та 0,6% для золедронової кислоти.
Не було виявлено жодного явища, пов’язаного з лікуванням, для окремих видів раку та раку з розподілом за групами.
Лишаєподібні висипання, викликані лікарським засобом. Лишаєподібні висипання, викликані лікарським засобом (наприклад реакції, подібні до плаского лишая), відмічались у пацієнтів у постмаркетинговий період.
Діти. Препарат Іксджева® вивчався у відкритому дослідженні за участю 28 підлітків з дозрілою кістковою системою, які мали гігантоклітинну пухлину кісток. На основі цих обмежених даних профіль побічних реакцій виявився аналогічним профілю для дорослих.
У післяреєстраційний період повідомлялося про клінічно значущу гіперкальціємію після припинення лікування у дітей (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Інші особливі групи пацієнтів
Ниркова недостатність. У клінічному дослідженні у пацієнтів без пізньої стадії раку з нирковою недостатністю тяжкого ступеня (кліренс креатиніну <30 мл/хв) або пацієнтів на діалізі спостерігався більш високий ризик розвитку гіпокальціємії за відсутності кальцієвих добавок. Ризик розвитку гіпокальціємії під час лікування препаратом Іксджева® зростає з підвищенням ступеня ниркової недостатності. У клінічному дослідженні за участю пацієнтів без пізньої стадії раку у 19% пацієнтів з нирковою недостатністю тяжкого ступеня (кліренс креатиніну <30 мл/хв) та у 63% пацієнтів, які були на гемодіалізі, виникала гіпокальціємія, незважаючи на прийом кальцієвих добавок. Загальна частота виникнення клінічно суттєвої гіпокальціємії становила 9%.
Супутнє підвищення рівнів паратиреоїдного гормону також відмічалося у пацієнтів, які отримували препарат Іксджева® і мали ниркову недостатність тяжкого ступеня або були на діалізі. Моніторинг рівнів кальцію та достатнє надходження кальцію та вітаміну D особливо необхідні для пацієнтів з нирковою недостатністю (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Повідомлення про підозрювані побічні реакції. Важливо повідомляти про підозрювані побічні реакції, виявлені після реєстрації лікарського засобу. Це дає змогу продовжувати спостерігати за співвідношенням користі та ризику застосування лікарського засобу. Необхідно повідомляти про будь-які підозрювані побічні реакції через національну систему.
Особливості застосування
додавання кальцію та вітаміну D. Додавання кальцію та вітаміну D необхідне для всіх пацієнтів, за винятком випадків гіперкальціємії (див. ЗАСТОСУВАННЯ).
Гіпокальціємія. Існуючу гіпокальціємію необхідно коригувати до початку лікування препаратом Іксджева®. Гіпокальціємія може виникнути в будь-який час протягом лікування препаратом Іксджева®. Моніторинг рівнів кальцію слід проводити перед введенням початкової дози препарату Іксджева®, протягом 2 тиж після введення початкової дози, якщо виникають симптоми з підозрою на гіпокальціємію (див. ПОБІЧНА ДІЯ для ознайомлення з симптомами). Необхідно розглянути додатковий моніторинг рівня кальцію під час лікування у пацієнтів з факторами ризику появи гіпокальціємії або в інших випадках залежно від клінічного стану пацієнта.
Пацієнти повинні повідомляти про симптоми, які вказують на гіпокальціємію. Якщо гіпокальціємія виникає під час лікування препаратом Іксджева®, може виникнути потреба у додатковому вживанні кальцієвих добавок та додатковому моніторингу рівнів кальцію.
У період післяреєстраційного застосування повідомлялося про тяжку симптоматичну гіпокальціємію (включаючи летальні випадки) (див. ПОБІЧНА ДІЯ), при цьому більшість випадків виникали протягом перших тижнів від початку лікування, але могли виникати і пізніше.
Ниркова недостатність. Пацієнти з тяжкою нирковою недостатністю (кліренс креатиніну <30 мл/хв) або пацієнти на діалізі належать до групи ризику розвитку гіпокальціємії. Ризик розвитку гіпокальціємії та супутнього підйому рівня паратиреоїдного гормону підвищується зі збільшенням ступеня ниркової недостатності. Постійний моніторинг рівнів кальцію особливо важливий для цих пацієнтів.
ОНЩ. У пацієнтів, які отримували препарат Іксджева®, часто повідомлялось про виникнення ОНЩ (див. ПОБІЧНА ДІЯ).
Початок лікування/новий курс лікування повинен бути відкладений у пацієнтів з незагоєними відкритими ураженнями м’яких тканин у ротовій порожнині. Рекомендується стоматологічний огляд з відповідним профілактичним стоматологічним лікуванням та індивідуальна оцінка співвідношення користь/ризик перед початком застосування деносумабу.
При оцінці ризику розвитку ОНЩ у пацієнта слід мати на увазі такі чинники ризику:
— ефективність лікарського засобу, що спричиняє гальмування кісткової резорбції (більш високий ризик у разі застосування сильнодіючих лікарських засобів), шлях введення (більш високий ризик у разі парентерального введення) та сумарна доза лікарських засобів, які застосовували для гальмування кісткової резорбції;
— рак, супутні захворювання (наприклад анемія, коагулопатія, інфекція), тютюнопаління;
— супутня терапія: кортикостероїди, хіміотерапія, інгібітори ангіогенезу, променева терапія голови та шиї;
— погана гігієна ротової порожнини, захворювання пародонта, зубні протези, що погано прилягають, наявність стоматологічного захворювання, інвазійне стоматологічне втручання, наприклад видалення зуба.
Всі пацієнти повинні підтримувати достатню гігієну ротової порожнини, проходити періодичні стоматологічні огляди і негайно повідомляти про будь-які симптоми з боку ротової порожнини, такі як рухливість зубів, біль або набряк, виразки, що не загоюються або прориваються, під час лікування деносумабом. Під час лікування інвазивні стоматологічні процедури потрібно проводити лише після ретельного розгляду, таких процедур слід уникати безпосередньо перед початком введення препарату Іксджева®.
План ведення окремих пацієнтів, у яких розвинулися ОНЩ, повинен бути розроблений в тісній співпраці лікуючим лікарем та стоматологом або щелепно-лицьовим хірургом, який має досвід лікування ОНЩ. Тимчасове припинення лікування препаратом Іксджева® необхідно розглядати до моменту завершення хвороби і у разі можливості зменшувати провокуючі фактори.
Остеонекроз зовнішнього слухового проходу. У разі застосування деносумабу повідомлялося про остеонекроз зовнішнього слухового проходу. Можливими чинниками ризику цього запалення є використання стероїдів і хіміотерапія, а також локальні фактори ризику, такі як інфекції та травми. Вірогідність остеонекрозу зовнішнього слухового проходу слід враховувати у пацієнтів, які отримують деносумаб та мають симптоми з боку органів слуху, у т. ч. хронічні інфекції вуха.
Атипові переломи стегна. Про атипові переломи стегна повідомлялося у пацієнтів, які отримували деносумаб (див. ПОБІЧНА ДІЯ). Атипові переломи стегна можуть виникати при незначній травмі або за її відсутності в субтрохантерній або діафізарній ділянці стегна. Специфічні результати рентгенологічного дослідження характеризують ці явища. Також про атипові переломи стегна повідомлялося у пацієнтів з певними супутніми станами (такими як дефіцит вітаміну D, ревматоїдний артрит, гіпофосфатазія) та при застосуванні певних фармацевтичних засобів (наприклад бісфосфонатів, глюкокортикоїдів, інгібіторів протонної помпи). Ці явища також виникали без антирезорбтивної терапії. Аналогічні переломи, про які повідомлялося у зв’язку з прийомом бісфосфонатів, часто є білатеральними; таким чином, необхідно обстежувати протилежне стегно у пацієнтів, які отримують деносумаб, з підтвердженим переломом тіла стегнової кістки. Потрібно розглянути відміну препарату Іксджева® для пацієнтів з підозрою на атиповий перелом стегна під час оцінки пацієнта на основі індивідуального співвідношення користь/ризик. Під час лікування деносумабом пацієнтам необхідно рекомендувати повідомляти про новий або незвичний біль в стегні, кульшовому суглобі або паховій ділянці. Пацієнтів з такими симптомами слід перевіряти на наявність неповного перелому стегна.
Гіперкальціємія після припинення застосування препарату у пацієнтів із гігантоклітинними пухлинами кісток, а також із кістковою системою, що росте. Про клінічно значущу гіперкальціємію, що потребувала госпіталізації та ускладнювалася гострим ураженням нирок, повідомляли при застосуванні препарату Іксджева® у пацієнтів із гігантоклітинними пухлинами кісток через тижні чи місяці після припинення лікування.
Після припинення лікування необхідно контролювати пацієнтів щодо виникнення ознак і симптомів гіперкальціємії із періодичним визначенням рівня кальцію у сироватці крові та повторною оцінкою необхідності додаткового застосування препаратів кальцію та вітаміну D (див. ПОБІЧНА ДІЯ).
Препарат Іксджева® не рекомендується пацієнтам із кістковою системою, що розвивається (див. ЗАСТОСУВАННЯ). Також повідомлялося про клінічно суттєву гіперкальціємію у цієї групи пацієнтів, що виникала через проміжок часу від тижнів до місяців після припинення застосування препарату.
Інші патології. Пацієнти, які отримують препарат Іксджева®, не повинні одночасно застосовувати інші лікарські засоби, які містять деносумаб (у зв’язку з остеопорозом).
Пацієнти, які отримують препарат Іксджева®, не повинні одночасно застосовувати бісфосфонати.
Злоякісність гігантоклітинної пухлини або прогресування метастазуванням виникає нечасто і є відомим ризиком у пацієнтів з гігантоклітинною пухлиною кісток. Необхідно контролювати стан пацієнтів на наявність рентгенологічних ознак злоякісності, нових ділянок просвітлення або остеолізу. Доступні клінічні дані не свідчать про підвищений ризик злоякісності у пацієнтів з гігантоклітинною пухлиною кісток, які отримують препарат Іксджева®.
Застереження щодо допоміжних речовин. Цей лікарський засіб містить сорбіт. Пацієнти з рідкісними спадковими проблемами, пов’язаними з непереносимістю фруктози, не повинні застосовувати цей лікарський засіб.
Цей лікарський засіб містить менше 1 ммоль натрію (23 мг) на 120 мг, тобто практично вільний від натрію.
Застосування у період вагітності та годування грудьми
Вагітність. Відсутні достатні дані щодо застосування деносумабу у вагітних. У дослідженнях на тваринах було продемонстровано репродуктивну токсичність (див. Дані доклінічних досліджень з безпеки).
Препарат Іксджева® не рекомендується для застосовування вагітним та жінкам репродуктивного віку, які не користуються методами контрацепції. Жінкам слід рекомендувати уникати вагітності в процесі лікування препаратом Іксджева® і щонайменше протягом 5 міс після цього. Будь-які ефекти препарату Іксджева® найімовірніше будуть сильнішими під час II та III триместру вагітності, оскільки моноклональні антитіла вільніше проходять через плаценту в лінійному порядку з розвитком вагітності, при цьому найбільша кількість проходить під час III триместру.
Грудне вигодовування. Невідомо, чи виводиться деносумаб з грудним молоком людини. Не може бути виключений ризик для новонароджених/немовлят. Дослідження на мишах з нокаутним геном показали, що відсутність RANKL під час вагітності може впливати на дозрівання молочних залоз, призводячи до порушеної лактації після пологів (див. Дані доклінічних досліджень з безпеки). Необхідно прийняти рішення про відмову від грудного вигодовування або відмову від терапії препаратом Іксджева®, враховуючи користь грудного вигодовування для новонародженого/немовляти та користь лікування препаратом Іксджева® для жінки.
Репродуктивна функція. Дані щодо впливу деносумабу на репродуктивну функцію у людини відсутні. Дослідження на тваринах не показали прямих або непрямих шкідливих впливів на репродуктивну функцію (див. Дані доклінічних досліджень з безпеки).
Здатність впливати на швидкість реакції при керуванні транспортними засобами або роботі з іншими механізмами. Препарат Іксджева® не має впливу або має незначний вплив на швидкість реакції при керуванні транспортними засобами або роботі з іншими механізмами.
Взаємодія з іншими лікарськими засобами
дослідження взаємодії не проводилися. У клінічних дослідженнях препарат Іксджева® застосовувався в комбінації зі стандартною протипухлинною терапією та у випадках попереднього лікування бісфосфонатами. Не було клінічно значущих змін мінімальної сироваткової концентрації та фармакодинаміки деносумабу (N-телопептид сечі з поправкою на креатинін, uNTx/Cr) при одночасному застосуванні хіміотерапії та/або гормональної терапії або при попередньому в/в введенні бісфосфонату.
Несумісність. Оскільки дослідження щодо сумісності з іншими засобами не проводилися, цей лікарський засіб не можна застосовувати разом з іншими лікарськими засобами.
Передозування
досвід передозування в клінічних дослідженнях відсутній. Препарат Іксджева® вводився в клінічних дослідженнях в дозах до 180 мг кожні 4 тиж та 120 мг — кожні 3 тиж.
Умови зберігання
зберігати в холодильнику при температурі 2–8 °С в оригінальній упаковці для захисту від світла. Не заморожувати. Не струшувати. Зберігати в недоступному для дітей місці. Після вилучення з холодильника лікарський засіб Іксджева® можна зберігати при кімнатній температурі (до 25 °С) в оригінальній упаковці не більше 30 днів та слід використати протягом цих 30 днів.
