Лібератті® таблетки, вкриті плівковою оболонкою 0,02 мг + 3 мг блістер №28
Лібератті інструкція із застосування
Склад
Етинілестрадіол - 0,02 мг
Дроспіренон - 3 мг
Фармакологічні властивості
Фармокодинаміка.
Індекс Перля контрацептивних невдач: 0,41 (верхній двосторонній 95% довірчий інтервал: 0,85). Загальний індекс Перля (контрацептивні невдачі + помилки з боку пацієнток): 0,80 (верхній двосторонній 95% довірчий інтервал: 1,30).
Протизаплідна дія лікарського засобу Лібератті® базується на взаємодії різних чинників, найважливішими серед яких є пригнічення овуляції і зміна цервікальної секреції.
У ході три-циклового клінічного дослідження пригнічення овуляції порівняння комбінації дроспіренон 3 мг/етинілестрадіол 0,02 мг при 24-денному та 21-денному режимі, 24-денний режим асоціювався з більшою супресією розвитку фолікулів. Після навмисних помилок у дозуванні протягом третього циклу терапії у переважної більшості жінок із 21-деним режимом спостерігалася активність яєчників, включаючи овуляцію порівняно із жінками з 24-деним режимом. Активність яєчників поверталася до рівнів, що були до початку терапії протягом циклу після терапії у 91,8% жінок із 24-денним режимом.
Лікарський засіб Лібератті — це комбінований пероральний контрацептив з етинілестрадіолом та прогестогеном дроспіреноном. У терапевтичних дозах дроспіренон проявляє антиандрогенні та помірні антимінералокортикоїдні властивості. Він не має естрогенної, глюкокортикоїдної та антиглюкокортикоїдної активності. Отже, дроспіренон має схожий фармакологічний профіль з природним прогестероном.
Згідно даних клінічних досліджень помірні антимінералокортикоїдні властивості препарату призводять до помірного антимінералокортикоїдного впливу.
Було проведено два багатоцентрових, подвійних сліпих, рандомізованих, плацебо-контрольованих дослідження для оцінки ефективності та безпеки застосування препарату жінкам з acne vulgaris середнього ступеня. Після 6 місяців терапії, порівняно з плацебо, препарат продемонстрував статистично значущий ефект зниження на 15,6% (49,3% порівняно з 33,7%) кількості запальних елементів, 18,5% (40,6% порівняно з 22,1%) кількості незапальних елементів, та 16,5% (44,6% порівняно з 28,1%) загальної кількості висипань. Також більший відсоток суб’єктів, 11,8% (18,6% порівняно з 6,8%), був із «чистою» та «майже чистою» шкірою, які оцінювалися за шкалою ISGA (Investigator’s Stated Global Assessment).
Фармакокінетика.
Дроспіренон
Всмоктування. Перорально прийнятий дроспіренон швидко і повністю всмоктується. Максимальна концентрація у сироватці крові, що становить 38 нг/мл, досягається приблизно через 1-2 год після одноразового перорального застосування. Біодоступність становить 76-85%. Одночасне вживання їжі не впливає на біодоступність дроспіренону.
Розподіл. Після перорального застосування концентрація дроспіренону в сироватці крові знижується із середнім кінцевим Т½ близько 31-ї год. Дроспіренон зв’язується із сироватковим альбуміном, при цьому не з’єднуючись із ГЗСС, та кортикоїдозв’язуючим глобуліном. Тільки 3-5% його загальної кількості в сироватці крові присутні у вільному стані. Спричинене етинілестрадіолом підвищення ГЗСС не впливає на зв’язування дроспіренону з протеїнами сироватки крові. Середній об’єм розподілу дроспіренону становить 3,7±1,2 л/кг.
Метаболізм. Дроспіренон значною мірою метаболізується після перорального застосування. Головними метаболітами у плазмі є кислотні форми дроспіренону, що утворюються при відкритті лактонового кільця, та 4,5-дигідро-дроспіренон-3-сульфат, які утворюються шляхом гідратації з подальшим сульфатуванням. Дроспіренон також є об’єктом окиснювального метаболізму, що каталізується CYP3A4. In vitro дроспіренон може слабко або помірно пригнічувати ферменти цитохрому P450: CYP1A1, CYP2C9, CYP2C19 та CYP3A4.
Виведення з організму. Швидкість метаболічного кліренсу дроспіренону із сироватки крові становить приблизно 1,5±0,2 мл/хв/кг. Дроспіренон виділяється у незміненій формі тільки у дуже незначній кількості. Метаболіти виділяються із сечею та калом у співвідношенні від 1,2 до 1,4. Т½ метаболітів із сечею та калом становить приблизно 40 год.
Стан рівноваги. Упродовж циклу застосування максимальна рівноважна концентрація дроспіренону в сироватці крові, що становить приблизно 70 нг/мл, досягається після 8 днів застосування. Рівні дроспіренону у крові кумулювали в 3 рази як наслідок співвідношення термінального періоду напіввиведення та інтервалу дозування.
Окремі групи пацієнток
Жінки із порушенням функції нирок. Рівноважна концентрація дроспіренону в сироватці крові у жінок з нирковою недостатністю легкого ступеня тяжкості (кліренс креатиніну 50-80 мл/хв) була порівнянною із цим показником для жінок із нормальною функцією нирок (кліренс креатиніну більше 80 мл/хв). Рівень дроспіренону в сироватці крові був у середньому на 37% вищим у жінок із нирковою недостатністю середнього ступеня тяжкості (кліренс креатиніну 30–50 мл/хв) порівняної з цим показником для жінок із нормальною функцією нирок. Застосування дроспіренону продемонструвало добру переносимість у всіх групах пацієнток. Показано, що приймання дроспіренону не має клінічно значущого ефекту на концентрацію калію в сироватці крові.
Жінки з порушенням функції печінки.
У дослідженні застосування разової дози кліренс дроспіренону при пероральному застосуванні знижувався приблизно на 50% в осіб із помірною печінковою недостатністю порівняно з добровольцями з нормальною функцією печінки. Виявлене відхилення кліренсу дроспіренону в осіб із помірною печінковою недостатністю не зумовлювало будь-яких явних відмінностей відносно концентрації калію у сироватці крові. Навіть при наявності цукрового діабету та супутньої терапії спіронолактоном (два фактори, що можуть провокувати гіперкаліємію) не спостерігалося підвищення концентрації калію в сироватці крові вище верхньої межі норми. Можна зробити висновок, що дроспіренон добре переноситься особами із печінковою недостатністю легкого та помірного ступеня (клас В за класифікацією Чайлда-П’ю).
Етнічні групи. Не спостерігалося клінічно значущої різниці у фармакокінетиці дроспіренону або етинілестрадіолу у жінок японської національності та європейців.
Етинілестрадіол
Всмоктування. При пероральному застосуванні етинілестрадіол швидко і повністю всмоктується. Cmax, що дорівнює 33 пкг/мл, досягається протягом 1-2 год після одноразового перорального застосування. Абсолютна біодоступність внаслідок пресистемної кон’югації і метаболізму при першому проходженні через печінку становить приблизно 60%. Одночасне вживання їжі зменшує біодоступність етинілестрадіолу приблизно у 25% досліджуваних, при незмінній у решти.
Розподіл. Рівні етинілестрадіолу у сироватці зменшуються двофазно, термінальна фаза характеризується Т½, що приблизно дорівнює 24 год. Етинілестрадіол міцно, проте неспецифічно, зв’язується з альбумінами сироватки (приблизно 98,5%) та індукує збільшення концентрації ГЗСС та КЗГ у сироватці крові. Уявний об’єм розподілу становить приблизно 5 л/кг.
Метаболізм. Етинілестрадіол значною мірою метаболізується у ШКТ та при першому проходженні через печінку. Етинілестрадіол метаболізується, головним чином, шляхом гідроксилювання ароматичного кільця з утворенням широкого спектра гідроксильованих та метильованих метаболітів, які присутні у вільному стані та як кон’югати з глюкуронідами та сульфатами. Метаболічний кліренс етинілестрадіолу становить приблизно 5 мл/хв/кг.
In vitro етинілестрадіол є зворотнім інгібітором CYP2C19, CYP1A1 та CYP1A2, а також на основі механізму дії – інгібітором CYP3A4/5, CYP2C8 та CYP2J2.
Виведення з організму. Етинілестрадіол практично не виводиться у незміненій формі. Метаболіти етинілестрадіолу виводяться із сечею та жовчю у співвідношенні 4:6. Т½ метаболітів становить майже 1 добу.
Стан рівноваги. Стан рівноваги досягається у другій половині циклу застосування, коли концентрація етинілестрадіолу в сироватці крові збільшується в 2,0-2,3 раза.
Доклінічні дані з безпеки.
У лабораторних тварин ефекти дроспіренону та етинілестрадіолу були обмежені такими, що асоціювалися з відомою фармакологічною дією. Зокрема, дослідження з виявлення репродуктивної токсичності у тварин показали наявність видоспецифічних ембріотоксичного та фетотоксичного впливів. При експозиції, що перевищує таку у користувачів препарату, у деяких видів тварин спостерігали вплив на статеву диференціацію.
Показання Лібератті
Пероральна контрацепція.
Застосування Лібератті
Таблетки слід приймати щоденно згідно з порядком, зазначеним на блістері, приблизно в один і той самий час, запиваючи невеликою кількістю рідини. Препарат приймають по 1 таблетці на добу протягом 28 днів поспіль. Приймання таблеток з кожної наступної упаковки слід розпочинати на наступний день після закінчення попередньої упаковки.
До комплекту упаковки входить тримач для блістеру, в який можна покласти блістер, коли його необхідно взяти з собою та календарна шкала.
Блістер містить 24 таблетки з діючими речовинами (рожеві таблетки) та 4 таблетки плацебо (білі таблетки), що не містять діючих речовин.
• Початок застосування препарату Лібератті:
якщо гормональні контрацептиви у попередній період (минулий місяць) не застосовувались, приймання таблеток слід розпочинати у перший день природного циклу (тобто в перший день менструальної кровотечі). Можна почати приймання також з 2–5-го дня, проте в цьому випадку необхідно використовувати додатковий метод контрацепції (наприклад бар’єрний) протягом перших 7 днів приймання препарату.
• Перехід з іншого комбінованого перорального контрацептиву (КПК), вагінального кільця або трансдермального пластиру: бажано розпочати приймання таблеток Лібератті наступного дня після приймання останньої гормоновмісної таблетки попереднього КПК, але не пізніше наступного дня після перерви у прийманні таблеток або після приймання таблеток плацебо попереднього КПК. У разі застосування контрацептивного вагінального кільця або трансдермального пластиру слід розпочати приймати Лібератті у день видалення засобу, але не пізніше дня, коли необхідне наступне застосування цих препаратів.
• Перехід з методу, що базується на застосуванні лише прогестогену («міні-пілі», ін’єкції, імплантати або внутрішньоматкової системи з прогестогеном):
можна розпочати приймання Лібератті у будь-який день після припинення приймання «міні-пілі» (у випадку імпланту або внутрішньоматкової системи – в день їх видалення, у випадку ін’єкції — замість наступної ін’єкції). Однак у всіх випадках рекомендується додатково використовувати бар’єрний метод контрацепції протягом перших 7 днів приймання препарату.
• Після аборту в першому триместрі вагітності:
можна починати прийом Лібератті одразу ж. У такому випадку немає необхідності застосовувати додаткові засоби контрацепції.
• Після пологів або аборту в другому триместрі:
у випадку годування груддю див. розділ Застосування у період вагітності або годування груддю. Рекомендується розпочинати приймання Лібератті з 21-28-го дня після пологів або аборту в другому триместрі вагітності. При пізнішому початку приймання таблеток рекомендується додатково використовувати бар’єрний метод контрацепції протягом перших 7 днів приймання таблеток. Проте, якщо статевий акт уже відбувся, то перед початком застосування препарату слід виключити можливу вагітність або дочекатися настання першої менструації.
Що робити у разі пропуску приймання таблетки
Пропуском у прийманні таблеток плацебо можна знехтувати. Проте їх слід вилучити з упаковки, щоб уникнути ненавмисного подовження фази застосування плацебо. Нижчезазначені вказівки стосуються тільки пропуску прийому рожевих таблеток, що містять діючі речовини.
Якщо запізнення в прийманні рожевої таблетки не перевищує 24 год, протизаплідна дія препарату не знижується. Пропущену таблетку треба прийняти одразу, як тільки це з’ясувалося. Наступну таблетку з цієї упаковки слід приймати у звичний час.
Якщо запізнення з прийманням рожевої таблетки перевищує 24 год, контрацептивний захист може знизитися. У такому разі слід керуватися двома основними правилами:
1. Перерва у прийманні таблеток ніколи не повинна перевищувати 4 дні.
2. Адекватне пригнічення системи гіпоталамус–гіпофіз–яєчники досягається безперервним прийманням таблеток протягом 7 днів.
Відповідно до цього у повсякденному житті потрібно керуватися нижчезазначеними рекомендаціями:
• День 1-7
Слід прийняти останню пропущену таблетку якомога швидше, навіть якщо доведеться прийняти дві таблетки одночасно. Після цього продовжують приймати таблетки у звичний час. Крім того, протягом наступних 7 днів слід використовувати бар’єрний метод контрацепції, наприклад презерватив. У разі, якщо у попередні 7 днів відбувся статевий акт, слід враховувати можливість настання вагітності. Чим більше прийомів таблеток пропущено і чим ближчий період застосування таблеток плацебо, тим більший ризик вагітності.
• День 8-14
Слід прийняти останню пропущену таблетку якомога швидше, навіть якщо доведеться прийняти дві таблетки одночасно. Після цього продовжують приймати таблетки у звичний час. За умови, що жінка правильно приймала таблетки протягом 7 днів перед пропуском, немає необхідності використовувати додаткові протизаплідні засоби. Якщо це не так або пропущено більше ніж однієї таблетки, рекомендується додатково використовувати бар’єрний метод контрацепції протягом 7 днів.
• День 15-24
Ризик настання вагітності при наближенні періоду застосування таблеток плацебо зростає. Однак, при дотриманні схеми приймання таблеток, можна уникнути зниження контрацептивного захисту. Якщо дотримуватися однієї з нижченаведених рекомендацій, то не виникне необхідності використовувати додаткові контрацептивні засоби за умови правильного приймання таблеток протягом 7 днів до пропуску. Якщо це не так, рекомендується дотримуватися першої з нижченаведених рекомендацій і використовувати додаткові контрацептивні засоби протягом наступних 7 днів.
1. Слід прийняти останню пропущену таблетку якомога швидше, навіть якщо доведеться прийняти дві таблетки одночасно. Після цього продовжують приймати таблетки у звичний час до закінчення застосування таблеток рожевого кольору з діючими речовинами. 4 таблетки плацебо приймати не потрібно. Таблетки з наступної упаковки слід почати приймати одразу ж після застосування останньої рожевої таблетки. Малоймовірно, що менструальноподібна кровотеча почнеться до закінчення приймання всіх рожевих таблеток з другої упаковки, хоча під час приймання таблеток можуть спостерігатися кровомазання або проривна кровотеча.
2. Можна також припинити приймання таблеток з поточної упаковки. В такому разі перерва у прийманні препарату повинна становити 4 дні, включаючи дні пропуску таблеток; приймання таблеток слід почати з наступної упаковки.
Якщо після пропуску в прийманні таблеток відсутня очікувана менструація протягом першої нормальної перерви в прийманні препарату, то ймовірна вагітність. Проконсультуйтеся з лікарем, перш ніж почнете застосування таблеток з нової упаковки.
Рекомендації на випадок розладів з боку ШКТ
У випадку тяжких розладів з боку шлунково-кишкового тракту можливе неповне всмоктування препарату. У такому разі слід застосовувати додаткові засоби контрацепції. Якщо блювання почалось упродовж 3 – 4 годин після приймання таблетки Лібератті®, слід дотримуватись рекомендацій як у випадку пропуску таблеток.
Як змінити час настання менструації або затримати менструацію
Щоб затримати менструацію, слід продовжувати приймати таблетки з діючими речовинами (рожеві) препарату Лібератті із нової упаковки і не робити перерви у прийманні гормональних таблеток препарату. Якщо є бажання термін приймання можна продовжити аж до закінчення рожевих таблеток із другої упаковки. При цьому можуть спостерігатися проривна кровотеча або кровомазання. Зазвичай приймання препарату Лібератті відновлюють після приймання таблеток плацебо, що не містять гормони.
Щоб змістити час настання менструації на інший день тижня, рекомендується скоротити перерву в прийманні таблеток плацебо без гормонів на стільки днів, на скільки бажано. Слід зазначити, що чим коротша буде перерва, тим частіше спостерігається відсутність менструальноподібної кровотечі та проривної кровотечі або кровомазання протягом приймання таблеток з другої упаковки (як і у випадку затримки настання менструації).
Діти. Цей лікарський засіб показаний для застосування за призначенням лікаря тільки після настання сталих менструацій.
Протипоказання
Комбіновані гормональні контрацептиви (КГК) не слід застосовувати при наявності хоча б одного із нижчезазначених станів. У разі якщо будь-який із цих станів виникає вперше під час застосування КГК, прийом лікарського засобу слід негайно припинити.
• Наявність або ризик розвитку венозної тромбоемболії (ВТЕ).
— венозна тромбоемболія на даний час, зокрема внаслідок терапії антикоагулянтами, або в анамнезі (наприклад тромбоз глибоких вен (ТГВ) або тромбоемболія легеневої артерії (ТЕЛА));
— відома спадкова або набута схильність до венозної тромбоемболії, така як резистентність до активованого протеїну С (у тому числі мутація фактора V Лейдена), дефіцит антитромбіну-III, дефіцит протеїну С, дефіцит протеїну S;
— великі оперативні втручання із тривалою іммобілізацією (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ);
— високий ризик венозної тромбоемболії через наявність множинних факторів ризику (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
• Наявність або ризик розвитку артеріальної тромбоемболії (АТЕ).
— наявність артеріальної тромбоемболії на даний час або в анамнезі (наприклад інфаркт міокарда) або наявність продромальних симптомів (наприклад стенокардія);
— порушення мозкового кровообігу на даний час або в анамнезі, наявність продромальних симптомів (наприклад транзиторна ішемічна атака (TIA));
— відома спадкова або набута схильність до артеріальної тромбоемболії, така як гіпергомоцистеїнемія та антитіла до фосфоліпідів (антитіла до кардіоліпінів, вовчаковий антикоагулянт);
— мігрень з вогнищевими неврологічними симптомами в анамнезі;
— високий ризик артеріальної тромбоемболії через наявність множинних факторів ризику (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ) або через наявність одного серйозного фактору ризику, такого як:
– цукровий діабет із судинними ускладненнями;
– тяжка АГ;
– тяжка дисліпопротеїнемія.
• Наявність тяжкого захворювання печінки на даний час або в анамнезі, поки показники функції печінки не повернулися у межі норми.
• Ниркова недостатність тяжкого ступеня або гостра ниркова недостатність.
• Наявність пухлин печінки на даний час або в анамнезі (доброякісних або злоякісних).
• Відомі або підозрювані злоякісні пухлини (наприклад, статевих органів або молочних залоз), що є залежними від статевих гормонів.
• Вагінальна кровотеча нез’ясованої етіології.
• Підвищена чутливість до діючих речовин або до будь-якого із компонентів лікарського засобу.
Лікарський засіб Лібератті протипоказаний при одночасному застосуванні з лікарськими засобами, що містять омбітасвір/паритапревір/ритонавір та даcабувір (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ та ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ).
Побічна дія
Щодо серйозних побічних реакцій у пацієнток, які застосовують КОК, див. також розділ «Особливості застосування».
У «Таблиці 3.» наведено побічні реакції згідно класів та систем органів MedDRA. Частота приведена на основі клінічних даних. Найбільш прийнятні терміни MedDRA використані для опису певних реакцій та їх синонімів і пов’язаних станів.
Таблиця 3.
Частота побічних реакцій, про які повідомлялося у ході клінічних досліджень препарату як перорального контрацептива та для лікування неважкої форми акне згідно термінів, класів систем органів MedDRA.
| Класи та системи органів (MedDRA версія 9.1) | Часто (≥1/100 до <1/10) | Нечасто (≥1/1000 до <1/100) | Поодинокі (≥1/10000 до <1/1000) | Частота невідома |
| Інфекції та інвазії | Кандидоз | |||
| З боку системи кровотворення та лімфатичної системи | Анемія, тромбоцитемія | |||
| З боку імунної системи | Алергічні реакції | Гіперчутливість | ||
| З боку ендокринної системи | Ендокринні розлади | |||
| З боку обміну речовин та харчування | Підвищення апетиту, анорексія, гіперкаліємія, гіпонатріємія | |||
| Психічні розлади | Емоційна лабільність | Депресія, нервозність, сонливість | Аноргазмія, безсоння | |
| Нервова система | Головний біль | Запаморочення, парестезія | Вертиго, тремор | |
| З боку органів зору | Кон’юнктивіт, сухість очей, порушення зору | |||
| З боку серця | Тахікардія | |||
| З боку судин | Мігрень, варикозне розширення вен, артеріальна гіпертензія | Флебіт, судинні розлади, носова кровотеча, непритомність, венозна тромбоемболія (ВТЕ), артеріальна тромбоемболія (АТЕ) | ||
| З боку ШКТ | Нудота | Абдомінальний біль, блювання, диспепсія, метеоризм, гастрит, діарея | Збільшення живота, шлунково-кишкові розлади, відчуття наповнення ШКТ, хіатальна грижа, кандидоз ротової порожнини, запор, сухість у роті | |
| З боку гепатобіліарної системи | Біль у жовчному міхурі, холецистит | |||
| З боку шкіри та підшкірної клітковини | Акне, свербіж, висип | Хлоазма, екзема, алопеція, акнеформний дерматит, сухість шкіри, нодозна еритема, гіпертрихоз, розлади з боку шкіри, розтяжки, контактний дерматит, фото чутливий дерматит, нодулярна шкіра | Мультиформна еритема | |
| З боку м’язової та сполучної тканини | Біль у спині, біль у кінцівках, судоми м’язів | |||
| З боку репродуктивної системи та молочних залоз | Болючість молочних залоз, метрорагія*, аменорея | Вагінальний кандидоз, тазовий біль, збільшення молочних залоз, фіброзно-кістозна мастопатія, маткові/ вагінальні кровотечі*, виділення зі статевих органів, припливи, вагініт, порушення менструального циклу, дисменорея, гіпоменорея, менорагія, вагінальна сухість, сумнівний мазок Папаніколау, зниження лібідо | Диспареунія, вульвовагініт, посткоїтальна кровотеча, кровотеча відміни, киста молочної залози, гіперплазія молочної залози, новоутворення у молочній залозі, поліп шийки матки, атрофія ендометрію, киста яєчника, збільшення матки | |
| Загальні розлади | Астенія, підвищене потовиділення, набряк (генералізований набряк, периферичний набряк, набряк обличчя) | Нездужання | ||
| Дослідження | Збільшення маси тіла | Зменшення маси тіла | ||
*нерегулярні кровотечі зазвичай зникають при продовженні терапії
Опис окремих побічних реакцій
У жінок, які приймали КГК, спостерігався підвищений ризик розвитку венозних або артеріальних тромботичних та тромбоемболічних явищ, у тому числі інфаркту міокарда, інсульту, транзиторних ішемічних атак, венозного тромбозу та ТЕЛА, які детальніше описані у розділі ОСОБЛИВОСТІ ЗАСТОСУВАННЯ.
Нижчезазначені серйозні побічні реакції спостерігалися у жінок, які застосовують КОК, що також були описані у розділі «Особливості застосування»:
• венозні тромбоемболічні розлади;
• артеріальні тромбоемболічні розлади;
• АГ;
• пухлини печінки;
• розвиток або загострення захворювань, для яких зв’язок із прийомом КОК не з’ясований остаточно: хвороба Крона, неспецифічний виразковий коліт, епілепсія, міома матки, порфірія, системний червоний вовчак, герпес вагітних, хорея Сіденхама, гемолітико-уремічний синдром, холестатична жовтяниця;
• хлоазма;
• гострі або хронічні розлади функції печінки, що можуть потребувати припинення застосування КОК, доки показники функції печінки не повернуться до норми;
• у жінок зі спадковою схильністю до ангіоневротичного набряку екзогенні естрогени можуть спричинити або посилювати симптоми ангіоневротичного набряку.
Частота діагностування раку молочної залози дещо підвищується серед жінок, які застосовують КОК. Оскільки рак молочної залози у жінок віком до 40 років зустрічається рідко, збільшення кількості випадків діагностування раку молочної залози у жінок, які застосовують нині або нещодавно застосовували КОК, є незначним щодо рівня загального ризику раку молочної залози. Взаємозв’язок із застосуванням КОК невідомий. Див. також ПРОТИПОКАЗАННЯ та ОСОБЛИВОСТІ ЗАСТОСУВАННЯ.
Взаємодії
Проривні кровотечі та/або зниження контрацептивної дії може виникнути внаслідок взаємодії інших лікарських засобів (індукторів ферментів) з оральними контрацептивами (див. ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ).
Особливості застосування
Рішення про призначення лікарського засобу Лібератті слід приймати з урахуванням індивідуальних факторів ризику жінки, що існують на даний момент, у тому числі факторів ризику розвитку венозної тромбоемболії (ВТЕ), а також ризику ВТЕ, пов’язаного з прийомом препарату Лібератті, порівняно з іншими комбінованими гормональними контрацептивами (КГК) (див. розділи ПРОТИПОКАЗАННЯ та ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Попередження
При наявності будь-яких станів або факторів ризику, зазначених нижче, слід обговорити з жінкою доцільність застосування лікарського засобу Лібератті®.
У разі загострення або при перших проявах будь-яких із вказаних станів або факторів ризику жінкам рекомендується звернутися до лікаря та визначити необхідність припинення прийому лікарського засобу Лібератті.
У разі підозрюваної або підтвердженої ВТЕ або АТЕ слід припинити застосування КГК. Якщо розпочата антикоагулянтна терапія, слід забезпечити альтернативну адекватну контрацепцію через тератогенний вплив антикоагулянтів (кумарини).
• Циркуляторні розлади
Ризик розвитку венозної тромбоемболії (ВТЕ)
Застосування будь-яких КГК підвищує ризик розвитку венозної тромбоемболії (ВТЕ) у жінок, які їх застосовують, порівняно з тими, які їх не отримують. Лікарські засоби, що містять левоноргестрел, норгестимат або норетистерон, асоціюються з нижчим ризиком ВТЕ. Застосування інших лікарських засобів, таких як Лібератті, може призводити до підвищення ризику удвічі. Рішення про застосування лікарських засобів, окрім тих, що мають найнижчий ризик розвитку ВТЕ, слід приймати лише після обговорення з жінкою. Необхідно переконатися, що вона усвідомлює ризик розвитку ВТЕ, асоційований із застосуванням лікарського засобу Лібератті, ступінь впливу наявних у неї факторів ризику та той факт, що ризик ВТЕ є найвищим протягом першого року застосування. За деякими даними ризик ВТЕ може зростати при відновленні застосування КГК після перерви у 4 тижні або довше.
У двох з 10 000 жінок, які не приймають КГК та не є вагітними, розвивається ВТЕ протягом року. Однак у кожної окремої жінки ризик може бути значно вищим залежно від наявних у неї факторів ризику (див. нижче).
Встановлено1, що з 10 000 жінок, які застосовують КГК, що містять дроспіренон, у 9–12 жінок розвинеться ВТЕ протягом одного року. Це порівнюється з показником 62 у жінок, які застосовують КГК, що містять левоноргестрел.
В обох випадках кількість випадків ВТЕ за рік була меншою, ніж зазвичай очікується протягом вагітності або у післяпологовому періоді.
ВТЕ може призводити до летальних наслідків у 1-2% випадків.
Кількість випадків ВТЕ на 10 000 жінок за 1 рік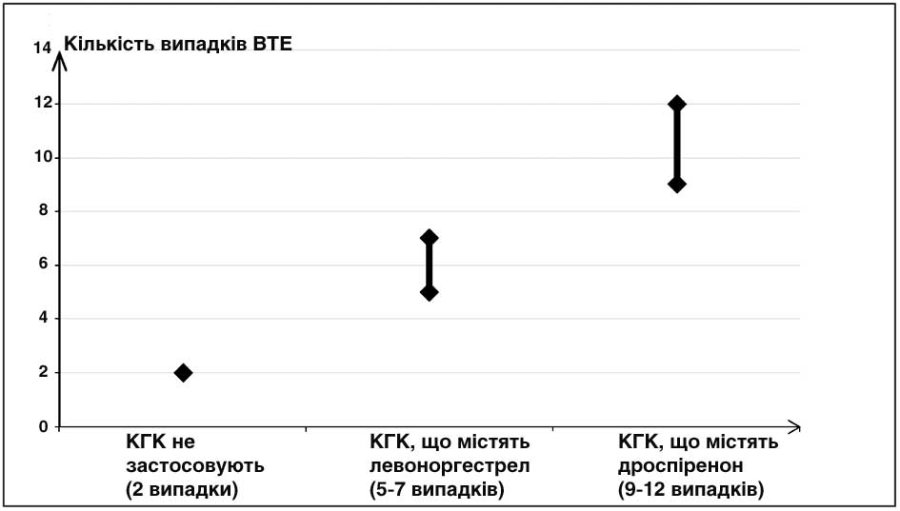
1Ці показники отримано на основі всіх даних епідеміологічних досліджень з урахуванням відносних ризиків, пов’язаних із прийомом різних КГК, порівняно із застосуванням КГК, що містять левоноргестрел.
2У середньому 5-7 випадків на 10 000 жінко-років на основі розрахунку відносного ризику застосування КГК, що містять левоноргестрел, порівняно з таким у жінок, які не отримують КГК (близько 2,3–3,6 випадку).
Фактори ризику розвитку ВТЕ
Ризик розвитку венозних тромбоемболічних ускладнень у жінок, які застосовують КГК, може бути значно вищим при наявності додаткових факторів ризику, особливо множинних (див. таблицю 1).
Застосування лікарського засобу Лібератті протипоказане жінкам з множинними факторами ризику, що може підвищити ризик розвитку венозного тромбозу (див. ПРОТИПОКАЗАННЯ). Якщо жінка має більше одного фактора ризику, зростання ризику може бути більшим, ніж сума ризиків, асоційованих із кожним окремим фактором, тому слід брати до уваги загальний ризик розвитку ВТЕ. Якщо співвідношення користь/ризик є несприятливим, не слід призначати КГК (див. ПРОТИПОКАЗАННЯ).
Таблиця 1.
Фактори ризику розвитку ВТЕ
| Фактор ризику | Примітка |
| Ожиріння (індекс маси тіла перевищує 30 кг/м2) | Ризик значно підвищується при збільшенні індексу маси тіла. Особливо потребує уваги при наявності інших факторів ризику. |
| Тривала іммобілізація, велике оперативне втручання, операція на нижніх кінцівках або органах таза, нейрохірургічні втручання або обширна травма. Примітка: тимчасова іммобілізація, у тому числі перельоти >4 год, також можуть бути фактором ризику розвитку ВТЕ, особливо у жінок з іншими факторами ризику. | У таких ситуаціях рекомендується припинити застосування лікарського засобу (у разі планового оперативного втручання щонайменше за 4 тижні) та не відновлювати застосування раніше ніж через 2 тижні після повного відновлення рухової активності. З метою уникнення небажаної вагітності слід застосовувати інші методи контрацепції. Слід розглянути доцільність антитромботичної терапії, якщо застосування лікарського засобу Лібератті не було припинено попередньо. |
| Сімейний анамнез (венозна тромбоемболія у когось із родичів або батьків, особливо у відносно молодому віці, наприклад до 50 років). | У разі наявності спадкової схильності перед застосуванням будь-яких КГК жінкам рекомендується порадитися зі спеціалістом. |
| Інші стани, пов’язані з ВТЕ | Рак, системний червоний вовчак, гемолітико–уремічний синдром, хронічне запальне захворювання кишечнику (хвороба Крона або виразковий коліт) та серпоподібноклітинна анемія. |
| Вік | Особливо у віці понад 35 років |
Немає єдиної думки щодо можливого впливу варикозного розширення вен та поверхневого тромбофлебіту на розвиток та прогресування венозного тромбозу.
Необхідно звернути увагу на підвищений ризик розвитку тромбоемболії у період вагітності, особливо протягом 6 тижнів після пологів (інформацію щодо періоду вагітності або годування груддю див. у розділі Застосування у період вагітності або годування груддю).
Симптоми ВТЕ (тромбоз глибоких вен та тромбоемболія легеневої артерії)
Жінкам слід порадити у разі появи нижчевказаних симптомів негайно звернутися до лікаря та повідомити про те, що вони застосовують КГК.
Симптомами ТГВ можуть бути: однобічний набряк ноги та/або ступні або ділянки уздовж вени на нозі; біль або підвищена чутливість у нозі, що може відчуватися тільки при стоянні або ходьбі, відчуття жару в ураженій нозі; почервоніння або зміна кольору шкіри на нозі.
Симптомами ТЕЛА можуть бути: раптова задишка нез’ясованої етіології або прискорене дихання; раптовий кашель, можливо з кров’ю; раптовий біль у грудній клітці; переднепритомний стан або запаморочення; швидке або нерегулярне серцебиття.
Деякі з цих симптомів (наприклад задишка, кашель) є неспецифічними або можуть бути неправильно інтерпретовані як більш поширені або менш тяжкі явища (наприклад як інфекції дихальних шляхів).
Інші прояви васкулярної оклюзії можуть включати раптовий біль, набряк, гострий живіт та незначне посиніння кінцівки.
При оклюзії судин ока початковою симптоматикою може бути нечіткість зору, що не супроводжується больовими відчуттями і яка може прогресувати до втрати зору. Інколи втрата зору розвивається майже миттєво.
Ризик розвитку артеріальної тромбоемболії (АТЕ)
За даними епідеміологічних досліджень застосування будь-яких КГК асоціюється із підвищеним ризиком артеріальної тромбоемболії (інфаркт міокарда) або цереброваскулярних подій (транзиторна ішемічна атака, інсульт). Артеріальні тромбоемболічні явища можуть мати летальний наслідок.
Фактори ризику розвитку АТЕ
При застосуванні КГК ризик розвитку артеріальних тромбоемболічних ускладнень або цереброваскулярних подій зростає у жінок із факторами ризику (див. таблицю 2). Застосування лікарського засобу Лібератті протипоказане, якщо жінки мають один серйозний або множинні фактори ризику розвитку АТЕ, які можуть підвищити ризик розвитку артеріального тромбозу (див. ПРОТИПОКАЗАННЯ). Якщо жінка має більше одного фактора ризику, зростання ризику може бути більшим, ніж сума ризиків, асоційованих із кожним окремим фактором, тому слід брати до уваги загальний ризик. Якщо співвідношення користь/ризик є несприятливим, не слід призначати КГК (див. ПРОТИПОКАЗАННЯ).
Таблиця 2.
Фактори ризику розвитку АТЕ
| Фактор ризику | Примітка |
| Збільшення віку | Особливо у віці понад 35 років |
| Паління | Жінкам, які користуються КГК, рекомендується утримуватися від паління. Жінкам віком від 35 років, які продовжують палити, настійно рекомендується застосовувати інший метод контрацепції. |
| Артеріальна гіпертензія | |
| Ожиріння (індекс маси тіла перевищує 30 кг/м2) | Ризик значно підвищується при збільшенні індексу маси тіла. Особливо потребує уваги при наявності у жінок інших факторів ризику. |
| Сімейний анамнез (артеріальна тромбоемболія у когось із родичів або батьків, особливо у відносно молодому віці, наприклад до 50 років) | У разі наявності спадкової схильності перед застосуванням будь-яких КГК жінкам рекомендується порадитися зі спеціалістом. |
| Мігрень | Зростання частоти виникнення або тяжкості перебігу мігрені під час застосування КГК (можливі продромальні стани перед розвитком цереброваскулярних подій) можуть стати причиною негайного припинення прийому КГК. |
| Інші стани, пов’язані із небажаними реакціями з боку судин | Цукровий діабет, гіпергомоцистеїнемія, вади клапанів серця, фібриляція передсердь, дисліпопротеїнемія та системний червоний вовчак. |
Симптоми АТЕ
Жінкам слід порадити у разі появи нижчезазаначених симптомів негайно звернутися до лікаря та повідомити про те, що вони застосовують КГК.
Симптомами цереброваскулярного розладу можуть бути: раптове оніміння обличчя, слабкість або оніміння кінцівок, особливо одностороннє; раптове порушення ходьби, запаморочення, втрата рівноваги або координації; раптова сплутаність свідомості, порушення мовлення або розуміння; раптове погіршення зору на одне або обидва ока; раптовий, сильний або тривалий головний біль без визначеної причини; втрата свідомості або зомління з судомами або без них.
Транзиторний характер симптомів може свідчити про транзиторну ішемічну атаку (ТІА).
Симптомами інфаркту міокарда можуть бути: біль, дискомфорт, відчуття стиснення або тяжкості у грудній клітці, руці або нижче груднини; дискомфортне відчуття, що віддає у спину, щелепу, горло, руку, шлунок; відчуття переповнення шлунка, порушення травлення або ядуха; посилене потовиділення, нудота, блювання або запаморочення; надзвичайна слабкість, тривожний стан або задишка; швидке або нерегулярне серцебиття.
Пухлини
Результати деяких епідеміологічних досліджень вказують на додаткове підвищення ризику розвитку раку шийки матки при довготривалому застосуванні КОК (>5 років), проте це твердження залишається суперечливим, оскільки остаточно не з’ясовано, наскільки результати досліджень враховують супутні фактори ризику, наприклад статеву поведінку, та інші фактори, наприклад папіломавірусну інфекцію людини.
Метааналіз на підставі 54 епідеміологічних досліджень вказує на незначне підвищення відносного ризику (ВР = 1,24) розвитку раку молочної залози у жінок, які застосовують КОК. Цей підвищений ризик поступово зникає протягом 10 років після закінчення застосування КОК. Оскільки рак молочної залози у жінок віком до 40 років зустрічається рідко, збільшення кількості випадків діагностики раку молочної залози у жінок, що застосовують нині або нещодавно застосовували КОК, є незначним щодо рівня загального ризику раку молочної залози. Результати цих досліджень не надають доказів існування причинного взаємозв’язку. Підвищення ризику може бути зумовлене як більш ранньою діагностикою раку молочної залози у жінок, які застосовують КОК, так і біологічною дією КОК або поєднанням обох факторів. Відзначено тенденцію, що рак молочної залози, виявлений у жінок, які будь-коли приймали КОК, клінічно менш виражений, ніж у тих, хто ніколи не вживав КОК.
У поодиноких випадках у жінок, які застосовують КОК, спостерігалися доброякісні, а ще рідше — злоякісні пухлини печінки, що в окремих випадках призводили до небезпечної для життя внутрішньочеревної кровотечі. У разі виникнення скарг на сильний біль в епігастральній ділянці, збільшення печінки або ознаки внутрішньочеревної кровотечі при диференційній діагностиці слід враховувати можливість наявності пухлини печінки при застосуванні КОК.
Застосування КОК у високих дозах (50 мкг етинілестрадіолу) знижує ризик раку ендометрію та яєчників. Залишається підтвердити, чи ці дані можуть стосуватися і низькодозових КОК.
Інші стани
Прогестиновий компонент лікарського засобу Лібератті є антагоністом альдостерону із калійзберігаючими властивостями. У більшості випадків застосування не очікується підвищення рівнів калію. У ході клінічних досліджень у деяких пацієнтів із легкою та помірною нирковою недостатністю та одночасним застосуванням калійзберігаючих лікарських засобів рівні калію в сироватці крові дещо, але не суттєво, підвищувалися під час застосування дроспіренону. Тому рекомендується контроль рівня калію під час першого циклу лікування пацієнткам із нирковою недостатністю. Вказаним пацієнткам також рекомендовано перед початком застосування лікарського засобу утримувати рівень калію сироватки крові не вище верхньої межі норми, особливо при одночасному застосуванні калійзберігаючих лікарських засобів (див. ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ).
Жінки з гіпертригліцеридемією або сімейним анамнезом щодо цього порушення становлять групу ризику розвитку панкреатиту при застосуванні КОК.
Хоча повідомлялося про незначне підвищення АТ у багатьох жінок, які приймають КОК, клінічно значуще підвищення АТ спостерігається у поодиноких випадках. Негайне припинення прийому КОК необхідне лише у цих поодиноких випадках. У разі тривалої артеріальної гіпертензії або неможливості контролювати показники АТ за допомогою антигіпертензивних засобів, жінкам які приймають КОК, слід припинити їх застосування. Якщо це доцільно, застосування КОК можна відновити після досягнення нормотонії за допомогою антигіпертензивної терапії.
Повідомлялося про виникнення або загострення зазначених нижче захворювань у період вагітності та при застосуванні КОК, але їх взаємозв’язок із застосуванням естрогенів/прогестинів не є остаточно з’ясованим: жовтяниця та/або свербіж, пов’язаний з холестазом, утворення жовчних каменів, порфірія, системний червоний вовчак, гемолітико-уремічний синдром, хорея Сіденхама, герпес вагітних, втрата слуху, пов’язана з отосклерозом.
У жінок зі спадковим ангіоневротичним набряком екзогенні естрогени можуть індукувати або посилювати симптоми ангіоневротичного набряку.
Гострі або хронічні розлади функції печінки можуть потребувати припинення застосування КОК, поки показники функції печінки не повернуться у межі норми та причинний зв’язок із КОК буде виключений.
При рецидиві холестатичної жовтяниці та/або свербежу, пов’язаного з холестазом, що раніше виникали у період вагітності або попереднього приймання статевих гормонів, застосування КОК слід припинити.
Хоча КОК можуть впливати на периферичну інсулінорезистентність та толерантність до глюкози, немає даних щодо потреби змінювати терапевтичний режим жінкам з діабетом, які приймають низькодозовані КОК (<0,05 мг етинілестрадіолу). Проте жінок, які страждають на цукровий діабет, слід ретельно обстежувати протягом застосування КОК, особливо на початку лікування.
Випадки загострення ендогенної депресії, епілепсії, хвороби Крона та виразкового коліту також спостерігалися під час застосування КОК.
Пригнічений настрій та депресія є добре відомими побічними явищами, які можуть виникнути на тлі застосування гормональних контрацептивів (див. ПОБІЧНА ДІЯ). Депресія може бути серйозним станом та є добре відомим фактором ризику суїцидальної поведінки та самогубства. Жінкам слід порадити звернутися до лікаря при змінах настрою та появі симптомів депресії, в тому числі незабаром після початку прийому.
Іноді може виникати хлоазма, особливо у жінок з хлоазмою вагітних в анамнезі. Жінкам, схильним до виникнення хлоазми, слід уникати дії прямих сонячних променів або ультрафіолетового опромінювання під час застосування КОК.
Кожна таблетка рожевого кольору містить 44 мг лактози, кожна таблетка білого кольору містить 89,5 мг лактози. Це слід враховувати при наявності рідкісних спадкових станів непереносимості галактози, дефіциту лактази Лаппа або мальабсорбції глюкози-галактози, у разі перебування на безлактозній дієті.
Підвищення рівня АлАТ
У ході клінічних досліджень за участю пацієнтів, які отримували терапію для лікування вірусного гепатиту С лікарськими засобами, що містять омбітасвір/паритапревір/ритонавір та дасабувір з додаванням рибавірину або без такого, підвищення рівня трансаміназ (АлАТ) у понад 5 разів вище верхньої межі норми (ВМН) спостерігалося значно частіше у жінок, які застосовували лікарські засоби, що містять етинілестрадіол, такі як комбіновані гормональні контрацептиви (КГК) (див. ПРОТИПОКАЗАННЯ і ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ).
Консультації/медичне обстеження
Перед початком або відновленням прийому лікарського засобу Лібератті рекомендується зібрати повний медичний анамнез (включаючи сімейний анамнез), пройти повне медичне обстеження та виключити вагітність. Необхідно виміряти АТ та провести медичне обстеження, беручи до уваги протипоказання (див. ПРОТИПОКАЗАННЯ) та особливості застосування (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ). Слід звернути увагу жінки на інформацію щодо венозного та артеріального тромбозу, у тому числі на ризик, пов’язаний із застосуванням лікарського засобу Лібератті, порівняно з таким при застосуванні інших КГК, щодо симптомів ВТЕ та АТЕ, відомих факторів ризику та дій, які необхідно здійснити при підозрі на тромбоз.
Пацієнткам рекомендується уважно прочитати інструкцію для медичного застосування лікарського засобу та дотримуватися рекомендацій, які містяться в ній.
Частота і характер оглядів повинні ґрунтуватися на існуючих нормах медичної практики з урахуванням індивідуальних особливостей кожної жінки.
Пацієнток потрібно попередити, що гормональні контрацептиви не захищають від зараження ВІЛ-інфекцією (СНІДом) та будь-яким іншим захворюванням, що передається статевим шляхом.
Зниження ефективності
Ефективність КОК може знижуватись у разі пропуску прийому таблетки (див. розділ «Спосіб застосування та дози»), розладів шлунково-кишкового тракту (див. ЗАСТОСУВАННЯ) або при одночасному застосуванні інших лікарських засобів (див. ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ). Порушення циклу
При прийомі КОК можуть спостерігатися нерегулярні кровотечі (кровомазання або проривні кровотечі), особливо протягом перших кількох місяців. Якщо після трьох менструальних циклів такі кровотечі продовжуються, їх слід вважати серйозними.
Якщо нерегулярні кров’янисті виділення зберігаються або з’являються після періоду регулярних кровотеч, потрібно розглянути негормональні причини кровотеч та відповідні діагностичні заходи, включаючи обстеження з метою виключення наявності пухлин та вагітності. До діагностичних заходів можна включити кюретаж.
У деяких жінок може не настати кровотеча відміни під час перерви в прийомі препарату. У разі прийому КОК відповідно до вказівок розділу «Спосіб застосування та дози» вагітність малоймовірна. Проте якщо прийом КОК відбувався нерегулярно до відсутності першої кровотечі відміни або якщо кровотечі відміни відсутні протягом двох циклів, перед продовженням застосування КОК необхідно виключити вагітність.
Застосування у період вагітності і годування груддю.
Вагітність. Цей лікарський засіб протипоказаний до застосування у період вагітності.
У разі виникнення вагітності під час застосування Лібератті, його прийом необхідно припинити негайно. Проте результати епідеміологічних досліджень не вказують на підвищення ризику появи вроджених вад у дітей, матері яких приймали КОК до вагітності, так само, як і на існування тератогенної дії при ненавмисному прийомі КОК протягом вагітності.
Дослідження на тваринах показали наявність небажаних ефектів протягом вагітності та лактації (див. ФАРМАКОЛОГІЧНІ ВЛАСТИВОСТІ). На основі цих досліджень на тваринах не можна виключати небажані ефекти внаслідок гормональної дії діючих речовин. Однак загальний досвід застосування КОК у період вагітності не свідчить про існуючий небажаний вплив у людини.
Наявні дані щодо прийому препарату у період вагітності занадто обмежені для того, щоб зробити висновки стосовно негативного впливу препарату Лібератті на перебіг вагітності, здоров’я плода та новонародженого. На даний час немає жодних відповідних епідеміологічних даних.
При відновленні застосування Лібератті слід враховувати підвищення ризику розвитку ВТЕ у післяпологовому періоді (див. ЗАСТОСУВАННЯ, ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Годування груддю. КОК можуть впливати на годування груддю, оскільки під їх впливом може зменшуватися кількість грудного молока, а також змінюватись його склад. Зважаючи на це, КОК не рекомендується приймати у період годування груддю. Невеликі кількості контрацептивних стероїдів та/або їх метаболіти можуть проникати у грудне молоко під час застосування КОК. Ці кількості можуть вплинути на дитину.
Фертильність. Лібератті показаний для запобігання вагітності. Інформацію щодо відновлення фертильності див. у розділі ФАРМАКОЛОГІЧНІ ВЛАСТИВОСТІ.
Здатність впливати на швидкість реакції при керуванні транспортними засобами або іншими механізмами. Жодних досліджень щодо впливу лікарського засобу Лібератті® на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами не проводилося. Не відзначалося впливу на здатність керувати автомобілем або працювати з механізмами у жінок, які застосовують КОК.
Взаємодія з іншими лікарськими засобами
Слід ознайомитися з інформацією щодо лікарського засобу, що застосовується одночасно, для виявлення потенційних взаємодій.
• Вплив інших лікарських засобів на лікарський засіб Лібератті
Взаємодії можливі з лікарськими засобами, що індукують мікросомальні ферменти. Це призведе до збільшення кліренсу статевих гормонів, що у свою чергу спричиняє зміни характеру менструальної кровотечі та/або втрати ефективності контрацептива.
Терапія
Індукція ферментів може бути виявлена через декілька днів лікування. Максимальна індукція ферментів загалом спостерігається через декілька тижнів. Після відміни лікування індукція ферментів може тривати близько 4 тижнів.
Короткострокове лікування
Жінки, які приймають лікарські засоби, що індукують ферменти, мають тимчасово використовувати бар’єрний метод або інший метод контрацепції додатково до КОК. Бар’єрний метод слід застосовувати протягом усього терміну лікування відповідним препаратом і ще протягом 28 днів після припинення його застосування. Якщо терапія розпочинається у період застосування останніх таблеток КОК з упаковки, то прийом таблеток з наступної упаковки КОК слід розпочати одразу після попередньої без звичного інтервалу без застосування таблеток.
Довгострокове лікування
Жінкам при довгостроковій терапії діючими речовинами, що індукують ферменти печінки, рекомендується бар’єрний або інший відповідний негормональний метод контрацепції.
Нижчезазначені взаємодії були зафіксовані згідно з опублікованими даними.
Діючі речовини, що збільшують кліренс КОК (зниження ефективності КОК через індукцію ферментів), наприклад: барбітурати, бозентан, карбамазепін, фенітоїн, примідон, рифампіцин; препарати, що застосовуються при ВІЛ-інфекції: ритонавір, невірапін та ефавіренц; також, можливо, фелбамат, гризеофульвін, окскарбазепін, топірамат і рослинні лікарські засоби, що містять екстракт звіробою (Hypericum perforatum).
Діючі речовини із непостійним впливом на кліренс КОК
При одночасному застосуванні з КОК велика кількість комбінацій інгібіторів ВІЛ-протеази та ненуклеозидних інгібіторів зворотної транскриптази, включаючи комбінації з інгібіторами вірусу гепатиту С (ВГС), можуть підвищувати або знижувати концентрації естрогену або прогестинів у плазмі крові. Сукупний вплив таких змін може бути клінічно значущим у деяких випадках.
Тому для виявлення потенційних взаємодій та будь-яких інших рекомендацій слід ознайомитися з інформацією щодо медичного застосування лікарського засобу для лікування ВІЛ/ВГС, що приймається одночасно. У разі наявності будь-яких сумнівів жінкам додатково слід використовувати бар’єрний метод контрацепції при терапії інгібіторами протеази або інгібіторами ненуклеозидної зворотної транскриптази.
Діючі речовини, що знижують кліренс КОК (інгібітори ферментів)
Клінічна значущість потенційної взаємодії з інгібіторами ферментів залишається нез’ясованою.
Одночасне застосування сильних інгібіторів CYP3A4 може підвищити плазмові концентрації естрогену або прогестину, або обох компонентів.
У дослідженні багаторазових доз комбінації дроспіренон (3 мг/добу)/етинілестрадіол (0,002 мг/добу) та сильного інгібітора CYP3A4 кетоконазолу, що застосовувався одночасно, протягом 10 днів збільшувалося значення AUC(0-24h) дроспіренону та етинілестрадіолу у 2,7 та 1,4 раза відповідно.
Еторикоксиб у дозах від 60 до 120 мг/добу продемонстрував підвищення плазмових концентрацій етинілестрадіолу у 1,4-1,6 раза відповідно при одночасному застосуванні із комбінованим гормональним контрацептивом, що містить 0,035 мг етинілестрадіолу.
• Вплив лікарського засобу Лібератті на інші лікарські засоби
КОК можуть впливати на метаболізм деяких діючих речовин. Відповідно, концентрації у плазмі крові та у тканинах можуть або підвищуватися (наприклад, циклоспорин), або знижуватися (наприклад, ламотриджин).
На підставі досліджень взаємодії in vivo у жінок–добровольців, які застосовували омепразол, симвастатин та мідазолам як субстрати-маркери, встановлено, що клінічно значуща взаємодія дроспіренону в дозі 3 мг з іншими активними субстанціями, що індукуються цитохромом Р450, є малоймовірною.
Клінічні дані свідчать про те, що етинілестрадіол пригнічує кліренс субстратів CYP1A2, що, у свою чергу, викликає слабке (наприклад, теофілін) або помірне (наприклад, тизанідин) підвищення їх плазмових концентрацій.
Фармакодинамічні взаємодії
Одночасне застосування з лікарськими засобами, що містять омбітасвір/ парітапревір/ритонавір та дасабувір з додаванням рибавірину або без такого, збільшує ризик підвищення рівня АлАТ (див. розділи ПРОТИПОКАЗАННЯ та ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Тому, жінкам, які застосовують лікарський засіб Лібератті, необхідно тимчасово перейти на альтернативний метод контрацепції (наприклад контрацептиви, що містять тільки прогестаген, або негормональні методи) перед початком терапії із застосуванням зазначеної комбінації лікарських засобів. Застосування лікарського засобу Лібератті можна відновити через 2 тижні після завершення терапії зазначеною комбінацією.
У пацієнтів з нормальною функцією нирок одночасне застосування дроспіренону та інгібіторів АПФ або НПЗП не показало значущого впливу на рівні калію сироватки крові. Однак одночасне застосування лікарського засобу Лібератті та антагоністів альдостерону або калійзберігаючих діуретиків не досліджувалося. У цьому випадку рівень калію у сироватці крові потрібно досліджувати протягом першого циклу лікування (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Інші форми взаємодії
Лабораторні аналізи
Застосування контрацептивних стероїдів може впливати на результати деяких лабораторних аналізів, таких як біохімічні параметри функції печінки, щитовидної залози, надниркових залоз і нирок, на концентрацію у плазмі транспортних білків, таких як глобулін, що зв’язує кортикостероїди, на концентрацію у плазмі крові фракцій ліпідів/ліпопротеїнів, на показники вуглеводного обміну, коагуляції та фібринолізу. Зазвичай такі зміни перебувають у межах норми. Дроспіренон збільшує активність реніну та альдостерону у плазмі крові, що індукується його помірною антимінералокортикоїдною активністю.
Передозування
Дотепер немає жодних даних клінічних досліджень щодо передозування таблеток лікарського засобу Лібератті. Як свідчить загальний досвід застосування КОК, при передозуванні може спостерігатися нудота, блювання та кровотеча відміни. Кровотеча відміни може спостерігатися у дівчат навіть до настання менархе у випадку ненавмисного/випадкового застосування лікарського засобу. Спеціального антидоту не існує, лікування повинно бути симптоматичним.
Умови зберігання
в оригінальній упаковці при температурі не вище 30 °С.
