Лантус® Солостар® (Lantus Solostar)
Лантус Солостар інструкція із застосування
Склад
Допоміжні речовини: цинку хлорид, м-крезол, гліцерин (85%), кислота хлористоводнева концентрована, натрію гідроксид, вода для ін’єкцій.
Інсулін гларгін - 3,6378 мг/1мл
Фармакологічні властивості
фармакодинаміка. Інсулін гларгін розроблений як аналог інсуліну людини, що має низьку розчинність у нейтральному середовищі. У препараті Лантус СолоСтар він є повністю розчинним завдяки кислому середовищу р-ну для ін’єкцій (рН 4). Після введення у п/ш тканини кислий р-н нейтралізується, що зумовлює виникнення мікропреципітатів, з яких постійно вивільняється невелика кількість інсуліну гларгіну, що забезпечує плавний (без піків) та передбачуваний профіль кривої залежності «концентрація–час», а також більш тривалу дію препарату.
Інсулін гларгін метаболізується до 2 активних метаболітів — M1 та M2 (див. Фармакокінетика).
Зв’язування з інсуліновим рецептором.
Результати досліджень in vitro свідчать про те, що афінність інсуліну гларгіну та його метаболітів M1 і M2 до інсулінового рецептора людини подібна до афінності людського інсуліну.
Зв’язування з рецептором інсуліноподібного фактора росту-1 (ІФР-1).
Афінність інсуліну гларгіну до рецептора ІФР-1 приблизно у 5–8 разів вища за афінність людського інсуліну (але приблизно у 70–80 разів нижча, ніж афінність ІФР-1 до цього рецептора), у той час як метаболіти M1 і M2 зв’язуються з рецептором ІФР-1 з афінністю, дещо нижчою за афінність людського інсуліну.
Загальна терапевтична концентрація інсуліну (інсуліну гларгіну та його метаболітів), що визначалася у пацієнтів з цукровим діабетом 1-го типу, була значно нижчою за ту, яка була б необхідною для напівмаксимального зв’язування з рецептором ІФР-1 та для подальшої активації мітогенно-проліферативного механізму, який запускається рецептором ІФР-1. Ендогенний ІФР-1 у фізіологічних концентраціях може активувати мітогенно-проліферативний механізм; проте терапевтичні концентрації інсуліну, які використовуються при інсулінотерапії, в тому числі при терапії інсуліном Лантус СолоСтар, значно нижчі за фармакологічні концентрації, необхідні для активації ІФР-1-опосередкованого механізму.
Найважливішою дією інсуліну, у тому числі інсуліну гларгіну, є регуляція метаболізму глюкози. Інсулін та його аналоги знижують рівень глюкози в крові за рахунок стимуляції її споживання периферичними тканинами, зокрема скелетними м’язами та жировою тканиною, а також внаслідок пригнічення утворення глюкози у печінці. Інсулін пригнічує ліполіз в адипоцитах та протеоліз, одночасно посилюючи синтез білка.
Клініко-фармакологічні дослідження довели еквівалентність однакових доз інсуліну гларгіну та інсуліну людини після в/в введення цих препаратів. Як і при застосуванні будь-яких інсулінів, на характер дії інсуліну гларгіну у часі можуть впливати фізична активність та інші чинники.
Дослідження із застосуванням методу фіксації глікемічного стану, які проводилися за участю здорових добровольців і хворих на цукровий діабет 1-го типу, продемонстрували, що, на відміну від нейтрального протаміну Хагедорна (НПХ) інсуліну людини, початок дії інсуліну гларгіну після п/ш введення настає пізніше, препарат діє плавно, не викликаючи появи піків концентрації глюкози у крові, а тривалість його дії пролонгована.
Результати одного з досліджень серед пацієнтів наведені на графіку нижче.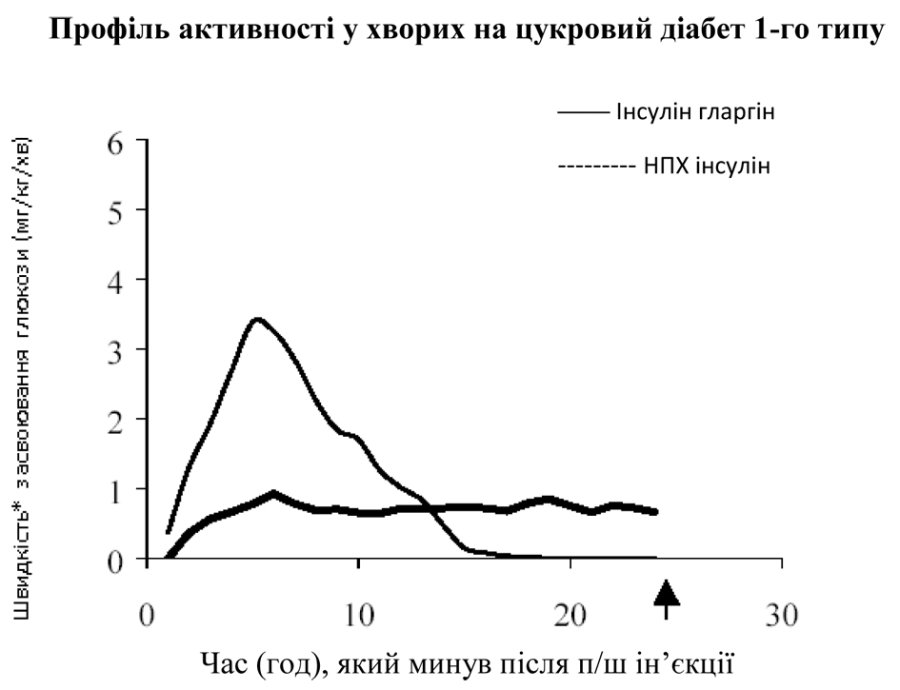
↑Кінець періоду спостереження
*Визначена як кількість глюкози, введеної для підтримки постійного рівня глюкози у плазмі крові (щогодинні середні показники).
Більша тривалість дії п/ш введеного інсуліну гларгіну безпосередньо пов’язана із повільнішою абсорбцією, що дозволяє застосовувати препарат один раз на добу. Характер дії у часі інсуліну та його аналогів, таких як інсулін гларгін, може мати значну міжіндивідуальну та інтраіндивідуальну варіабельність.
У клінічному випробуванні після в/в введення інсуліну гларгіну та інсуліну людини симптоми гіпоглікемії або контррегуляції гормональної відповіді були аналогічними у здорових добровольців та хворих на цукровий діабет 1-го типу.
Вплив інсуліну гларгіну (який вводили 1 раз на добу) на перебіг діабетичної ретинопатії оцінювався під час відкритого 5-річного випробування, препаратом порівняння у якому був НПХ інсулін (вводили 2 рази на добу) та яке проводилося за участю 1024 хворих на цукровий діабет 2-го типу, у яких відмічено прогресування ретинопатії на 3 та більше пунктів за шкалою, що застосовувалася у дослідженні «Раннє лікування діабетичної ретинопатії» (Early Treatment Diabetic Retinopathy Study — ETDRS). Прогресування оцінювалося за допомогою фотографування очного дна. Статистично значущої різниці між прогресуванням діабетичної ретинопатії при введенні інсуліну Лантус та НПХ інсуліну не виявлено.
Дослідження ORIGIN (Outcome Reduction with Initial Glargine INtervention, «Зниження ризику несприятливих клінічних наслідків при первинному призначенні гларгіну») було багатоцентровим рандомізованим дослідженням з факторіальним дизайном 2 x 2, що проводилося за участю 12 537 пацієнтів з високим серцево-судинним ризиком, у яких виявлені порушена глікемія натще (ПГН) або порушена толерантність до глюкози (ПТГ) (12% учасників) чи цукровий діабет 2-го типу, з приводу якого вони отримували ≤1 перорального протидіабетичного препарату (88% учасників). Учасники дослідження були рандомізовані (1:1) для отримання або інсуліну гларгіну (n=6264), доза якого титрувалася до досягнення рівня глюкози в плазмі крові натще ≤95 мг/дл (5,3 ммоль/л), або стандартної терапії (n=6273).
Першим показником у складі комбінованої первинної кінцевої точки був час до першого настання смерті з серцево-судинних причин, нелетального інфаркту міокарда або нелетального інсульту, а другим показником у складі комбінованої первинної кінцевої точки був час до першого настання будь-якої з цих подій комбінованої первинної кінцевої точки або проведення процедури реваскуляризації (коронарних, сонних або периферичних судин), або госпіталізації з приводу серцевої недостатності.
До вторинних кінцевих точок належали смертність з усіх причин і комбінована кінцева точка мікроваскулярних подій.
Інсулін гларгін не змінював відносний ризик серцево-судинних захворювань і смерті з серцево-судинних причин порівняно зі стандартною терапією. Не відмічено різниці між інсуліном гларгіном і стандартною терапією за обома показниками у складі комбінованої первинної кінцевої точки; за жодною складовою кінцевої точки, що включає ці несприятливі клінічні наслідки; за смертністю з усіх причин; або за комбінованою кінцевою точкою мікроваскулярних подій.
Середня доза інсуліну гларгіну наприкінці дослідження становила 0,42 ОД/кг. На початку дослідження середній показник HbA1c в учасників становив 6,4%, а на фоні досліджуваного лікування показники HbA1c варіювали від 5,9 до 6,4% в групі застосування інсуліну гларгіну і від 6,2 до 6,6% в групі застосування стандартної терапії протягом усього періоду спостереження.
Частота виникнення тяжкої гіпоглікемії (представлена у вигляді кількості учасників дослідження, у яких відмічали такі епізоди, на 100 пацієнто-років лікування) становила 1,05 в групі застосування інсуліну гларгіну і 0,30 в групі застосування стандартної терапії, а частота підтверджених епізодів нетяжкої гіпоглікемії становила 7,71 в групі застосування інсуліну гларгіну і 2,44 в групі застосування стандартної терапії. Протягом цього 6-річного дослідження у 42% пацієнтів в групі застосування інсуліну гларгіну взагалі не виявлено епізодів гіпоглікемії.
Під час останнього візиту, виконаного на фоні досліджуваного лікування, відмічали збільшення маси тіла від вихідного рівня в групі застосування інсуліну гларгіну в середньому на 1,4 кг і її зменшення в середньому на 0,8 кг в групі застосування стандартної терапії.
Діти та підлітки. Під час рандомізованого контрольованого клінічного дослідження діти (віком 6–15 років), хворі на цукровий діабет 1-го типу (n=349), упродовж 28 тиж отримували інсулінотерапію у базально-болюсному режимі, при якому перед кожним прийомом їжі вводився звичайний людський інсулін. Інсулін гларгін вводили 1 раз на ніч, а НПХ інсулін вводився 1 або 2 рази на добу. У обох групах вплив на рівень глікозильованого гемоглобіну та на частоту виникнення гіпоглікемії, що супроводжувалася клінічними проявами, був аналогічним, проте зниження рівня глюкози у плазмі крові натще порівняно з початковим показником було більшим у групі, яка отримувала інсулін гларгін, порівняно із групою, що отримувала НПХ. Також у групі, що отримувала інсулін гларгін, тяжкість гіпоглікемії була меншою. 143 пацієнти із тих, які отримували інсулін гларгін під час цього дослідження, продовжили лікування інсуліном гларгіном у межах неконтрольованого продовження цього дослідження, середня тривалість подальшого спостереження у якому становила 2 роки. При продовженні лікування інсуліном гларгіном жодних нових сигналів, які б свідчили про небезпеку, не отримано.
Також було проведено перехресне порівняльне дослідження інсуліну гларгіну плюс інсулін ліспро та НПХ інсуліну плюс звичайний людський інсулін (кожен вид лікування застосовувався впродовж 16 тиж випадковим чином) за участю 26 підлітків, хворих на діабет 2-го типу, віком 12–18 років. Як і у описаному вище дослідженні серед дітей, зниження рівня глюкози у крові натще порівняно з початковим рівнем було вищим у групі, що отримувала інсулін гларгін, порівняно із групою, у якій вводився НПХ інсулін/звичайний людський інсулін. Зміни рівня HbA1c гемоглобіну порівняно з початковим рівнем були аналогічними в обох групах, проте нічні глікемічні показники були достовірно вищими у групі, що отримувала інсулін гларгін/інсулін ліспро, ніж у групі НПХ інсулін/звичайний інсулін, при цьому середні найнижчі показники становили 5,4 мМ та 4,1 мМ. Відповідно, і частота виникнення нічної гіпоглікемії становила 32% у групі, що отримувала інсулін гларгін/інсулін ліспро, та 52% у групі НПХ інсулін/звичайний інсулін.
Проведено 24-тижневе дослідження у паралельних групах, в якому взяли участь 125 дітей з цукровим діабетом 1-го типу віком 2–6 років, в якому інсулін гларгін, що призначався 1 раз на добу вранці, порівнювався із НПХ-інсуліном, що призначався 1 або 2 рази на добу як базальний інсулін. Учасники обох груп дослідження отримували болюсні ін’єкції інсуліну перед прийомом їжі.
Головна мета дослідження — продемонструвати, що НПХ інсулін принаймні не має переваг перед інсуліном гларгіном стосовно сукупного ризику гіпоглікемій, — не досягнута, і на фоні застосування інсуліну гларгіну виявлена тенденція до підвищення частоти гіпоглікемічних подій (співвідношення частоти в групах застосування інсуліну гларгіну: НПХ (95% ДІ 1,18 (0,97–1,44)).
Зміна показників рівнів глікозильованого гемоглобіну та глюкози в крові в обох досліджуваних групах була подібною. Жодних нових даних щодо безпеки досліджуваних препаратів у цьому дослідженні не виявлено.
Фармакокінетика. Порівняння концентрації інсуліну в сироватці крові у здорових добровольців та у хворих на цукровий діабет вказувало на більш повільну та тривалішу абсорбцію, а також продемонструвало відсутність піку концентрації після п/ш ін’єкції інсуліну гларгіну, порівняно з НПХ інсуліном людини. Таким чином, отримані концентрації інсуліну гларгіну повністю відповідали профілю фармакодинамічної активності препарату у часі. На графіку, наведеному вище, продемонстрований профіль активності інсуліну гларгіну та НПХ інсуліну у часі.
При введенні інсуліну гларгіну 1 раз на добу рівноважна концентрація досягається вже через 2–4 дні після першої ін’єкції.
При в/в введенні Т½ інсуліну гларгіну та інсуліну людини були цілком порівнюваними.
Після п/ш ін’єкції інсуліну Лантус СолоСтар у пацієнтів з цукровим діабетом інсулін гларгін швидко метаболізується на карбоксильному кінці бета-ланцюга з утворенням двох активних метаболітів — M1 (21A-гліцин-інсулін) і M2 (21A-гліцин-дес-30B-треонін-інсулін). У плазмі крові головною циркулюючою сполукою є метаболіт М1. Експозиція М1 зростає пропорційно введеній дозі інсуліну Лантус СолоСтар. Фармакокінетичні та фармакодинамічні дані свідчать про те, що ефект п/ш ін’єкції інсуліну Лантус СолоСтар пов’язаний переважно з експозицією М1. Інсулін гларгін та метаболіт М2 у більшості учасників досліджень не виявляли, а коли їх вміст можна було визначити, їх концентрації не залежали від введеної дози інсуліну Лантус СолоСтар.
У клінічних дослідженнях при аналізі підгруп, сформованих за віком і статтю, не виявлено різниці у показниках безпеки та ефективності між пацієнтами, які отримували інсулін гларгін, та досліджуваною популяцією у цілому.
Діти та підлітки. Фармакокінетика препарату у дітей віком від 2 до ≤6 років з цукровим діабетом 1-го типу оцінювалася в одному клінічному дослідженні (див. Фармакодинаміка). У дітей, які отримували інсулін гларгін, визначали мінімальні рівні інсуліну гларгіну та його головних метаболітів (М1 і М2) в плазмі крові. Встановлено, що закономірності зміни концентрації в плазмі крові подібні до таких у дорослих, і не виявлено жодних доказів на користь кумуляції інсуліну гларгіну або його метаболітів при тривалому застосуванні препарату.
Доклінічні дані з безпеки. Доклінічні дані, отримані у рамках стандартних досліджень з фармакологічної безпеки, токсичності при багатократному застосуванні препарату, генотоксичності, канцерогенного потенціалу і токсичності для репродуктивної функції, не виявили особливої небезпеки для людини.
Показання Лантус Солостар
лікування цукрового діабету у дорослих, підлітків та дітей віком від 2 років.
Застосування Лантус Солостар
дозування. Лантус СолоСтар містить інсулін гларгін — аналог інсуліну тривалої дії. Препарат вводять 1 раз на добу будь-коли, але щоразу в один і той самий час.
Режим дозування препарату Лантус СолоСтар (доза та час введення) слід підбирати індивідуально. Хворим на цукровий діабет 2-го типу Лантус СолоСтар також можна приймати одночасно з пероральними протидіабетичними лікарськими засобами. Сила дії цього лікарського засобу виражається в одиницях. Ці одиниці застосовуються винятково для препарату Лантус СолоСтар і відрізняються від МО чи одиниць, в яких виражається сила дії інших аналогів інсуліну (див. ФАРМАКОЛОГІЧНІ ВЛАСТИВОСТІ).
Діти і підлітки. Безпека і ефективність інсуліну Лантус СолоСтар доведені при його застосуванні у підлітків та дітей віком від 2 років (див. ФАРМАКОЛОГІЧНІ ВЛАСТИВОСТІ). Застосування препарату Лантус СолоСтар у дітей віком до 2 років не вивчали.
Пацієнти літнього віку (старше 65 років). У пацієнтів літнього віку вікове прогресуюче погіршення функції нирок може стати причиною постійного зменшення потреби в інсуліні.
Ниркова недостатність. У пацієнтів з нирковою недостатністю потреба в інсуліні може бути зменшена через послаблення метаболізму інсуліну.
Печінкова недостатність. У пацієнтів з печінковою недостатністю потреба в інсуліні може зменшуватися через зниження здатності до глюконеогенезу та уповільнення метаболізму інсуліну.
Переведення з інших інсулінів на препарат Лантус СолоСтар. При переході зі схем лікування інсулінами середньої тривалості дії або тривалої дії на схему лікування препаратом Лантус СолоСтар може виникнути потреба у зміні дози базального інсуліну, а також у корекції супутньої протидіабетичної терапії (доз і часу введення додатково застосованих звичайних (регуляр) інсулінів або аналогів інсуліну швидкої дії чи доз пероральних протидіабетичних лікарських засобів).
Переведення з дворазового введення НПХ інсуліну (нейтрального протаміну Хагедорна) на препарат Лантус СолоСтар. Щоб знизити ризик розвитку гіпоглікемії у нічні або у ранні ранкові години, пацієнтам, які змінюють режим застосування базального інсуліну з дворазового введення НПХ інсуліну на одноразове введення препарату Лантус СолоСтар, слід знизити дозу базального інсуліну на 20–30% протягом перших тижнів лікування.
Переведення з інсуліну гларгіну 300 ОД/мл на препарат Лантус СолоСтар. Лантус СолоСтар і Тожео СолоСтар (інсуліну гларгіну 300 ОД/мл) не є біоеквівалентними і не можуть використовуватися як безпосередньо взаємозамінні. Щоб знизити ризик розвитку гіпоглікемії, пацієнтам, які змінюють режим застосування базального інсуліну з одноразового введення інсуліну гларгіну 300 ОД/мл на одноразове введення препарату Лантус СолоСтар, потрібно знизити дозу базального інсуліну приблизно на 20%.
Упродовж цього періоду зниження дози має бути принаймні частково компенсовано підвищенням дози інсуліну, введення якого пов’язане із прийомом їжі. Після завершення цього періоду режим дозування слід коригувати індивідуально.
Під час переходу на інший препарат та впродовж перших тижнів після цього рекомендується ретельно контролювати метаболічні показники.
Покращання метаболічного контролю і пов’язане з цим підвищення чутливості до інсуліну можуть потребувати додаткової корекції режиму дозування. Корекція дози також може бути потрібна, наприклад, при зміні маси тіла хворого чи зміні його способу життя, зміні часу доби, коли здійснюється введення інсуліну, або при виникненні інших факторів, які сприяють підвищенню схильності до розвитку гіпо- або гіперглікемії (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
У пацієнтів, які отримують високі дози інсуліну внаслідок наявності антитіл до людського інсуліну, при переході на препарат Лантус СолоСтар можеливе покращення відповіді організму на введення інсуліну.
Спосіб введення. Лантус СолоСтар слід вводити п/ш.
Лантус СолоСтар не можна вводити в/в. Тривала дія препарату Лантус СолоСтар зумовлена його введенням у підшкірно-жирову тканину. В/в введення звичайної п/ш дози може призвести до виникнення тяжкої гіпоглікемії.
Немає клінічно значущої різниці у рівнях інсуліну або глюкози у плазмі крові після введення препарату Лантус СолоСтар в абдомінальну ділянку, ділянку дельтоподібного м’яза або стегна. При кожній наступній ін’єкції місце уколу слід щоразу змінювати в межах ділянки тіла, рекомендованої для введення інсуліну.
Лантус СолоСтар не можна змішувати з будь-яким іншим інсуліном або розводити. При змішуванні або розведенні може змінитися профіль дії препарату у часі. Крім цього, змішування з іншими інсулінами може призвести до утворення осаду.
Перед застосуванням шприц-ручки СолоСтар слід уважно прочитати розділ Інструкція для використання шприц-ручки Лантус СолоСтар.
Перед першим застосуванням шприц-ручку слід витримати при кімнатній температурі протягом 1–2 год. Перевірити картридж перед його використанням. Його можна застосовувати лише тоді, коли р-н у ньому є прозорим, безбарвним, без видимих твердих часточок та має таку ж консистенцію, як вода. Оскільки Лантус СолоСтар є р-ном, він не потребує ресуспендування перед застосуванням.
Порожні шприц-ручки не можна використовувати повторно, вони мають бути належним чином утилізовані.
Щоб запобігти інфікуванню, кожну шприц-ручку може застосовувати лише одна особа.
Перед кожною ін’єкцією слід перевіряти етикетку на інсуліні, щоб уникнути помилкового введення замість інсуліну гларгіну інших інсулінів (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Схематичне зображення шприц-ручки Лантус СолоСтар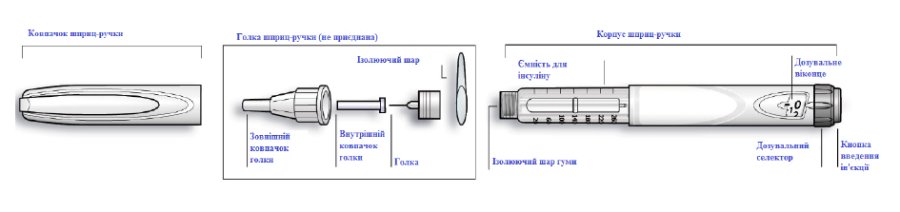
Інструкція для використання шприц-ручки Лантус СолоСтар. Уважно і повністю прочитати інструкцію перед першим використанням шприц-ручки. При необхідності перечитати інструкцію перед подальшим застосуванням шприц-ручки. Зберігати дану інструкцію, оскільки може знадобитися перечитати її в майбутньому.
Перед початком користування шприц-ручкою СолоСтар слід уважно ознайомитися з цією інструкцією. Якщо пацієнт не в змозі самостійно повністю дотримуватися всіх рекомендацій, то слід користуватися СолоСтар тільки за допомогою особи, яка може дотримуватися інструкцій. Тримати шприц-ручку так, як показано у цій інструкції. Щоб переконатися в тому, що дозу правильно встановлено, слід тримати шприц-ручку горизонтально голкою ліворуч, а селектором дози праворуч.
Можна встановлювати дози від 1 до 80 ОД з кроком в 1 ОД. У кожній шприц-ручці міститься декілька доз.
Важлива інформація щодо використання шприц-ручки Лантус СолоСтар
• Для кожної ін’єкції слід використовувати нову голку, сумісну тільки зі шприц-ручкою Лантус СолоСтар.
• Тест на безпеку потрібно виконувати перед кожною ін’єкцією.
• Шприц-ручка призначена особисто, і не слід передавати її іншим особам.
• Якщо ін’єкцію проводить інша особа, ця особа має вжити спеціальних заходів безпеки для уникнення нещасних випадків, пов’язаних із застосуванням голки та перенесенням інфекції.
• Не використовувати шприц-ручку Лантус СолоСтар у разі її пошкодження або за наявності сумніву щодо правильності її функціонування.
• Завжди необхідно мати запасну шприц-ручку Лантус СолоСтар на випадок її втрати або пошкодження.
Стадія 1. Контроль інсуліну.
A. Уважно прочитати етикетку на екземплярі шприц-ручки для того, щоб переконатися у введенні відповідного інсуліну. Шприц-ручка Лантус СолоСтар сірого кольору з фіолетовою кнопкою для введення ін’єкції.
B. Зняти ковпачок шприц-ручки.
C. Проконтролювати зовнішній вигляд інсуліну. Лантус є прозорим інсуліном. Не використовувати шприц-ручку Лантус СолоСтар, якщо інсулін мутний, забарвлений або містить сторонні частки.
Стадія 2. Приєднання голки.
Для кожної ін’єкції завжди використовувати нову стерильну голку. Це допоможе запобігти забрудненню, а також можливому засміченню голки.
А. Зняти захисну етикетку з контейнера голки.
В. Встановити голку на одній лінії зі шприц-ручкою, а потім утримувати на одній прямій до її приєднання (накручують або насаджують, залежно від типу голки).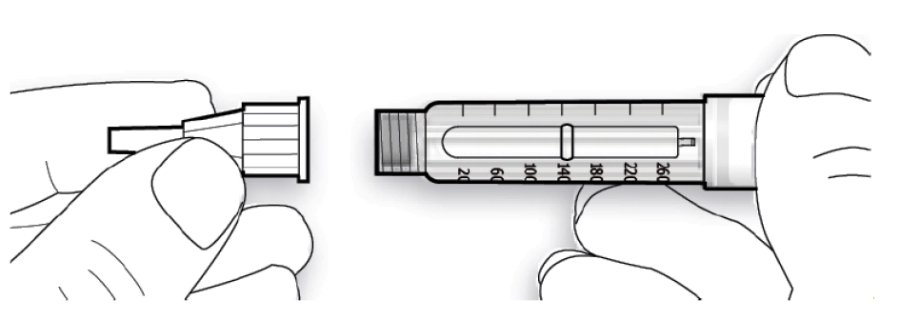
• Якщо голка не знаходиться на одній лінії зі шприц-ручкою у момент приєднання, це може призвести до порушення ізолюючого шару гуми і спричинити витікання рідини або перелом голки.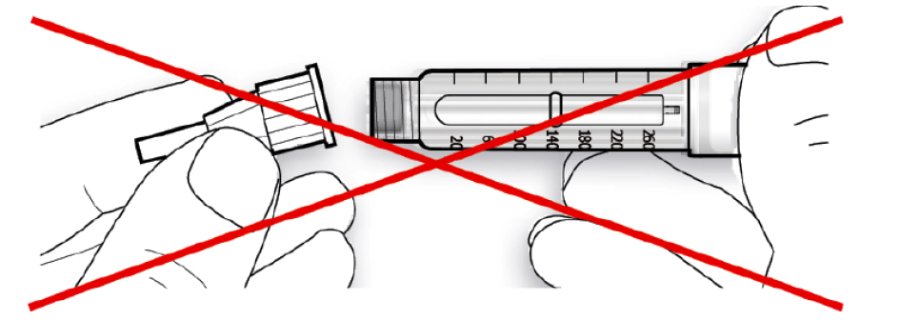
Стадія 3. Тест на безпеку.
У всіх випадках виконувати тест на безпеку перед кожною ін’єкцією, що забезпечить одержання точної дози за допомогою наступного:
• гарантії того, що шприц-ручка і голка функціонують нормально;
• видалення пухирців повітря.
A. Відміряти дозу, що дорівнює 2 ОД, повертаючи дозувальний селектор.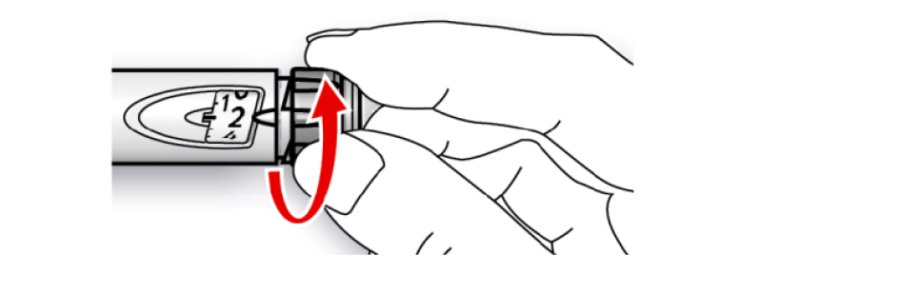
B. Зняти зовнішній ковпачок голки і зберігати, щоб потім помістити в нього використану після введення ін’єкції голку. Зняти внутрішній ковпачок голки і викинути його.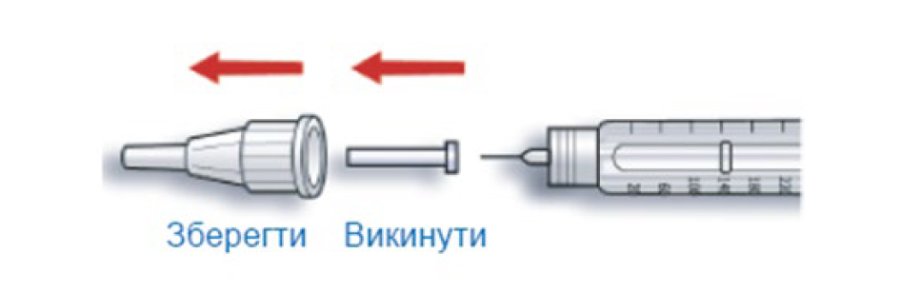
C. Розмістити шприц-ручку голкою вгору.
D. Кінчиками пальців обережно постукати по ємності для інсуліну, щоб усі пухирці повітря піднялися вгору до голки.
E. Натиснути на кнопку введення ін’єкції до упору. Перевірити, чи з’являється інсулін на кінчику голки.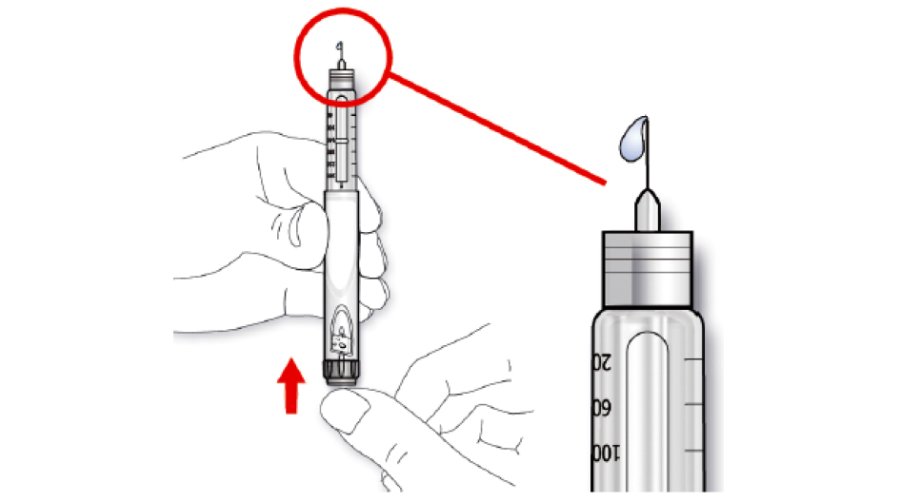
Можна провести тест на безпеку кілька разів, поки не з’явиться інсулін.
• Якщо інсулін не з’явився, перевірити наявність пухирців повітря та повторно провести тест на безпеку ще 2 рази до їх видалення.
• Якщо появи інсуліну не спостерігається, це може бути ознакою засмічення голки. Слід замінити голку і повторити тест.
• Якщо появи інсуліну не відмічається після заміни голки, це може бути ознакою того, що шприц-ручка зіпсована. Не слід використовувати її.
Стадія 4. Вибір дози.
Можна встановити дозу з точністю до 1 ОД (від мінімальної дози 1 ОД до максимальної дози 80 ОД). Якщо необхідно ввести дозу, що перевищує 80 ОД, слід провести 2 або більше ін’єкції.
A. Перевірити, щоб дозувальне віконце показувало «0» після завершення тесту на безпеку.
B. Обрати необхідну дозу (на нижченаведеному прикладі обрана доза становить 30 ОД). Якщо встановлено дозу, що перевищує необхідну, слід повернути дозувальний селектор у початкове положення.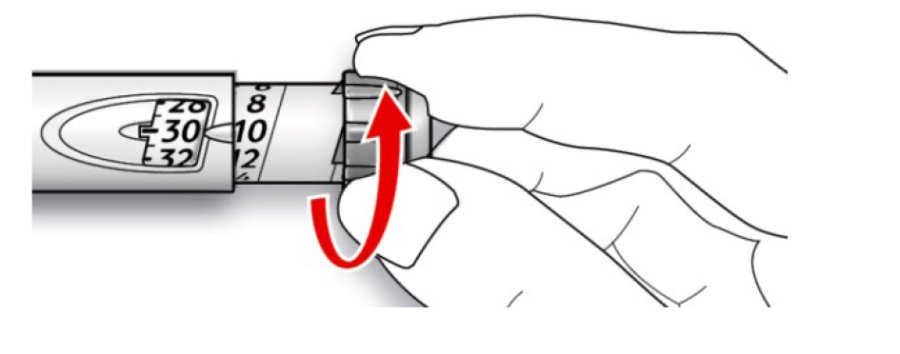
• Не натискати на кнопку введення ін’єкції під час обертання селектора, інакше інсулін витече.
• Не можна повернути дозувальний селектор до числа одиниць, що перевищує кількість, яка залишилася у шприц-ручці. Не слід намагатися силою повернути дозувальний селектор. У цьому випадку слід або ввести залишок інсуліну гларгіну та доповнити необхідну дозу з нової шприц-ручки, або використати новий Лантус СолоСтар для введення повної дози.
Стадія 5. Техніка введення ін’єкції.
А. Слід дотримуватися техніки введення ін'єкції, з якою ознайомить лікар.
В. Ввести голку у шкіру.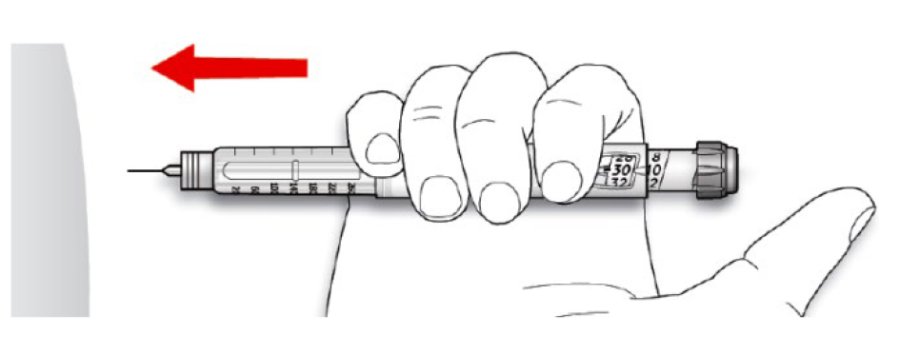
С. Ввести дозу за допомогою натискання на кнопку введення ін’єкції до упору. Після введення ін’єкції у дозувальному віконці має встановитися «0».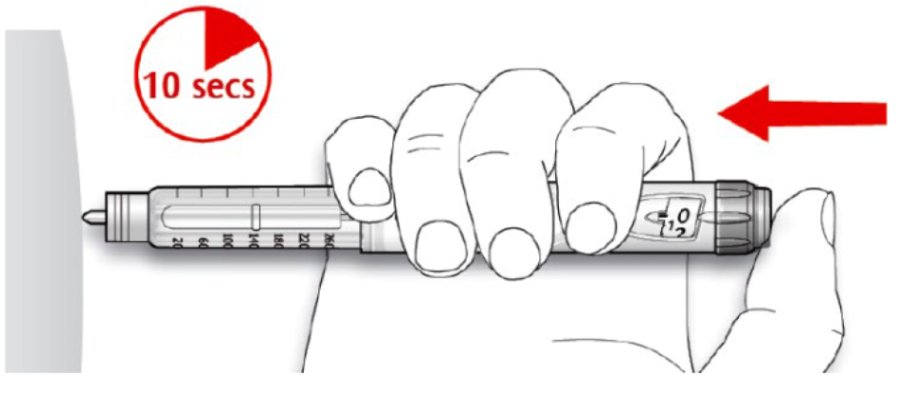
D. Залишити кнопку введення ін’єкції у натиснутому положенні. Повільно рахувати до 10 перед витягуванням голки зі шкіри. При цьому забезпечується введення повної дози.
Стадія 6. Видалення та викидання голки.
У всіх випадках видалити голку після кожної ін’єкції та зберігати шприц-ручку без прикріпленої голки. Цим забезпечується профілактика:
• забруднення та/або потрапляння інфекції;
• потрапляння повітря до ємності для інсуліну та витікання інсуліну, що може призвести до неправильного дозування.
A. Надіти зовнішній ковпачок голки назад на голку і використовувати його для викручування голки зі шприц-ручки. Для зниження ризику нещасних випадків, пов’язаних із використанням голки, ніколи не надівати назад внутрішній ковпачок голки.
• Якщо ін’єкцію проводила інша особа, вона має вжити спеціальних запобіжних заходів при видаленні та викиданні голки (наприклад техніка закривання ковпачка однією рукою) для зниження ризику нещасних випадків, пов’язаних із використанням голки, а також перенесення інфекційних захворювань.
B. Обережно викинути голку (згідно зі встановленими інструкціями).
C. У всіх випадках закривати ковпачком шприц-ручку та зберігати шприц-ручку до наступної ін’єкції.
Інструкції щодо зберігання. Слід уважно ознайомитися з інформацією щодо зберігання шприц-ручки Лантус СолоСтар.
Якщо шприц-ручка Лантус СолоСтар зберігається у холодильнику, вийняти її звідти за 1–2 год перед введенням препарату, щоб вона нагрілася до кімнатної температури. Ін'єкційне введення охолодженого інсуліну є більш болісним.
Використана шприц-ручка Лантус СолоСтар підлягає знищенню згідно із встановленими правилами.
Експлуатація. Захищати шприц-ручку Лантус СолоСтар від пилу та бруду.
Очистити зовнішній бік шприц-ручки Лантус СолоСтар можна, протираючи її вологою тканиною.
Не занурювати у рідину, не промивати і не змащувати шприц-ручку, оскільки цим можна пошкодити її.
Шприц-ручка Лантус СолоСтар призначена для точної і безпечної роботи.
Її необхідно використовувати з обережністю. Слід уникати ситуацій, при яких можливе пошкодження шприц-ручки. Якщо є підозра, що Лантус СолоСтар пошкоджений, слід використовувати нову шприц-ручку.
Діти. Безпека та ефективність препарату Лантус СолоСтар встановлені для підлітків та дітей віком 2 років і старше.
Протипоказання
підвищена чутливість до діючої речовини або будь-якої допоміжної речовини, що входить до складу препарату.
Побічна дія
загальний огляд профілю безпеки препарату. Гіпоглікемія (відмічається дуже часто), як правило, є найчастішою побічною реакцією, яку виявляють під час інсулінотерапії. Вона виникає тоді, коли доза введеного інсуліну набагато перевищує потребу в ньому (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Небажані реакції, пов’язані із застосуванням препарату, що відмічали під час клінічних досліджень, наводяться нижче за класами систем органів у порядку зниження частоти виникнення (дуже часто (≥1/10), часто (≥1/100–<1/10), нечасто (≥1/1000–<1/100), рідко (≥1/10 000–<1/1000), дуже рідко (<1/10 000).
У кожній із цих груп побічні реакції наведені у порядку зниження ступеня їх серйозності.
Табличний перелік небажаних реакцій
| Клас систем органів MedDRA | Дуже часто | Часто | Нечасто | Рідко | Дуже рідко | Частота невідома |
|---|---|---|---|---|---|---|
| Розлади з боку імунної системи | Алергічні реакції | |||||
| Метаболічні та аліментарні розлади | Гіпоглікемія | |||||
| Розлади з боку нервової системи | Дисгевзія | |||||
| Розлади з боку органів зору | Порушення зору, ретинопатія | |||||
| Розлади з боку шкіри та підшкірних тканин | Ліпогіпертрофія | Ліпоатрофія | Амілоїдоз шкіри | |||
| Розлади з боку опорно-рухової системи та сполучної тканини | Міалгія | |||||
| Порушення загального стану та реакції у місці введення | Реакції у місці ін’єкційного введення препарату | Набряк | ||||
Опис окремих небажаних реакцій
Метаболічні та аліментарні розлади. Тяжкі епізоди гіпоглікемії, особливо якщо вони виникають неодноразово, можуть стати причиною ураження нервової системи. Тривала або тяжка гіпоглікемія може становити загрозу для життя хворого.
У багатьох пацієнтів появі симптомів, що свідчать про недостатнє надходження глюкози до тканин головного мозку (нейроглікопенія), передують ознаки адренергічної контррегуляції. Як правило, чим більше та швидше знижується рівень глюкози в крові, тим більш вираженою є адренергічна контррегуляція та інтенсивніше проявляються характерні симптоми (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Розлади з боку імунної системи. Реакції гіперчутливості негайного типу на інсулін виникають рідко. Проявами таких реакцій на інсулін (у тому числі на інсулін гларгін) або допоміжні речовини можуть бути, наприклад, генералізовані реакції з боку шкіри, ангіоневротичний набряк, бронхоспазм, артеріальна гіпотензія і шок, які можуть становити загрозу для життя хворого.
Введення препаратів інсуліну може зумовити утворення антитіл до нього. Під час клінічних випробувань у груп пацієнтів, які отримували лікування НПХ інсуліном та інсуліном гларгіном, утворення антитіл, що перехресно реагували з людським інсуліном, відмічали з однаковою частотою. У поодиноких випадках через наявність антитіл до інсуліну може виникати потреба у корекції дози, щоб попередити виникнення гіпо- або гіперглікемії.
Розлади з боку органа зору. Значна зміна рівня глюкози у крові може спричинити тимчасове порушення зору внаслідок тимчасової зміни тургору та індексу рефракції кришталика.
Ризик прогресування діабетичної ретинопатії знижується при досягненні тривалої нормалізації рівня глюкози у крові. Однак інтенсифікація інсулінотерапії із раптовим покращенням глікемічного контролю може супроводжуватися тимчасовим погіршенням перебігу діабетичної ретинопатії. У хворих на проліферативну ретинопатію, особливо у тих, кому не проводилася фотокоагуляція, епізоди тяжкої гіпоглікемії можуть призвести до виникнення тимчасової втрати зору.
Розлади з боку шкіри та підшкірних тканин. Як і при застосуванні будь-яких інших препаратів інсуліну, у місці ін’єкційного введення може виникати ліподистрофія, внаслідок цього швидкість всмоктування інсуліну у місці ін’єкції зменшується. Постійна зміна місця проведення ін’єкції у межах окремої ін’єкційної ділянки дає змогу зменшити вираженість цих явищ або попередити їх появу (див. ОСОБЛИВОСТІ ЗАСТОСУВАННЯ).
Порушення загального стану та реакції у місці введення. До реакцій, що виникають у місці введення, належать почервоніння шкіри, біль, свербіж, кропив’янка, припухлість або запалення. Більшість нетяжких реакцій на інсулін, які виникають в місці введення препарату, зазвичай минають упродовж періоду від кількох днів до кількох тижнів.
Зрідка інсулін може викликати затримку в організмі натрію та появу набряків, особливо у випадках, коли завдяки посиленню інтенсивності інсулінотерапії вдається покращити глікемічний контроль, який до цього не був адекватним.
Діти та підлітки. Загалом профіль безпеки препарату у дітей та підлітків (віком до 18 років) не відрізняється від профілю його безпеки у дорослих пацієнтів.
У звітах про побічні реакції, отриманих під час постмаркетингового спостереження, повідомлялося про відносно частіше виникнення реакцій у місці введення препарату (біль у місці введення препарату, реакція у місці введення препарату), а також реакцій з боку шкіри (висип, кропив’янка) у дітей та підлітків (віком ≤18 років), порівняно із дорослими. Дані клінічних досліджень стосовно безпеки застосування препарату у дітей віком до 2 років наразі відсутні.
Особливості застосування
Лантус СолоСтар не є препаратом вибору для лікування діабетичного кетоацидозу. Замість нього у таких випадках рекомендується в/в введення звичайного (регуляр) інсуліну.
Якщо у результаті лікування не вдається досягти достатнього контролю рівня глюкози або відмічають епізоди гіпо- чи гіперглікемії, перед тим як змінювати дозування препарату, слід перевірити, чи дотримується хворий призначених режиму лікування, місць введення препарату, належної техніки ін’єкційного введення, а також оцінити інші важливі фактори, які впливають на ефективність лікування.
Переведення пацієнта на інший тип або марку інсуліну має відбуватися під ретельним медичним наглядом. Зміни сили дії, марки (виробника), типу (регуляр, НПХ, ленте, тривалої дії і тощо), походження (тваринний, людський, аналог людського інсуліну) та/або методу виробництва можуть зумовити необхідність зміни дози інсуліну.
Введення препаратів інсуліну може викликати утворення антитіл до нього. У поодиноких випадках через наявність антитіл до інсуліну може виникати потреба у корекції дози для профілактики гіпо- або гіперглікемії (див. ПОБІЧНА ДІЯ).
Пацієнтів потрібно попередити про необхідність постійно змінювати місце ін’єкції, щоб зменшити ризик розвитку ліподистрофії та амілоїдозу шкіри. Існує потенційний ризик затримки абсорбції інсуліну та погіршення глікемічного контролю після ін’єкцій інсуліну в місцях цих реакцій. Повідомляється, що зміна місця ін’єкції на неуражену ділянку шкіри призводить до гіпоглікемії. Рекомендується проводити моніторинг рівня глюкози в крові після зміни місця введення і врахувати коригування дози протидіабетичних препаратів.
Гіпоглікемія. Час, через який розвивається гіпоглікемія, залежить від профілю дії інсулінів, що застосовуються, і тому може змінюватися при зміні режиму лікування. Внаслідок більш стабільного надходження в організм базального інсуліну при застосуванні препарату Лантус слід очікувати меншої імовірності виникнення гіпоглікемії у нічний час, тоді як у ранні ранкові години гіпоглікемія є більш імовірною.
Дотримуватися особливої обережності і посилено контролювати рівень глюкози у крові необхідно пацієнтам, у яких напади гіпоглікемії можуть бути особливо небезпечними з клінічної точки зору, як, наприклад, пацієнтам з вираженим стенозом коронарних артерій або кровоносних судин, що постачають кров'ю головний мозок (ризик серцевих чи мозкових ускладнень гіпоглікемії), а також пацієнтам з проліферативною ретинопатією, яким не проводилася фотокоагуляція (ризик виникнення транзиторної постгіпоглікемічної сліпоти).
Пацієнти повинні знати про те, що за певних обставин перші симптоми розвитку гіпоглікемії можуть бути менш помітними. Симптоми, що вказують на розвиток гіпоглікемії, можуть змінюватися, ставати менш вираженими або бути взагалі відсутніми у пацієнтів, що належать до певних груп ризику. Серед них хворі:
– у яких спостерігається значне покращення глікемічного контролю;
– у яких гіпоглікемія розвивається поступово;
– літнього віку;
– що перейшли з інсуліну тваринного походження на людський інсулін;
– з автономною (вегетативною) нейропатією;
– на цукровий діабет впродовж тривалого періоду;
– з психічними розладами;
– які одночасно отримують терапію деякими іншими лікарськими засобами (див. ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ).
У таких ситуаціях може виникати тяжка гіпоглікемія (можливо, із втратою свідомості) ще до того, як пацієнт зрозуміє, що у нього знизився рівень глюкози у крові.
Оскільки інсулін гларгін при п/ш введенні діє впродовж тривалого періоду, це може призвести до того, що для нормалізації глікемічного стану потребуватиметься більше часу.
Якщо у хворого відмічають нормальний чи знижений рівень глікозильованого гемоглобіну, це може вказувати на виникнення у нього періодичних недіагностованих (особливо нічних) епізодів гіпоглікемії.
Для зниження ризику виникнення гіпоглікемії дуже важливими є дотримання пацієнтом дози препарату, режиму харчування, правильне введення інсуліну, а також поінформованість хворого стосовно симптомів гіпоглікемії. Існує ряд факторів, які підвищують схильність до виникнення гіпоглікемії та потребують ретельного спостереження за станом хворого, а іноді і корекції дози препарату. До них належать:
– зміна місця введення інсуліну;
– підвищення чутливості до інсуліну (наприклад при усуненні стресових факторів);
– незвичне, надмірне або тривале фізичне навантаження;
– супутнє захворювання (наприклад блювання, діарея);
– нераціональне харчування;
– пропуск прийому їжі;
– вживання алкоголю;
– деякі порушення ендокринної системи (порушення функції щитовидної залози, недостатність аденогіпофізу чи кори надниркових залоз) у стадії декомпенсації;
– одночасне застосування деяких інших лікарських засобів.
Супутні захворювання. Наявність супутнього захворювання потребує посилення контролю за метаболічними показниками. У багатьох випадках показане проведення аналізу сечі на наявність кетонових тіл та часто виникає необхідність у корекції дози інсуліну. Потреба в інсуліні нерідко може зростати. Хворим на цукровий діабет 1-го типу необхідно продовжувати регулярно споживати хоча б невелику кількість вуглеводів, навіть якщо вони здатні приймати лише незначну кількість їжі або зовсім не можуть приймати їжу, або у них виникає блювання. Вони ніколи не повинні припиняти застосування інсуліну повністю.
Антитіла до інсуліну. Введення препаратів інсуліну може зумовити утворення антитіл до нього. У рідкісних випадках через наявність антитіл до інсуліну може виникати потреба у корекції дози, щоб попередити виникнення гіпо- або гіперглікемії (див. ФАРМАКОЛОГІЧНІ ВЛАСТИВОСТІ).
Користування шприц-ручкою. Перед використанням шприц-ручки СолоСтар слід уважно прочитати інструкцію для її використання. СолоСтар слід використовувати відповідно до рекомендацій, що містяться у цій інструкції (див. Інструкція для використання шприц-ручки Лантус СолоСтар).
Помилкове введення іншого препарату. Надходили повідомлення про помилкове введення препаратів, коли замість інсуліну гларгіну випадково вводили інші інсуліни, зокрема інсуліни короткої дії. Перед кожною ін’єкцією слід перевіряти етикетку на інсуліні, щоб уникнути помилкового введення замість інсуліну гларгіну інших інсулінів.
Комбінація препарату Лантус СолоСтар з піоглітазоном. Про випадки серцевої недостатності повідомлялося при застосуванні піоглітазону в поєднанні з інсуліном, особливо у пацієнтів з ризиком розвитку серцевої недостатності. Це слід враховувати при розгляді можливості проведення лікування комбінацією піоглітазону та препарату Лантус СолоСтар. При застосуванні цієї комбінації пацієнти повинні перебувати під медичним наглядом через можливість виникнення ознак і симптомів серцевої недостатності, збільшення маси тіла і набряків. При будь-якому збільшенні вираженості кардіологічних симптомів застосування піоглітазону необхідно припинити.
Допоміжні речовини. Цей лікарський засіб містить менше 1 ммоль натрію (23 мг) на одну дозу, тобто він практично не містить натрію.
Застосування у період вагітності або годування грудьми
Вагітність. Клінічних даних, отриманих у ході контрольованих клінічних досліджень, стосовно застосування інуліну гларгіну у період вагітності немає. Значний обсяг даних щодо застосування цього препарату у вагітних (більш ніж 1000 випадків вагітності), які отримані під час постмаркетингового спостереження, вказує на те, що інсулін гларгін не чинить шкідливого впливу на перебіг вагітності, а також не спричиняє ані вад розвитку у плода/новонародженого, ані токсичного впливу на нього. Дослідження на лабораторних тваринах не виявили ознак репродуктивної токсичності. Препарат Лантус СолоСтар можна призначати у період вагітності, якщо у цьому є потреба.
Пацієнткам, у яких цукровий діабет виник до вагітності, та пацієнткам з гестаційним цукровим діабетом упродовж усього періоду вагітності дуже важливо підтримувати належний метаболічний контроль, щоб запобігти розвитку небажаних клінічних наслідків, асоційованих із гіперглікемією. Потреба в інсуліні може зменшуватися у І триместр вагітності та зростати протягом ІІ та ІІІ триместрів. Одразу після пологів потреба в інсуліні стрімко знижується (підвищується ризик виникнення гіпоглікемії). Тому дуже важливе значення має ретельний контроль за рівнем глюкози у крові.
Годування грудьми. На сьогодні невідомо, чи виділяється інсулін гларгін у грудне молоко. Виникнення будь-яких метаболічних ефектів, спричинених проникненням інсуліну гларгіну в організм новонародженого/немовляти із грудним молоком, не очікується, оскільки інсулін гларгін є пептидом, який у ШКТ людини розщеплюється на амінокислоти. Однак жінки, які годують грудьми, можуть потребувати корекції дози препарату та дієти.
Репродуктивна функція. Дослідження на лабораторних тваринах не виявили безпосереднього шкідливого впливу на репродуктивну функцію.
Здатність впливати на швидкість реакції при керуванні транспортними засобами або з іншими механізмами. Здатність пацієнта до концентрації уваги та швидкість його реакції можуть порушуватися внаслідок виникнення гіпоглікемії чи гіперглікемії або, наприклад, унаслідок зорових розладів. Це може бути небезпечним у тих ситуаціях, коли ці якості є особливо важливими (під час керування транспортними засобами або роботи з механізмами).
Пацієнтам необхідно порадити вживати необхідних запобіжних заходів з метою уникнення гіпоглікемії під час керування транспортним засобом. Це є особливо важливим для тих пацієнтів, у яких перші ознаки розвитку гіпоглікемії є слабко вираженими або взагалі відсутні, а також для тих хворих, у яких гіпоглікемія виникає досить часто. Слід ретельно зважити, чи варто сідати за кермо або працювати з механізмами у такому стані.
Взаємодія з іншими лікарськими засобами
існує ряд речовин, які впливають на метаболізм глюкози, а отже, їх застосування може потребувати корекції дози інсуліну гларгіну.
До речовин, які можуть посилювати гіпоглікемічний ефект інсуліну та підвищувати схильність до виникнення гіпоглікемії, належать пероральні протидіабетичні лікарські засоби, інгібітори АПФ, дизопірамід, фібрати, флуоксетин, інгібітори МАО, пентоксифілін, пропоксифен, саліцилати та сульфаніламідні протимікробні засоби.
До речовин, які можуть послаблювати гіпоглікемічний ефект інсуліну, належать кортикостероїди, даназол, діазоксид, сечогінні засоби, глюкагон, ізоніазид, естрогени та прогестагени, похідні фенотіазину, соматропін, препарати-симпатоміметики (епінефрин, сальбутамол, тербуталін), гормони щитовидної залози, атипові антипсихотичні лікарські засоби (наприклад клозапін та оланзапін) та інгібітори протеаз.
Блокатори β-адренорецепторів, клонідин, солі літію або алкоголь можуть як посилювати, так і послаблювати гіпоглікемічний ефект інсуліну. Пентамідин може викликати гіпоглікемію, після якої іноді настає гіперглікемія.
Крім того, під дією симпатолітичних засобів, таких як блокатори β-адренорецепторів, клонідин, гуанетидин та резерпін, вираженість ознак адренергічної контррегуляції може зменшуватися або зовсім зникати.
Несумісність. Цей лікарський засіб не можна змішувати з іншими лікарськими засобами.
Передозування
симптоми. Передозування інсуліну може призвести до тяжкої, а іноді тривалої гіпоглікемії, яка може бути небезпечною для життя хворого.
Лікування. Нетяжкі випадки гіпоглікемії зазвичай можуть бути скориговані пероральним застосуванням вуглеводів. Можуть знадобитися також корекція дози лікарського засобу і внесення змін у режим харчування чи фізичної активності.
Більш тяжкі епізоди гіпоглікемії, які супроводжуються комою, судомами або неврологічними порушеннями, потребують в/м чи п/ш введення глюкагону або в/в введення концентрованого р-ну глюкози. Оскільки гіпоглікемія може повторитися навіть після явного покращання клінічного стану хворого, необхідними заходами є тривале вживання вуглеводів і спостереження за станом пацієнта.
Умови зберігання
шприц-ручки, що не перебувають у використанні. Зберігати при температурі 2–8 °C. Не заморожувати. Не допускати контакту з морозильним відділенням або накопичувачами холоду. Зберігати шприц-ручку у зовнішній картонній упаковці з метою захисту від світла.
Термін придатності після першого використання шприц-ручки. Цей лікарський засіб слід зберігати протягом максимум 4 тиж при температурі не вище 30 °C у захищеному від джерел прямого тепла та прямого світла місці. Шприц-ручки, які перебувають у використанні, не повинні зберігатися у холодильнику. Після кожної ін’єкції на шприц-ручку слід знову надівати ковпачок з метою захисту від світла.
