Механизмы действия системной энзимотерапии
(К.Н. Веремеенко, В.Е. Досенко, А.И. Кизим)
Комбинированные препараты гидролитических ферментов животного и растительного происхождения, вводимые перорально, широко и с успехом используют в различных областях медицины [28–30, 30а, 126]. Согласно многочисленным исследованиям, эти средства способны оптимизировать течение воспалительного процесса, иммунных реакций, нормализовать реологические свойства крови, липопротеидный спектр, улучшать проницаемость соединительной ткани и другое. Энтеральное (пероральное, ректальное) применение полиэнзимных препаратов получило название СЭТ, поскольку предполагается системное влияние ферментов на многие физиологические и биохимические процессы организма, а не местное воздействие, направленное на пораженный орган или на улучшение переваривания пищи в кишечнике [28, 111, 126]. По нашему мнению, этот термин не совсем удачен, так как аналогичные эффекты наблюдаются и при парентеральном введении ферментов (внутривенном, внутримышечном). Мы считаем важным отметить, что нами впервые в СССР получены лечебные препараты протеиназ поджелудочной железы — кристаллический трипсин и α-химотрипсин для внутримышечного введения, обосновано их применение, проведена апробация и внедрение в медицинскую практику в качестве противовоспалительных, муколитических и некролитических средств [7–9]. Именно этим объясняется наш интерес к новому методу энзимотерапии — пероральному применению протеолитических ферментов, который был предложен профессором М. Вольфом и Г. Бенитез и развитый проф. К. Рансбергером и его учениками.
Использование современных диагностических методов (биохимических, иммунологических, морфологических, не говоря уже о клинических наблюдениях) позволило объективизировать эффективность терапии с помощью протеолитических ферментов, однако, на наш взгляд, не намного приблизило разрешение главного вопроса о механизмах СЭТ. Понимание последних затруднялось прежде из-за традиционного представления о невозможности всасывания цельных белковых молекул из кишечника в кровь. Полученные в последние годы данные (см. гл. 2) с использованием биохимических и иммунологических методов позволили убедиться в возможности резорбции и приблизиться к пониманию механизмов всасывания макромолекул белков — ферментов [38, 39, 54, 74, 79, 86, 87, 90, 110]. Важным доказательством всасывания энзимов является обнаружение их специфической активности в крови после перорального применения ферментных комбинаций. Предложенный нами высокочувствительный метод позволяет определять нанограммы трипсина, бромелаина, папаина, а также полиэнзимных препаратов флогэнзим и вобэ-мугос Е в циркулирующей крови животных в различные сроки после их перорального введения [17].
Детальное изучение взаимодействия протеиназ поджелудочной железы с ингибиторами плазмы крови позволило установить, что, поступая в кровь, ферменты связываются в основном с двумя ингибиторами — α2М и α1ИП принципиально разным образом. Существенно, что последний полностью и необратимо инактивирует протеолитические ферменты, а α2М лишь ограничивает их способность действовать на большинство высокомолекулярных субстратов [13, 14, 16, 18, 37, 55]. Таким образом, в циркулирующей крови отсутствуют свободные трипсино- и папаиноподобные протеиназы. Сериновые и тиоловые протеиназы осуществляют свою функцию в связанном с α2М состоянии, в котором активный центр фермента не блокируется и контактирует с молекулами определенных низкомолекулярных субстратов. Именно эта ограниченная активность и определяется в крови после перорального приема протеолитических энзимов. Надо отметить также, что α2М обладает более высоким сродством к трипсиноподобным протеиназам (по нашим данным константа ассоциации трипсина с α2М в 6 раз превышает таковую для трипсина и α1ИП) и большая часть поступающих из кишечника энзимов связывается именно с α2М. Этот весьма существенный момент, а именно образование комплекса α2М — протеиназа, часто не учитывается, однако, по нашему мнению, имеет ключевое значение в реализации лечебного действия СЭТ. Именно в комплексе с α2М фермент транспортируется в различные органы и ткани, где и проявляется его каталитическая функция. Взаимодействие протеиназы с α2М не только способствует угнетению активности фермента, ограничению его субстратного спектра и маскировке антигенных детерминант, но и ведет к образованию биологически активной молекулы — лиганда для клеточных рецепторов (рис. 25).
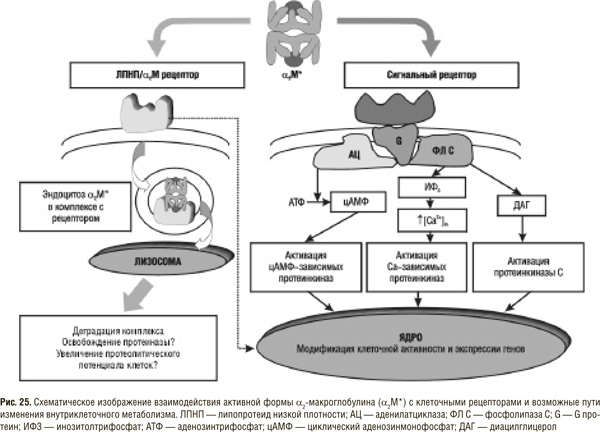
В настоящее время описаны два типа таких рецепторов (см. гл. 1): протеин, связанный с рецептором к ЛПНП/α2М-рецептор — рецептор эндоцитозного типа, экспрессированный на макрофагах, гепатоцитах, гладкомышечных клетках, фибробластах и других клетках [48, 116], и сигнальный рецептор, связанный с G-протеином, идентифицированный на клетках моноцитарного происхождения [88а, 88б]. Описаны следующие эффекты возбуждения ЛПНП/α2М-рецептора комплексом α2М — протеиназа: 1) модификация связывания и катаболизма ЛПНП в макрофагах; 2) стимуляция пролиферации гладкомышечных клеток путем экспрессии -рецептора к PDGF; 3) стимуляция митоза гладкомышечных клеток синергично с TGF ; 4) угнетение пролиферации фибробластов, индуцированного PDGF- BB; 5) регуляция синтеза простагландина Е; 6) продукция супероксиданиона перитонеальными макрофагами и др. [48, 125а].
Активация второго рецептора (сигнального) комплексом α2М — протеиназа приводит к: опосредованной инозитол-3-фосфатом мобилизации кальция из эндоплазматического ретикулума; активации синтеза фактора активации тромбоцитов; индукции синтеза цАМФ и др. [88а, 88б].
Без сомнения, в ближайшее время могут быть описаны и другие эффекты возбуждения клеточных рецепторов комплексом α2М — протеиназа и расшифровано их биологическое значение. Однако уже сейчас очевидно, что именно этот комплекс является важнейшим связующим звеном, опосредующим действие поступающих через кишечную стенку протеиназ на клетки практически всех органов и тканей организма. Возбуждением рецептора действие протеиназ не заканчивается, так как после эндоцитоза и формирования эндолизосомы протеиназа может освобождаться от ингибитора и повторно использоваться клеткой, поглотившей комплекс α2М — протеиназа. Это особенно касается поврежденных тканей, в которых снижается рН, что способствует диссоциации указанного комплекса. Данных, подтверждающих это предположение, немного, но сама возможность освобождения существует, а это открывает новое направление в исследовании механизмов действия протеиназ за счет увеличения внутриклеточного протеолитического потенциала [85, 103а].
Таким образом, именно комплексу α2М — протеиназа или активированной форме α2М принадлежит важнейшая роль в реализации эффектов СЭТ. Акцентируя внимание на этом принципиальном положении, в дальнейшем изложении попробуем проследить путь фермента, поступающего перорально, от кишечной стенки до всех органов.
Фермент, защищенный оболочкой, от переваривающего действия желудочного сока, попадает в просвет тонкого кишечника. Как правило, исследователи опускают возможность того, что часть лечебных эффектов протеолитических ферментов (пищеварительных ферментов, например, трипсина и химотрипсина) реализуется именно в кишечнике. Наоборот, подчеркивается, что прием ферментов натощак позволяет им достаточно быстро и эффективно всосаться и попасть в системный кровоток в отличие от широко известных фестала, дигестала, панзинорма и других, которые применяются для улучшения переваривания пищи в кишечнике. Как указывалось ранее (см. гл. 2), не исключено, что определенная часть эффектов СЭТ реализуется через рецепторы, активирующиеся протеиназами (PAR), наличие которых доказано на поверхности энтероцитов, гладкомышечных клеток кишечника [89, 93]. Действительно, это может иметь физиологический характер, ведь даже в норме небольшие, но концентрированные порции секрета поджелудочной железы поступают в просвет кишечника между приемами пищи. Не исключено, что воздействие трипсина и других протеиназ на соответствующие рецепторы кишечной стенки влияет на различные функциональные системы организма, причем данное влияние имеет определенный адаптационный характер, напоминающий перестройку метаболических процессов при голодании. Естественно, что избыточное потребление пищи, особенно продуктов, требующих для своего переваривания большого количества протеолитических ферментов, приводит к относительной недостаточности ферментов поджелудочной железы, прежде всего по отношению к периодической секреции между приемами пищи. Исходя из этого предположения, для большинства населения мира, употребляющего в пищу продукты животного происхождения, богатые белком, весьма полезным может оказаться профилактический прием комплексов протеолитических ферментов не для улучшения процесса переваривания, а в качестве биологически активных веществ, регулирующих жизнедеятельность организма в целом.
Следующей «мишенью» протеолитических ферментов, поступающих перорально, являются лимфоидные образования кишечной стенки. Лимфатические фолликулы кишечника (пейеровы бляшки) считаются аналогом бурсы Фабрициуса птиц, в которой происходят процессы дозревания, дифференциации В-лимфоцитов, которые после антигенной стимуляции и бласт-трансформации становятся продуцентами иммуноглобулинов. Поэтому протеолитические ферменты, прежде всего те, которые проникают через М-клетки, имеют возможность влиять на протекание системных иммунных реакций. Каким же образом используются протеолитические ферменты клетками лимфатических фолликулов кишечника, имеет ли это биологическую целесообразность? Можно выдвинуть несколько предположений. Во-первых, эндоцитоз ферментов через описанные выше рецепторы позволяет поглотить протеиназу и после освобождения от лиганда использовать как лизосомальный фермент, что повышает эффективность внутриклеточного протеолиза [85]. Хорошо известно, что лизосомальные ферменты имеют свои аналоги в крови и других тканях организма (трипсиноподобные протеиназы, эластаза, ряд цистеиновых протеиназ и др.) [24, 31]. Кроме того, протеолитические ферменты могут воздействовать на иммуноциты через поверхностные рецепторы, не проникая внутрь клеток. Например, доказано, что типичный пищеварительный фермент эластаза стимулирует митоз лимфоцитов [96]. Не исключено, что трипсин или растительные протеиназы обладают аналогичным действием, хотя это предположение требует экспериментальной проверки.
После попадания в кровь, а в основном в лимфу, протеиназы в связанном с α2М виде поступают в легкие (по большому лимфатическому протоку, верхней полой вене, через правое сердце и легочную артерию) или в печень по системе воротной вены. Макрофаги как легких, так и печени (клетки Купфера) играют важную роль не только в функционировании названных органов, но и всего организма. Множество комплексов α2М — протеиназа через ЛПНП/α2М-рецептор и сигнальные рецепторы активируют эти клетки, а также гепатоциты, приводя к изменению их метаболизма, что может проявляться по-разному. Например, увеличением антитоксической функции печени или усилением барьерной функции аэрогематического барьера, активацией неспецифической резистентности этих органов и как следствие — всего организма за счет интенсивности фагоцитоза, продукции супероксиданион радикала мононуклеарами, антимикробной защиты в целом.
Не связавшиеся с легочными и печеночными рецепторами комплексы α2М — протеиназа продолжают свой путь, поступая с общим кровотоком ко всем органам и прежде всего к клеткам, имеющим на своей поверхности рецептор к активированному α2М. Это опять же макрофаги, клетки системы мононуклеарных фагоцитов (СМФ): макрофаги селезенки, костного мозга, гистиоциты соединительной ткани, кожи, клетки Купфера, остеокласты, клетки микроглии в нервной системе и т.д. [36а]. Кроме того, и другие клетки (гладкомышечные, фибробласты) получают сигнал о поступающих в кровь энзимах.
Активация СМФ может многое объяснить в механизмах СЭТ, причем этот метод может оказаться уникальным в своем роде, так как на сегодняшний день другие возможности физиологического воздействия на СМФ не найдены. Активность фагоцитоза, процессинга и презентации антигена, выделение интерлейкинов (монокинов) макрофагами СМФ имеет настолько большое значение как в норме, так и при самых различных заболеваниях, что проходить мимо факта влияния СЭТ именно на эти процессы было бы неоправданным.
Каким образом протеиназы, поступающие перорально, оказывают многогранное лечебное воздействие на такие разные по этиологии и патогенезу заболевания, как ревматоидный артрит и ишемическая болезнь сердца, мастопатия и вирусный гепатит, нефросклероз и спортивная травма? При тщательном анализе видно, что в основе большинства этих болезней лежат механизмы тех или иных типических патологических процессов, к которым относится воспаление, аллергия (аутоиммунные заболевания), новообразования, артериальная и венозная гиперемия, тромбоз и др. Можно утверждать, что при этих патологических процессах нарушается регуляция протеолиза с преобладанием либо активации, либо угнетения. Согласно данным литературы [28, 29, 77], комбинированные ферментные препараты с успехом используются при лечении больных, у которых нарушается динамическое равновесие между протеиназами и их ингибиторами в сторону первых. Это происходит и при воспалении, и при наличии опухоли, аутоиммуной патологии, артериосклероза и т.д. Вместе с тем для лечения обоснованно рекомендуется применение ингибиторов протеолитических ферментов, кининогенеза и фибринолиза (контрикал, гордокс и др.). Накоплен достаточный клинический опыт использования полифункциональных ингибиторов протеиназ при лечении острого панкреатита, артрита, сосудистых поражений мозга и многих других [9]. Этот пародокс, по-видимому, объясняется недостаточным знанием степени нарушения баланса между активностью протеолиза и его белковыми ингибиторами крови и тканей, а также трудностями ее определения с помощью современных энзимологических методов. На основании собственных и литературных данных можно высказать предположение, что применение ингибиторов протеиназ показано при системной гиперактивации общего и специфического протеолиза, когда эндогенные ингибиторы протеолитических ферментов не могут компенсировать избыток протеиназ. Это особенно относится к заболеваниям органов, которые богаты потенциально активными ферментами и/или их активаторами (поджелудочная железа, легкие, почки и др.). Так, например, на ранней стадии острого панкреатита происходит внутрипанкреатическая активация калликреинов, катализирующих образование вазоактивных кининов, способствующих развитию отека, повышению проницаемости сосудов и т.д. Активированные протеиназы из поврежденной поджелудочной железы затем всасываются в кровь и вызывают генерализованную активацию кининовой и фибринолитической систем крови как прямым, так и опосредованным путем, что приводит к «ферментной токсемии». В этом случае раннее назначение полифункциональных ингибиторов протеолиза является патогенетически обоснованным. Подробные сведения о механизмах действия естественных и синтетических ингибиторов протеолиза, показаниях и дозировании при острых панкреатитах, нарушениях процесса гемостаза приведены в литературе [9, 10].
Применение СЭТ с использованием комбинаций ферментов представляется более целесообразным при ограниченных воспалительных процессах, при которых ингибиторная емкость обеспечивает нейтрализацию активированных протеиназ. Учитывая сравнительно небольшую долю резорбции перорально вводимых протеолитических ферментов и ограниченную специфичность протеиназ, связанных с α2М, можно предположить, что лечебный, в частности противовоспалительный, эффект достигается путем инактивации вазоактивных полипептидов комплексом α2М — протеиназа как непосредственно, так и через СМФ. Однако нельзя исключить и возможность существования других, пока не выясненных механизмов действия СЭТ.
По нашим данным (Досенко В.Е., 1999), при моделировании адреналинового артериосклероза резко возрастает активность эластазы и нарушается баланс между этой протеиназой и ее ингибиторами как в сыворотке крови, так и в тканях аорты. Введение кроликам препарата флогэнзим способствовало снижению активности эластазы и нормализации коэффициента ингибиторы/эластаза, что приводит к мысли о том, что механизмы СЭТ нельзя объяснить простым увеличением содержания протеиназ и снижением количества ингибиторов.
Вообще, утверждать, что при воспалении или опухолевом росте преимущественно увеличивается содержание ингибиторов, а протеиназ становится относительно меньше не приходится. Хорошо известно, что одним из основных механизмов вторичной альтерации при воспалении является именно активация протеолиза. Опухолевые клетки продуцируют сами или стимулируют другие клетки к продукции специфических протеолитических ферментов широкого спектра (активаторы плазминогена, эластаза, матриксные металлопротеиназы, катепсины В, L, D) [13], и говорить о недостатке протеиназ и, наоборот, избыточном образовании ингибиторов при опухолевом росте не уместно. Именно ингибиторы протеиназ контролируют активность ферментов, предупреждают процессы неограниченного протеолиза как в очаге, так и в системном кровотоке. α1ИП — один из основных ингибиторов протеиназ — является белком острой фазы и повышается при различных воспалительных процессах, онкологических заболеваниях [1, 11]. При воспалении ингибиторов протеолиза становится больше, чем протеиназ, только в последней стадии — пролиферации с репарацией. Образование комплексов протеиназа — α2М стимулирует пролиферацию клеток соединительной ткани, что обеспечивает заживление с прекращением вторичной альтерации [125а]. Поэтому ферменты, поступающие перорально, вероятно, действуют не путем снижения «вредоносных» ингибиторов, а опосредуют свое действие через рецепторы к α2М, активируя таким образом СМФ, которые, как известно, играют важнейшую регуляторную роль при воспалении. Конечно, этим действие протеиназ не ограничивается.
Особый интерес в последнее время вызывает возможность модуляции активности цитокинов, факторов роста с помощью перорально вводимых энзимов. Действительно, активированный взаимодействием с протеиназой α2М может способствовать выведению (через описанный выше рецептор) некоторых факторов роста или инактивировать их (интерлейкин 1 — IL1 , TGF). Другие же цитокины (PDGF, VEGF и т.д.) после связывания с α2М приобретают устойчивость к протеолитическому расщеплению и могут переноситься вместе с α2М к клеткам-мишеням. Таким образом, α2М является одновременно и резервуаром и курьером этих факторов роста (рис. 26).
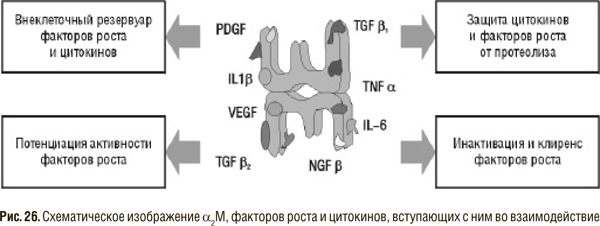
Однако не следует упрощенно трактовать этот факт, ведь абсолютно вредных, так же как абсолютно полезных, цитокинов не существует, все они выполняют определенную биологическую роль и только в случае гиперпродукции или, наоборот, недостаточного выделения могут приводить к патологическим изменениям. Трудно себе представить, что α2М самостоятельно регулирует содержание цитокинов, способствуя то снижению, то увеличению его при разных заболеваниях. Однако активная (связанная с протеиназой) форма α2М, взаимодействуя с рецепторами на поверхности клеток, продуцирующих цитокины, возможно, регулирует как активность синтеза, так и уровень рецепторов к определенным факторам роста, тем самым способствуя удалению или, наоборот, сохранению отдельных цитокинов в патологическом очаге [59a].
Не меньший интерес представляет действие протеиназ на экспрессию молекул адгезии и других рецепторов, обеспечивающих взаимодействие между лейкоцитами и эндотелиальными клетками. Хорошо известно, что уровень экспрессии этих рецепторов резко возрастает при воспалении, а применение СЭТ способствует уменьшению их количества на поверхности клеток. Можно ли из этого заключить, что протеиназы, поступающие перорально, непосредственно расщепляют молекулы адгезии, приводя к их замене на поверхности клетки (так называемому шеддингу рецептора)?
Очевидно, что вряд ли возможно. Если лейкоцитарная эластаза выделяется локально нейтрофильным гранулоцитом, то возможен гидролиз поверхностно расположенной белковой молекулы, но если фермент прошел долгий путь из кишечника до очага воспаления и в комплексе с α2М контактирует с эндотелиальной или какой-либо другой клеткой, то гидролиз указанных молекул сомнителен. Протеиназа, связанная с α2М, имеет суженный субстратный спектр, и расщепление высокомолекулярного соединения, которое к тому же является компонентом клеточной мембраны, представляется маловероятным. Этот факт можно объяснить и по-другому. Комплексы α2М — протеиназа, активируя соответствующие рецепторы, способствуют интернализации молекул адгезии или макрофаги, изменяя спектр выделяемых интерлейкинов, уменьшают активность эндотелиальных клеток по отношению к экспрессии молекул адгезии. Не исключено, что увеличение количества этих комплексов является сигналом к переходу воспаления в завершающую III стадию.
Влияние СЭТ на аутоимунные заболевания, в частности, в патогенезе которых играют роль иммунокомплексные механизмы (аллергические реакции ІІІ типа), доказано результатами многочисленных исследований. Распространенным является мнение о расщеплении протеиназами в токе крови и тканях иммунных комплексов (ИК) [28, 29]. Этот факт установлен для условий in vitro, однако то, что может происходить в пробирке, далеко не всегда реализуется в реальных условиях. Молекулярная масса иммунного комплекса превышает 1 млн дальтон, так как способность к образованию этих комплексов имеют белковые молекулы с константой седиментации 19S, а в качестве антител выступают чаще всего пентамерные молекулы иммуноглобулинов группы М (молекулярная масса 900 000 дальтон). Мы вовсе не собираемся отрицать факт снижения количества ЦИК в процессе лечения препаратами протеолитических ферментов, который подтвержден многими исследователями, но объяснять уменьшение количества этих комплексов прямым протеолитическим действием ферментов, по нашему мнению, неверно. Механизмы этого явления гораздо сложнее, они связаны прежде всего с более активным захватом ИК макрофагами различных органов и уменьшением их образования вследствие снижения активности процесса альтерации клеток в очаге аутоиммунного воспаления.
Еще одним распространенным объяснением механизмов действия СЭТ является способность ферментов к прямому гидролизу фибрина в очаге воспаления, который якобы создает препятствия для обратной диффузии жидкости и приводит к развитию отека. Ни в экспериментальных, ни в клинических исследованиях тем не менее не удалось убедительно показать возможность непосредственного расщепления фибрина энзимными комбинациями при наличии плазменных ингибиторов как при пероральном, так и парентеральном введении. Согласно нашим данным, препараты флогэнзим и вобэ-мугос Е в присутствии избытка ингибиторов плазмы крови не гидролизуют фибрин [18a]. Кроме того, в эксперименте противоотечное действие протеиназ проявляется уже через 1–2 ч после введения флогогена, когда фибриновый барьер еще не сформирован. По-видимому, экзогенные протеиназы, взаимодействуя в крови с α2М, могут влиять на метаболизм биологически активных веществ, выделяющихся в очаге воспаления. В их числе низкомолекулярные пептиды с кининоподобным действием (брадикинин, лейкокинины), интерлейкины, которые являются медиаторами воспаления [125б]. Последние накапливаются в месте повреждения тканей и вызывают повышение проницаемости сосудов, болевой синдром, эмиграцию лейкоцитов.
Протеолитические ферменты даже в комплексе с α2М способны расщеплять указанные пептиды в очаге воспаления, что может быть одним из механизмов противоотечного и противоспалительного действия энзимов. Следует заметить, что такие биологически активные вещества, как гистамин, серотонин или эйкозаноиды, не могут гидролизоваться протеиназами, так как имеют непептидную природу и прямое протеолитическое воздействие на эти вещества практически исключается. Как указывалось выше, маловероятным является и непосредственное расщепление фибрина ферментами, поступающими перорально. Однако возможен и другой вариант — не исключено, что протеиназы стимулируют продукцию активаторов плазминогена, а те в свою очередь приводят к образованию плазмина, который действительно является основным фибринолитическим агентом. Кратко остановимся на основных путях активации плазминогена — внутреннем и внешнем [13, 15, 21]. Первый из них осуществляется посредством фактора Хагемана, неактивная форма которого активируется с помощью калликреина — основного кининобразующего фермента — по типу ограниченного протеолиза. Внешний путь активации осуществляется с помощью тканевых активаторов — специфических сериновых протеиназ. Среди них выделены и охарактеризованы два основных типа — тканевый активатор плазминогена (t-PA) и активатор урокиназного типа (u-PA), которые продуцируются эндотелиальными клетками, фибробластами и макрофагами. Существенно, что оба активатора имеют высокое сродство к фибрину, в его присутствии скорость активации плазминогена в плазме крови увеличивается в сотни раз. Таким образом, на поверхности фибрина адсорбируются активаторы плазминогена и сам плазминоген, содержащий специфические ЛСУ, которые соединяются с ЛУ молекулы фибрина [13]. Плазмин образуется внутри самого волокна фибрина и действует там локально, не подвергаясь инактивации антиплазминами (α2АП и α2М), которыми богата плазма крови. Такая литическая система функционирует безопаснее и надежнее, чем плазмин, вводимый непосредственно в кровь. По мнению выдающегося энзимолога академика А.Е. Браунштейна, более перспективным направлением в лечении ферментами является не использование их прямого действия, а поиск препаратов, способных индуцировать синтез или активацию в самом организме тех или иных проферментов (ферментов). Возможно, протеиназы, вводимые перорально, решают именно эту задачу — увеличивают интенсивность фибринолиза опосредованно через активацию плазминогена, способствуя выделению тканевых активаторов эндотелиальными клетками, макрофагами. Физиологический механизм, посредством которого активаторы выделяются из стенок сосудов в кровь, пока не ясен. В связи с этим лишь напомним, что одним из лигандов рецептора α2М являются тканевый и урокиназный активатор плазминогена, а также ингибитор-1 активатора плазминогена. Таким образом, если в ткани много комплексов α2М — протеиназа, то конкуренция за рецептор должна приводить к повышению содержания в этой ткани активаторов плазминогена.
Известно, что введение ряда вазоактивных веществ (адреналина, никотиновой кислоты, вазопрессина) кратковременно повышает содержание активаторов плазминогена. Продукция и высвобождение последних также усиливаются введением бигуанидов (например, фенформином), анаболическими стероидами. Однако эти препараты небезопасны, имеют ряд побочных эффектов и поэтому уступают комплексным ферментным смесям, используемым для СЭТ.
Полиферментные препараты снижают вязкость крови, которая во многом зависит от концентрации высокомолекулярного асимметричного белка фибриногена. Нами изучена способность препаратов вобэ-мугос Е и флогэнзим и составляющими их протеиназами гидролизовать фибриноген [18а]. Оба препарата обладают выраженной фибриногенолитической активностью, причем эффект флогэнзима является более значительным, чем вобэ-мугоса Е. Этот факт объясняется тем, что в состав первого входит бромелаин, а не папаин, который обладает слабой активностью по отношению к фибриногену. Существенно, что оба препарата расщепляют фибриноген в присутствии избытка плазменных ингибиторов, что может рассматриваться как доказательство гидролиза фибриногена до не свертываемых тромбином продуктов непосредственно в циркулирующей крови. Полученные результаты могут быть использованы для снижения уровня фибриногена, а значит, и вязкости крови при многих патологических состояниях — атеросклерозе, тромбозе вен нижних конечностей, варикозном расширении вен и др.
Обобщая приведенные данные, прежде всего отметим, что упрощенный, поверхностный подход к расшифровке механизмов СЭТ, отсутствие критического взгляда на проблему нередко дискредитирует весьма перспективный терапевтический метод. Наш анализ, конечно, далек от завершенности, но позволяет по-новому взглянуть на СЭТ, способствует пониманию сущности процессов, происходящих в организме при пероральном приеме комплексов протеолитических ферментов. Основными механизмами действия данных препаратов (в порядке реализации) являются:
- Активация рецепторов на поверхности энтероцитов с последующим воздействием как на пищеварительный тракт, так и на другие системы организма.
- Образование активированного α2М под действием протеиназ, поступающих из кишечника в кровь, и осуществление специфической каталитической активности фермента в составе этого рестриктора протеиназ.
- Модуляция клеточной активности комплексами α2М — протеиназа опосредованно через рецептор к активированной форме 2.