Резорбция в кровь перорально вводимых препаратов системной энзимотерапии
Содержание
Механизмы всасывания протеолитических ферментов в пищеварительном тракте (В.Е. Досенко)
Процесс переваривания пищи, в частности белков, предусматривает расщепление веществ c высокой молекулярной массой до низкомолекулярных с последующей резорбцией последних через кишечную стенку. Возможность всасывания нативных белковых молекул из кишечника в кровь вызывает скептическое отношение у многих ученых в силу явного противоречия с господствующей парадигмой пищеварения и неопределенной биологической целесообразностью поступления нерасщепленных до аминокислот белков в системный кровоток. Приводимые ранее [28, 38, 126] сведения о резорбции иммуноглобулинов матери в кишечнике ребенка грудного возраста, бактериальных токсинов (например, ботулотоксина), инсулина, вазопрессина, релизинг-факторов из просвета кишечника не выдерживают критики. Так, поступление антител прекращается по мере дозревания системы собственного гуморального иммунитета ребенка и формирования кишечного барьера. Попадание бактериальных токсинов не может считаться примером физиологического механизма всасывания, так как нельзя исключить возможность повреждения ими энтерогематического барьера и как следствие — патологическое увеличение проницаемости стенки кишечника, в том числе и для высокомолекулярных соединений. Физиологические эффекты некоторых веществ белковой, полипептидной природы, например инсулина, вводимых перорально, вовсе не доказывают их всасывания, а могут объясняться воздействием указанных веществ на рецепторы энтероцитов. Последние, как известно, функционально тесно связаны с пищеварительными железами и поэтому могут воздействовать на метаболические процессы всего организма (в случае с инсулином — вызывать гипогликемию).
Однако данные, полученные исследователями в последние десятилетия, диктуют необходимость изменения устоявшихся представлений о резорбции протеинов, в частности белокгидролизующих энзимов. Прежде всего следует указать, что протеолитические ферменты, хотя и могут иметь какие-либо особенности проникновения через кишечный барьер, в принципе являются белковыми молекулами и их всасывание является такой же сложной задачей, как и других высокомолекулярных веществ. Кишечный барьер, как известно, морфологически представляет собой плотные контакты между соседними энтероцитами, а в функциональном — дополняется наличием активных протеолитических ферментов на поверхности кишечных клеток, не позволяющих высокомолекулярным соединениям достигать щеточной каемки [32, 34, 36].
Мы попытаемся рассмотреть все существующие на сегодняшний день подходы и, взвесив все «за» и «против», охарактеризовать современное состояние проблемы, имеющей как чисто теоретический, так и практический интерес в связи с широким распространением системной энзимотерапии.
Впервые предположение о том, что протеолитические ферменты, поступающие в кишечник, могут всасываться в кровь, выдвинул русский ученый Болдырев еще в 1904 г. [35]. Впоследствии было доказано, что трипсин и другие протеолитические пищеварительные ферменты постоянно циркулируют в кровяном русле и имеют определенные биологические функции. Каким образом попадают ферменты поджелудочной железы в общий кровоток? Предполагается три основных пути: инкреторный, экскреторный, предусматривающий последующее всасывание, и экскреторно-инкреторный как компромиссный вариант.
Гипотеза об инкреции панкреатических энзимов была выдвинута Н. Janowitz, F. Hollander в 1951 г., одновременно был поднят вопрос об экскреторно-инкреторном соотношении дигестивных ферментов [75]. Авторы приводят данные о том, что около 1% пепсиногена поступает не в просвет желудка, а выделяется железами непосредственно в тканевую жидкость. Аналогичные сведения имеются и относительно ферментов поджелудочной железы (амилазы, липазы) и амилазы слюны. Показано, что наибольшая концентрация ферментов определяется в крови, оттекающей от поджелудочной железы, и при прекращении поступления сока в кишку не изменяется. Предполагается, что инкреция осуществляется в концевых отделах мелких выводных протоков, которые не имеют соединительнотканной оболочки и богато снабжены кровеносными капиллярами. Возможен также транспорт по лимфатической системе. Bartoš удалось показать, что изменения экзосекреции в большей степени коррелируют с изменениями содержания ферментов в лимфе, чем в крови [35].
Несмотря на привлекательность идеи инкреторного пути проникновения интактных протеолитических ферментов в кровь, факты, полученные в настоящее время, убедительно свидетельствуют о возможности всасывания протеиназ и других белков клетками кишечника. Основными механизмами резорбции белковых молекул в нерасщепленном виде, согласно современным представлениям, являются: 1) рецептор-опосредованный эндоцитоз (пиноцитоз); 2) пиноцитоз без наличия специфичных рецепторов к молекулам, подвергающихся всасыванию; 3) эндоцитоз через М-клетки кишечника; 4) межклеточное просачивание (парацеллюлярная диффузия); 5) персорбция [32–34, 38, 40, 64, 79, 122]. Далее мы более подробно остановимся на каждом из видов абсорбции белковых молекул (рис. 20).
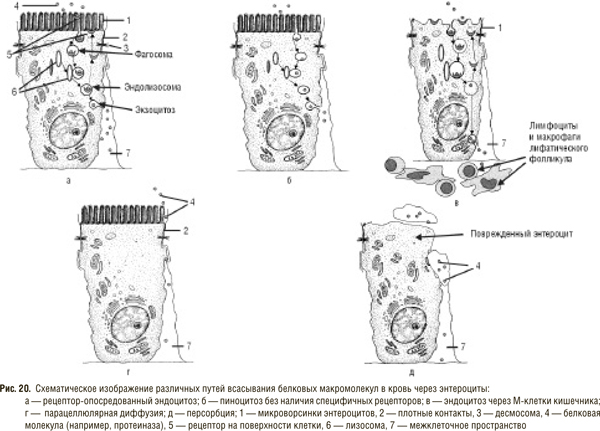
Эндоцитоз, независимо от того, в реализации каких функций он участвует, описывается как строгая последовательность событий, которая сводится к тому, что под влиянием определенного сигнала участок мембраны, находящийся в непосредственном контакте с захватываемой молекулой, инвагинируется внутрь цитоплазмы. В дальнейшем это ведет к образованию везикулы, покрытой плазматической мембраной, которая начинает двигаться по направлению к центральным структурам клетки [32, 34]. Выделяют несколько типов эндоцитоза: 1) фагоцитоз — обеспечивает поступление внутрь клетки больших структур (целые микроорганизмы, компоненты их мембраны и др.); 2) пиноцитоз — поступление во внутриклеточную среду жидких субстратов и мелких частиц (белки, липопротеиды и др.); 3) микропиноцитоз, который характеризуется образованием везикул наименьшего размера.
Особый интерес представляет процесс, при котором комбинируются эндо- и экзоцитоз. В этом случае образовавшаяся на поверхности мембраны везикула поступает в клетку путем эндоцитоза, а на другом полюсе клетки путем экзоцитоза освобождает свое содержимое. Этот процесс, определяемый А.М. Уголевым [32] как трансцитоз, обеспечивает прохождение частично или полностью интактного материала через клетку и играет исключительную роль в процессе передачи высокомолекулярных соединений через клеточные слои, в том числе через стенку кишечника. Именно таким путем обеспечивается всасывание иммуноглобулинов матери в пищеварительном тракте ребенка грудного возраста. Установлено, что у взрослых пиноцитоз (трансцитоз) не является способом усвоения белков, но может играть важную роль в связи с иммунореактивностью, приводя к сенсибилизации и развитию аллергии [32, 33, 36, 122]. Значительно увеличить эффективность пиноцитоза может наличие рецептора к молекуле, которая подвергается захвату, в чем и состоит механизм рецептор-опосредованного эндоцитоза. J. Goldstein и соавторы [64] описывают этот процесс как один из наиболее важных механизмов, с помощью которого клетки животных получают пищевые и регуляторные белки из экстрацеллюлярного пространства. Убедительно показано, что рецептор-опосредованный эндоцитоз участвует по крайней мере в 12 различных процессах интернализации макромолекул, главным образом белков, в различных типах клеток в норме и при патологии. Среди них есть и лизосомальные ферменты, которые поглощаются фибробластами и обнаруживаются в лизосомах и структурах, связанных с комплексом Гольджи, сохраняя свою активность в течение многих дней [92]. Окаемленные везикулы, в которых макромолекулы транспортируются через клетку, обнаруживаются во всех ядерных клетках животных [32, 64]. Насколько специфичны эти рецепторы по отношению к протеолитическим ферментам, необходим ли для транспорта протеиназы белок-переносчик — неизвестно.
Исследования последних лет позволили обнаружить специфичные рецепторы на энтероцитах к трипсину и, возможно, другим протеиназам. Правда, эти рецепторы не относятся к рецепторам эндоцитозного типа, а объединяются в новое семейство рецепторов, активирующихся в результате протеолиза (proteinase-activating receptor) [93, 121]. В настоящее время описано три таких рецептора — PAR-1, PAR-2 и PAR-3. Например, PAR-2 является рецептором для трипсина и представлен на поверхности интестинального эпителия, гладкомышечных клетках тонкого и толстого кишечника [89]. Окончательно не решен вопрос о последствиях, физиологических эффектах возбуждения протеиназами PAR-2. Какое значение для кишечника и всего организма имеет активация этого рецептора? Известно, что поджелудочная железа выделяет секрет не только во время приема и переваривания пищи. Периодически (каждые 20–30 мин) также отделяется несколько миллилитров сока с очень высоким содержанием ферментов [35]. Именно эти протеиназы получают возможность наиболее тесного взаимодействия с рецепторами на слизистой оболочке кишечника, так как выделяются в просвет свободного от пищи кишечника. Присутствие PAR-2 на гладкомышечных клетках желудка, толстого и тонкого кишечника, которые сокращаются под воздействием трипсина и синтетических агонистов данного рецептора, позволяет предположить, что таким образом реализуется один из механизмов регуляции моторики пищеварительного тракта [89]. Однако, зная о сложных и тесных взаимосвязях энтероцитов с пищеварительными органами (печень, поджелудочная железа) и железами внутренней секреции (островковая часть поджелудочной железы и др.), нельзя настолько ограничивать значение активации рецепторов протеиназ в кишечнике. Указанные факты позволяют предположить, что определенная часть эффектов СЭТ реализуется через возбуждение рецепторов пищеварительного тракта на энтероцитах без какого-либо дальнейшего всасывания интактных молекул. Вопрос осложняется тем, что в состав полиэнзимных смесей входят протеиназы не только животного (трипсин, химотрипсин из поджелудочной железы свиньи), но и растительного происхождения (цистеиновые протеиназы из ананаса и дынного дерева). Неизвестно, имеют ли возможность названные протеолитические ферменты растений воздействовать на рецепторы человека.
Возможность эндоцитоза (как рецептор-опосредованного, так и безрецепторного) в типичных энтероцитах взрослого человека до сих пор вызывает сомнения ученых. Более активную роль в этом процессе могут принимать так называемые микроскладчатые клетки (М-клетки) или энтероциты, ассоциированные с лимфоидными фолликулами (FAE-клетки), описанные Owen и Jones в 1974 г. [33, 40, 74]. Считается, что внутри этой сравнительно «бедной» части эпителиальной выстилки М-клетки расположены идеально с точки зрения их основной функции — абсорбции антигена (белковых молекул в том числе, возможно, и протеолитических ферментов) и передачи его лимфоцитам, макрофагам и другим клеткам подслизистого слоя кишечника (см. рис. 20в). Р. Jani и соавторы [74] исследовали абсорбцию частичек латекса размером от 50 нм до 3 мкм в диаметре и установили сравнительно быстрое поступление в слизистую оболочку кишечника крыс 26–34% от введенного перорально количества частичек. Основным путем поступления авторы считают энтероциты, связанные с лимфатическими фолликулами (пейеровыми бляшками). Известно, что протеиназы обладают чрезвычайно консервативной структурой и как следствие низкой иммуногенностью и незначительной видоспецифичностью [24]. Длительный опыт применения в клинике СЭТ массивными количествами очищенных протеиназ животного и растительного происхождения свидетельствует о том же: протеиназы, хотя и являются высокомолекулярными белковыми молекулами, не вызывают сенсибилизации иммунной системы организма при попадании в организм через кишечник [28, 38]. Введение энзимов парентерально позволяет получить антитела не к самому протеолитическому ферменту, а к комплексу ингибитор — протеиназа, который образуется в считанные секунды после поступления фермента в кровь.
Однако площадь эпителия, покрывающего пейеровы бляшки, составляет всего несколько процентов от общей площади слизистой оболочки кишечника и, по мнению С. Kolac и соавторов [79], поступление протеиназ через М-клетки не может объяснить попадание в кровоток более 10% от введенной в кишечник дозы фермента.
Следующий механизм всаcывания белков — парацеллюлярная диффузия (или межклеточное просачивание) — длительное время считался маловероятным из-за наличия плотных контактов между энтероцитами. Исследования, проведенные С. Kolac и соавторами [79], на монослое энтероцитов карциномы ободочной кишки человека (клеточная линия Caco-2), которые считаются морфологически и биохимически аналогичными нормальным энтероцитам тонкого кишечника, позволяют как минимум усомниться в невозможности такого пути проникновения протеолитических ферментов, но не всех остальных белков. Авторы утверждают, что именно протеолитические ферменты обладают исключительным свойством проникновения через энтерогематический барьер за счет механизма самоусиливающейся (self-enhanced) парацеллюлярной диффузии. Меченные флюоресцеином (флюоресцирующим изотиоционатом — FITC) протеиназы (трипсин, бромелаин, папаин и химотрипсин) проникали через монослой Caco-2, уменьшая при этом трансэпителиальное электрическое сопротивление, что свидетельствует об открытии межэндотелиальных щелей. Параллельно нарастала и флуоресценция в базолатеральном компартменте камеры. Протеиназы способствовали также проникновению других высокомолекулярных соединений — FITC-меченых декстранов с молекулярной массой от 4,4 до 580 кДа, которые также проникали через монослой Caco-2 после предварительного воздействия протеолитических ферментов. Авторы полагают, что данный феномен нельзя объяснить повреждением клеток кишечного эпителия, так как через некоторое время (~ 100 ч) клетки полностью восстанавливают трансэпителиальное электрическое сопротивление и продолжают оставаться жизнеспособными. Таким образом, часть протеолитических ферментов может проникать через стенку кишечника путем парацеллюлярной диффузии. Однако не следует забывать, что Caco-2 — линия опухолевых клеток и что их проницаемость, абсорбционные и репаративные способности могут значительно отличаться от показателей нормальной слизистой оболочки в естественных условиях. Кроме того, поступление под действием протеиназ веществ с молекулярной массой 580 кДа во внутреннюю среду организма через типичные энтероциты на протяжении всего кишечника не может рассматриваться как физиологическое, оно неминуемо сопровождалось бы бурной реакцией со стороны иммунной системы при каждом приеме пищи, чего на самом деле не происходит.
В то же время обратное всасывание собственных протеолитических ферментов с последующим повторным использованием имеет определенную биологическую целесообразность. По расчетам Nasset (1965), в сутки человек выделяет в кишечник более 100 г белка, большую часть которого составляют протеины пищеварительных соков (проферменты, ферменты, пептидные фрагменты проферментов), меньшую — мукопротеины и белки отторгнутых клеток [35]. Объем сока поджелудочной железы составляет 700 мл/сут, содержание в нем белка колеблется от 1 до 10%. Таким образом, с секретом поджелудочной железы человек может потерять до 50 г активных протеолитических ферментов в сутки, если учесть, что 72% от общего количества белка в соке поджелудочной железы составляют именно протеиназы [38]. Такое расточительство едва ли возможно в природе. Поэтому логичной представляется гипотеза о наличии своеобразного консервационного механизма — энтеропанкреатической циркуляции [65]. Проведенные Н. Gцtze и S. Rothman эксперименты заключались в следующем. Меченный I125 трипсин вводили в дистальный отдел двенадцатиперстной кишки кролика и через 20 мин до 1% введенного трипсина (высокомолекулярного вещества с радиоактивной меткой) определяли в секрете поджелудочной железы. Последующие исследования позволили установить, что от 13 до 38% меченого трипсина определяется затем в панкреатическом и билиарном секрете [47, 80]. Каким образом трипсин попадает обратно в пищеварительные железы и каким образом клетки поджелудочной железы его захватывают, остается загадкой. Спорным является и вопрос о том, попадают ли протеиназы в кровоток или после всасывания в тонком кишечнике диффундируют по направлению к поджелудочной железе и печени.
Последний из известных видов транспорта макромолекул — персорбция (Volkheimer, 1960) — реализуется по отношению к твердым частичкам, которые проникают через кишечный барьер в местах десквамации энтероцитов, через временно образующиеся промежутки эндотелиальной выстилки пищеварительного тракта [33, 38]. Таким образом могут проникать достаточно крупные частички размером от 3 до 100 мкм (размер белковых молекул протеолитических ферментов не превышает в диаметре 10–20 нм), однако количество абсорбированных частиц не превышает одной тысячной части от введенного в кишечник количества. По всей видимости, этот путь не имеет существенного значения для всасывания протеиназ.
Для доказательства возможности резорбции и количественного определения энзимов в общем кровотоке, т.е. эффективности всасывания используют различные методы определения активности протеиназ в сыворотке крови после перорального их применения. К сожалению, чувствительность этих методов часто не совпадает с их объективностью. Так, иммунологические методы позволяют определять менее одного процента (1/1000 часть) от введенной дозы препарата ферментов, энзиматические — указывают на всасывание 1–10% дозы, радиохимические — более 10% [29, 38, 79]. Причем, по данным разных авторов, применявших радиоактивную метку, количество определяемого в плазме крови фермента колеблется от 0,003 до 40%, что не может не вызывать удивления. Проведению иммунологических методов препятствуют непреодолимые на сегодняшний день трудности, основной из которых является маскировка антигенных детерминант протеиназ после связывания с белками-ингибиторами протеолитических ферментов плазмы крови. Более надежными являются энзимологические методы с применением субстратов различной специфичности, позволяющие определять в кровотоке активные протеиназы, даже если они находятся в комплексе с α2М — рестриктором их активности [13, 18, 38].
Суммируя приведенные сведения, можно заключить, что:
1) протеиназы, как и другие высокомолекулярные соединения, имеют несколько путей всасывания без нарушения нативной структуры и потери активности. Наиболее важным механизмом резорбции протеолитических ферментов следует признать рецептор-опосредованный эндоцитоз;
2) протеолитические ферменты благодаря возможности воздействия на структуры клеточной стенки и собственной устойчивости к протеолитическому расщеплению имеют ряд преимуществ по отношению к другим белковым молекулам, что облегчает их резорбцию из кишечника;
3) проблема всасывания протеиназ не может считаться окончательно решенной, так как остаются неизвестными структура рецепторов на поверхности энтероцитов, тонкие механизмы внутриклеточного транспорта протеиназ, предотвращения их расщепления в энтероците, передачи (экзоцитоза) ферментов в кровь или лимфу на базальной мембране кишечных клеток. Однако имеющиеся данные о повышении специфической протеолитической активности в сыворотке крови после перорального введения ферментов и их комбинаций свидетельствуют о всасывании неизмененных макромолекул энзимов в кровь с возможным последующим участием резорбированных ферментов в регуляции активности эндогенных протеолитических систем организма.
Исследование протеолитической активности в сыворотке крови животных после перорального введения препаратов СЭТ (К.Н. Веремеенко, А.И. Кизим, В.Е. Досенко, А.И. Терзов)
Важнейшая проблема СЭТ — оценка количества перорально вводимых протеиназ в циркулирующей крови, которая богата ингибиторами протеиназ. Системный эффект ферментов может быть достигнут при условии наличия в кровотоке эффективной концентрации энзима после его всасывания из кишечника. Исследование каталитического действия адсорбированных протеиназ в крови имеет не только теоретическое значение, но и представляет большой интерес для практической медицины в целях обоснования применения ферментов в клинике.
Для количественного определения в крови полиэнзимных препаратов использовались различные методические подходы: радиоизотопные, иммунологические и ферментативные. Первые исследования были проведены около 40 лет тому назад. Большинство работ по этому вопросу было выполнено с применением радиоактивных меченых ферментов, полученных путем йодирования белков I131. В 1957 г. J. Martin и соавторы [86] выявили радиоактивный трипсин в плазме крови после защечного введения фермента. J. Miller и соавторы [88] опубликовали данные о том, что при пероральном введении меченного I131 трипсина людям в сыворотке крови обнаруживалось около 3–7% исходной радиоактивности. Авторы полагали, что она принадлежит меченому трипсину. Аналогичные исследования были проведены с меченным I131 химотрипсином, который вводили в кишечник крысы. В сыворотке крови обнаружена радиоактивность, которая связана с белками [90].
Были проведены работы по выяснению всасывания не только сериновых протеиназ, но и растительной протеиназы (бромелаина) с помощью радиоактивного I125. S. Seifеrt и соавторы [104] выявили радиоактивность у крыс после внутридуоденального введения бромелаина, которая составляла ~ 40% от введенной дозы. Позднее эти авторы изучили количественное распределение трипсина, химотрипсина, папаина и панкреатина в крови и лимфе после их введения в желудок крыс через зонд. Меченные I125 ферменты обнаружены в крови и лимфе с помощью радиохроматографических методов. Результаты исследований показали, что 26% трипсина, 14% химотрипсина, 18% панкреатина и 6% папаина резорбируются из кишечника в кровь. Выявлена также радиоактивность на краях ран поврежденной кожи.
По данным R. White и соавторов [124], при введении бромелаина, меченного йодом, в плазме крови крыс обнаруживается лишь 0,003% от применяемой дозы.
Результаты этих работ свидетельствуют, что применение меченых ферментов для исследования их содержания в циркулирующей крови имеет недостаток: меченные радиоактивным йодом протеиназы могут разрушаться в кишечнике и крови, образуя при этом I131 и свободный энзим или его фрагмент. Поэтому данным методом определяются также и продукты распада белка-фермента, а также другие вещества, присоединившие метку после ее освобождения. Кроме того, за потенциально активный фермент можно принять необратимо инактивированный в крови и тканях. Необходимо также учитывать возможность химической модификации ферментов во время йодирования, при которой не исключается потеря их активности.
В последние годы для доказательства всасывания перорально вводимых ферментов используют иммунологические методы (в частности, иммуноферментный анализ — ИФА), которым присуща высокая чувствительность. Количественное определение адсорбированного бромелаина в плазме крови после перорального введения фермента (по 3 таблетки 5 раз в сутки на протяжении 2 дней и 1 таблетка на 3-й день) провел на 19 добровольцах J. Castel [54], используя метод твердофазного иммуноферментного анализа с флуорогенным субстратом. Выявлены значительные вариации уровня фермента. Наибольшее содержание бромелаина (5 нг/мл) обнаружено в среднем через 48 ч после введения. Однако автор не изучал концентрацию бромелаина в плазме крови после внутривенного введения, что необходимо для расчета количества бромелаина, всосавшегося в кровь. По данным автора, общее содержание энзима в крови испытуемого составляло 10,3 мкг, что свидетельствует о незначительном количестве, которое поступило в системный кровоток из кишечника (общая доза введенного препарата — 8,6 г).
Несмотря на высокую чувствительность иммуноферментного метода с его помощью можно определять иммунореактивный белок или его фрагмент, а не специфическую энзиматическую активность. По имеющимся данным [79], иммуногенные детерминанты энзимов «прикрываются» антипротеазами крови и поэтому не могут определяться с помощью антител. Кроме того, метод ИФА позволяет определять как активный фермент, так и не обладающий каталитической активностью (в соединении с ингибитором).
В связи с вышеизложенным нам представляется, что наиболее весомые доказательства всасывания в кровь из кишечника интактных белковых молекул могут быть получены при использовании энзимологических методов количественного определения активности перорально вводимых энзимов. С этой целью были предприняты многочисленные исследования с использованием белковых и синтетических субстратов.
Первые данные о повышении казеинрасщепляющей активности в сыворотке крови после перорального введения кислотоустойчивых таблеток бромелаина опубликованы J. Miller и A. Opher в 1964 г. [87]. Однако в работе отсутствовали данные о количестве обнаруженного фермента. В 1974 г. Neuhold сообщил о результатах изучения протеолитической активности сыворотки добровольцев после перорального приема 4 таблеток комбинированного препарата вобэ-мугос Е каждые 3 ч. Определение активности проводили на агаровых пластинках, содержащих крахмал, казеин и гемоглобин. Обнаружено повышение ферментативной активности в сыворотке крови в зависимости от используемого субстрата на 20–30% по сравнению с исходной. Максимум активности отмечен через 1,25 ч после введения полиэнзимной смеси, которая практически не изменялась на протяжении 7,5 ч. В 1996 г. М. Kleinе и W. Schaik [102] для изучения адсорбции перорально вводимого препарата вобэнзим (доза составляла 12,5 г) у людей исследовали протеолитическую активность сыворотки крови с помощью белковых пластин на протяжении 26 ч с интервалами взятия крови каждые 2 ч. Выявлены индивидуальные колебания активности фермента. Через 2 ч после начала опыта активность ферментной смеси повышалась примерно на 10%, затем через 4 ч резко снижалась и опять несколько возрастала спустя 8 ч после введения препарата. Через 24 ч активность соответствовала исходной. Эти же авторы провели аналогичные исследования на 12 добровольцах, которым назначали флогэнзим в дозе 1, 2 и 4 таблетки. Забор крови осуществляли до приема лекарства и спустя 1, 2, 4, 6, 10, 12 и 14 ч после его применения. При этом в сыворотке крови определяли протеолитическую активность с помощью гемоглобина. Как показали наблюдения, активность значительно варьировала у отдельных индивидуумов: после приема 1 таблетки максимальная активность обнаруживалась у большинства испытуемых через 8 ч, при приеме 2 и 4 таблеток наблюдали два пика активности — через 4 и 8 ч. Не удалось обнаружить дозозависимого нарастания протеолитической активности. Степень повышения активности не превышала 15–20% по отношению к исходному уровню. Так как в условиях опыта время ферментативной реакции составляло 48 ч, следует признать низкую чувствительность предложенного метода определения протеолитической активности по расщеплению гемоглобина. Поэтому авторы заключили, что необходима разработка новых методов определения активности перорально вводимых ферментов в сыворотке крови.
Следует подчеркнуть, что использование высокомолекулярных белков для определения протеолитической активности крови после перорально вводимых энзимных смесей мало перспективно, поскольку поступающие из пищеварительного тракта ферменты мгновенно связываются с белковыми ингибиторами, в основном α1ИП и α2М. Первый из них полностью блокирует фермент, а α2М образует с протеиназами комплекс, обладающий низкой протеолитической активностью при гидролизе белковых субстратов [14]. По нашим данным, активность комплексно связанного трипсина с α2М в отношении гемоглобина и казеина составляет всего 5–7% от исходной [37].
Для обнаружения в циркулирующей крови протеиназ, применяемых перорально, предпочтительнее использовать низкомолекулярные синтетические субстраты, имеющие доступ к активному центру фермента, связанного с α2М. Первые попытки применения синтетического субстрата (N-ацетил-L-тирозин этилового эфира — АТЭЭ) для обнаружения в крови перорально вводимого химотрипсина были сделаны S. Avakian [44]. Несмотря на некоторое повышение эстеразной активности в крови дозозависимого эффекта не было получено. Позднее J. Ambrus и соавторы [39], использовавшие для определения перорально вводимых трипсина БАПНА, а химотрипсина — АТЭЭ, не обнаружили перекрестной активности исследуемых протеиназ. Однако использование этих субстратов не дает полной информации об адсорбции перорально применяемых протеиназ ввиду их низкой чувствительности. Метод определения трипсина в сыворотке крови с помощью синтетического субстрата ТАМЭ позволяет выявлять фермент только при наличии в сыворотке крови больших концентраций трипсина (600 мкг/мл), т.е. количеств, которые в значительной степени нейтрализуют потенциальную антитриптическую активность.
Приведенные данные свидетельствуют о необходимости синтеза новых синтетических субстратов, позволяющих раздельно определять сериновые и цистеиновые протеиназы. Недавно предложен микрометод определения свободных тиоловых протеиназ растельного происхождения, который требует апробации при исследовании ферментов в сыворотке крови [63].
Важные данные о резорбции энзимов получены Rootsova (1997), который изучал концентрацию (с помощью иммуноферментного анализа) и протеолитическую активность трипсина и бромелаина в плазме крови после перорального введения различных доз флогэнзима. Обнаружено дозозависимое увеличение концентрации энзимов, однако она была незначительной, составляя 2–4 нг/мл плазмы.
Обобщая имеющиеся результаты исследований, можно отметить, что используемые до настоящего времени методы определения протеолитической активности в сыворотке крови с помощью белковых и синтетических субстратов не позволяют количественно оценить резорбцию перорально вводимых протеолитических смесей.
Разработан высокочувствительный метод определения трипсина в сыворотке крови после парентерального введения фермента [12]. Метод основан на использовании низкомолекулярного белка — протамина сульфата, в котором содержится в основном аргинин. Он позволяет определять нанограммовые количества трипсина в присутствии избытка ингибиторов протеиназ в сыворотке крови. Как показали опыты in vitro, этот субстрат с большой скоростью расщепляется также бромелаином и папаином [17]. Метод позволяет определять десятые доли мкг указанных цистеиновых протеиназ. Это послужило основанием для использования предложенного протаминового теста для количественного определения в сыворотке крови применяемых перорально полиэнзимных препаратов. Нами была изучена ПРА в сыворотке крови кроликов в различные сроки после перорального введения им препаратов флогэнзим и вобэ-мугос Е. Для количественной оценки резорбции экзогенно вводимых ферментов исследовали ПРА в сыворотке крови животных после внутривенного введения им препарата вобэ-мугос Е (в ампулированной форме) и входящих в его состав цистеиновых протеиназ.
Опыты проведены на 15 кроликах обоего пола породы шиншилла (средняя масса тела составила 2,6 кг). Препараты применяли перорально в дозе, соответствующей суточной среднетерапевтической для человека, — 9 и 6 таблеток соответственно. Ежедневно утром натощак с помощью желудочного зонда кроликам вводили 43,2 мг флогэнзима и 72,8 мг вобэ-мугоса Е (на 1 кг массы животного). После введения капсулы в желудок через тот же зонд вливали 4 мл воды и не кормили животных в течение 30 мин. Продолжительность эксперимента составляла 6 сут, в течение которых проводили ежедневное одноразовое введение препаратов. Кровь брали из вены уха кролика до и в различные сроки после введения препаратов — 2, 4 ч и 1–6 сут. Для внутривенного введения использовали препарат вобэ-мугос Е в ампулированной форме. Содержимое ампулы растворяли в 2 мл стерильной воды для инъекций и медленно вводили со скоростью 0,2 мл/мин в вену уха. Папаин и бромелаин в дозе 6 мг вводили аналогичным образом. Кровь получали из вены уха до инъекции и в разное время после нее — через 5, 15, 30, 120 и 1440 мин.
Объектом исследования служила сыворотка крови животных, которую получали путем центрифугирования крови при 3000 об/мин в течение 15 мин. ПРА сыворотки крови определяли по разработанному нами методу и выражали в ммоль аргинина за 1 мин на 1 л. Содержание 1ИП определяли по способности сыворотки подавлять гидролиз БАПНА трипсином [13]. Уровень 2М определяли энзиматическим методом, основанным на способности этого белка образовывать активный комплекс с трипсином, расщепляющий БАПНА и не чувствительный к ингибитору трипсина из соевых бобов (в г/л).
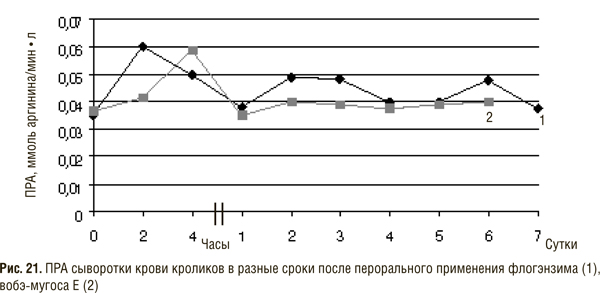
Результаты опытов, в которых определяли протеолитическую активность в сыворотке крови кроликов после перорального введения им полиэнзимных препаратов, приведены на рис. 21.
Через 2–4 ч после введения препаратов ПРА сыворотки крови повышается по сравнению с исходной, затем постепенно снижается, не достигая исходного уровня. В последующие сроки (2–6 сут) ПРА повышалась, хотя и в меньшей степени, чем через 2 ч после первого введения. Максимальная ПРА после перорального введения флогэнзима была выше, чем после введения вобэ-мугоса Е. Это можно объяснить тем, что в состав последнего входит папаин, который по сравнению с бромелаином (входящим в флогэнзим) с меньшей скоростью гидролизует протамина сульфат.
Для выяснения вопроса о том, какая доза введенных полиэнзимных смесей поступает в кровь, были проведены опыты, в которых вобэ-мугос Е внутривенно вводили кроликам, после чего определяли ПРА и ингибиторы протеиназ в разное время: от 5 мин до 1 сут (рис. 22). Результаты сопоставляли с таковыми, полученными после перорального введения таблеток вобэ-мугос Е.
Максимальная протеолитическая активность сыворотки крови обнаруживается спустя 5 мин после внутривенного введения вобэ-мугоса Е. ПРА индивидуально варьировала. Она превышала исходную величину у разных кроликов в 13,6–24,5 раза. Спустя 30 мин активность снижалась в среднем на 50% (колебания от 33 до 72%), а через 24 ч приближалась к исходной.
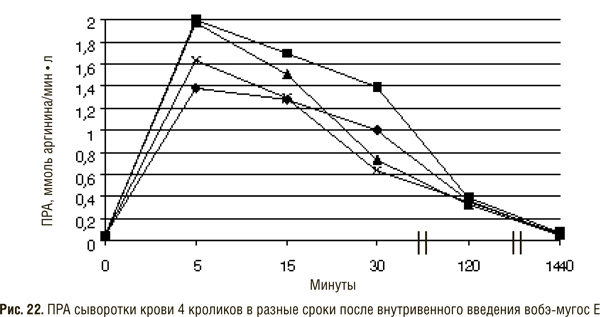
Протеолитическую активность сыворотки крови животных в разные сроки после введения определяли также с помощью казеина и БАПНА, которые, как было показано нами ранее, быстро расщепляются свободными ферментами и содержащимися в комбинированном препарате вобэ-мугос Е. Результаты исследований показали, что эти субстраты не гидролизировались протеиназами даже при максимальной активности сыворотки, определяемой с помощью протаминового теста. Это свидетельствует о низкой чувствительности этих субстратов к действию протеолитических ферментов сыворотки крови по сравнению с предложенным нами низкомолекулярным аргининсодержащим протамином. Расчеты показали, что при пероральном введении вобэ-мугоса Е в сыворотке крови можно выявить примерно 3% ПРА от таковой, определяемой после внутривенного введения.
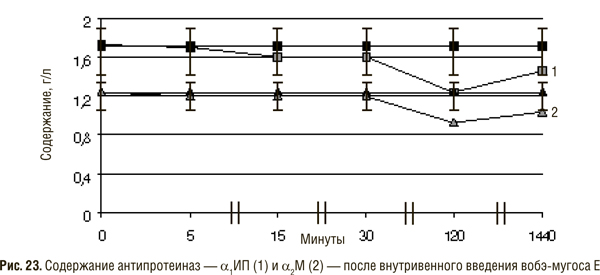
Результаты исследований содержания антипротеазных белков в сыворотке крови после внутривенного введения вобэ-мугоса Е (рис. 23) свидетельствуют о снижении уровня α2М и α1ИП.
В эксперименте изучали ПРА в сыворотке крови животных, которым внутривенно вводили отдельные протеиназы, входящие в состав препаратов СЭТ: папаина и бромелаина (рис. 24).
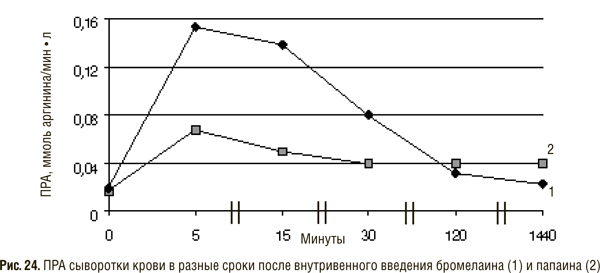
Максимальный уровень активности бромелаина и папаина обнаруживался через 5 мин, как и в опытах с комбинированным препаратом вобэ-мугос Е, причем первый превышал исходную величину в 8 раз, а второй — в 3,7 раза. Через 30 мин ПРА быстро снижалась, особенно после внутривенного введения бромелаина. Активность папаина снижалась в меньшей степени.
Максимальная ПРА сыворотки крови после внутривенного введения вобэ-мугоса Е составляла в среднем 1,76, а папаина — 0,067 ммоль аргинина/мин•л, т.е. часть выявляемой активности папаина незначительна — примерно 3,8% от суммарной ПРА полиэнзимного препарата. Основная же часть ПРА принадлежит, по-видимому, сериновой протеиназе трипсину, который с наибольшей скоростью расщепляет протамин.
Таким образом, полученные данные указывают на то, что с помощью предложенного протаминового метода удается выявить в сыворотке крови животных протеолитическую активность перорально и внутривенно вводимых полиэнзимных смесей и отдельных ферментов, входящих в их состав. Максимальная ПРА обнаруживается через 2 и 4 ч соответственно после перорального введения препаратов флогэнзим и вобэ-мугос Е. Обычные белковые субстраты, используемые для определения активности (казеин, БАПНА), в этих условиях не расщепляются протеиназами сыворотки. Если принять максимальную активность в сыворотке после внутривенного введения препарата вобэ-мугос Е за 100%, то обнаруживаемая активность после перорального введения составляет примерно 3%, т.е. существует резорбция, хотя и в небольших количествах, в кровь интактных энзиматически активных форм фермента.
Удаление протеолитических ферментов из циркулирующей крови происходит быстро: время полувыведения при внутривенном введении составляет ~ 30 мин, что приближается к величинам, установленным для активной формы α2М. Полученные результаты указывают на то, что обнаруживаемая протеолитическая активность присуща комплексу протеиназа — α2М.
Установлен параллелизм между повышением ПРА и снижением уровня α2М и 1ИП после внутривенного введения комбинированных протеиназных препаратов. Это можно объяснить как убыль ингибиторов для связывания с протеиназами, комплексы которых быстро удаляются из кровеносного русла с помощью эндоцитоза макрофагами и фибробластами.
Полученные данные углубляют наши представления о биохимических механизмах СЭТ, в частности о возможности каталитического действия протеолитических ферментов в условиях избытка сывороточных ингибиторов протеиназ. Предложенный метод определения протеолитической активности может быть использован для изучения фармакокинетики протеазных смесей и оптимизации способов применения перорально вводимых ферментных комбинаций в клинической практике.