Профилактика и лечение остеопороза
Содержание
- 4.1. Профилактика остеопороза
- 4.1.1. Коррекция диеты по достаточному содержанию кальция, фосфора, белка, микроэлементов, витаминов
- 4.1.2. Заместительная гормональная терапия
- 4.1.3. Физическая нагрузка
- 4.1.4. Профилактика травм
- 4.2. Основные принципы лечения остеопороза
- 4.3. Кальций, его препараты. Клиническая эффективность Кальцемина и Кальцемина адванс
- 4.3.1. Состав Кальцемина и Кальцемина адванс
- 4.3.2. Значение препаратов кальция (Кальцемина и Кальцемина адванс) в травматологической практике
4.1. Профилактика остеопороза
Целью профилактики является сохранение массы и плотности костной ткани и, таким образом, предотвращение развития переломов, улучшение долговременного прогноза. Первичную профилактику остеопороза проводят в период интенсивного роста, беременности, лактации, в пременопаузальный и менопаузальный период. Она необходима для пациентов, которые относятся к группам риска развития остеопороза, а также предусматривает выявление этих групп риска, проведение обследования. Вторичная профилактика необходима для уменьшения потери массы костной ткани после развития менопаузы, в период длительной иммобилизации, лечения ГК, другими лекарственными средствами, во время заболеваний и состояний, сопровождающихся развитием остеопении. Третичная профилактика проводится у лиц, которые уже перенесли переломы.
Средства профилактики остеопороза включают:
- Коррекцию диеты по достаточному содержанию кальция, фосфора, белка, микроэлементов, витаминов, антиоксидантов;
- Заместительную терапию эстрогенами;
- Физическую нагрузку, лечебную физкультуру, массаж;
- Регулярное пребывание на солнце;
- Отказ от употребления крепких алкогольных напитков, курения;
- Профилактику травм.
Проведение профилактики обходится значительно дешевле, чем лечение остеопороза. Общей профилактикой должны быть охвачены лица, относящиеся к группам риска, люди зрелого возраста. Достаточное употребление кальция и витамина D считается одним из наиболее адекватных средств профилактики остеопороза. Профилактическими мероприятиями считаются своевременная диагностика и адекватное лечение заболеваний, сопровождающихся развитием вторичного остеопороза. Профилактика остеопороза у пациентов, длительно принимающих КС, должна включать гормональные препараты в минимально эффективных дозах, прием комплексов кальция с витамином D и микроэлементами.
4.1.1. Коррекция диеты по достаточному содержанию кальция, фосфора, белка, микроэлементов, витаминов
Как указано ранее, результаты исследований, проведенных в Институте геронтологии АМНУ (Поворознюк В.В. и соавт., 1999; 2001; Поворознюк В.В., Григорьева Н.В., 2002), свидетельствуют, что рацион украинской популяции является дефицитным по многим пищевым веществам. В частности, содержание в суточном рационе женщин старшего возраста белков растительного и животного происхождения значительно ниже рекомендованного. Имеющийся дисбаланс за счет уменьшения количества животных белков (незаменимых аминокислот) отрицательно сказывается на состоянии костной ткани. Исследователями установлено, что содержание в рационе жиров растительного происхождения также ниже рекомендованного. По их данным, имеется прямая зависимость между уровнем потребления растительных жиров и индексом прочности костной ткани. Люди пожилого и старческого возраста недостаточное потребление белков и жиров растительного происхождения компенсируют избыточным потреблением углеводов, что отрицательно сказывается на структурно-функциональном состоянии костной ткани. Авторы установили обратную зависимость между уровнем потребления углеводов и индексом прочности костной ткани. Отмечается высокий уровень потребления населением холестерина. Ниже рекомендованного в суточном рационе женщин различного возраста уровень основных макроэлементов — кальция, фосфора и магния. Негативно сказывается на состоянии костной ткани нарушение в рационе питания женщин старшего возраста соотношения между уровнями кальция, магния, фосфора. Исследователи выявили, что содержание кальция превышает 1000 мг в рационе только у 3,2% женщин. У населения старшего возраста потребление кальция составляет 42% рекомендованного уровня. Люди старшего возраста недостаточно потребляют и продукты, содержащие витамин D. Исследователи отмечают, что на фоне хронической кальциевой недостаточности возможно развитие парадоксального эффекта витамина D — ухудшения показателей структурно-функционального состояния костной ткани, усиления резорбции кости. Недостаток витамина D в организме (судя по уровню 25-ОН-D3 в сыворотке крови) — частое явление среди жителей Украины и большинства зарубежных стран. Его дефицит отмечается как у людей зрелого, так и молодого возраста. В суточном рационе людей старшего возраста снижено содержание микроэлементов цинка и меди (Поворознюк В.В. и соавт., 1999). Питание у большей части населения Украины нерациональное, разбалансированное, полидефицитное за счет нехватки микронутриентов: витаминов, макро- и микроэлементов. Возникновение дефицита витаминов у жителей Украины обусловлено ухудшением качества питания, питьевой воды, воздуха, широким использованием различных медикаментозных средств, психоэмоциональной перегрузкой, неблагоприятной экологической ситуацией в стране, повышенным радиационным фоном, вредными условиями труда. Эти негативные явления сопровождаются нарушениями физического состояния людей, в том числе состояния костной ткани, повышением общей заболеваемости, уменьшением средней продолжительности жизни (снижение МПКТ на 1SD повышает риск преждевременной смерти, не связанной с остеопоротическими переломами, на 40% в течение последующих 2 лет (Browner W.S. et al., 1993)). Учитывая то, что профилактика остеопороза с применением пищевых продуктов, богатых кальцием, не оправдала ожиданий в полной мере (Поворознюк В.В., Григорьева Н.В., 2002), адекватным является назначение препаратов кальция в комбинации с витамином D и микроэлементами.
Последние годы исследователи придерживаются концепции пожизненной профилактики остеопороза. Адекватное потребление кальция необходимо начинать с периода созревания скелета для достижения максимально возможной костной массы. После начала менопаузы необходим прием препаратов кальция для замедления потери костной массы. В соответствии с имеющимися оценками, потребление кальция и у мужчин, и у женщин до наступления менопаузы должно составлять 1000 мг/сут, у женщин после менопаузы — 1500 мг/сут. Чтобы достигнуть такого уровня, большинство женщин должны принимать (дополнительно к кальцию, поступаемому с пищей) 500–1000 мг кальция в сутки. B.L. Riggs, S. Khosla (1996) считают, что при остеопорозе к употреблению 1000 мг кальция с пищей следует добавлять 1000–1500 мг элементарного кальция в сутки. Рекомендуемые в США нормы потребления кальция составляли 1200 мг/сут для детей и подростков в период роста скелета и 800 мг — для взрослых. Однако ранее принятая норма потребления кальция 800 мг/сут сегодня считается недостаточной: при таком уровне потребления развивается отрицательный баланс кальция у 1/3 обследованных (Riggs B.L., Khosla S., 1996). Баланс становится положительным при поступлении в организм 1200 мг кальция в сутки. R. Heaney (1991) считает, что рекомендуемые нормы потребления кальция должны составлять 1500 мг/сут для подростков, 1000 мг/сут для женщин в предменопаузальный период и 1500 мг/сут после менопаузы. В пожилом возрасте из-за нарушения всасывания кальция, вторичного гиперпаратиреоза, усиления метаболизма костной ткани для поддержания баланса кальция необходимо большее его поступление с пищей, чем взрослым людям молодого возраста. Результаты исследования (Heaney R., 1991) свидетельствуют, что употребление кальция с пищей у людей пожилого возраста снижено. С возрастом всасывание кальция в тонком кишечнике снижается, при этом снижение всасывания наиболее выражено у людей с остеопорозом. У людей пожилого возраста также повышена потребность в витамине D: они нуждаются в ежедневном поступлении дополнительно 800 МЕ (20 мкг)/сут (Heaney R., 1991).
4.1.2. Заместительная гормональная терапия
Эстрогены ингибируют костную резорбцию, умеренно увеличивают костную массу, снижают риск развития переломов позвоночника, бедра и костей запястья. Они наиболее эффективны для профилактики постменопаузального остеопороза, а также полезны для лечения уже возникшего остеопороза. По мнению У. Клаттера (1995), профилактика остеопороза предпочтительнее его лечения, ибо никакая терапия не способна заметно увеличить костную массу. Уже в самом начале менопаузы следует оценить факторы риска развития остеопороза, определить костную массу. Если она ниже нормы для лиц данного пола и возраста, то рекомендуется проведение профилактики. Всем женщинам с ранней менопаузой при отсутствии противопоказаний рекомендована заместительная терапия эстрогенами. Это лечение препятствует резорбции костей, замедляет потерю костной массы, снижает риск возникновения переломов. Лечение начинают сразу же после наступления менопаузы для замедления развития быстрой фазы резорбции костей, хотя эстрогены могут быть эффективны и в возрасте 70 лет. Оптимальная длительность лечения, по мнению автора, должна составлять не менее 10 лет. У женщин с преждевременной менопаузой терапию следует проводить до момента ее наступления в норме (возраст 50 лет).
Сегодня в мире насчитывается несколько десятков миллионов женщин, которые принимают в постменопаузальный период препараты ЗГТ. В странах Европы ЗГТ получают от 20 до 40% женщин, нуждающихся в ней (Клаттер У., 1995). ЗГТ эффективно купирует проявления климактерического синдрома (приливы жара, тахикардию, потливость, перепады артериального давления, нарушения сна и др.). Важнейшим показанием к проведению ЗГТ является профилактика остеопороза, остеопоротических переломов в постменопаузальный период (риск переломов снижается на 34%) (Клаттер У., 1995). ЗГТ также тормозит прогрессирование дегенеративных изменений в суставах, снижает частоту развития коксартроза, гонартроза (дефицит эстрогенов обусловливает развитие остеоартроза). Эстрогены влияют (опосредованно) на гемостаз, снижают активность антитромбина III, ускоряют процессы фибринолиза, снижают (на 50–80%) риск возникновения ишемической болезни сердца, рецидивов инфаркта миокарда (Клаттер У., 1995). ЗГТ снижает риск развития рака прямой и ободочной кишки (в среднем на 37%), болезни Альцгеймера (Клаттер У., 1995). Позднее начало ЗГТ — через 10 и более лет после наступления менопаузы — повышает риск развития сердечно-сосудистых заболеваний.
При применении эстрогенов необходимо регулярно осматривать молочные железы, ежегодно проводить маммографию. В случае возникновения маточного кровотечения проводят биопсию эндометрия.
К абсолютным противопоказаниям к назначению эстрогенов относят:
- наличие в анамнезе рака молочной железы или эндометрия;
- маточные кровотечения неясной этиологии;
- повторные тромбоэмболии;
- острые заболевания печени.
Относительные противопоказания:
- фиброзно-кистозная мастопатия;
- эндометриоз;
- фибромиома матки;
- наличие в семейном анамнезе рака молочной железы.
К побочным эффектам относят повышение плотности молочной железы, менструальные кровотечения, болезненность молочных желез, тошноту, избыточную массу тела. Комбинированная эстроген-прогестагеновая терапия положительно влияет на костную массу, но ее длительное применение ограничивают побочные эффекты. Представленные на VI Европейском конгрессе по менопаузе, состоявшемся в 2003 г., данные (Кошевая А., Мухайндли О., 2003) о результатах длительного применения тиболона свидетельствуют, что это препарат первого выбора в лечении и профилактике климактерических расстройств и остеопороза у женщин в постменопаузальный период (Поворознюк В.В., Григорьева Н.В., 2002; Поворознюк В.В., 2003).
При применении эстрогенов рекомендуется (в целях защиты эндометрия) применять гестагены в циклическом или непрерывном режиме. Селективное действие, распространяющееся на эндометрий и проявляющееся антипролиферативным, защитным эффектом, оказывает диеногест (Липелис Г., 2003). Он не уменьшает положительного влияния эстрогенов на органы и системы, обладает антирезорбтивным действием на костную ткань. Таким образом, вместе с эстрогенами диеногест проявляет мощный противоостеопоротический эффект. Диеногест оказывает антиандрогенное действие, улучшает состояние кожи, волос, положительно влияет на жировой и углеводный обмен (он снижает уровень ИПФР), вызывает апоптоз раковых клеток молочной железы. Диеногест в комбинации с эстрогеном (эстадиола валератом) назначают в целях устранения климактерических симптомов.
Применяют также другие комбинации гестагенов и эстрогенов.
4.1.3. Физическая нагрузка
Физические упражнения стимулируют костеобразование и ингибируют резорбцию костей (мышечная нагрузка стимулирует активность остеобластов). Мышечная сила является важным компонентом здорового состояния скелета, ее снижение обусловливает изменение осанки, ухудшение состояния нижних конечностей. Сохранению костной массы способствуют физические упражнения, регулярные прогулки, сопровождающиеся нагрузкой на кости скелета, по 1 ч 3 раза в неделю (Клаттер У., 1995). За счет улучшения мышечной силы и координации движений физические упражнения снижают вероятность и тяжесть падений. Эффективны упражнения как с дополнительной нагрузкой, так и без нее. Поддерживают и улучшают состояние костей упражнения с гантелями, гирями, а также другие упражнения с сопротивлением. На МПКТ положительно влияют плавание, упражнения в воде, ходьба по лестнице. Водные процедуры уменьшают потерю костной массы, повышают МПКТ. Для состояния позвоночника важно укреплять мышцы спины и одновременно мышцы брюшной стенки. Снижение мышечной силы и МПК приводит к ухудшению состояния сердечно-сосудистой системы.
4.1.4. Профилактика травм
Поскольку в большинстве случаев переломы бедра и запястья являются результатом падений, необходимо устранять факторы риска, обусловливающие падения, а именно проводить:
- коррекцию зрения;
- лечение церебральных нарушений, полинейропатии;
- предотвращение ортостатической гипотонии;
- ограничение приема седативных, гипотензивных средств, алкоголя;
- ограничение подъема тяжестей.
4.2. Основные принципы лечения остеопороза
Включают этиологическую, патогенетическую и симптоматическую терапию.
- Этиологическое лечение:
а) лечение основного заболевания (при вторичном остеопорозе);
б) отмена (при возможности) препаратов, оказавших ятрогенный эффект.
- Патогенетическая терапия:
а) снижение (подавление) костной резорбции;
б) стимуляция костеобразования;
в) воздействие на эти процессы одновременно.
- Симптоматическое лечение:
а) диета, сбалансированная по кальцию, фосфору, микроэлементам, белкам, витаминам, антиоксидантам;
б) препараты кальция;
в) лечебная физкультура, дозированная физическая нагрузка;
г) физиотерапевтические методы;
д) ортопедическое лечение;
е) обезболивающие препараты.
К медикаментозным средствам патогенетического действия относятся:
1) ингибиторы резорбции костной ткани: кальций, эстрогены, селективные модуляторы эстрогеновых рецепторов, бисфосфонаты, кальцитонин, иприфлавон, оссеин-гидроксиапатитный комплекс;
2) стимуляторы костеобразования: фториды, СТГ, анаболические стероиды, витамин D и его активные метаболиты, ПТГ (в низких дозах), иприфлавон, оссеин-гидроксиапатитный комплекс;
3) препараты многостороннего действия: витамин D и его активные метаболиты, витамины А, С, группы В, оссеин-гидроксиапатитный комплекс, иприфлавон, Кальцемин, Кальцемин адванс. Перечисленные препараты способствуют установлению баланса между процессами резорбции и костеобразования (табл. 4.1).
Антирезорбтивные средства являются препаратами первого выбора для профилактики и лечения остеопороза. Они безопасны, эффективны, относительно недорогостоящие, значительно снижают костную резорбцию и не влияют на костеобразование (McDermott M.T., 1999б). При их применении костеобразование превосходит резорбцию, и костная масса увеличивается (феномен временного костного ремоделирования). Как отмечает автор, через 6–18 мес лечения костеобразование ступенчато снижается до уровня резорбции, и дальнейшего увеличения костной массы не происходит. Антирезорбтивные средства увеличивают костную массу на 4% при низкооборотном остеопорозе и на 5–20% в первые 6–18 мес при высокооборотном остеопорозе. В дальнейшем костная масса стабилизируется на постоянном уровне. Стимулирующие костеобразование средства вызывают почти линейное повышение МПК у большинства больных (Riggs B.L., L.J. Melton, 1992). Рекомендуемая суточная доза витамина D составляет 400 ЕД. Оптимальную абсорбцию кальция в кишечнике и снижение редукции костной ткани обеспечивает введение 400–800 ЕД витамина D в сутки. Сходный эффект отмечается при приеме кальцитриола в физиологических дозах 0,25–1,0 мкг/сут. Он способствует положительному балансу кальция и снижает вероятность переломов. Кальцитриол в дозе 2 мкг/сут стимулирует костеобразование, повышает МПК. Для избежания токсических эффектов M.T. McDermott (1999б) рекомендует кальцитриол в высоких дозах сочетать с низкосодержащей или умеренной кальциевой диетой. У больных, получающих витамин D и кальцитриол в высоких (выше физиологических) дозах, каждые 6 мес следует определять суточную экскрецию кальция с мочой и концентрацию кальция в сыворотке крови. Витамин D не следует применять при наличии в анамнезе нефролитиаза, нарушения функции почек. При развитии гиперкальциурии и гиперкальциемии следует использовать витамин в минимальной дозе, способной повысить всасывание кальция. При применении кальцитриола в случае возникновения гиперкальциемии и гиперкальциурии они устраняются в течение нескольких дней. В клинической практике используют и альфакальцидол. Витамин D и его метаболиты комбинируют с препаратами кальция из расчета 500 мг/сут. Действие кальцитонина (он ингибирует остеокласты) сопровождается небольшим приростом костной массы. За счет высвобождения опиатов в центральной нервной системе он уменьшает выраженность боли у пациентов с переломами костей. Сочетанно с кальцитонином всегда следует применять кальций (500 мг/сут) для предотвращения вторичного гиперпаратиреоза. Синтетический кальцитонин лосося применяют по 50 МЕ внутримышечно или подкожно в течение 3 нед. Увеличивают костную массу и снижают частоту возникновения переломов бисфосфонаты (этидроновая, алендроновая, памидроновая, тилудроновая кислоты и др.). Они угнетают резорбцию кости, вызванную остеокластами. Чаще используют алендроновую кислоту в дозе 10 мг 1 раз в сутки на протяжении 1 года и более. Прогрессивное увеличение костной массы отмечается при приеме фторидов, однако вероятность переломов не снижается (имеются структурные и механические аномалии новой кости). Применяют фторид натрия и натрий монофлуорофосфат в средней дозе 0,5 г/сут. Считают, что длительность курсового лечения не должна превышать 2–3 года. При приеме препарата возможно развитие побочных эффектов — гастрита, синдрома болезненности нижних конечностей. У части больных эффекта от применения фторидов не отмечается. Увеличение костной массы за счет высокого темпа ремоделирования, наблюдающееся при применении антирезорбентов (эстрогенов, кальцитонина, бисфосфонатов) является временным эффектом. После отмены антирезорбентов масса костной ткани возвращается к исходному уровню (Fleish H., 1997). Костеобразование у мужчин и женщин стимулируют андрогены. Применение тестостерона у мужчин с гипогонадизмом увеличивает скелетную массу. ПТГ стимулирует первоначально остеобласты, которые секретируют факторы, активирующие остеокласты. Введение ПТГ подкожно больше стимулирует костеобразование, чем резорбцию (McDermott M.T., 1999б). Интермиттирующую секрецию ПТГ стимулируют фосфаты, принимаемые внутрь. В настоящее время уточняются преимущества схем лечения, сочетающих прием антирезорбтивных препаратов и стимуляторов костеобразования. Исследуется эффективность при остеопорозе ИПФР-1. Перспективы лечения остеопороза связывают с применением рекомбинантного человеческого ПТГ, ренелата стронция, антагониста рецепторов остеокластов, ингибитора катепсина К, антител к ФНО-α, ингибиторов ИЛ-1 и -6. К перспективным направлениям лечения остеопороза относят методы фармакогенетики, которые позволят модифицировать гены (определяющие синтез коллагена, эстрогеновых рецепторов, витамина D и др.). Теоретически и практически обосновано применение при остеопорозе антиоксидантов — витаминов С, А, Е, меди, цинка, селена, которые связывают, инактивируют свободные радикалы, предотвращают интенсификацию окисления полиненасыщенных жирных кислот в костных клетках. Антиоксидантным и остеотропным действием обладает иприфлавон, который относится к группе флавоноидов. Он улучшает метаболические процессы в костной ткани, стимулирует костеобразование, обладает анальгезирующим действием и применяется в дозе 200 мг 3 раза в сутки. По данным Н.В. Дедух и соавторов (1997), лечение иприфлавоном в течение 1 года повышает МПКТ от 10 до 18%. Антиоксидантной, антирадикальной активностью обладает изофлавоноид кверцетин. Он блокирует синтез эйкозаноидов из арахидоновой кислоты, липоксигеназный путь ее метаболизма, снижает синтез лейкотриенов, секрецию серотонина, других медиаторов воспаления. Кверцетин угнетает синтез тромбоксана, снижает агрегацию тромбоцитов. В результате приема кверцетина (3 г/сут) отмечалось улучшение структурно-функционального состояния костной ткани (Поворознюк В.В., Бондаренко Е.В., 2001).
Кальций, микроэлементы, витамины являются как профилактическими, так и лечебными средствами патогенетического действия при остеопорозе, что обусловливает необходимость их широкого применения.
4.3. Кальций, его препараты. Клиническая эффективность Кальцемина и Кальцемина адванс
Препараты кальция представляют собой важнейшее профилактическое и лечебное средство.
Восстановление нарушенного кальциевого баланса, повышение всасывания его в кишечнике и уменьшение выведения из организма признано универсальным подходом к профилактике и лечению остеопороза (ВОЗ, 1994). Рекомендуемые дозы потребления кальция для профилактики остеопороза в различные периоды жизни представлены в таблицах 4.2 и 4.3. Ежегодно обменивается до 18% кальция, содержащегося в скелете (Ковалев Д.И., 1991). Недостаточное поступление кальция в организм (дефицит в пище, нарушение всасывания), усиленное его выведение служат одними из факторов развития остеопороза. В большинстве экономически развитых стран люди пожилого и старческого возраста потребляют кальция меньше физиологической нормы. У жителей регионов с высоким потреблением кальция показатели костной массы выше, чем у жителей районов с низким потреблением (Matkovic V. et al., 1979).
Соли кальция замедляют потерю костной массы, снижают частоту переломов. Для успешного лечения остеопороза необходимо их адекватное потребление. Считается, что в сутки взрослый человек, больной остеопорозом, должен потреблять не менее 1500 мг кальция. Для предотвращения отрицательного баланса кальция в организме необходимо его ежедневное потребление не менее 1000–1500 мг. Суточный рацион, даже при включении в него 12 стаканов молока и 100 г творога, содержит значительно меньшее количество — 600–900 мг. Поэтому необходимая ежедневная добавка кальция должна составлять 500–900 мг. По результатам скринингового исследования потребление кальция с пищей жителем Украины в настоящее время не превышает 600 мг/сут (Поворознюк В.В., Григорьева Н.В., 2000; 2001; 2002; Поворознюк В.В. и соавт., 2001; 2002д). Большинство населения нуждается в ежедневном дополнительном введении в организм не менее 500 мг кальция и 200 МЕ витамина D. Всасывание кальция нарушается при дефиците витамина D.
Выполнение диетических рекомендаций, прием препаратов кальция и витамина D чрезвычайно важны для профилактики остеопороза, его осложнений, увеличения продолжительности жизни населения, ее качества. Недостаточное потребление кальция в период роста обусловливает образование костей с тонким кортикальным слоем и с меньшим числом тонких трабекул (рост кости в длину или ширину не ограничивается). Усиливается эндостально-трабекулярная резорбция, снижается баланс между костеобразованием и резорбцией. Результатом недостаточного потребления кальция во время роста является построение скелета с малой костной массой при нормальном размере и форме. Диета с высоким содержанием кальция не приводит к созданию большего количества кости, чем заложено в генетической программе, но дефицит кальция может воспрепятствовать реализации этой программы. После окончания линейного роста у лиц молодого возраста продолжается накопление кальция: консолидация костной массы продолжается и после остановки роста. Увеличение костной массы продолжается в течение третьей декады жизни (выполнение генетической программы сохраняется до 30-летнего возраста). После достижения пика костной массы в возрасте около 30 лет начинается ее уменьшение как у женщин, так и мужчин. R.P. Heanеy, V. Matkovic (2000) пришли к выводу, что современные нормы потребления кальция ограничивают величину пиковой костной массы у растущих молодых женщин и современные рекомендации по потреблению Са2+ существенно ниже оптимальных. Адекватное потребление взрослыми людьми кальция сопровождается снижением скорости потери костной массы, риска переломов костей (Поворознюк В.В., Григорьева Н.В., 2002). Дефицит кальция приводит к быстрой потере костной ткани в ранний период менопаузы (Nordin B.С. et al., 1974). Терапия с применением кальция приводит к усилению минерализации кости и костного ремоделирования (Orwoll E.S. et al., 1989). Особенно значительный эффект отмечается у лиц с низким потреблением кальция с пищей (ниже 400 мг/сут) на фоне повышения потребления до 800 мг (ранее рекомендованная доза потребления кальция в США) (Dawson-HughesГB., 1990). Прием кальция в адекватном количестве стабилизирует МПКТ у женщин в постменопаузальный период. У мужчин и женщин пожилого и старческого возраста на фоне приема кальция снижается уровень биохимических маркеров, отражающих резорбцию костной ткани. Нарушение кальциевого гомеостаза отмечается не только при развитии остеопороза, но и таких распространенных в пожилом и старческом возрасте заболеваний, как атеросклероз, ишемическая болезнь сердца, остеохондроз, спондилез позвоночника, остеоартроз (Fujita T., 1997). Приблизительно у 25% пациентов с остеопорозом имеется недостаточность лактазы (Newcomer A.D. et al., 1978), они нуждаются в постоянном потреблении препаратов кальция. По данным обследования с использованием радиоактивного кальция, при определении баланса кальция у значительной части пациентов с остеопорозом обнаруживает нарушение всасывания кальция (Gallagher J.C. et al., 1973; 1979). Одной из причин снижения абсорбции кальция является снижение уровня кальцитриола (1,25-(ОН)2D3) в сыворотке крови. Поэтому считается необходимым назначение метаболитов витамина D для нормализации абсорбции кальция у таких пациентов. Выраженный дефицит витамина D широко распространен среди лиц пожилого возраста. Этому способствует сниженный у них синтез витамина в коже, недостаточная инсоляция. Назначение витамина D3 по 800 мг в комбинации с добавками кальция в дозе 1000 мг/сут приводит к достоверному снижению частоты переломов бедра на 2,4% (Сhapuy M.С. et al., 1992). По данным T. Chevalley и соавторов (1991; 1994), сочетанное применение препаратов кальция и витамина D сопровождается снижением частоты переломов скелета на 25–70%. J.C. Gallagher и соавторы (1979) считают целесообразным применение у пожилых людей витамина D по 400–800 МЕ/сут. Наиболее активным метаболитом витамина D по отношению к стимуляции абсорбции кальция является кальцитриол. В результате лечения кальцитриолом женщин в постменопаузальный период в дозе 14 мкг/сут повышается плотность костной ткани позвоночника, шейки бедра, снижается частота переломов позвоночника. Не подтверждено значение высокого потребления кальция в образовании конкрементов (Curhan G.C. et al., 1993).
Как отмечают И.А. Зупанец и соавторы (2002), все схемы лечения остеопороза включают дополнительное применение препаратов кальция, поскольку антирезорбтивные препараты вызывают гипокальциемический эффект. При этом препараты кальция необходимо сочетать с витамином D3, который оказывает регулирующее влияние на метаболизм кальция. Рекомендации специалистов Американского национального фонда по изучению остеопороза включают следующие положения (Зупанец И.А. и соавт., 2002а):
- назначение кальция и витамина D не обязательно должно сопровождаться определением МПКТ;
- даже при нормальной МПКТ у женщин профилактика препаратами кальция экономически эффективна;
- лечение препаратами кальция сопровождается снижением риска переломов не менее чем на 10%;
- лечение препаратами кальция и витамина D снижает риск переломов на 30%;
- применение витамина D (400–800 МЕ/сут) экономически эффективно у лиц пожилого и старческого возраста с предрасположенностью к дефициту витамина;
- потребление кальция в адекватных дозах (пища, препараты кальция) необходимо рекомендовать всем женщинам независимо от приема других антиостеопоротических препаратов.
Препараты кальция повышают эффективность антирезорбентов в комплексной терапии остеопороза. Так, у пациентов, принимающих кальцитонин без дополнительного приема кальция, наблюдается отрицательная динамика показателя МПКТ (Nievis J.W. et al., 1998). Назначение добавок витамина D и кальция ослабляет негативные изменения в костях, отмечающиеся после лечения фторидами (избыточное образование остеоида, неполная минерализация новой кости). Добавка кальция снижает резорбтивную активность кости, которая наблюдается после монотерапии фторидами, а витамин D повышает кишечную абсорбцию кальция и усиливает минерализацию кости. Для пациентов с ГК-индуцированным остеопорозом характерно нарушение абсорбции кальция. Больным, принимающим ГК, по мнению Е.Л. Насонова и соавторов (1997), необходим постоянный прием кальция в дозе не ниже 1 г/сут и витамина D до 500 МЕ/сут. Низкая токсичность и невысокая стоимость терапии, включающей кальций и витамин D, дают возможность рекомендовать ее в качестве профилактики развития остеопороза всем пациентам, которые принимают ГКС или планируют их прием. Нарушение абсорбции кальция, которое корригируется витамином D, характерно при идиопатическом остеопорозе у женщин в пременопаузальный период. Большинству из них следует назначать лечение препаратами кальция с добавлением витамина D. При ускоренном обмене костной ткани у этих пациенток дополнительно проводят антирезорбтивную терапию кальцитонином или бисфосфонатами. Уровень потребления кальция женщинами в постменопаузальный период в экономически развитых странах составляет менее 500–800 мг/сут (Riggs B.L., Khosla S., 1996). Также снижено потребление ими магния, цинка, железа. Добавление 1500 мг/сут кальция и витамина D в невысокой дозе больным с постменопаузальным остеопорозом приводит к снижению уровня ПТГ в сыворотке крови, сокращению поверхностей резорбции по данным морфометрии подвздошной кости (Riggs B.L., Khosla S., 1996). При признаках нарушения всасывания кальция применяют кальцитриол. У 55% мужчин молодого и среднего возраста с остеопорозом он носит вторичный характер. У 10–20% из них выявляется гипогонадизм различной этиологии (Seсman E. et al., 1983). Эти пациенты должны получать ЗГТ, препараты кальция с витамином D, при повышенном костном метаболизме — антирезорбтивную терапию. Терапией выбора у большинства пациентов пожилого возраста с сенильным остеопорозом является добавление кальция и витамина D до 800 МЕ/сут (Seсman E. et al., 1983). У 10–20% из них имеются нарушения минерализации костной ткани в результате дефицита витамина D. Применение витамина D 800 МЕ/сут и 500 мг кальция лицам пожилого возраста уменьшает число переломов (Seсman E. et al., 1983). При вторичном остеопорозе различного генеза лечение зависит от конкретной причины потери костной ткани, но важной мерой общего характера является назначение препаратов кальция и витамина D. В случае мальабсорбции, операций на кишечнике могут потребоваться фармакологические дозы витамина D (50 000–100 000 МЕ в сутки) и 1500–2000 мг кальция в сутки (Riggs B.L., Khosla S., 1996). Значительные дозы витамина D (до 5000 МЕ) используют при нарушении абсорбции кальция в результате приема противосудорожных препаратов. Применение кальция и витамина D предотвращает потерю костной ткани, переломы костей в любом (молодом, пожилом, старческом) возрасте у больных со вторичным остеопорозом различного генеза (не только с ГК-индуцированным).
Препараты кальция, применяющиеся для профилактики и лечения остеопороза, можно разделить на три группы:
1) простые соли кальция;
2) комбинация солей кальция с витамином D;
3) комбинация солей кальция с витамином D и микроэлементами.
Содержание элементарного кальция в солях кальция представлено в табл. 4.4
При применении простых солей кальция их необходимо комбинировать с витаминами D2 и D3 (эргокальциферолом, холекальциферолом) 400–800 МЕ или его активными метаболитами — кальцитриолом (1,25-(ОН)2D3), или его предшественника альфакальцидола (1б-ОН-D3) по 0,5 г/сут. Альфакальцидол превращается в кальцитриол в костной ткани в результате окисления при участии 25-гидроксилазы. При лечении гипокальциемии может быть использован структурный аналог витамина D2 — дигидротахистерол.
Преимущество второй группы препаратов заключается в соединении простых солей кальция с витамином D, который усиливает абсорбцию кальция в кишечнике и минерализацию костной ткани, предотвращает резорбцию костной ткани, обусловленной ПТГ.
Наибольшее преимущество у препаратов третьей группы — комбинации солей кальция с витамином D3 и микроэлементами (медь, марганец, цинк, бор, магний). Удачным примером сочетания солей кальция, витамина D и микроэлементов в одном препарате являются Кальцемин и Кальцемин адванс.
4.3.1. Состав Кальцемина и Кальцемина адванс
В 1 таблетке Кальцемина содержится 50 МЕ витамина D3 (холекальциферол), 250 мг кальция элементарного (842 мг в виде кальция цитрата и 202 мг кальция карбоната), 2 мг цинка (в виде цинка оксида), 0,5 мг марганца (в виде марганца сульфата), 0,5 мг меди (в виде оксида меди), 50 мкг бора (в виде натрия бората). В 1 таблетке Кальцемина адванс содержится 500 мг элементарного кальция (в виде 217 мг кальция цитрата, 1312 мг кальция карбоната), 200 МЕ витамина D3, 250 мкг бора, 7,5 мг цинка, 1 мг меди, 1,8 мг марганца, 40 мг магния.
Показанием к применению этих препаратов является профилактика и терапия остеопороза, заболеваний опорно-двигательного аппарата, обусловленных нарушениями кальциевого обмена в пожилом возрасте, в менопаузальный период, недостаток поступления и усвоения кальция в период беременности, детям и подросткам в период активного роста, в посттравматический период, характеризующихся повышенной потребностью в минерализующих элементах и риском деминерализации костной ткани.
Таким образом, в состав препаратов входят две формы ионизированного кальция — цитрат и карбонат, которые относятся к солям с высоким содержанием элементарного кальция. Наличие в составе Кальцемина и Кальцемина адванс цитрата кальция снижает зависимость биодоступности препарата от состояния пищеварительного тракта, а наличие карбоната кальция позволяет принимать препарат независимо от приема пищи. Цитрат кальция тормозит секрецию ПТГ и тем самым повышает антирезорбтивное действие Кальцемина, Кальцемина адванс. Его присутствие в препаратах снижает степень риска развития мочекаменной болезни при их длительном приеме. Имеющийся в составе препаратов витамин D3 повышает всасываемость кальция в кишечнике. Преимуществом препаратов является и наличие в их составе микроэлементов, необходимых для метаболизма костной ткани — меди, цинка, марганца, магния, бора.
В целом комбинированные препараты Кальцемин и Кальцемин адванс оказывают остеохондропротекторное действие (Поворознюк В.В., Григорьева Н.В., 2002). Они стимулируют синтез коллагена, эластина, глюкозоаминогликанов в хрящах, костях, повышают темп накопления кальция в костях. В связи с положительным влиянием на формирование органического матрикса кости, минерализацию костной ткани такие комбинированные препараты имеют широкую сферу применения, в том числе используются для профилактики остеопенического синдрома у детей и беременных, при сколиотических деформациях позвоночника, остеохондрозе, остеоартрозе, других заболеваниях опорно-двигательного аппарата.
В эксперименте на крысах зрелого возраста проведено изучение (Поворознюк В.В. и соавт., 2001; Поворознюк В.В., Григорьева Н.В., 2002) эффективности Кальцемина. Использовались следующие методы исследования: остеометрия большеберцовой, бедренной, плечевой костей и поясничного позвонка LIII; химическое и биохимическое исследование большеберцовой кости; биомеханическое исследование плечевой кости. Результаты сопоставлялись с показателями контроля (крысы аналогичного возраста).
При остеометрическом исследовании различных костей авторами не установлено изменений показателей на фоне приема Кальцемина в сравнении с интактными и оперированными (овариоэктомия) крысами, кроме показателя толщины диафиза бедра. Этот показатель отличался у животных, которые получали Кальцемин, в сравнении с оперированными (овариоэктомия) животными, не получавшими Кальцемин. Не отмечалось также изменения показателей содержания органических и минеральных веществ в сухом остатке различных костей. Однако данные биомеханического исследования плечевой кости свидетельствуют о достоверном улучшении прочностных характеристик плечевой кости на фоне неизмененных ее остеометрических показателей.
В эксперименте (Поворознюк В.В. и соавт., 2001; Поворознюк В.В., Григорьева Н.В., 2002) изучена эффективность препаратов простых солей кальция и комбинации солей кальция с витаминами и минералами (Кальцемин) в коррекции биомеханических нарушений костной ткани у самок крыс зрелого возраста после двусторонней овариоэктомии (модель экспериментального остеопороза). Животным производили двустороннюю овариоэктомию, затем через 6 нед после хирургической кастрации двум группам оперированных крыс назначали терапию препаратами кальция (соль кальция и Кальцемин). Дозы кальция для животных исследователи рассчитывали с учетом необходимого уровня потребления (1500 мг/сут) для женщин в постменопаузальный период жизни без применения ЗГТ. Эффективность проведенного лечения оценивалась после 30-дневного курса терапии. Для анализа были выделены группы: неоперированные животные (1-я группа); крысы после двусторонней овариоэктомии, не получавшие препаратов кальция (2-я группа); оперированные крысы, получавшие лечение солью кальция (3-я группа); оперированные крысы, получавшие лечение Кальцемином (4-я группа). В результате исследований авторами установлено, что двусторонняя овариоэктомия обусловливает ухудшение механических свойств костной ткани: достоверно снижается показатель прочности (рис. 4.1).
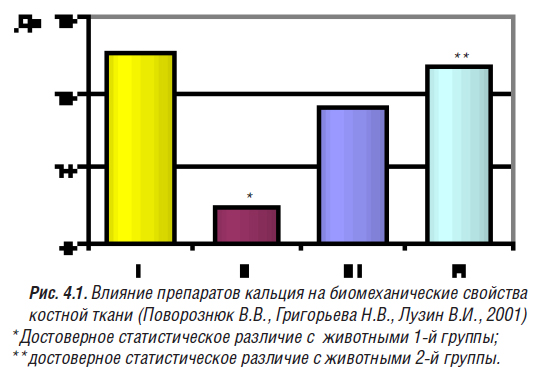
Применение соли кальция, по данным авторов, обусловливало недостоверное повышение данного показателя. В то же время Кальцемин оказывал достоверный лечебный эффект: прочность костной ткани восстанавливалась до уровня данного показателя у 1-й группы животных. Улучшение структурно-функционального состояния костной ткани (повышение индекса прочности костной ткани) было отмечено ранее (Поворознюк В.В., Григорьева Н.В., 2000) у женщин в постменопаузальный период, принимавших Кальцемин в течение 6 мес и более.
Авторами проведено изучение эффективности препарата Кальцемин у пациентов со структурно-функциональными нарушениями костной ткани. Группу изучения составили 12 женщин в постменопаузальный период в возрасте от 69 до 74 лет, в анамнезе которых перелом дистального отдела предплечья и которые в течение 6 мес принимали Кальцемин по 1 таблетке 2 раза в сутки. Исключались больные с заболеваниями, которые могли влиять на метаболизм кальция (синдром мальабсорбции, заболевания печени, почек, крови и/или эндокринной системы). Не включались также больные, которые применяли ЗГТ или терапию препаратами, влияющими на метаболизм кальция. В начале приема препарата, через 1, 3 и 6 мес проводили ультразвуковую денситометрию, определяли биохимические маркеры резорбции костной ткани. У всех женщин наблюдалась естественная менопауза (менструация отсутствовала не менее чем 12 мес). Характеристика обследованных пациенток представлена в табл. 4.5.
Диагноз «остеопороз» авторы устанавливали на основании ультразвуковой денситометрии и рентгенографии грудного и поясничного отдела позвоночника. При месячном лечении Кальцемином не получено достоверных изменений показателя болевого синдрома. Через 3 и 6 мес приема Кальцемина достоверно уменьшалась интенсивность боли, которая оценивалась по вербально-аналоговой шкале. Через 3 мес отмечалась тенденция к снижению рангового индекса боли — интегративный показатель по опроснику боли МакГилла (табл. 4.6).
Через 6 мес лечения Кальцемином повысились показатели, характеризующие прочность и МПКТ (индекс прочности — ИП, широкополосное ослабление ультразвука — ШОУ, скорость распространения ультразвука — СРУ) (табл. 4.7). Авторы не отмечали существенных возрастных различий при терапии препаратом (табл. 4.8).
Изучение авторами биохимических маркеров резорбции и формирования костной ткани выявило снижение показателей общего гидроксипролина у пациентов, которые получали Кальцемин в течение 6 мес по сравнению с показателями до начала приема препарата (табл. 4.9, 4.10).
Не наблюдалось повышения уровня кальция в крови и повышение выведения кальция с мочой (см. табл. 4.9). Таким образом, применение Кальцемина в дозе 1 таблетка 2 раза в сутки в течение 6 мес предотвращает потерю костной массы, при этом уменьшается выраженность болевого синдрома, улучшается качество и прочность костной ткани, отсутствуют побочные эффекты.
Данные проведенных исследований (Поворознюк В.В. и соавт., 2001; Поворознюк В.В., Григорьева Н.В., 2002) по изучению эффективности Кальцемина в профилактике и лечении остеопороза позвоночника свидетельствуют, что у 71,4% пациентов, которые принимали Кальцемин по 1 капсуле 2 раза в сутки на протяжении 1 года, уже через 4 мес приема препарата отмечается уменьшение выраженности болевого синдрома. В контрольной группе за этот же период уменьшение выраженности болевого синдрома отмечалось только у 18,8%. К завершению годичного курса ощутимое улучшение состояния здоровья наблюдалось у 85,7% (в контроле — у 31,3%) пациентов. Проведение ультразвуковой костной денситометрии с интервалом 12 мес показало, что у пациентов, принимавших Кальцемин, отсутствовала потеря костной массы (в отличие от контроля). Среди лиц, которые принимали Кальцемин в течение 1 года, не было зафиксировано появления новых остеопоротических переломов тел позвонков. Это дало возможность авторам рекомендовать монотерапию препаратом Кальцемин по стандартной схеме дозирования для профилактики и лечения вертебрального остеопороза и его осложнений (остеопоротических деформаций тел позвонков).
Еще более выраженные изменения остеометрических, биомеханических и химических показателей наблюдались при комбинированной терапии Кальцемином и средством ЗГТ — комбинацией эстрадиола с дидрогестероном (Фемостоном) (Поворознюк В.В. и соавт., 2001). Установлено не только достоверное увеличение толщины диафиза бедра, которое наблюдалось при монотерапии Кальцемином, но и увеличение ширины его дистального эпифиза. В большей степени снизился показатель удельной стрелы изгиба, повысились показатели разрушающего момента и работы разрушения кости. Таким образом, монотерапия Кальцемином и особенно его сочетание с Фемостоном приводит к улучшению биомеханических свойств костной ткани и интенсификации процессов минерализации.
Эффективность противоостеопоротической терапии повышается при сочетании Кальцемина с препаратом синтетического кальцитонина лосося (Поворознюк В.В. и соавт., 2001) (табл. 4.11, 4.12).
Как свидетельствуют данные экспериментальных исследований авторов, еще в меньшей степени снижается показатель удельной стрелы изгиба, повышаются показатели разрушающего момента и работы разрушения кости. При этом показатели достигают уровня интактных животных. Изменения в химическом составе плечевой кости и ее биомеханических характеристик на фоне неизмененных показателей остеометрии свидетельствуют об улучшении качества костной ткани и повышении прочностных характеристик (табл. 4.13).
В последние годы большое внимание исследователи уделяют созданию и использованию новых препаратов со специфическим для разных типов тканей организма действием, к которым относят и синтетический стероид — тиболон. Препарат обладает слабым эстрогенным, прогестагенным, андрогенным действием и более 20 лет используется в Европе в целях профилактики и лечения симптомов, развивающихся в менопаузальный период. Подобно эстрогенам он снижает интенсивность резорбции костной ткани, предотвращает потерю костной ткани, повышает МПКТ в ранний и поздний постменопаузальный период у женщин с диагностированным остеопорозом. Как подтверждают данные экспериментальных исследований В.В. Поворознюка и соавторов (2001), при комбинации Кальцемина с тиболоном наблюдалось увеличение ширины диафиза плечевой кости, уменьшение ширины дистального эпифиза плечевой кости и ширины проксимального эпифиза и толщины диафиза большеберцовой кости (табл. 4.14).
При сочетанном применении Кальцемина с тиболоном у овариоэктомированных крыс отмечались положительные изменения биомеханических характеристик костной ткани: снизилась удельная стрела изгиба кости (достигла уровня интактных животных), повысился показатель разрушающего момента и работы разрушения кости, что отражает повышение прочности костной ткани. Таким образом, Кальцемин в сочетании с тиболоном улучшают структурно-функциональное состояние костной ткани за счет повышения ее прочностных характеристик, изменений в химическом составе костей.
Учитывая, что микроэлементы, входящие в Кальцемин, оказывают положительное влияние на состояние хрящевой ткани, авторы делают выводы о целесообразности применения препарата для профилактики и лечения остеохондроза, остеоартроза, первичного и вторичного остеопороза, травм опорно-двигательного аппарата, для коррекции нарушений кальциевого обмена у людей пожилого возраста, у женщин в постменопаузальный период, для устранения дефицита и улучшения усвоения кальция при беременности, в период активного роста детей и подростков для формирования здорового скелета, в комплексном лечении заболеваний пародонта, для профилактики и лечения структурно-функциональных нарушений костной ткани у населения, проживающего в экологически неблагоприятных регионах. Также препарат следует использовать как базисное средство при профилактике и лечении системного остеопороза антирезорбентами (ЗГТ, кальцитонин, бисфосфонаты). Полученные авторами результаты (уменьшение выраженности болевого синдрома, улучшение качества и МПКТ, отсутствие побочных эффектов) позволили рекомендовать Кальцемин как приоритетное средство в базисной терапии и профилактике системного остеопороза.
В гериатрической клинике Белорусской медицинской академии последипломного образования в 2001–2002 гг. проведено (Сытый В.П. и соавт., 2002) клиническое изучение препарата Кальцемин, цель которого — оценить эффективность Кальцемина у больных с первичным и вторичным остеопорозом. В исследование были включены пациенты, соответствующие следующим критериям:
1) наличие информированного согласия;
2) соответствие диагноза рубрикам Международной классификации болезней ВОЗ 10-го пересмотра (МБК-10) для остеопороза;
3) возраст от 55 до 80 лет;
4) наличие факторов риска развития остеопороза;
5) без предшествующего применения препаратов для лечения остеопороза.
Критериями исключения были: тяжелая сопутствующая патология и функциональная недостаточность жизненно важных органов. Всего в исследование были включены 43 больных: 23 женщины и 20 мужчин. Средняя продолжительность симптомов заболевания составила 10 (от 5 до 15) лет. Больные, включенные в исследование, получали по 4 таблетки Кальцемина в сутки. С учетом цели исследования терапию сопутствующих заболеваний авторы не проводили. Другие препараты для лечения остеопороза не назначались. Продолжительность лечения на первом этапе составила 12 нед. В начале и конце исследования проводили двухфотонную абсорбциометрию в области костей предплечья нерабочей руки. Для объективизации клинических данных протокол исследования предусматривал оценку болевого синдрома по 3-балльной шкале, выраженность кифоза и лордоза, снижение роста, оценку побочного действия препарата. Общесоматическое исследование включало ЭКГ, измерение артериального давления в динамике, рентгенографию позвоночника, общий анализ и биохимическое исследование крови, общий анализ мочи. В процессе диагностики были установлены диагнозы: М82, J44.8 Остеопороз при хронической обструктивной болезни легких (ХОБЛ); М81.0 — постменопаузальный остеопороз; М81.8 — сенильный остеопороз. Все больные были распределены на три группы:
1-я группа — 13 пациентов с хронической обструктивной болезнью легких, длительное время принимавшие ГК-гормоны.
2-я группа — 15 женщин в постменопаузальный период.
3-я группа — 15 человек старческого возраста без других факторов риска остеопороза.
МПК по губчатому (МПК-UDST) и компактному (МПК-MDST) веществу, МНК по губчатому (МНК-UDST) и по компактному (МНКBMC-MDST) веществу определяли методом двухэнергетической рентгенологической абсорбциометрии (DEXA) на диагностическом комплексе Dexa Scan DX-10 фирмы Direx (Израиль). Исходные денситометрические показатели у больных представлены в табл. 4.15. Все больные закончили лечение и были включены в анализ эффективности и безопасности лечения Кальцемином. Эффективность Кальцемина оценивалась по степени редукции клинических признаков остеопороза и глобальной эффективности терапии.
Приведенные в табл. 4.16 данные, характеризующие глобальную эффективность терапии Кальцемином, свидетельствуют о выявлении минимального улучшения в состоянии больных на 45-й день терапии в 79% случаев. Более существенные положительные результаты терапии отмечены на 90-й день, когда значительное улучшение выявлено у 49% пациентов и минимальное улучшение — у 44%. С учетом медленнопротекающих процессов метаболизма и восстановления костной ткани полученные данные оценены авторами как хороший терапевтический результат.
Динамика ЩФ, содержания фосфора и кальция в крови в процессе лечения Кальцемином представлены в табл. 4.17.
Выраженность болевого синдрома до лечения соответствовала 2 баллам по 3-балльной шкале. В процессе лечения интенсивность болевого синдрома в спине уменьшилась у всех пациентов 2-й, у 12 — 3-й и у 10 больных 1-й группы (у 3 — без динамики). Динамики роста и выраженности грудного кифоза в процессе лечения не отмечено. Таким образом, несмотря на небольшую продолжительность первого этапа применения Кальцемина у больных остеопорозом, В.П. Сытым и соавторами получены убедительные клинические данные, подтверждающие его эффективность. Побочных эффектов Кальцемина не отмечено. Авторами сделаны выводы:
- Кальцемин в дозе 4 таблетки (1000 мг кальция) в сутки эффективен в лечении больных остеопорозом.
- Наличие микроэлементов в составе Кальцемина, оказывающих продолжительное влияние на хрящевую ткань, позволяет рекомендовать его для профилактики и лечения остеохондроза и остеоартрита.
- Кальцемин может использоваться как средство базисной терапии при лечении остеопороза с применением антирезорбентов и стимуляторов формирования кости.
- Кальцемин не вызывает побочных эффектов при длительном применении.
Установлено (Якименко О.О. та співавт., 2003), что комплексное лечение больных ОА (стандартная терапия вместе с Кальцемином) сопровождается достоверным снижением болевого индекса (таблица 4.18).
Почти полное исчезновение боли в суставах в покое отмечено у 17 пациентов из 29, принимавших Кальцемин. При этом значительное уменьшение выраженности болевого синдрома наступало уже на 45-й день лечения, полное исчезновение — к концу 3-й недели. У 14 больных на момент выписки боль возникала только при нагрузке на суставы. После лечения с использованием Кальцемина значительно снизились показатели суставного индекса. Уменьшение болезненности при пальпации суставов через 57 дней отмечали у 18 больных. К концу 3-й недели только у 1 пациента сохранялась болезненность в области коленных суставов. Включение Кальцемина в терапию больных с реактивным синовитом также снижало болевой, суставной индексы сравнительно с контрольной группой. Однако эффективность комплексного лечения с использованием Кальцемина была более высокой у больных без реактивного синовита. Достоверное снижение клинических индексов наблюдалось у больных остеоартрозом I и II рентгенологической стадии, I и II степени функциональной недостаточности суставов (табл. 4.19).
У пациентов молодого возраста значения болевого и суставного индексов были более низкими по сравнению с пациентами пожилого возраста. Данные проведенных исследований позволили авторам сделать выводы, что включение в комплексную терапию Кальцемина не влияет на воспалительный синдром, повышает эффективность терапии у пациентов различного возраста, разной рентгенологической стадии и степени функциональной недостаточности суставов за счет действия на суставной и болевой компоненты клинической симптоматики заболевания.
Как известно, при заболеваниях почек развивается вторичный остеопороз. В этих случаях необходимо применение препаратов, которые бы влияли на патогенетические звенья развития вторичного остеопороза и прежде всего устраняли гипокальциемию, гиперфосфатемию, поддерживали адекватный уровень ПТГ в крови, влияли на процессы ремоделирования кости. Таким препаратом, по мнению Л.П. Мартынюк (2002), является Кальцемин. Наличие в нем карбоната кальция позволяет повысить уровень в крови ионизированного кальция и одновременно устранить гиперфосфатемию. Цитрат кальция тормозит секрецию ПТГ и тем самым влияет на механизм развития почечных остеодистрофий, повышает антирезорбтивный эффект. Наличие в препарате цитрата кальция снижает риск развития нефролитиаза при длительном приеме препарата, повышает биодоступность препарата вне зависимости от состояния пищеварительного тракта (гастродуоденальные нарушения наблюдаются у 36–89% больных с ХПН). Кальцемин позволяет уменьшить дефицит витамина D3 (возникает в связи с протеинурией), улучшить абсорбцию кальция в кишечнике. Л.П. Мартынюк (2002) изучила эффективность Кальцемина в терапии пациентов с заболеваниями почек без нарушения азотовыделительной функции и с дефицитом МПКТ. В исследование было включено 23 пациента с заболеваниями почек в возрасте от 22 до 68 лет (средний возраст — 42,01±11,47 года, 80% из них — в возрасте до 60 лет, женщины составили большинство — 55,6%). У 10 пациентов отмечали хронический гломерулонефрит, нефротический синдром; у 8 — хронический гломерулонефрит, мочевой синдром; у 5 — хронический пиелонефрит с латентной, доазотемической стадией почечной недостаточности. Критериями включения в исследование были: жалобы на боль в спине, быстрая утомляемость, снижение физической активности, по данным двухэнергетической рентгеновской денситометрии — потеря костной ткани хотя бы в одной из точек исследования более 1 SD по Т-критерию. Больные не получали в течение последних 6 мес до начала исследования препаратов, влияющих на ремоделирование костной ткани. Больные основной (1-й) группы (16 человек) в течение 2 мес получали по 2 таблетки Кальцемина 2 раза в сутки, в дальнейшем — по 1 таблетке 2 раза в сутки (суточная доза кальция составляла 500–1000 мг/сут). Пациенты контрольной (2-й) группы (7 человек) принимали глюконат кальция по 34 г/сут (270–360 мг кальция). До начала исследования, через 3 и 6 мес после начала лечения, проводили определение МПК методом двухфотонной рентгеновской костной денситометрии, определяли концентрацию кальция и фосфатов в сыворотке крови, активность ЩФ.
Результаты исследования МПКТ позвонков поясничного отдела представлены в табл. 4.20.
Клинические симптомы ренальных остеодистрофий чаще выявляли при наличии выраженной остеопении и остеопороза. В 1-й группе количество больных, которые отмечали уменьшение выраженности болевого синдрома, возрастало по мере увеличения длительности приема Кальцемина (табл. 4.21).
При лечении в течение 1 мес существенной разницы в выраженности болевого синдрома не отмечалось. Через 3 мес лечения уменьшение выраженности боли в поясничном отделе позвоночника выявлено у 10 (62,5%) больных, через 6 мес — 12 (75%), через 9 мес — у 14 (87,5%). Через 6 мес лечения Кальцемином МПКТ (позвонков LILIV) повысилась на 0,72%, через 9 мес — на 1,16%. Во 2-й группе отмечено снижение МПКТ (табл. 4.22).
У 8 больных 1-й группы отмечали повышение МПКТ, у 6 — стабилизацию костной массы, у 2 — негативную динамику. В 1-й группе наблюдали повышение уровня кальция и снижение уровня фосфора в крови, выраженную тенденцию к снижению активности ЩФ, увеличилось выведение кальция с мочой, но не достигло уровня у здоровых лиц (табл. 4.23).
Во 2-й группе повысилась активность ЩФ, содержание кальция и фосфора в крови существенно не изменилось.
Таким образом, у пациентов, которые принимали Кальцемин, выраженность боли в спине значительно уменьшилась, у большинства боль исчезла полностью. Это позволило в дальнейшем не применять обезболивающие препараты, которые оказывают негативное влияние на почечную паренхиму. Прием Кальцемина сопровождался повышением МПКТ, при этом остеопоротических переломов тел позвонков не отмечалось, что автор связывает с активным влиянием Кальцемина на ремоделирование костной ткани.
Т.Д. Никула и соавторы (2003) изучали клиническую эффективность Кальцемина у больных с остеопатиями на различных стадиях развития ХПН. В основную группу (39 человек) были включены пациенты с ХПН 0II стадии (24 человек) и III стадии (15 человек), пролонгированной гемодиализом. В состав основной группы вошли 27 пациентов с хроническим гломерулонефритом, 8 — с хроническим вторичным пиелонефритом, 4 — с сахарным диабетом. Они получали Кальцемин (другие остеопротекторы не применяли) на фоне базисной терапии — реополиглюкина, фуросемида, аминофиллина, гипотензивных средств. Пациенты контрольной группы получали только базисную медикаментозную терапию. Сопутствующая патология была представлена остеохондрозом позвоночника (у большинства), остеодистрофией, остеоартрозом, остеопорозом костей, дисплазией позвоночника, сочетанием нескольких заболеваний опорно-двигательного аппарата. У всех больных отмечали ирритационное поражение периферической и вегетативной нервной системы. У 2 больных в анамнезе указаны переломы тел позвонков, у 3 — спонтанные разрывы сухожилий, у 2 — задержка роста и полового развития (инсулинзависимый сахарный диабет). Кальцемин пациенты принимали по 1 таблетке 2 раза в сутки на протяжении 46 мес. У больных основной группы чаще, чем в контрольной, отмечали положительную динамику клинических симптомов (табл. 4.24).
Отмечалось полное исчезновение или уменьшение выраженности остеогенного болевого синдрома. Уменьшение его выраженности в основной группе наблюдалось уже через 7,4±2,4 дня по сравнению с 15,9±1,8 в контрольной. Раньше всего уменьшалась выраженность боли в поясничном отделе позвоночника, ребрах, бедренных костях, голенях, а также пальпаторная болезненность костей, суставов. Уменьшилась выраженность псевдоподагрической боли в стопах, значительно (на 33%) снизилась интенсивность зуда кожи. Через 6 мес лечения ни у одного больного не отмечено спонтанного разрыва сухожилий. Под влиянием Кальцемина наблюдали положительную динамику кальциемии и изменений степени выраженности признаков вегетативной дисфункции. Эта динамика коррелировала с таковой у пациентов с ХПН (табл. 4.25).
Незначительное симптоматическое улучшение наблюдалось у пациентов с ХПН IIA и IIБ. Ирритативные поражения периферической нервной системы у больных нефрологического профиля проявлялись болью в надкостнице, мышцах, нервных корешках. В результате приема Кальцемина уменьшилась выраженность боли в костях, мышцах, она осталась без изменений только в области периферических нервов (у пациентов контрольной группы боль сохранялась во всех указанных областях поражения). Эффективность лечения, которую оценивали по суммарному положительному эффекту у больных с хроническим гломерулонефритом, ХПН 0I, принимавших Кальцемин, была на 22% выше по сравнению с контролем. Лечение было неэффективным соответственно у 20±4% и 42±7% больных с прогрессирующим течением патологического процесса.
Т.Д. Никула и соавторы (2003) пришли к выводу, что применение Кальцемина в комплексном лечении больных с остеопатией на различных стадиях ХПН является эффективным и безопасным. Его можно использовать в додиализный и диализный период. Отсутствие побочных эффектов, возможность комбинировать с другими средствами позволяет индивидуализировать лечение, улучшить кальциевый метаболизм, предупредить развитие гиперпаратиреоза, нормализовать тонус вегетативной нервной системы, улучшить качество жизни больных, достигнуть желаемого терапевтического эффекта.
Самой распространенной патологией среди всех стоматологических заболеваний являются заболевания тканей пародонтального комплекса. Болезни пародонта диагностируются все чаще с возрастом человека и в возрасте 40 лет и старше частота заболеваний достигает 100% (Поворознюк В.В., Мазур И.П., 2003). Этот рост заболеваний пародонта объясняют различными причинами: экологической ситуацией, увеличением числа различных соматических заболеваний, нарушениями иммунной резистентности и др. Применявшиеся ранее схемы лечения нуждаются в коррекции в связи с выявленными в последние годы общими звеньями патогенеза системного остеопороза и генерализованного пародонтита. К ним относят нарушения метаболизма костной ткани альвеолярного отростка: активацию остеокластов и резорбции кости, торможение минерализации костной ткани, синтеза коллагена, полимеризацию протеогликанов, гликозамингликанов и деструкцию межзубных костных перегородок. Для коррекции указанных изменений необходимы комбинированные остеотропные препараты, к которым П.В. Сидельников (2002) относит Кальцемин. В целях повышения эффективности лечения генерализованного пародонтита автор включал Кальцемин в схему комплексной терапии больных с этой патологией. Под его наблюдением находились 73 пациента в возрасте 19–45 лет с генерализованным пародонтитом I и II степени тяжести. Пациенты были обследованы по единой схеме, включающей клинические методы исследования, рентгенографию альвеолярной кости, определение индексов гигиены, гингивита. Состояние периферического кровообращения оценивали по индексу периферического кровообращения по Л.Н. Дедовой. Пациентов распределили на две группы: в 1-й группе проводили комплексную консервативную терапию, во 2-й — в комплексном лечении применяли хирургические методы — открытый кюретаж и гингивопластику. Участников каждой из двух групп распределили на две подгруппы, в одной из которых (основной) получали Кальцемин по схеме: 1-й месяц — по 2 таблетки утром и вечером до еды или через 30 мин после еды; 2-й и 3-й месяц — по 1 таблетке утром и вечером; затем 1 мес перерыв и снова в течение 3 мес по 1 таблетке 2 раза в сутки.
Индексная оценка состояния гигиены полости рта и тканей пародонта в динамике лечения представлена в табл. 4.26 и 4.27.
Функциональное состояние периферического кровообращения у пациентов 1-й группы оценено как «удовлетворительное», 2-й — как «декомпенсированное». Результаты лечения оценивались через 3, 6, 12, 14 мес.
Лечение проводили до полной клинической стабилизации воспалительно-дистрофического процесса в тканях пародонта. Для всех пациентов были составлены индивидуальные программы гигиены полости рта. Через 3 мес при контрольном осмотре не выявлено клинико-рентгенологических различий в основной и контрольной подгруппах. Результаты проведенной индексной оценки состояния гигиены и тканей пародонта (см. табл. 4.26) свидетельствуют о необходимости коррекции гигиенических мероприятий у пациентов контрольной подгруппы. Через 6 мес у 15% пациентов контрольной подгруппы 1-й группы возникла необходимость в проведении превентивного лечения. Через 1 год таких пациентов уже было 42%, а остальные 58% нуждались в комплексном противорецидивном лечении. В основной подгруппе получавших Кальцемин лишь спустя 12–14 мес у 13% пациентов возникла необходимость в проведении превентивного лечения. Функциональное состояние периодонтальных микрососудов в основной подгруппе 1-й группы было в 2,4 раза лучше, чем в контрольной.
Результаты хирургического лечения больных (2-я группа) (см. табл. 4.27) свидетельствуют о том, что через 6 мес в основной подгруппе не было пациентов, нуждающихся в лечении, а в контрольной у 10% возникла необходимость в проведении превентивной терапии. Через 12–14 мес в основной подгруппе 2-й группы только 14% пациентов нуждались в превентивной терапии, а в контрольной подгруппе — 35 и 25% пациентам было необходимо комплексное лечение. Через 1 год после лечения функциональное состояние периферического кровообращения оценивалось в основной группе как «компенсированное», а в контрольной — как «удовлетворительное».
Включение в курс консервативного и хирургического лечения препарата Кальцемина способствовало снижению частоты обострений заболевания в 23 раза и увеличивало период ремиссии до 1618 мес.
Таким образом, данные исследования В.П. Сидельникова (2002) свидетельствуют, что применение комбинированного препарата Кальцемин в комплексной терапии пациентов с генерализованным пародонтитом повышает эффективность лечения, стабилизирует дистрофические процессы в альвеолярной кости и тканях пародонта, увеличивает период ремиссии до 14 мес. Особенно эффективно применение Кальцемина при проведении хирургических методов лечения.
В онкологической практике достаточно часто наблюдается поражение костной системы (первичные опухоли, метастазы). В комплекс применяющихся специальных лечебных мероприятий (хирургических операций, гормонотерапии, лучевой и химиотерапии) включают препараты, корригирующие кальциевый обмен (Толстопятов Б.А., Паливец А.Ю., 2002). Эта коррекция имеет следующие задачи:
- ускорение репарации костей;
- уменьшение (предотвращение) резорбции кости в результате опухолевого процесса;
- профилактика остеопороза на фоне терапии ГК.
По данным авторов, оптимальным средством коррекции обмена кальция у больных онкологического профиля является Кальцемин. Методика применения препарата (по 1 таблетке 2 раза в сутки в течение 24 нед) апробирована в Институте онкологии АМН Украины и предложена для внедрения в практику работы онкологических стационаров, областных, районных, участковых больниц.
4.3.2. Значение препаратов кальция (Кальцемина и Кальцемина адванс) в травматологической практике
Переломы костей сопровождаются метаболическими изменениями, которые являются отражением развития общего неспецифического адаптационного синдрома. Сразу после перелома развивается катаболическая реакция (она длится около 2 нед), в результате которой происходит распад тканевых белков, потеря целого ряда органических и минеральных веществ (Климовицкий В., Кривенко С.М., 2003). Высвобождаются важные химические элементы, необходимые для регенерации. В острый период после травмы активизируются липолиз, свободнорадикальные процессы, из костной ткани освобождаются неорганический фосфор и кальций (концентрация их в плазме крови повышена в течение 2 нед). Особенно значительны изменения в острый период множественной травмы. К концу 2-й недели наступает анаболическая фаза с постепенной нормализацией состава крови, плазмы крови. Нормализация белкового обмена наступает через 3 нед с момента возникновения переломов.
К тяжелым травмам опорно-двигательного аппарата относятся внутрисуставные переломы шейки бедренной кости, развитие которых возникает у людей старшего возраста при минимальной травме по причине остеопороза. У больных, которым проводят эндопротезирование тазобедренных суставов, необходима своевременная диагностика остеопоротических изменений костной ткани для соответствующей терапии, в том числе применения адекватного количества кальция (Рыбачук О.И., Бесединский С.Н., 2002). Во всем мире частота переломов шейки бедра у пациентов пожилого возраста при минимальной травме повышается. С возрастом поступление и всасывание кальция из пищи снижается. Как мы уже отмечали, рацион людей пожилого возраста в Украине дефицитен по кальцию: потребление кальция в Украине составляет 42% рекомендуемых норм (Поворознюк В.В., 1998). Наряду с разработкой технологии органосохраняющих операций необходимо постоянное применение пациентами пожилого возраста антиостеопоротических препаратов пожизненно (Корж Н.А. и соавт., 2002). Положительные исходы при лечении внутрисуставных переломов шейки бедренной кости, по данным авторов, во многом зависят от состояния костной ткани (генерализованного и/или локального остеопороза) и постоянного приема антиостеопоротических препаратов под контролем биохимических маркеров и костной денситометрии.
При переломах большеберцовой кости ее МП снижается уже в период иммобилизации и в большей мере снижается через 12 мес (Зупанец И.А. и соавт., 2002). Структурно-метаболические нарушения в костях отмечаются уже к моменту травмы, а травматические повреждения костей сопровождаются дополнительной потерей кальция и других минералов. Локальное повреждение костной ткани сопровождается длительным остеопеническим синдромом или проявляется в виде остеопороза в нижележащих сегментах скелета. При планировании оперативного лечения в случае травматических повреждений и костно-суставной патологии, по мнению авторов, следует оценивать МПКТ методом костной денситометрии. Результаты денситометрии следует учитывать при прогнозировании исходов репаративной регенерации. И.А. Зупанец и соавторы (2002) рекомендуют на всех этапах репаративного процесса применение антиоксидантов, витаминов, микроэлементов. Поскольку любое травматическое повреждение приводит к интенсификации перекисного окисления ненасыщенных жирных кислот, в качестве антиоксиданта авторы рекомендуют аскорбиновую кислоту, которая также принимает участие в дифференцировке клеток хряща и кости. К факторам, необходимым для регенерации, они относят также кальций и магний. Применение препаратов кальция и витаминов на различных стадиях заживления переломов (для заживления и снижения потери костной массы) рекомендует S.N. Cornell (1990). Он считает, что остеотропную терапию необходимо продолжать и после завершения репаративного процесса.
Для профилактики и лечения остеопороза у пациентов пожилого возраста рекомендуют потреблять 1200–1500 мг кальция. Употребление препаратов кальция на 50% уменьшает возрастзависимую потерю костной ткани. Прием препаратов кальция более эффективен в пожилом возрасте по сравнению с первыми 5 годами после начала менопаузы. При проведении длительной кальцийзаместительной терапии следует учитывать содержание кальция в суточном рационе. Эффект увеличения костной массы усиливается при сочетании терапевтических доз витамина D3 и препаратов кальция. Преимуществом использования в травматологической практике Кальцемина является наличие в его составе хорошо всасывающихся солей кальция, витамина D3, микроэлементов. Высокая остеотропная эффективность препарата подтверждена в представленных выше исследованиях.