Доказательная медицина и дизайн клинических исследований при остеоартрозе
Содержание
Значительный прогресс в понимании патофизиологии и эволюции ОА привел не только к улучшению диагностики заболевания, но и к переоценке методологии и метрологии проведения клинических исследований при ОА. Клиническая метрология ОА затруднена.
Это связано с рядом факторов (Bellamy N., 1997):
- нередко бессимптомностью болезни;
- диссоциацией между рентгенологической картиной и клинической манифестацией;
- частым несоответствием данных артроскопии и рентгенографии пораженных суставов;
- отсутствием надежных БМ хрящевого метаболизма, отражающих прогрессирование ОА и имеющих прогностическое значение;
- индивидуальными для каждой локализации ОА (кисти, коленные, тазобедренные суставы и др.) критериями оценки, однако вместе взятые они не подходят для генерализованной формы ОА.
В связи с появлением на фармацевтическом рынке новых препаратов для терапии ОА и большим количеством публикаций с результатами контролированных исследований возникла необходимость разработки унифицированных критериев эффективности. Список показателей, которые могли бы быть включены в протокол клинического исследования ОА, достаточно большой (табл. 33). Эти показатели можно условно разделить на: субъективные (показатели боли, функциональной способности, качества жизни) и объективные — характеризующие прогрессирование болезни (по данным рентгенографии, МРТ, артроскопии, УЗИ, радиоизотопного сканирования; БМ).
Боль. Чаще всего для оценки болевого синдрома у больных с ОА используют визуальную шкалу боли (ВАШ Хаскиссона) и шкалу Ликерта (Huskisson E.S., 1982; Bellamy N., 1993a). Результаты многочисленных исследований продемонстрировали их высокую информативность (Bellamy N., 1993b–d). Первая представляет собой вертикальную или горизонтальную прямую длиной 10 см (0 см — нет боли, 10 см — максимально выраженная боль), вторая — такую же прямую, на которой отложены «баллы боли» от 0 (нет боли) до 5 (максимально выраженная боль) (см. гл. 12). Варианты «классических» аналоговых шкал — хроматическая аналоговая шкала (Grossi E. et al., 1983), Анкета боли МакГилла (Melzack R., 1975) и другие — редко используются в клинических исследованиях ОА. Так как боль является субъективным симптомом, ее выраженность на соответствующей шкале пациент должен отмечать сам.
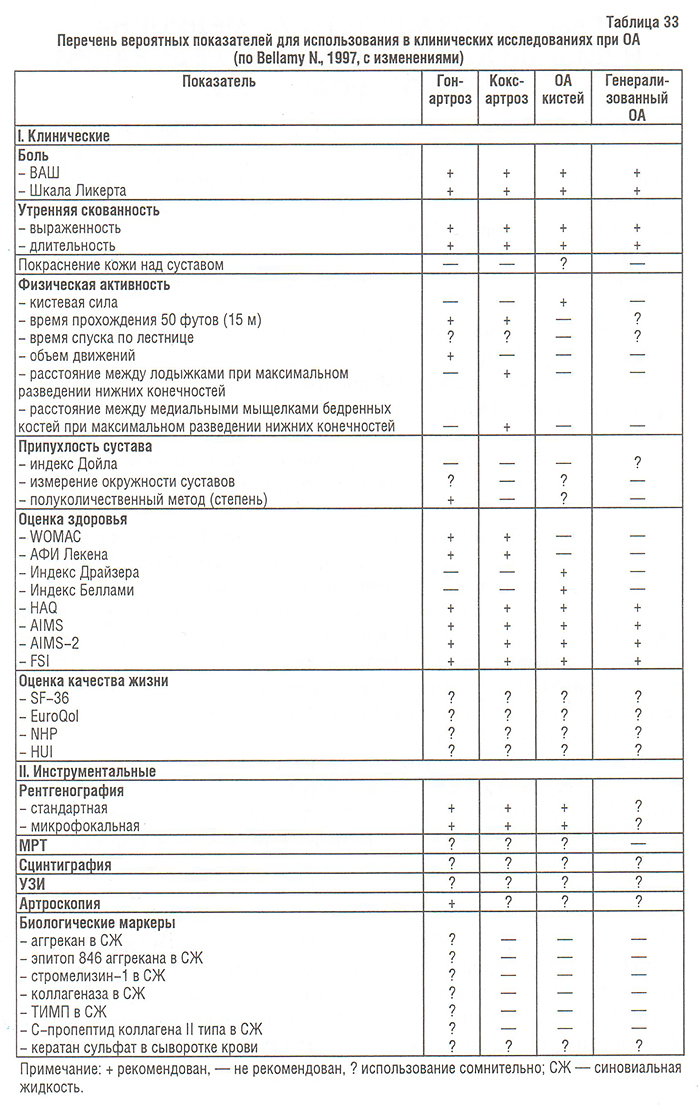
Утренняя скованность у больных с ОА — симптом непостоянный; по сравнению с больными ревматоидным артритом (РА) ее длительность значительно короче (не более 30 мин). Поэтому она имеет меньшее значение в оценке статуса больного ОА, чем, например, боль в суставах. N. Bellamy и W.W. Buchanan (1986) предложили пациентам с ОА самим оценить важность этого симптома. Большинство больных сочли утреннюю скованность умеренно важным симптомом. Учитывая небольшую продолжительность этого симптома, целесообразно оценивать его тяжесть, а не длительность (в отличие от РА). Для облегчения оценки аналоговые шкалы (см. гл. 12) адаптированы для показателя утренней скованности (Bellamy N., 1993b, c, d).
Время прохождения 50 футов. Этот показатель применим только при исследовании больных с ОА суставов нижних конечностей. Результаты исследования, проведенного N. Bellamy и W.W. Buchanan (1984), показали, что даже у больных с гонартрозом и коксартрозом этот показатель малоинформативен, поэтому использование показателя времени прохождения 50 футов в клинических исследованиях у больных с ОА сомнительно (Bellamy N., 1993b, c, d).
Аналогично предыдущему показатель времени подъема по лестнице применим лишь при поражении суставов нижних конечностей. Для него не определены стандарты (например, необходимое количество ступенек). Кроме того, ряд сопутствующих болезней (сердечно-сосудистые заболевания, болезни нервной системы) могут значительно влиять на выполнение данного теста. Таким образом, использование показателя времени подъема по лестнице при ОА также нецелесообразно (Bellamy N., 1997).
Определение объема движений у больных с ОА применимо только для коленного сустава. Ограниченный объем движений в коленном суставе может отражать не только изменения в суставном хряще, но и в суставной капсуле, околосуставных мышцах, связочном аппарате. При сгибании конечности в коленном суставе взаимное расположение осей бедренной и большеберцовой костей изменяется таким образом, что стандартный механический гониометр не сможет правильно измерить угол. Однако соответствующим образом подготовленный специалист может грамотно измерить углы сгибания и разгибания в коленном суставе, в таком случае этот тест можно включить в протокол исследования (Bellamy N., 1993b, c, d). Необходимо заметить, что в клинических исследованиях обнаружена статистически значимая разница объемов движений в коленном суставе между больными, получавшими активное лечение (НПВП) и плацебо (Bellamy N., Buchanan W.W., 1984).
Расстояние между лодыжками при максимальном разведении нижних конечностей. Этот тест, характеризующий объем приведения в тазобедренном суставе, может быть достаточно информативен, если проводится умелым специалистом (Bellamy N., 1993b, c, d). Его информативность продемонстрирована в исследованиях эффективности НПВП у больных с коксартрозом (Bellamy N., Buchanan W.W., 1984). Однако, подобно другим показателям геометрии суставов, этот тест не рекомендуется использовать в клинических исследованиях.
Расстояние между медиальными мыщелками бедренных костей при максимальном разведении нижних конечностей — многоплановый тест, характеризующий объемы приведения и наружной ротации в тазобедренных суставах и объем сгибания в коленных — может быть информативен только в случае выполнения подготовленным специалистом (Bellamy N., 1993b, c, d). Аналогично предыдущему информативность этого показателя продемонстрирована в клиническом исследовании применения НПВП при ОА (Bellamy N., Buchanan W.W., 1984). Необходимость включения данного теста в протокол исследования сомнительна.
Индекс Дойла представляет собой адаптированный индекс Ричи, разработанный специально для РА и ОА (Doyle D.V. et al., 1981). Методика теста включает оценку по балльной системе чувствительности суставов при их пальпации, при движениях в них, а также оценку припухлости сустава. По непонятным причинам он не вызвал интереса у ревматологов, его информативность никто не определял. Не исключено, что после проведения дополнительных исследований индекс Дойла будет рекомендован для включения в протокол клинических исследований больных с генерализованным ОА.
Оценка припухлости сустава представляется спорной, поскольку у больных с ОА она может быть обусловлена не только отечностью мягких тканей, но и разрастанием костной. В первом случае на фоне лечения можно ожидать динамику соответствующих показателей, во втором — нет. Несмотря на то, что измерение окружности суставов в сантиметрах было включено в протокол нескольких исследований (Bellamy N., Buchanan W.W., 1984; Bellamy N., 1993e), информативность этого теста ограничена и зависит от степени подготовленности исследователя. Измерение окружности применимо лишь к коленным суставам и суставам кистей. В первом случае можно использовать стандартную сантиметровую ленту, во втором — специальные пластиковые или деревянные кольца разных размеров (Bellamy N., 1993e). Даже в клинических исследованиях, при которых опыт использования данного теста значительно больший, его редко включают в протокол исследования (Bellamy N., 1993b, c, d, e).
Оценка кистевой силы с помощью пневматического динамометра редко включается в протоколы исследования ОА, вероятно, потому что эти исследования редко фокусируются на ОА кистей (Bellamy N., Buchanan W.W., 1984; Bellamy N., 1993e). Этот тест, безусловно, должен выполнять специально подготовленный исследователь (Bellamy N., 1993b, c, d). При захвате щипком динамометра I и II пальцами можно отдельно оценить первый запястно-пястный сустав кисти больного при поражении ОА. Сложность интерпретации динамики показателя кистевой силы снижает ценность теста для клинических исследований.
Потребление анальгетиков. При оценке эффективности симптоматических препаратов, применяемых в терапии ОА, главным критерием является боль в суставах. В таких случаях для дополнительной оценки динамики болевого синдрома используют показатель приема анальгетиков. Обычно для этого применяют парацетамол. Наряду с исследуемым препаратом пациенту в ходе исследования рекомендуют при необходимости принимать парацетамол с обязательным заполнением специально разработанного дневника. Для дополнительной оценки влияния на болевой синдром препаратов, не относящихся к группе симптоматических (например, хондропротекторов), вместо парацетамола можно использовать НПВП с последующим пересчетом принимаемой дозы на эквивалент диклофенака (табл. 34). Учитывая более высокую частоту развития побочных эффектов при назначении НПВП, предпочтение все же следует отдавать парацетамолу. Для объективизации учета обезболивающих препаратов разрабатываются специальные контейнеры с микрочипом, помещенным в крышку, который записывает количество открываний контейнера.

Общая оценка. Таким методом можно оценить:
- эффективность лечения;
- переносимость лечения;
- функциональную способность больного;
- выраженность болевого синдрома.
Первые три пункта независимо друг от друга оценивают врач и больной, последний — только больной. Обычно общая оценка осуществляется по балльной системе (табл. 35, 36).

Оценка здоровья. Методы оценки здоровья больных с ОА можно разделить на специфические и генерические (Bellamy N., 1997). Такое деление несколько искусственно, однако оно позволяет дифференцировать методы, используемые для всех суставов одновременно (специфические) и для отдельных суставных групп (генерические).
Индекс WOMAC (Western Ontario and McMaster Universities osteoarthritis Index). Тест WOMAC представляет собой вопросник для самостоятельного заполнения больным, состоит из 24 вопросов, характеризующих выраженность боли (5 вопросов), скованность (2 вопроса) и функциональную способность (17 вопросов) больных с гонартрозом и коксартрозом (Bellamy N. et al., 1988). Для заполнения анкеты WOMAC требуется 5–7 мин. Индекс WOMAC — высокоинформативный показатель, который можно использовать для оценки эффективности медикаментозного и немедикаментозного (хирургического, физиотерапевтического) лечения.
Альгофункциональные индексы (АФИ) Лекена. M. Lequesne разработал два АФИ — для ОА коленного и тазобедренного суставов (Lequesne M.G. et al., 1987; 1997). Тесты Лекена также представляют собой вопросники для самостоятельного заполнения больным, вопросы разделены на три группы — боль или дискомфорт, максимальная дистанция ходьбы и повседневная активность (см. гл. 12). Вопрос, касающийся сексуальной сферы больного, который был включен автором в анкету для коксартроза, не обязателен для исследования эффективности противоревматических препаратов (Bellamy N., 1997). Индексы Лекена были рекомендованы EULAR в качестве критерия эффективности при проведении клинических исследований у больных с ОА (WHO, 1985), а наряду с индексом WOMAC — для оценки эффективности так называемых медленно действующих препаратов (SADOA) (Lequesne M.G. et al., 1994). Статистически информативность и надежность индексов WOMAС и Лекена одинакова (Bellamy N., 1995).
Альгофункциональный индекс Драйзера разработан специально для клинических исследований при ОА суставов кистей, представляет собой вопросник из десяти пунктов (Dreiser R.L. et al., 1995). Девять из десяти вопросов касаются функции суставов кистей, а десятый (насколько охотно пациент отвечает на рукопожатие) скорее отражает выраженность болевого синдрома. Индекс Драйзера — относительно новый и малоизученный тест, поэтому до выяснения степени его информативности и надежности лучше не включать его в протокол исследования.
Анкета оценки здоровья (HAQ — Health Assessment Questionnaire) разработана в Стенфордском университете J.F. Fries и соавторами (1978), поэтому имеет еще и второе название — Стенфордская анкета.
HAQ — один из первых методов, специально разработанных для изучения в проспективных и перекрестных исследованиях долгосрочного влияния различных хронических болезней на состояние здоровья пациентов. HAQ как количественный метод, характеризующийся надежностью, обоснованностью и достаточной демонстративностью, играет значительную роль в оценке исходов хронических болезней.
Поскольку Стенфордская анкета имеет ревматологическое «происхождение», иногда ее рассматривают как специфичную для ОА, хотя ее структура, содержание и опыт применения ставят под сомнение это утверждение. HAQ скорее является генерическим, чем специфическим инструментом, поскольку позволяет оценить функциональную недееспособность, побочные эффекты препаратов, экономические затраты и другие аспекты, каждый из которых не характерен для какой-либо болезни.
HAQ существует в трех форматах: полном (расширенном), коротком (2-страничном) и модифицированном. Первый, классический, формат анкеты последнее время почти не используется. Для оценки здоровья чаще всего применяют короткий (short or 2-page HAQ) и модифицированный (mHAQ) форматы (см. главу 13).
Полный HAQ позволяет собрать информацию по 5 показателям здоровья:
- недееспособность (disability);
- боль или дискомфорт;
- побочные явления лечения;
- стоимость лечения;
- отсрочивание смерти.
Также анкета содержит дополнительные показатели: демографическая информация, образ жизни и привычки.
2-страничная анкета HAQ состоит из индекса недееспособности HAQ (HAQ Disability Index, HAQ-DI), ВАШ боли и ВАШ общей оценки здоровья пациентом.
HAQ-DI оценивает степень функциональной способности пациента и включает 20 вопросов, разделенных на 8 категорий, характеризующих движения верхних и нижних конечностей. Каждый вопрос построен по схеме «Способны ли вы выполнить то или иное действие в течение последней недели?». Ответы пациента представляют собой 4-балльную шкалу от 0 (дееспособность отсутствует) до 3 (полностью недееспособен). В результате HAQ-DI представляет собой среднее арифметическое полученных ответов. ВАШ боли предназначена для оценки наличия или отсутствия боли, связанной с артритом, и степени ее тяжести за последнюю неделю.
Самым распространенным форматом Стенфордской анкеты является ее модифицированный вариант, состоящий из 8 вопросов, ответы на которые также оцениваются по 4-балльной шкале (см. главу 13).
Данные клинических исследований свидетельствуют о том, что минимальной клинически значимой разницей для HAQ является изменение на 0,22 балла (B. Bruce, J.Fries, 2003).
Однако HAQ имеет ряд недостатков, например, с помощью анкеты невозможно оценить недееспособность при дисфункции органов чувств или в психиатрической практике, удовлетворенность пациента и его социальные связи.
HAQ обычно используют для оценки здоровья пациента с генерализованным ОА.
AIMS (Arthritis Impact Measurement Scale) разработана R.F. Meenan и соавторами (1980). 46 вопросов анкеты AIMS разделены на 9 категорий — подвижность, физическая активность, ловкость, социальная роль, социальная активность, повседневная жизнь, боль, депрессия, беспокойство (см. гл. 12). G. Griffiths и соавторы провели сравнительное исследование анкет WOMAС, HAQ и AIMS и обнаружили некоторое преимущество первой. Авторы рекомендуют использовать анкету WOMAC в исследованиях ОА коленного и/или тазобедренного суставов, а анкеты HAQ и AIMS — в исследованиях генерализованного ОА.
KOOS (Knee injury and Osteoarthritis Outcome Score (Roos E.M., Lohmander L.S., 2003) представляет собой специфичный для коленного сустава опросник, созданный для оценки разного рода поражений коленных суставов (ОА, травмы) и результатов протезирования (Roos E.M., Toksvig-Larsen S., 2003). Основой для его создания стало то, что травмам суставов обычно сопутствуют повреждения многих структур (связок, менисков, хряща и др.), а исходом травм коленного сустава часто бывает ОА. По мнению авторов, KOOS позволяет наблюдать пациента, следить за эволюцией симптомов, функций и т.д. в течение длительного времени после травмы.
Анкета KOOS состоит из 42 вопросов, распределенных на 5 групп:
P — боль (9 вопросов);
S — симптомы (7 вопросов);
ADL — ограничения повседневной жизнедеятельности (17 вопросов);
SP — спорт и развлечения (5 вопросов);
QOL — качество жизни, связанное с коленным суставом (4 вопроса).
Ответы на вопросы в анкете КOOS можно кодировать в виде ВАШ Ликерта (0–4) или в виде 10 см, или 100 мм ВАШ (см. главу 13).
HOOS (Hip Disability and osteoarthritis outcome score ). Для оценки результатов протезирования тазобедренных суставов в настоящее время существует более 20 скоринговых систем. Для высокочувствительной и специфичной оценки клинических изменений через некоторое время после тотальной артропластики тазобедренных суставов A.K. Nilsdotter и соавторы (2003) разработали на основе WOMAC LK 3.0 и KOOS специальный опросник Hip Disability and osteoarthritis outcome score (HOOS). Последний состоит из 5 рубрик (всего 50 вопросов), позволяющих оценить:
Р — боль (12 вопросов);
S — симптомы, включая скованность и объем движения в суставах (10 вопросов);
АDL — ограничения повседневной жизнедеятельности (18 вопросов);
SP — спорт и развлечения (6 вопросов);
QOL — качество жизни, связанное с тазобедренным суставом (4 вопроса).
Ответы на вопросы в анкете HOOS можно также кодировать в виде ВАШ Ликерта (0–4) или в виде 10 см, или 100 мм ВАШ (см. главу 13).
HOOS включает все вопросы WOMAC LK 3.0 в неизмененном виде, что позволяет одновременно оценить статус пациента по WOMAC.
FSI (Functional Status Index) разработан A.M. Jette, O.L. Deniston (1978) как часть Pilot Geriatric Arthritis Project. Существуют две версии FSI: «классическая», состоящая из 45 вопросов, классифицированных на три категории (зависимость, боль, повседневная активность), для заполнения которой требуется 60–90 мин, и укороченная (пересмотренная), состоящая из 18 вопросов, разделенных на 5 групп (общая подвижность, подвижность кисти, самообслуживание, работа по дому, межличностные контакты), для заполнения которой требуется 20–30 мин. Особенностью FSI является обязательное участие опрашивающего лица (врача, исследователя) при заполнении анкеты. FSI можно использовать при проведении клинических исследований у больных с генерализованным ОА, хотя предпочтение все же следует отдавать HAQ и AIMS.
Качество жизни. В последние годы оценка качества жизни больного стала чрезвычайно важной и крайне востребованной частью оценки качества лечения и исходов болезни. Для популяции пациентов с хроническими заболеваниями оценка качества жизни дает возможность определить влияние лечебных программ в случаях, когда излечение невозможно.
QOLS (Quality of Life Scale). Автором первой шкалы качества жизни является американских психолог Джон Фланаган (Flanagan J.C., 1978). За последние 20 лет создано несколько сотен различных методик оценки качества жизни (с большинством из них можно ознакомиться на сайте www.qolid.org). По мнению P.M. Fayers и соавторов (1997), за редким исключением современные методы оценки качества жизни являются скорее «случайными признаками качества жизни».
В настоящее время назрела необходимость, чтобы врачи знали о существовании понятия концептуального определения качества жизни и не путали его с функциональным статусом, симптомами, естественным течением болезни или побочными эффектами лечения (Leplege A. et al., 1997; Anderson K.L. et al., 1999; Haas B.K., 1999; Smith K.W. et al., 1999). Общепринятое определение качества жизни все еще находится в стадии разработки. Наиболее удачным, на наш взгляд, является определение D.A. Revicki и соавторов (2000): «Качество жизни представляет собой широкий спектр событий, относящихся к общему благополучию человека. Оно подразумевает субъективную оценку функционирования в сравнении с личными ожиданиями и определяется субъективной оценкой событий, состояний и восприятий. По своей природе качество жизни индивидуально, однако интуитивно поддается интерпретации и пониманию большинством людей». Это определение выводит за рамки здоровья понятие качества жизни. Первая шкала качества жизни (Quality of Life Scale), разработанная Д. Фланаганом, наиболее точно подходит под это определение (Flanagan J.C., 1978, 1982).
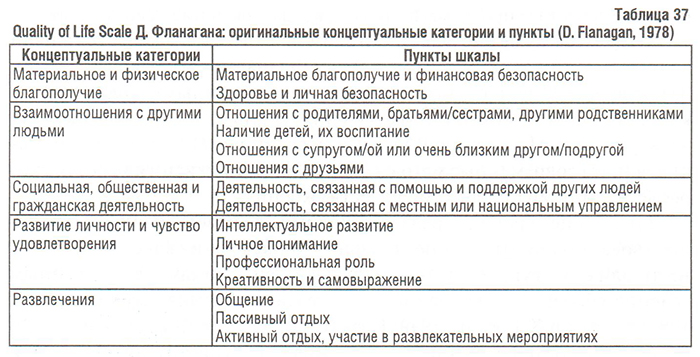
Оригинальная шкала Фланагана состояла из 15 пунктов, которые позволяли измерить 5 концептуальных областей качества жизни: материальное и физическое благополучие, взаимоотношения с другими людьми, социальная, общественная и гражданская деятельность, личное развитие и чувство удовлетворения, развлечения (табл. 37). Позже Фланаган ввел в свою шкалу еще одну категорию — независимость, т.е. возможность заботиться о себе. Для разработки шкалы Д. Фланаган в середине 70-х годов ХХ в. обследовал около 3000 лиц разного возраста, пола, расы, уровня образования из всех регионов США. Фланаган прилагал максимум усилий для того, чтобы среди опрошенных были представлены этнические меньшинства, жители сельской местности, дети, представители категории населения с низким доходом. По словам самого Д. Фланагана, целью охвата широких слоев населения было не получение точных данных, а желание убедиться в том, что в шкале учтены разные точки зрения и опыт (Flanagan J.C., 1982). До сего дня никакой другой метод оценки качества жизни, кроме QOLS Д. Фланагана, не создавался с таким исключительным вниманием к многообразию и индивидуальности аспектов качества жизни.
Вторым шагом Д. Фланагана к созданию своего инструмента оценки качества жизни стало обследование 3000 людей в возрасте 30, 50 и 70 лет с использованием 5-пунктовой шкалы «важности» и «удовлетворения потребности». В результате оказалось, что опрошенные лица независимо от возраста и пола посчитали заданные им вопросы важными, за исключением пунктов, касающихся участия в местном или национальном управлении (большинство 30-летних сочли это не существенным), а также креативность и самовыражение, общение и пассивный отдых (большинство мужчин считали не существенным) (Flanagan J.C., 1982).
Развивая концепцию оценки качества жизни, профессор Д. Фланаган допускал, что его шкала нуждается в некоторой адаптации для хронических больных, и в 1981 г. он дал на это авторское разрешение. Новый метод получил название Адаптированная шкала качества жизни (Adapted Quality of Life Scale) или шкала качества жизни Фланагана (Flanagan Quality of Life Scale) (Flanagan J.C., 1982; Burckhardt C.S. et al., 2003).
К настоящему времени разработано несколько методов оценки качества жизни. В клинических исследованиях у больных с ОА чаще используют Short Form-36 (SF-36) Health Status Questionnaire (Ware J.E. et al., 1992), EuroQol (Hurst N.P. et al., 1994), Health Utilities Index (Feeny D. et al., 1992) и Nottingham Health Profile (Hunt S.M. et al., 1981).
Short Form-36 (SF-36) Health Status Questionnaire (Ware J.E. et al., 1992) состоит из 36 вопросов для самостоятельного заполнения пациентом в течение 5 мин (см. гл. 13). SF-36 и приведенная ниже анкета EuroQol разработаны таким образом, что они могут быть заполнены интервьюером по телефону или разосланы больным по почте.
EuroQol (European Quality of Life Questionnaire) (Hurst N.P. et al., 1994) состоит из двух частей — непосредственно вопросника из 5 вопросов и ВАШ, по которой пациент оценивает состояние своего здоровья (см. гл. 13).
Анкета Health Utilities Index (HUI) (Feeny D. et al., 1992) была совместно разработана Health Utility Inc. и университетом McMaster. Первая версия HUI (HUI I) была создана специально для оценки исходов у новорожденных с дефицитом массы тела. Основываясь на этом опыте, авторы приступили к разработке HUI II, рассчитанной специально на детей со злокачественными опухолями, отражающей все многообразие форм и последствий рака. В дальнейшем HUI II нашла свое применение у разных пациентов: от опухолевых до пациентов с болезнью Альцгеймера. Разрабатывая HUI III, авторы стремились создать инструмент для оценки качества жизни, применимый как в клинических испытаниях, так и в исследованиях общей популяции населения (Horsman J. et al., 2003).
HUI представляет собой шкалу из 8 показателей (зрение, слух, речь, ходьба, ловкость, эмоции, когнитивная способность, боль), которые стандартизированно оцениваются по 4–6-балльной шкале (см. гл. 13). Для количественной обработки полученных результатов используются специальные таблицы пересчета, которые также приведены в гл. 13. Существуют два метода пересчета HUI — моноатрибутивная (HUI Single-Attribute Utility Function) и мультиатрибутивная (HUI Multi-Attribute Utility Function) функции полезности. Первый метод очень прост в использовании: сумма баллов, соответствующих уровням каждого признака состояния здоровья, и является индексом HUI. Последний — оценивают в динамике, его изменение на ≥0,05 балла считается клинически значимым (Horsman J. et al., 2003). Существуют данные, свидетельствующие о том, что значимым может являться изменение HUI даже на 0,03, а в некоторых случаях — и на 0,01 балла (Drummond M., 2001). При использовании мультиатрибутивной системы пересчета итоговый индекс представляет собой точку Смерть на шкале (0 баллов), а идеальное состояние здоровья соответствует 1 баллу.
Наиболее часто HUI используют в проспективных исследованиях как средство количественного и качественного описания состояния здоровья. Эту анкету очень редко применяют для оценки качества жизни больных ревматического профиля. Обычно предпочтение отдают SF-36, реже — EuroQol.
Анкета Nottingham Health Profile (Hunt M. et al., 1981) включает 38 пунктов, разделенных на 6 секций: подвижность, боль, сон, социальная изоляция, эмоциональные реакции, уровень активности. Эту анкету больной может заполнять самостоятельно. Как и предыдущую анкету, Nottingham Health Profile крайне редко используют в ревматологии.
К сожалению, в настоящее время не существует специфической для ОА анкеты, позволяющей оценить качество жизни больного. Обычно в клинических исследованиях с этой целью используют анкеты SF-36, ее модификации и EuroQol, реже — другие анкеты. Основным их недостатком является неспецифичность для ОА и ограниченная клиническая значимость. Так, результаты анкетирования могут продемонстрировать статистически значимое или незначимое изменение качества жизни в процессе прогрессирования болезни или на фоне лечения, а также отличие качества жизни и ее компонентов у больных с ОА и пациентов с другими ревматическими или неревматическими болезнями, а также здоровых людей. В то же время невозможно определить, насколько изменилось качество жизни у пациента с SF-36, составляющим 30,4 балла, или индексом EuroQol 1,2 балла.
Минимальная клинически значимая разница (МКЗР).
Информативность этого показателя для анализа оценивания пациентами с ОА и РА боли, активности болезни, общего состояния здоровья была подтвеждена в многочисленных исследованиях (Goldsmith S. et al., 1993; Wells G.A. et al., 1993; Guyatt G. et al., 1998; Sloan J. et al., 2003).
Методы определения МКЗР для анкет, использующих ответы пациентов, можно разделить на 2 категории (Samsa D. et al., 1999):
1) якорные, или основанные на непосредственных наблюдениях («якорем» в данном случае могут служить нормативные данные или результаты, полученные в рандомизированном клиническом исследовании с использованием другого критерия эффективности, и др.) (Zhao S.Z. et al., 1999; Enrich E.W. et al., 2000);
2) распределительные, или основанные на методе статистического распределения.
Якорный метод может быть прямым, проспективным и перекрестным. При использовании прямого якорного метода пациентов опрашивают, чтобы оценить относительную разницу между двумя состояниями здоровья (например, без изменений vs несколько улучшилось или несколько ухудшилось). Каждому из состояний присвоен определенный балл, разница между которыми — МКЗР. При перекрестном подходе сравнивают показатель качества жизни двух популяций с различной степенью выраженности болезни. В данном случае МКЗР представляет собой разницу между этими показателями. Проспективный метод дает возможность рассчитать МКЗР на основе сопоставления показателей состояния здоровья пациентов в начале и в конце определенного периода наблюдения.
Методы визуализации. К настоящему времени ни для одного лекарственного вещества не доказаны хондропротекторные свойства, которые определены как «способность замедлять, останавливать или обращать дегенеративный процесс в гиалиновом хряще у больных ОА» (Lequesne M.G. et al., 1994; Bellamy N., 1997). Во многом это объясняется тем, что вопрос о способе идентификации феномена хондропротекции и возможностях в этом плане рентгенографии или альтернативных методов (артроскопия, МРТ) до сих пор широко не обсуждался.
Рентгенография. В последние годы появилось большое количество публикаций, посвященных рентгенографии суставов, пораженных ОА (см. гл. 7). Усовершенствованы методики съемки, появилось множество количественных (измерение ширины суставной щели) и полуколичественных (оценка в баллах, степенях) методов оценки рентгенограмм у больных с ОА. При проведении крупных контролированных исследований рентгенография — наиболее предпочтительный метод визуализации, который может косвенно охарактеризовать динамику морфологических изменений в тканях сустава, пораженного ОА.
Использование МРТ в контролированных исследованиях при ОА ограничено высокой ценой и малой доступностью. Более того, имеются данные о лишь частичной конкордантности повреждений суставного хряща, обнаруживаемых на МРТ и при артроскопии (Adams M.E. et al., 1991). L. Pilch и соавторы (1994) обнаружили ошибки в программном обеспечении компьютера, использовавшегося для волюметрических исследований суставного хряща при ОА. Таким образом, необходимо дальнейшее изучение возможностей МРТ при проведении клинических исследований больных с ОА.
P. Dieppe и соавторы (1993) подтвердили способность сцинтиграфии в прогнозировании сужения суставной щели при ОА. Однако ее роль в оценке динамики морфологических изменений в тканях пораженных суставов при проведении клинических исследований остается сомнительной.
S.L. Myers и соавторы (1995) in vitro продемонстрировали, что высокочастотное УЗИ обеспечивает точное измерение толщины суставного хряща человека, а также воспроизводит точное изображение его поверхности. Кроме того, УЗИ — достаточно доступный метод, не сопряженный с лучевой нагрузкой. Однако способность определять хондропротекторные свойства лекарственных веществ с помощью УЗИ не доказана. Требуется дальнейшее изучение возможностей УЗИ в этом направлении.
Артроскопия дает наиболее достоверную информацию о состоянии суставного хряща и тканей полости сустава. Разработано большое количество систем оценки хондроскопии (см. гл. 7). Несмотря на это, высокая инвазивность метода резко ограничивает его использование в клинических исследованиях.
Биологические маркеры, а также их достоинства и недостатки подробно описаны в гл. 8.
Различные ревматологические и неревматологические организации (например, EULAR, FDA, SADOA, ORS) опубликовали рекомендации по дизайну исследований ОА (табл. 38). В настоящее время наиболее широкое распространение получили рекомендации OMERACT III (Outcome Measures in Arthritis Clinical Trials) и рекомендации ORS (Osteoarthritis Research Society) по дизайну и проведению клинических исследований при ОА.

OMERACT III
Основным результатом первой конференции OMERACT (OMERACT I), которая состоялась в 1992 г., была разработка рекомендаций по проведению клинических исследований при РА. Именно эти рекомендации легли в основу появившихся позже критериев улучшения РА. В ходе следующей конференции OMERACT II рассматривались вопросы измерения токсичности лекарственных препаратов, которые используются в лечении ревматических болезней, оценки качества жизни больных ревматического профиля и вопросы фармакоэкономики. Третья конференция OMERACT (1996) закончилась разработкой рекомендаций по проведению клинических исследований при ОА и остеопорозе.
Из всего вышесказанного видно, что движение OMERACT вышло за пределы изучения РА, что было изначально отражено в его названии. Поэтому было предложено переименовать его в OMR (Outcome Measures in Rheumatology), а после включения остеопороза — в OMMSCT (Outcome Measures in Musculoskeletal Clinical Trials). Главным образом из-за благозвучности первой аббревиатуры было решено оставить название OMERACT.
Еще до начала конференции участникам предложили заполнить анкеты для определения показателей, которые потенциально могли служить критериями эффективности при проведении клинических исследований ОА. Затем была предложена другая анкета, в которой участников просили ранжировать по значимости показатели в зависимости от локализации ОА (коленного, тазобедренного суставов, суставов кистей и генерализованный ОА), от класса исследуемых лекарственных препаратов (симптоматические или модифицирующие структуру хряща), от класса показателей (клинические, инструментальные и БМ). Второе задание оказалось сложным, поскольку лишь 15 заполненных анкет были возвращены в секретариат конференции.
Уже в ходе OMERACT III участники конференции должны были предложить перечень показателей для включения их в:
- основной перечень критериев эффективности (обязательный для клинических исследований III фазы больных с ОА коленных, тазобедренных суставов, суставов кистей);
- дополнительный перечень критериев эффективности (т.е. тех, которые в будущем могут быть включены в основной);
- перечень критериев, которые не войдут ни в основной, ни в дополнительный.
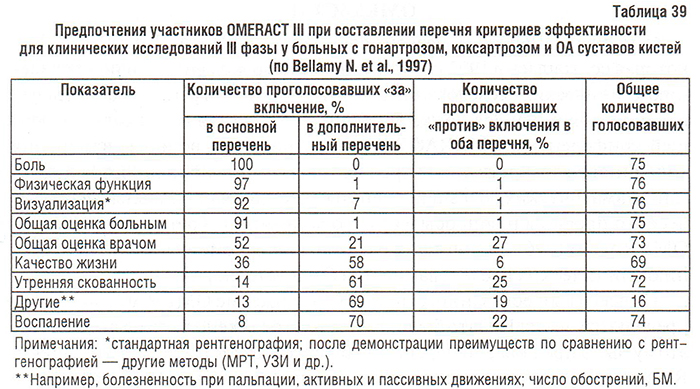
После обнародования результатов голосования (см. табл. 38) возникли несколько важных вопросов, требовавших решения (Bellamy N. et al., 1997):
- Является ли генерализованный ОА отдельным от других форм заболевания объектом для клинического исследования? (Резолюция — в дальнейшем генерализованный ОА не рассматривать в качестве объекта для клинического исследования);
- Определяет ли время начала действия исследуемого лекарственного вещества необходимость различных критериев эффективности? (Резолюция — время начала действия определяет скорее когда исследовать, чем что исследовать);
- Требуют ли исследования эффективности «простых» анальгетиков и НПВП различных критериев? (Резолюция — группы критериев одни и те же, а методы их определения могут варьировать);
- Должны ли быть различными критерии эффективности для симптоматических лекарственных препаратов (symptom modifying drugs) и препаратов, модифицирующих структуру хряща (structure modifying drugs)? (Резолюция — группы показателей, входящих в основной перечень, должны быть одинаковыми);
- Предполагается, что БМ в будущем будут важной частью протокола клинического исследования ОА, однако в настоящее время убедительных данных, свидетельствующих о значении БМ в оценке эффективности лечения больных, а также о их прогностическом для ОА значении недостаточно;
- Было признано, что ни для одного из существующих методов оценки качества жизни не продемонстрировано преимуществ по сравнению с другими. Отмечена важность оценки качества жизни при проведении клинических исследований при ОА. (Резолюция — не включать оценку качества жизни в основной перечень критериев эффективности, но рекомендовать ее использовать при проведении исследований III фазы продолжительностью не менее 6 мес; в ближайшие 3 года — 5 лет определить роль показателя качества жизни при проведении клинических исследований);
- Было отмечено, что не исключается использование в будущем при исследовании эффективности вновь созданных препаратов тех критериев, которые не вошли в основной и дополнительный перечни;
- Необходимо ли включать симптом «скованность» в какой-либо из перечней критериев эффективности; относятся ли боль и скованность к одной и той же группе показателей; понимают ли больные ОА саму концепцию «скованности»; насколько существующие методы способны оценить скованность? (Резолюция — для оценки скованности у больных с ОА коленного или тазобедренного сустава следует использовать WOMAC или индекс Лекена);
- Обсуждался вопрос информативности показателя «общая оценка врача» при проведении клинических исследований у больных с ОА (аналогичную проблему обсуждали в ходе OMERACT I в отношении РА); несмотря на то, что лишь 52% участников конференции высказались за включение его в основной перечень критериев эффективности, показатель не был исключен.
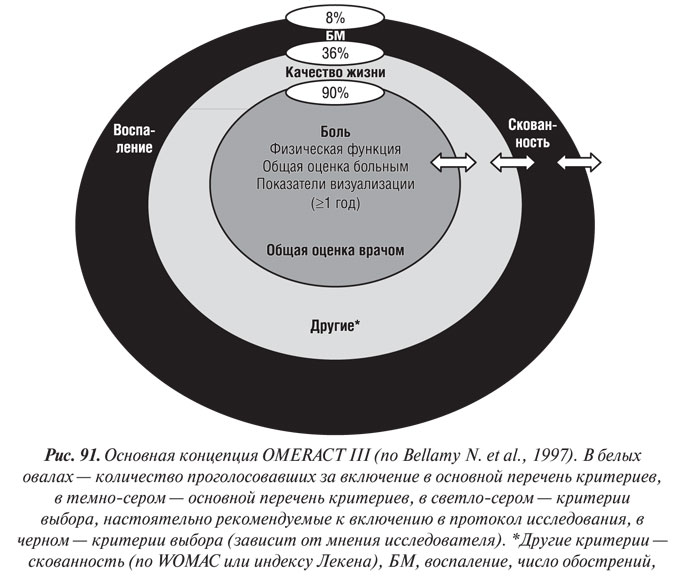
При составлении перечня критериев было решено включать не сами показатели, а их группы, оставляя окончательный выбор метода оценки за исследователем. Более 90% участников конференции OMERACT III высказались за включение в основной перечень следующих показателей (или их групп) (рис. 91):
- боль;
- физическая функция;
- общая оценка больным;
- методы визуализации (при длительности исследования 1 год и более в качестве критерия эффективности и безопасности препаратов, модифицирующих структуру хряща).
ORS
В основе рекомендаций Osteoarthritis research Society (ORS) лежит разделение противоартрозных препаратов, предложенное WHO и ILAR, на две группы — симптоматические (быстро- и медленнодействующие) и модифицирующие структуру хряща. Очевидно, что демонстрация преимуществ этих препаратов во многом будет зависеть от дизайна исследования и выбранных критериев эффективности. При этом дизайн исследования будет зависеть от механизма действия лекарственного вещества и ожидаемого результата.
При планировании исследования необходимо учитывать следующие факторы:
- фармакодинамику препарата;
- время от начала приема препарата до появления эффекта;
- длительность сохранения эффекта, полученного в результате лечения, после отмены препарата;
- путь применения препарата (местно, внутрь, парентерально и др.);
- частоту и выраженность побочных эффектов;
- влияние на болевой синдром;
- влияние на воспаление;
- влияние на другие симптомы болезни.
Большинство членов комитета, принимавших участие в изучении этого вопроса, склонялись к мысли, что в отношении дизайна клинических исследований ОА нет необходимости разделять симптоматические препараты на два подкласса — быстро- и медленнодействующие (Altman R.D. et al., 1996). К первым относят ненаркотические анальгетики и НПВП, ко вторым — препараты, для которых симптоматическое действие не является основным, — гиалуроновая кислота, хондроитин сульфат, глюкозамин, диацереин. Таким образом, в данных рекомендациях термин «симптоматические лекарственные средства» используется как для быстро-, так и для медленнодействующих симптоматических препаратов. При составлении протокола исследования следует иметь в виду, что симптоматический препарат может обладать свойствами модифицировать структуру хряща (благоприятными и неблагоприятными).
Независимо от влияния на симптомы болезни препарат может оказывать действие на структуру или функцию пораженного сустава. Протокол исследования эффективности препаратов, вероятно, модифицирующих патологический процесс при ОА, должен включать критерии, отражающие изменение структуры сустава. Такие препараты могут:
1) предотвращать развитие ОА и/или
2) предотвращать, замедлять прогрессирование имеющегося ОА или стабилизировать состояние больного.
Препарат, обладающий патогенетическим действием, не обязательно должен влиять на симптомы ОА. Симптоматического эффекта такого препарата следует ожидать лишь после длительного периода лечения. В цели исследования эффективности препарата, модифицирующего структуру хряща, не обязательно включать изучение его симптоматического эффекта.
Препараты, потенциально способные модифицировать структуру хряща, называют «хондропротекторами», «препаратами, модифицирующими болезнь» (DMOADs — Disease Modifying OA drugs), «препаратами, модифицирующими анатомию», «препаратами, модифицирующими морфологию» и т.д. (Altman R.D. et al., 1996). К сожалению, нет единого мнения относительно термина, который наиболее полно отражал бы действие этих агентов. ORS в своих рекомендациях использует термин «препараты, модифицирующие структуру» и отмечает, что к настоящему времени ни для одного агента не доказаны свойства модифицировать структуру хряща in vivo у человека.
Уровни клинических исследований ОА. В ходе предклинических исследований изучают потенциальный механизм действия и терапевтическую широту (эффективная — токсичная дозы) препарата. Результаты предклинического исследования могут сократить продолжительность клинического исследования потенциального препарата, модифицирующего структуру хряща.
I фаза клинических испытаний. Изучают фармакокинетику и безопасность препарата, иногда дополнительно — дозы препарата. В зависимости от поставленных задач объектами исследования обычно выступают здоровые волонтеры или больные с ОА без сопутствующей патологии. Оптимальным для изучения безопасности испытуемого препарата в I фазе является двойное слепое плацебо-контролированное исследование с одной или несколькими дозами препарата. Оценка эффективности лечения может выступать в качестве второстепенной задачи.
II фаза клинических испытаний. Целью II фазы является определение идеальной терапевтической широты и режимов дозирования изучаемого препарата. Длительность исследования и количество пациентов зависят от механизма действия препарата, длительности его действия, критериев эффективности, которые будут использованы в протоколе исследования, вариабельности изучаемых параметров, а также популяции больных. В этом и последующих исследованиях необходимо определить минимальную эффективную и максимальную переносимую дозы препарата, а также профиль эффектов этих доз у больных с ОА.
Исследование симптоматического лекарственного средства II фазы должно быть плацебо-контролированным рандомизированным и двойным слепым. Эффективность препаратов может быть продемонстрирована в течение нескольких дней испытаний. Более длительное исследование (в течение нескольких недель) может потребоваться для демонстрации медленного начала действия препарата или длительности полученного эффекта. Для изучения безопасности препарата может понадобиться еще более длительное исследование. При проведении длительных испытаний симптоматических препаратов может понадобиться назначение обезболивающих препаратов. С этой целью следует назначать анальгетики короткого действия после соответствующего «отмывочного» (washout) периода.
Целью III фазы клинических испытаний является убедительная демонстрация эффективности и безопасности оптимальных доз исследуемого препарата и режимов дозирования. В ходе исследования оценивается только один сустав (обычно коленный, при двустороннем ОА — наиболее пораженный). В этой фазе клинических испытаний необходимо окончательно определить дозы препарата и режим дозирования, которые будут рекомендованы для использования в клинической практике, продолжить изучение его токсичности, а также сравнить тестируемый препарат с референтным и/или плацебо. Объем и длительность исследования должны быть спланированы таким образом, чтобы по истечении необходимого периода времени определить клинически и статистически значимую разницу параметров эффективности препарата между основной и контрольной группами больных. Необходимое количество пациентов и длительность исследования безопасности препарата рассчитывают, исходя из рекомендаций для хронических заболеваний Guidelines for Industry.
Длительность ІІІ фазы клинических испытаний эффективности быстродействующих симптоматических препаратов должна быть не более 4 нед (иногда значительно меньше). Для объективизации исследования необходим адекватный «отмывочный» (washout) период. В целях более глубокого изучения безопасности быстродействующего симптоматического агента вслед за коротким двойным слепым исследованием можно провести более длительное двойное слепое или открытое испытание. Для демонстрации эффективности медленно действующих симптоматических средств понадобится более длительный период, а также дополнительное обезболивание.
Объем исследования, необходимого для демонстрации эффективности препаратов, модифицирующих структуру хряща, не определен. Продолжительность такого испытания не должна быть меньше 1 года. Главными или первичными критериями эффективности должны быть структурные изменения в суставах, пораженных ОА. Численность исследуемой популяции следует рассчитать, исходя из результатов ІІ фазы.
IV фаза клинических испытаний проводится после разрешения соответствующими органами клинического использования препарата. Исследования IV фазы проводятся в целях более глубокого изучения данных клинических наблюдений, в результате которых расширяется перечень показаний. Кроме того, в ходе исследования изучают редко встречающиеся побочные явления, а также эффективность длительного лечения тестируемым препаратом. Некоторые исследования IV фазы могут быть открытыми.
Включение пациентов в исследование. Для изучения симптоматического эффекта тестируемого агента важным является исходный уровень выраженности симптомов, который позволит оценить их динамику. Таким образом, обязательными критериями включения больных в исследование эффективности симптоматических препаратов являются следующие:
- выраженность болевого синдрома по ВАШ не менее 2,5 см или по 5-балльной шкале Ликерта — не менее 1 балла (см. гл. 12);
- наличие определенных рентгенологических критериев ОА, например, II стадия (или выше) по Kellgren и Lawrence для ТФО коленного сустава (т.е. наличие определенных ОФ) или II стадия (или выше) по модифицированной шкале Croft для тазобедренных суставов.Среди критериев включения в исследование эффективности препаратов, модифицирующих структуру хряща, обязательными являются следующие:
- для изучения способности предотвращать развитие изменений, свойственных ОА 0 или I стадии на рентгенограммах по Kellgren и Lawrence (т.е. отсутствие определенных ОФ); для изучения способности замедлять патологический процесс II или III стадии или предотвращать его прогрессирование по Kellgren и Lawrence, при которых степень сужения суставной щели позволяет оценить прогрессирование заболевания;
- наличие боли в исследуемых суставах в момент включения или в анамнезе не обязательно; динамика болевого синдрома может быть изучена как вторичный (дополнительный) критерий эффективности.
В исследованиях препаратов, модифицирующих структуру хряща, важным является выбор субпопуляции пациентов с высоким риском быстрого прогрессирования ОА. Для определения такой субпопуляции можно использовать некоторые БМ, способные прогнозировать прогрессирование изменений на рентгенограммах пораженных суставов.
Кроме того, среди критериев включения необходимо указать возраст и пол исследуемых больных, какие диагностические критерии будут использоваться, какие суставы, пораженные ОА, будут изучаться (например, коленные или тазобедренные).
Критерии исключения также должны быть четко очерчены; в них необходимо указать следующее:
- степень выраженности симптомов ОА;
- степень рентгенографических изменений;
- сопутствующие болезни;
- наличие пептической язвы в анамнезе (если предполагается токсичность препарата в отношении слизистой оболочки пищеварительного тракта);
- сопутствующая терапия;
- беременность/контрацепция;
- внутрисуставные инъекции депо-кортикостероидов или гиалуроновой кислоты;
- приливно-отливный лаваж;
- наличие вторичного ОА.
Интервал времени, прошедшего после последней внутрисуставной инъекции депо-кортикостероидного препарата или гиалуроновой кислоты, является важным критерием исключения. Он необходим для оптимальной минимизации возможного влияния внутрисуставных инъекций на симптомы ОА. Рекомендованный интервал составляет не менее 3 мес. Исследователь может увеличить этот интервал при использовании гиалуроновой кислоты, поскольку достоверные данные о длительности ее симптоматического эффекта отсутствуют. При проведении длительных (более 1 года) исследований необходима стратификация пациентов, получавших внутрисуставные инъекции до начала испытания.
Дополнительными критериями исключения являются:
- серьезная травма пораженного сустава в течение 6 мес до начала исследования;
- артроскопия в течение 1 года до начала исследования;
- поражение позвоночника или суставов нижних конечностей, сопровождающееся выраженным болевым синдромом, что может затруднить оценку исследуемого сустава;
- использование больным вспомогательных приспособлений для передвижения (за исключением трости, костыля);
- сопутствующие ревматические болезни (например, фибромиалгия);
- тяжелое общее состояние больного.
Женщины детородного возраста должны быть обследованы на наличие беременности и при ее обнаружении исключены из исследования.
Клиническая характеристика больных должна включать:
- локализацию ОА;
- количество симптоматичных суставов с клинической симптоматикой;
- наличие суставов кистей, пораженных ОА (узлы Гебердена, Бушара, эрозивный ОА);
- длительность симптомов ОА;
- период с момента установления диагноза ОА;
- предыдущее лечение (препараты, дозы, длительность терапии);
- хирургическое лечение исследуемого сустава в анамнезе (включая артроскопию) с обязательным указанием дат;
- использование вспомогательных приспособлений (трости, костыли, наколенники);
- внутрисуставные инъекции в анамнезе (препарат, доза, кратность инъекций, длительность лечения, количество курсов) с указанием дат последних инъекций.
Дополнительно в клинической характеристике больных можно указать:
- курение (сколько сигарет в день, как давно курит; если в настоящее время не курит — сколько лет курил и как давно отказался от курения);
- гормональный статус (период постменопаузы);
- сопутствующие хронические заболевания;
- сопутствующая терапия (например, эстрогены, противовоспалительные препараты).
Протокол исследования ограничивается оценкой одной группы суставов (например, коленного или тазобедренного). При двустороннем поражении оценивают сустав с наиболее выраженными симптомами поражения. Изменения в контралатеральном суставе могут рассматриваться в качестве вторичных критериев. При изучении эффективности потенциальных препаратов, модифицирующих структуру хряща, изменения в контралатеральном суставе, который в начале исследования был интактным или с минимальными изменениями, могут оказаться клинически и статистически значимыми. Этот факт необходимо учитывать при составлении протокола исследования и анализа полученных результатов.
При физикальном обследовании изучаемых суставов необходимо обратить внимание на наличие воспаления (например, суставного выпота), уменьшения объема движений, деформаций и контрактур сустава. Наличие выраженной вальгусной/варусной деформации крупных суставов является критерием исключения.
При оценке степени функциональных нарушений в исследуемом суставе перед началом исследования необходимо использовать систему WOMAC или АФИ Лекена.
Общее физикальное обследование следует произвести в начале и в конце исследования.
Важным условием включения больного в исследование является подписание информированного согласия на участие в исследовании, составленного в соответствии с Хельсинкской Декларацией последнего пересмотра и утвержденного соответствующей структурой исследовательского учреждения.
Процедура проведения исследования. Исследования эффективности препаратов, применяемых при ОА, должны быть контролированными рандомизированными двойными слепыми с участием параллельных групп. В начале исследования используют скрининговый и базисный (рандомизационный) визиты, в ходе которых собирают анамнез, проводят исследование крови и другие анализы, проверяют, удовлетворяет ли больной критериям включения и др.; затем рандомизируют больных согласно предварительно разработанной схеме.
Во время каждого визита кроме исследования пораженного сустава необходимо также измерить АД, пульс, определить массу тела больного, а также расспросить его о побочных эффектах лечения. Для объективизации получаемой информации больного должен обследовать один и тот же врач, желательно в одно и то же время суток и день недели на протяжении всего исследования.
При составлении протокола исследования необходимо выделить первичный (желательно один) критерий эффективности. Выбор этого/этих критериев зависит от задач исследования и класса тестируемого препарата. Для усиления дизайна исследования протокол следует дополнить одним или несколькими вторичными критериями.
Требования «отмывочного» (washout) периода. За определенный период до начала лечения тестируемым симптоматическим препаратом необходимо отменить все обезболивающие и противовоспалительные препараты, включая средства местного действия. Длительность этого периода обусловлена временем, необходимым для прекращения клинического эффекта (например, 5 периодов полувыведения препарата). В течение washout-периода больные могут принимать парацетамол до 4 мг/сут (в США) и до 3 мг/сут (в странах Европы). Последний также отменяют с учетом того, чтобы к началу приема тестируемого препарата его действие было прекращено. Ухудшение симптомов ОА в washout-период необходимо отметить в протоколе.
При проведении исследований препаратов, модифицирующих структуру хряща, washout-период не требуется. Если есть необходимость изучения симптоматического действия тестируемого агента, washout-период включают в протокол.
Назначение исследуемого препарата. Контрольные препараты могут включать плацебо или активный агент, например анальгетик или НПВП. Преимуществом второго является возможность продемонстрировать преобладание эффективности исследуемого агента над препаратами, которые широко используют в настоящее время. В случае применения референтного препарата в качестве контроля требуется бoльшее количество пациентов. При лечении внутрисуставными инъекциями часто наблюдается плацебо-эффект, поэтому исследования эффективности препаратов, вводимых внутрисуставно, должны быть плацебо-контролированными.
Препараты местного действия должны выдаваться пациентам в таких же контейнерах, что и препараты сравнения (лекарственное средство или плацебо). Плацебо должно полностью имитировать исследуемый препарат по виду, запаху и локальному воздействию на кожу. Четкие инструкции по использованию препарата должны быть изложены больному врачом лично, в письменном виде, а также приведены в информированном согласии. Аккуратность применения препарата проверяется путем взвешивания возвращенной пациентом тубы с мазевой, гелевой или другой формой либо путем измерения объема жидкости во флаконе.
Вид препаратов для перорального и для парентерального применения (в том числе внутрисуставного), а также их упаковка должны быть идентичны таковым агентов сравнения или плацебо. Пероральные препараты лучше выдавать в блистерах, снабженных клеящимися ярлыками, на которых указаны точная дата и время выдачи. Мониторинг приема препарата больными осуществляется путем подсчета неиспользованных таблеток (драже, капсул).
Препараты для сопутствующей терапии (например, анальгетики или НПВП при исследованиях препаратов, модифицирующих структуру хряща) можно выдавать во флаконах. Во время каждого визита производят подсчет использованных таблеток. Вечером накануне визита, а также в день визита не следует принимать сопутствующий обезболивающий или противовоспалительный препарат, поскольку это может повлиять на оценку болевого синдрома.
Если нет возможности обеспечить идентичность тестируемого препарата, принимаемого парентерально, агенту сравнения, непосредственное введение его должно осуществлять третье лицо (например, другой врач или медсестра), не сообщая больному и исследователю, какой именно препарат вводился.
Перед внутрисуставными инъекциями из суставной полости извлекают выпот, его объем отмечают в протоколе.
При проведении всех клинических исследований ОА необходимо проводить фармакоэкономический анализ.
Сопутствующая медикаментозная терапия. Нелогично ожидать, что пациенты примут участие в длительном исследовании без дополнительного использования симптоматических препаратов. Поэтому прием анальгетиков следует разрешить, но ограничить. Ограничивают перечень препаратов, максимальные дозы, а также время приема (за день до визита и в день визита не следует принимать обезболивающее средство). Протокол должен обязательно включать раздел, в котором отмечают применение анальгетиков и НПВП, выполнение внутрисуставных инъекций. Если внутрисуставное введение депо-кортикостероидов не является частью протокола исследования, их использование запрещается.
Сопутствующая терапия может помешать адекватной оценке эффективности DMO AD. Однако при проведении длительных исследований нецелесообразно и неэтично исключать все сопутствующие препараты. Исключению подлежат лишь те, которые могут повлиять на структуру суставов. Сопутствующую терапию необходимо стандартизировать, осуществлять ее мониторинг и регистрировать в протоколе при каждом визите. Как уже отмечалось, предпочтение отдают парацетамолу. В день визита, а также вечером накануне визита препарат сопутствующей терапии не принимают.
Сопутствующую немедикаментозную терапию (физиотерапию, трудотерапию, лечебную физкультуру) также следует стандартизировать и привести в соответствие с протоколом таким образом, чтобы она не влияла на исход исследования. В протоколе необходимо выделить раздел, в котором будет фиксироваться информация об изменениях массы тела (уменьшение/увеличение), об использовании вспомогательных приспособлений (трости, костыли и др.), а также назначение или изменение процедур и т.д.
Лабораторные тесты. Для большинства многоцентровых исследований рутинные лабораторные тесты (общий анализ крови, анализ мочи, биохимический анализ крови) следует проводить в центральных лабораториях.
Рутинный анализ синовиальной жидкости должен включать исследование клеток и кристаллов.
Побочные эффекты фиксируют в протоколе при каждом визите и между визитами. Указывают дату возникновения, степень тяжести, отношение к исследуемому препарату (связано/не связано), назначенное лечение и его длительность, разрешение побочной реакции.
Нарушение протокола. Повторное нарушение протокола больным является основанием для исключения его из исследования. Причины прекращения участия в исследовании в связи с нарушением протокола должны быть специфицированы. К ним могут относиться прием неразрешенных для данного исследования препаратов, использование вспомогательных приспособлений для облегчения боли и др.
Критерии эффективности лечения ОА. В клинических исследованиях ОА необходимо использовать опубликованные критерии, которые применяли другие авторы в своих работах, что позволяет сравнивать результаты исследований различных агентов. Основной перечень критериев включает показатели:
- боли;
- физической функции;
- общей оценки состояния больного;
- рентгенологического или других методов визуализации (для исследований ≥1 года).
Дополнительными критериями эффективности, которые также рекомендуется включать в протокол, являются показатели:
- качества жизни (обязательный) и общая оценка врача.
Критерии выбора для исследований ОА включают показатели:
- воспаления;
- БМ;
- скованности;
- требующие выполнения определенной работы (время прохождения определенной дистанции, преодоление определенного количества ступенек, кистевая сила и др.);
- количество обострений;
- прием анальгетиков;
- объем движений;
- расстояние между лодыжками;
- расстояние между медиальными мыщелками бедренных костей;
- окружность сустава и др.
Первичным критерием эффективности симптоматических препаратов является боль. Ее исследование должно проводиться через равные промежутки времени, длительность которых зависит от исследуемого сустава и задач исследования (минимум 1 мес).
Оценку выраженности боли в пораженном суставе следует производить с использованием 5-балльной шкалы Ликерта (0 — нет боли, 1 — слабая боль, 2 — умеренная боль, 3 — сильная боль, 4 — очень сильная боль) или 10 см ВАШ. Кроме того, необходимо уточнить, что вызывает (например, ношение тяжестей, физические упражнения, подъем по лестнице) и/или когда возникает боль (например, ночью, в покое). Для дополнительной характеристики боли можно использовать некоторые системы оценки здоровья (WOMAC, HAQ, AIMS).
Для оценки функции пораженных коленных и/или тазобедренных суставов у больных с ОА рекомендуется использовать WOMAC или АФИ Лекена, в меньшей степени HAQ и AIMS.
Оценку общего состояния пациента им самим и врачом следует проводить с использованием шкалы Ликерта или ВАШ.
Определение качества жизни больных с ОА в ходе исследования является обязательным, хотя и не относится к первичным критериям. Окончательный выбор системы оценки качества жизни (например, SF-36, EuroQol) — за исследователем.
Информативность вышеназванных критериев выбора окончательно не определена, поэтому их включение в протокол исследования не является обязательным.
В исследованиях препаратов, модифицирующих структуру хряща, первичным критерием эффективности является оценка морфологии пораженного сустава, которую осуществляют с помощью непрямых (рентгенография, УЗИ, МРТ) и прямых (артроскопия) методов визуализации. Клиническое наблюдение за больными, получающими эти препараты, производится с интервалами 3 мес и меньше.
Рентгенография. Оценивают рентгенограммы одного сустава (коленного, тазобедренного) или пораженных суставов исследуемой кисти. Несмотря на то, что оценивать следует динамику не только морфологии хряща, но и кости, первичным рентгенологическим критерием для исследований прогрессирования гонартроза или коксартроза должно быть измерение в миллиметрах высоты суставной щели, поскольку это показатель более чувствителен, чем методы оценки по балльной системе или по степеням. Остеофитоз и другие изменения подлежащей кости следует изучать в качестве вторичных критериев либо измеряя в миллиметрах, либо по степеням с использованием опубликованных атласов. При изучении факторов, предотвращающих развитие ОА, первичным критерием является остеофитоз, поскольку именно этот признак ассоциирован с болью в коленном суставе, входит в классификационные критерии ACR для гонартроза и является критерием рентгенологической классификации гонартроза по Kellgren и Lawrence. Критерии для ОА кистей должны быть основаны на опубликованных в специальных атласах.
Выполнение рентгенологического исследования изучаемых суставов при каждом визите — важное условие адекватной оценки прогрессирования ОА. Рентгенографию нужно выполнять со строгим соблюдением условий стандартизированного протокола, который разрабатывают на основе опубликованных рекомендаций, поскольку вариабельность измерения высоты суставной щели зависит от положения пациента (вертикальное или weight-bearing, горизонтальное), самой процедуры рентгенографии и других факторов.
МРТ позволяет визуализировать все суставные структуры одновременно, что дает возможность оценить сустав как орган. Кроме того, МРТ позволяет количественно оценить ряд морфологических параметров ОА. Разработанные неинвазивные методы количественной оценки объема суставного хряща, его толщины, содержания воды, особенно на ранних стадиях болезни, вероятно, будут широко использоваться в терапевтических исследованиях в будущем.
Информативность компьютерной томографии, УЗИ и сцинтиграфии недостаточно изучена, поэтому перечисленные методы не рекомендуется использовать в длительных исследованиях.
Артроскопия способна непосредственно визуализировать суставной хрящ и другие внутрисуставные структуры, включая мениски, синовиальную оболочку, связки, хондрофиты. Попытки количественно оценить эту информацию привели к разработке двух типов систем полуколичественной оценки. Одна из них кодирует информацию о каждом повреждении хряща (главным образом — глубину и площадь повреждения) в баллах, которые затем суммируются, вторая использует глобальную оценку врачом дегенерации хряща в различных отделах, которая фиксируется на ВАШ.
Информативность молекулярных маркеров в качестве критериев эффективности патогенетической терапии ОА не доказана (см. гл. 8). Однако БМ можно использовать для оценки действия препаратов на определенные патогенетические механизмы, а также для изучения фармакодинамики в І фазе клинических исследований.