Лабораторная диагностика остеоартроза
В большинстве случаев у больных с ОА отсутствуют изменения в анализах крови и мочи, за исключением случаев синовита со значительным выпотом, когда могут возникнуть увеличение СОЭ, гипергаммаглобулинемия, повышение уровня показателей острой фазы — СРБ, фибриногена и др. При исследовании синовиальной жидкости значительных отличий от нормальных показателей не выявляют.
В последние годы ведется интенсивный поиск возможных биологических маркеров (БМ) деградации и репарации тканей суставов (главным образом хрящевой и костной). БМ должны отражать эти динамические изменения, служить предикторами прогноза ОА и маркерами эффективности патогенетического лечения. Открытие новых и более глубокое изучение известных БМ позволит лучше понять механизмы патогенеза ОА. Однако главная задача использования БМ хрящевого метаболизма — оценка хондропротекторных свойств лекарственных препаратов и мониторинг лечения препаратами, относящимися к группе DМО АD — «модифицирующих болезнь».
При ОА патологические изменения происходят главным образом в суставном хряще, а также в субхондральной кости, синовиальной оболочке, других мягких тканях сустава. Поскольку наши возможности непосредственно исследовать эти структуры ограничены, наиболее важными источниками для забора БМ являются кровь, моча и синовиальная жидкость (рис. 89).

Исследование мочи наиболее предпочтительно, поскольку не сопряжено с какими-либо инвазивными процедурами. На наш взгляд, идеальным материалом для исследования является суточная моча. Анализ утренней порции мочи был бы более целесообразным, однако возможность ее использования основывается лишь на том, что именно такой анализ используют для определения БМ костного метаболизма при остеопорозе: известно, что БМ подчиняются циркадным ритмам, а пик концентрации БМ костного метаболизма приходится на ночные часы. К настоящему времени в литературе отсутствуют сведения о циркадных ритмах БМ мягких тканей, хряща, поэтому окончательное решение о выборе адекватного анализа мочи будет принято после проведения соответствующих исследований.
Исследование крови относится к рутинным клиническим анализам. Некоторые БМ в крови определяют уже сегодня, например показатели острой фазы, другие, возможно, в ближайшем будущем войдут в стандартный перечень биохимических тестов. Для каждого БМ необходимо уточнить, в каком компоненте крови его следует определять — в плазме или сыворотке. Результаты исследований свидетельствуют о том, что концентрация БМ в плазме крови значительно отличается от таковой в сыворотке. Обычно БМ определяют в сыворотке крови. По данным V. Rayan и соавторов (1998), концентрации БМ в крови, взятой из вены вблизи пораженного сустава и из более отдаленной вены, различны. Эти данные свидетельствуют о необходимости стандартизации забора крови для исследования БМ.
По данным L.J. Attencia и соавторов (1989), хрящ синовиальных суставов взрослого человека составляет всего 10% от общей массы гиалинового хряща организма, включая межпозвоночные диски. Таким образом, определение БМ в крови и моче скорее отражает системный метаболизм, чем местные изменения в пораженном ОА суставе. Синовиальная жидкость находится ближе всего к патологическому очагу при ОА и, вероятно, наиболее точно отражает процессы, происходящие в пораженном суставе. Концентрация БМ в синовиальной жидкости может быть значительно выше, чем в крови, а значит, ее легче определить. Примерами могут служить эпитоп 846 аггрекана — в синовиальной жидкости его в 40 раз больше, чем в сыворотке крови (Poole A.R. et al., 1994), хрящевые олигомерные матриксные белки (ХОМБ) — в 10 раз больше, чем в сыворотке крови (Saxne Т., Heinegard D., 1992). Продукты деградации в синовиальной жидкости более точно отражают катаболические процессы в суставном хряще. Дренаж молекул из синовиальной жидкости через местную лимфатическую систему может привести к уменьшению их размеров (Fraser J.R.E., Laurent T.C., 1989) и даже к их разрушению (Heinegard D. et al., 2000).
Несмотря на инвазивность методики забора синовиальной жидкости, сопряженной с рядом возможных осложнений, ценность определения БМ в ней очевидна. Для избежания проблем с так называемым сухим суставом непосредственно перед изъятием жидкости в сустав можно ввести 20 мл изотонического раствора NaCl. Тотчас после инъекции изотонического раствора пациент должен произвести 10 раз сгибание-разгибание конечности в суставе, за этим следует быстрая аспирация разведенной синовиальной жидкости. По мнению E.M.-J.A. Thonar (2000), такое разведение синовии влияет на метаболизм в суставном хряще. Однако результаты исследования F.C. Robion и соавторов (2001) свидетельствуют о том, что повторный лаваж коленных суставов лошадей не вызывает существенных изменений метаболизма хряща. Эти данные, безусловно, требуют подтверждения. Следовательно, для каждого БМ на этапе преклинических исследований у животных необходимо определять влияние лаважа сустава на изменение его концентрации.
Следующим важным моментом является определение для каждого БМ времени полужизни в синовиальной жидкости и в крови. Без таких данных интерпретация результатов анализов будет затруднена. Обычно время полужизни биологически активных веществ в крови меньше, чем в других жидких средах, в связи с эффективным клиренсом печенью и почками. Таким образом, для каждого БМ также необходимо определять путь элиминации. Так, N-пропептид коллагена ІІІ типа выделяется печенью путем рецепторопосредованного эндоцитоза (Smedsrod B., 1988), а негликозилированные фрагменты коллагена выводятся главным образом с мочой так же, как остеокальцин (Price P.A. et al., 1981). На эндотелиальных клетках синусов печеночных долек имеются рецепторы к гликозаминогликанам, поэтому гиалуроновая кислота и протеогликаны элиминируются печенью. Время полужизни гиалуроновой кислоты в крови составляет 2–5 мин (Fraser J.R.E., Laurent T.C., 1989). Наличие синовита может ускорять клиренс БМ из суставов (Wallis W.J. et al., 1987; Myers S.L. et al., 1995; 1996), хотя исследование у кроликов не обнаружило существенных различий клиренса протеогликанов при наличии и отсутствии синовита (Page-Thomas D.P. et al., 1987). Таким образом, необходимо исследовать влияние воспаления на изменения концентрации БМ в жидких средах организма.
Почки селективно фильтруют БМ. Так, гликозаминогликаны, несущие большой отрицательный заряд, могут не проникать через базальную мембрану почек, тогда как такие гликозаминогликаны, как хондроитин-6-сульфат и хондроитин-4-сульфат, определяются в моче (Lee G.J.L., Tieckelmann H., 1981).
Кроме патологии (в частности, ОА) на концентрацию БМ в жидких средах организма могут влиять ряд факторов:
- Циркадные ритмы исследованы лишь для небольшого количества БМ. Для маркеров костного метаболизма они изучены. Так, пик концентрации остеокальцина приходится на ночные часы (Gundberg C.M. et al., 1985), а поперечных связей коллагена на утренние — на 8 ч (Gertz B.J. et al., 1998). При ревматоидном артрите пик активности ИЛ-6 также приходится на ночные часы (около 2 ч), причем раньше, чем у остеокальцина (Arvidson N.B. et al., 1994). Эти данные представляют определенный интерес в отношении участия ИЛ-6 в воспалении и физиологии костной ткани. ФНО-α, напротив, не имеет циркадных ритмов (Arvidson N.B. et al., 1994). Однако рецепторы этого цитокина могут подчиняться им.
- Перистальтика. Гиалуроновая кислота синтезируется синовиальными клетками (а также многими другими клетками) и является потенциальным маркером синовита при ОА и ревматоидном артрите. Однако наиболее высокая концентрация гиалуроната обнаруживается в лимфатической системе кишечника (Engstrom-Laurent A., 1989). Не удивительно, что концентрация циркулирующей гиалуроновой кислоты может повышаться после еды. Таким образом, забор крови для определения БМ следует производить натощак или через 3 ч после еды. А влияние перистальтики на уровень БМ в крови требует изучения.
- Физическая активность утром после сна приводит к повышению концентрации гиалуроновой кислоты в крови (Engstrom-Laurent A., Hallgren R., 1985), ММП-3 и эпитопа кератан-сульфата (Manicourt D.H. et al., 1999) у здоровых лиц. Физическая нагрузка может изменять концентрацию некоторых маркеров как в синовиальной жидкости, так и в сыворотке крови (Roos H. et al., 1995). Такое повышение более выражено у больных с ревматоидным артритом, более того концентрация БМ коррелирует с клиническим состоянием этих больных.
- Болезни печени и почек. Цирроз печени вызывает значительное повышение уровня гиалуроновой кислоты в сыворотке крови (Engstrom-Laurent A., 1989) и, вероятно, влияет на элиминацию протеогликанов. Известно, что болезни почек влияют на концентрацию остеокальцина. Данная проблема также требует более глубокого изучения.
- Возраст и пол. В процессе роста организма повышается активность клеток пластинки роста, что сопровождается повышением концентрации скелетных БМ в сыворотке крови. Примером может служить повышение концентрации фрагментов аггрекана и коллагена ІІ типа в периферической крови и моче у растущих животных (Thonar E.M.-J.A. et al., 1988; W. Carey et al., 1997). Таким образом, интерпретация анализов БМ у детей и подростков с заболеваниями опорно-двигательного аппарата затруднена. Для многих БМ обнаружено повышение концентрации при старении. У мужчин концентрация БМ значительно превышает таковую у женщин в хрящевой (Poole A.R. et al., 1990) и костной (del Pino J. et al., 1991) тканях. Кроме того, у женщин в менопаузальный и постменопаузальный периоды можно ожидать изменений концентрации БМ метаболизма хрящевой ткани подобно тому, что наблюдается в костной ткани.
- Хирургические операции также могут влиять на уровень БМ, более того, этот эффект может длиться несколько недель.
Основой концепции БМ ОА является предположение, что они отражают определенные стороны метаболических процессов в тканях суставов. Однако взаимоотношения между концентрациями БМ в жидких средах организма и метаболизмом хрящевой, синовиальной и других тканей оказались очень сложными (рис. 90).

Так, например, концентрация маркеров деградации ВКМ суставного хряща в синовиальной жидкости может зависеть не только от степени деградации самого матрикса, но и от других факторов, таких, как степень элиминации фрагментов молекул из синовии, о чем уже было сказано выше (Wallis W.J. et al., 1987; Levick J.R., 1992; Simkin P.A., Bassett J.E., 1995), а также от количества хрящевой ткани, оставшейся в суставе (Dahlberg L. et al., 1992).
Несмотря на вышеприведенные факты, концентрация БМ в синовиальной жидкости в общем коррелирует с метаболизмом молекул ВКМ суставного хряща (Lohmander L.S., 1994). Так, например, изменения концентрации фрагментов аггрекана, эпитопа 846, ХОМБ и С-пропептида коллагена ІІ в синовиальной жидкости после травмы сустава и при развитии ОА согласуются с изменениями интенсивности метаболизма аггрекана, ХОМБ и коллагена ІІ в экспериментальных моделях ОА у животных in vivo и в суставном хряще больных с ОА in vitro (Eyre D.R. et al., 1980; Carney S.L. et al., 1984; Aigner T. et al., 1992; Lohmander L.S. et al., 1993; 1994; 1996; 1998; Heinegard D. et al., 1998).
Идентификация специфических источников молекулярных фрагментов — сложный процесс. Повышение степени высвобождения фрагментов молекул может происходить как за счет общего усиления процессов деградации, которые не компенсируются синтетическими процессами, так и за счет усиления деградации с одновременным повышением интенсивности синтеза тех же молекул ВКМ; в последнем случае концентрация молекул ВКМ не изменяется. Таким образом, необходим поиск маркеров, специфических для деградации и для синтеза. Примером первых могут быть фрагменты аггрекана, а вторых — С-пропептид коллагена ІІ.
Даже если БМ связан с определенным аспектом метаболизма, необходимо учитывать специфические особенности этого процесса. Например, идентифицируемые фрагменты могут образовываться в результате деградации синтезированной de novo молекулы, которая еще не успела встроиться в функциональный ВКМ, молекулы, которая была только что встроена в ВКМ и, наконец, постоянной молекулы ВКМ, которая является важной функциональной частью зрелого матрикса. Проблемой также является определение специфической зоны матрикса (перицеллюлярный, территориальный и межтерриториальный матрикс), которая послужила источником БМ, обнаруженного в синовиальной жидкости, крови или моче. Исследования in vitro свидетельствуют о том, что интенсивность метаболизма в отдельных зонах ВКМ суставного хряща может быть различной (Mok S.S. et al., 1994). Исследование некоторых эпитопов, связанных с сульфатированием хондроитин сульфатов, могут способствовать идентификации популяции синтезированных de novo молекул аггрекана (Visco D.M. et al., 1993; Poole A.R. et al., 1994; Plaas A.H.K. et al., 1997; 1998; Lohmander L.S. et al., 1998).
Можно предположить, что появление в суставной жидкости фрагментов молекул, в норме присутствующих в ВКМ хряща, связано с метаболизмом хрящевого матрикса. Однако это не всегда так, поскольку зависит от ряда факторов, в частности от того, насколько концентрация данной молекулы в суставном хряще превышает таковую в других тканях сустава и насколько интенсивность ее метаболизма в хряще превышает таковую в других тканях сустава. Так, общая масса аггрекана в суставном хряще значительно превышает таковую, например в менисках коленного сустава, при этом общая масса ХОМБ в менисках практически не отличается от таковой в суставном хряще (Hauser N. et al., 1995). И хондроциты, и синовициты вырабатывают стромелизин-1, однако общее количество клеток в синовиальной оболочке превышает таковое в хряще, поэтому значительная часть обнаруженного в синовиальной жидкости стромелизина-1 скорее всего синовиального происхождения (Wolfe G.C. et al., 1993). Таким образом, идентификация специфического источника БМ чрезвычайно сложна и часто невозможна.
При исследовании БМ в сыворотке крови и моче появляется проблема определения возможного его внесуставного источника. Кроме того, при моноартикулярном поражении БМ, выделяемые пораженным суставом, могут смешиваться с маркерами, выделяемыми интактными суставами, в том числе и контралатеральными. В состав суставного хряща входит менее чем 10% общей массы гиалинового хряща организма (Lohmander L.S., 1999). Таким образом, определение БМ в крови и моче может быть обоснованным скорее при полиартикулярных, или системных, болезнях (применительно к ОА — при генерализованном ОА).
Ниже в табл. 32 представлен неполный перечень предполагаемых БМ метаболизма суставного хряща, кости и синовиальной оболочки в синовиальной жидкости, сыворотке крови и моче.
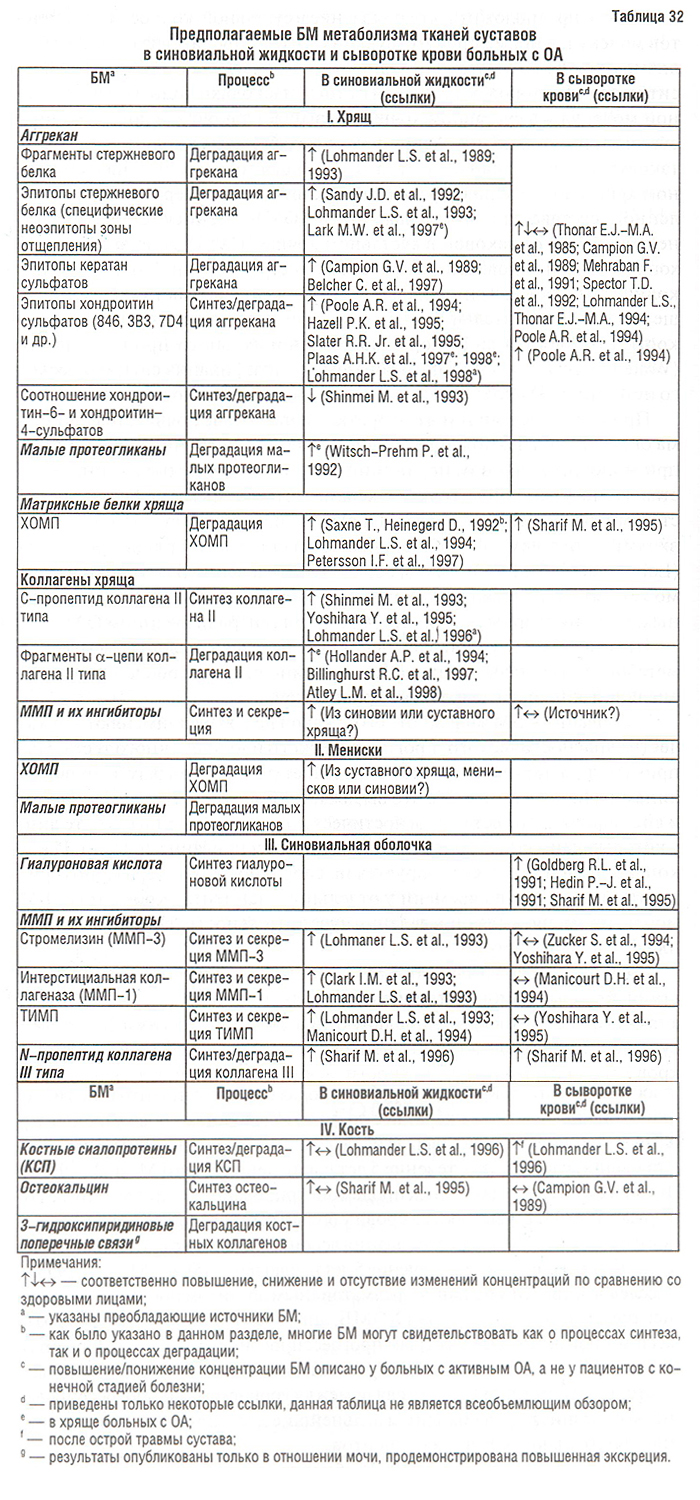
Требования к БМ зависят от того, с какой целью их применяют — в качестве диагностического, прогностического или оценочного теста. Например, диагностический тест определяет различия между здоровыми лицами и пациентами с ОА, что выражается понятием чувствительности и специфичности теста. Прогностический тест выявляет в когорте лиц, у которых наиболее вероятно быстрое прогрессирование болезни. И наконец, оценочный тест базируется на способности маркера мониторировать изменения во времени у отдельного пациента. Кроме того, БМ можно применять для определения чувствительности пациентов к тому или иному препарату.
Вначале предполагали, что БМ могут служить диагностическими тестами, которые помогут отличить пораженный ОА сустав от интактного, а также провести дифференциальную диагностику с другими болезнями суставов. Так, определение концентрации кератан сульфата в сыворотке крови рассматривали как диагностический тест для генерализованного ОА (Thonar E.J.-M.A. et al., 1985). Однако последующие исследования показали, что данный БМ может лишь отражать деградацию протеогликанов хряща в некоторых ситуациях (Spector T.D. et al., 1992; Thonar E.J.-M.A. et al., 1993; Poole A.R. et al., 1994). Оказалось, что концентрации БМ в сыворотке крови зависят от возраста и пола обследуемого лица (Lohmander L.S., Thonar E.J.-M.A., 1994).
Ряд исследований продемонстрировали различия концентраций фрагментов аггрекана, ХОМП и ММП и их ингибиторов в суставной жидкости коленных суставов здоровых волонтеров, пациентов с ревматоидным артритом, реактивным артритом или ОА (Saxne T. et al., 1987; Lohmander L.S. et al., 1993; 1994; Petersson I.F. et al., 1997). Несмотря на то, что авторы демонстрируют значительные различия средних концентраций БМ, интерпретация данных затруднена, поскольку проведенный сравнительный анализ был профильным и ретроспективным. Прогностические свойства этих тестов необходимо подтвердить в проспективных исследованиях.
БМ можно использовать для оценки тяжести болезни или стадийности патологического процесса. Применительно к ОА о тяжести болезни и ее стадиях судят по результатам рентгенологических исследований, артроскопии, а также по выраженности болевого синдрома, ограничению функции пораженных суставов и функциональной способности пациента. L. Dahlberg и соавторы (1992) и T. Saxne и D. Heinegard (1992) предложили использовать некоторые молекулярные маркеры метаболизма суставного хряща для дополнительной характеристики стадий ОА. Однако для внедрения таких БМ в медицинскую практику необходимо дальнейшее проведение исследований в этом направлении.
Имеются сообщения о возможном использовании БМ в качестве прогностических тестов. Например, было показано, что концентрация гиалуроновой кислоты (но не кератан сульфата) в сыворотке крови у пациентов с ОА коленного сустава в начале исследования свидетельствует о прогрессировании гонартроза в течение 5 лет наблюдения (Sharif M. et al., 1995a). В той же популяции больных продемонстрировано, что повышенное содержание ХОМБ в сыворотке крови у больных гонартрозом в течение первого года после начала исследования ассоциировалось с рентгенологическим прогрессированием в течение 5 лет наблюдения (Sharif M. et al., 1995b). Исследования БМ у больных с ревматоидным артритом показали, что концентрация в сыворотке крови ХОМБ, эпитопа 846, хондроитин сульфата ассоциирована с более быстрым прогрессированием болезни (Mansson B. et al., 1995). Эти результаты, полученные в небольших группах больных, часто не демонстрируют силу связи между уровнем БМ и прогрессированием болезни, т.е., необходимы дальнейшие исследования, проспективные и на больших когортах пациентов.
T.D. Spector и соавторы (1997) обнаружили небольшое повышение уровня СРБ в сыворотке крови больных с ранним ОА и сообщили, что СРБ может служить предиктором прогрессирования ОА. В данном случае повышение уровня СРБ отражает процессы повреждения тканей суставов и может быть связано с повышением уровня гиалуроновой кислоты, также свидетельствующем о прогрессировании болезни (Sharif M. et al., 1995a). Не исключено, что синовиальная оболочка ответственна за большую часть гиалуроновой кислоты, определяемой в сыворотке крови, что свидетельствует о наличии слабого синовита. Повышение концентрации ММП стромелизина в синовильной жидкости и сыворотке крови больных с ОА и после травмы сустава также может быть связано со слабым синовитом (Clark I.M. et al., 1993; Lohmander L.S. et al., 1993; Manicourt D.H. et al., 1994; Zucker S. et al., 1994; Yoshihara Y. et al., 1995).
Наконец, БМ можно использовать в качестве критериев эффективности в клинических исследованиях препаратов, а также для мониторирования патогенетического лечения. Однако существуют две взаимосвязанные проблемы: отсутствие препаратов с доказанными свойствами «модифицировать структуру» или «модифицировать болезнь» во многом связано с отсутствием надежных БМ и наоборот, отсутствие специфических маркеров метаболизма тканей суставов во многом обусловлено недостатком контролированных исследований препаратов названных групп.