Экспериментальные модели остеоартроза
Содержание
Экспериментальные модели для исследования повреждения и репарации суставного хряща in vitro
Хрящ — высокоспециализированная ткань, содержащая только один тип клеток (хондроциты), характеризующаяся отсутствием кровеносных и лимфатических сосудов. Питание хряща главным образом осуществляется путем всасывания из синовиальной жидкости. Метаболизм хондроцитов регулируется рядом растворимых факторов, вырабатывающихся локально хондроцитами и окружающими тканями. Функция хондроцитов также зависит от состава внеклеточной среды (напряжение кислорода, концентрация ионов, рН и др.), состава ВКМ, взаимодействия клеток и матрикса, физических сигналов. Главной задачей экспериментального моделирования является создание культур во внеклеточной среде без изменения фенотипа зрелых клеток. Вторая задача — создание культур для изучения преждевременного, отсроченного, короткого или продолжительного ответа хондроцитов на химические и/или физические сигналы. Исследования in vitro также дают возможность изучать поведение хондроцитов при ОА. Третьей задачей является развитие кокультуральных систем, позволяющих изучать взаимодействия различных тканей в суставе. Четвертая задача — подготовка хрящевых имплантатов к последующей трансплантации. И, наконец, пятая задача — исследование факторов роста, цитокинов или терапевтических агентов, которые способны стимулировать репарацию и/или угнетать его резорбцию хряща.
За последние десятилетия созданы различные модели культур клеток суставного хряща, среди них — монослойные культуры, взвешенные культуры, культуры хондронов, эксплантаты, кокультуры, культуры бессмертных клеток. Каждая культура имеет свои преимущества и недостатки и каждая подходит для исследования одного определенного аспекта метаболизма хондроцитов. Так, хрящевые эксплантаты — прекрасная модель для изучения оборота элементов матрикса, для чего требуются подлинные рецепторы клеточной поверхности и нормальные взаимодействия клетка–матрикс и матрикс–клетка. В то же время исследование отложений в матриксе или механизмов регуляции метаболизма хондроцитов рекомендуют проводить на культуре изолированных клеток. Монослойная культура низкой плотности необходима для изучения процесса дифференцировки клеток. Культуры, взвешенные в естественном или синтетическом матриксе, — модель для анализа адаптационного ответа хондроцитов на механический стресс.
Культуры хондроцитов
При выборе хрящевой ткани для исследований in vitro необходимо учитывать несколько важных моментов. Состав матрикса и метаболическая активность хондроцитов варьируют в разных суставах, а последняя также зависит от глубины расположения хондроцитов в ткани. Эти данные были получены в ходе нескольких экспериментов, в которых изучались изолированные субпопуляции хондроцитов из зон хряща различной глубины. Обнаружен ряд морфологических и биохимических различий между культивируемыми хондроцитами, расположенными в поверхностных и глубоких слоях суставного хряща. Поверхностные клетки синтезируют редкий, обедненный протеогликанами фибриллярный матрикс, тогда как более глубокие клетки вырабатывают матрикс, изобилующий фибриллами и протеогликанами (Aydelotte M., Kuettner K.E., 1988; Archer C. et al., 1990). Более того, поверхностные клетки вырабатывают относительно больше мелких неагрегированных протеогликанов и гиалуроновую кислоту и относительно меньше аггрекана и кератан сульфата, чем более глубоко расположенные хондроциты (Manicourt D., Pita J., 1988; Siczkowski M., Watt F., 1990; Korver T. et al., 1992). Другой важной отличительной чертой метаболизма хондроцитов, изолированных из зон хряща разной глубины, является ответ на экзогенный стимул. По данным M. Aydelotte и соавторов (1988, 1991), хондроциты быка из поверхностной зоны хряща были более чувствительны к ИЛ-1, чем клетки глубокой зоны.
Поведение клеток также зависит от локализации ткани. Хондроциты хрящей ребер и ушей, взятые от одного и того же животного, по-разному реагируют на факторы роста, такие, как фактор роста фибробластов (ФРФ) и ТФР-β. ФРФ увеличивал включение тимидина, пролина и лейцина в культуру хондроцитов ребра, но не уха. ТФР-β увеличивал включение тимидина в хондроциты хряща ребра и уха, но не влиял на включение тимидина и пролина в хондроциты уха (Lee J. et al., 1997). Хрящевые клетки, полученные из зон, несущих наибольшую нагрузку, отличаются от таковых из участков с низкой нагрузкой на хрящ. Так, хондроциты зрелого хряща коленного сустава овцы из центральной области суставной поверхности большеберцовой кости, не покрытой мениском, которая переносит наибольшую нагрузку in vivo, меньше синтезируют аггрекан, но больше декорин, чем клетки из зон, покрытых мениском (Little C., Ghosh P., 1997). Авторы также подчеркивают важность использования хряща из идентичных зон суставов при исследовании синтетической функции суставов.
Метаболизм хондроцитов и их ответ на регуляторные факторы также значительно зависит от возраста донора, развития его скелета и состояния суставов, из которых берут клетки. У хондроцитов человека наблюдается значительное снижение с возрастом пролиферативного ответа. Наибольшее снижение отмечается у доноров в возрасте 40–50 лет и старше 60 лет (Henroitin Y., Reginster J.Y., 1999). Более того, выраженность пролиферативного ответа на факторы роста (например, ФРФ и ТФР-β) снижается в процессе старения. Кроме количественных изменений пролиферации хондроцитов существуют еще и качественные изменения. Клетки молодых доноров (10–20 лет) лучше реагируют на фактор роста, полученный из тромбоцитов (ФРПТ), чем на ТФР-β, тогда как обратное наблюдается в клетках взрослых доноров (Guerne P.A. et al., 1995). Для объяснения возрастно-зависимых изменений синтетической функции хондроцитов и их ответа на действие факторов роста используют несколько механизмов. Среди них уменьшение количества и аффинности поверхностных клеточных рецепторов, изменение синтеза и биоактивности факторов роста и цитокинов, модификация пострецепторных сигналов.
Патологическое состояние суставов также изменяет морфологию и метаболическую активность хондроцитов. Так, J. Kouri и соавторы (1996) идентифицировали три субпопуляции хондроцитов в хряще при ОА. Хондроциты из поверхностной и верхней части середины хряща образуют скопления и синтезируют большее количество протеогликанов и коллагена (Lafeber F. et al., 1992; Aigner T. et al., 1997). ТФР-β и инсулиноподобный фактор роста (ИФР) способны стимулировать синтез протеогликанов хондроцитами и частично нивелировать эффекты ИЛ-1 и ФНО-α. Эксплантаты хряща, пораженного ОА, и хондроциты, изолированные из хряща больного с ОА, более чувствительны к стимуляции ТФР-β, чем хондроциты здорового хряща. Эти различия, вероятнее всего, связаны с фенотипическими изменениями хондроцитов в верхних слоях суставного хряща (Lafeber F. et al., 1997).
Изоляция отдельных хондроцитов достигается последовательной обработкой протеолитическими ферментами ВКМ. После их высвобождения из ВКМ изолированные клетки идеально подходят для исследования синтеза компонентов матрикса de novo. Некоторые авторы используют только коллагеназу клостридий, другие — предварительно инкубируют хрящ с трипсином, проназой, ДНКазой и/или гиалуронидазой. Количество изолированных клеток зависит от используемых ферментов. Так, при обработке одной коллагеназой из 1 г ткани можно получить 1,4·106 хондроцитов, тогда как при использовании проназы, гиалуронидазы и коллагеназы — 4,3·106. При обработке коллагеназой в культуре клеток остаются аггрекан, белки, ИЛ-6, ИЛ-8 в значительно большем количестве, чем при последовательной обработке различными ферментами.
Существует несколько объяснений этим различиям между двумя клеточными культурами:
- Клеточные рецепторы повреждены или угнетены под действием ферментов (Loeser R., 1993), ТФР-β ингибирует ДНК и синтез протеогликанов в только что изолированных хондроцитах (1-й день), тогда как ДНК и синтез протеогликанов хондроцитов, культивируемых в монослое (7 дней), стимулируется ТФР-β (van der Kraan P. et al., 1992). Однако для реэкспрессии этих компонентов мембраны необходим адекватный период перед началом эксперимента.
- Экзогенные протеазы могут разорвать взаимодействие клеток и матрикса, опосредуемое интегринами. Семейство интегринов способствует прикреплению хондроцитов к молекулам ВКМ (Shakibaei M. et al., 1997).Этот разрыв может повлиять на экспрессию матричных генов (Hering T. et al., 1994).
- Остатки компонентов матрикса могут регулировать синтетическую функцию хондроцитов. Интегрины способны распознавать продукты деградации ВКМ, тем самым играя важную роль в репарации ткани после воздействия протеолитических ферментов. T. Larsson и соавторы (1989) сообщили о том, что добавление интактных или фрагментированных протеогликанов к культуре клеток стимулирует синтез белков и протеогликанов. Однако высокий уровень гиалуроновой кислоты вызывает значительное снижение включения сульфатов в синтез протеогликанов хондроцитами эмбриона цыпленка, зрелыми хондроцитами свиньи и клетками хондросаркомы крысы (Bansal M. et al., 1986). Более того, гиалуроновая кислота — ингибитор высвобождения протеогликанов из клеток даже в присутствии ИЛ-1β, ФНО-α, ФРФ, что свидетельствует о противодействии первой биологической активности факторов роста и цитокинов (Shimazu M., 1993). Точный механизм, лежащий в основе действия гиалуроновой кислоты, остается неясным; известно, что хондроциты содержат рецептор к гиалуроновой кислоте, связанный с актиновыми филаментами цитозоля (Lacy B., Underhill C., 1987; Aruffo A. et al., 1990). Связывание гиалуроновой кислоты с ее рецептором стимулирует фосфорилирование белков (Turley E., 1989). Таким образом, эти данные демонстрируют модулирование метаболической функции хондроцитов фрагментированными или нативными молекулами матриксных белков путем активации мембранных рецепторов клеток.
- Быстрая стимуляции ферментами синтеза матриксных протеинов хондроцитами может быть следствием изменения формы хондроцитов и/или реорганизации цитоскелета.
- Некоторые цитокины (например, ИЛ-8) и факторы роста (например, ИФР-1, ТФР-β) фиксируются в ВКМ (Morales T. et al., 1991; Recklies A., Gold E., 1992). Наиболее известным примером является связывание ТФР-β декорином, что приводит к снижению способности первого индуцировать клеточный рост в клетках яичника у китайских хомячков (Yamaguchi Y. et al., 1990). Данные о том, что содержание декорина в хряще повышается с возрастом, свидетельствуют о снижении биодоступности ТФР-β при старении (Roughley P. et al., 1994). Факторы роста и цитокины могут высвобождаться из остатков матрикса во время культивирования и затем модулировать функции хондроцитов.
Монослойная культура хондроцитов. Дифференцированный фенотип хондроцитов прежде всего характеризуется синтезом коллагена ІІ типа и тканеспецифических протеогликанов, а также низким уровнем митотической активности. Имеются данные о том, что при длительном культивировании клеток в монослое, а также после нескольких повторных пассажей клеток хондроциты утрачивают свои сферические очертания, приобретают удлиненную, фибробластоподобную форму (von der Mark K. et аl., 1977). При такой фибробластной метаплазии также модифицируется синтетическая функция клеток, характеризующаяся прогрессирующим снижением синтеза коллагенов ІІ, ІХ и ХІ типов и повышением синтеза коллагенов І, ІІІ и V типов (Elima K., Vuorio E., 1989; Lefebvre V. et al., 1990). Малые неагрегированные протеогликаны синтезируются за счет функционального аггрекана (Kuettner K. et al., 1982; Watt F., 1988 ). Синтез катепсина В и L чрезвычайно низок в дифференцированных клетках, но в процессе утраты дифференцированности повышается. Коллагеназа-1 экспрессируется в дифференцированных хондроцитах, при длительной культивации ее экспрессия снижается, тогда как повышается продукция тканевых ингибиторов металлопротеаз (ТИМП) (Lefebvre V. et al., 1990).
Дифференцированные хондроциты реэкспрессируют коллаген дифференцированного фенотипа при переносе их из монослойной культуры во взвешенную (Benya P., Schaffer J., 1982; Elima K., Vuorio E., 1989). Процесс дифференцировки, вероятно, связан с формой клеток (Loty S. et al., 1995). Это свойство регулярно используется исследователями, изучающими дефектные трансплантаты с аутологичными хондроцитами. Небольшое количество клеток, полученных из биопсийного материала, можно размножить в монослойной культуре и затем вновь поместить в трехмерный матрикс перед трансплантацией. Реэкспрессию специфического фенотипа дедифференцированными хондроцитами, перенесенными в агарозную культуру, можно стимулировать ТФР-β, оссеин-гидроксиапатитным комплексом и аскорбиновой кислотой (Harrison E. et al., 1992).
В ответ на действие факторов роста и цитокинов хондроциты модифицируются во время процесса дифференцировки. Клеточный ответ на цитокины и факторы роста различаются между недифференцированными и дифференцированными хондроцитами. ИЛ-1 стимулирует пролиферацию фибробластов, тогда как рост недифференцированных хондроцитов угнетается ИЛ-1 (Guerne P. et al., 1994). Синтез ДНК стимулируется ИФР-1 в удлиненных, но не уплощенных хондроцитах (Lee D. et al., 1993). В дифференцированных хондроцитах стимулирующие эффекты ИЛ-1β и ФНО-α на продукцию проколлагеназы более выражены, чем в недифференцированных (Lefebre V. et al., 1990).
Культивирование хондроцитов во взвеси в жидкой среде или в естественном или синтетическом трехмерном матриксе стабилизирует фенотип хондроцита. Клетки сохраняют свою сферическую форму, синтезируют тканеспецифические белки. Взвешенную культуру хондроцитов обычно рекомендуют для исследования образования нового перицеллюлярного матрикса. Культуры хондроцитов в синтетических или естественных абсорбирующих полимерах используют для имплантации клеток в дефекты хряща для стимуляции регенерации хрящевой ткани сустава.
Синтетическая или естественная среда для имплантируемых клеток должна удовлетворять ряду требований (Henrotin Y., Reginster J.-Y., 1999):
- имплантаты должны иметь пористую структуру для адгезии и роста клеток,
- ни сам полимер, ни продукты его деградации не должны вызывать воспаление или токсические реакции при имплантации in vivo,
- носитель трансплантата должен иметь способность связываться с прилегающим хрящом или субхондральной костью,
- естественный или синтетический матрикс должен обладать способностью к абсорбции, его деградация должна уравновешиваться регенерацией ткани,
- для облегчения репарации хряща химическая структура и архитектура пор матрикса должны способствовать поддержанию помещенными в него хондроцитами клеточного фенотипа и синтеза тканеспецифических белков,
- во время имплантации in vivo необходимо изучить механические свойства синтетического или естественного матрикса.
Взвесь хондроцитов в жидкой фазе. Прикрепление клеток к пластиковым сосудам, в которых осуществляется культивирование хондроцитов, можно предотвратить покрытием их стенок раствором метилцеллюлозы, агарозы, гидрогеля (поли-2-гидроксиэтилметакрилат) или смесью коллаген-агароза (Reginato A. et al., 1994). В этих условиях хондроциты формируют скопления и синтезируют главным образом аггрекан и тканеспецифические коллагены (II, IX, XI типы). Обычно обнаруживают два типа клеток. Расположенные в центре клетки сохраняют сферическую форму, окружены хорошо развитым ВКМ, что подтверждается данными гистохимического и ультраструктурного исследований. На периферии хондроциты имеют дискоидные очертания, окружены редким ВКМ; о функциональных особенностях таких клеток известно мало.
Возможна культивация хондроцитов на микроносителях, поддерживаемых во взвеси; в качестве микроносителей используют декстрановые бусины (цитодекс), покрытые коллагеном декстрановые бусины (цитодекс ІІІ), беспоровые микросферы коллагена І типа (целлаген) (Freed L. et al., 1993; Fronroza C. et al., 1996). В этих условиях культивирования хондроциты прикрепляются к поверхности микроносителя, сохраняют свою сферическую форму и вырабатывают матриксно-подобный материал. Более того, использование целлагена способствует пролиферации хондроцитов и реэкспрессии нормального фенотипа (Fronroza C. et al., 1996). Поэтому культивирование хондроцитов на микросферах целлагена можно использовать для восстановления фенотипа клеток перед трансплантацией.
Еще одним методом культивирования взвеси хондроцитов в жидкой среде является их культивирование в виде плотных шариков, состоящих из клеток (0,5–1·106), полученных путем центрифугирования. Такие хондроциты способны продуцировать матрикс, содержащий большое количество протеогликанов, коллагена II типа, но не коллагена I типа, что подтверждено гистологическими, иммуногистохимическими и количественными методами (Xu C. et al., 1996; Ronziere M.-C. et al., 1997).
Взвесь хондроцитов в естественном ВКМ. Хондроциты можно культивировать во взвеси в трехмерном матриксе (мягкий агар, агароза, коллагеновый гель или губка, гиалуроновая кислота, фибриновый клей, бусины алгината).
Культивируемые в агарозе хондроциты сохраняют свой нормальный фенотип и синтезируют коллаген II типа и тканеспецифические аггрекановые агрегаты (Benya P., Schaffer J., 1982). При культивировании в агарозе синтезируемые клеткой протеогликаны выделяются в среду в течение 50 дней. Для сравнения — в монослойной культуре клеточная фаза переполняется гликозаминогликанами уже в первые 5–6 дней культивирования; при культивировании в среде после усиления синтеза и высвобождения гликозаминогликанов в первые 8–10 дней наступает времязависимое их уменьшение (Spirito S. et al., 1993). Тем не менее, поведение хондроцитов при их культивировании в агарозе отличается от такового в условиях in vivo. В агарозе большое количество синтезируемых агрегатов аггрекана содержит более мелкие и в меньшем количестве молекулы, чем in vivo (Cornelissen M. et al., 1993). ТФР-β стимулирует синтез протеогликанов в эксплантате (Morales T., Roberts A., 1988; Pujol J.-P. et al., 1991), однако снижает синтез аггрекана в агарозе (Skantze K. et al., 1985).
Алгинат — линейный полисахарид, полученный из коричневой морской водоросли. В присутствии двухвалентных катионов, таких, как ионы Са2+, этот полимер становится гелем. Каждый хондроцит, попавший в алгинат, окружен матриксом из отрицательно заряженных полисахаридов, поры которого соизмеримы с таковыми в гиалиновом хряще. Матрикс, который формируют хондроциты в бусинах алгината, состоит из двух отделов — тонкого слоя клеточно-ассоциированного матрикса, соответствующего перицеллюлярному и территориальному матриксу, суставного хряща и более удаленного матрикса, эквивалентного межтерриториальному в нативной ткани. На 30-й день культивирования относительный и абсолютный объем, занимаемый клетками, и каждый из двух отделов в бусине алгината почти полностью идентичны таковым в нативном хряще (Hauselmann H. et al., 1996; Petit B. et al., 1996). В течение почти 30 дней хондроциты сохраняют свою сферическую форму и вырабатывают аггрекан, гидродинамические свойства которого схожи с таковыми молекул аггрекана в матриксе суставного хряща, а также коллагеновые молекулы II, IX и XI типов (Mok S. et al., 1994; Petit B. et al., 1996; Platt D. et al., 1997). В то же время, подобно другим культурам-суспензиям, на поверхности бусин алгината присутствуют уплощенные клетки, которые вырабатывают небольшое количество молекул коллагена I типа, непосредственно высвобождающихся в среду и не инкорпорирующихся в ВКМ (Petit B. et al., 1996). В бусинах алгината наблюдается умеренная пролиферация хондроцитов. После 8 мес культивирования в геле алгината зрелые хондроциты не утрачивают метаболическую активность и продолжают синтезировать тканеспецифические коллаген II типа и аггрекан (Hauselmann H. et al., 1994).
H. Tanaka и соавторы (1984) исследовали диффузионные свойства различных естественных молекул в алгинате и обнаружили, что молекулы массой более 70 кД не диффундируют через алгинат. Таким образом, культивирование клеток в алгинате подходит для исследования регуляции биосинтеза матрикса и организации ВКМ. Доступность клеток, культивируемых в алгинате, позволяет исследовать действие пептидных регуляторных факторов и фармакологических агентов на транскрипционном, посттранскрипционном и трансляционном уровнях.
Хондроциты также культивируют в матриксе из коллагеновых волокон I и II типов (Schuman L. et al., 1995; Fujisato T. et al., 1996). S. Nehrer и соавторы (1997) сравнивали функционирование хондроцитов собаки в порозных коллагеново-протеогликановых полимерных матриксах, содержащих коллагены разного типа. Они обнаружили важные различия в морфологии биосинтетической функции хондроцитов, культивируемых в коллагеновых матриксах, содержащих коллаген I и II типов. Клетки в матриксе из коллагена II типа сохряняли свою сферическую форму, в то время как в коллагене I типа имели фибробластоподобную морфологию. Более того, в матриксе из коллагена II типа хондроциты вырабатывали большее количество гликозаминогликанов. J. van Susante и соавторы (1995) сравнивали свойства хондроцитов, культивируемых в алгинате и коллагеновом (I тип) геле. Авторы обнаружили значительное увеличение количества клеток в коллагеновом геле, однако с 6-го дня культивации клетки утратили характерный фенотип, превратившись в фибробластоподобные клетки. В геле алгината наблюдали уменьшение количества клеток, однако хондроциты сохраняли свой нормальный фенотип. В коллагеновом геле количество протеогликанов, приходящихся на одну клетку, было значительно выше, чем в алгинате, однако в геле наблюдали снижение синтеза элементов матрикса, начиная с 6-го дня культивирования, тогда как в алгинате синтез продолжал расти.
Твердый трехмерный фибриновый матрикс представляет собой естественное вещество, которое поддерживает взвешенные в нем хондроциты в дифференцированном фенотипе. Трехмерный фибриновый матрикс также может использоваться в качестве носителя при трансплантации хондроцитов (Homminga G. et al., 1993). Преимуществами фибрина являются отсутствие цитотоксичности, способность заполнять пространство, адгезивная способность (Hendrickson D. et al., 1994; Fortier L. et al., 1997). Путем гистологических и биохимических исследований, ауторадиографии, электронной микроскопии обнаружено, что хондроциты в фибриновом геле сохраняют свою морфологию, размножаются и вырабатывают матрикс даже после 2 нед культивирования (Fortier L. et al., 1997). Однако G. Homminga и соавторы (1993) сообщили, что уже после 3 дней культивирования начинается дезинтеграция фибрина, прогрессирует дедифференцировка хондроцитов.
Взвесь хондроцитов в искусственном (синтетическом) ВКМ. Имплантаты хряща для реконструктивной или ортопедической хирургии могут быть получены путем выращивания изолированных хондроцитов in vitro в синтетическом биосовместимом матриксе.
Культивируемые в полигликолевой кислоте хондроциты пролиферируют и поддерживают нормальную морфологию и фенотип в течение 8 нед. Комплекс хондроциты—полигликолевая кислота состоит из клеток, гликозаминогликанов, коллагнов, имеет наружную коллагеновую капсулу. Однако в таких имплантатах присутствуют два типа коллагеновых молекул — I и II. Имплантаты из дедифференцированных серией пассажей хондроцитов имеют большее количество гликозаминогликанов и коллагенов, чем в имплантатах из первично недифференцированных хондроцитов (Freed L. et al., 1994b).
L. Freed и соавторы (1993b) сравнили поведение культур хондроцитов человека и быка в волокнистой полигликолевой кислоте (ВПГК) и порозной полилактиловой кислоте (ППЛК). Через 6–8 нед культивации хондроцитов быка в ВПГК или ППЛК авторы наблюдали пролиферацию клеток и регенерацию хрящевого матрикса. В ВПГК хондроциты имели сферическую форму, располагались в лакунах, окруженных хрящевым матриксом. После 8 нед культивирования in vitro регенерированная ткань содержала до 50% сухого вещества (4% клеточной массы, 15% гликозаминогликанов и 31% коллагенов). В ППЛК клетки имели веретенообразную форму, небольшое количество гликозаминогликанов и коллагена. В ВПГК рост клеток был в 2 раза интенсивнее, чем в ППЛК (Freed L. et al., 1993a). В условиях in vivo хондроциты, выращенные в ВПГК и ППЛК, в течение 1–6 мес вырабатывали ткань, гистологически похожую на хрящ. Имплантаты содержали гликозаминогликаны, коллагены I и II типа (Freed L. et al., 1993a).
Фетальные хондроциты быка культивировали в порозном высокой плотности гидрофобном и гидрофильном полиэтилене. После 7 дней инкубации в обоих субстратах клетки сохраняли сферическую форму, содержали главным образом коллаген II типа. После 21 дня культивации оказалось, что гидрофильный матрикс содержит большее количество коллагена II типа, чем гидрофобный (Livecchi A. et al., 1994).
Хрящевую ткань также можно получить путем культивирования в монослое на фильтрах Millicell-CM. Предварительное покрытие фильтров коллагеном необходимо для прикрепления хондроцитов. Гистологическое исследование культуры демонстрирует аккумуляцию хондроцитов в ВКМ, содержащем протеогликаны и коллаген II типа. Коллаген I типа в такой культуре не обнаружен. Хондроциты в полученной хрящевой ткани имеют сферическую форму, однако на поверхности ткани они несколько уплощены. Толщина вновь образованной ткани увеличивалась со временем и зависела от начальной плотности монослоя клеток. В оптимальных условиях культивирования толщина хрящевой ткани достигала 110 мкм, организация ее клеток и коллагена в поверхностный и глубокий слои аналогична таковой у суставного хряща. ВКМ содержит приблизительно в 3 раза большее количество коллагена и протеогликанов. После 2 нед культивации отмечена аккумуляция матрикса, позволявшая извлечь ткань из фильтра и использовать ее для трансплантации (Boyle J. et al., 1995; Kandel R. et al., 1995).
C. Sims и соавторы (1996) исследовали культивирование хондроцитов в полиэтиленоксид-геле — инкапсулированном полимерном матриксе, позволяющем переносить большое количество клеток путем инъекции. Через 6 нед после инъекции в подкожную клетчатку у бестимусных мышей был образован новый хрящ, который морфологически характеризовался белым опалесцированием подобно гиалиновому хрящу. Данные гистологического и биохимического исследований свидетельствовали о наличии активно пролиферирующих хондроцитов, вырабатывающих ВКМ.
Эксплантация. Эксплантация хрящевой ткани используется для исследования процессов ана- и катаболизма в ней, поддержания гомеостаза, резорбции и репарации (Campbell M. et al., 1985; Sandy J. et al., 1991). Хондроциты в эксплантатах хрящевой ткани поддерживают нормальный фенотип и состав ВКМ, похожие на таковые в суставном хряще in vivo. После 5 дней культивирования в присутствии сыворотки достигается постоянный уровень процессов синтеза и естественной деградации (Campbell M. et al., 1984). Резорбцию ткани можно ускорить в основной культуре и культуре с добавлением сыворотки с помощью ряда агентов, например, ИЛ-1β, ФНО-α, бактериальных липополисахаридов, дериватов ретиноивой кислоты или активных кислородных радикалов. Для изучения репарации хряща его повреждение индуцируют растворимыми медиаторами воспаления (Н2О2, ИЛ-1, ФНО-α) или физическим разрывом матрикса.
Метод органотипных культур — модель для исследования in vitro эффектов изолированных внешних факторов на хондроциты и окружающий их матрикс. В условиях in vivo хондроциты редко расположены в ВКМ и не контактируют друг с другом. Культура эксплантата суставного хряща сохраняет эту структурную организацию, а также особенные взаимодействия между хондроцитами и окружающей их внеклеточной средой. Такую модель также используют для изучения влияния механического стресса, фармакологических агентов, факторов роста, цитокинов, гормонов на метаболизм хряща.
Еще одним преимуществом эксплантации хрящевой ткани является отсутствие повреждения хондроцитов под действием протеолитических ферментов или механического фактора, что неизбежно при изоляции клеток. Рецепторы и другие мембранные белки и гликопротеины защищены от повреждающих факторов.
Культура хондронов. Хондрон — структурная, функциональная и метаболическая единица суставного хряща, состоящая из хондроцита, его перицеллюлярного матрикса и компактной филаментной капсулы и отвечающая за гомеостаз матрикса. Хондроны механическим путем экстрагируют из хряща и собирают с помощью нескольких последовательных низкоскоростных гомогенизаций. Изолированные из зон разной глубины хряща хондроны можно разделить на четыре категории: единичный хондрон, спаренные хондроны, множественные (три или более) линейно расположенные хондроны (колонки хондронов), скопление хондронов.
Единичные хондроны обычно обнаруживают в средних слоях интактного хряща, спаренные — на границе средних и глубоких слоев, линейно расположенные множественные хондроны типичны для глубоких слоев интактного хряща. Наконец, скопления хондронов состоят из случайно организованных групп единичных и спаренных хондронов, которые сохраняют агрегированное состояние после гомогенизации. Скопления хондронов представляют собой крупные фрагменты хряща, обычно содержащие несколько хондронов и радиально расположенные коллагеновые фибриллы, т. е. типичная организация, характерная для глубоких слоев матрикса (Poole C.A. et al., 1988). Хондроны иммобилизируют в прозрачной агарозе, что позволяет проводить исследования их структуры, молекулярного состава и метаболической активности. Систему хондрон — агароза рассматривают как микромодель хряща, которая отличается от традиционной системы хондроцит — агароза тем, что сохраняется естественное микроокружение, нет необходимости осуществлять его синтез и сборку (Poole C., 1997). Культура хондронов — модель для изучения взаимодействий клеток и матрикса в суставном хряще в норме и при патологических состояниях.
Культура бессмертных хондроцитов. Для создания перманентных линий клеток используют рекомбинантную ДНК или онкогенсодержащие вирусы, способные сделать клетку «бессмертной» (Horton W. et al., 1988; Thenet S. et al., 1992; Oxford J. et al., 1994; Mallein-Gerin F. et al., 1995). Бессмертные хондроциты обладают способностью к бесконечной пролиферации, сохраняя стабильный фенотип. F. Mallein-Gerin и соавторы (1995) показали, что SV40T-онкоген индуцирует пролиферацию хондроцитов мыши, которые при этом продолжают стабильно экспрессировать коллагены II, IX и XI типов, а также суставной аггрекан и связующий белок. Однако такая линия клеток приобретает способность синтезировать коллаген I типа при культивировании ее в монослойной культуре или в агарозном геле.
W. Horton и соавторы (1988) описали линию бессмертных клеток с низким уровнем экспрессии мРНК коллагена ІІ типа. Эти клетки были получены путем их трансформации ретровирусом мыши, содержащим v-myc- и v-raf-онкогены. Этот тип клеток представляет собой уникальную модель для изучения взаимодействий суставного матрикса в отсутствие коллагена ІІ типа, а также регуляцию синтеза коллагена ІІ типа (Oxford J. et al., 1994).
Культура хондроцитов с мутированными, или удаленными генами — удобная модель для исследования их физиологической функции. Эта модель особенно подходит для изучения роли специфических молекул в организации хрящевого матрикса или исследования эффектов различных регуляторных факторов на метаболизм хряща. Хондроциты с удаленным геном коллагена IX типа синтезируют коллагеновые фибриллы шире, чем нормальные, что свидетельствует о том, что коллаген IX типа регулирует диаметр фибрилл (Mallein-Gerin F. et al., 1995). Как отмечалось в главе 1, недавно обнаружена мутация гена COL2A1, кодирующего коллаген ІІ типа в семьях с первичным генерализованным ОА. Для исследования влияния мутантного коллагена ІІ типа на суставной матрикс R. Dharmrvaram и соавторы (1997) выполнили трансфекцию («заражение» чужой нуклеиновой кислотой) дефектного COL2A1 (аргинин в положении 519 заменен на цистеин) в фетальные хондроциты человека in vitro.
Система кокультур. В суставе хрящ взаимодействует с клетками других типов, содержащимися в синовиальной мембране, синовиальной жидкости, связках, субхондральной кости. На метаболизм хондроцитов могут влиять различные растворимые факторы, синтезируемые перечисленными клетками. Так, при артритах суставной хрящ разрушается протеолитическими ферментами и свободными радикалами, которые вырабатываются синовиальными клетками. Поэтому были разработаны модели для изучения сложных взаимодействий между хрящом и окружающими тканями, которые получили название кокультуры.
S. Lacombe-Gleise и соавторы (1995) культивировали хондроциты кролика и остеобласты в системе кокультур (COSTAR), в которой клетки были отделены микропористой мембраной (0,4 мкм), позволявшей обмен между клетками двух типов без каких-либо прямых контактов. Это исследование продемонстрировало способность остеобластов стимулировать рост хондроцитов посредством растворимых медиаторов.
A.M. Malfait и соавторы (1994) исследовали взаимоотношения моноцитов периферической крови и хондроцитов. Данная модель удобна для изучения процессов, опосредованных цитокинами, при воспалительных артропатиях (ревматоидный артрит, серонегативные спондилоартриты и др.). Авторы модели разделяли клетки протеинсвязывающей мембраной с порами диаметром 0,4 мкм. Исследование показало, что стимулированные липополисахаридом моноциты вырабатывали ИЛ-1 и ФНО-α, которые угнетали синтез хондроцитами аггрекана и способствовали деградации уже синтезированных агрегатов аггрекана.
K. Tada и соавторы (1994) создали модель кокультуры, в которой эндотелиальные клетки в коллагеновом (І типа) геле были помещены во внутреннюю камеру, отделенную от наружной камеры с помещенными в нее хондроцитами фильтром с размером пор 0,4 мкм. В состоянии полной изоляции от наружной камеры эндотелиальные клетки человека образовывали трубки в коллагеновом геле в присутствии ЭФР или ТФР-α. При одновременном культивировании обоих типов клеток ТФР-α зависимое образование трубок эндотелиальными клетками угнеталось. Угнетение хондроцитами этого процесса частично устранялось анти-ТФР-β антителами. Можно предположить, что ТФР-β, вырабатываемый хондроцитами, угнетает васкуляризацию самого хряща.
C. Groot и соавторы (1994) одновременно культивировали хондроциты из гипертрофической и пролиферативной зон кости 16-дневного плода мыши с кусочками мозговой ткани. После 4 дней культивирования наблюдали трансдифференцирование хондроцитов в остеобласты и начало формирования остеоида. Через 11 дней культивирования часть хряща была замещена костной тканью и костный матрикс был частично кальцифицирован. Некоторые нейропептиды и нейротрансмиттеры, вырабатываемые тканью головного мозга, влияют на метаболизм остеобластов или имеют рецепторы на них. Среди них можно выделить норэпинефрин (Kumagai H. et al., 1989), вазоактивный интестинальный пептид (Bjurholm A. et al., 1988a; 1988b), пептид, связанный с геном кальцитонина (Michelangeli V. et al., 1989; Bjurholm A. et al., 1990), субстанцию Р (Bjurholm A. et al., 1990) и соматостатин (Mackie E. et al., 1990). Культивированные совместно с хондроцитами кусочки ткани головного мозга могут вырабатывать некоторые из перечисленных факторов, способных индуцировать процесс трансдифференцировки хондроцитов в остеобласты.
Влияние внешних факторов на культуру хондроцитов
Влияние напряжения кислорода на метаболизм хондроцитов. В большинстве случаев культуры хондроцитов развиваются в условиях атмосферного напряжения кислорода. Тем не менее хорошо известно, что in vivo хондроциты существуют в условиях гипоксии и напряжение кислорода варьирует при различных патологических состояниях. Во время процесса созревания наблюдают значительные изменения кровоснабжения эпифизов. Так как васкуляризация варьирует в различных зонах пластинки роста, варьирует также и напряжение кислорода в них. C. Brighton и R. Heppenstall (1971) продемонстрировали, что в пластинке большеберцовой кости у кроликов напряжение кислорода в гипертрофической зоне меньше, чем в окружающем ее хряще. Измерения некоторых параметров метаболизма показало, что хондроциты способны быстро реагировать на локальные изменения концентрации кислорода. Прежде всего, при низком напряжении кислорода снижается его потребление хондроцитами (Haselgrove J. et al., 1993). При снижении напряжения кислорода от 21 до 0,04% увеличивается утилизация глюкозы, повышаются активность ферментов гликолиза и синтез молочной кислоты. Даже при низком напряжении кислорода абсолютное количество АТФ, АДФ и АМФ остается стабильным (Rajpurohit R. et al., 1996). Эти данные свидетельствуют о направленности метаболизма хондроцитов на максимальное сбережение энергии. Тем не менее, синтетическая активность, а значит, процессы репарации изменяются в условиях гипоксии (Lane J. et al., 1977).
Высокое напряжение кислорода также влияет на метаболизм хондроцитов, вызывая уменьшение синтеза протеогликанов и ДНК (Lane J. et al., 1977), деградацию матрикса хряща (Sledge C., Dinle J., 1965). Эти эффекты, как правило, сопровождаются продукцией свободных кислородных радикалов (Henrotin Y. et al., 1993; Dascalu A. et al., 1996).
Влияние концентрации ионов и осмотического давления окружающей среды на функцию хондроцитов. В нативном хряще концентрация ионов значительно отличается от таковой в других тканях: содержание натрия во внеклеточной среде составляет 250 — 350 ммоль, а ее осмолярность — 350–450 мосмоль. При изолировании хондроцитов из ВКМ и инкубации их в стандартных средах (DMEM (Dulbecco’s Minimal Essential Medium — минимальная эссенциальная среда Дульбекко) осмолярность — 250–280,7 мосмоль) резко изменяется окружающая клетки среда. Кроме того, концентрация кальция и калия в стандартных средах значительно ниже, чем в нативной ткани, а концентрация анионов — значительно выше.
Добавление в среду сахарозы приводит к повышению ее осмолярности и индуцирует преходящее внутриклеточное повышение концентрации Н+ и анионов кальция в цитозоле (Dascalu A. et al., 1996). Подобные внутриклеточные изменения могут влиять на процессы дифференцировки хондроцитов и их метаболическую активность. J. Urban и соавторы (1993) обнаружили, что включение 35S-сульфата и 3Н-пролина изолированными хондроцитами, инкубируемыми в стандартной среде DMEM в течение 2–4 ч, составило только 10% от такового в нативной ткани. Интенсивность синтеза достигла максимума при осмолярности внеклеточной среды 350–400 мосмоль как в только что изолированных хондроцитах, так и в эксплантатах хрящевой ткани. Более того, объем хондроцитов увеличился на 30–40% после помещения изолированных клеток в стандартную среду DMEM указанной осмолярности. Однако при культивировании хондроцитов в условиях нефизиологичной осмолярности в течение 12–16 ч клетки адаптируются к новым условиям, уменьшая интенсивность биосинтеза пропорционально сдвигу осмолярности внеклеточной среды.
P. Borgetti и соавторы (1995) исследовали влияние осмолярности внеклеточной среды на рост, морфологию и биосинтез хондроцитов свиньи. Авторы продемонстрировали схожие биохимические и морфологические особенности хондроцитов, культивируемых в средах с осмолярностью 0,28 и 0,38 мосмоль. При осмолярности среды 0,48 мосмоль в течение первых 4–6 ч культивирования наблюдали снижение пролиферации клеток и синтеза белков, однако в дальнейшем происходило восстановление этих параметров, которые в конце концов достигли контрольных величин. При культивировании хондроцитов в среде с осмолярностью 0,58 мосмоль клетки теряют способность поддерживать физиологическую интенсивность пролиферативных процессов и через 6 дней значительно уменьшается количество хондроцитов. При осмолярности среды 0,58 мосмоль наблюдают глубокое угнетение синтеза белков. Кроме того, при культивировании в средах с осмолярностью 0,28–0,38 мосмоль хондроциты сохраняют физиологический фенотип, при более высокой осмолярности (0,48–0,58 мосмоль) происходят значительные изменения морфологии клеток, что проявляется утратой характерного фенотипа, превращением хондроцитов в фибробластоподобные клетки, а также потерей клетками способности к сборке матриксных протеогликанов. Результаты данного исследования свидетельствуют о способности хондроцитов реагировать на ограниченные колебания осмолярности внеклеточной среды.
Изменение концентрации других ионов также может влиять на процессы биосинтеза в хондроцитах. Так, степень включения 35S (сульфата) увеличивается на половину при повышении концентрации ионов калия от 5 ммоль (концентрация в стандартной среде DMEM) до 10 ммоль (концентрация в ВКМ in vivo) (Urban J. et al., 1993). Концентрация кальция ниже 0,5 ммоль способствовала продукции коллагена зрелыми хондроцитами быка, тогда как концентрация 1–2 ммоль (соответствует концентрации в стандартной среде DMEM) вызывала значительное снижение синтеза коллагена. Умеренное увеличение биосинтеза наблюдали при высоких уровнях кальция (2–10 ммоль) (Koyano Y. et al., 1996). Различные катионы принимают участие в прикреплении хондроцитов к белкам ВКМ. Так, ионы магния и марганца обеспечивают прикрепление к фибронектину и коллагену ІІ типа, тогда как ионы кальция не участвуют в прикреплении хондроцитов к белкам (Loeser R., 1994). Таким образом, результаты описанных исследований свидетельствуют о влиянии изменений внеклеточных ионов калия, натрия, кальция и осмолярности среды на биосинтетическую функцию хондроцитов, инкубированных в стандартных средах.
Влияние механического стресса на метаболизм хондроцитов. Иммобилизация сустава вызывает обратимую атрофию хряща, что свидетельствует о необходимости механических стимулов для нормального протекания метаболических процессов в ВКМ. В большинстве случаев используемые модели культур клеток существуют в условиях нормального атмосферного давления. M. Wright и соавторы (1996) показали, что механическое окружение влияет на метаболизм хондроцитов, реакция клеток зависит от интенсивности и частоты компрессионной нагрузки. Эксперименты с нагрузкой на эксплантаты интактного суставного хряща in vitro продемонстрировали снижение синтеза белков и протеогликанов под действием статической нагрузки, тогда как динамическая нагрузка стимулирует эти процессы (Saamanen A. et al., 1990; Korver T. et al., 1992; Parkkinen J. et al., 1992). Точные механизмы реализации влияния механической нагрузки на хрящ сложные и, вероятно, связаны с деформацией клеток (Lee D., Bader D., 1995), гидростатическим давлением (Parkkinen J. et al., 1993), осмотическим давлением (Urban J. et al., 1993), электрическим потенциалом (Frank E., Grodzinsky A., 1987) и поверхностными клеточными рецепторами к молекулам матрикса (Holmvall K. et al., 1995). Для изучения влияния каждого из перечисленных параметров необходимо создать систему, в которой можно независимо варьировать один параметр. Например, культура эксплантата не подходит для исследования деформации клеток, однако ее можно использовать для изучения общего влияния давления на метаболическую активность хондроцитов. Компрессия хряща приводит к деформации клеток, а также сопровождается возникновением градиента гидростатического давления, электрического потенциала, тока жидкости и изменением таких физико-химических показателей, как содержание воды в матриксе, плотность электрического заряда, уровень осмотического давления. Деформацию клеток можно изучить с помощью изолированных хондроцитов, погруженных в агарозный или коллагеновый гель (Lee D., Bader D., 1995).
Для исследования влияния механической стимуляции на культуру хондроцитов разработаны несколько систем. Некоторые исследователи используют для этого системы, в которых давление прилагается к культуре клеток через газообразную фазу. Так, J.-P. Veldhuijzen и соавторы (1979), используя давление выше атмосферного на 13 кПа с низкой частотой (0,3 Гц) в течение 15 мин, наблюдали увеличение синтеза цАМФ и протеогликанов и снижение синтеза ДНК. R. Smith и соавторы (1996) показали, что перемежающаяся экспозиция культуры первичных хондроцитов быка гидростатическому давлению (10 МПа) с частотой 1 Гц в течение 4 ч вызвала повышение синтеза аггрекана и коллагена ІІ типа, тогда как постоянное давление не влияло на эти процессы. Используя аналогичную систему, M. Wright и соавторы (1996) сообщили, что циклическое давление на культуру клеток ассоциируется с гиперполяризацией клеточной мембраны хондроцитов и активацией Са2+-зависимых калиевых каналов. Таким образом, эффекты циклического давления опосредуются ионными каналами, активируемыми растяжением, в мембране хондроцитов. Ответ хондроцитов на гидростатическое давление зависит от условий культивирования клеток и частоты прилагаемой нагрузки. Так, циклическое гидростатическое давление (5 МПа) снижает включение сульфата в монослой хондроцитов при частоте 0,05, 0,25 и 0,5 Гц, тогда как при частоте более 0,5 Гц включение сульфата в эксплантат хряща увеличивается (Parkkinen J. et al., 1993).
M. Bushmann и соавторы (1992) сообщили, что хондроциты в агарозном геле изменяют биосинтез в ответ на статическую и динамическую механическую нагрузку так же, как и культивируемый интактный орган. Авторы обнаружили, что механическая нагрузка генерирует гиперосмотический стимул с последующим снижением рН в хондроцитах.
Эффект механического растяжения можно исследовать на культуре клеток, погруженных в гель. Силу растяжения можно создать с помощью контролируемого компьютером вакуума. Когда система находится в вакууме определенной степени, дно чашки Петри с культурой клеток удлиняется на известную величину, деформация максимальна по краям дна чашки и минимальна в центре. Растяжение передается и культивируемым в чашке Петри хондроцитам. С помощью этого метода K. Holmvall и соавторы (1995) показали, что в культивируемых в коллагеновом (II тип) геле клетках хондросаркомы увеличена экспрессия мРНК α2-интегрина. α2β1-интегрин способен связываться с коллагеном II типа. Его рассматривают как механорецептор, поскольку он взаимодействует с актинсвязывающими протеинами, таким образом соединяя ВКМ и цитоскелет.
Влияние рН на метаболизм хондроцитов. рН интерстициальной жидкости ВКМ хрящевой ткани более кислый, чем в других тканях. A. Maroudas (1980) определил рН матрикса суставного хряща на уровне 6,9. B. Diamant и соавторы (1966) обнаружили рН 5,5 в патологических условиях. Известно, что хондроциты живут при низком РО2, что свидетельствует о важнейшей роли гликолиза (95% всего метаболизма глюкозы) в метаболизме этих клеток; гликолиз сопровождается продукцией большого количества молочной кислоты (Stefanovic-Racic M. et al., 1994).
Кроме закисления среды продуктами гликолиза важное значение имеют сами компоненты матрикса. Большое количество фиксированного отрицательного заряда на протеогликанах модифицирует внеклеточный ионный состав: отмечаются высокая концентрация свободных катионов (например, Н+, Nа+, К+) и низкая концентрация анионов (например, Cl–, НСО3–) (Lesperance L. et al., 1992). Кроме того, под действием механической нагрузки происходит изгнание воды из ВКМ, что приводит к повышению концентрации фиксированных отрицательных зарядов и привлечению большего количества катионов в матрикс. Это сопровождается снижением рН внеклеточной среды, которое влияет на внутриклеточный рН, модифицируя тем самым метаболизм хондроцитов. R. Wilkin и A. Hall (1995) изучили влияние рН внеклеточной и внутриклеточной среды на биосинтез матрикса изолированными хондроцитами быка. Они наблюдали двойственную модификацию синтеза матрикса при снижении рН. Небольшое снижение рН (7,4<pH<7,1) на 50% увеличивало включение 35SO4 и 3Н-пролина в хондроциты, тогда как более глубокое закисление среды (рН<7,1) угнетало синтез на 75% по сравнению с контролем. Создание же низкого рН (6,65) с помощью ионов аммония вызвало снижение синтеза матрикса только на 20%. Полученные результаты свидетельствуют о том, что модификацию рН внеклеточной среды синтеза матрикса нельзя объяснить только изменениями рН внутриклеточной среды. Более того, хондроциты обладают способностью регулировать внутриклеточный рН с помощью Nа+, Н+-обменника, Nа+-зависимого Cl–—НСО3–-транспортера и Н+/АТФазой (Dascalu A. et al., 1993).
Влияние состава среды для культивирования на метаболизм хондроцитов. Среда для культивирования хондроцитов должна соответствовать условиям эксперимента. В последние годы для оптимизации условий культивирования используют телячью сыворотку. Однако при использовании сыворотки необходимо учитывать ряд важных моментов:
- наружный рост клеток от периферии ткани в культурах органа,
- вариабельность состава сывороток различных серий (Morales T., 1991a),
- наличие в них неизвестных компонентов,
- повышенный риск возникновения помех, артефактов при исследовании влияния различных биологических факторов на метаболическую активность клеток.
Примером последнего может служить исследование (Ribault D. и соавт., 1997) влияния ЭФР на хондроциты хряща у крыс. ЭФР стимулировал включение 3Н-тимидина и повышение содержания ДНК в культуре. Этот эффект был более выражен при низких концентрациях сыворотки (≤1%), однако при высокой концентрации (≥7,5%) эффект исчезал.
Хорошо известно, что уровни синтеза и деградации в DMEM, обогащенной телячьей сывороткой, значительно повышены по сравнению с условиями in vivo. Различия между метаболизмом in vivo и in vitro могут быть вызваны различиями между синовиальной жидкостью и средой, в которой культивируются клетки. D. Lee и соавторы (1997) культивировали хондроциты молодых быков в агарозе с использованием питательной среды, содержащей DMEM, обогащенную 20% телячьей сывороткой и большим количеством нормальной аллогенной синовиальной жидкости. Наличие синовиальной жидкости в среде индуцировало увеличение количества протеогликанов, до 80% от общего количества синовиальной жидкости. Полученные результаты свидетельствуют о том, что синовиальная жидкость в культуре индуцирует уровень метаболизма, аналогичный таковому in vivo, с высоким уровнем синтеза гликозаминогликанов и низким уровнем деления клеток.
G. Verbruggen и соавторы (1995) показали, что синтез 35S-аггрекана хондроцитами человека, культивируемыми в агарозе в DMEM без сыворотки, составил 20–30% от уровня синтеза, наблюдаемого в DMEM, обогащенной 10% телячьей сывороткой. Авторы определи степень, при которой ИФР-1, ИФР-2, ТФР-β или инсулин восстанавливают продукцию аггрекана в среде без сыворотки. Авторы сделали заключение, что 100 нг/мл инсулина, ИФР-1 или ИФР-2 частично восстанавливают синтез аггрекана до 39–53% от контрольного уровня. При комбинации перечисленных факторов явлений синергизма или кумуляции не выявлено. В то же время 10 нг/мл ТФР-β при наличии 100 нг/мл инсулина стимулировали синтез аггрекана до 90% и более от референтного уровня. И наконец, трансферрин сыворотки человека, один или в комбинации с инсулином, не влиял на синтез аггрекана. При замене телячьей сыворотки бычьим сывороточным альбумином содержание агрегатов аггрекана значительно снизилось. Обогащение среды для культивирования инсулином, ИФР или ТФР-β частично восстанавливало способность клеток продуцировать агрегаты аггрекана. При этом ИФР-1 и инсулин способны поддерживать гомеостаз в культурах клеток. После 40 дней культивирования в среде, обогащенной 10–20 нг/мл ИФР-1, синтез протеогликанов поддерживался на том же уровне или даже на более высоком по сравнению со средой, содержащей 20% телячьей сыворотки. Катаболические процессы протекали медленнее в среде, обогащенной ИФР-1, чем в среде, обогащенной 0,1% раствором альбумина, но несколько быстрее в среде, обогащенной 20% сывороткой. В длительно живущих культурах 20 нг/мл ИФР-1 поддерживает стабильное состояние клеток (Campbell M. et al., 1984).
D. Lee и соавторы (1993) сравнили влияние состава среды для культивирования (DMEM, DMEM+20% телячья сыворотка, DMEM+20 нг/мл ИФР-1) на синтез ДНК в культуре эксплантата хрящевой ткани, монослойной культуре и во взвеси в агарозе. При культивировании в агарозе в присутствии сыворотки авторы наблюдали тенденцию к группированию хондроцитов в крупные скопления. Клетки, культивируемые без сыворотки или с ИФР-1, сохраняли в агарозе круглую форму, собирались в небольшие группы, но не формировали крупные агрегаты. В монослое синтез ДНК был значительно выше в среде, содержащей сыворотку, чем в среде, обогащенной ИФР-1; синтез ДНК в последней был значительно выше, чем в необогащенной среде. При культивировании хондроцитов во взвеси в агарозе в необогащенной среде и в среде с ИФР-1 не обнаружено различий в синтезе ДНК. В то же время культивирование взвеси хондроцитов в агарозе в среде, обогащенной сывороткой, сопровождалось повышенным включением радионуклеотида 3Н-тимидина по сравнению с другими средами.
Витамин С необходим для активации ферментов, участвующих в формировании стабильной спиральной структуры коллагеновых фибрилл. Хондроциты, дефицитные в отношении аскорбиновой кислоты, синтезируют недогидроксилированные неспиральные предшественники коллагена, которые медленно секретируются. Введение аскорбиновой кислоты (50 мкг/мл) вызывает гидроксилирование коллагенов II и IX типов и их секретирование в нормальных количествах. Добавление витамина С не влияло на уровень синтеза протеогликанов. Следовательно, секреция коллагена регулируется независимо от секреции протеогликанов (Pacifici M., 1990).
Экспериментальное моделирование ОА у животных
K.P.H. Pritzker (1994) определил экспериментальную модель какой-либо болезни у животных как «гомогенную группу животных, у которых имеется унаследованный, естественно приобретенный или экспериментально индуцированный биологический процесс, подвергающийся научному исследованию, который по одному или нескольким параметрам схож с болезнью у человека». Модели ОА у животных удобны для исследования эволюции структурных изменений в суставных тканях для выяснения того, как различные факторы риска их инициируют или способствуют появлению этих изменений, а также для оценки применяемых терапевтических мер. Необходимо помнить, что ОА — это заболевание не одной ткани — суставного хряща, а всех тканей пораженного сустава, включая субхондральную кость, синовиальную оболочку, мениски, связки, периартикулярные мышцы и афферентные нервы, окончания которых лежат как снаружи, так и внутри суставной капсулы. Проводимые исследования фармакологических агентов на моделях у животных фокусируются главным образом на их влиянии на суставной хрящ. На экспериментальных моделях невозможно оценить главный симптом ОА у людей — боль в суставах. В то же время при моделировании ОА у животных не учитывают ряд важных факторов, способствующих развитию и прогрессированию ОА (например, вертикальное положение тела человека, слабость периартикулярных мышц и др.).
Неполный, но достаточно обширный перечень моделей ОА представлен в табл. 10. Разумеется, наиболее наглядной моделью болезни является та, которая имеет наибольшее сходство с изменениями при ОА у человека. Наибольший интерес модели ОА у животных представляют в плане исследования эффективности препаратов, «модифицирующих болезнь» (DMOAD — disease modifying OA drugs). Несмотря на то, что ряд препаратов этой группы предотвращают развитие или замедляют прогрессирование экспериментально-индуцированного или спонтанного ОА у животных, при изучении их действия у человека все они оказались неэффективными (Brandt K.D., 1999).
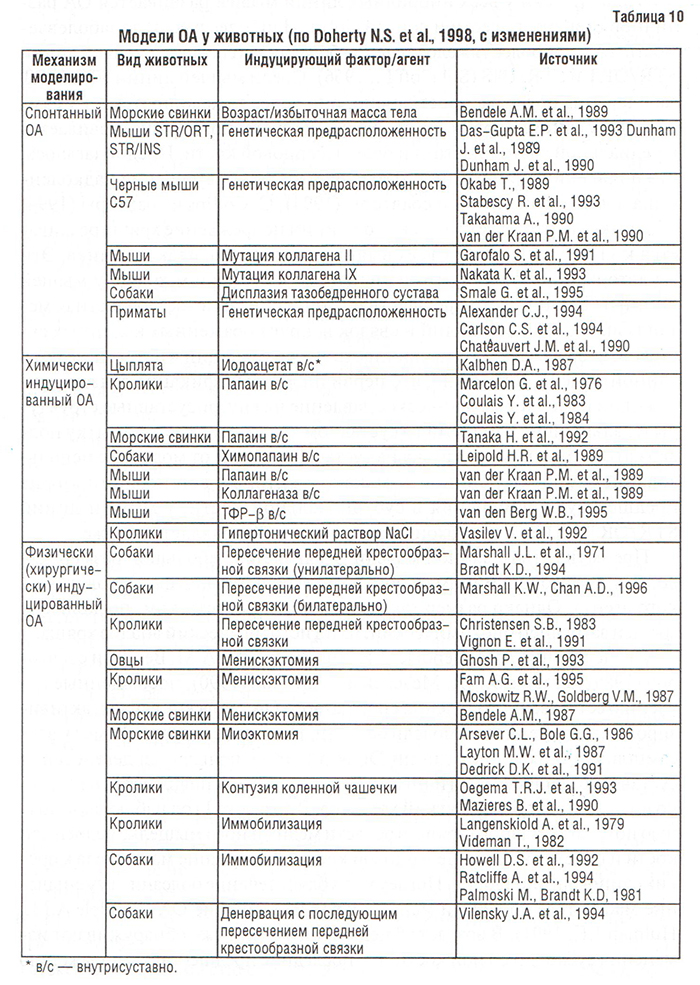
Физически и химически индуцированные модели ОА очень популярны в настоящее время, однако они скорее отражают процессы, которые наблюдаются при вторичном ОА у человека, чем при идиопатическом. Альтернативой им являются модели спонтанного ОА у двуногих приматов и четвероногих животных.
Некоторые авторы весьма скептически относятся к моделированию ОА у животных вообще. Так, по мнению M.E.J. Billingham (1998), использование моделей для открытия модифицирующих ОА препаратов представляет собой «…дорогостоящую авантюру».
Модели спонтанного ОА
Практически у всех инбридных линий мышей развивается ОА различной степени тяжести и локализации. Наиболее высокую заболеваемость ОА и наиболее тяжелое течение болезни наблюдают у мышей линий STR/ORT и STR/INS (Sokoloff L., 1956). Среди мышей линии STR/ORT заболевание более распространено, оно более тяжело протекает у самцов, чем у самок. Первичное повреждение суставного хряща развивается в медиальной части пластинки большеберцовой кости. Предполагалось, что появлению изменений в хряще предшествует смещение надколенника, однако R.G. Evans и соавторы (1994), C. Collins и соавторы (1994) обнаружили, что у всех мышей этой линии повреждение хряща развивается к 11 мес, однако не у всех выявлено смещение надколенника. Эти же авторы обнаружили, что изменениям в суставном хряще у мышей линий STR/ORT часто предшествует хондроцитарно-остеобластная метаплазия клеток сухожилий и связок вокруг пораженных коленных суставов, что указывает на первичность этих изменений в патогенезе ОА в данной модели. Возможно, что первичная кальцификация связок и сухожилий изменяет механическое давление на внутрисуставные структуры и дальнейшие изменения в суставном хряще отражают попытку поддержать нормальную нагрузку на сустав. В отличие от моделей с использованием морских свинок и макак, у которых дегенерации хряща предшествуют изменения в субхондральной кости, у мышей линий STR/ORT и STR/INS субхондральный склероз появляется позже.
Преимуществом данной модели ОА является небольшой размер животных, требующий минимального расхода испытуемого фармакологического агента. Однако размер также является и недостатком, поскольку у мышей затруднен биохимический, патогистологический анализ хряща.
Исследования A.M. Bendele, J.F. Hulman (1988), A.M. Bendel и соавторов (1989), а также S.C.R. Meacock и соавторов (1990), посвященные изучению естественного течения спонтанного ОА у морских свинок, активизировали интерес к этой модели болезни. Начиная с возраста 13 мес у всех самцов морских свинок линии Dunkin Hurtley появляется дегенерация суставного хряща. Аналогичные изменения у самок появляются несколько позже и носят более мягкий характер. В возрасте 1 год наблюдают полную потерю суставного хряща в области медиального мыщелка бедренной кости и пластинки большеберцовой кости. Увеличение массы тела морских свинок линии Dunkin Hurtley усугубляет течение болезни, а уменьшение массы тела до 900 г и меньше улучшает течение ОА (Bendele A.M., Hulman J.F., 1991). В возрасте 8 нед в этой модели уже обнаруживают изменения субхондральной кости, т.е. последние предшествуют поражению хряща (Watson P.J. et al., 1994). Изменения крестовидных связок коленных суставов могут ускорять ремоделирование костной ткани.
Спонтанный ОА развивается у макак rhesus и cynomolgus (DeRousseau C.J., 1985; Kessler M.J. et al., 1986; Pritzker K.P.H. et al., 1989; Chateauvert J.M. et al., 1990; Moskowitz R.W., 1992; Carlson C.S. et al., 1995). Очень важным преимуществом приматов перед другими животными, используемыми для создания экспериментальной модели ОА, является двуногость. Заболевание развивается у особей среднего/пожилого возраста. Ранними гистологическими находками являются утолщение субхондральной кости с последующим разволокнением суставного хряща в области медиальной пластинки большеберцовой кости (Carlson C.S. et al., 1995). В дальнейшем в процесс вовлекается и латеральная пластинка. Примечательно, что дегенерация суставного хряща начинает развиваться только после того, как толщина субхондральной кости достигнет 400 мкм (Carlson C.S. et al., 1996). Рост распространенности и степени тяжести ОА у макак происходит с возрастом, однако на эти показатели не влияют пол и масса тела. До настоящего времени модели ОА у приматов не использовали для изучения эффективности DMOADs.
Модели физически (хирургически) индуцированного ОА. Модели ОА, основанные на хирургически индуцированной разболтанности коленных суставов, изменяющей механическое давление на них, наиболее часто используют у собак и кроликов. Наиболее широко применяют модель с пересечением крестовидных связок у собак (Brandt K.D., 1994). При создании хирургических моделей ОА у кроликов используют операции по пересечению крестовидных связок с иссечением медиальных и коллатеральных связок или без такового, тотальную или парциальную менискэктомию, хирургический разрыв менисков (Moskowitz R.W., 1992). У морских свинок описаны хирургические модели ОА, созданные путем пересечения крестовидных и коллатеральных связок, частичной менискэктомии (Bendele A.M., White S.L., 1987; Meacock S.C.R. et al., 1990). Частичная менискэктомия у морских свинок ведет к образованию остеофитов в течение 2 нед и избыточной дегенерации суставного хряща в течение 6 нед.
До недавнего времени к модели ОА у собак, развившемуся после пересечения передних крестовидных связок, относились скептически в связи с отсутствием ульцерации хряща и заметного прогрессирования болезни, наблюдаемых при ОА у человека. J.L. Marshall и S.-E. Olsson (1971) обнаружили, что изменения в тканях коленных суставов у собак через 2 года после операции практически не отличались от зарегистрированных сразу после нее. Авторы предположили, что механические факторы (например, фиброз суставной капсулы и образование остеофитов) стабилизируют разболтанный после операции коленный сустав и препятствуют дальнейшему прогрессированию разрушению суставного хряща. Также было предложено считать данную модель моделью повреждения и репарации хряща, а не моделью ОА. Однако результаты исследований, проведенных K.D. Brandt и соавторами (1991), которые более длительно изучали динамику изменений в тканях коленных суставов, дестабилизированных пересечением передних крестовидных связок, опровергли предположения предыдущих авторов.
C.A. McDevitt и соавторы (1973, 1977) обнаружили, что уже в течение первых дней после пересечения крестовидных связок увеличивается синтез протеогликанов хондроцитами суставного хряща. В течение 64 нед после хирургического индуцирования нестабильности коленного сустава толщина суставного хряща была выше нормы, хотя биохимические, метаболические и гистологические изменения в нем соответствовали таковым при ОА (Adams M.E., Brandt K.D., 1991). Это утолщение хряща ассоциировалось с повышенным синтезом протеогликанов и их высокой концентрацией в суставном хряще. Используя магнитно-резонансную томографию (МРТ), M.E. Adams и K.D. Brandt (1991) показали, что после пересечения крестовидных связок гипертрофия хряща поддерживается в течение 36 мес, в дальнейшем возникает прогрессирующая потеря хряща, так что уже через 45 мес большая часть суставных поверхностей лишена хряща. Морфологическое исследование хряща через 54 мес после операции подтвердило результаты МРТ. Таким образом, M.E. Adams и K.D. Brandt (1991) доказали, что хирургически индуцированную нестабильность коленных суставов у собак можно считать моделью ОА.
Феномен гипертрофической репарации суставного хряща хорошо иллюстрирует вышеописанная модель ОА у собак. Однако известно, что данный феномен присущ не только ей. Гипертрофия суставного хряща, которая носила репаративный характер, впервые была описана у больных с ОА E.G.L. Bywaters (1937), а впоследствии L.C. Johnson. Ее также обнаруживают и в других моделях ОА — у кроликов после частичной менискэктомии (Vignon E. et al., 1983), у макак rhesus гипертрофия хряща развивается спонтанно (Chateauvert J. et al., 1989; 1990).
Современное описание патогенеза акцентируется главным образом на прогрессирующей «потере» хряща, однако часто авторы упускают из виду его утолщение и усиление синтеза протеогликанов, что соответствует гомеостатической фазе стабилизированного ОА. В течение этой фазы репарация хряща компенсирует его потерю и может поддерживать сустав в функциональном состоянии длительное время. Но репаративная ткань часто не может справляться с возложенной на нее механической нагрузкой так, как это делает здоровый суставной хрящ, что приводит к неспособности хондроцитов поддерживать нормальный состав матрикса и снижению синтеза протеогликанов. Развивается конечная стадия ОА (Brandt K.D. et al., 1991).
Изучение артропатии Шарко привело к появлению метода нейрогенного ускорения моделирования хирургически индуцированного ОА. Артропатия Шарко характеризуется тяжелой деструкцией суставов, суставными «мышами», выпотом в сустав, нестабильностью связок, образованием новой костной и хрящевой ткани в пределах сустава. Общая концепция патогенеза артропатии Шарко (нейрогенной) заключается в прерывании чувствительных сигналов от проприорецепторов и ноцицепторов конечностей в центральную нервную систему (ЦНС) (Brandt K.D., 1999). Для ускорения прогрессирования ОА, индуцированного пересечением передних крестовидных связок у собак, перед операцией выполняют ганглийэктомию (Vilensky J.A. et al., 1994) или иссечение иннервирующего сустав нерва (O’Connor B.L. et al., 1992), что приводит к появлению эрозий хряща уже в первую неделю после операции (O’Connor B.L. et al., 1985). Интересно, что новый DMOAD диацереин оказался эффективным при использовании на медленно прогрессирующей (нейрологически интактной) модели ОА, однако при нейрогенно ускоренном экспериментальном ОА препарат оказался неэффективным (Brandt K.D. et al., 1997).
В заключение необходимо отметить, что невозможно полностью оценить идентичность экспериментальной модели ОА и ОА у человека, поскольку этиология и точные механизмы патогенеза заболевания к настоящему времени не выяснены. Как указывалось ранее, основной задачей использования экспериментальных моделей ОА у животных является их использование для оценки эффективности новых препаратов, главным образом группы «модифицирующих болезнь». Вероятность того, насколько результаты лечения животного совпадут с результатами применения экспериментального фармакологического агента у человека, также невозможно определить. N.S. Doherty и соавторы (1998) акцентировали внимание на значительных различиях между видами животных, используемых для моделирования ОА, в плане разного развития патологии, различных медиаторов, рецепторов, ферментов, что приводит к необъективной экстраполяции терапевтической активности новых препаратов, используемых у животных, на человека. Примером может быть высокая эффективность НПВП при моделировании воспалительного артрита у грызунов (Rogachevsky R.A. et al., 1994). Это привело к переоценке эффективности НПВП у человека, у которого простагландины не играют той фундаментальной роли в патогенезе заболевания, которую они играют у грызунов, а клиническая эффективность НПВП скорее ограничена лечением симптомов, чем модификацией болезни.
В то же время недооценка новых фармакологических агентов при изучении их эффективности на моделях у животных может привести к утрате потенциально эффективных у человека терапевтических агентов. Например, соли золота, пеницилламин, хлорохин и сульфазалазин, обладающие определенным эффектом при терапии ревматоидного артрита, абсолютно не эффективны у животных, которых используют для скриннинга антиревматических препаратов (Zhang J. et al., 1995). Открытие эффективности этих препаратов у больных с ревматоидным артритом было счастливой случайностью, их точные механизмы действия до конца не выяснены (Brandt K.D., 1999).
Отличие ответа животного с моделированным ОА и больного с ОА на лечение DMOAD во многом зависит от коллагеназы — фермента, который, как полагают, принимает активное участие в патогенезе ОА. У грызунов с моделированным ОА часто обнаруживают ингибиторы интерстициальной коллагеназы (коллагеназы-1 или матричной металлопротеиназы (ММП) –1) (Howell D.S. et al., 1986), однако гомолог коллагеназы-1 человека у грызунов не найден, возможно, его не существует. Таким образом, специфические ингибиторы коллагеназы-1 человека не проявят терапевтическую эффективность у грызунов с экспериментальным ОА. Большинство ингибиторов ММП, созданных к настоящему времени, неселективные и поэтому угнетают коллагеназу-3 (ММП-13), участвующую в патогенезе экспериментального ОА у грызунов. Более того, как показали исследования N.R.A. Beeley и соавторов (1994), J.M.P. Freije и соавторов (1994), коллагеназа-3 человека экспрессируется в суставном хряще больных с ОА и, возможно, играет роль в патогенезе заболевания.
Можно предположить, что данные медиаторы, рецепторы или ферменты играют аналогичную роль в патогенезе моделированного ОА у определенного животного и у человека. Примером может служить хемотаксическая способность лейкотриена В4, которая у человека, мыши и кролика считается одинаковой, однако активность антагонистов этого биологически активного вещества между видами животных различается в 1000 раз (Doherty N.S. et al., 1998). Для того чтобы избежать подобных неточностей в экспериментах, необходимо создать методы, позволяющие исследовать фармакодинамику in vivo. Например, можно изучать влияние каких-либо веществ на активность экзогенных ферментов или медиаторов человека. Эта методика была применена V. Ganu и соавторами (1994) для оценки активности ингибиторов ММП путем определения способности препаратов угнетать высвобождение протеогликанов из суставного хряща после инъекции стромелезина человека в коленный сустав кролика.
Несмотря на то что результаты, полученные в эксперименте на моделированном ОА, могут привести к неправильной оценке потенциальных DMOAD, модели ОА у животных играют важную роль в базисных исследованиях. Окончательное же решение об эффективности фармакологических агентов в терапии болезней человека можно сделать только после проведения ІІІ фазы клинических испытаний у человека.