Прогрессирование изменений костной ткани и функциональной недостаточности суставного аппарата у больных остеоартрозом, их прогнозирование
Несмотря на значительное развитие современных методов медицинской визуализации (МРТ, компьютерная томография, УЗИ) в последние годы рентгенография остается наиболее распространенным объективным методом диагностики и контроля эффективности лечения пациентов с ОА, что обусловлено его доступностью, простотой, экономичностью и достаточной информативностью (Peterson I.F. et al., 1997; Lanyon P.et al., 1998; Vignon E., 2003). Способ оценки прогрессирования ОА впервые был предложен Келлгреном и Лоуренсом в 1952 г. Они выделили 5 стадий (степеней прогрессирования) от 0 (отсутствие рентгенологических признаков ОА) до 4 (выраженная степень прогрессирования) в зависимости от степени сужения РСЩ, распространенности остеосклероза, количества и размеров остеофитов (Kellgren J.H., Lawrence J.S., 1957). В рутинной клинической практике во всем мире стадийность прогрессирования ОА сегодня диагностируют по Келлгрену и Лоуренсу.
На современном этапе при проведении эпидемиологических или клинических исследований используют 2 метода оценки прогрессирования по данным рентгенографии: количественный (измерение РСЩ) и полуколичественный (наиболее важные рентгенологические симптомы ОА определяют в баллах или степенях, обычно от 0 до 3) (Ahlback S., 1968; Spector T.D. et al., 1992; Buckland-Wright J.C. et al., 1995; Nagaosa Y. Et al., 2000). Учитывая, что при оценке рентгенограмм суставов у больных с ОА коленных суставов (КС) нельзя ограничиваться лишь исследованием РСЩ, полуколичественный является лучшим.
В отличие от гонартроза, для коксартроза не существует скоринговых систем оценки прогрессирования локальных изменений в суставном аппарате. Обычно стадию процесса определяют измерением РСЩ в точке наибольшего сужения в динамике на увеличенных рентгенограммах (Dieppe P., 1996; Auley G.R. et al., 2000). Это связано с тем, что для коксартроза остеофитоз имеет меньшее значение при диагностике болезни и оценке прогрессирования, чем для гонартроза — приблизительно в 1/4 или 1/3 случаев поражения тазобедренного сустава имеют атрофический характер без признаков гипертрофии КТк (остеофитоза, остеосклероза) (Dieppe P., 1995; Conroziere T. et al., 1998).
В настоящее время все чаще обсуждается вопрос об ограниченной информативности метода Келлгрена и Лоуренса в диагностике коксартроза и определении его прогрессирования. Результаты нескольких исследований свидетельствуют о необходимости поиска других критериев прогрессирования коксартроза (Croft P. et al., 1990; Ingvarsson T. et al., 1999; 2000).
В нескольких исследованиях разной продолжительности определяли нормальную РСЩ и изучали скорость ее сужения у больных с ОА. E. Vignon (2003) подытожил результаты нескольких французских исследований и предложил следующие нормальные величины РСЩ в точке наибольшего сужения: тазобедренный сустав — 4,7 мм (больные в возрасте <60 лет) и 4,16 мм (больные в возрасте >60 лет), коленный сустав — 4,98 мм (медиальный ТФО коленного сустава). Сужение РСЩ составило 0,24 мм/год, 0,24 мм/год и 0,19 мм/год соответственно (Vignon E., 2003).
Невзирая на то что прогрессирование ОА — актуальная проблема современной ревматологии, ее изучению было посвящено лишь несколько исследований. Относительно темпов прогрессирования гонартроза существуют определенные расхождения. Так, по данным P. Ravaud и соавторов (1996) РСЩ в ТФО КС сужается со скоростью 0,1–0,6 мм за год. По свидетельству T. Miyazaki и соавторов (2002) за 6 лет наблюдения РСЩ в ТФО КС у больных гонартрозом сузилась на 1,4±1,2 мм (в среднем — на 0,23 мм/год). В другом 4-годичном исследовании сужение РСЩ составило в целом 0,53±0,43 мм (0,13 мм/год) (Sugiyama S. et al., 2003). По свидетельству T. Conrozier и соавторов (1998), J.F. Maillefert и соавторов (2003), темпы сужения РСЩ тазобедренных суставов несколько выше — 0,33± 0,4 и 0,31±0,5 мм у женщин, 0,3±0,5 мм у мужчин соответственно.
При оценке прогрессирования с помощью скоринговых систем, а также по Келлгрену и Лоуренсу, прогрессирование рентгенологических признаков гонартроза регистрировали у 38 (42,22%) из 90 больных с ОА за 3 года наблюдения, в 137 (39%) из 350 коленных суставов за 1–5 (медиана — 2) лет наблюдения, у 13 (22,4%) из 58 женщин с унилатеральным гонартрозом за 2 года наблюдения, у 42 (56,76%) из 74 больных с гонартрозом за 6 лет наблюдения и у 24 (38%) из 63 больных с гонартрозом за 11 лет наблюдения (Spector T.D. et al., 1992).
J. Ledingham и соавторы (1992), P. Dieppe (1995), J.F. Maillefert и соавторы (2002) указывают, что при коксартрозе можно выделить два варианта течения болезни — медленно прогрессирующее, когда от появления симптомов до необходимости артропластики проходит много лет (иногда десятилетий) и быстро прогрессирующее, когда это происходит на протяжении 3–36 мес.
ОА суставов кистей считается вариантом болезни с благоприятным прогнозом — медленным прогрессированием, незначительным влиянием на функциональную недостаточнойсть (ФН) больных и существенной диссоциацией между тяжестью морфологических изменений и клиническими проявлениями (Dieppe P., 1995; Cicuttini F.M. et al., 1998; Kessler S. et al., 2000; Haara M.M. et al., 2003; Vignon E., 2003).
Работы относительно прогнозирования прогрессирования гонартроза появились лишь в последнее время, и их результаты очень противоречивы. Так, наблюдение за такими больными на протяжении 12 лет позволило J.S.A.G. Schouten и соавторам (1992) выделить следующие прогностические факторы прогрессирования локальных изменений в коленных суставах: повышенный ИМТ, возраст >60 лет, наличие узелков Гебердена, генерализованного ОА, а также физиологические искривления нижних конечностей и клинически не значимая травматизация КС в анамнезе. По мнению P. Dieppe (1995), интенсивность выраженности боли в суставах на ранних стадиях ОА является единственным прогностическим фактором необходимости проведения артропластики в дальнейшем. T.D. Spector и соавторы (1994) установили, что у женщин с унилатеральным гонартрозом ожирение является единственным прогностическим фактором возникновения билатерального поражения на протяжении 2–5 лет, а также прогрессирования локальных рентгенологических изменений в КС. В другом исследовании выявлена сильная связь между прогрессированием гонартроза по Келлгрену и Лоуренсу на протяжении 1–5 лет и клиническими признаками воспаления в КС, генерализованным ОА, наличием узелков Гебердена. Наблюдение S. Sugiyama и соавторов (2000) за состоянием здоровья 172 женщин с ОА ТФО КС показало, что единственным прогностическим фактором прогрессирования сужения РСЩ является исходный уровень проколаген ІІ С-пропептида в синовиальной жидкости. Данные ретроспективного анализа M. Sharif и соавторов (2000) свидетельствуют, что повышенный уровень СРБ в сыворотке крови может служить прогностическим фактором прогрессирования гонартроза на протяжении 5 лет.
При анализе различных источников выявлено ограниченное количество исследований относительно прогнозирования прогрессирования коксартроза. Так, в публикации J. Ledingham и соавторы (1992) выделяют следующие прогностические факторы прогрессирования болезни: супралатеральная миграция головки бедренной кости, «атрофический» коксартроз, женский пол, дебют заболевания в пожилом возрасте. В другом исследовании прогностическими факторами прогрессирования коксартроза были РСЩ в начале исследования ≤2 мм, супралатеральная миграция головки бедренной кости, женский пол, возраст в дебюте заболевания >65 лет, индекс Лекена >10 (Auley G.R. et al., 2000). И, наконец, авторы недавно опубликованного исследования выявили сильную корреляционную связь между быстрым сужением РСЩ и дебютом заболевания в преклонном возрасте, отсутствием остеофитов на рентгенограммах (Conroziere T. et al., 1998).
Изучению влияния на ФН больных гонартрозом клинических, демографических или рентгенологических показателей посвящено ограниченное количество публикаций, причем результаты, изложенные в них, очень противоречивы. Так, по данным P. Craemer и соавторов (2000), наиболее важными детерминантами нетрудоспособности при гонартрозе являются боль по ВАШ, ожирение по ИМТ и ощущение незащищенности по «субшкале незащищенности» RAI (Rheumatology Attitudes Index). Авторы не установили никакой связи между выявленными на рентгенограммах изменениями в КС и ФН (Craemer P. et al., 2000). А P. Lanyon и соавторы (1998) сообщили о значительной связи остеофитоза с болью в пораженных КС, причем с повышением степени остеофитоза эта ассоциация была сильнее. Значительно меньшее влияние на боль оказывало сужение РСЩ (Lanyon P. et al., 1998). По свидетельству M. Davis и соавторов (1992), у больных гонартрозом боль в КС сильно коррелирует со степенью локальных изменений в них.
В другом исследовании выявлены определенные различия по половой принадлежности: если у больных гонартрозом женщин рентгенологические признаки заболевания являются лишь слабыми независимыми предикторами локомоторной неспособности, то у мужчин вообще не найдено какой-либо ассоциации между изменениями на рентгенограммах КС и ФН (Odding E. et al., 1998). Авторы публикации отмечают, что наиболее важными независимыми предикторами функциональной недееспособности у больных с ОА КС являются возраст, боль в КС и общая утренняя скованность (Odding E. et al., 1998). Анализ результатов большого эпидемиологического исследования NHANES-I и Фремингемского исследования свидетельствует о значительном влиянии локальных изменений в КС (по данным рентгенографии) на степень ФН больных гонартрозом и интенсивность выраженности болевого синдрома (Guccione A.A. et al., 1989; 1990; Hochberg M.C. et al., 1990; Davis M.A. et al., 1991).
Нами были обследованы 75 больных с ОА с поражением КС, демографическая и стартовая клинические характеристики которых представлены в табл. 50.

У обследованных больных с ОА КС одностороннее поражение выявлено у 34 (45,33%), двустороннее — у 41 (54,67%) пациента. І рентгенологическая стадия ОА диагностирована у 24 (32%), ІІ — у 30 (40%), ІІІ — у 13 (17,33%) и ІV — у 8 (10,67%) больных. Дополнительно было проведено рентгенологическое обследование 20 здоровых волонтеров (6 мужчин, 14 женщин, средний возраст — 52,34±6,1 года, средний ИМТ — 26,71± 5,2 кг/м2), которые составили контрольную группу (КГ).
Сужение РСЩ медиального ТФО КС было установлено на рентгенограммах у 67 (89,33%), латерального отдела — у 36 (48%) больных с ОА, среди них унимедиальное сужение РСЩ выявлено у 39 (52%), унилатеральное — у 8 (10,67%), а билатеральное — у 28 (37,33%) больных с ОА. На рентгенограммах КС в аксиальной проекции сужение РСЩ в ПФО диагностировано у 41 (54,67%) больного, среди них унимедиальное сужение РСЩ определено у 4 (5,33%), унилатеральное — у 34 (45,33%), а билатеральное — лишь у 3 (4%) больных гонартрозом. Полученные результаты несколько отличаются от данных, приведенных в публикации T.E. McAlindon и соавторов (1996), которые обнаружили поражение медиального ТФО — у 75%, латеральной ТФО — у 26%, а ПФО — у 48% больных гонартрозом.
Результаты измерения РСЩ по собственной методике в 6 стандартных точках у больных с ОА и здоровых лиц показали, что у больных она статистически значительно уже, чем у здоровых (р<0,01), причем в медиальном ТФО КС это различие более выражено, чем в латеральном (табл. 51 и 52).
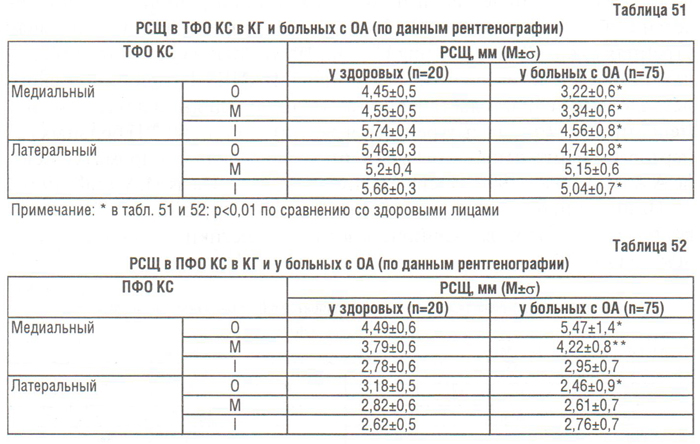
В медиальном ПФО КС наблюдали даже расширение РСЩ, а в латеральном — ее сужение (см. табл. 51). Из группы больных гонартрозом мы выделили подгруппу с сужением РСЩ в ПФО КС (n=41) и сравнили результаты измерения с КГ. Оказалось, что у пациентов с суженной РСЩ в ПФО КС в медиальном ПФО сужение РСЩ превышало не только таковое в КГ, но и таковое у группы больных гонартрозом в целом (в точках Om p=0,003 и Mm p=0,02), а в латеральном отделе было меньшим не только такового в КГ, но и такового в целом по группе больных гонартрозом (в точке Ol p=0,0003) (рис. 95). Аналогичный феномен наблюдали P. Lanyon и соавторы (1998). Они лишь констатировали находку, но не объяснили ее. Мы связываем упомянутый феномен с особенностями анатомического строения надколенника (треугольник).
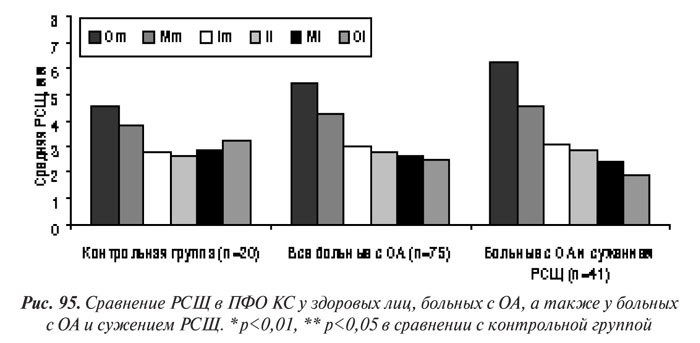
Мы сопоставили полученные результаты измерения РСЩ с рентгенологической стадией гонартроза по Келлгрену и Лоуренсу. В медиальном отделе ТФО КС РСЩ у больных с ОА большей стадии была существенно меньшей, чем при более легкой, а также в сравнении с контрольной группой (рис. 96). Впрочем, в латеральном ТФО КС у больных с ОА І и ІІ стадии в точке Ml и І стадии — в точке Ol РСЩ в среднем превышала таковую в КГ, что, по нашему мнению, было связано с компенсаторным расширением РСЩ в латеральной области при ее сужении в медиальной (унимедиальное сужение). В меньшей степени такое компенсаторное расширение мы наблюдали и у больных с ОА ІІІ рентгенологической стадии (рис. 96).
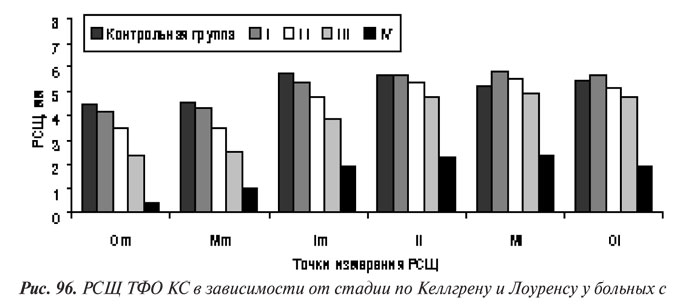
Сравнение результатов измерения сужения РСЩ в ПФО КС больных с ОА разных стадий по Келлгрену и Лоуренсу показало, что чем выше рентгенологическая стадия болезни, тем шире РСЩ в медиальном отделе и тем уже в латеральном (см. рис. 96). Эти особенности можно объяснить треугольной формой надколенника и физиологическим относительным сужением латерального ПФО, (см. табл. 52 — у здоровых людей РСЩ в латеральном ПФО меньше, чем в медиальном).
Мы оценили степени прогрессирования локальных изменений КТк по собственной скоринговой системе, согласно которой степень сужения РСЩ, остеофитоз, остеосклероз и остеокистоз оценивали в баллах от 0 до 3 (рис. 97 и 98).
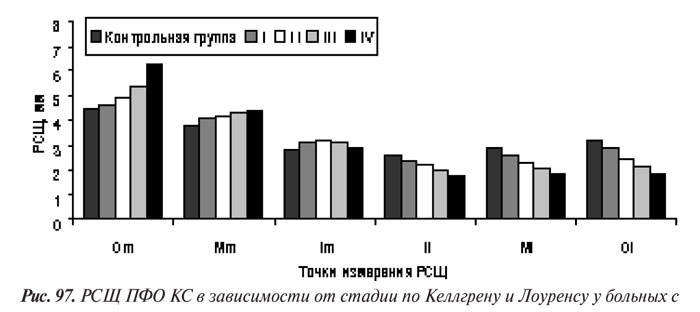
Полученные результаты сопоставления данных оценки прогрессирования по скоринговой системе с рентгенологическими стадиями по Келлгрену и Лоуренсу отображают хорошо известные закономерности прогрессирования ОА КС: к ранним рентгенологическим признакам гонартроза относятся сужение РСЩ и появление ОФ, а признаки остеосклероза и остеокистоза появляются позже — на ІІ и даже ІІІ стадии (см. рис. 98 и 99).
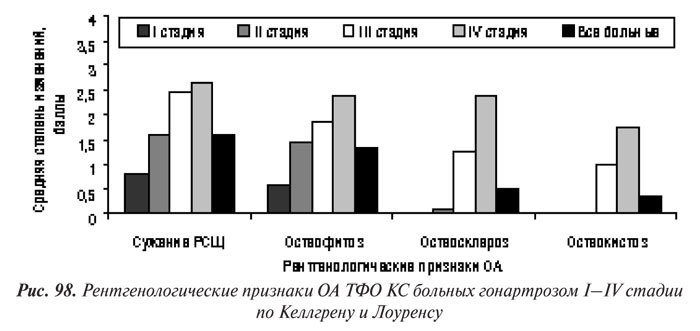
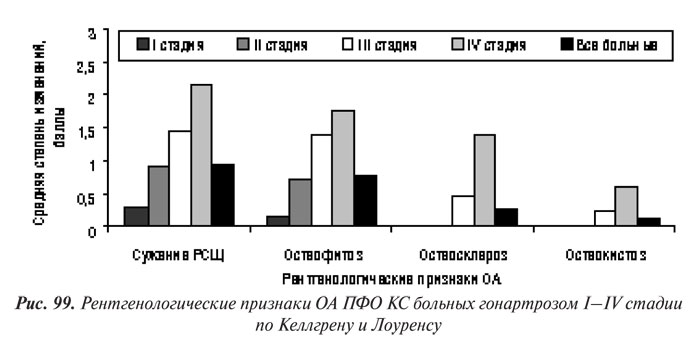
Корреляционный анализ свидетельствует о наличии наиболее сильной связи между рентгенологической стадией и рентгенологическими изменениями в ТФО КС, в сравнении с ПФО (табл. 53). Поражение ПФО чаще регистрировали у больных с большей рентгенологической стадией. Так, из 24 пациентов с ОА І стадии рентгенологические признаки поражения ПФО выявлены у 9 (37,5%), из 30 больных с ОА ІІ стадии — у 21 (70%), из 13 пациентов с ОА ІІІ — у 11 ( 4,62%), а при IV стадии — у всех 8 пациентов.
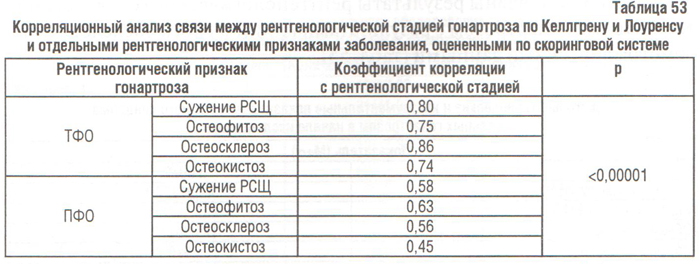
Не менее интересными были данные корреляционного анализа связи между сужением РСЩ в определенных точках на рентгенограммах КС и результатами оценки отдельных рентгенологических признаков гонартроза по скоринговой системе (см. табл. 53).
Корреляционная связь между рентгенологическими признаками гонартроза и сужением РСЩ в ТФО была отрицательной как в медиальном, так и латеральном отделах, причем в медиальном она была сильнее, чем в латеральном. Характерно, что корреляция между остеосклерозом, остеокистозом и сужением РСЩ была более сильной, чем корреляция между сужением РСЩ и остеофитозом и РСЩ (см. табл. 53). Таким образом, полученные результаты подтверждают существующие данные о том, что остеофитоз, остеосклероз и остеокистоз более выражены в зонах наибольшего сужения РСЩ (Martin K. et al., 1996; Nagaosa Y. et al., 2000).
Корреляционный анализ результатов оценки рентгенограмм ПФО КС показал, что в медиальном ТФО связь между рентгенологическими признаками ОА и сужением РСЩ была положительной, причем более выраженной для остеосклероза и остеокистоза, чем для сужения РСЩ и остеофитоза. Однако в латеральном ПФО КС эта связь была очень сильной и отрицательной (табл. 54).
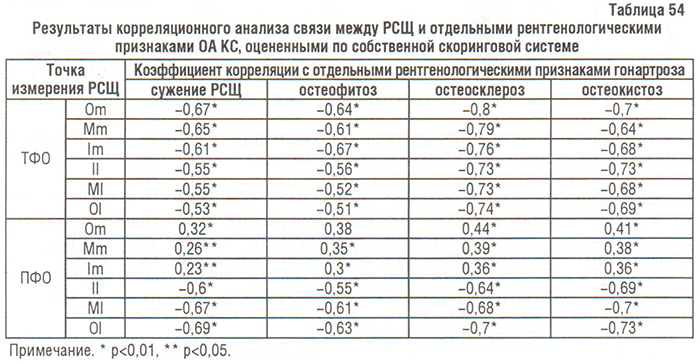
Итак, в ПФО КС остеофитоз, остеосклероз и остеокистоз более выражены в тех суставах, где РСЩ наименьшая в медиальном отделе и наибольшая в латеральном.
Нами сопоставлены результаты рентгенологического обследования КС больных гонартрозом с результатами клинического обследования и демографическими данными (табл. 55).

Для оценки состояния больного с ОА, особенно с поражением КС, наибольшее значение имеет изучение структурных изменений в суставном аппарате с помощью определенных инструментальных методов (в первую очередь рентгенологического) и ФН, для определения которого мы использовали наиболее распространенный в наше время метод оценки по WOMAC (Bellamy N. еt al., 1988). Средний индекс WOMAC составил 43,17±21,9, медиана — 43,9.
Результаты анализа отдельных пунктов анкеты WOMAC показывают, что наиболее выраженную боль пациенты ощущают при поднимании или спускании по лестнице (55,89±21,3), очень тяжело больным гонартрозом выполнять тяжелую домашнюю работу (57,93±28,7), спускаться по ступенькам (52,11±28,6), подниматься из положения сидя (50,13±28,5), ходить за покупками (49,75±30,8) и спускаться по ступенькам (48,42±27,6). Легче всего больным лежать в кровати (27,61±25,3) и сидеть (26,8±21,5).
Итак, мы проанализировали влияние демографических, клинических и инструментальных показателей выраженности суставного синдрома и изменений на рентгенограммах на функциональное состояние больных гонартрозом.
Наиболее сильная корреляционная связь выявлена между индексом WOMAC и клиническими показателями, которые характеризуют выраженность боли (ВАШ боли, болезненность при пальпации РСЩ, нажатии на надколенник) и нарушение функции суставов (объем сгибания) (табл. 56, 57). У больных с костными разрастаниями, выявленными при пальпации, общий индекс WOMAC был значительно выше (44,76±21,5), чем у пациентов без них (30,62±23, р=0,046). Среди демографических показателей существенно влияли на ФН возраст (больные старшего возраста более функционально недееспособны), уровень образования (чем выше уровень образования, тем меньше ФН больных гонартрозом) и ИМТ (табл. 56).
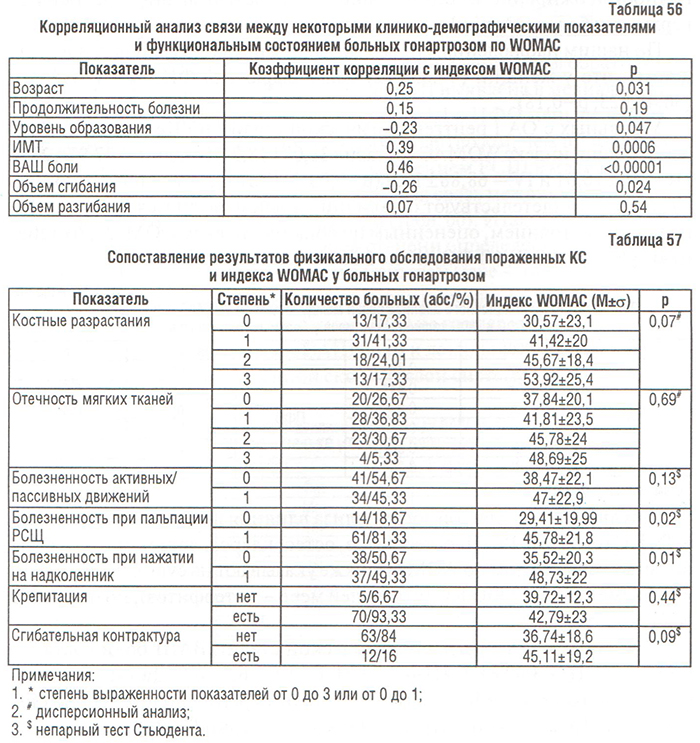
Результаты более детального корреляционного анализа свидетельствуют о сильной положительной связи с ИМТ каждого из 17 пунктов анкеты WOMAC. У больных с ожирением (ИМТ≥30 кг/м2) общий индекс WOMAC составлял 50,23±19,1, тогда как у пациентов без ожирения — 34,18±22,56 (р=0,002). Возрастание ФН у больных с ОА, осложненных ожирением можно объяснить также сугубо механическими неудобствами, которые возникают у них при выполнении действий, оговоренных в анкете WOMAC (Craemer P. et al., 2000). Даже у лиц без ОА нижних конечностей ожирение ассоциировано со слабостью мышц передней поверхности бедра (Martin K. et al., 1996).
По нашим наблюдениям прослеживается незначительная тенденция к тому, что у женщин (44,53±22) более выражена ФН, чем у мужчин (36,48±23, р=0,18).
У больных с ОА І рентгенологической стадии по Келлгрену и Лоуренсу общий индекс WOMAC составил 38,08±18,2, ІІ стадии — 37,97±23,4, ІІІ — 49±16,01 и ІV — 68,88±17,9 (р=0,001). Результаты корреляционного анализа свидетельствуют о наличии сильной связи между функциональным состоянием, оцененным по общему индексу WOMAC, и степенью сужения РСЩ в ТФО, но не в ПФО КС (табл. 58).
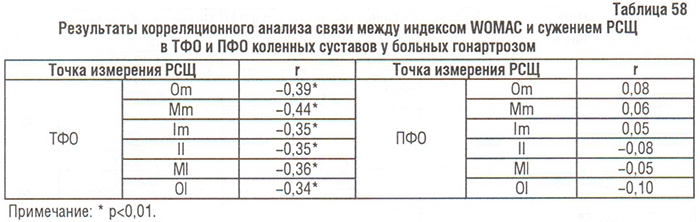
Результаты дисперсионного анализа влияния локальных изменений КТк КС (сужение РСЩ, остеофитоз, остеосклероз, остеокистоз) на ФН больных гонартрозом по WOMAC также указывают на существенное влияние изменений в ТФО КС (в большей мере — остеофитоз), но не в ПФО КС (табл. 59).
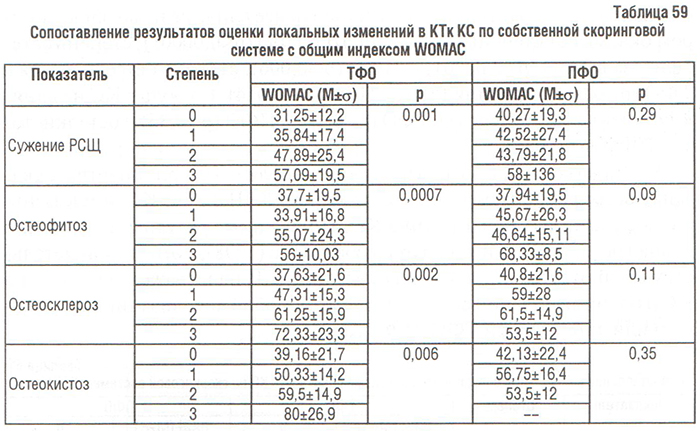
У больных с ОА І рентгенологической стадии ВАШ боли составил 0,96±0,9, с ІІ — 3,08±1,1, ІІІ — 4,92±1,2 и IV — 6,5±0,9. Данные дисперсионного анализа свидетельствуют о влиянии рентгенологической стадии ОА по Келлгрену и Лоуренсу и ВАШ боли (р<0,00001).
По результатам корреляционного анализа более сильная обратная корреляционная связь между ВАШ боли и РСЩ выявлена в медиальном отделе ТФО, чем в латеральном. Сужение РСЩ в ПФО меньше влияет на выраженность боли по ВАШ у больных гонартрозом, чем в ТФО. Кроме того, прямая связь между ВАШ боли и сужением РСЩ в медиальном отделе ПФО была более сильной, чем обратная связь между сужением РСЩ в латеральном отделе ПФО и ВАШ боли (табл. 60). Итак, у больных гонартрозом боль в КС по ВАШ в большей степени определяется степенью сужения РСЩ в медиальном ТФО, и в меньшей мере — степенью сужения РСЩ в латеральном ТФО и степенью расширения РСЩ в медиальном ПФО. Сужение РСЩ в латеральном ПФО не влияет на боль в КС.
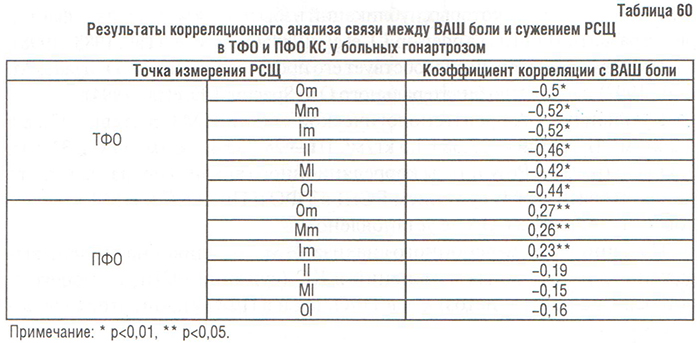
Результаты сопоставления ВАШ боли и локальных изменений в КТк КС, оцененных по собственной скоринговой системе, свидетельствуют о том, что у больных гонартрозом наибольшее влияние на болевой синдром оказывают степень сужения РСЩ в ТФО (р<0,00001), степень остеофитоза в ТФО (р<0,00001) и ПФО (р=0,006), степень остеосклероза в ТФО (р=0,01) и сужения РСЩ в ПФО (р=0,014). На боль в КС не влияют степень остеосклероза в ТФО (р=0,11) и ПФО (р=0,35) и остеокистоза в ПФО (р=0,085).
Как показано в табл. 61, выраженность боли в КС при гонартрозе связана с остеофитозом, меньше — с сужением РСЩ в ТФО КС, и еще меньше — с сужением РСЩ в ПФО КС. Полученные результаты частично совпадают с данными P. Lanyon и соавторов (1998), которые свидетельствуют об отсутствии влияния сужения РСЩ на выраженность боли в КС и наличии сильной связи остеофитоза любой локализации (медиальный или латеральный ТФО/ПФО КС).
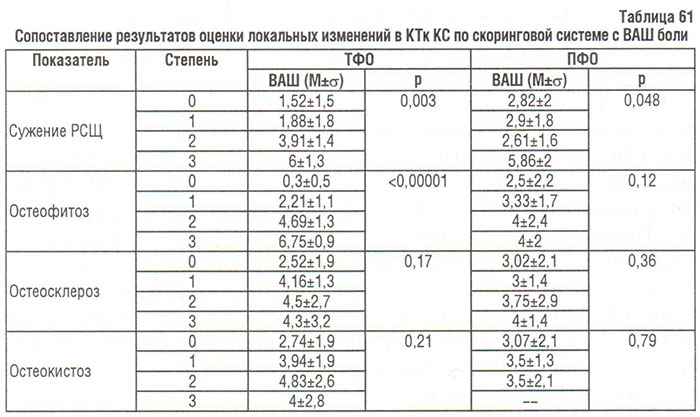
Среди приведенных данных (см. табл. 61) следует отметить повышенное ИМТ. По данным некоторых публикаций избыточная масса тела — фактор риска развития ОА КС (Anderson J.J. et al., 1988; Davis M.A. et al., 1988–1998), а также фактор, который способствует его прогрессированию (Dougados M. et al., 1992) и развитию билатерального ОА (Spector T.D. et al., 1994).
У больных с ОА І рентгенологической стадии ИМТ составил 27,68± 5,2 кг/м2, ІІ стадии — 27,38±4,5 кг/м2, ІІІ — 28,28±4,9 кг/м2 и ІV — 31,59± 4,3 кг/м2 (р=0,3). Результаты корреляционного анализа показывают, что никакой связи между сужением РСЩ в ТФО и ПФО КС и ИМТ у обследованных больных с ОА не установлено.
По данным дисперсионного анализа, ИМТ не влияет на степень выраженности локальных изменений в КС (сужение РСЩ, остеофитоз, остеосклероз, остеокистоз) как в ТФО, так и в ПФО у пациентов с гонартрозом.
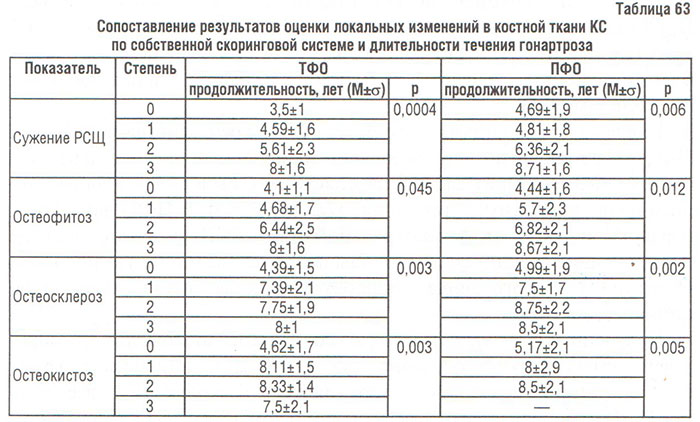
В ходе изучения влияния продолжительности течения ОА КС на локальные изменения в СА по данным рентгенографии установлена существенная зависимость рентгенологической стадии гонартроза, его рентгенологических признаков и сужения РСЩ от продолжительности болезни. Так, при гонартрозе І стадии средняя продолжительность болезни составила 4,08±1,4, ІІ — 4,67±1,5, ІІІ — 7,92±1,7 и ІV — 8,13±1,7 года (р<0,00001).
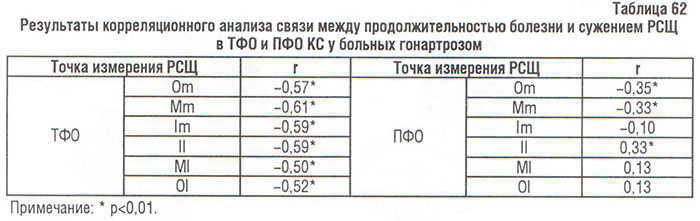
В результате корреляционного анализа выявлена статистически значимая обратная связь между сужением РСЩ в латеральном и медиальном ТФО и частично в медиальном ПФО и продолжительностью болезни (табл. 62).
Данные дисперсионного анализа свидетельствуют о значительном влиянии продолжительности течения гонартроза на все его рентгенологические признаки, оцененные по скоринговой системе (табл. 63).
Нами не выявлено существенного влияния наличия узелков Гебердена и/или Бушара, генерализованного ОА, возраста больных, их пола на РСЩ и на степень выраженности локальных изменений в КС (р>0,05).
После стартового обследования мы осуществили 3-годичный клинико-инструментальный мониторинг больных с ОА, причем в конце исследования проанализировали степень прогрессирования локальных изменений в КС и сопоставили полученные результаты с демографическими, стартовыми клиническими и рентгенологическими показателями с целью создания прогностической модели.
Результаты 3-х-годичного мониторинга больных показали, что прогрессирование изменений на рентгенограммах по Келлгрену и Лоуренсу (на ≥I стадию) отмечали у 22 (29,33%) больных гонартрозом (р=0,35) (рис. 100).
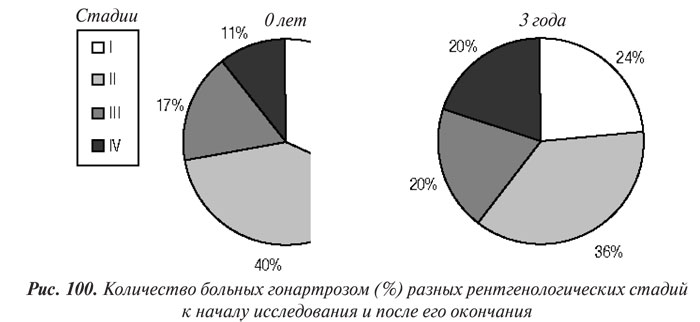
У 6 (25%) из 24 пациентов с ОА І стадии через 3 года диагностировали II, у 9 из 30 (30%) больных с ОА ІІ стадии — III, у 7 из 13 (53,85%) больных с ОА ІІІ стадии — IV. У 4 (50%) больных с ОА ІV стадии через 3 года наблюдения полностью исчезла РСЩ в ТФО, из них у 2 — в медиальном и латеральном ТФО.
В ходе изучения динамики сужения РСЩ на рентгенограммах ТФО и ПФО КС установлено, что наибольшие изменения происходили в медиальном ТФО; сужение РСЩ в латеральном ТФО было значительно меньшим во внешних симметричных точках (р=0,045). В ПФО наблюдали парадоксальную картину: в латеральном отделе РСЩ сузилась, тогда как в медиальном расширилась, что обычно обусловлено не увеличением толщины суставного хряща, а поворотом надколенника в латеральную сторону (рис. 101).
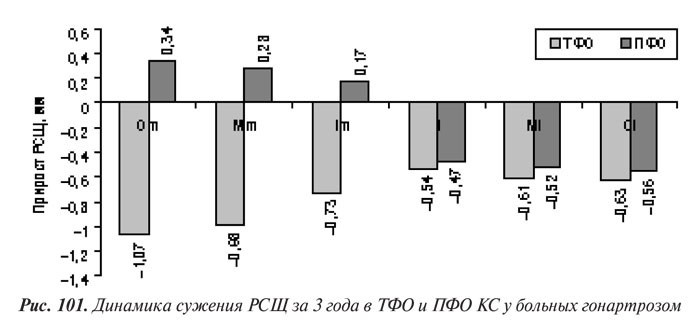
Полученные результаты подтверждают наше предположение, что определенную роль в прогрессировании сужения РСЩ при гонартрозе играют физиологические особенности строения КC — несколько меньшее сужение РСЩ в медиальном ТФО, чем в латеральном, и меньшее в латеральном ПФО, чем в медиальном, а также треугольное строение надколенника.
По данным анализа динамики сужения РСЩ у больных с ОА разных рентгенологических стадий, не выявлено существенных различий. У больных с ОА І и ІІ рентгенологической стадии в ПФО сужение РСЩ было несколько более выражено, чем у больных с ОА ІІІ и ІV стадии.
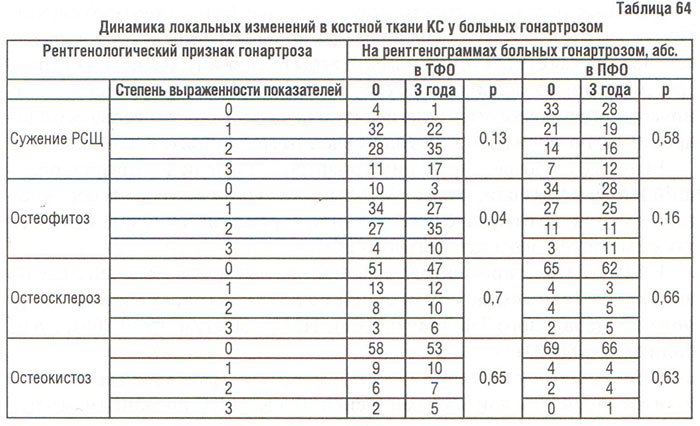
В результате оценки рентгенограмм KC, выполненных через 3 года после начала исследования по собственной скоринговой системе установлено, что в ТФО сужение РСЩ ≥1 балла зарегистрировано в 22 (29,33%) случаях, прогрессирование остеофитоза — в 27 (36%), остеосклероза — 12 (16%), остеокистоза — 12 (16%). В ПФО оно составило 17 (22,67%), 22 (29,33%), 10 (13,33%) и 10 (13,33%) соответственно. Эти результаты подтверждают полученные нами ранее данные (Борткевич О.П., 2002) о том, что у обследованных больных гонартрозом единственным рентгенологическим признаком ОА, который существенно изменяется в динамике заболевания, является остеофитоз (табл. 64).
Следующим этапом изучения прогрессирования локальных изменений КТк КС по данным рентгенографии у больных гонартрозом была попытка создания прогностической модели этого процесса. Надо заметить, что в последнее время появились публикации, касающиеся прогноза прогрессирования гонартроза, и их результаты очень противоречивые.
Так, наблюдение за больными гонартрозом на протяжении 12 лет позволило J.S.A.G. Schouten и соавторам (1992) выделить следующие прогностические факторы прогрессирования локальных изменений в КС: повышенный ИМТ, возраст >60 лет, наличие узелков Гебердена, генерализованного ОА, а также физиологических искривлений нижних конечностей и клинически незначительных травм KC в анамнезе. По свидетельству P. Dieppe (1995; 1996), интенсивность выраженности боли в суставах на ранних стадиях ОА — единственный прогностический фактор необходимости проведения артропластики в дальнейшем. T.D. Spector и соавторы (1994) установили, что у женщин с унилатеральним гонартрозом единственным прогностическим фактором возникновения билатерального поражения на протяжении 2–5 лет, а также прогрессирования локальных рентгенологических изменений в коленных суставах является ожирение. В ходе других исследований выявлена сильная корреляционная связь между прогрессированием гонартроза по Келлгрену и Лоуренсу на протяжении 1–5 лет и клиническими признаками воспаления в KC, генерализованным ОА, наличием узелков Гебердена (Ledingham J. et al., 1992; 1995). В результате наблюдения S. Sugiyama и соавторов (2000) 172 женщин с ОА ТФО KC установлено, что единственным прогностическим фактором прогрессирования сужения РСЩ является исходный уровень проколаген ІІ С-пропептида в синовиальной жидкости. По данным ретроспективного анализа M. Sharif и соавторов (2000) установлено, что повышенный уровень СРБ в сыворотке крови является прогностическим фактором прогрессирования гонартроза на протяжении 5 лет.
С целью создания прогностической модели неблагоприятного течения ОА КС мы прежде всего разделили больных на 2 группы: тех, у кого рентгенологическая стадия увеличилась хотя бы на единицу, и таковых без прогрессирования. У больных обеих групп сравнили демографические, клинические и рентгенологические показатели выраженности суставного синдрома, что позволило выявить определенные различия (табл. 65).
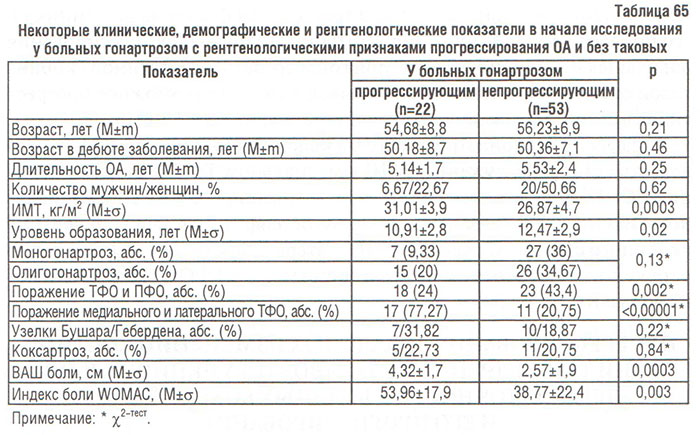
Больные с прогрессирующим гонартрозом имели достоверно больший ИМТ, ВАШ боли, индекс WOMAC, более низкий уровень образования, у них чаще отмечалось сочетанное поражение ТФО и ПФО КС, а также медиального и латерального ТФО КС.
Нами получена прогностическая модель, в которую включены следующие достоверные факторы: наличие сочетанного поражения медиального и латерального ТФО (р=0,0001), ИМТ ≥30 кг/м2 (р=0,006), ВАШ боли ≥4 (р=0,0103).
При наличии у больного гонартрозом всех 3 факторов вероятность прогрессирования локальных изменений в КТк КС по данным рентгенографии (увеличение рентгенологической стадии заболевания по Келлгрену и Лоуренсу ≥1), составила 54,57%.
Полученная модель, несмотря на значимость при использовании в рутинной клинической практике, имеет довольно низкую вероятность в плане прогнозирования. Другая модель, созданная нами, включает еще один независимый фактор — персистирование сановита по данным УЗИ. В эту модель включены такие факторы: персистирование синовита по данным УЗИ (р<0,00001), сочетанное поражение медиального и латерального ТФО (р=0,0005), ИМТ ≥30 кг/м2 (р=0,037).
Согласно этой модели вероятность прогрессирования локальных изменений в костной ткани и суставном аппарате КС у больных гонартрозом была почти вдвое выше, чем в первой — 91,19%. Соответственно изменился и прогностический алгоритм.
За 3 года наблюдения индекс WOMAC в среднем изменялся незначительно, в отдельных случаях наблюдали существенные колебания показателя в зависимости от наличия или отсутствия клинических и УЗИ-признаков синовита.
Подытожив результаты 3-летнего мониторинга, полученные с использованием собственных методик количественной оценки прогрессирования локальных изменений костной ткани у больных гонартрозом, полученных на основании тщательного анализа разных рентгенологических феноменов ОА (сужение РСЩ, остеофитоз, остеокистоз, остеосклероз) и исследования их прогрессирования, хотелось бы отметить: у больных гонартрозом сужение РСЩ в медиальном ТФО превышает таковое в латеральном ТФО, а в латеральном ПФО сужение наименьшее; в медиальном ПФО наблюдается расширение РСЩ, причиной которого является не утолщение суставного хряща, а треугольная форма надколенника и его поворот в медиальную сторону. Данные анализа прогрессирования локальных изменений КТк КС при гонартрозе по собственной скоринговой системе позволяют сделать вывод о том, что возможное прогрессирование выявлено лишь со стороны остеофитоза в ТФО (р=0,04).
У пациентов с гонартрозом боль в коленных суставах по ВАШ определяется степенью сужения РСЩ в медиальном ТФО > степени сужения РСЩ в латеральном ТФО > степени расширения РСЩ в медиальном ПФО, а также связана со степенью остеофитоза в ТФО, но не ПФО коленного сустава. Сужение РСЩ в латеральном отделе ПФО, а также остеофитоз в ПФО, остеосклероз и остеокистоз в ТФО и ПФО не влияют на боль в КС по ВАШ.
Прогрессирование локальных изменений костной ткани тазобедренных суставов и функциональной недостаточности у больных коксартрозом
и его прогнозирование
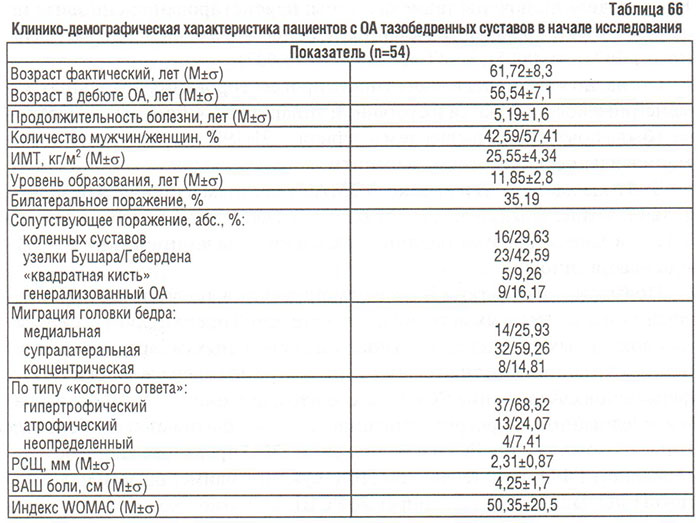
В нашем исследовании принимали участие 54 больных с одно- или двусторонним поражением тазобедренных суставов. Их клинико-демографическая характеристика приведена в табл. 66. Из всех включенных в исследование пациентов І рентгенологическую стадию по Келлгрену и Лоуренсу диагностировали у 9 (16,67%), ІІ — 24 (44,44%), ІІІ — 13 (24,07%) и ІV — 8 (14,82%) больных.
В отличие от гонартроза, для коксартроза не существует скоринговых систем оценки прогрессирования локальных изменений КТк и суставного аппарата. Обычно процесс определяют измерением РСЩ в точке наибольшего сужения в динамике на увеличенных рентгенограммах (Dieppe P., 1996; Auley G.R. et al., 2000). Это связано с тем, что для коксартроза остеофитоз имеет меньшее значение в диагностике болезни и ее прогрессировании, чем для гонартроза — приблизительно в 1/4–1/3 случаев поражение тазобедренного сустава носит атрофический характер без признаков гипертрофии костной ткани (остеофитоза, остеосклероза) (Ledingham J. et al., 1992; Dieppe P., 1996; Conroziere T. et al., 1998). В нашем исследовании атрофический тип «костного ответа» найден у 24% больных коксартрозом.
У всех больных коксартрозом мы провели обследование с измерением РСЩ в динамике (в начале исследования, потом — 1 раз в год) в наиболее суженной точке на рентгенограммах тазобедренных суставов в стандартной прямой проекции. Также нами обследовано 17 лиц (контрольная группа), сопоставимых с группой больных коксартрозом по демографическим показателям (пол, возраст, рост, ИМТ) с отсутствием жалоб со стороны опорно-двигательного аппарата.
У больных коксартрозом РСЩ в точке максимального сужения в среднем составила 1,93±0,9 мм, у здоровых лиц — 4,03±0,4 (рис. 102).
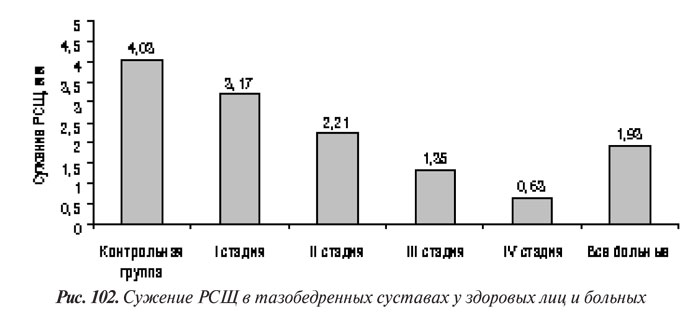
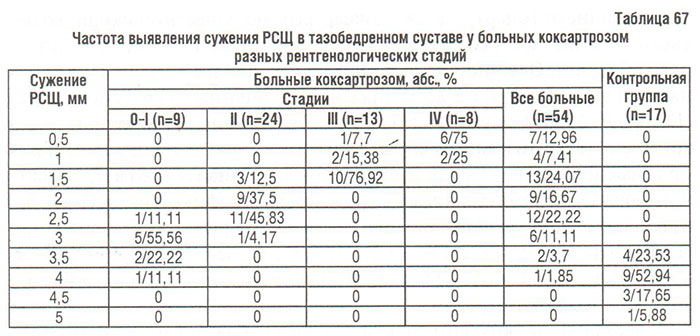
В последнее время в мировой ревматологии актуален вопрос об ограниченной информативности метода Келлргена и Лоуренса в диагностике коксартроза и определении его прогрессирования. Результаты нескольких исследований позволили их авторам рекомендовать критерий сужения РСЩ тазобедренного суставa ≤2,5 мм (Croft P. et al., 1990; Ingvarsson T. et al., 1999; 2000) или <3 мм (Maillefert J.F. et al., 2002) в качестве дополнительного критерия диагностики коксартроза. Приведенные в табл. 67 данные показывают, что наиболее вероятным диагностическим показателем при ОА тазобедренного сустава является сужение РСЩ ≤3 мм, которого мы не выявили ни у одного здорового человека из контрольной группы.
Нами не выявлено существенной связи между сужением РСЩ и фактическим возрастом больных (r=-0,21, p=0,13), продолжительностью болезни (r=0,26; p=0,06), ИМТ (r=0,05; p=0,75). Однако есть хотя и слабая, но прямая связь между продолжительностью коксартроза и сужением РСЩ. Полученные результаты можно объяснить особенностями течения болезни. J. Ledingham и соавторы (1992), P. Dieppe (1995) и J.F. Maillefert и соавторы (2002) указывают на то, что при коксартрозe можно выделить 2 варианта течения болезни — медленно прогрессирующее, когда от появления симптомов до необходимости проведения артропластики проходит много лет (иногда десятилетий), и быстро прогрессирующего, когда этот процесс происходит на протяжении 3–36 мес. Также заслуживают внимания относительно низкий ИМТ у больных коксартрозом и незначительная связь между показателем и сужением РСЩ. В отличие от гонартроза, для которого ожирение является важным фактором возникновения и прогрессирования заболевания, при поражении тазобедренных суставов ожирение не имеет значения (Dougados M. et al., 1992; Conroziere T. et al., 1998).
Корреляционная связь между сужением РСЩ и уровнем образования была умеренной (r=0,28; p=0,035). Сильная корреляционная связь была установлена между возрастом больных в дебюте заболевания и сужением РСЩ (r=-0,45; р=0,0007). У пациентов, первые симптомы заболевания которых появились в возрасте ≥60 лет (n=25), производная РСЩ составила 1,52±0,8 мм, в то время как в случае дебюта коксартроза в возрасте <60 лет — 2,28±0,8 мм (р=0,0005).
Данные дисперсионного анализа зависимости сужения РСЩ от атрибутивных показателей у больных коксартрозом подтверждают наличие значительного влияния супралатеральной миграции головки бедренной кости (р=0,001), узелкового поражения суставов кистей (р=0,036) и «костного ответа» (р=0,014) на сужение РСЩ. Так, у больных с супралатеральной миграцией головки бедра среднее сужение РСЩ составило 1,64±0,8 мм, при медиальной и концентрической — 2,39±0,7 мм (р=0,0005). При наличии у больных коксартрозом узелков Бушара и/или Гебердена среднее сужение РСЩ было 1,56±0,8 мм, при их отсутствии — 2,19±0,8 мм (р=0,004). И, наконец, при атрофическом характере ответа КТк среднее сужение РСЩ составило 1,46±0,7 мм, а при гипертрофическом — 2,07±0,9 мм (р=0,013).
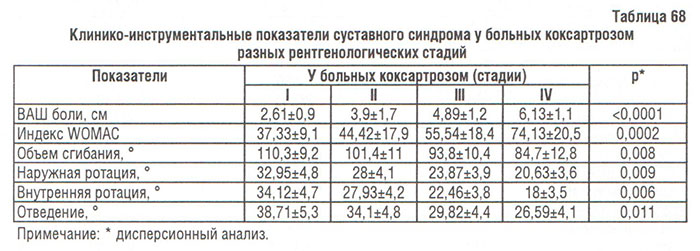
Дополнительно нами проанализирована связь между клиническими показателями суставного синдрома (ВАШ боли, индекс WOMAC, объем движений) и сужением РСЩ у больных коксартрозом (табл. 68). В результате корреляционного анализа выявлено статистически значимую связь между сужением РСЩ в тазобедренном суставе и ВАШ боли (r=-0,82, р<0,00001), индексом WOMAC (r=-0,76, р<0,00001), объемом сгибания (r=0,53, р<0,00001), внешней ротацией (r=0,49, р<0,00001), внутренней ротацией (r=0,61, р<0,00001) и отведением нижней конечности (r=0,37, р=0,006).
В ходе повторного рентгенологического обследования тазобедренных суставов, проведенного через 3 года после стартового комплексного клинико-инструментального обследования, было выявлено уменьшение среднего сужения РСЩ у больных коксартрозом — от 1,93±0,9 до 1,28± 1 мм (общее сужение РСЩ — 0,69±0,5 мм, ежегодное сужение — 0,23± 0,2 мм). Полученные результаты относительно темпов сужения РСЩ при коксартрозе согласовываются с данными E. Vignon (2003), который подытожил результаты нескольких французских исследований и установил, что ежегодное сужение РСЩ в тазобедренных суставах по данным рентгенографии у больных коксартрозом составляет 0,24 мм. Тем не менее, по свидетельству T. Conroziere и соавторов (1998), а также J.F. Maillefert и соавторов (2003), темпы сужения РСЩ тазобедренных суставов несколько выше и составляют, соответственно, 0,33±0,4 мм и 0,31± 0,5 мм у женщин и 0,3±0,5 мм у мужчин.
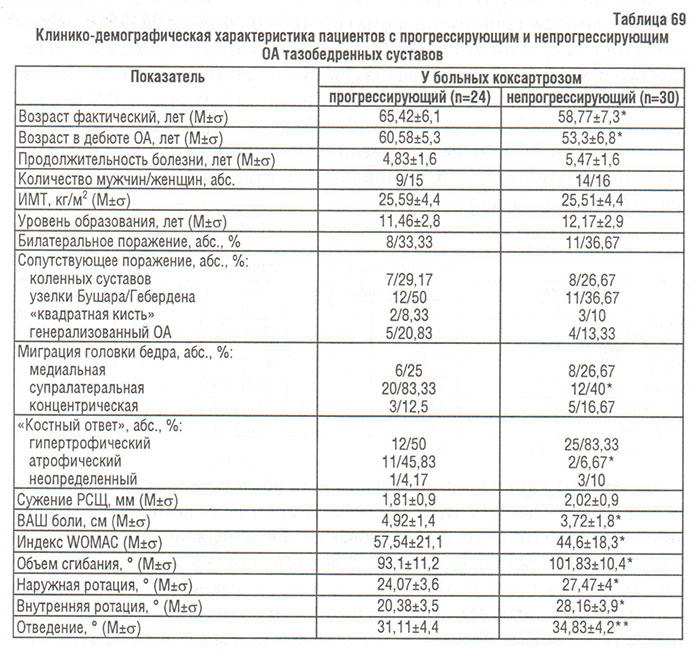
Результаты сравнения клинико-демографических и инструментальных показателей суставного синдрома у больных коксартрозом, прогрессирующим более чем на 5 мм или меньше 5 мм, продемонстрированы в табл. 69. Больные с прогрессирующим коксартрозом были старше по фактическому возрасту (р=0,004) и возрасту в дебюте болезни (p<0,00001), у них достоверно чаще диагностировали миграцию супралатерального полюса головки бедренной кости (р=0,0013), атрофический тип «костного ответа» (р=0,0008), а также более выраженную боль в тазобедренных суставах по ВАШ (р=0,005), ухудшение функционального состояния по WOMAC (р=0,01) и уменьшение объема движений в тазобедренных суставах.
Анализ данных литературы свидетельствует об очень ограниченном количестве исследований относительно прогнозирования прогрессирования коксартроза. Так, J. Ledingham и соавторы (1993) выделяют следующие прогностические факторы прогрессирования болезни: супралатеральная миграция головки бедренной кости, «атрофический» коксартроз, женский пол, дебют заболевания в преклонном возрасте. Другие авторы прогностическими факторами прогрессирования коксартроза считают сужение РСЩ в начале исследования ≤2 мм, супралатеральную миграцию головки бедренной кости, женский пол, возраст в дебюте болезни >65 лет, индекс Лекена >10 (Vignon E., 2003). И, наконец, выявлена сильная корреляционная связь между быстрым сужением РСЩ и дебютом коксартроза в преклонном возрасте, а также отсутствием остеофитов на рентгенограммах (Conroziere T. et al., 1998).
Учитывая противоречивые данные разных публикаций, нами предпринята попытка определить факторы прогрессирования локальных изменений КТк у больных коксартрозом.
Кроме стартовых демографических (возраст, фактический возраст в дебюте заболевания, пол, уровень образования), клинических (ИМТ, ВАШ, WOMAC, ОА других суставов) и инструментальных (сужение РСЩ, тип «костного ответа», тип миграции головки бедра, объем движений) показателей, мы включили в анализ еще одну переменную — среднюю скорость прогрессирования локальных изменений в тазобедренных суставах в начале исследования. С этой целью мы ретроспективно проанализировали 2–9 рентгенограмм (медиана-3) тазобедренных суставов в стандартной передне-задней проекции у каждого больного. В среднем темп прогрессирования сужения РСЩ в тазобедренных суставах, который статистически не отличался от средней скорости сужения РСЩ во время исследования (р=0,74) в анамнезе составил 0,25±0,2 мм/год.
Логистический регрессионный анализ, в котором зависимым фактором было прогрессирование локальных изменений (сужение РСЩ за 3 года ≥0,5 мм), позволил получить статистически достоверную прогностическую модель, в которой независимыми предикторами являлись такие факторы: среднее ежегодное сужение РСЩ тазобедренного сустава ≥0,4 мм в прошлом (р<0,00001), атрофический тип «костного ответа» (р<0,00001), супралатеральная миграция головки бедренной кости (р=0,0005), возраст в дебюте болезни ≥60 лет (р=0,0034).
Вероятность сужения РСЩ тазобедренного сустава за 3 года на ≥0,5 мм при наличии у больного всех 4 прогностических факторов составляет 70,52%.
Функциональное состояние по WOMAC у обследованных больных коксартрозом изменилось несущественно: показатель повысился с 50,35± 20,5 до 52,89±21,4 (р=0,46).
Прогрессирование локальных изменений костной ткани суставов кистей и функциональной недостаточности у больных с ОА суставов кистей
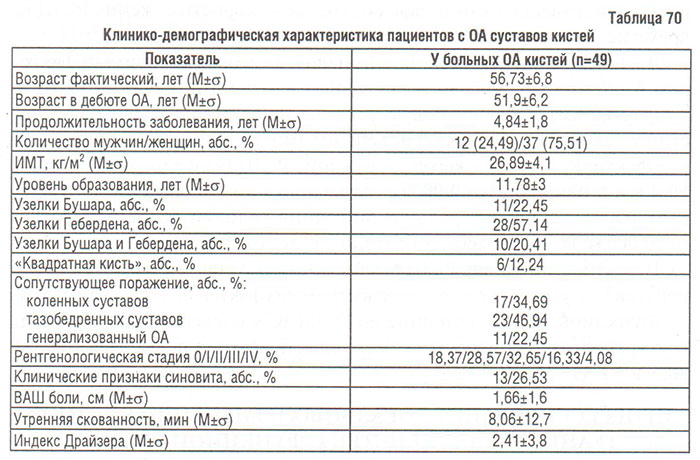
Нами обследовано 49 больных с ОА суставов кистей. Всего клинически и инструментально было обследовано 392 проксимальных межфаланговых сустава (ПМС), 392 дистальных межфаланговых сустава (ДМС) и 98 І запястно-пястных суставов. Критерием включения в исследование служило наличие узелков Бушара и/или Гебердена, симптома «квадратной» кисти (клинически). У значительно большего количества больных диагностировали поражения дистальных межфаланговых суставов (узелки Гебердена), чем проксимальных (узелки Бушара). В 20,41% случаев выявлено поражение обеих групп суставов фаланг кистей (табл. 70). Поражение І лучезапястного сустава во всех случаях было односторонним, часто в сочетании с поражением других суставов кистей в 2 (4,08%) — с узелками Бушара, в 3 (6,12%) — с узелками Гебердена, в 1 (2,04%) — с узелками Бушара и Гебердена). Поражение суставов фаланг кистей во всех случаях было симметричным. ОА суставов кистей почти втрое чаще диагностировали у женщин, чем у мужчин (табл. 70). Полученные результаты согласовываются с данными публикаций относительно распространенности ОА суставов кистей: у женщин в 4 раза чаще выявляют это заболевание (Dieppe P., 1996), поражение дистальных межфаланговых суставов диагностируют у 70%, проксимальных межфаланговых — у 35% пациентов (Swanson A.B., Swanson G., 1985). A.B. Swanson и соавторы (1985) считают, что распределение поражения суставов кистей при ОА является «зеркальным» отображением такового при РА. 20 (40,82%) пациентов не ощущали боли в суставах кистей (ВАШ=0), у 32 (65,31%) пациентов не установлено никаких функциональных нарушений (индекс Драйзера = 0).
ОА суставов кистей считается вариантом болезни с благоприятным прогнозом — медленным прогрессированием, незначительным влиянием на функциональное состояние больных и существенной диссоциацией между тяжестью морфологических изменений и клиническими проявлениями (Dieppe P., 1996; Cicuttini F.M. et al., 1998; Kessler S. et al., 2000; Haara M.M. et al., 2003; Vignon E., 2003).
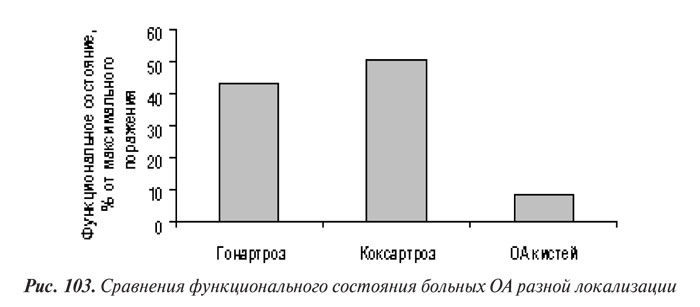
Мы сравнили степень функциональных нарушений у больных ОА КС, тазобедренных суставов и суставов кистей путем перерасчета соответствующих индексов в процентном выражении от максимально возможного поражения (WOMAC max=100, максимальный индекс Драйзера = 30). Представленные результаты этого сравнения (рис. 103) свидетельствуют о незначительном влиянии ОА суставов кистей на функциональное состояние больных в сравнении с таковым гонартроза и коксартроза.
В результате корреляционного анализа выявлено сильную связь между индексом Драйзера и ВАШ (r=0,75, р<0,00001) и продолжительностью утренней скованности (r=0,87, р<0,00001), а также слабую связь с уровнем образования (r=-0,01, р=0,94) и ИМТ (r=0,07, р=0,62). Данные дисперсионного анализа демонстрируют статистически значимое влияние синовита (клинически) на индекс Драйзера (р=0,023) и отсутствие зависимости этого показателя от рентгенологической стадии ОА кистей (р=0,09).
Интересным, на наш взгляд, вопросом было исследование связей между наличием узелков и определенными рентгенологическими признаками ОА (сужение РСЩ, остеофитоз, остеосклероз). Происхождение плотных узелковых утолщений на супралатеральных поверхностях проксимальных и дистальных межфаланговых суставов кистей неустановлено. В начале XIX в. их причиной считали костные разрастания (Charcot J.M., 1803; Nichols E.H., Richardson F.L., 1909), позже — гипертрофия суставного хряща (Fassbender H.G., 1975) и мукоидная трансформация периартикуляной фиброзной ткани, ассоциированная с пролиферацией фибробластов и формированием миксоидных кист (Begg M.W., Scott J.E., 1966). F.M. Cicuttini и соавторы (1998) не определили связь между наличием ОФ и узелков Гебердена.
Прежде всего надо отметить, что в 16 ПМС с узелками Бушара и 32 ДМС с узелками Гебердена на рентгенограммах кистей нами не выявлено признаков ОА — наоборот, сужение РСЩ было несколько большим, чем на контрольных рентгенограммах у пациентов с отсутствием жалоб со стороны опорно-двигательного аппарата и без узелков Бушара и/или Гебердена. J.C. Buckland-Wright (1994; 1995) объяснял этот феномен повышенной гидрофильностью суставного хряща на ранних стадиях ОА суставов кистей.
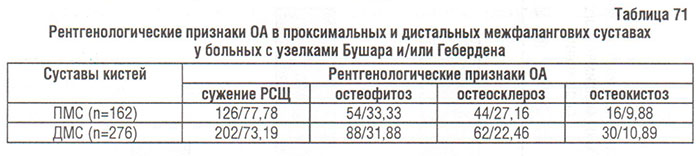
Результаты анализа рентгенограмм суставов кистей (табл. 71) свидетельствуют о том, что наиболее частым рентгенологическим признаком ОА при наличии узелков Бушара или Гебердена является сужение РСЩ; другие признаки регистрировали значительно реже — остеофитоз в 1/3, остеосклероз — в 1/4, остеокистоз — в 1/10 суставов.
Нами клинически классифицированы узелки Бушара и/или Гебердена по 4-бальной шкале от 0 (нет клинических признаков плотных узелковых утолщений) до 3 (значительно выраженные плотные узелковые утолщения с деформацией фаланг пальцев) (Cicuttini F.M. et al., 1998).
При дисперсионном анализе не установлено влияния ни на наличие любого рентгенологического признака ОА, ни рентгенологической стадии ОА на степень выраженности узелковых утолщений на ПМС и ДМС (р>0,05). Нами обнаружена полная диссоциация не только между локальными изменениями КТк в ПМС и ДМС по данным рентгенографии и клиническими проявлениями ОА (боль, нарушения функции), но и с наличием и степенью выраженности узелковых изменений.
При повторном клиническом и рентгенологическом обследовании больных через 3 года не отмечено существенных изменений, что подтверждает данные о медленном прогрессировании этой локализации ОА. Лишь у 7 из 49 (14,29%) больных нами диагностировано увеличение рентгенологической стадии болезни по Келлгрену и Лоуренсу.