Системные изменения костной ткани при остеоартрозе
Содержание
- Механизмы развития ОП
- Нарушения в системе ремоделирования КТк как причина ОП
- Влияние глюкокортикостероидов на состояние костной ткани
- Нарушения гомеостаза кальция или его дефицит
- Возрастные аспекты развития остеопенического синдрома при ОА
- Клиника и диагностика системного ОП при ОА
- Патологические переломы
- Влияние длительности заболевания ОА на минеральную плотность костной ткани
- Особенности развития ОП у больных с ОА
- Роль иммобилизации в развитии остеопенического синдрома
- Биохимические маркеры костного метаболизма
- ОП: современные подходы к профилактике и лечению
- Первичная профилактика
- Вторичная и третичная профилактика
Изучение связи между остеопорозом (ОП) и ревматическими заболеваниями суставов (РЗС) вызывает большой интерес не только у ревматологов, но и у специалистов других областей медицины. Наряду с воспалением и терапией глюкокортикостероидами, которые являются наиболее универсальными факторами, ведущими к развитию вторичного ОП при РЗС (Насонов Е.Л. и соавт., 1997, 1998), существует масса других факторов, влияющих на формирование остеопенического синдрома у данной группы больных, — иммобилизация, сопутствующая патология, особенно эндокринная, и др.
Существует целый ряд общих факторов, предрасполагающих к развитию как ОА, так и ОП, — женский пол, пожилой возраст, генетическая предрасположенность (семейная аггрегация гена коллагена типа I и др.), дефицит эстрогенов и витамина D и др. ОП диагностируют у каждой 5-й женщины в возрасте 75 лет, а ОА отмечается у 1 из 10 человек в возрасте старше 50 лет и каждого второго в возрасте старше 75 лет. Оба заболевания играют значительную роль в нарушении здоровья населения, приводя к ранней инвалидизации и снижению продолжительности жизни.
Остеопороз — системное заболевание скелета, характеризующееся снижением костной массы, нарушениями микроархитектоники костной ткани, приводящее к повышению хрупкости кости и риска переломов (Конференция по остеопорозу, г. Копенгаген, 1990).
По мнению экспертов ВОЗ, в рейтинге основных медико-социальных проблем современности (Kleerekoper M., 1985; Meunier P.J., 1997) ОП занимает третье место после заболеваний сердечно-сосудистой системы и сахарного диабета и, по данным некоторых исследователей (Родионова С.С., 1994), является самым распространенным и серьезным заболеванием обмена веществ скелета человека. В первую очередь, это обусловлено частым развитием и тяжестью его осложнений, среди которых наиболее важное значение имеют патологические переломы костей, в том числе компрессионные переломы тел позвонков, переломы дистального отдела костей предплечья, шейки бедренной кости и др. (Melton L.J., 1993; Подрушняк Е.П., 1997). Эти осложнения приводят к инвалидизации и часто к преждевременной смерти больных от сопутствующих нарушений со стороны сердечно-сосудистой и дыхательной систем (Поворознюк В.В. и соавт., 1998). Так, например, риск перелома шейки бедренной кости у женщин в возрасте 50 лет составляет 15,6% и он выше, чем риск возникновения рака молочной железы (9%) (Cummings S.R. et al., 1989). При этом риск смерти примерно одинаков (2,8%) (Melton L.J., 1993; Kanis J.A., 1994). По данным ВОЗ, почти у 25% женщин в возрасте до 65 лет уже имеются компрессионные переломы позвонков, а у 20% — переломы костей предплечья (WHO Techn Rep., 1994; Поворознюк В.В., 1997). Кроме того, у больных с ОП повышается риск нетравматических (спонтанных) переломов позвоночника и лучевой кости (соответственно 32 и 15,6%) (Kanis J.A., 1994). В последние десятилетия проблема ОП приобрела особое медико-социальное значение в связи со значительным постарением населения высокоразвитых стран мира и соответственным увеличением количества женщин, находящихся в климактерическом периоде (Cummings S.R. et al., 1989; Geusens P., Dequeker J., 1991; Франке Ю., Рунге Г., 1995).
Проблема ОП актуальна и в Украине в связи со значительным постарением населения — 13,2 млн (25,6%) составляют люди в возрасте 55 лет и старше, а также высоким процентом лиц, проживающих на радиоактивно загрязненных территориях и имеющих несбалансированный рацион питания (Поворознюк В.В. и соавт., 1995; Корж А.А. и соавт., 1997). Результаты исследований, проведенных в Институте геронтологии АМН Украины (Поворознюк В.В., 1996; 1997; 1998; Поворознюк В.В. и соавт., 1995, 1997, 1998), показали, что с 30 до 80 лет минеральная плотность компактной костной ткани (КТк) снижается у женщин на 27%, у мужчин — на 22%, а губчатой КТк — соответственно на 33 и 25%. Это приводит к значительному повышению риска переломов и реальному увеличению их числа. С учетом данных эпидемиологических и демографических исследований в Украине можно прогнозировать, что риск переломов имеется у 4,4 млн женщин и у 235 тыс. мужчин; всего 4,7 млн, или 10,7% от общей численности населения (Поворознюк В.В. и соавт., 1995).
За рубежом проблема ОП активно разрабатывается с 60-х годов ХХ в. и относится к одной из наиболее дорогостоящих медицинских программ: лечение больных с ОП и его осложнениями — процесс длительный, не всегда эффективный и требующий значительных материальных затрат (Riggs B.L., Melton L.G., 1995). Если в 1994 г. финансирование такой программы в США составило 10 млрд долларов, то в 2020 г., по подсчетам специалистов, ее стоимость может возрасти до 62 млрд. Таким образом, необходимость профилактики и лечения ОП и его осложнений не вызывает сомнений, а успешность профилактики зависит от сроков диагностики ОП.
Механизмы развития ОП
Нарушения в системе ремоделирования КТк как причина ОП
С позиций современной остеологии кость изучается как орган опорно-двигательного аппарата, форма и структура которого обусловлена функциями, для выполнения которых и приспособлена макроскопическая и микроскопическая структура (Спузяк М.И., 1988). В состав кости входят корковое (компактное) и губчатое вещество (в скелете соответственно составляющие 80 и 20% массы), содержание которых зависит от формы костей. КТк является подвижным резервом минеральных солей, причем в метаболизме КТк на долю компактного вещества приходится около 20%, а губчатого — около 80% (Kanis J.A., 1994).
Клеточными элементами КТк, принимающими участие в постоянном обмене минеральных и органических компонентов между костным матриксом и тканевой жидкостью с перицеллюлярной резорбцией костного вещества как непременным компонентом такого обмена, являются остеобласты (формируют кость), остеокласты (разрушают кость) и остеоциты (Ach P. et al., 1980; Kalender W.A., 1992).
В течение жизни человека происходит постоянное обновление кости, которое заключается в резорбции отдельных участков скелета с почти одновременным формированием новой КТк (ремоделирование). Ежегодно от 2 до 10% масcы скелета перестраивается (Canalis E., 1993), причем эта внутренняя перестройка является локальной и не изменяет геометрию или размеры костей. Она характерна для взрослого организма, тогда как растущая кость характеризуется формообразованием — ростом в длину и ширину.
Ремоделирование происходит в дискретно расположенных участках кости — так называемых единицах ремоделирования, количество которых одномоментно достигает 1 млн (Поворознюк В.В., 1997). Для резорбции 100 мк кости необходимо около 30 дней, замещение этой массы кости новой костью происходит в течение 90 дней, т.е. полный цикл ремоделирования составляет 120 дней (Корж А.А. и соавт., 1995). На тканевом уровне метаболические процессы в скелете определяются общим количеством активных единиц ремоделирования (в норме около 1 млн) и балансом ремоделирования — отношением количества резорбированной и вновь сформированной кости в каждой единице. Процесс ремоделирования КТк протекает значительно более активно в трабекулярных костях, чем в кортикальных.
У практически здоровых молодых людей скорость перестройки кости в единицах ремоделирования остается постоянной: количество КТк, резорбируемой остеокластами, практически соответствует количеству сформированной остеобластами (Eriksen E., 1986). Нарушение ремоделирования в сторону преобладания процессов резорбции над процессами формирования кости приводит к уменьшению массы и нарушению структуры КТк (Kanis J.A., 1994). Для инволютивного же ОП характерно сниженное костеобразование, в то время как при ряде заболеваний, являющихся причиной вторичных остеопений, наблюдается повышенная резорбция кости.
Таким образом, ОП рассматривается как результат нарушения процессов ремоделирования КТк и обычно возникает сначала в метаболически более активной трабекулярной ткани, где уменьшается количество и толщина пластинок и полости между ними увеличиваются вследствие перфорации трабекул. Эти изменения обусловлены нарушениям баланса между глубиной резорбированных полостей и толщиной вновь образованных пластинок.
Процесс перестройки КТк находится под контролем целого ряда системных и локальных факторов, в совокупности составляющих многократно дублируемую на разных уровнях систему взаимодействия. Факторы системного действия влияют на высвобождение и активацию факторов местного действия, которые, в свою очередь, оказывают аутокринное или паракринное влияние на КТк.
Гормональные механизмы. Большинством исследователей признается роль гормонов в контроле метаболизма и гомеостаза КТк. Известно, что гормоны анаболического действия (эстрогены, андрогены) стимулируют костеобразование, а антианаболические гормоны (например, ГКС) усиливают резорбцию кости. По мнению ряда исследователей, такие гормоны, как ПТГ, кальцитонин и витамин D, в большей степени принимают участие в регуляции кальциевого гомеостаза, чем непосредственно влияют на функциональную активность остеобластов и остеокластов.
Обнаружение на остеобластоподобных клетках специфических высокоаффинных рецепторов свидетельствует о прямом действии эстрогенов на скелет. Секреция остеобластами факторов роста и регуляция эстрогенами продукции ИЛ-6 и кальцитонина указывают на возможность паракринных влияний эстрогенов на КТк.
Важное значение имеют и опосредованные эффекты эстрогенов, в частности их влияние на гемостаз. Так, известно, что высокие дозы этих препаратов снижают активность антитромбина III, а низкие дозы (особенно трансдермальных форм) ускоряют запуск фибринолитической системы приблизительно в 8 раз. Это имеет важное значение при ряде РЗС, когда система гемостаза склонна к гиперкоагуляции. Кроме того, эстрогены снижают риск возникновения ИБС и риск рецидивов инфаркта миокарда (на 50–80%), климактерических нарушений (у 90–95% женщин), улучшают состояние мышечного тонуса, кожи, снижают вероятность возникновения гиперпластических процессов в матке и молочных железах, урогенитальных нарушений и др.
Факты, свидетельствующие о влиянии эстрогенов на костную ткань
- Более значительная потеря костной массы у женщин в постменопаузальный период.
- Выработка анаболических стероидов у женщин в постменопаузальный период уменьшается на 80% (у мужчин — на 50%), в то время как выработка кортикостероидов — только на 10%.
- Среди больных с пресенильным ОП женщин в 6–7 раз больше, чем мужчин.
- Женщины с ранней (в том числе искусственно вызванной) менопаузой теряют костную массу быстрее, чем женщины того же возраста с физиологической менопаузой.
- ОП или гипостоз — часто отмечаемые признаки гипогонадизма.
- Заместительная терапия эстрогенами привела за последние 10 лет к уменьшению постменопаузальной потери КТк и как следствие — к сокращению количества переломов (Lindsay R. et al., 1977; Lindsay R., 1983).
- Так как дефицит эстрогенов приводит к местному дисбалансу в единицах ремоделирования, то метаболические изменения, повышающие скорость ремоделирования кости, будут способствовать ускорению потери костной массы в дальнейшем (Kanis J.A., 1994).
Учитывая то, что одним из основных патогенетических механизмов развития первичного ОП является дефицит эстрогенов, к числу наиболее эффективных методов профилактики и лечения заболевания относится заместительная гормональная терапия — ЗГТ (Rizzoli R., Bonjour J.-P., 1997).
Еще в начале 20-х годов R. Cecil и B. Archer (1926) обнаружили, что в течение первых 2 лет после менопаузы в 25% случаев у женщин развиваются симптомы дегенеративного артрита. В дальнейшем было установлено, что если до 50 лет ОА (как и ОП) регистрируется у мужчин и женщин примерно с одинаковой частотой, то после 50 лет частота развития ОА (так называемый менопаузальный артрит) резко возрастает у женщин, но не у мужчин. Более того, по последним данным, ЗГТ способствует снижению частоты развития коксартроза и гонартроза, причем длительная ЗГТ влияет на прогрессирование дегенеративных изменений в суставах в большей степени, чем короткий курс ЗГТ. Все перечисленное свидетельствует о том, что дефицит эстрогенов играет важную роль в развитии не только ОП, но и ОА, ЗГТ оказывает благоприятный эффект в отношении прогрессирования обоих заболеваний (Zhang Y. et al., 1998).
К гормонам, оказывающим положительное влияние на КТк, относят андрогены, особенно у женщин сразу после наступления менопаузы, когда происходит резкое (в среднем на 80%) снижение выработки анаболических стероидов (у мужчин тех же возрастных групп в среднем на 50%). Они увеличивают минеральную массу кости, действуя непосредственно на рецепторы костных клеток, и стимулируют биосинтез белка в остеобластах, способствуют включению кальция, фосфора. Аналогичным действием на КТк обладают и гестагены. Учитывая то, что в КТк имеются рецепторы только к эстрадиолу, действие гестагенов на КТк мощнее, чем эстрогенов.
Важным свойством вышеуказанных гормонов является их влияние на кортикостероидные рецепторы в КТк, составляющее конкуренцию экзогенным кортикостероидам (см. ниже). Они также стимулируют синтез белка в остеобластах и интрамембранную оссификацию.
Влияние глюкокортикостероидов на состояние костной ткани
ГКС, являясь в настоящее время самыми мощными из имеющихся противовоспалительных препаратов, используются для лечения широкого спектра заболеваний уже более 40 лет (Axelrod L., 1993). При ОА речь идет в первую очередь о местном (внутрисуставном или периартикулярном) применении этих гормонов. Однако не следует умалять и системный эффект ГКС на организм, проявляющийся даже при локальном их использовании, и в некоторых случаях достаточно выраженный.
Скелет, являясь органом-мишенью для ГКС, поражается наиболее часто. Клинически ГКС-индуцированное нарушение обмена кальция проявляется остеопенией, ОП, асептическим некрозом костей, гиперпаратиреозом, миопатией, кальцификацией тканей и другими нарушениями.
Разобщая процессы костеобразования и резорбции, ГКС вызывают быструю потерю костной массы, прямо ингибируя формирование кости и тем самым снижая синтез главных компонентов матрикса, включая коллаген и протеогликаны (Canalis E., 1983). Нарушения гомеостаза кальция и фосфора относятся к наиболее распространенным следствиям терапии ГКС. Индуцированное последними нарушение фосфорно-кальциевого обмена связано как с прямым действием препаратов на ткани и органы, так и с расстройством функций кальций-регулирующих гормонов. Ведущим звеном в этом патологическом процессе является угнетение всасывания кальция и фосфора в кишечнике, связанное с нарушением метаболизма или физиологического действия витамина D. Снижение абсорбции кальция в кишечнике в результате ингибирования синтеза кальцийсвязывающего протеина, ответственного за активный транспорт кальция в стенку кишечника, приводит к увеличению экскреции кальция с мочой, отрицательному кальциевому балансу и повышению резорбции кости (Adashi J.D. et al., 1993).
Вторичная кальциевая недостаточность способствует развитию гиперпаратиреоза, усугубляющего деминерализацию скелета и приводящего к изменениям в органическом матриксе КТк и повышению потерь кальция и фосфора с мочой. Кроме того, ГКС снижают секрецию половых гормонов путем ингибирования секреции питуитарного гонадотропина, а также путем прямого отрицательного действия на продукцию эстрогенов и тестостерона.
По мнению S. Benvenuti, M.L. Brandi (1999), влияние ГКС на процессы дифференцировки клеток КТк зависит от используемых доз, типа ГКС, длительности применения препарата (экспозиции), специфичности. Так, показано, что после внутрисуставного введения ГКС отмечено снижение уровня пиридинолина и деоксипиридинолина (MacDonald A. et al., 1994).
Метаболизм витамина D. Метаболиты витамина D специфически связываются с рецепторами с высоким сродством в рецепторных участках и появляются в ядрах клеток тканей и органов-мишеней (кость, кишечник, железы внутренней секреции и др.) (Lawson D.E.M., Wilson P.W., 1979; Stumpf W.E. et al., 1979). Эксперименты in vivo (Mellow A.M. et al., 1978) показали, что 1,25-(ОН)2 D и 25-(ОН) D связываются с изолированными костными клетками и гомогенатами кости. Исследования с помощью меченного радиоактивной меткой витамина D (DeLuca H.F., 1979) показали, что последний локализуется в остеобластах, остеоцитах и хондроцитах. Витамин D индуцирует как минерализацию, так и резорбцию КТк, поэтому в настоящее время по своему действию на кость он рассматривается как стероидный гормон системного действия (Сорока Н.Ф., 1997). Кроме того, доказано влияние витамина D на синтез коллагена и протеогликанов (Stern P.H., 1980), что обусловливает дополнительное его действие на процесс формирования кости. Механизм действия витамина D связан также с усилением транспорта кальция и фосфора в кишечнике, реабсорбции кальция в почках, поэтому гиповитаминоз D сопровождается существенной деминерализацией КТк (DeLuca H.F., 1978, 1979). В биоптатах при этом обнаруживают широкие остеоидные прослойки вследствие недостаточного обызвествления. Хронический дефицит витамина D приводит к остеомаляции, которая может осложнять течение ОП. Прогрессирующая гипоминерализация кости ухудшает биомеханические свойства последней и повышает риск переломов. Избыток витамина D приводит к усилению резорбции КТк. Известно, что отравление витамином D сопровождается гиперкальциемией, гиперфосфатемией, гиперкальциурией и гиперфосфатурией.
Витамин D действует на резорбцию костной ткани совместно с ПТГ, причем в экспериментах на животных и в клинических наблюдениях (Stern P.H., 1980) было выявлено существование реципрокной связи между ними: 1,25-(ОН)2 D3 осуществляет контроль секреции и синтеза ПТГ (стимулом к усилению его секреции служит снижение уровня кальция в крови), а ПТГ является основным гормональным фактором, регулирующим синтез почечной 1-α-гидроксилазы. Возникновение вторичного гиперпаратиреоидизма при наличии дефицита витамина D можно объяснить этим взаимодействием.
Синтез и метаболизм витамина D в организме подвержен инволюционному воздействию за счет следующих факторов:
- Дефицит эстрогенов (за счет снижения уровня кальцитонина, обладающего способностью непрямой стимуляции образования 1,25-(ОН)2 D3, а также уровня активности 1-α-гидроксилазы в почках).
- Снижение с возрастом способности кожи к образованию витамина D (к 70 годам — более чем в 2 раза).
- Инволюционные изменения в почках (нефросклероз) приводят к снижению активности ферментных систем, принимающих участие в метаболизме витамина D.
- Уменьшение с возрастом количества рецепторов к кальцитриолу в кишечнике.
Возрастное снижение образования кальцитриола по принципу обратной связи приводит к повышению синтеза ПТГ. В свою очередь избыток последнего усиливает резорбцию костной ткани и ведет к ее рарефикации.
Таким образом, дефицит витамина D является одним из ведущих факторов в развитии практически всех форм ОП.
В последние годы появились данные о том, что витамин D принимает участие в метаболизме не только костной, но хрящевой ткани (Насонов Е.Л., 1998, 1999). Он стимулирует синтез протеогликана хондроцитами, модулирует активность металлопротеиназ, участвующих в разрушении хряща. Так например, снижение уровня 24,25- и 1,25-витамина D ассоциируется с повышением активности металлопротеиназ, а нормальный уровень снижает активность этих ферментов in vitro. Таким образом, снижение уровня витамина D может усиливать продукцию деструктивных ферментов и снижать синтез матриксных протеогликанов, что в свою очередь приводит к потере хрящевой ткани. Следует также подчеркнуть, что на ранней стадии ОА витамин D-зависимое нарушение метаболизма хряща может сопровождаться ремоделированием и утолщением субхондральной костной ткани. Это вызывает снижение амортизационной способности субхондральной кости и ускорение дегенеративных изменений в хряще.
В недавних исследованиях было показано, что у больных с гонартрозом снижение потребления витамина D c пищей и низкий уровень 25-витамина D в сыворотке крови ассоциируется с 3-кратным повышением риска прогрессирования рентгенологических изменений в коленных суставах, 3-кратным повышением риска образования ОФ и 2-кратным — потери хрящевой ткани (судя по сужению межсуставной щели) (McAlidon T.E. et al., 1996). У женщин пожилого возраста с низким уровнем 25-витамина D в сыворотке крови наблюдается 3-кратное повышение частоты развития коксартроза (судя по сужению межсуставного пространства, но не по образованию ОФ) по сравнению с женщинами, имеющими нормальный уровень витамина D (Lane N.E. et al., 1999). Более того, недавно было высказано предположение о том, что потеря костной массы и дегенеративные изменения в позвоночнике — патогенетически взаимосвязанные процессы, имеющие общую тенденцию к прогрессированию с возрастом. Полагают, что дефицит кальция и витамина D приводит к увеличению синтеза ПТГ, что в свою очередь вызывает избыточное отложение кальция в суставном хряще (Fujita T., 1997).
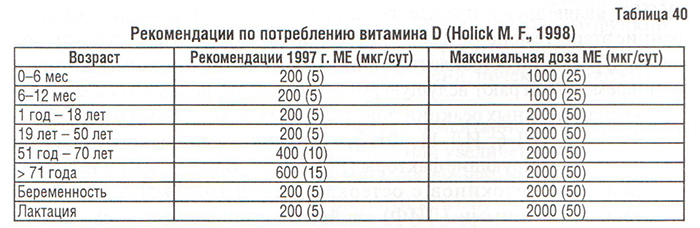
Рекомендации Американской Академии наук, касающиеся нормы адекватного потребления витамина D в различных возрастных группах (табл. 40), необходимости увеличения суточного потребления витамина D до 400 МЕ (у мужчин) и 600 МЕ (у женщин) в возрастных группах 51 год — 70 лет и старше (Holick M.F., 1998), важны для профилактики не только ОП, но и ОА.
В клинической практике в настоящее время используют преимущественно синтетические производные витамина D — кальцитриол и появившийся на рынке Украины альфакальцидол, причем последний считается наиболее перспективным препаратом этой группы (хорошо переносится больными, редки случаи гиперкальциемии и гиперкальциурии).
Кальцитриол связывается напрямую с рецепторами кишечника к витамину D, следовательно, оказывает в большей степени местное действие, способствуя абсорбции кальция в кишечнике, и не влияет значительно на синтез ПТГ.
Альфакальцидол, в отличие от кальцитриола, вначале подвергается трансформации в печени с образованием активного метаболита 1,25 (OH)2D, поэтому его эффекты на синтез ПТГ и абсорбцию кальция сопоставимы, что свидетельствует о более физиологичном его действии. Суточные дозы препарата составляют 0,25–0,5 мкг в целях профилактики ГКС-индуцированного ОП и 0,75–1 мкг при достоверно установленном ОП.
Эффективным комбинированным препаратом является кальций-D3 Никомед, содержащий в одной таблетке 500 мг элементарного кальция и 200 МЕ витамина D. Прием 1 или 2 таблеток этого препарата (в зависимости от особенностей питания, возраста и уровня физической активности) полностью покрывает рекомендуемую суточную потребность в этих веществах и абсолютно безопасен даже при длительном применении.
Иммунологические аспекты возникновения вторичного остеопенического синдрома при ОА
В настоящее время существенная роль медиаторов системы иммунитета (цитокинов и факторов роста) в локальной регуляции процессов ремоделирования КТк не вызывает сомнений. Считается, что нарушения в системе иммунных медиаторов играют важную роль в патогенезе вторичного ОП на фоне РЗС (Насонов Е.Л. и соавт., 1996, 1997).
Обладая сходными морфологическими свойствами с некоторыми линиями костномозговых стромальных клеток, остеобласты способны синтезировать цитокины (КСФ, интерлейкины). Последнее предполагает участие остеобластов как в процессе ремоделирования костной ткани, так и в миелопоэзе. Поскольку остеокласты происходят из гемопоэтических гранулоцитарно-макрофагальных колониеобразующих единиц (КОЕ), являющихся предшественниками моноцитов/макрофагов, то ранние этапы гемопоэза и остеокластогенеза регулируются похожим образом. В развитии остеокластов принимают участие цитокины, которые одновременно играют ведущую роль в регуляции локальных и системных воспалительных реакций при различных заболеваниях человека, — ИЛ-1, ИЛ-3, ИЛ-6, ИЛ-11, ФНО, гранулоцитарно-макрофагальные колониестимулирующие факторы (ГМ-КСФ). Важен также и тот факт, что действие цитокинов с остеокластогенными (ИЛ-6 и ИЛ-11) и остеобластогенными (ЛИФ) свойствами опосредуется сходными молекулярными механизмами, а именно модуляцией гликопротеина 130 (ГП-130), участвующего в передаче цитокин-опосредованного активационного сигнала клеткам-мишеням. Примечательно, что эстрогены подавляют, а 1,25 (ОН)2D3 и ПТГ усиливают экспрессию ГП-130 в клетках костного мозга. Следовательно, изменение уровня гормонов (в том числе и на фоне острофазового ответа, связанного с аутоиммунным воспалением при РЗС) может влиять на чувствительность предшественников остеокластов и остеобластов к воздействию цитокинов, участвующих в процессе ремоделирования КТк.
Подробная характеристика иммунологических аспектов развития ОП у больных ревматологического профиля приведена нами ранее в книге «Ревматоидный артрит. Диагностика и лечение» (К.: Морион, 2001).
Алиментарные причины ОП
Известны многие алиментарные факторы, являющиеся причиной ОП. Приводим наиболее важные из них.
Некоторые алиментарные факторы, вызывающие повышение риска развития ОП:
- Различные нарушения диеты
- Недостаточное поступление кальция с пищей
- Недостаточное поступление в организм витамина D
- Диета с высоким содержанием протеинов или фосфатов
- Кофеин
- Диета с высоким содержанием натрия
- Алкоголь
- Низкое поступление в организм флюоридов
- Цинга
- Дефицит витаминов В6, В12, К
- Дефицит микроэлементов (бора, цинка и др.).
Нарушения гомеостаза кальция или его дефицит
Большинство ученых в настоящее время признают, что ОП — кальцийзависимое заболевание (Nordin B.E.C., Morris H.A., 1989). Из 1–1,7 кг кальция, содержащегося в организме взрослого человека, 99% входит в состав скелета и 1% циркулирует в межклеточной жидкости (Корж А.А. и соавт., 1997). Суточная потребность в элементарном кальции составляет не менее 1100–1500 мг, что необходимо для нормального функционирования органов и систем, принимающих участие в метаболизме минералов КТк: пищеварительного тракта, печени, почек, сыворотки крови и межтканевой жидкости.
Дефицит кальция возникает из-за его алиментарной недостаточности, нарушения всасывания в кишечнике или увеличенного выделения. Важными факторами являются сниженная абсорбция кальция, низкие концентрации кальцитриола и резистентность к нему тканей-мишеней. Вследствие этого повышается резорбция КТк для выравнивания кальциевого баланса. Однако различия в потреблении кальция в разных регионах мира не могут объяснить разницу в риске переломов между популяциями. Так, переломы бедренной кости весьма часты в странах с высоким потреблением кальция, например в Скандинавских странах и Нидерландах, и наоборот, их число меньше в странах с низким потреблением кальция. Этот факт подтверждает сложный патогенез ОП, составляющей которого является кальцийзависимый механизм. Возможно, ускоренная потеря костной массы происходит вследствие повышения чувствительности КТк к ПТГ (Heaney R.P., 1970; Riggs B.L., Melton L.J., 1995) и в ряде случаев из-за пониженной чувствительностью к нему почечной α-гидроксилазы. В результате ускорения ремоделирования кости скелетный баланс становится отрицательным; кроме того, из-за недостаточного образования 1,25-(OH)2D3 снижается абсорбция кальция в кишечнике.
Изменение чувствительности к ПТГ органов-мишеней может быть обусловлено дефицитом эстрогенов, особенно в постменопаузальный период.
Возрастные аспекты развития остеопенического синдрома при ОА
В настоящее время большинство исследователей указывают на важное значение заложенной в период активного формирования скелета костной массы и достижение так называемого пика костной массы — ПКМ (в иностранной литературе — peak bone mass) (Kanis J.A., Pitt F., 1992; Kanis J.A., 1994; Broll H., 1996). Проведенный на основании данных ультразвуковой денситометрии (Поворознюк В.В., 1998) и ОФА (Дедух Н.В. и соавт., 1998) анализ структурно-функционального состояния КТк у детей и подростков Украины показал, что основное увеличение костной массы происходит у детей обоего пола в возрасте от 10 до 14 лет. ПКМ, зависящий от многих факторов, является важной детерминантой структурно-функционального состояния костной системы у людей более старших возрастных групп, развития инволюционного ОП (постменопаузального и сенильного) и его осложнений (Kroger H. et al., 1993). Согласно данным P.I. Meunier и соавторов (1997), небольшая исходная костная масса служит причиной возникновения ОП в 57% случаев. В пользу этой теории свидетельствует более редкое возникновение ОП в популяциях, имеющих бoльшую костную массу, например, у представителей негроидной расы.
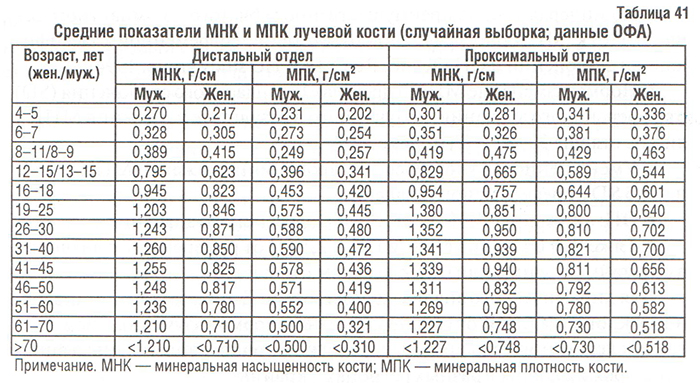
За рубежом изучение показателей минеральной насыщенности и минеральной плотности КТк у лиц различных возрастных групп в целях установления закономерностей формирования и резорбции КТк проводится уже более 20 лет (Clochon P. et al., 1988). В Украине подобные исследования проводятся в Институте геронтологии АМН Украины (Поворознюк В.В., Подрушняк Е.П. и др.), Украинском ревматологическом центре (УРЦ) (Коваленко В.Н. и др.), Институте патологии позвоночника и суставов АМН Украины (г. Харьков) (Корж А.А., Дедух Н.В. и др.). Данные, полученные при использовании однофотонной абсорбциометрии (ОФА) на базе УРЦ (Коваленко В.Н. и соавт., 1995–1997) и Института патологии позвоночника и суставов АМН Украины (г. Харьков) (Дедух Н.В. и соавт., 1998), представлены в табл. 41.
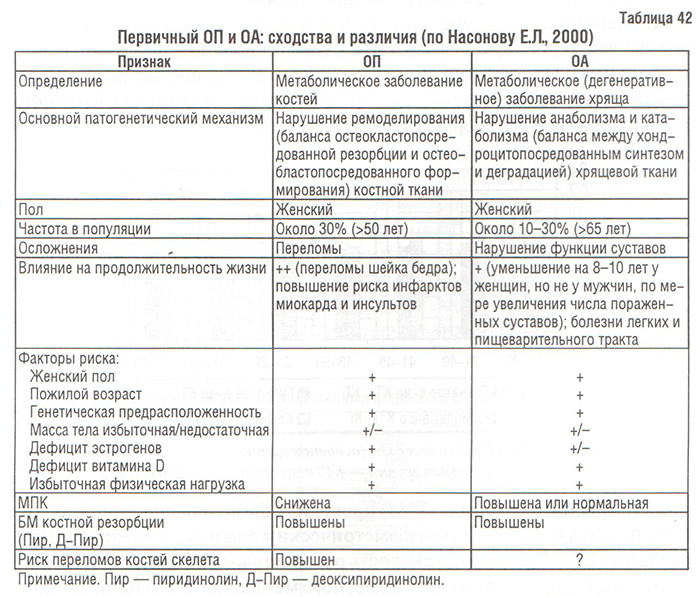
Имеющиеся на сегодняшний день литературные данные о соотношении ОП и ОА противоречивы. По данным некоторых исследователей, ОП и ОА редко встречаются у одних и тех же больных (Healey J. et al., 1985; Hordon L. et al., 1993). Соотношения между первичными ОА и ОП приведены в табл. 42.
Нами проведено обследование методом ОФА (прибор NK-364A с изотопом 125I в качестве источника ионизирующего излучения) лиц без патологии со стороны опорно-двигательного аппарата (контрольная группа) и больных с ОА (основная группа). Сканировали стандартные участки КТк дистального и проксимального отделов предплечья, отражающие соответственно минерализацию преимущественно губчатого и компактного вещества КТк. МПК определяли в соответствии с современной классификацией остеопений и ОП (Techn. Rep. of a WHO study group, 1994):
- Норма: изменение МПК в пределах 1 стандартного отклонения (SD) от референсного значения, полученного в результате измерения МПК у лиц не старше 30 лет — Т-индекс
- Уменьшение костной массы (остеопения): снижение МПК > 1 SD и < 2,5 SD от референсного значения
- ОП: снижение МПК > 2,5 SD от референсного значения
- Тяжелый ОП: снижение МПК > 2,5 SD от референсного значения в сочетании с одним или более переломами костей.
Для динамического анализа использовали Z-показатель — стандартное отклонение МПК от средневозрастных норм, полученных нами путем обследования 2500 лиц без патологии опорно-двигательного аппарата, проживающих в разных регионах Украины.
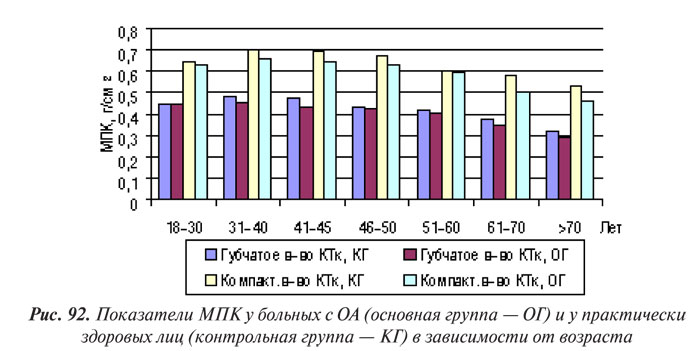
По нашим данным, уменьшение МПК во всех исследованных участках скелета коррелирует с возрастом как у лиц контрольной группы, так и у больных с ОА (рис. 92). Нами отмечено также существенное ускорение потери КТк минерального компонента у пациентов с ОА в ранний постменопаузальный период (p<0,05).
В.И. Алякна и соавторы (1988) проводили биопсию подвздошной кости с последующим гистоморфометрическим анализом недекальцинированных срезов, измеряли скорость распространения ультразвука в костях, определяли некоторые БМ костного метаболизма (кальций общий и ионизированный, неорганический фосфат, оксипролин в моче) у 89 больных с ОА и у 344 практически здоровых лиц. Выявлено, что у больных с ОА более старших возрастных групп (70 лет и старше) скорость распространения ультразвука на 4,2% меньше, чем в контроле, что служит отражением более низкой МПК у этих пациентов. Зависимость развития ОП от возраста больных с ОА и продолжительности заболевания подтверждали снижение уровня оксипролина в моче и тенденцию к снижению уровня ионизированного кальция в крови. Данные биопсии показали при ОА снижение синтеза остеоида, нарушение его минерализации и некоторое уменьшение общей поверхности резорбции кости.
Клиника и диагностика системного ОП при ОА
Системный ОП — сложное многофакторное заболевание, характеризующееся обычно медленным бессимптомным прогрессированием до момента появления переломов костей, которые в большинстве случаев являются первыми достоверными признаками ОП (Melton L.J., 1993), причем характерно возникновение спонтанных нетравматических или неадекватных тяжести травмы переломов.
Нами была проведена сопоставительная оценка состояния КТк у больных с ОА, РА и практически здоровых лиц. Были обследованы 348 пациентов с РЗС: 149 пациентов с диагнозом ОА, установленным в соответствии с критериями, предложенными ACR (1994), и 199 больных с достоверным диагнозом РА по критериям ARA (табл. 43). Больные обследованы клинически, включая определение индекса массы тела (ИМТ), и с помощью инструментальных методов. У 310 больных производили ОФА; часть больных (n=38) была обследована методом ультразвуковой денситометрии (УЗД) пяточной кости (ультразвуковой денситометр Achilles, «LUNAR»). Всем больным проводили рентгенографию позвоночника с последующим расчетом морфометрических индексов рентгенограмм — центрального индекса Barnett, Nordin (Спузяк М.И., 1988) для оценки состояния КТк. Осуществляли корреляционный анализ (r<0,35 квалифицировали как слабую связь).
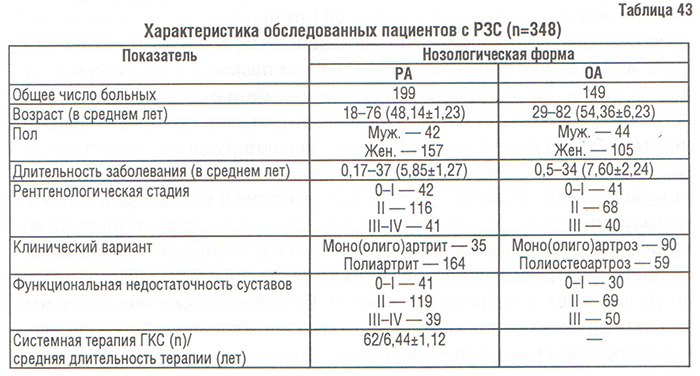
В качестве основных симптомов, сопровождающих генерализованную рарефикацию КТк при РЗС, мы выделяем анатомические изменения и болевой синдром.
Анатомические изменения в виде уменьшения роста (в среднем на 4,8±0,31 см) за время заболевания отметили 46 обследованных, или 23,11% от их общего числа, а нарушения осанки зарегистрированы у 76% больных. Уменьшение роста определяли, измерив расстояния голова — симфиз (1) и симфиз — стопы (2): уменьшение соотношения (1) к (2) более чем на 5 см свидетельствовало об ОП. При проведении корреляционного анализа обнаружена очень слабая корреляционная связь анатомических изменений с выраженностью ОП (r=0,09).
Болевой синдром, обусловленный патологическими процессами в КТк, сопровождающимися ее разрежением, отмечали у 72% больных, у которых денситометрически были выявлены нарушения МПК (табл. 44).

Болевой синдром включал:
1. Локализованную боль, которую мы разделяли на «надкостничную», характеризующуюся острым началом и достаточно четкой локализацией, «псевдорадикулярную» (типа люмбаго), малодифференцированную и имеющую тенденцию к хронизации, с ригидностью мышц (мышечным спазмом) как рефлекторной реакцией на боль и, как правило, с отсутствием компрессионной боли, и «радикулярную» — как острую, так и хроническую.
2. Генерализованную боль в позвоночнике, достигающую наибольшей интенсивности преимущественно в его «переходных» зонах (шейно-грудной, пояснично-грудной, пояснично-крестцовой).
Клинические варианты течения ОП позвонков были следующими: а) острый болевой синдром, связанный обычно со свежим компрессионным переломом позвонка или нескольких позвонков, характеризовавшийся острой интенсивной болью в пораженном отделе позвоночника, последующим острым реактивным мышечным напряжением в пораженной зоне, часто в виде опоясывающей, иррадиирующей псевдорадикулярной боли в грудной клетке, брюшной полости или бедренных костях; б) хронический: жалобы на тупую боль в спине в течение длительного времени, постоянную или периодически возникающую, сопровождающуюся вышеописанными анатомическими изменениями — уменьшением роста, деформацией позвоночника (сутулость наблюдалась у 60% из числа всех обследованных пациентов). Симптоматика у таких больных медленно нарастала при увеличении длительности заболевания, и характеризовалась чередованием периодов обострения с ремиссиями, когда болевой синдром становился менее выраженным или практически отсутствовал (Насонов Е.Л. и соавт., 1997; Подрушняк Е.П., 1997). Предполагается, что причина подобного течения ОП — ползучая деформация тел позвонков (множественные микропереломы трабекул) с прогрессирующим уменьшением высоты позвонков, деформацией позвоночника — увеличением кифоза грудного отдела (Орлова Е.В., 1980).
3. Боль в различных костях скелета (оссалгия). Ранее считалось, что поскольку в кости нет болевых рецепторов, то болевой синдром при ОП не может возникнуть без деформации тела позвонка, однако в настоящее время это предположение опровергнуто. Так, диффузная боль в костях, чувствительность при поколачивании ребер и тазовых костей и общая чувствительность к сотрясению отмечены у пациентов при условии регистрации на рентгенограммах разрежения трабекулярной структуры КТк и отсутствии деформации тел позвонков (Франке Ю., Рунге Г., 1995). Подобная боль может быть обусловлена костными микропереломами или раздражением периоста выпяченной порозной костью. Существование зависимости интенсивности боли от выраженности ОП у пациентов с РЗС подтверждено и другими исследователями (Kocian J. еt al., 1987). Данные корреляционного анализа между выраженностью боли и степенью остеопенических изменений представлены в табл. 43. Наиболее сильная позитивная коррелятивная связь отмечена между генерализованной болью в позвоночнике и остеопеническим синдромом (r=0,62).
Таким образом, анатомические изменения позвоночника и болевой синдром (локализованная боль, генерализованная боль в позвоночнике, оссалгия) являются основными клиническими проявлениями, сопровождающими генерализованную рарефикацию костной ткани при РЗС. Выявление соответствующих клинических признаков на ранней (до переломов) стадии развития остеопении у данной категории больных позволит практическому врачу целенаправленно проводить дифференциальную диагностику подобных нарушений и своевременно назначать адекватную терапию с учетом факторов риска развития спонтанных (патологических) переломов — возраста больных (особенно у женщин в ранний постменопаузальный период), системных проявлений, а также специфической терапии (системное введение ГКС и др.).
Подчеркнем, что установление диагноза ОП только на основании клинико-анамнестических данных не представляется возможным и требует подтверждения с помощью лабораторных и инструментальных методов исследования.
Наш опыт (Коваленко В.Н. и соавт., 2000) подтверждает, что в симптоматической терапии болевого синдрома при ОП хорошо себя зарекомендовали новокаиновые, тримекаиновые блокады, а также ненаркотические анальгетики. Особенно эффективен у больных ревматологического профиля трамадол, позволяющий значительно уменьшить выраженность (или устранить полностью) болевого синдрома, обусловленного как ОП, так и поражением суставов (артриты, артралгии) (Коваленко В.Н., Головков Ю.Ж., 1995).
Патологические переломы
Известно, что для клинической стадии развития ОП характерны патологические (спонтанные, хрупкостные, остеопоретические) переломы, возникающие при отсутствии травматического фактора или при несоответствии тяжести травмы (Поворознюк В.В., 1997). Имеющиеся в современной литературе данные свидетельствуют о тесной корреляции между предрасположенностью к переломам и ОП.
К параметрам, влияющим на состояние КТк и соответственно на частоту развития остеопоретических переломов, относятся: масса или МПК (в иностранной литературе — BMD (bone mineral density), г/см2)), склонность к потере равновесия, геометрия костей (особенно шейки бедренной кости), «качество» кости, микроархитектоника КТк.
Особенно важное значение для возникновения переломов в возрасте до 65 лет большинство исследователей (Войташшак Й., Швец А., 1997; Корж А.А. и соавт., 1997) придают МПК, которая независимо от других причин тесно коррелирует с прочностью кости и риском переломов. Снижение МПК в любом участке скелета на 1 SD от нормы приводит к 1,5-кратному повышению риска переломов (Cummings S.R. et al., 1989).
В проспективных и ретроспективных исследованиях установлена прямая коррелятивная связь между наличием переломов в анамнезе и/или повышенным риском возникновения перелома и низкой костной массой (Ross P.D. et al., 1987; Gardsell P. et al., 1989; Cummings S.R. et al., 1993). S.R. Cummings и соавторы (1993) показали, что у женщин, показатель МПК шейки бедренной кости которых составляет (< –2 SD), риск перелома бедра в 8,5 раза выше, чем у тех, чья МПК >2 SD. Снижение МПК шейки бедренной кости на каждое SD повышает риск перелома в 2,6 раза, что свидетельствует о достоверной связи МПК с вероятностью перелома.
В группе пациентов с РЗС, обследованных нами, переломы в анамнезе отмечены у 69 (19,8%) человек. Наибольшее количество переломов приходилось на возраст 52 года — 56 лет у женщин и около 60 лет у мужчин. Следует отметить, что в 76,7% случаев переломы происходили в результате действия лишь минимальной нагрузки, т.е. наблюдалось несоответствие тяжести травмы и силы провоцирующего момента.
Несмотря на то, что при ОП все отделы скелета имеют повышенную хрупкость, некоторые из них являются типичными местами локализации остеопоретических переломов, а именно тела нижних грудных и верхних поясничных позвонков (так называемые переходные зоны позвоночника), проксимальный конец бедренной кости (подголовчатая, межвертельная, подвертельная части), проксимальный конец плечевой и дистальный отдел лучевой кости (перелом Colles) (табл. 45).

Переломы длинных трубчатых костей, наиболее характерные для бедренной кости, возникают примерно на 15 лет позже, чем компрессионные переломы позвонков; средний возраст больного с переломом запястья — 65 лет, а с переломом бедренной кости — 80 (Delmas P.D., Woolf A.D., 1997). Это, по всей видимости, связано с тем, что в бедренной кости, в том числе и в ее шейке, содержится большее количество компактной кости, чем в теле позвонка. Преимущественная локализация переломов в обследованной нами выборке больных РЗС представлена в табл. 46.
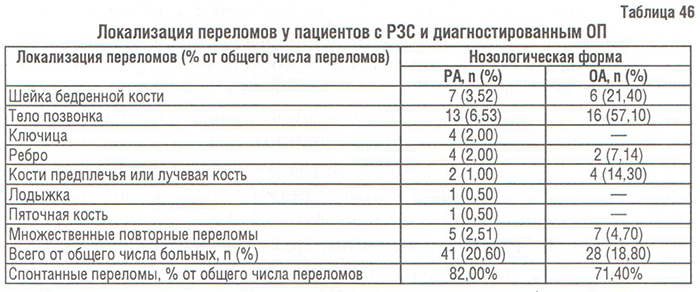
Наличие компрессионных переломов тел позвонков (включая клиновидную деформацию и линзообразную форму тел позвонков с уменьшением их высоты) подтверждалось данными центрального индекса Barnett — Nordin (Спузяк М.И., 1988). Показатели состояния КТк в данной группе больных, полученные при проведении ОФА, представлены в табл. 47.

В группе больных с переломами ИМТ составил 17,15–33 усл.ед. (в среднем — 24,91±4,36 усл. ед.) и не отличался достоверно от ИМТ в основной группе в целом (p>0,1). Мы предполагаем, что общетрофические нарушения сами по себе не служат важным прогностическим фактором патологических переломов.
Хотя снижение МПК является ведущим фактором, определяющим риск остеопоретических переломов, по данным клинических и эпидемиологических исследований риск переломов костей скелета не всегда коррелирует со снижением МПК по данным денситометрии, т.е. имеются в виду не «количественные», а «качественные» изменения в КТк (Dempster D.W., 2000).
Это хорошо иллюстрируют имеющиеся на сегодняшний день противоречивые данные, полученные разными исследователями. Так, S. Boonen и соавторы (1996) в популяционных исследованиях установили, что у больных с ОА (и даже у их кровных родственников) наблюдается снижение риска переломов костей скелета (ОR –0,33–0,64), особенно шейки бедренной кости. В то же время результаты проспективных исследований свидетельствуют о том, что у больных с ОА, несмотря на увеличение МПК, не наблюдается снижение риска «непозвоночных» переломов по сравнению с больными без ОА (Arden N.K. et al., 1999). Более того, у больных с коксартрозом наблюдается 2-кратное повышение риска переломов бедренной кости. Эти данные имеют исключительно важное значение, так как свидетельствуют о необходимости проведения мероприятий по профилактике остеопоретических переломов костей скелета не только у больных с ОА со сниженной, но и «нормальной» и даже «повышенной» МПК. Следует также принимать во внимание, что «высокая» МПК по данным денситометрии часто является артефактом, обусловленным дегенеративными изменениями у лиц пожилого возраста (ОФ, сколиоз и др.) (Belmont-Serrano M.A. et al., 1993; Jones G. et al., 1995; Nevitt M.C. et al., 1995). Наконец, у больных с ОА, как и при РА, обнаружено развитие периартикулярного ОП костей, прилегающих к пораженному суставу (Karvonen R.L. et al., 1998). Полагают, что склонность к остеопоретическим переломам при ОА, несмотря на отсутствие выраженного снижения МПК, связана с нарушением «качества» костной ткани (Stewart A., 1999) и нарушением мышечной массы, создающих предпосылки для случайных потерь равновесия (Jones G. et al., 1995; Arden N.K. et al., 1999).
Отдельно следует упомянуть деструкцию КТк в отделах, являющихся «мишенями» для асептических (бессосудистых) некрозов — омертвения участка кости вследствие недостаточного питания или полного его прекращения при сохраненной жизнедеятельности смежных зон кости, в первую очередь головок бедренных костей. Это осложнение наблюдалось нами у 7 (3,52%) больных с РА и у 2 (1,34%) с ОА. Гибель костных клеток при сохранении межуточного вещества — характерная особенность этого процесса (минеральный состав мертвой кости не изменяется). Омертвевший участок кости теряет жидкие элементы крови, лимфы и тканевой жидкости, вследствие чего на единицу массы омертвевшей кости приходится больше неорганических веществ, чем на единицу массы живой. В окружающей живой КТк усиливаются васкуляризация и резорбция кости, поэтому на рентгенограмме участок остеонекроза представляется более интенсивным, чем окружающая его КТк.
Можно предположить, что бессосудистые некрозы представляют собой крайнюю степень выраженности рарефикации КТк с потерей как минерального, так и органического ее компонента.
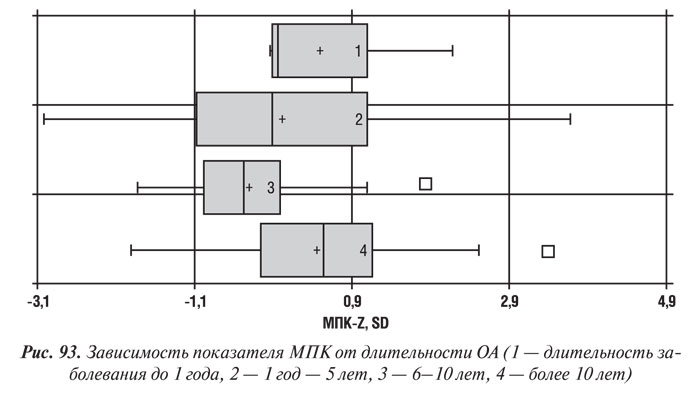
Влияние длительности заболевания ОА на минеральную плотность костной ткани
Зависимость МПК от длительности заболевания является малоизученным вопросом. По нашим данным (рис. 93), самые низкие денситометрические показатели регистрировались у болеющих ОА в течение 6–10 лет. В группе больных с длительностью ОА 1 год–5 лет и более 10 лет костная масса несколько больше, хотя в целом по группе не достигает показателей лиц того же возраста без поражения опорно-двигательного аппарата, а также лиц, болеющих меньше года. Обнаружена также тенденция к увеличению МПК у пациентов с ОА, болеющих более 10 лет. По нашему мнению, это объясняется развитием компенсаторных процессов в КТк, снижающих ее метаболизм и замедляющих темпы потери скелетом минерального компонента.
Особенности развития ОП у больных с ОА
По данным клинических исследований (Malavolta L. et al., 2000) установлено, что МПК позвоночника и шейки бедренной кости, а также масса тела больше у пациентов с ОА тазобедренного сустава по сравнению с больными с преимущественным поражением мелких суставов кистей и лицами группы контроля (без патологии опорно-двигательного аппарата). Данные анализа МПК у обследованных нами больных в зависимости от количества пораженных суставов представлены на рис. 94.
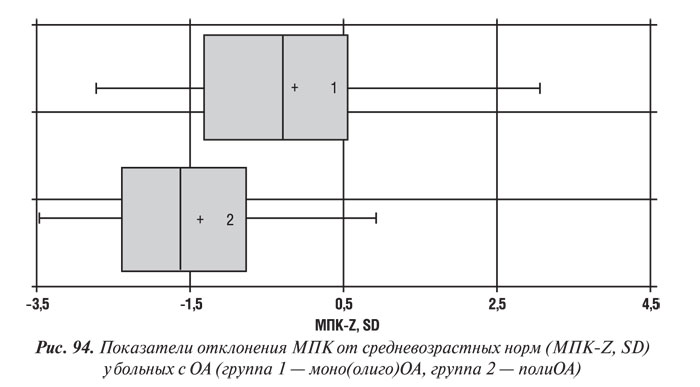
По нашим данным, лица с поражением многих суставов (полиОА) имели достоверно более низкую МПК. Показатель МПК-Z составил у больных с полиОА и олиго(моно)ОА в губчатом веществе КТк (–1,39±0,22) и (–0,15±0,29) (p<0,01), a в компактном (–1,13±0,47) и (+0,12±0,52) соответственно. Следует отметить, что у 69 (76,7%) пациентов с моно- или олигоартрозами МПК была значительно выше возрастной нормы. Вероятно, в этом случае дегенеративно-дистрофический процесс, обусловленный ОА, оказывал протекторное действие по отношению к потере костной массы.
Роль иммобилизации в развитии остеопенического синдрома
Гипокинезия, или недостаток двигательной активности, сопутствующая ОА, сопровождается развитием сердечно-сосудистых заболеваний, ожирения, атрофии скелетных мышц, остеопении и т.д. Практическим врачам часто приходится сталкиваться с крайним проявлением гипокинетического режима — клиностатической гипокинезией (при длительном пребывании больного в постели). Влияние постельного режима на КТк было отмечено еще в 50-х годах XX в. Изменение вектора земной силы тяжести относительно вертикальной оси тела ведет к уменьшению весовой нагрузки на опорно-двигательный аппарат и внутренние органы, снижению двигательной активности, в основном в крупных суставах, и динамической силовой нагрузки на скелет (локомоции, поддержание вертикальной позы и т.д.) (Оганов В.С., 1998).
Установлено, что гипокинезия сопровождается избыточной экскрецией (отрицательным балансом) кальция (Григорьева А.И. и соавт., 1994), причем величина кальциевых потерь значительно варьирует у обследованных лиц в зависимости от двигательного режима и приема антиостеопоретических препаратов. Остаются, однако, нерешенными вопросы, касающиеся топографии, степени выраженности и обратимости изменений в КТк в условиях гипокинезии.
В.С. Оганов, В.С. Шнайдер (1996), применяя метод ОФА, изучали изменения МПК диафизов большеберцовой и бедренной костей у здоровых лиц (25 лет — 44 года) в условиях постельного режима в течение 120 сут (МПК суммарно большеберцовой и малоберцовой костей определяли на границе средней и дистальной трети голени), а также в условиях антиортостатической гипокинезии (АНОГ — 6°) на протяжении 370 сут (причем одна группа испытуемых выполняла физические упражнения и принимала кислоту этидроновую в течение всего периода постельного режима, а другая — физические упражнения, начиная со 121-го дня и до периода окончания постельного режима). В последнем эксперименте, более показательном, выявлено снижение МПК в среднем на 10% у 3/4 тренирующихся в постоянном режиме, и на 5–12% — у всех обследованных в группе «отсроченной» профилактики в разные сроки эксперимента. Авторы заключили, что частота случаев изменений МПК возрастает с увеличением продолжительности экспозиции (МПК поясничных позвонков снижается в течение 120 сут на 1,7% в месяц (компьютерная количественная томография) или на 0,91% в месяц (абсорбциометрия, DEXA).
Особого внимания заслуживают данные о снижении содержания минералов в костях таза в восстановительный период после гипокинезии. Анализ БМ (14-е и 30-е сутки восстановительного периода после 120-суточной АНОГ (–5°), а также гистоморфометрических показателей биопсии (30-е сутки) гребня подвздошной кости (Оганов В.С. и соавт., 1997) позволил авторам предположить, что в этот период происходит параллельная активация процессов формирования и резорбции КТк. Следовательно, этим можно объяснить и потерю костной массы из-за относительной ригидности процессов формирования КТк.
Результаты вышеприведенных исследований согласуются с существующим в настоящее время взглядом на механизм адаптации КТк к внешней «механической среде». Установлено, что адаптивные процессы в КТк «запускаются» в первую очередь в результате деформации костного материала и лишь затем механической нагрузкой или напряжением как таковыми. Более значимым параметром являются не пиковые значения относительной деформации, а некая нижняя граница физиологической деформации (т.е. минимально эффективная деформация, при превышении которой процессы формации КТк начинают преобладать над резорбцией кости) (Burr D.B., Martin B., 1992; Оганов В.С., 1998).
Величина потерь костной массы в наиболее критических с биомеханической точки зрения регионах скелета (поясничные позвонки, проксимальный эпифиз бедра) имеет выраженную положительную связь с длительностью гипокинезии. Так, при гипокинезии до 120 сут снижение МПК у части пациентов можно было трактовать как «норму» или «остеопению» по критериям ВОЗ (1994), а при увеличении длительности гипокинезии часть обследуемых переходила в группу с ОП.
Не менее важен выявленный феномен избирательного увеличения МПК губчатой кости (тела поясничных позвонков) в условиях клинортостатической гипокинезии в результате постельного режима вследствие спинномозговой травмы (Woodard D. et al., 1988), терапии сколиоза (Hansson T.H. et al., 1985) или в условиях космического полета (Оганов В.С., Шнайдер В.С., 1996). Одной из наиболее приемлемых версий для объяснения феномена представляется гипотеза о замедлении процессов ремоделирования КТк при дефиците физической нагрузки (Оганов В.С., Шнайдер В.С., 1996) и накоплении вследствие этого высокоминерализованной фракции минерального компонента КТк (Burr D.B., Martin B., 1992).
Причины потери костной массы при гипокинезии остаются предметом дискуссий, но наиболее вероятно предположение о том, что уменьшение механической стимуляции снижает уровень эффективного «деформационного потенциала», что в итоге приводит к замедлению адаптивного ремоделирования КТк как системы (Burr D.B., Martin B., 1992). Интересно также, что у больных, длительно находившихся на постельном режиме при геми- или квадриплегии (Woodard D. et al., 1988), наблюдали уменьшение объема кости в среднем на 33% и дальнейшую стабилизацию процесса деминерализации после 25 нед, причем отмечено также общее замедление процессов резорбции и формации кости, что обозначается в литературе как «ленивая кость» (Родионова С.С., 1993).
Знание механизмов формирования «ленивой кости» необходимо для понимания патогенеза остеопенических состояний при ОА, однако неоспоримо то, что остеопения при дефиците механической нагрузки (в неосложненном варианте) обусловлена изначально торможением остеобластического гистогенеза и, возможно, имеет характер тканевой адаптации или адаптивного ремоделирования (Оганов В.С., 1998). Феномен «гиперминерализации» губчатой кости тел поясничных позвонков, наблюдаемый при гипокинезии как у здоровых людей, так и у пациентов, соблюдающих длительный постельный режим, следует считать прогностически неблагоприятным.
Приведенные данные подтверждают важную роль фактора иммобилизации в развитии остеопенических состояний при ОА.
Биохимические маркеры костного метаболизма
Совершенствование в последние годы специфических и чувствительных биохимических маркеров, отражающих общую скорость формирования и резорбции кости, значительно улучшило неинвазивную оценку костного метаболизма при различных метаболических заболеваниях кости. Как известно, биохимические маркеры разделяются на маркеры костеобразования и костной резорбции. Поскольку имеющиеся в настоящее время маркеры костного метаболизма детально описаны в современной литературе в книгах «Ревматоидный артрит. Диагностика и лечение» (под ред. Коваленко В.Н., 2001), «Остеопороз: эпидемиология, клиника, диагностика, профилактика и лечение» (под ред. Коржа Н.А. и др., 2002), кратко остановимся лишь на некоторых из них.
К наиболее перспективным маркерам костной резорбции относятся пиридинолин (Пир) и деоксипиридинолин (Д-Пир) — два неделимых пиридиновых соединения, образующиеся в результате посттрансляционной модификации молекул коллагена, присутствующие в нативном коллагене и не участвующие в его ресинтезе (Fujimoto D. et al., 1978). При РЗС эти маркеры рассматриваются как чувствительные и специфические лабораторные индикаторы не только костной резорбции, но и суставной деструкции (Greenwald R., 1996). Так, по данным экспериментальных исследований, у крыс с адъювантным артритом уже в течение первых 2 нед после индуцирования заболевания наблюдается повышение экскреции Пир с мочой, коррелирующее с клиническими признаками воспаления (Tordjman С. et al., 1994). Уровень Д-Пир в моче повышается позже и более тесно связан со снижением МПК. Примечательно, что введение ингибиторов коллагеназ ассоциируется со снижением экскреции Пир и Д-Пир (Ganu V. et al., 1994; Greenwald R., 1994).
Уровни Пир и Д-Пир в моче значительно выше у детей, чем у взрослых; характерно их повышение на 50–100% во время менопаузы (Beardsworth L.J. et al., 1990). У больных с ОП их концентрации в моче (особенно Д-Пир) коррелируют со скоростью костного метаболизма, измеренной по кинетике кальция, и данными гистоморфометрии КТк (Delmas P.D. et al., 1991).
У больных с ОА повышение экскреции с мочой Пир и Д-Пир выражено в меньшей степени, чем при РА, и слабее коррелирует с выраженностью клинических проявлений (Thompson P. et al., 1992; Astbury С. et al., 1994; MacDonald A. et al., 1994; Takahashi М. et al., 1995). He отмечено связи между тяжестью рентгенологических изменений (по шкале Kellgren — Lawrence) и уровнями этих маркеров (Thompson P. et al., 1992).
Из маркеров костеобразования следует упомянуть остеокальцин. R. Emkey и соавторы (1996) установили, что внутрисуставное введение ГКС приводит к существенному снижению концентрации остеокальцина в крови на следующий день после инъекции с последующей нормализацией в течение 2 нед (при этом клинический эффект сохраняется на протяжении 4 нед), причем существенных изменений концентрации Пир в моче не отмечено. Эти результаты свидетельствуют о том, что внутрисуставное введение ГКС вызывает только транзиторную ингибицию образования КТк и не влияет на процесс резорбции.
Определение лабораторных маркеров костного метаболизма повышает эффективность инструментальной оценки риска развития ОП (в первую очередь денситометрических методов). Повторные измерения костных маркеров в период лечения могут улучшать качество мониторинга больных с ОП.
Практические рекомендации по использованию биохимических маркеров костного метаболизма для диагностики остеопенических состояний:
- Сывороточный остеокальцин и костный изофермент щелочной фосфатазы в настоящее время являются наиболее чувствительными маркерами костеобразования при ОП.
- Наиболее чувствительные маркеры костной резорбции — экскреция с мочой пиридинолиновых соединений и терминальных фрагментов коллагена I типа с помощью иммунологического анализа или жидкостной хроматографии под высоким давлением.
- Перед заключением о клинической значимости исследуемых лабораторных маркеров костного метаболизма необходима тщательная оценка каждой клинической ситуации и особенностей проводимой терапии.
- Повышенный уровень костного метаболизма ассоциирован с высокой скоростью потери костной массы. Лабораторные маркеры костеобразования и/или резорбции могут помочь выявить среди больных с ОА лиц с исходно нормальной костной массой, имеющих повышенный риск развития остеопении (особенно на ранних стадиях развития заболевания).
- Повышенные уровни маркеров костной резорбции ассоциированы с повышенным риском переломов позвоночника и бедренной кости, независимо от костной массы. Таким образом, комбинированная оценка костной массы и маркеров костного метаболизма полезна для выбора «мишеней» для лечения больных с ОА с наиболее высоким риском переломов (с учетом других факторов риска).
- Костные маркеры удобны для оценки эффективности антирезорбтивной терапии для быстрого (3–6 мес) скрининга больных, не реагирующих на лечение, так как действие терапии на костный метаболизм обнаруживается раньше, чем изменения костной массы, выявленные денситометрически.
Главным недостатком используемых в настоящее время лабораторных методик является то, что они отражают лишь состояние метаболизма КТк на момент исследования, не давая непосредственной информации о количественных параметрах состояния КТк (т.е. на основании использования только показателей лабораторных исследований невозможно установить диагноз ОП или остеопении). Следует также отметить, что в отличие от некоторых метаболических заболеваний костей (болезнь Педжета, почечная остеодистрофия), которые характеризуются значительным изменением костного метаболизма, при ОП на фоне ОА часто незначительные изменения скорости ремоделирования кости за продолжительный период могут приводить к существенной потере костной массы. Это может объяснять тот факт, что данные, полученные с помощью стандартных маркеров (активность общей щелочной фосфатазы, уровень гидроксипролина и др.), у больных с ОП в большинстве временных промежутков находятся в пределах нормы. Следовательно, необходима разработка более специфических и чувствительных маркеров костного метаболизма. Так, требования к идеальному маркеру костной резорбции следующие: это должен быть продукт деградации компонентов костного матрикса, который не обнаруживается в других тканях, не усваивается организмом в процессе нового формирования кости, а также не подвергается влиянию эндокринных факторов при определении его уровня в крови.
ОП: современные подходы к профилактике и лечению
В имеющихся на сегодняшний день данных о причинах, закономерностях и механизмах формирования остеопенических состояний заложен мощный потенциал, позволяющий создавать методы и определять тактику лечения на различных этапах развития остеопений.
Стратегия профилактики и лечения ОП основана на различных подходах и «мишенях». Общей целью стратегии должно быть уменьшение числа случаев переломов в популяции или улучшение прогноза для лиц, уже перенесших перелом (популяционный подход к профилактике и лечению). Примером удачного популяционного подхода к профилактике может служить вакцинация при ряде инфекционных заболеваний (оспе, полиомиелите и т.д.). К сожалению, эффективный популяционный подход к антиостеопоретическим мероприятиям в настоящее время не разработан. Другой подход — индивидуальный, направленный на пациентов, относящихся к какой-либо группе риска (первичная профилактика), имеющих низкую костную массу, но еще не перенесших перелом (вторичная профилактика) либо уже перенесших его (третичная профилактика или лечение).
Первичная профилактика
Первичную профилактику можно применять на всех этапах жизни. Она должна базироваться на выявлении групп риска развития ОП и переломов с использованием некоторых методов скрининга (определение факторов риска с последующим проведением денситометрии с помощью имеющихся методик или БМ костеобразования и/или резорбции). Следует подчеркнуть, что уровень костного метаболизма может быть «независимым» фактором риска потери костной массы.
Учитывая то, что подавляющее большинство переломов возникает у лиц старших возрастных групп, одной из методик снижения индивидуального риска переломов на протяжении жизни в популяции является в первую очередь повышение костной массы в более раннем возрасте в целях влияния на долговременный прогноз. Для достижения эффекта применение подобных мер должно быть длительным и удовлетворяющим требованию о соотношении риск/безопасность в пользу безопасности. К сожалению, большинство исследований риска/безопасности антиостеопоретических мероприятий, проведенных к настоящему времени, являются не проспективными рандомизированными контролируемыми, а обсервационными, что снижает их ценность относительно долговременного прогнозирования. Практически отсутствуют работы, в которых оценивалась бы роль комплекса факторов, как позитивных, так и негативных, влияющих на костную систему индивидуума, а также освещалась бы экономическая сторона вопроса, в первую очередь соотношение реальной стоимости программ первичной профилактики ОП и потенциальной выгоды от нее в будущем (снижение риска переломов, нетрудоспособности и инвалидизации). Несомненно то, что положительное влияние могут оказать изменение стиля жизни, в частности, отказ от курения и злоупотребления алкоголем, регулярные занятия физкультурой, включение в диету продуктов, богатых кальцием, витаминами, коррекция дисгормональных нарушений.
Вторичная и третичная профилактика
Вторичная профилактика основана на выявлении «доклинических» случаев, т.е. пациентов с низкой костной массой или «независимым» риском переломов. Тактика определения аналогична таковой для первичной профилактики. Третичная профилактика подразумевает в первую очередь настороженность врачей первого звена, ревматологов, ортопедов-травматологов и смежных специалистов в отношении риска повторных переломов у лиц с низкой костной массой.
Предупреждение падений — обязательная часть профилактических мероприятий, так как при повышенной ломкости скелета любое падение может осложниться переломом. Пути профилактики падений активно разрабатываются: это физические упражнения, тренировка вестибулярного аппарата, модуляция внешних и внутренних факторов риска, а в некоторых случаях применение специальных «протекторов» для бедра, различных корсетов и т.д.
При лечении больного с ОП врач должен постараться прежде всего снизить скорость потери скелетом минерального компонента и стабилизировать костную массу. Антиостеопоретическая терапия должна быть эффективной в течение длительного периода, иметь минимум побочных эффектов. В зависимости от характера клинической манифестации и выраженности ОП врач может выбрать оптимальную тактику профилактики и лечения или сочетание того и другого.
Большое внимание врачи-ревматологи должны уделять взаимодействию антиостеопоретических препаратов с наиболее часто используемыми в лечении ОА и ОП средствами — НПВП и ГКС.
Терапия остеопений и ОП должна базироваться на следующих принципах:
- Этиологический (лечение основного заболевания, на фоне которого возникла остеопения или ОП);
- Патогенетический (медикаментозная терапия ОП);
- Симптоматический (в первую очередь уменьшение выраженности болевого синдрома);
- Дополнительные методы — диета, физиотерапевтические процедуры, лечебная физкультура, массаж, бальнеотерапия.
В настоящее время для патогенетически обоснованных профилактики и лечения ОП используют две основные группы препаратов: стимулирующие костеобразование и ингибирующие резорбцию кости (антирезорбенты).
Группы препаратов, применяемых в лечении ГКС-индуцированного ОП
1. Препараты, стимулирующие костеобразование
- Фториды (натрия фторид, монофлуорофосфат)
- Анаболические стероиды
- Оссеин-гидроксиапатитный комплекс
- Пептид (1–34) ПТГ
- Простагландин Е2
- Соматотропный гормон
2. Препараты, ингибирующие резорбцию кости (антирезорбенты)
- Кальций
- Витамин D и его активные метаболиты
- Тиазидные диуретики
- Оссеин-гидроксиапатитный комплекс
- Кальцитонин
- Бисфосфонаты (кислота этидроновая, клодроновая, памидроновая, алендроновая, тилудроновая)
- Анаболические стероиды (нандролон, станозолол, оксандролон и др.)
- ЗГТ (эстрогены, прогестагены, комбинированные препараты и др.)
3. Комбинированная терапия
4. Экспериментальные препараты (антагонисты интегрина, ингибиторы протонного насоса, амилин).
«Идеальным» можно считать препарат, отвечающий следующим требованиям:
- повышает МПК различных участков скелета независимо от возраста больных (как мужчин, так и женщин);
- снижает риск развития и частоту переломов костей скелета (в первую очередь шейки бедренной кости и компрессионных переломов тел позвонков);
- не нарушает нормальной структуры костей;
- не вызывает серьезных побочных явлений;
- хорошо переносится больными;
- имеет удобный способ применения и дозирования;
- экономически выгоден;
- хорошо комбинируется с другими лекарственными препаратами;
- позитивно влияет на сопутствующую патологию (атеросклероз и др.).
На наш взгляд, стандартная оценка эффективности каждого антиостеопоретического препарата у больного ревматологического профиля (на фоне комплексной терапии с помощью НПВП, базисных средств, ГКС и др.) должна включать:
- эффективность препарата в устранении болевого синдрома (характеризовалась динамикой болевого синдрома, выражаемого болевым индексом);
- эффективность препарата в восстановлении функционального статуса больных (динамика показателей суставного индекса, Стэнфордской анкеты состояния здоровья, индексов кистевой силы, скорости прохождения 15 м);
- вероятность возникновения новых переломов (выражаемая в %);
- вероятность возникновения побочных эффектов с анализом их влияния на органы и системы, показаниями для прекращения лечения (%), а также негативным влиянием на стандартные схемы терапии РЗС.
Универсальным подходом к профилактике ОП является восстановление нарушенного кальциевого баланса в сторону повышения всасывания в кишечнике и уменьшения выведения из организма. Диета с повышенным содержанием кальция — необходимый компонент комплексного лечения. Источниками кальция являются молочные продукты (особенно твердый сыр, содержащий от 600 до 1000 мг кальция на 100 г продукта, а также плавленый сыр, в меньшей степени творог, молоко, сметана), миндаль, лесные орехи, грецкие орехи и т.д.
Наряду с диетой при наличии факторов риска развития ОП необходим дополнительный прием препаратов кальция, которые смогут компенсировать его дефицит. У больных с диагностированным ОП суточные дозы кальция, принимаемого дополнительно к пище, должны составлять 1500–2000 мг; для профилактики остеопении у больных, принимавших ГКС, — 1000–1500 мг, причем дозы могут варьировать в зависимости от ряда факторов.
Наиболее часто применяют следующие препараты кальция (табл. 48).

Эффективность кальциевых препаратов зависит от их биоусвояемости (самая низкая — у хлорида и глюконата кальция, выше — у карбоната и фосфата, наиболее высокая — лактата и цитрата кальция).
Поскольку в ночное время потеря минеральных компонентов костью ускорена (циркадное ускорение резорбтивных процессов в кости — см. выше), целесообразно принимать препараты кальция вечером, что предотвратит этот процесс во второй половине ночи.
Необходимо помнить, что при повышенном потреблении кальция имеется определенный риск развития мочекаменной болезни, коррелирующий с повышением дозы препарата (особенно при использовании доз выше 2000 мг/сут). Практическим врачам следует рекомендовать таким пациентам увеличить прием жидкости (1,2–1,5 л/сут).
Усвоению кальция способствуют лактоза, лимонная кислота, белковый рацион, фосфор, магний. Ухудшают усвоение кальция избыточное количество жиров, недостаток белков, голодание, строгое вегетарианство, недостаток магния, фосфора и витамина D, продукты с высоким содержанием щавелевой кислоты (щавель, ревень, шпинат, свекла, шоколад), заболевания органов пищеварения (гастрит, энтерит, колит, пептическая язва), заболевания поджелудочной железы (сахарный диабет, панкреатит), желчного пузыря и желчных путей, щитовидной железы (зоб, тиреотоксикоз, тиреоидит), гинекологические заболевания, особенно связанные с эндокринной патологией, некоторые препараты, особенно ГКС (преднизолон, бетаметазон, дексаметазон), левотироксин и др.
Важную роль в оптимизации ведения больных с ОА с угрозой развития или уже развившимся остеопеническим синдромом играют витамины.
Роль витаминов в оптимизации терапии больных с ОА и остеопеническим синдромом
1. Кислота аскорбиновая:
- усиливает синтез ГКС в организме;
- уменьшает проницаемость сосудов;
- участвует в образовании основного вещества соединительной ткани;
- повышает антигиалуронидазную активность.
2. Биофлавоноиды:
- уплотняют и уменьшают проницаемость стенки сосудов, в частности капилляров.
3. Витамин В5:
- участвует в клеточных окислительно-восстановительных реакциях;
- улучшает капиллярный кровоток;
- нормализует секреторную функцию желудка.
4. Токоферол (витамин Е):
- предотвращает окисление ненасыщенных жирных кислот в липидах;
- влияет на биосинтез ферментов;
- улучшает функции сосудистой и нервной систем.
5. Витамин D и его активные метаболиты.
Одним из направлений медикаментозного лечения вторичного ОП является применение ЗГТ (эстрогены, гестагены или комбинированные препараты, а также андрогены.
Среди эстрогенов наиболее часто используют эстрадиол либо в виде этерифицированных форм (эстрадиола валерат 20 мг, эстрадиола сульфат), либо конъюгированных форм, содержащих эстрон, в организме превращающийся в эстрадиол и эстриол (эффект сохраняется еще 1–2 мес). В монотерапии используются и трансдермальные формы, например, эстрадиол в форме 0,1% геля, разовая доза которого составляет 0,05 или 0,1, что соответствует 1 мг эстрадиола (суточная доза), хорошо действующий, как и другие трансдермальные эстрогены, у женщин с гиперкоагуляционным синдромом, часто возникающим на фоне РА, системной красной волчанки и других ревматических заболеваний.
Кроме того, ЗГТ эстрогенами позволяет снизить риск возникновения ИБС и рецидивов инфаркта миокарда (на 50–80%), климактерических нарушений (у 90–95% женщин), улучшить состояние мышечного тонуса, кожи, снизить вероятность гиперпластических процессов в матке и молочных железах, урогенитальных нарушений и др.
При назначении ЗГТ эстрогенами необходимо помнить о противопоказаниях: указания в анамнезе на рак молочной железы, рак эндометрия, острые заболевания печени, порфирии, эстрогензависимые опухоли. Следует помнить, что повышение уровня триглицеридов крови является противопоказанием к пероральному применению препаратов ЗГТ, даже на фоне нормального уровня холестерина; тогда как для трансдермальной — его нет. К ЗГТ-нейтральным состояниям относятся: варикозное расширение вен, флебиты, эпилепсия, бронхиальная астма, системные заболевания соединительной ткани, системный атеросклероз.
Специалисты считают, что все женщины в постменопаузальный период, принимающие ГКС, должны получать ЗГТ при отсутствии противопоказаний, причем курс (для профилактики и лечения ОП) составляет 5–7 лет.
Мужчинам с недостаточностью гонад (а в ряде случаев и женщинам) может быть рекомендована ЗГТ андрогенами — тестостерона пропионат 100–200 мг внутримышечно 1 раз в 2–4 нед, тестостерона энантат и др.
К препаратам гестагенов относятся: Цикло-прогинова (1–2 мг эстрадиола валерата + 0,5 мг норгестрела), Климонорм (2 мг эстрадиола валерата + 0,15 мг левоноргестрела), производные 17-ОН прогестерона — Климен (2 мг эстрадиола валерата + 1 мг ципротерона ацетата), Дивина (1–2 мг эстрадиола ацетата + 10 мг медроксипрогестерона), имплантационные лекарственные формы и др. Противопоказанием к назначению препаратов данной группы является менингиома.
Денситометрический контроль при проведении ЗГТ необходим каждые 3 мес.
Кальцитонин (эндогенный полипептид, содержащий 32 аминокислотных остатка) также обладает способностью предупреждать потерю костной массы, а в высоких дозах повышает содержание минеральных веществ в скелете. Антирезорбтивный эффект препарата обусловлен специфическим связыванием с рецепторами для кальцитонина, экспрессируемыми на остеокластах. Однако характер влияния кальцитонина на трабекулярную и кортикальную кость, а также его эффективность при остеопенических состояниях у пациентов с РЗС (особенно на фоне приема ГКС) в отечественной и зарубежной литературе до последнего времени были малоизучены.
В клинической практике в настоящее время используются четыре вида кальцитонина: природный свиной кальцитонин, синтетические кальцитонины человека, угря и лосося. Последний нашел широкое применение в Украине в различных областях медицины, в том числе и в ревматологии.
Достаточно высокая эффективность в лечении ОП кальцитонина лосося (торговое название препарата, зарегистрированного в Украине, — Миакальцик®) в сочетании с препаратами кальция, витаминами группы D и диетой у пациентов с РЗС и ОП подтверждена результатами исследований, проведенных на базе Института кардиологии им. Н.Д. Стражеско, УРЦ (Коваленко В.Н. и соавт., 1995–1999).
В последнее время получила широкое распространение концепция о том, что в основе действия антиостеопоретических препаратов лежит их способность положительно влиять не только на «количество», но и на «качество» костной ткани (Dempster D.W., 2000). Эта концепция оказалась особенно важной для объяснения механизмов действия и высокой клинической эффективности синтетического кальцитонина лосося, который относится к числу наиболее эффективных средств, антиостеопоретическая активность которого связана с подавлением костной резорбции (Насонов Е.Л. и соавт., 1997; Беневоленская Л.И., 1999). Более того, наряду с высокой антиостеопоретической активностью кальцитонин лосося обладает широким спектром системных эффектов, что делает его применение особенно целесообразным при ОП, развивающемся на фоне других заболеваний, в том числе ОА.
Особый интерес представляет изучение анальгетических эффектов кальцитонина. Иммунореактивный кальцитонин был идентифицирован в головном мозге, спиномозговой жидкости, гипофизе и др. Меченный 125I кальцитонин необратимо связывается со специфическими рецепторами, локализующимися в различных структурах мозга, особенно в тех зонах гипоталамуса, которые участвуют в передаче и восприятии болевых ощущений. Примечательно, что центральные анальгетические эффекты кальцитонина напоминают таковые опиоидных анальгетиков. Анальгетический потенциал кальцитонина может быть связан со стимуляцией высвобождения эндогенного агониста опиоидных рецепторов — β-эндорфина. На фоне интраназального введения кальцитонина наблюдается повышение уровня β-эндорфина в плазме крови. Анальгетическое действие кальцитонина было продемонстрировано в клинических исследованиях при болевом синдроме различной этиологии, в том числе ревматической. Более того, данные недавно проведенных экспериментальных исследований свидетельствуют о том, что при экспериментальном ОА собак in vivo кальцитонин эффективно подавляет продукцию Пир и Д-Пир, тормозит прогрессирование морфологических изменений в хряще и стимулирует синтез протеогликана in vitro (Framington P. et al., 1989; Manicourt D.H. et al., 1999). Эти данные свидетельствуют не только о симптоматическом, но и, возможно, модифицирующем влиянии миакальцика на прогрессирование ОА. Таким образом, кальцитонин — препарат выбора при ОП, сопровождающемся болью различного генеза, в том числе остеоартритической, а также при сочетании ОП и ОА. Кроме того, способность кальцитонина ингибировать желудочную секрецию, на наш взгляд, важное свойство препарата в отношении предотвращения и лечения «медикаментозных» язв (НПВП-гастропатия) у больных с ОА, длительно принимающих НПВП.
К одному из перспективных классов антиостеопоретических лекарственных препаратов относятся бисфосфонаты — аналоги неорганического пирофосфата, эндогенного регулятора костного метаболизма (Chesnut C.H., III, 1995; Fleish H., 1995). Препараты данной группы стабильны, не метаболизируются, но обладают высокой аффинностью к фосфату кальция и, следовательно, к кости, что способствует их быстрому выведению из крови и дает возможность включаться в кальцифицированные ткани (Lin J.H. et al., 1991). Распределение их в кости негомогенное: они откладываются преимущественно в местах формирования новой кости.
В фармакотерапии ОП, связанного с воспалением, бисфосфонатам отводится значительная роль как препаратам, имеющим определенные противовоспалительные свойства, подавляющим развитие суставного воспаления и деструкцию суставов в различных экспериментальных моделях артритов (Barbier A. et al., 1986). Для некоторых бисфосфонатов показано, что они способны снижать синтез ФНО-α, ИЛ-1, ИЛ-6 (Matsuda Т. et al., 1991; Passeri G. et al., 1994; Richards P.J. et al., 1996).
Доказаны эффективность и безопасность этих препаратов в поддержании костной массы скелета и предотвращении переломов (Black D.M. et al., 1996). Однако различная структура препаратов этого класса обусловливает их разные антирезорбтивные возможности и соотношение эффективности и токсичности (Fleish H., 1995). Установлено, что они обладают ингибирующим свойством в отношении остеокластопосредованной резорбции кости. Однако сильное и длительное ингибирование резорбции, достигающееся долговременным применением бисфосфонатов, может вызвать нарушение формирования кости и, следовательно, повышение ее хрупкости, повысить риск переломов (что доказано для этидроната и др.). К более мощным бисфосфонатам со значительным терапевтическим промежутком между дозами, ингибирующими резорбцию кости, и дозами, потенциально способными нарушать минерализацию, относятся кислота алендроновая и тилудроновая — бисфосфонаты новой генерации, обладающие сильной ингибирующей активностью на резорбцию кости и положительным действием на формирование кости (Chesnut C.H., III, 1995; Liberman U.A. et al., 1995).
Наиболее распространенные побочные эффекты бисфосфонатов — незначительные нарушения функции пищеварительного тракта, которые не требуют отмены препаратов. Кроме того, при применении бисфосфонатов первого поколения могут отмечаться явления дефектов минерализации и остеомаляция, т.е. нарушения качества кости.
В отношении взаимодействия антиостеопоретических препаратов с наиболее часто используемыми в лечении НПВП доказано отсутствие взаимовлияния на фармакокинетику бисфосфонатов и НПВП, за исключением индометацина. Очень важным является оптимальный выбор НПВП. На базе УРЦ (Шуба Н.М. та співавт., 2000) было проведено сравнительное исследование эффективности и безопасности применения в комплексной терапии пациентов с РЗС (ОА и РА) НПВП — мелоксикама (Мовалис), диклофенака натрия и флурбипрофена, которое включало обследование больных методом ОФА в начале лечения и через 12 мес.
Из данных табл. 49 видно, что у больных, получавших мелоксикам или диклофенак, скорость потери КТк минерального компонента (как в губчатом, так и компактном веществе) была меньше, чем у получавших флурбипрофен, что коррелировало с более выраженной положительной динамикой лабораторных показателей активности воспалительного процесса.

Таким образом, протекторное действие НПВП на костную ткань при РЗС можно объяснить снижением ими активности воспалительного процесса, сопровождающегося аутоиммунным компонентом (Насонов Е.Л. и соавт., 1997; Шуба Н.М. та співавт., 2000), т. е. их противовоспалительные свойства могут дополнительно обеспечивать протекторное действие в отношении деминерализации КТк, особенно на фоне применения ГКС.
В заключение сформулируем некоторые принципы профилактических и лечебных мероприятий при вторичном ОП у больных с ОА:
1. Снижение негативного влияния таких факторов развития ОП, как курение, злоупотребление алкоголем, малоподвижный образ жизни, длительное голодание и др.
2. Своевременное лечение сопутствующей патологии, влияющей на костный метаболизм, — гипертиреоидизма, гиперпаратиреоидизма и т.д.
3. Сохранение и поддержание положительного кальциевого баланса (диета, дополнительный прием препаратов кальция в сочетании с витамином D или его активными метаболитами).
4. При отсутствии противопоказаний назначение женщинам в постменопаузальный период препаратов ЗГТ; в пременопаузальный период при нарушениях овариально-менструального цикла — контроль 17β-эстрадиола и при необходимости — ЗГТ (в том числе андрогены с учетом гормонального профиля).
5. У мужчин — контроль уровня тестостерона; при необходимости — ЗГТ андрогенами.
6. Проведение контрольного денситометрического обследования больных с ОА, относящихся к группе риска.
7. Ежегодный денситометрический контроль показателей МНК и МПК у больных с ОА и выявленным ОП.
Мониторинг антиостеопоретической терапии ОП:
роль биохимических маркеров костного метаболизма
R. Civitelly и соавторы (1988) отметили значительное повышение МПК позвоночника после терапии кальцитонином в течение 1 года, тогда как у лиц с низким костным метаболизмом аналогичная терапия не приводила к повышению костной массы. Авторы предположили, что больные с повышенным костным метаболизмом, характеризующимся повышением уровней остеокальцина и гидроксипролина, имеют более благоприятный прогноз относительно терапии кальцитонином. Бoльшая эффективность других антирезорбтивных средств (эстрогензамещающая терапия, бисфосфонаты) в терапии ОП у пациентов с повышенным метаболизмом костной ткани остается недоказанной.
Антирезорбтивные агенты типа эстрогензамещающей терапии и бисфосфонатов индуцируют значительное, но обратимое снижение маркеров резорбции и формирования кости. Опираясь на точное измерение костной массы денситометрическим методом и ожидаемый уровень изменения костной массы, индуцированного антирезорбтивной терапией, лишь через 2 года можно определить, эффективно ли лечение у конкретного больного, т.е. возрастает ли достоверно костная масса. Во многих исследованиях показана значительная корреляция между ранними изменениями (после 3–6 мес) показателей маркеров формирования и/или резорбции кости и отсроченными (более 1 года — 2 лет) изменениями костной массы по данным денситометрических исследований (в лучевой кости, позвоночнике или во всем скелете) у больных, леченных антирезорбтивными агентами типа эстрогенов или бисфосфонатов (Delmas P.D. et al., 1985, 1991; Delmas P.D., Woolf A.D., 1997). Коэффициенты корреляции в этих исследованиях постоянно составляли около –0,5. Это позволило авторам предположить, что на индивидуальном уровне маркеры костного метаболизма могут быть неспособны точно предсказывать отсроченные изменения костной массы. Однако, вводя лимитирующий порог достоверного снижения костных маркеров после 6 мес (30–60% или более в зависимости от точности измерения), можно идентифицировать сразу после начала лечения большинство больных, которые будут реагировать повышением костной массы спустя 2 года с очень низкой частотой ложноположительных и ложноотрицательных результатов (Delmas P.D., Woolf A.D., 1997).
Таким образом, повторные измерения чувствительных и специфических маркеров (формирования или резорбции) через 3–6 мес после начала антиостеопоретической терапии, вероятно, приемлемы для мониторинга больных ревматологического профиля с ОП, тем более что эффекты подобного лечения могут быть обнаружены еще до появления изменений МПК.
Приведенные выше данные литературы, а также результаты наших исследований подтверждают актуальность проблемы остеопенического синдрома при ОА. Сочетанное развитие ОП и ОА существенно ухудшает качество жизни, и, вероятно, продолжительность жизни больных, особенно пожилого и старческого возраста.
Подчеркнем важность проведения денситометрического и биохимического мониторинга состояния КТк для оценки динамики, а также эффективности применяемых препаратов, в первую очередь НПВП.