Лихорадочные состояния
Содержание
- Семиотика лихорадочных состояний
- 7.2. Лихорадочные состояния бактериальной, вирусной, грибковой и протозойной этиологии
- Бактериальные инфекции
- Вирусные инфекции
- Грибковые инфекции
- Протозойные заболевания
- 7.3. Лихорадочные состояния при нарушениях иммунитета
- 7.4. Лихорадка неинфекционного (иммунного) генеза
Семиотика лихорадочных состояний
В практике семейный врач, врач поликлиники и стационара нередко общается с пациентами, у которых наиболее ярким, первым и основным проявлением болезни является повышение температуры тела. У одних она не превышает 38 °C, и тогда говорят о субфебрилитете, у других — выше 38 °C, что определяют как лихорадочное состояние.
Причина лихорадки — это прежде всего инфекция (бактерии, вирусы, грибы, простейшие и гельминты). Инфекционные болезни сформировались в серьезнейшую проблему конца XX–начала XXI в. Это связано с тем, что практически ни одно инфекционное заболевание (за исключением натуральной оспы, да и то существует вероятность ее вспышек в будущем) не удалось полностью ликвидировать. Более того, как только «сникает» одна инфекция, ее нишу стремится занять другая. За последние 20 лет описано не менее 30 новых инфекционных заболеваний.
Реже причиной лихорадки являются иммунодефицитные состояния (но и они в итоге обусловливают развитие инфекций), собственно иммунные заболевания (но и на них легко наслаивается инфекция). Все остальные причины (перегревание, некрозы асептические, лихорадка центрального генеза, паранеопластическая гипертермия, злокачественная гипертермия) — достаточно редки.
Здоровый организм живет в гармонии со своей микробной флорой, которая даже защищает его от инвазии патогенной флоры. Микроорганизмы колонизируют те или иные части тела по феномену так называемого тканевого тропизма, часть органов оказывается практически свободной от флоры, часть — заселена. Флора дыхательных путей не равнозначна флоре кишечника. Да и в разных отделах кишечника персистирует разная флора. Более того, даже на одном и том же отрезке кишки флора в ее просвете не идентична персистирующей на стенках. Колонизирующую флору разделяют на резидентную, постоянную и быстро самовосстанавливающуюся при ее нарушении, и транзиторную, которая может селиться на организме-хозяине на часы — недели, но не способна к постоянному самовосстановлению.
На флору влияет масса факторов: личная гигиена, санитарные условия, диета, загрязнение воздуха, состояния здоровья индивидуума. Например, лактобациллы — типичные комменсалы кишечника людей, потребляющих большое количество молочных продуктов, a Haemophilus influenzae колонизируют трахеобронхиальное дерево пациентов с хроническими неспецифическими заболеваниями легких. Патогены обычно являются только частью нормальной флоры. Микроогранизмы из «нормальной флоры» могут вызывать заболевания, особенно у людей с нарушенными естественными барьерами (кожа и слизистая оболочка).
Защитные механизмы хозяина включают наряду с естественными барьерами неспецифический иммунный ответ (фагоцитоз) и специфический иммунный ответ (антитела).
Кожа — эффективнейший естественный барьер. Ни одна из бактерий не способна проникнуть через неизмененную кожу. Через неповрежденную кожу способны проникать папилломавирус, этиологический агент бородавок, и некоторые паразиты. Слизистая оболочка покрыта антимикробным секретом, содержащим лизоцим, разрушающий стенку бактерий, и секреторные иммуноглобины J и А, блокирующие прикрепление микроорганизмов к клеткам хозяина.
В дыхательном тракте ингалированные микроорганизмы должны вначале преодолеть фильтрующую систему в верхних дыхательных путях и трахеобронхиальном дереве. В трахее и бронхах микроорганизмы выносятся наружу движением ресничек эпителия. Этому же способствует и кашель. Если микроорганизм достигает альвеол, в дело вступают альвеолярные макрофаги и тканевые гистиоциты. Воспаление вызывает приток нейтрофильных гранулоцитов и моноцитов, которые максимально активны в присутствии опсонинов. Все эти защитные барьеры могут быть преодолены при большом количестве микроорганизмов или при нарушении самих барьеров: курение, загрязнение воздуха, искусственная вентиляция легких.
В желудочно-кишечном тракте серьезными барьерами являются секреция соляной кислоты в желудке1 и антимикробные свойства желчи, секрета тонкой кишки и сока поджелудочной железы. Перистальтика и естественное слущивание эпителия способствуют удалению микроорганизмов. Нарушение перистальтики (беладонна, опиумные алкалоиды) снижает клиренс. Важную защитную роль играет флора толстой кишки. Ее подавление антибиотиками ведет к росту патогенных микроорганизмов или к суперинфекции обычными комменсалами (Candida albicans).
Мочеполовой тракт мужчины «защищен» длиной уретры, у женщин — кислой средой влагалища. Гипертоническая среда почечных пирамидок и белок (гликопротеин) Тамм — Хорсфалля, продуцируемый в больших количествах почками, экскретируемый в мочу и связывающий бактерии, препятствует размножению флоры.
Неспецифический иммунный ответ складывается из продукции цитокинов, что является прелюдией специфического иммунного ответа, и воспаления.
Специфический иммунный ответ — из образования антител по отношению к специфическим микробным антигенам.
Патогенез инфекции — способность к токсинообразованию, факторы вирулентности, способность флоры связываться со структурами хозяина и формировать устойчивость к антимикробным агентам.
Манифестация инфекции:
- Гематологическая манифестация
- Лейкоцитоз
- Анемия
- Диссеминированное внутрисосудистое свертывание
- Тромбоцитопения.
Повышение температуры тела издревле рассматривалось как признак болезни. Лихорадка — эволюционно выработанная реакция центрального аппарата терморегуляции на обширную группу «чрезвычайных» патогенных внешних и внутренних раздражителей (пирогенов), вызывающих в больном организме перестройку регулирования температуры тела на новый, более высокий уровень (П.Н. Веселкин). То есть лихорадка — это неспецифическая реакция на пирогены бактериальной и небактериальной природы.
Пирогены подразделяют на эндогенные (воздействующие на центр терморегуляции) и экзогенные. Эндогенные пирогены (ЭП) содержатся в основном в цитоплазме продуцирующих их клеток (макрофаги, нейтрофильные гранулоциты, моноциты, в небольшой степени — эозинофильные гранулоциты). ЭП вырабатывают фиксированные макрофаги (купферовские клетки — эндотелиальные макрофаги печени, альвеолярные и тканевые макрофаги, макрофаги серозных оболочек), так и моноциты, как свободно циркулирующие, так и в очаге воспаления. Эндогенные пирогены — это интерферон, интерлейкин (ИЛ)-1, фактор некроза опухолей и др. Макрофаги продуцируют в 20–40 раз больше ЭП, чем нейтрофильные гранулоциты. Нейтрофильные гранулоциты начинают продуцировать ЭП раньше, чем моноциты и макрофаги, но выделяют пирогены не длительно. Лимфоциты и фибробласты эндопирогены не продуцируют. Способностью к выработке ЭП обладают некоторые опухоли: гепатома, гипернефрома, лимфома Ходжкина, миело-, моноцито- и макрофагальные лейкозы. Причем ЭП продуцируются опухолевыми клетками без их стимуляции внешними факторами. Поэтому гипертермический эффект некоторых опухолей сравнительно длительное время может быть единственным проявлением неоплазмы.
Экзогенные пирогены — вещества, сами по себе не раздражающие центр терморегуляции, но стимулирующие выработку эндопирогенов. К экзопирогенам относят бактерии, вирусы, патогенные грибы, антигены, сенсибилизированные Т-лимфоциты, запускающие выработку растворимых медиаторов-лимфокинов, а также иммунные комплексы «антиген — антитело», некоторые полисахариды и лекарственные вещества, кристаллы, эндотоксины (липополисахариды), стероидные гормоны, желчные кислоты, латекс.
Латентный период от попадания в организм экзопирогенов до развития температурной реакции вариабелен: от нескольких минут для эндотоксинов до длительного при бактериальной инфекции.
В норме температура в подмышечной впадине составляет 36,6–36,8 °C (не поднимаясь выше 37,1 °C), во рту — 37,8 °C, в прямой кишке — 38,2 °C. Наиболее стабильная температура в прямой кишке. Температура тела регулируется передней долей гипоталамуса. Существуют некоторые колебания показателей температуры тела. Они зависят от возраста (у младенцев температура неустойчива; у стариков — ниже, чем у здоровых людей молодого возраста), от времени суток (ранним утром ниже, днем — выше), физической активности, окружающей температуры, влажности среды, одежды, от физиологического состояния (овуляция). В нормальных условиях амплитуда циркадного ритма составляет 0,6 °C. Температура повышается при курении, при обильной жирной еде (особенно со спиртным). Многие препараты (салицилаты, НПВП, преднизолон, хинин и др.) могут выступать как антипиретики.
В организме существуют следующие источники тепла:
1. Синтез АТФ.
2. Различные процессы биосинтеза.
3. Мышечная работа.
Возникающие на холоде озноб, дрожь способствуют выработке тепла за счет интенсивных частых мышечных сокращений, как и сопутствующее этому сужение сосудов кожи с перераспределением крови. Вот почему попытки внешнего согревания людей, длительное время находившихся на холоде, могут привести к неблагоприятным результатам: устранение спазма периферических сосудов ведет к быстрому притоку холодной крови к внутренним органам и нарушению их функционирования. Согревание целесообразно проводить путем внутривенного введения теплых растворов и антиагрегантов, промывания теплой жидкостью желудка и кишечника.
Повышение температуры тела предотвращается расширением периферических сосудов и потовыделением. В естественных условиях температура тела в течение суток колеблется не более чем на 1 °C. Если эти суточные колебания больше, то даже не выходящие за пределы 37 °C расценивают как скрытый субфебриллитет, чаще всего такая температура обусловлена центральными расстройствами у невропатов или пациентов с туберкулезной интоксикацией.
При неконтролируемом и достаточно длительном повышении температуры тела возможен тепловой удар, проявляющийся бледностью, рвотой, затем потерей сознания. Нарушения микроциркуляции в сосудах мозга могут быть при этом необратимыми.
Злокачественная гипертермия является достаточно редким а/д состоянием, манифестирующим после наркоза, особенно галотанового.
При работе врача с пациентом с лихорадкой необходимо прежде всего выяснить наличие критических, угрожающих состояний. К ним относятся злокачественная упорная гипертермия, расстройства сознания, судороги, повышение внутричерепного давления, сердечная и дыхательная недостаточность, нарушение микроциркуляции, расстройства функций печени и/или почек, сахарный диабет, надпочечниковая недостаточность. Если положение пациента критическое, то немедленно начинают посиндромную терапию, а генез лихорадки расшифровывают параллельно с вмешательством или даже чуть позже.
Нет ни одного рутинного лабораторного теста для обследования пациента с лихорадкой. Применение лабораторных исследований целиком определяется клинической картиной.
При расшифровке гипертермического состояния особое место принадлежит анамнезу. Необходим детальнейший расспрос о времени возникновения повышенной температуры тела, предшествующих факторах (профессия больного, сексуальные контакты, семейный анамнез, пищевые привычки, типы отдыха, выезды в другие климатические зоны, укусы насекомых или животных, травмы, заболевания). Большое значение для диагноза имеет динамика температурной кривой. Лихорадка может быть постоянной, либо ремитирующей с повышением температуры тела во 2-й половине дня или к вечеру и возвращением к нормальной в течение ночи. Повышению температуры тела может предшествовать озноб, а затем профузный пот. Такая температура наиболее характерна для бактериальных инфекций или болезни Стилла. Необходимо четко описать реакцию лихорадки на жаропонижающие, анальгетики, противовоспалительные препараты. Обязателен опрос о функции важнейших систем и органов, сведения о предшествующих обследованиях и последовавших за этим врачебных заключений. Желательно получение подлинников ранее выполненных исследований (анализов крови, рентгено- и эхоГ, т. д.), а не их описаний, поскольку сложные в диагностическом плане больные, как правило, уже достаточно долго лечились, что существенно изменяет клиническую и лабораторно-инструментальную картину. Лихорадка не существует «сама по себе». Требуется тщательный поиск всех сопутствующих симптомов. Подробнейший клинический осмотр больного лежит в основе диагноза, определяет направление лабораторных исследований, всю ДД-работу. Внимательнейшим образом необходимо оценить состояние глазного дна (артериит, нарушения микроциркуляции), височных артерий, придаточных пазух носа и ротоглоточного кольца, щитовидной железы, мочевых путей, придатков матки, предстательной железы, поскольку заболевания этих регионов могут протекать клинически бессимптомно и сопровождаться лихорадочной реакцией (табл. 7.1.1).
Таблица 7.1.1
Наиболее вероятные состояния при сочетании гипертермии с той или иной симптоматикой
| Лихорадка + местная симптоматика | Вероятное состояние |
| Тошнота, ригидность затылочных мышц | Менингит, абсцесс мозга, энцефалит, васкулит мозга, синусит, риккетсиоз, микоплазменная пневмония |
| Ангина | Тонзиллофарингит, эпиглотит, инфекционный мононуклеоз, дифтерия, пара/ретрофарингеальный абсцесс |
| Кашель, одышка, боль в груди | Пневмония, плеврит, эмболия легочных сосудов, абсцесс легкого, разрыв пищевода |
| Боль в правом верхнем квадранте живота | Холецистит, субдиафрзгмальный/абсцесс печени, правосторонняя нижнедолевая пневмония |
| Боль внизу живота | Аппендицит, воспалительные заболевания органов малого таза, дивертикулит |
| Боль в спине | Пиелонефрит, спондилит, ретроперитонеальный абсцесс |
| Диарея | Бактериальный, псевдомембранозный или амебный колит, мезентериальная ишемия, дивертикулит |
| Локальная боль в костях или суставах, дефигурация суставов | Остеомиелит, гнойный артрит, РА, синдром Рейтера |
Важно оценить, где появилось повышение температуры тела: в амбулаторных условиях или в стационаре. В последнем случае надо подумать о ятрогенных факторах (катетеры, зонды, внутрибольничная инфекция).
Наряду с инфекционными болезнями лихорадка свойственна многим другим заболеваниям. Повреждение терморегулирующей зоны в области гипоталамуса, безусловно, будет сопровождаться высокой общей температурой.
Лихорадка при эндокринологических расстройствах типична для гипертиреоза, обусловленного подострым тиреоидитом. При тиреотоксических кризах температура может повышаться до 40 °C. Повышение температуры тела свойственно острому гиперпаратиреоидизму и сочетается с очень выраженной гиперкальциемией. Быстрое снижение дозы кортикостероидов, получаемой пациентом длительное время, может сопровождаться аддисоновым кризом с повышением температуры тела. Другие стероиды (прогестерон) сами по себе действуют пирогенно. Резкое повышение температуры тела характерно при феохромоцитомных кризах, для которых очень типична одновременная гипергликемия. Лихорадку с общей симптоматикой в виде потливости, вялости, слабости, похудания без отчетливых локальных симптомов отмечают при туберкулезе, эндокардите, остеомиелите и спондилите у детей, лиц старшего возраста и наркоманов, при пневмонии у лиц старческого возраста и алкоголиков, внутрибрюшинных абсцессах, флебите тазовых вен, пиелонефрите. Тромбозы, флебиты и тромбоэмболии длительное время могут протекать без существенных клинических изменений, только с таким неспецифическим симптомом, как лихорадка. В этих случаях необходимо выяснить длительность инфузионной терапии, место установления внутривенных катетеров. Необходимо исключить сепсис, бактеремию.
Высокая и/или длительная лихорадка свойственна малярии, пситтакозу и орнитозу, бруцеллезу, лептоспирозу, а также цитомегаловирусной инфекции, СПИДу в 1 и 4А стадии, микозам. Установление диагноза основывается на результатах посевов крови, бактериоскопии, иммунологических проб, ультразвуковых-, КТ- и ЯМР-исследований.
Рецидивирующие эмболии легочных сосудов у лиц старческого возраста могут протекать с выраженной лихорадочной реакцией при минимальной респираторной и рентгенологической симптоматике. Определяющими для диагноза являются данные перфузионной и вентиляционной сцинтиграмм.
Повышение температуры тела и боль в животе у лиц старческого возраста отмечают при тромбозах, молодого — при васкулите, болезни Крона. В последнем случае только данные колоноскопии позволяют установить правильный диагноз.
Периодическая болезнь (средиземноморская семейная лихорадка) протекает со значительным повышением температуры тела и болью в животе. В последующем может присоединяться суставной, церебральный синдром, спленомегалия. Национальность больного и семейный анамнез имеют большое значение при установлении диагноза.
Цирроз печени, гранулематозный гепатит, болезнь Уиппла также могут сопровождаться температурной реакцией.
Лихорадка неинфекционного генеза свойственна прежде всего опухолям, особенно лимфомам, раку бронхов (лихорадка может быть обусловлена как самой опухолью, так и обструкцией бронха с развитием пневмонии), почек, поджелудочной железы, миксоме сердца (для нее типичны синкопальные состояния, изменчивая аускультативная картина, наличие эфелид, особенно периорально), метастазам в молочной железе, в легкое или в печень.
При некоторых опухолях лихорадка может предшествовать появлению опухолевого узла, что исключает ее генез как ответ на распад опухоли. Такую лихорадку чаще отмечают при опухолях лимфоретикулярной, моноцитарно-макрофагально-фагоцитарной системе. Рецидивирующую лихорадку часто выявляют у больных с лимфомами и лейкозами. У 19% больных с лимфогранулемами достаточно типичная температурная кривая. При лимфогранулематозе и неходжкинской лимфоме выделяют A-тип, при котором отсутствует общая симптоматика, и В-тип, при котором определяют такую общую симптоматику, как ночное потовыделение и/или неинфекционная лихорадка в 38 °C и/или уменьшение массы тела > 10% за 6 мес. Методы неинвазивной интраскопии, биопсия ЛУ и костного мозга занимают первое место по информативности результатов при диагностике относительно опухолей как причины лихорадки.
Среди иммунопатологических состояний лихорадочные реакции свойственны ревматической полимиалгии (патогномоничных симптомов нет), ревматизму, системным вариантам РА (достаточно типична сыпь в утренние часы на фоне повышения температуры тела), СКВ (наличие антинуклеарного фактора и антител к нативной ДНК). Сюда же с известными оговорками можно отнести и медикаментозную лихорадку аллергического характера. Эфемерность кожной сыпи при этом состоянии затрудняет диагностику.
Повышение температуры тела у госпитализированных больных, особенно после пребывания в стационаре в течение 2 нед и более, дает основание исключить медикаментозную лихорадку и внутри- госпитальную инфекцию, осложнения катетеризации, венопункций, интубаций, реакцию на имплантанты или их инфицирование.
В современных условиях особое значение приобретает медикаментозная лихорадка как одно из проявлений лекарственной болезни. Она составляет 1–2% всех случаев лихорадки неясного генеза. Наиболее часто развивается при применении амфотерицина, антигистаминных препаратов, метилдопы, блеомицина, пенициллина, фенинтоина, прокаинамида, хинидина, салицилатов, сульфаниламидов. Выделяют (А. Кудрин) следующие типы медикаментозной лихорадки.
- Воздействие лекарств на звенья терморегуляции.
1А. Стимуляция центра терморегуляции. Отмечают при применении фенаминов, производных кокаина.
1Б. Воздействие на периферические звенья терморегуляции: усиление темпа метаболизма (гормоны щитовидной железы), сокращение периферических сосудов (норадреналин), уменьшение потовыделения.
- Лихорадка развивается в момент введения или вскоре после завершения введения препарата (блеомицин, амфотерицин В). Механизм неясен, но не исключена прямая стимуляция этими препаратами гранулоцитов периферической крови с высвобождением эндогенных пирогенов.
- Фармакологическое действие препарата, вызывающее гибель микроорганизмов и тканевую деструкцию. Отмечают при введении антибиотиков и других антибактериальных препаратов с массовой гибелью возбудителей и освобождением эндотоксинов, играющих роль пирогенов. Типичный пример — реакция Герксгеймера при лечении пациентов с сифилисом и аналогичное состояние — с менингококковой инфекции. Тканевую деструкцию отмечают при лечении при опухолях, при этом из разрушающихся опухолевых клеток освобождаются пирогены.
- Идиосинкразия отдельных больных к лекарственным средствам, обусловленная генетическими дефектами обмена. Известна как лихорадка с гемолитической анемией и гемоглобинурией при лечении больных малярией хинином и примахином (основа — дефицит глюкозо-6-фосфат дегидрогеназы). Этот же механизм лихорадки не исключен в случаях злокачественной гипертермии после применения миорелаксантов и общих анестетиков.
- Повышенная индивидуальная чувствительность больного к лекарственному средству как проявление общей аллергической реакции. Образуется комплекс антиген — антитело, где антиген — лекарственный препарат или его метаболит самостоятельно или в сочетании с белками крови. Продукты распада комплекса стимулируют выработку макрофагами ЭП и их освобождение. Медикаментозная лихорадка иммунного генеза обычно появляется на 7–10-й день лечения и позже. При повторном применении препаратов лихорадка появляется раньше.
Диагностика медикаментозной лихорадки представляет большие трудности. Нередко лихорадку рассматривают только в связи с инфекцией и продолжают лечение, применяя новые антибиотики или меняя дозы прежних препаратов. Нет ни одного лабораторного метода ее подтверждения или исключения. Помогает наличие других симптомов лекарственной болезни. Характерно снижение температуры тела после отмены препарата. Обычно температура снижается через 48 ч, но в отдельных случаях может сохраняться на протяжении несколько суток. Диагноз «медикаментозная лихорадка» считают несомненным, если ее рецидив отмечают после повторного введения препарата. Но специально идти на подобное подтверждение диагноза нецелесообразно, так как не исключена анафилактическая реакция.
В практике врача известна так называемая лихорадка неясного генеза — заболевание длительностью не менее 3 нед с повышением температуры тела выше 38,3 °C и в течение 1 нед неустановленным диагнозом. Это определение приемлемо для ретроспективных и проспективных клинических исследований. Но в практической деятельности врач должен быть более мобильным. Целесообразно сократить допустимые сроки до 2 нед лихорадки и 1 нед неустановленной причины при условиях самостоятельных визитов пациента к врачу, трех подряд визитов врача к больному домой (к больному с лихорадкой неясного генеза, особенно ребенку, приходят ежедневно) или 3 дней лихорадки в стационаре. Для детей критерии более строгие. Лихорадкой неясного генеза в педиатрии считают 4 и более эпизодов повышения температуры тела в течение 2 нед, которые не могут быть объяснены анамнезом и физикальным обследованием. Другое определение основано на повышении температуры тела в течение 8 и более дней при тех же условиях (анамнез и физикальное обследование). Эти критерии позволяют отсеять ряд лихорадочных вирусных состояний. Так, самозавершающиеся лихорадочные заболевания составляют 15–20% всех вызовов на дом у терапевтов и 25–60% — у педиатров. В период эпидемиологического повышения частоты респираторных вирусных заболеваний доля этих состояний в общей структуре вызовов увеличивается в 1,5–2,5 раза. В связи с тем, что пациенты с так называемой лихорадкой неизвестной этиологии чаще всего уже подвергались диагностическим и терапевтическим вмешательствам, ДД следует осуществлять по принципиальным группам состояний, опираясь на наиболее вероятные для конкретного случая с учетом возраста и пола, учитывая предшествующие результаты, очень щадящие, проводя болезненные вмешательства в последнюю очередь.
В ДД прежде всего исключают инфекции генерализованные и локализованные (абсцессы); затем — опухоли, особенно лимфомы, рак кишечника, печени, опухоли с обструкцией и перфорацией; затем — иммунные заболевания. Но эта схема не является абсолютной, а очередность ДД зависит от других факторов (возраст, симптоматика, профессия, посещение регионов с эндемичной патологией).
Так, при повышении температуры тела у пациента пожилого возраста с ревматическим пороком сердца и кальцинозом створок клапанов, конечно же, в первую очередь врач подумает об инфекционном эндокардите. А у ребенка с прежде интактными внутренними органами — о лимфоме или лейкозе. Что касается особенностей этиологии лихорадки неясного генеза у детей, то она представлена, прежде всего, необычными вариантами частых заболеваний и редко — классической презентацией редкой патологии.
Среди всех причин лихорадки неясного генеза у детей 55–75% составляет инфекция. Из них половина случаев — вирусные заболевания, а среди больных детей этой группы до 70% в возрасте младше 6 лет. Инфекции верхних дыхательных путей и вирусные инфекции чаще выявляют у детей в возрасте до 3 лет, инфекционный мононуклеоз — у детей старше 6 лет. Заболевания соединительной ткани и воспалительные заболевания составляют около 20–25% случаев лихорадки неясного генеза. Опухоли (прежде всего лейкозы и лимфомы) — около 10% всех случаев, что в 2 раза реже, чем у взрослых. Остальные причины (тиреоидит, лекарственная лихорадка и т. д.) составляют менее 10%.
Схематически группы нозологических единиц при так называемой лихорадке неясного генеза могут быть представлены следующим образом (табл. 7.1.2).
Таблица 7.1.2
Диагностическая схема при лихорадке неясного генеза
| Повышение СОЭ и воспалительный сдвиг белков крови | СОЭ не повышена, нет воспалительного сдвига белков крови | ||
| Моносимптомная лихорадка | Лихорадка + другая симптоматика | ||
| Кратковременная (несколько недель) | Длительная (месяцев и лет) | ||
| Миалгии: сепсис, бактериальный эндокардит, токсоплазмоз, узелковый периартериит | Острая вирусная инфекция (грипп, аденовирусная) | ||
| Острые инфекционные заболевания | Злокачественные опухоли пищеварительного тракта, лимфомы, саркоидоз, редкие заболевания | Непродуктивный кашель: туберкулез, бронхокарцинома | Нарушение центральной терморегуляции |
| Туберкулез | — | Сухой кератоконъюнктивит: РА, СКВ, узелковый периартериит | Симуляция |
| Коллагенозы | — | Геморрагии в конъюнктиве: бактериальный эндокардит | — |
| — | Увеит: туберкулез, токсоплазмоз, саркоидоз, СКВ, синдром Рейтера | — | |
| — | Лимфаденопатия: лимфомы, туберкулез, метастазы,токсоплазмоз, инфекционный мононуклеоз | — | |
| — | Боль в груди: метастазы, лейкоз | — | |
В 7–10% случаев у взрослых и в 10–20% у детей словосочетание «лихорадка неясного генеза» так и остается нерасшифрованным ни при жизни, ни при секционных исследованиях.
Повышение температуры тела при вегетативных дистониях сочетается с общим изменением эмоционального статуса пациента, мелким тремором пальцев, тахикардией покоя, влажной кожей с легко возникающим сосудистым рисунком. СОЭ обычно очень низкая, в крови — лимфоцитоз. Все эти симптомы напоминают гипертиреоз, для ДД с которым необходимо определение уровня гормонов щитовидной железы, а лимфоцитоз характерен и при латентном туберкулезе.
Схожие признаки отмечают и при хронической интоксикации ртутью. При этом у работников соответствующих производств или лабораторий развиваются снижение аппетита, саливация, стоматит, уменьшение массы тела, боль в животе, диарея. Из неврологической симптоматики отмечают легкий тремор пальцев, век, кончика языка, атаксия, дизартрия, повышенная возбудимость или апатия, страхи, тревожность, плохой сон, потливость, выраженный красный или белый дермографизм. Профессиональный анамнез, определение концентрации паров ртути на рабочем месте и концентрации ртути в моче пациента служат обоснованию диагноза.
Периодическое повышение температуры тела при более или менее ее регулярном подъеме с длительностью каждого такого приступа в один или несколько дней. При этом больного беспокоят боль в груди, в животе, головная боль, артралгия, выявляют серозиты, в анализах крови — лейкоцитоз и повышение СОЭ. При многолетнем периодическом лихорадочном анамнезе, отсутствии признаков бактериального или любого другого инфекционного воспаления, опухолей необходимо исключить периодическую болезнь (семейная средиземноморская асептическая лихорадка). Предполагают, что заболевание наследуется по а/д типу. Возникает, прежде всего, у евреев, армян, ирландцев, жителей Средиземноморья. Ген заболевания расположен на коротком плече 16-й хромосомы. Ген кодирует белок, построенный из 781 аминокислоты и называемый одними исследователями пирином, а другими — маренострином. Образуется только циркулирующими нейтрофильными гранулоцитами и усиливает транскрипцию противовоспалительных промотеров этими клетками. В патогенезе заболевания, очевидно, имеет значение и альфа-фактор некроза опухолей. Так, у 6 из 7 членов одной семьи с а/д вариантом периодической болезни выявлена мутация рецептора фактора некроза (TNFR1). Мутация содержится в трансмембранном домене. Это ведет к периодической активации рецептора и появлению признаков воспаления. Заболевание начинается обычно в возрасте 5–15 лет, но, возможно, и раньше, и значительно позже. Тяжесть и частота симптомов снижаются с возрастом, в период беременности или при развитии амилоидоза. Клинически (с вариабельной для популяции, но достаточно стабильной для индивидуума частотой и длительностью) отмечают высокую лихорадку, артралгию, интенсивную боль в груди и в животе. Последняя часто симулирует так называемый острый живот, что и приводит пациентов на операционный стол. При обследовании выявляют серозиты, в том числе асептический перитонит, разрешающийся самостоятельно, и болезненную эритему. До и в период приступа в крови повышается концентрация мочевой кислоты и этиохоланола. Возможно развитие амилоидоза.
Всегда следует помнить, что повышение температуры тела может быть симулировано больным, особенно пациентом невропатического склада. Несоответствие между частотой пульса и показаниями термометра, отсутствие органных и системных изменений служат основанием для проведения одновременной термометрии в подмышечной впадине и в прямой кишке в присутствии врача.
Лихорадочные состояния могут сочетаться с кожными, суставными изменениями, гиперплазией ЛУ и т. д. Эти проявления существенно облегчают ДД.
Петехии и пурпура обусловлены бактериями, риккетсиями, вирусами. Вне зависимости от наличия синдрома внутрисосудистого диссеминированного свертывания при сепсисе, особенно вызванном грамотрицательной флорой, петехии являются одним из наиболее частых кожных проявлений. При эндокардите петехии чаще необильные, а при менингококковой инфекции — сливные. Петехии появляются при дебюте бактеремии при гонококковой, стрепто- и стафилококковой инфекциях, в дальнейшем подвергаются обратному развитию. Петехии и экхимозы на боковых поверхностях живота бывают при ретроперитонеальных гематомах.
Типичная кожная сыпь свойственна кори, скарлатине и краснухе. Из неинфекционных заболеваний с петехиями протекают капилляротоксикоз (болезнь Шенляйна — Геноха), СКВ.
Везикулы и пустулы — достаточно типичное проявление герпетической и оспенной вирусной инфекций.
Вирусы Коксаки группы А-16 вызывают экзантему на ладонях, подошвах и слизистой оболочке полости рта: везикулы с полупрозрачным или слегка опалесцирующим содержимым располагаются в типичных местах на инфильтрированном гиперемированном основании.
У ВИЧ-инфицированных сыпь чаще пустулезная, вызванная инфицированием атипичными микобактериями или возбудителем бациллярного ангиоматоза (Aflpia felis).
Макуло-папулезные высыпания на фоне лихорадочной реакции выявляют при кори, краснухе, инфекциях, вызванных вирусами ECHO и Коксаки. Расположение элементов сыпи преимущественно на ладонях и подошвах типично для вторичного сифилиса.
Особенно яркие, распространенные и упорно сохраняющиеся высыпания появляются у больных инфекционным мононуклеозом (вирус Эпштейна — Барр), получавших лечение ампициллином.
Склонность к поражению кожи отмечают при стрептококковых инфекциях (скарлатина, рожа), что завершается шелушением.
Редкими причинами могут быть риккетсиозы, системные микозы, инфекционная эритема (Parvovirus В19), системные кандидозы и аспергиллезы, токсоплазмоз, болезнь Кавасаки.
Неинфекционного характера макуло-папулезная экзантемя возникает при лекарственной и сывороточной болезни, СКВ.
Лихорадка в сочетании с хориоретинитами типична для системного (генерализованного — глубокого) кандидоза (грибковый сепсис по распространенной терминологии), токсоплазмоза и генерализованной цитомегаловирусной инфекции.
Лихорадка в сочетании с субконъюнктивальными кровоизлияниями заставляет вспомнить о трихинеллезе и инфекционном эндокардите.
Лихорадка и хориоидальные бугорки — типичное сочетание для туберкулеза, а повышение температуры тела и ретинальные кровоизлияния — для эндокардита.
Лихорадка в сочетании с подногтевыми кровоизлияниями по типу укола иглой (рис. 7.1), расположенных по длиннику ногтя, характерна для инфекционного эндокардита, системных васкулитов и СКВ.
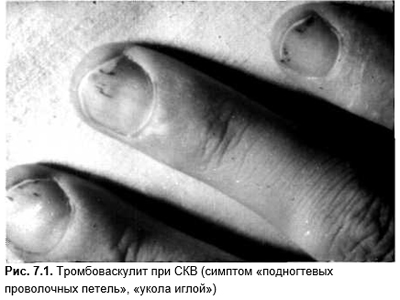
Повышение температуры тела в сочетании с узловатой эритемой возникает при туберкулезе, стрептококковой инфекции, саркоидозе, лимфомах, васкулите Кристиана — Вебера.
Лихорадочные состояния с «простудными симптомами» — едва ли не самая частая ситуация в практике врача общего профиля. Они охватывают большую группу состояний от общих расстройств (недомогание, общая разбитость, головная боль) до конъюнктивита, ринита, тонзиллита, фарингита, отита. В таких ситуациях врач всегда вспоминает о так называемых острых вирусных инфекциях, при которых повышение температуры тела обычно проходит за 2–3 дня.
Но адено-, Коксаки-, ECHO- и герпес-вирусы могут вызвать развитие тяжелой ангины. При этом наряду с гиперемией зева выявляют везикулы или мелкие язвочки на слизистой оболочке языка, щек, неба.
При мононуклеозе важнейшими симптомами являются лихорадка, ангина, фарингит, увеличение лимфоузлов. Схожая картина возможна в начале СПИДа.
В противоположность вирусным заболеваниям, бактериальные чаще характеризуются более тяжелой клинической картиной.
Стрептококковая ангина протекает с высокой лихорадкой, болью в горле, увеличенными яркими миндалинами, часто с белым налетом, иногда с петехиями на мягком небе, болезненным увеличением шейных лимфоузлов, лейкоцитозом.
Дифтерия протекает с похожими проявлениями, но налет в типичных случаях плотный, отделяется с кровотечением. Патогномоничен плотный отек шеи.
Ангина Симановского — Плаута — Венсана (фузоспириллезная) обычно односторонняя, налет не выражен, после удаления оставляет кратерообразное изъязвление миндалины, запах изо рта гнилостный. Регионарный лимфаденит односторонний, маловыраженный, малоболезненный. Бактериоскопическое выявление фузиформных палочек и боррелий подтверждает диагноз.
Редкими причинами фарингита являются стафиллококки, нейсерии, листерии, Н. influenzae, гонококки, бледная трепонема.
Повышение температуры тела и гнойные очаги во рту типичны для лейкемий, воспаления периодонта.
Лихорадочное состояние, кашель и боль в грудной клетке при дыхании весьма типичны для пневмонии (табл. 7.1.3). В любой возрастной группе с большим отрывом лидирует так называемая бронхопневмония. При этом трудно различить переход от бронхита к пневмонии. В первые дни болезни ведущими являются клинические проявления. Рентгенологические признаки не типичны и разными специалистами трактуются как «усиление сосудистого и/или бронхолегочного рисунка», «перибронхит», «сгущение легочного рисунка» и т. д. Любая антибиотикотерапия изменяет рентгенографическую картину. Ни в коем случае нельзя спешить с заключением об отсутствии пневмонии по результатам просмотра «мокрого снимка». Поэтому пограничные состояния не должны быть «полем для ломания копий». В интересах больного (особенно лиц старческого возраста, больных с иммунодефицитными состояниями или пациентов раннего возраста) — интенсивное этио- патогенетическое лечение.
Таблица 7.1.3
Клинические формы пневмонии
| Показатель | Бронхопневмония | Долевая пневмония | Интерстициальная пневмония |
| Кашель | Вначале сухой, затем — с мокротой | Нередко коклюшеобразный | Сухой, короткие приступы кашля |
| Частота дыхания | Обычно не изменена | Умеренно повышена | Резко повышена |
| Дыхательная недостаточность | Обычно нет | Умеренная | Есть, усиливается периодически |
| Цианоз | Обычно нет | Не выражен | В период приступов кашля |
| Лихорадка | Умеренная | Часто значительная | Определяется этиологическим фактором |
| Мокрота | Скудная | «Ржавая» | Белая, пенистая |
| Перкуссия | Часто без особенностей | Локальное притупление звука | Без особенностей |
| Аускультация | Проявления вариабельны, у новорожденных — усиление бронхиального компонента | Крепитация, мелкопузырчатые хрипы | Мелкопузырчатые хрипы, снижение интенсивности дыхательных шумов |
| Возбудитель, разрешающий фактор | Чаще — Суперинфекция | Прежде всего — пневмококки | Вирусы, бактерии, иммунные нарушения |
Достаточно часто пневмония обусловлена пневмококками и Haemophilus influenzae. Пневмония стрептококковой этиологии чаще возникает у новорожденных, а стафилококки выявляют при смешанной инфекции или при развитии бронхоэктазов. Пневмонию грибковой этиологии выявляют при нарушениях иммунитета, опухолях или при муковисцидозе. Микоплазмы, Chlamydia pneumoniae, легионеллы обусловливают развитие атипичной пневмонии с непродуктивным кашлем, скудными физикальными данными, несегментарно расположенными пятнистыми инфильтратами.
Еще реже возбудителями оказываются вирусы и хламидии Бюрнета. В качестве госпитальной инфекции выступают стафиллококки и энтеробактерии. Аспирационную пневмонию, прежде всего у алкоголиков, вызывает анаэробная флора полости рта.
Бактериальная пневмония в большинстве случаев протекает остро, с высокой температурой, кашлем с мокротой, одышкой, в случае поражения плевры — с болью. Для инфекции Коксаки- и ЕСНО-вирусов характерна выраженная плевральная боль, но не свойственны легочные инфильтраты. Классикой хронической бронхолегочной инфекции остается туберкулез.
Абсцесс легкого как результат неблагоприятного течения пневмонии, аспирации или обтурации бронха опухолью, как и хроническая эмпиема плевры, может обусловить высокую лихорадку, длительный кашель и боль в груди.
У пациентов с иммунодефицитными состояниями причинами пневмонии может быть оппортунистическая инфекция: грибы, пневмоцисты, цитомегало- и герпес-вирусы, токсоплазмы.
Неинфекционными причинами лихорадки в сочетании с кашлем и болью в груди могут быть эмболия легочных сосудов, аспирация химических веществ или их паров, распадающаяся опухоль, аллергический альвеолит, интерстициальная пневмония. Диагноз основывается на пунктуальном сборе анамнеза, результатах рентгенографии или КТ грудной клетки, функциональных проб.
Инфаркт миокарда с перикардитом, как и вирусный перикардит, в первые дни может протекать с повышением температуры тела до 37,5 °C. Уточнение жалоб и динамики болезни, внимательный клинический осмотр, электрокардиограмма (ЭКГ), эхоКГ, энзимная диагностика приводят к правильному заключению.
Из лекарственных препаратов повышение температуры тела и появление инфильтратов в легких способны вызывать блеомицин и нитрофуранотоин.
Сочетание температурной реакции и регионарного лимфаденита, особенно при оценке топографической локализации измененных ЛУ, иногда сразу позволяет установить диагноз.
Затылочные ЛУ увеличиваются при краснухе. Острое болезненное припухание шейных и подчелюстных лимфоузлов отмечают при инфекциях верхних дыхательных путей. Наряду с разнообразными вирусами особое значение имеет стрептококковая инфекция, листериоз, вирус Эпштейна — Барр (инфекционный мононуклеоз). Но в период сезонного повышения заболеваемости острыми вирусными инфекциями у ряда больных с токсоплазмозом и цитомегалией отмечают синдром генерализованного увеличения ЛУ с наличием атипичных лимфоцитов, что напоминает инфекционный мононуклеоз.
В зависимости от локализации входных ворот стрептококковая инфекция группы А может обусловить развитие пахового, локтевого или подмышечного лимфаденита. Опоясывающий лишай (herpes zoster) сочетается с регионарным умеренным увеличением лимфоузлов, что вместе с типичным видом и локализацией высыпаний позволяет быстро установить диагноз.
Повышение температуры тела с увеличением ЛУ типично для бруцеллеза и туляремии. В ряде регионов нельзя забывать о бубонной чуме.
Одностороннее безболезненное увеличение шейных ЛУ типично для туберкулеза, а в современных условиях — для инфекции атипичными типами микобактерий.
Сохраняющаяся неблагополучная эпидемиологическая ситуация заставляет помнить о дифтерии.
Асимметричное безболезненное прогрессирующее увеличение группы ЛУ типично для лимфомы. Безболезненное увеличение паховых ЛУ в сочетании с первичным аффектом характерно для первичного сифилиса. В противоположность этому, увеличение паховых ЛУ при генитальном герпесе, мягком шанкре, венерической и паховой лимфогранулемах болезненно, иногда даже с флюктуацией. В то же время гоноррея практически никогда не протекает с паховой лимфаденопатией.
Генерализованная реакция ЛУ характерна при ВИЧ-инфекциях, многих других контагиозных заболеваниях.
Клиническая картина, анализы крови, результаты серологических исследований, биопсия ЛУ приводят к окончательному диагнозу.
Генерализованная микрополиадения возникает при туберкулезной интоксикации, циркуляции иммунных комплексов. Наряду с этим генерализованная реакция ЛУ в сочетании с лихорадкой присущи лимфомам, лейкозам, метастазирующим опухолям, саркоидозу, амилоидозу, аутоиммунным гемолитическим анемиям, гистиоцитозу.
Лихорадка и спленомегалия часто возникают при лимфо- и миелопролиферативных заболеваниях, а также при некоторых инфекциях, реже — при ретикулоэндотелиозах. Редкими (но возможными) заболеваниями в европейской части России являются малярия, висцеральный лейшманиоз, шистозомиаз, трипаносомоз. Острая пневмония, головная боль, повышение температуры тела и спленомегалия типичны для пситтакоза. Из неинфекционных заболеваний, протекающих с повышением температуры тела и выраженной спленомегалией, следует назвать синдром Фелти.
Суставной синдром при лихорадке надо отличать от артралгий, при которых нет опухания, покраснения или ограничения функции сустава. Они свойственны гриппоподобным инфекциям, ревматической полимиалгии, узелковому периартерииту, продромальной фазе гепатита А. Артрит и лихорадка могут быть типичным или атипичным проявлением гетерогенной группы инфекционных и ревматических заболеваний (табл. 7.1.4).
Таблица 7.1.4
Клинико-лабораторные признаки у пациентов с артритом и лихорадкой
| Симптом или признак | Вероятный диагноз |
| t>4O°C | Бактериальный артрит, болезнь Стилла, СКВ |
| Лихорадка предшествует артриту | Вирусный артрит, боррелиоз (болезнь Лайма), реактивный артрит, болезнь Стилла, бактериальный эндокардит |
| Мигрирующий артрит | Ревматизм, гонококцемия, менингококцемия, вирусный артрит, СКВ, острый лейкоз, болезнь Уиппла |
| Отеки суставов превалируют над болезненностью | Туберкулезный артрит, бактериальный эндокардит, воспалительные заболевания кишечника, гигантоклеточный артериит, болезнь Лайма |
| Болезненность преобладает над отечностью суставов | Ревматизм, семейная средиземноморская лихорадка, острый лейкоз, СПИД |
| Положительный РФ | РА, вирусный артрит, артрит при системной склеродермии, СКВ, системный васкулит, саркоидоз, бактериальный эндокардит,туберкулезный артрит |
| Утренняя скованность в суставах | РА, ревматическая полимиалгия, болезнь Стилла, синдром Рейтера, кишечный артрит, некоторые вирусные артриты |
| Симметричный синовит мелких суставов | РА, СКВ, вирусный артрит |
| Лейкоцитоз >15 000/мм3 | Бактериальный артрит, бактериальный эндокардит, болезнь Стилла, системный васкулит, острый лейкоз |
| Лейкопения | СКВ, вирусный артрит |
| Эпизодические рецидивы | Болезнь Лайма, болезнь Стилла, болезнь Уиппла, кристаллоартролатия, неспецифические воспалительные заболевания кишечника, СКВ, семейная средиземноморская лихорадка |
На основании каких же исследований можно подтвердить генез артрита?
Инфекционные артриты
- бактериальные инфекции:
— септический артрит, бактериальный артрит → бактериологическое (культуральное) исследование культур крови и синовиальной жидкости;
— болезнь Лайма (боррелиоз) → серологические исследования;
— микобактериальный и грибковый артрит → бактериологические исследования или биопсия;
- вирусный артрит → серологические исследования.
Постинфекционный или реактивный артрит
- кишечные инфекции → культуральные или серонегативные исследования;
- урогенитальные инфекции (синдром Рейтера) → культуральные исследования;
- ревматическая лихорадка (ревматизм) → клинические исследования;
- неспецифические воспалительные заболевания кишечника → клиническая симптоматика;
- РА и болезнь Стилла → клиническая симптоматика.
Системные ревматические заболевания
- системные васкулиты → биопсия или ангиография;
- СКВ → серологические исследования.
Кристаллоартропатии (микрокристаллические артропатии)
- подагра или псевдоподагра → поляризационная микроскопия синовиальной жидкости или тофусов.
Другие заболевания
- семейная средиземноморская лихорадка (периодическая болезнь) → клиническая симптоматика, генные исследования;
- опухоли → биопсия;
- саркоидоз → биопсия.
Болезни мягких тканей
- дерматомиозит (полимиозит) → клиническая симптоматика и биопсия;
- болезнь Бехчета, пурпура Шенляйна — Геноха, болезнь Кавасаки, узловатая эритема, многоформная эритема, гангренозная пиодермия, пустулезный псориаз → клиническая симптоматика и биопсия.
Сочетание периодически возникающего артрита и лихорадки типично для семейной средиземноморской лихорадки (периодической болезни). Болезнь проявляется в детском возрасте короткими рецидивами лихорадки, артрита, болью в грудной клетке и животе. Артрит начинается остро, очень болезненно, характеризуется локальным мышечным спазмом, небольшим выпотом. Поражаются преимущественно крупные составы (коленные, голеностопные, тазобедренные, локтевые, плечевые). Во время каждой атаки поражается один сустав.
В большинстве случаев артрит длится не более 1 нед и завершается полным исчезновением признаков воспаления без дефигурации. Для установления диагноза необходим тщательный сбор анамнеза.
Острый транзиторный симметричный полиартрит коленных и голеностопных суставов при саркоидозе ассоциируется с узловатой эритемой, аденопатией ворот легких и сопровождается умеренной лихорадкой. Поражение суставов характеризуется внезапно или постепенно возникающей болью, утренней скованностью, выпотом. Впечатляющий отек периартикулярных тканей и гиперемия обоих коленных суставов напоминают подагрический артрит, но такой суставной синдром при саркоидозе развивается у молодых женщин, для которых подагра не характерна.
Синовиальная жидкость воспалительного характера с нейтрофильным лейкоцитозом.
Инфекционный артрит
Вирусные артриты. Вирусные инфекции являются частой причиной транзиторного артрита (синовита). Тяжелое поражение суставов возникает редко. Артрит, как правило, сопровождает или следует за вирусным заболеванием. При вирусной инфекции гепатита В артрит предшествует симптомам гепатита и разрешается при появлении желтухи.
Поражение суставов при гепатите В отмечают в 10–30% случаев. В течение 1–3 нед продромального периода на фоне симптомов, напоминающих сывороточную болезнь (лихорадка, недомогание, кожные высыпания, диспепсические явления, ангионевротический отек, артралгия), отмечают развитие двустороннего симметричного артрита с преимущественным вовлечением проксимальных межфаланговых, реже — коленных, плечевых, тазобедренных, локтевых, голеностопных суставов, позвоночника. Характерно внезапное появление боли, скованности, резкой болезненности в суставах, кожной гипертермии. У некоторых пациентов возможен мигрирующий артрит. Сывороточный комплемент снижен.
Несмотря на то что данный вариант сочетания артрита и лихорадки описан на примере гепатита В, аналогичные проявления возможны при гепатите А и других формах вирусных гепатитов.
Артрит может возникать при эпидемическом паротите, мононуклеозе, арбо-, ECHO- и Коксаки-вирусной инфекции. Причем взрослые подвержены этому осложнению вирусной инфекции больше, чем дети.
Тропизмом к синовиальной оболочке обладает вирус краснухи. Сходный артрит вызывает парво- вирус В19. Вирус краснухи чаще поражает суставы рук и пальцев у молодых женщин. Поражение суставов отмечают у 60–70% больных, преимущественно взрослых. Около 15–30% детей, перенесших краснуху или вакцинированных живым ослабленным вирусом, в ближайшие 2 нед переносят артрит, развивающийся после экзантемы. Вообще же артрит при краснухе развивается параллельно с другими проявлениями заболевания, но может опережать их на 7 дней и более.
Поражение суставов двустороннее, симметричное с преимущественным вовлечением мелких суставов кисти и лучезапястных суставов. Описано развитие моноартрита. Артрит характеризуется острым началом, болезненностью, утренней скованностью, отеком, покраснением, поражением периартикулярных тканей. Синовиальная жидкость воспалительного характера. Все это создает сложности в ДД с РА.
Несколько видов артропатий (включая короткие эпизоды тяжелой артралгии, острый эпизодический олигоартрит и симметричный хронический полиартрит) описаны у больных, инфицированных ВИЧ (табл. 7.1.5).
Таблица 7.1.5
Типы полиартрита, ассоциированного с ВИЧ-инфекцией
| Тип | Характеристика |
| Неслецифичеекий синовит (СПИД- ассоциированный артрит) | Олигоартрит ног с выраженными воспалительными и болевыми изменениями. Синовиальная жидкость невоспалительного характера. Симметричный персистирующий полиартрит |
| Серонегативная спондилопатия. Синдром Рейтера. Псориатический артрит. Реактивный артрит | Энтезопатии; сильная связь с носительством HLA В-27. Более тяжелые проявления, чем у пациентов без ВИЧ. |
| Септический артрит | Поражаются преимущественно аксиальные суставы |
Артрит, ассоциированный со СПИДом, нечасто сопровождается лихорадкой. Картина может измениться при сопутствующей инфекции.
Предполагается, но окончательно не доказана патогенетическая роль ВИЧ в возникновении артропатий. Поскольку артрит может быть ранним проявлением СПИДа, клиницист должен учитывать этот вариант полиартрита, особенно у молодых людей при каждом случае впервые выявленного полиартрита. Последнее имеет важное значение с точки зрения терапии, поскольку при СПИДе противопоказаны иммуносупрессивные препараты.
Артриты при кокцидиомикозе, криптококкозе, споротрихозе, гистоплазмозе и бластомикозе возникают крайне редко, хотя в США их описывают значительно чаще. Клиническая картина напоминает туберкулезный артрит, первичный очаг грибковой инфекции обычно находится в легких, редко — в коже.
Лихорадка скалистых гор — риккетсиозный васкулит, проявляющийся лихорадкой, артралгией, миалгией, опуханием кистей и стоп с эритемой, возникающей первоначально на конечностях, включая ладони и подошвы. Все это напоминает ревматическое заболевание. В США ежегодно регистрируют около 1500 случаев этого заболевания. Диагноз подтверждается клинической картиной, эпидемиологи- чески-географическим анамнезом и выявлением повышенных титров соответствующих антител.
Постинфекционные или реактивные артриты. Бактериальные артриты
Под термином реактивные артриты подразумеваются воспалительные поражения суставов известной этиологии в тех случаях, когда инфекционный агент не может быть выделен из полости суставов. Хотя согласно этому определению к реактивным артритам могут быть отнесены вирусные артриты, гонококковый артрит, сочетающийся с узловатой эритемой, эта группа ограничивается, в основном, двумя синдромально-нозологическими формами: артрит на фоне урогенитальной или кишечной инфекции и острая ревматическая лихорадка (ревматизм по отечественной терминологии).
Реактивные артриты являются самой частой формой патологии суставов у мужчин молодого возраста.
Кишечная или урогенитальная инфекция — синдром Рейтера. Чаще развиваются после хламидийной, шигеллезной, сальмонеллезной, кампилобактериальной и иерсиниозной инфекции, а также при боррелиозе, синдроме Бехчета, неспецифическом язвенном колите и болезни Крона. Преимущественно — это асимметричный полиартрит. Суставной синдром проявляется локальной гипертермией и гиперемией, отеками, болезненностью суставов. Отмечают боль в различных отделах позвоночника, возможны признаки сакроилеита. Характерны тендиниты, бурситы, особенно нижних конечностей: ахиллобурситы, периоститы пяточных бугров (рыхлые пяточные шпоры), энтезопатии, дакгилиты («сосискообразные пальцы»).
Комплекс этих изменений является решающим для диагностики реактивного артрита, когда первичная инфекция клинически не проявляется.
Тяжесть пусковой инфекции плохо коррелирует с интенсивностью синовита, который обычно начинается спустя 1–2 нед.
Сходные клинические проявления могут быть связаны с различными инфекциями. Одна и та же инфекция может вызвать различные клинические формы суставной патологии (полный или неполный синдром Рейтера). У меньшей части пациентов отмечают классические проявления синдрома Рейтера (артрит, уретрит, конъюнктивит).
Непродолжительная лихорадка может сопутствовать гастроэнтериту. Во время последующего полиартрита температура бывает умеренной или нормальной. У некоторых пациентов выраженное полиартикулярное воспаление суставов сопровождается высокой температурой.
Атипичные проявления наиболее свойственны иерсиниозу, при котором иногда отмечают фарингит и шейную лимфаденопатию.
Иммунологическая предрасположенность определяется носительством HLA В-27, который выявляют у 90% пациентов с урогенитальным артритом и у 50–80% — с кишечным артритом. Наличие В-27 может подтвердить диагноз, но в целом его диагностическая ценность мала.
Синовиальная жидкость воспалительного типа. Жизнеспособных организмов не выявляют, но могут быть идентифицированы микробные антигены, способные поддерживать персистенцию синовита. Специальными лабораторными методами осуществляют диагностику инфекции.
Олигоартрит крупных суставов отмечают у 10–20% пациентов с воспалительными заболеваниями толстой кишки (обычно в период обострения болезни). Лихорадка является отражением гастроинтестинального процесса. В редких случаях в начале клинической картины при отсутствии симптомов со стороны толстой кишки преобладают артрит, лихорадка, общее недомогание, уменьшение массы тела, анемия.
Эпизодические лихорадка, синовит и везикуло-пустулезные высыпания на коже отмечают как осложнение после операций на толстой кишке или после наложения кишечных анастомозов (5–25%). Клиническая картина может напоминать диссеминированную гонококковую инфекцию, но культуральные исследования отрицательны.
Артрит может быть ранним осложнением болезни Уиппла, которая по клиническим проявлениям иногда напоминает воспалительные заболевания толстой кишки. Вовлекаются преимущественно коленные, голеностопные, лучезапястные суставы, реже — позвоночник, мелкие суставы кистей и стоп. Артрит носит мигрирующий характер. Атаки артрита длятся от нескольких дней до нескольких недель, рецидивируют нерегулярно. Диагноз болезни Уиппла можно предположить при мультиорган ном поражении. Он подтверждается биопсией слизистой оболочки и ЛУ тонкой кишки. Случаев артрита при болезни Уиппла у детей не описано.
Непосредственно инфекционные причины обусловливают до ¼ всех воспалительных заболеваний суставов. Часто выявляют такие предрасполагающие факторы, как травмы суставов, предшествующий хронический полиартрит, внутрисуставные пункции.
Почти все бактериальные артриты, за исключением генерализированной гонококковой инфекции, моноартикулярные. Инфекционный артрит характеризуется сильной болью, отеком с частым выпотом, гиперемией, ограничением движений и общей лихорадочной реакцией. Хронический артрит может протекать и без повышения температуры тела. В 50% всех случаев бактериальных артритов поражается коленный сустав, в 20–25% — тазобедренный, около 12% — плечевой, почти столько же локтевой. Остальное — лучезапястный, голеностопный и грудино-ключичный суставы. Илеосакральное сочленение поражается очень редко. При изучении внутрисуставной жидкости, полученной при выпоте, регистрирует лейкоцитоз до 50⋅109/л за счет нейтрофильных гранулоцитов, концентрация глюкозы снижена вдвое по сравнению с ее уровнем в крови, уровень лактата (исключение — гоноррейные артриты) превышает 11 ммоль/л. Грамотрицательная флора не дает таких резких лабораторных сдвигов. Необходимо выполнить бактериоскопическое и культуральное исследование, определить чувствительность микрофлоры. Наряду с поисками бактерий в пунктате, необходимо провести микроскопию в поляризованном свете для исключения кристаллоартропатий.
Туберкулез суставов чаще протекает без общей лихорадочной реакции, но при наличии свищевых ходов легко присоединяется гнойная инфекция, обусловливающая изменения общей и местной картины. Туберкулезный артрит преимущественно хронический с утолщением капсулы, местными отеком и повышением температуры тела. Рентгенологически отмечается остеопороз, эрозии развиваются позже. В синовиальной оболочке при биопсии или в синовиальной жидкости удается выявить микобактерии.
Остеомиелит — воспалительное и деструктивное поражение костей, обусловленное аэробными или анаэробными бактериями, микобактериями и грибами. У детей остеомиелит, как правило, является результатом гематогенного заноса инфекции. Чаще локализуется в метафизах большеберцовой или бедренной кости или в других быстро растущих богато васкуляризированных костях. У взрослых остеомиелит позвонков и костей стопы типичен для больных сахарным диабетом и как посттравматический на стороне пенетрирующей травмы. Наиболее вероятным этиологическим фактором гематогенного остеомиелита является грамположительная микрофлора. Остеомиелит с грамнегативными возбудителями типичен для тяжелобольных пациентов с малигномами, сахарным диабетом, а также тех, кому проводили многократные внутривенные инъекции. Инфекция костей сопровождается стазами и тромбозами сосудов с некрозами кости с возможным распространением воспаления в поднадкостничную зону и даже в мягкие ткани.
Клиническая картина острого гематогенного остеомиелита состоит из высокой лихорадки, отека части конечности, локальной гипертермии, местной болезненности. Поскольку дети вообще часто падают, местная боль списывается на травму. Количество лейкоцитов может быть не изменено, но СОЭ и концентрация СРВ повышены. Для остеомиелита позвонков характерна локальная боль в спине, местное напряжение паравертебральной мышцы. Температура может оставаться в норме. Рентгенологические изменения появляются только на 1–4-й неделе болезни. Более информативно сканирование с 99mTс при снимках как в боковой, так и в переднезадней проекциях. Область зоны роста у детей всегда «горячая», что может маскировать начальное воспаление. Если гной проник сквозь кость и приподнял надкостницу, то очаг воспаления в кости «холодный», но окружен «горячим ореолом».
При выявлении подозрительного участка желательна аспирационная биопсия. Но в 20% случаев аспират при его посеве не дает роста флоры. Культура из крови высевается в 50% случаев.
ДД проводят с другими очаговыми поражениями костей, прежде всего лейкемией (до 5% лейкемий у детей начинается с гнойного артрита), саркомой Эвинга и других опухолей. Для опухолей костей, в противоположность остеомиелиту, характерно противоречие между выраженными локальными рентгенологическими изменениями и мягкостью системных проявления. Для остеомиелита типично противоположное сочетание.
Синдром лихорадки, головной боли и менингизма
Ригидность затылочных мышц с головной болью— достаточно яркие симптомы при менингеальных изменениях. Наряду с ограничением и болезненностью наклонов головы, которые в выраженных случаях вообще не возможны, определяются симптомы Брудзинского и Кернига. Инфекционные заболевания являются наиболее частыми причинами этого состояния, но менингит или менингизм развивается при интракраниальной локализации экстрамедуллярных очагов патологического кровообразования при лейкозах, при метастазах опухолей, при сосудистых катастрофах, васкулитах, побочном действии таких препаратов, как ко-тримоксазол и некоторых антиревматических средств.
Менингит — воспаление мягкой мозговой оболочки (Leptomeninx — Pia mater и бессосудистая Arachnoidea с ликворпроводящим субарахноидальным пространством). Воспаление твердой мозговой оболочки (Dura mater) известно как пахименингит.
90% всех случаев менингитов развиваются как вторичные в результате поступления бактерий гема- тогенно или лимфогенно из первичного очага (инфильтрат в легком, эпиглоттит, отит). В этом случае менингит при менингококкцемии — типичный пример вторичного менингита. Вторичный менингит чаще всего развивается у новорожденных (особенно у недоношенных), при аномалиях развития мозга и ликворопроводящей системы, при травмах черепа и покровных тканей, рино- и/или отоликворрее, при хроническом алкоголизме, сахарном диабете, опухолях ретикуло-эндотелиальной системы, заболеваниях иммунной системы, цитостатической терапии и лучевой терапии черепа. В 80% случаев вторичный менингит протекает с осложнениями.
О первичном менингите говорят в случаях непосредственного гематогенного или лимфогенного поступления возбудителя без предшествующего заболевания (менингококковый менингит при так называемой капельной менингококковой инфекции). Осложнения первичного менингита возникают не чаше, чем в 20% случаев. Чем младше и чем старше пациент, тем выше вероятность осложнений и тем они выраженней.
Известна сезонность менингитов. Гнойные бактериальные менингиты чаще возникают осенью, зимой и ранней весной. Серозные вирусные менингиты — летом. Лептоспирозные — летом и ранней осенью. Боррелиозный (лаймовский) менигит чаще возникает с апреля по октябрь.
С поражением преимущественно конвексных отделов мозга по типу чепчика протекают менингиты, вызванные пневмококками, гемофильными палочками и Е. соli. С преимущественным поражением базальных отделов мозга протекают менингиты, вызванные микобактериями туберкулеза, боррелиями, стрепто/стафилококками, менингококкоками, бледными спирохетами, криптококками, а также при опухолях области III желудочка.
Клинически менингит проявляется (табл. 7.1.6) головной болью, ригидностью затылочных мышц (болезненность затылочных мышц при наклоне головы вперед; при боковых движениях головы болезненности обычно нет), повышением температуры тела, тошнотой, рвотой, светобоязнью, диплопией, гиперестезией. Неврологические проявления сводятся к нарушениям координации, тремору, сужению сознания вплоть до комы (чаще — при гнойных менингитах), делирию с цветистым бредом при вирусных серозных менингитах (30% всех случаев), расширению вен глазного дна и к застойному соску зрительного нерва, анизокории с измененной реакцией на свет. Выявляют парез отводящего нерва, повышение мышечного тонуса, гиперрефлексия. Соотношение симптомов и их выраженность могут варьировать и определяются степенью поражения менингеальной оболочки и этиологическим фактором, а также возрастом больного. Так, судороги типичны для менингитов, вызванных стафилококками, пневмококками, стрептококками, гемофильной или кишечной палочкой. У новорожденных и недоношенных клиника менингитов может быть очень нечеткой, маскироваться мышечной дистонией постгипоксического генеза.
Таблица 7.1.6
Неврологические признаки при менигитах и менингизме
| Признак | Проявления |
| Ригидность затылочных мышц | Рефлекторное напряжение затылочной мышцы при резком пассивном наклоне головы (при медленном наклоне может не определяться!) |
| Симптом Брудзинского | Резкий наклон головы у пациента, лежащего с выпрямленными ногами, ведет к сгибанию ног в коленных и тазобедренных суставах, иногда — и к сгибанию рук в локтевых суставах |
| Симптом Лассега | Пассивное сгибание ноги в тазобедренном суставе при разогнутом коленном обусловливает резкую ишиасоподобную боль и появление поясничного гиперлордоза. Выраженность боли усиливается при одновременной внутренней ротации ноги |
| Симптом Кернига | При согнутых под углом 90° тазобедренных суставах невозможно (боль) распрямить коленные суставы |
| Паховый рефлекс | При надавливании на бедренный нерв в паховой области появляется боль в бедреном и коленном суставах |
| Симптом Брагарда | Уменьшение выраженности боли, обусловленной подниманием распрямленной ноги, после подошвенной флексии стопы или большого пальца |
| Симптом опоры | В положении сидя пациент опирается на руки, откинутые за спину |
| «Поцелуй колена» | Пациент не может дотянуться до колен губами |
| Симптом Брудзинского — Пайпера | При сгибании одной ноги сгибается и другая |
| Тетанические знаки | «Рука акушера», отведение угла рта при раздражении лицевого нерва |
У детей общая клиническая симптоматика менингита может проявляться эфемерной продромой с легкими катарральными явлениями, разбитостью, болью в суставах, ревматоидноподобным опуханием суставов, наряду с повышенной — и пониженной(!) температурой тела, периодически прерывистым дыханием, потливостью, болью в спине, апатией, редким миганием, взглядом «в никуда», скудостью движений, сонливостью, оборонительными отгоняющими движениями при попытке пассивной перемены положения тела, пронзительными вскриками, синдромом «беспокойных ног», петехиями, неспецифическими экзантемами, у новорожденных выбухает родничок (этого признака нет при эксикозе), недержанием стула и мочи или затрудненным опорожнением кишечника и/или мочевого пузыря, общей симптоматикой сепсиса.
Биохимические и микроскопические исследования ликвора, определения уровня его давления позволяют во многих случаях установить правильный диагноз. Высокий цитоз за счет нейтрофильных гранулоцитов с большим содержанием белка и низким уровнем глюкозы, мутным ликвором, высоким уровнем СРБ (>0,4 мг/л) свидетельствуют о бактериальном поражении мозговой оболочки или об опорожнившемся абсцессе мозга. Значительная клеточность за счет мононуклеаров с высоким уровнем белка и низким или нормальным содержанием глюкозы свидетельствуют в пользу микобактериальной или криптококковой природы, об опухолевых метастазах или лейкемоидной инфильтрации. Два последних варианта подтверждаются предшествующими состояниями и цитологически. Значительный плеоцитоз за счет мононуклеаров, слегка повышенное содержание белка при нормальном или сниженном уровне глюкозы соответствуют так называемым серозным менингитам. Следует учесть, что в начале серозных менингитов в ликворе могут преобладать полинуклеары, а мононуклеары появляются в течении ближайших 3 дней.
«Серозные менингиты» вызываются многочисленными вирусами (герпеса, энтеровирусами и вирусом эпидемического паротита), бактериями (боррелиями, спирохетами, листериями и т. д.), простейшими (токсоплазмы, плазмодии). Во многих случаях этиология остается неизвестной.
Серозные вирусные менингиты часто протекают с энцефалитическим синдромом. Для последнего характерны плеоцитоз «раздражения (30/3–70/3 лимфоцитов), повышение уровня глобулинов, повышение концентрации белка и сахара в ликворе, сознание помрачено вплоть до комы, нарушение речи, очаговая симптоматика, психические симптомы, мозжечковая и пирамидная симптоматика, церебральные судороги, мышечная гипотония, миоклонии, паркинсонизм.
Постинфекционные менингоэнцефалиты, субдуральные и эпидуральные гематомы и эмпиемы, тромбофлебиты синуса твердой мозговой оболочки, остеомиелиты шейных позвонков могут протекать с плейоцитозом. Этот же признак отмечают и при благополучной динамике менингитов, леченых антибиотиками.
ДД менингитов в зависимости от цитоза ликвора и клиническое значение выявленных в ликворе клеток представлены в табл. 7.1.7 и 7.1.8.
Таблица 7.1.7
ДД менинингитов в зависимости от цитоза ликвора
| Цитоз клетки | Вероятное заболевание |
| 5–50/3 клеток | Рассеянный склероз; арахноидит; вирусный энцефалит; реактивный плеоцитоз (плеоцитоз раздражения); подострый склерозирующий панэнцефалит; полирадикулоневрит (синдром Гийена — Барре); нейросифилис; туберкулез; субарахноидальное кровотечение; абсцесс мозга; параинфекционные менингиты и микозы; интоксикации; гипогликемический шок; гипоксия; церебральные судороги |
| 50–100/3 клеток | Репарационная фаза гнойного и серозного менингита; плеоцитоз раздражения (пунктит); инсоляция; туберкулез; грибковый или паразитарный менингит; Lues connata, опухоли; субарахноидальное кровоизлияние; абсцесс мозга |
| 100–1000/3 клеток | Туберкулезный, лептоспирозный, листериозный и риккетсиозный менингиты; цереброспинальный сифилис;
ранняя фаза гнойного менингита (гранулоциты); подострый гнойный менингит; субарахноидальное кровотечение; грибковый менингит; цистицеркоз, токсоплазмоз; адгезивная арахнопатия; опухоли; абсцесс; тромбоз синусов |
| 1000–3000/3 клеток | Гнойный менингит острый и подострый; энтеровирусный, герпетический, вызванный вирусами опоясывающего лишая и др. серозные менингиты; актиномикоз; опухоли |
| Высокий и очень высокий: 3000–12 000/3 клеток | Гнойный менингит в острой фазе; паротитный, энтеровирусный и арбовирусный менингиты; нокардиоз; актиномикоз; прорыв абсцесса мозга |
Таблица 7.1.8
Клиническое значение клеток, выявленных в ликворе
| Чем представлен патологический цитоз | Вероятное заболевание |
| Нейтрофильные гранулоциты | Бактериальный менингит; опухоль мозга; грибковый (актиномикоз) энцефалит; острый полиомиелит; контузия мозга; эхо-, адено-, арбовирусные менингоэнцефалиты; острый реактивный менингит (менингит раздражения) после прорыва крови в ликворную систему; инсоляция; инфаркт мозга |
| Эозинофильные гранулоциты | Паразитарные заболевания ЦНС (эхинококкоз, аскаридоз, токсокароз, цистицеркоз, филяриоз, трихинеллез); туберкулез; сифилис; субарахноидальное кровотечение; рассеянный склероз; узелковый периартериит; опухоль мозга; подострый склерозирующий энцефалит |
| Лимфоциты | Вирусные менингиты; туберкулез; сифилис; опухоли первичные и метастазы; подострый бактериальный менингит; поздняя фаза полиомиелита; субарахноидальное кровотечение |
| Моноциты | Вирусные, листериозные и лептоспирозные менингиты; дегенеративные заболевания мозга; опухоли мозга; репаративная фаза менингита |
| Макро(эритро)фаги | Субарахноидальное кровоизлияние; интрацеребральное кровотечение; контузионные кровотечения; геморрагический энцефалит; абсцесс мозга |
| Макро(лейко)фаги | Бактериальный менингит; хроническое течение вирусного менингоэнцефалита |
| Липофаги | Инфаркт мозга; болезнь Тея — Сакса |
| Сидерофати | С 3–7-гo дня субарахноидального кровотечения и персистируют в течение недель и месяцев |
| Плазматические клетки | Рассеянный склероз; опухоли мозга; разгар нейросифилиса; бруцеллезный менинигит; хронический бактериальный менингит; туберкулезный менингит |
| Опухолевые клетки | Метастазы карцином; медуллобластома; эпендимома; глиома |
| Незрелые миелоидные и лимфатические клетки | Экстрамедуллярные очаги при миело- и лимфолейкозах |
Очаговые параменингеальные инфекционные поражения в современных условиях хорошо визуализируются методами КТ и ЯМР. Менингизм, повышение температуры тела, резчайшая головная боль при ксантомном или геморрагическом ликворе типичны для субарахноидального кровоизлияния (см. в соответственном разделе).
Бактериальные менингиты вызываются менингококками (чаще у детей), пневмококками (преимущественно у взрослых), палочкой Haemophilus influenzae.
Посттравматические и постоперационные менингиты обусловлены стрепто- и стафиллококками, грибами. Эти же возбудители, а также бактероиды, смешанная инфекция обусловливают менингиты на фоне абсцессов мозга, тромбозов синусов.
У новорожденных часто высевают кишечную палочку, стрептококки группы В, листерии, клебсиеллу, протей. Указанные возбудители инфицируют ребенка при прохождении родовых путей или тут же после рождения.
У иммунодепрессированных пациентов в качестве этиологических факторов превалируют грибковые менингиты.
Менингококковые менингиты. 70% всех менингококковых менингитов выявляют у детей в возрасте до 5 лет. Менингококковые менингиты составляют 40% всех менингитов детского возраста и 35–40% — менингитов взрослых. У взрослых эта инфекция эпидемически проявляется в плохо обустроенных казармах, негигиеничных общежитиях, при плохом питании, скученности и длительном пребывании в холоде. Типичная капельная инфекция. Человек — единственный хозяин (ребенок в возрасте до 3 лет практически никогда не бывает носителем!), место обитания — слизистая оболочка рото/носоглотки.
Заболевание (менингит) нередко развивается при смене погоды. Известны серотипы А, В, С. Перекрестного иммунитета не развивается. Но после перенесенного менингита остается пожизненный иммунитет по отношению к серотипу-возбудителю.
В 80–90% заболевание развивается как первичный менингит. Инкубационный период составляет 2–5 дней. Заболевание манифестирует после короткого (1–2 дня) продромального катарального периода. Появляются мучительная головная боль, потрясающий озноб, рвота, ригидность затылочных и, возможно, мышц спины. Очень редко возникают парезы глазных мышц (косоглазие, диплопия), зрительного и лицевого нервов.
Не типичны вялые и спастические параличи и судороги.
Сыпь, напоминающая скарлатину, корь или краснуху, отмечают у 25% больных. Менингококковая бактеремия может сопровождаться клинической картиной менингита, но чаще возникает менингит без менингококцемии и менингококцемия без менингита. Течение менингококцемии в 80% случаев сочетается с макулопапулезными высыпаниями и пурпурой. У детей возможен крайне неблагоприятный вариант: синдром Уотерхаузена — Фридриксена, обусловленный кровоизлияниями в надпочечники, сопровождающийся шоком и массивными кожными геморрагиями. Основная локализация — ноги, ягодицы. Известна хроническая менингококковая септицемия с лихорадкой, артралгиями, кожными сыпями (кожно-артритический синдром).
Осложнения при менигококковом менингите (который «у всех на слуху») возникают не чаще чем в 12–15% случаев. Из них 10% составляет тугоухость и только 2–5% — другие, более тяжелые.
Пневмококковый менингит развивается у детей младшего возраста (10% всех менингитов у детей — пневмококковые), у пациентов старше 50 лет (50% всех менингитов у взрослых) и после удаления селезенки (без профилактики — у 10–25% спленэктомированных). Чаще всего пневмококковый менингит развивается при наличии ликворного свища (например, spina bifida aperta). Ему предшествуют перенесенные пневмония, особенно при наличии бронхоэктазов, отит, синусит или мастоидит. Очень высок риск пневмококкового менингита у пациентов с сахарным диабетом или получающих цитостатики. Часто пневмококковый менингит обусловливает отоневрологические осложнения. 70% всех смертей при менингитах — вследствие пневмококковых менингитов.
Менингит, вызванный Haemophilus influenzae, поражает детей в возрасте до 2 лет (65% бактериальных менингитов у детей в возрасте до 5 лет составляют гемофильные менингиты). У взрослых возникает редко (10% всех других бактериальных менингитов). Предрасполагают все иммуносупрессирующие факторы, аспления, злокачественные опухоли, серповидноклеточная анемия. Формируется как «отсев» из верхних дыхательных путей или околоносовых пазух.
Клиническая картина характеризуется острым началом с судорогами (35%), комой (60%). Частыми осложнениями являются абсцессы мозга, снижение слуха. Последнее может развиться и через 2–6 мес после менингита.
Особенностью гемофильного менингита является то, что в 50% случаев в ликворе лимфоциты преобладают над нейтрофильными гранулоцитами.
Рецидивы обусловлены ликворными свищами, младенческим возрастом (у детей в возрасте до 1,5 года после выздоровления антител не выявляют), старческим возрастом, малигномами, способностью возбудителя переживать внутриклеточно.
Синдром Клейншмидта (возникает редко) — менингит, вызванный Haem. influenzae, + эпиглотгит + эндокардит, плеврит или синовит.
Серозные менингиты могут быть обусловлены вирусами (энтеровирусами, вирусами краснухи, герпеса, эпидемического паротита, кори, культуральным штаммом полиомиелита, ВИЧ), бактериями (боррелиями, микобактериями, лептоспирами), грибами или простейшими. Леченный антибиотиками гнойный менингит может протекать с теми же лабораторными изменениями, что и серозный. Серозные неинфекционные менингиты возникают при опухолях мозга, метастазах, СКВ. Клинические симптомы — повышение температуры тела, интенсивная головная боль, особенно заглазничная, светобоязнь (чаще у детей), рвота, общее беспокойство, иногда судороги, делирий. У недоношенных и новорожденных ригидность затылочных мышц может быть очень незначительной. Этиологическая расшифровка серозных менингитов возможна далеко не всегда. При ДД отличиями от гнойных менингитов является сравнительно медленно нарастающие признаки менингизма (в течение нескольких суток), общее состояние страдает в значительно меньшей степени (за исключением арбовирусных и герпетических менингитов), нередко выявляют макуло-папулезную сыпь. Петехии отмечают при менингитах, вызванных ЕСНО-вирусами 9-го типа.
Энтеровирусные менингиты (Коксаки-, полио-, ЕСНО-вирусы) чаще выявляют летом. 80% пациентов — дети, мальчики заболевают чаше девочек. Возможны не только менингиты, но и энцефалиты, миелиты. Подтверждение энтеровирусной этиологии основывается на изучении испражнений, мазков из зева, серологически. В последнем случае диагностически значимым считается 4-кратное повышение специфических антител IgA. Коксаки-менингиты могут протекать одновременно с серозными минимальными по объему экссудата плевритами, миокардитами и парезами.
В 1993 г. 141 страна заявили об освобождении своей территории от полиомиелита, что достигается вакцинацией не менее 90% населения. В России в декретированные сроки были вакцинированы только 1/3 детей, ревакцинированы однократно 35,5% подлежавших первой ревакцинации и 40,4% — подлежавших второй вакцинации. В 1994 г. только в Чечне было зарегистрировано 174 случая паралитического полиомиелита. В настоящее время в России ежегодно официально регистрируют от 3 до 17 случаев полиомиелита в год, хотя случаев заболевания, обусловленного «диким штаммом», не выявлено. Заболеваемость в некоторых ближайших сопредельных государствах значительно выше. В Московской области у детей-носителей выделены штаммы «дикого» вируса полиомиелита, родственные среднеазиатским. Поэтому проблема полиомиелитных менингитов, рассматриваемая в зарубежной литературе только как казуистический и преходящий результат вакцинальных штаммов, в России не решена. В последнее время состояние проблемы менее катастрофично. С 1997 г. не зарегистрировано случаев полиомиелита, вызванного «диким штаммом», но ситуация требует бдительности.
После короткого катарального фебрильного периода и 2–3-дневного безтемпературного интервала появляются менингеальные симптомы. Асимметрично пораженные мышцы вначале болезненны, сухожильные рефлексы оживлены. Через 2 дня практически полностью формируется зона парезов, сухожильные рефлексы не вызываются. Расстройства чувствительности или экстрапирамидно-мо- торной системы не свойственны. В ДД необходимо исключать полирадикулит Гийена — Барре.
Менингит при эпидемическим паротите субклинически (по данным ликвородиагностики) выявляют у 50% больных эпидемическим паротитом. Клинически значимый выявляется у 10%. Обычно при наличии менингита поражение слюнных желез протекает неманифестно. В ликворе выявляют лимфоцитарный цитоз, снижение содержание глюкозы, умеренное повышение белка. Реакция связывания комплемента помогает в диагностически неясных случаях.
Лимфоцитарный хориоменингит диагностируют редко, переносчиками являются мыши и хомячки. Заболеваемость повышается зимой. Через 1 нед после катарального периода, очень редко — бронхитов и пневмоний, развивается макуло-папулезная экзантема и серозный менингит. Этиологический диагноз устанавливают на основе выявления вируса в ликворе и крови, наличии вируснейтрализующих или комплементсвязывающих антител.
Туберкулезный менингит характеризуется вялым, очень невыраженным течением. Долгое время господствующим было мнение о туберкулезном менингите как о неуклонно прогрессирующем и фатальном заболевании. Но и в настоящее время прогноз неблагоприятен.
Туберкулезный менингит развивается как ранняя гематогенная диссеминация на основание мозга из первичного комплекса. Подозрение на туберкулезный менингит должно возникать при всяком заболевании у ребенка, сопровождающегося утомляемостью, апатией, нарушением поведения или дневного ритма жизни, продолжающимися в течение 5 дней без явных признаков других инфекционных заболеваний. В особенности это относится к детям в возрасте до 5 лет с недавним виражом туберкулиновых проб вне зависимости от того, проводилась им химиопрофилактика или нет. Свойственные менингитам тошнота и рвота при туберкулезном менингите могут сочетаться с интенсивной болью в животе, что симулирует брюшную катастрофу. Головная боль, тошнота, рвота, субфебрильная температура, менингизм, в выраженных случаях — парез отводящего нерва (базальный менингит) требуют проведения люмбальной пункции. При серозном туберкулезном менингите выявляют плеоцитоз за счет мононуклеаров, повышение белка, снижение глюкозы и хлоридов. Наличие микобактерий для экспресс-диагностики подтверждается цепной полимеразной реакцией. Менее надежны окраска мазков по Цилю — Нильсену или аурамином. Информативны, но длительны культуральные и биологические методы.
Лептоспирозные менингиты чаще возникают при заражении типом Pomona, вызывающим «болезнь свинопасов», но выявляют желтушно-геморрагические и другие штаммы. Инфицирование протекает за счет переноса инфекции с испражнениями мелких грызунов. Пик заболеваемости приходится на лето и раннюю осень. Инкубационный период составляет 8–14 дней. Заболевание протекает типично в две стадии. Менингит развивается на стадии органных изменений (II стадия), в противоположность менингизму, выявляющемуся в период бактериемической стадии. Между I и II стадиями возникает безлихорадочный период. Заболевание начинается с интенсивной головной боли, судорог, общей оглушенности. Типичен конъюнктивит с кровоизлияниями, покраснение лица, энантема на слизистой оболочке рта, макулопапулезные и геморрагические сыпи на теле. Относительная брадикардия, желтушность, гепатоспленомегалия, патологический мочевой осадок облегчают ДД. В ликворе на 6–7-й день выявляют лимфоцитоз, значительное повышение белка при нормальном или сниженном уровне глюкозы.
Прогностически благоприятно безжелтушное течение, оставляющее выраженный иммунитет.
Тяжелым осложнением являются персистирующий арахноидит, миелит, увеит, иридоциклит, неврит зрительного перва.
Лаймовский (боррелиозный) менингит. В последние годы повысилась частота этого менингита за счет поражения детей в возрасте 10–12 лет. Возбудителя (спирохета Borrelia burgdorferi) переносят клещи, оводы, мухи-жигалки, комары, грызуны. Пик заболеваемости — апрель— октябрь. Инкубационный период составляет 7–14 дней. Ведущий симптом в детском возрасте — парез лицевого нерва. (Об укусе клеща или мигрирующей эритеме пациенты часто и не помнят.) Клиническая картина — безлихорадочный лимфоцитарный хронический менингит с незначительно повышенной СОЭ, без значительного лейкоцитоза или ощутимого «сдвига влево». Заболевание протекает в несколько стадий.
Стадия I. Через 1–5 нед после укуса клеща появляется хроническая мигрирующая эритема. Лимфаденоз кожи. IgM повышен у 20% больных, к началу II стадии его концентрация снижается.
Стадия II. В интервале от 3–12 нед до 1 года после укуса клеща— неврологическая симптоматика (20% больных). У детей чаще — лимфоцитарный менингит, у взрослых — полирадикулоневрит и миелит. Дополнительно — поражение черепно-мозговых нервов, парез лицевого нерва, энцефалит. Нарушения ритма сердца, миокардит, перикардит. Специфический IgM не выявляют. Со 2–6-й недели болезни выявляют специфический IgG.
Стадия III. Моно/полиартрит.
Стадия IV. Только у взрослых в возрасте 40–50 лет и старше: на месте укуса насекомого формируется хронический атрофический акродерматит.
Боррелии очень тяжело выделяются в культуре. Поэтому решающим является повышение IgG-антител до 1:128 и IgM — до 1:32.
Сифилитический менингит развивается в 10–12% нелеченных случаев через 5–30 лет после инфицирования. Типичен очень невыраженный цитоз и умеренное повышение белка при положительных сифилитических реакциях ликвора. Травмы, наслоение вторичных инфекций, особенно ВИЧ, резко уменьшает период от инфицирования до развития менингита.
Грибковые менингиты протекают с лимфоцитозом, повышением белка, снижением сахара.
Наиболее частыми являются криптококковые менингиты, протекающие подостро или хронически. Развиваются как отсев из легкого, где могут персистировать у пациентов с туберкулезом, сахарным диабетом, лимфомами, лейкозами, ВИЧ-инфекцией. Возбудитель может быть выявлен в осадке ликвора при окраске тушью. Достовернее выявление антигена в культуре или серологически агглютинацией на латексе.
Вторичные (сопутствующие) менингиты возникают при гнойных процессах вблизи мозговой оболочки (отит, мастоидит, синусит, абсцесс мозга) и протекают с достаточно яркой менингеальной симптоматикой. В ликворе выраженный плейоцитоз за счет лимфо- и гранулоцитов, повышение белка, нормальное содержание глюкозы. Ликвор вытекает под давлением, но бактерии выделить не удается, что и предопределяет диагноз. Причины развития асептического менингита разнообразны и сводятся к следующим основным группам:
- Бактерии:
Нейроборрелиоз; не полностью излеченный бактериальный менингит; туберкулез; сифилис.
- Постинфекционные состояния:
Корь (склерозирующий энцефалит); краснуха; вакциния и оспа (исторически).
- Вирусы:
Ветряная оспа; опоясывающий лишай; герпес; Коксаки-, ECHO- и полиовирусы; восточный и западный лошадиный энцефалит; ВИЧ; цитомегаловирус; эпидемический паротит; энцефалит Сент- Луиса; лимфоцитарный хориоменингит.
- Прочие:
Амебиаз; бруцеллез; болезнь кошачьей царапины; церебральные осложнения болезни Уиппла; кокцидиомикоз; цистицеркоз; лептоспироз; паховая лимфогранулема; малярия; микоплазмоз; риккетсиоз; сифилис; токсоплазмоз; трихиноз; торулоз.
- Поствакциональная реакция:
Коклюш; бешенство и др. — реже.
- Поражение менингиальной оболочки иммунной (болезнь Бехчета) или онкологической природы.
- Параменингиальные процессы:
Абсцессы; кровоизлияния; опухоль мозга; рассеянный склероз; хронический отит или синусит.
- Лекарственные средства:
Азатиоприн; карбамазепин; ибупрофен; напроксен; триметоприм.
- Реакция на интратекальные введения:
Воздух; антибиотики; химиотерапевтические средства; рентгенконтрастные препараты.
- Интоксикации:
Свинец.
Менингеальные симптомы с повышением температуры тела могут возникать при внутричерепных кровоизлияниях. Для них типичны остро возникшая интенсивная головная боль и быстрое развитие неврологической симптоматики.
Энцефалиты также могут сопровождаться менингеальной симптоматикой. В отдельных случаях ДД асептического менингита и энцефалита может быть очень непростой. Менингиты могут протекать с церебральными знаками, энцефалитам иногда свойственна минимальная очаговая симптоматика при наличии менингиальных знаков. Изменения ликвора при серозных менингитах и энцефалитах схожи. Тем более, что в ряде случаев выявляют и общие возбудители. Большинство возбудителей, известных как возможная причина серозных менинигитов, могут вызывать и энцефалиты. Наибольшее значение принадлежит вирусам. Вирусы герпеса способны вызвать тяжелый энцефалит с летальным исходом и могут быть выявлены в кожных везикулах или при биопсии мозга. Серологически может быть подтверждена персистенция вирусов СПИДа, арбо-, энтеро-, адено-, миксо-, реогрупп. Важнейшими невирусными заболеваниями с возможным развитием энцефалита являются сифилис, сыпной тиф, малярия, трипаносомоз, шистозомиаз, цистицеркоз, трихинеллез, токсоплазмоз. В любом случае на первое место при энцефалитах выходит мозговая симптоматика (см. выше).
Лихорадочные состояния и желтуха
Всегда требуется быстро установить: является ли желтуха надпеченочной, печеночной или подпеченочной (см. главу Желтухи…). Естественно, одновременно следует выяснить случайности или закономерности комбинации лихорадки и желтухи.
Например, длительное время недиагностированно протекавший цирроз печени на фоне любой наслоившейся инфекции декомпенсируется со всеми из этого вытекающими изменениями клинической картины. Или долевая пневмония, туберкулез у алкоголика с пораженной печенью, неизбежно протекающие сами по себе с повышением температуры тела, будут сопровождаться и желтухой разной степени выраженности.
Гемолитические кризы, особенно при серповидноклеточной анемии, сопровождаются повышением температуры тела. Малярия, микоплазма пневмонии, клостридии способны вызвать гемолиз, выражающийся снижением уровня гемоглобина, повышением неконъюгированного билирубина, ретикулоцитов и ЛАГ. У пациентов с серповидноклеточной анемией, дефицитом Г-6-ФД и пароксизмальной ночной гемоглобинурией может возникнуть гемолитический криз при присоединении инфекции. Лихорадка возможна в продромальной стадии вирусного гепатита, цитомегалии и мононуклеоза, при Q-лихорадке, лептоспирозе и легионеллезе, во многих случаях сопровождаясь повышением активности трансаминаз. Но степень желтухи, особенно при двух последних состояниях, может быть очень умеренной.
При милиарном туберкулезе печень обязательно вовлекается в процесс, хотя клинически значимой желтухи, как правило, не бывает. Обычно отмечают только повышение ферментов печени, типичных для холестаза. Достоверный диагноз может быть установлен только на основании результатов лапароскопии, где визуализируются мелкие множественные гранулемы, и биопсии. Туберкулез печени нами выявлена только у детей с иммунодефицитными состояниями, с лимфомами или СКВ, длительно леченной кортикостероидами и иммуносупрессантами.
Тяжело протекающий пневмококковый, клеб- сиеллезный, сальмонеллезный, стрептококковый, бактероидный или вызванный кишечной палочкой сепсис также почти обязательно сочетается с желтухой.
Лихорадка с желтухой — одно из проявлений холангита, грозного осложнения обструкции желчевыводящих путей камнем или опухолью. Причем это осложнение наиболее вероятно при калькулез-ном холецистите, а не при опухолевой обструкции. Наличие в анамнезе приступа коликообразной боли в области правого подреберья с последующим развитием желтухи, боли в правой верхней половине живота, повышение уровня прямого билирубина в сыворотке крови, потемнение мочи и ахоличный стул заставляет исключать обтурацию желчных путей. Это предположение требует проведения эхоГ, ретроградной эндоскопической или транскутанной холангиопанкреатографии.
Холецистит и панкреатит также могут быть причиной сочетания лихорадки, холестаза и боли в животе.
Повышение температуры тела с потрясающими ознобами, желтухой, увеличением размеров печени, болезненностью в правом подреберье типично для абсцессов печени, развившихся как осложнение холангита (в отличие от других видов абсцессов они «привязаны» к желчным ходам), перитифлита и аппендикулярных абсцессов, неспецифического язвенного колита и болезни Крона, дивертикулярных абсцессов, перифлебита и флебита портальных вен, сепсиса или травмы. Обычно это множественные абсцессы, развившиеся гематогенно по типу микроэмболии. Но солидные абсцессы, даже большие, могут длительное время протекать без синдрома желтухи, только с лихорадкой.
При всех видах абсцессов основное значение в диагностике имеют (по нарастающей диагностической ценности) эхоГ, КТ и ЯМР. После этого возможна тонкоигольная пункционная биопсия, позволяющая по результатам посева гноя типировать флору и определить ее устойчивость к антибиотикам. Чаще высевают стрептококк, анаэробы и энтеробактерии. После пребывания в Средней и Юго-Восточной Азии, в тропиках при лихорадке с гепатомегалией, желтушностью и интоксикацией следует исключать амебные абсцессы, развивающиеся вторично по отношению к персистенции возбудителя в кишечнике. Но надеяться на положительный результат поиска амеб в содержимом кишечника для объяснения причины лихорадки нельзя: ко времени поражения печени кишечник в большинстве случаев уже успевает очиститься.
Для абсцессов типичны большие размеры и монолокулярность, плевропульмональный синдром справа в нижней доле, ограничение подвижности правого купола диафрагмы. Окраска на флору и культуральные исследования содержимого такого абсцесса дают отрицательные результаты, паразитов выявляют редко. Достоверные результаты дает поиск антигенов методом непрямой гемагглютинации.
Гепатотоксические препараты (рифампицин, изониазад, альфа-метилдопа, гидантоин, галотан) способны вызвать повышение температуры тела и увеличение размеров печени с желтухой.
Резорбционная лихорадка возникает при инфаркте миокарда, селезенки, почек, гангрене, панкреатите (имеет значение и нарушение калликреин-кининовой системы с большим выбросом эндопирогенов), при рассасывании больших гематом, внутричерепных кровоизлияних. Но при каждом из этих состояний на первый план выступает не лихорадка, а основное заболевание, обусловившее ее.
Лихорадка и диареи характерны при многих, прежде всего инфекционных, заболеваниях (подробную ДД диарей см. в специальной главе), хотя энтероток- сигенные возбудители (Сl. perfringens, V. cholerae, ряд штаммов Е. coli) вызывают развитие афебрильной диареи, за исключением Cl. difficile, вызывающей псевдомембранозный колит. Диареи, обусловленные энтеропатогенными возбудителями (сальмонеллы, шигеллы, иерсинии, энтеропатогенные штаммы кишечной палочки, кампилобактер), протекают с повышением температуры тела. Часто диарея вирусной этиологии (Норфолк-, энтеро-, ротавирусы) также протекает с лихорадкой. Важнейший признак энтеротоксигенной и энтеропатогенной диареи — наличие лейкоцитов в испражнениях. Это не типично для диареи вирусной этиологии. Амебная дизентерия и вторично бактериально инфицированный стронгилоидоз протекают с лихорадкой и диареей. В то же время лямблиоз характеризуется афебрильным течением.
Неинфекционного генеза лихорадочный синдром в сочетании с диареей возникает при болезни Крона, неспецифическом язвенном колите, ишемическом колите.
Незначительный субфебрилитет и диарея могут сопровождать течение тиреотоксикоза.
Инфекция мочеполовой системы в зависимости от ее уровня, тяжести, возбудителя, анатомо-физиологических особенностей может сопровождаться наряду с лихорадкой диз- или поллакиурией, болью в поясничной области или внизу живота, в анально-генитальной области, выделениями из уретры. Острое начало с повышением температуры тела, интоксикации, озноба, с положительным симптомом Пастернацкого при наличии лейкоцитоза в мочевом осадке и бактерурии свидетельствуют в пользу пиелонефрита. При вяло протекающих формах, особенно у женщин, бывает сложно провести ДД с циститом. Любая инфекция мочевых путей требует ДД между первичной (без предшествующих аномалий почек, мочевыводящих путей и сосудов, уролитиаза, гиперплазии предстательной железы, рефлюксов и т. д.) и вторичной — с наличием вышеперечисленных состояний. Первичные, неосложненные инфекции, достаточно просто и быстро излечиваются антибактериальными средствами. Вторичные, осложненные, требуют комплексного подхода.
Предрасполагают к инфицированию мочевых путей длительно находящиеся в мочевом пузыре катетеры, сахарный диабет, беременность, обструктивный синдром.
Абсцессы почек, забрюшинного пространства могут симулировать течение тяжелого пиелонефрита. Применение эхоГ и КТ позволяет провести ДД.
Боль при мочеиспускании, лейкоцитурия в первой порции трехстаканной пробы, выделения из уретры типичны для уретрита, который чаще обусловливают гонококки, трихомонады, хламидии, уреаплазма, кандиды, вирус простого герпеса. Повышение температуры тела не характерно, но лихорадку с потрясающими ознобами, диз- и никтурией, боль в промежности, прямой кишке отмечают при простатитах. Пальпаторно простата увеличена, эластична. Наиболее вероятными возбудителями являются кишечная палочка и энтерококк.
Сепсис характеризуется повышением температуры тела (хотя возможны и длительные гипотермические периоды), одышкой, тахикардией, клиническими признаками инфицирования. Часто отмечают признаки нарушения перфузии внутренних органов, гипоксемию, повышение лактата плазмы крови, олигурия даже при достаточном поступлении жидкости. Около 20% больных страдают респираторным дисстресс-синдромом с одышкой, гипоксемией (рО2<70 мм. рт. ст.), легочными инфильтратами. У них выявляют давление заклинивания в легочных капиллярах (>18 мм рт. ст.). Бактеремию удается подтвердить не более чем у ½ пациентов. Требуется забор крови с посевом на фоне нелеченной лихорадки. Как этиологический фактор грамотрицательная и грамположительная флора занимают приблизительно по 45%, остальные 10% составляют смешанная, грибковая и анаэробная инфекции. Очень важно попытаться выявить входные ворота инфекции. В половине случаев это кишечник на фоне иммунной недостаточности и мочевые пути (обструктивные уропатии, катетеры, оперативные вмешательства), реже — дыхательный тракт (интубации, длительная искусственная вентиляция, трахеостомия), кожа (ожоги). У женщин весьма часто отмечают генитальный сепсис (аборт, послеродовой эндометрит). Не следует забывать о банальных тонзиллите, отите, синусите и множественном кариесе. Эндопротезы (особенно интракардиальные клапанные), водители ритма, будучи недостаточно обработанными перед имплантацией, служат благодатной почвой для рассева возбудителя. Все заболевания, протекающие с выраженным снижением защитных сил организма (врожденные синдромы иммунодефицита, лимфома, лейкоз, цитостатическая и кортикостероидная терапия, сахарный диабет, цирроз печени) предрасполагают к развитию сепсиса. Именно у таких пациентов, а также при длительной катетеризации вен и полостей развивается грибковый сепсис. Рецидивирующая бактеремия обусловливает появление гнойных очагов во внутренних органах.
При наличии врожденных или приобретенных, интактных или корригированных пороков сердца, пролабирования клапанов и лихорадки всегда надо помнить об инфекционном эндокардите. Если бы современные врачи ориентировались на классические диагностические критерии инфекционного эндокардита, то в 90% случаев его было бы невозможно своевременно распознать. Инфекционный эндокардит — микробная инфекция эндокарда, характеризующаяся лихорадкой, шумом в сердце, петехиями, анемией, эмболиями, вегетациями на эндокарде с исходом в недостаточность или стеноз клапанов, миокардиальные абсцессы или микотические аневризмы.
Подострый бактериальный эндокардит обычно обусловлен стрептококками (viridans, microaerophilic, анаэробные, неэнтерококковая группа D-стрептококков, энтерококки), реже — Staph. aureus, Staph. epidermidis, Haemophilis. Подострый бактериальный эндокардит часто развивается на измененных клапанах после бессимптомной бактериемии из кариозных зубов, желудочно-кишечного или мочеполового тракта. Типично медленное начало, температура тела <39 °C, ночная потливость, общее недомогание, уменьшение массы тела, артралгия, озноб, узелки Ослера, микроэмболия в виде красных очажков на конъюнктиве, кончиках пальцев. Гломерулонефрит развивается у ½ больных. Селезенка увеличивается у 1/3. Энцефалопатию выявляют у 35% больных.
Острый бактериальный эндокардит диагностируют редко, вызывается обычно S. aureus, группой А гемолитического стрептококка, пневмококками или гонококками. Может развиваться на интактных клапанах. Протекает как и подострый эндокардит, но значительно тяжелее — с высокой лихорадкой, токсикозом, септическим шоком, быстрой деструкцией клапанов, абсцессами в области клапанного кольца. Не исключено развитие гнойного менингита. По статистике эндокардит осложняет до 20% врожденных и 40% ревматических пороков сердца. В ряде случаев бактериальный эндокардит рассматривают как вторичный по отношению к сепсису, своеобразный эндокардиальный метастатический отсев. Такой вариант отмечают приблизительно у 27% взрослых больных с сепсисом в инфекционных больницах и у 59% больных сепсисом во многопрофильной больнице. Эндокардиты на протезах клапанов сердца развиваются у 2-3% больных в течение года после операции и у 0,5% — после года. Эндокардит чаще развивается на аортальном (рис. 7.2), реже — на митральном протезе. Очень редко эндокардит развивается при пересадке свиных клапанов. Эндокардиты, развившиеся в ближайшие 2 мес после оперативного вмешательства, вызваны антибиотикоустойчивой флорой (дифтероиды, аспергиллы, кандиды, коли-бактерии, S. epidermidis). Эндокардиты с поздним началом вызваны обычно низко вирулентной флорой.
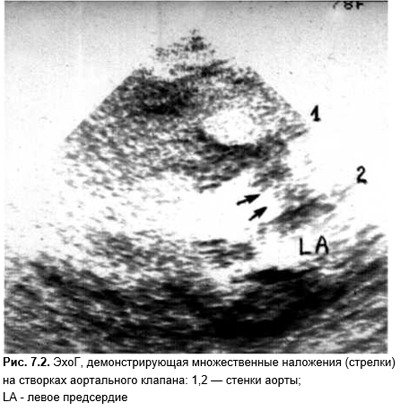
Наиболее частая причина отрицательных результатов посева крови при эндокардитах — антибиотикотерапия. Через 3 дня после начала лечения частота положительной гемокультуры снижается в 3 раза. Если представить, что первым порывом врача при лихорадке у пациента является поиск антибиотика, то остается только удивляться вообще наличию положительных гемокультур. Другая причина отрицательных заключений — длительное хранение крови до посева, грибковая инфекция, использование неадекватных сред и преждевременное прекращение лабораторного исследования при наличии медленно растущей флоры (НАСЕК-группа: Haemophilus, Actinobacillus, Cardiobacterium, Eikinella, Kingeda). К этой же группе медленно растущих форм можно отнести этиологически редких бруцелл, легионелл, хламидий и коксиелл. В таких случаях применяют серологическую диагностику.
При инфекционном эндокардите чаще всего поражается митральный клапан, затем аортальный, постоперативные соустья и имплантированные клапаны. Трехстворчатый клапан и (очень редко) клапан легочной артерии поражаются преимущественно у пациентов после катетеризации правых отделов и у наркоманов. Микотические эндокардиты и аневризмы являются редкостью, развиваются как результат грибковых отсевов с измененных клапанов или из предшествующей инфицированной аневризмы аорты. Лечение антибиотиками малопродуктивно, требуется как можно более скорое оперативное вмешательство для устранения очага инфекции.
Абактериальные эндокардиты развиваются при СКВ (эндокардит Либмана — Сакса), при гиперэозинофильном и карциноидном синдромах.
Общие симптомы (слабость, потливость, ознобы) по выраженности могут варьировать и появиться при уже сформированных вегетациях. Важным является появление шума над сердцем, нового шума или нового тембра уже существовавшего шума. Шум вначале не выслушивается у 10–15% пациентов, но позднее присоединяется обязательно. По данным эхоГ выявляют сравнительно большие вегетации, большее значение имеет доплеррография, выявляющая турбулентность потока крови. Трансторакальная эхоГ выявляет вегетации только у 50% больных с инфекционным эндокардитом, чреспищеводная эхоГ — вегетации у 90–95% больных, в том числе и при негативных гемокультурах. Эта методика позволяет визуализировать и внутримиокардиальные абсцессы. Риск развития эмболии возрастает в первые дни после начала антибактериальной терапии.
При лабораторных исследованиях выявляют лейкоцитоз, умеренная нормоцитарная-нормохромная анемия, повышение СОЭ, возможен высев гемо-культуры (для достоверных результатов необходимо брать по 25–30 мл крови 4–5 раз в сутки), повышение иммуноглобулинов, циркулирующие иммунные комплексы, ревматоидный фактор (РФ).
Лихорадка при токсико-аллергических реакциях
Почти все препараты при индивидуальной гиперчувствительности (идиосинкарзии) способны вызвать лекарственную лихорадку, которая как правило, сочетается с кожными высыпаниями. Чаше это макуло-папулезная экзантема, возможна крапивница. При применении хинина возможна скарлатиноподобная сыпь. Барбитураты могут вызывать кореподобную сыпь. Лихорадочная узловатая эритема может осложнять применение карбамазепина. В крови достаточно часто отмечают эозинофилию. Обычно через несколько дней после отмены препарата исчезают и лихорадка, и сыпь.
Для выяснения причин лихорадки важно проследить ее динамику, поскольку ряд заболеваний характеризуется определенной температурной кривой. Стабильное повышение температуры тела с небольшими (в пределах 1 °C колебаниями) отмечают на высоте заболевания пневмонией, рожей, тифом. При ремиттируюшей лихорадке утренние и вечерние показатели различаются не более чем на 2 °C, причем утром нормализация температуры тела все-таки не наступает. Такую температурную кривую отмечают при туберкулезе, бронхопневмонии, нагноительных процессах. Интермиттирующая лихорадка характеризуется разбросом показателей более чем в 2 °C, утренние показатели могут быть нормальными или субнормальными. Такой тип кривой характерен для сепсиса, пиелонефрита, плеврита. Нередко резкое повышение температуры тела сопровождаются ознобами, что типично для бактериемии самой разной этиологии, например сепсиса, подострого бактериального эндокардита, бактериальной пневмонии, малярии и многих других заболеваний. Регулярное периодическое повышение температуры тела — признак малярии и возвратной лихорадки. Ундулирующая (нерегулярная волнообразная кривая) лихорадка сопровождает течение лимфом и болезнь Банга. Периодически нерегулярно повышающуюся температуру («температурные свечки») отмечают при бронхоэктазе, холелитиазе, то есть при периодически возникающих воспалительных рецидивах. Иногда выявляют сочетание нескольких типов температурных кривых.
Антибактериальная и противовоспалительная терапия маскируют типичные температурные кривые.
Воспалительным и лихорадочным заболеваниям обычно сопутствует повышение СОЭ, определяемой количеством эритроцитов, уровнем фибриногена и альбуминов. Диспротеинемия и фибриногенемия развиваются через 20–30 ч после начала воспаления, поэтому при острейших воспалительных процессах изменения СОЭ могут отставать от состояния больного. С другой стороны, ускорение реакции оседания сохраняется и в период реконвалесценции. Максимальные показатели СОЭ известны при множественной миеломе, резко повышенная СОЭ типична для васкулитов, коллагенозов и диспротеинемических состояниях (опухоли, особенно распадающиеся, заболевания печени). СОЭ значительно повышается при гнойных заболеваниях, при большинстве бактериальных процессов (пневмония, менингиты). Умеренное повышение СОЭ отмечают при лептоспирозах, бруцеллезе, туберкулезе. Хотя при последнем состоянии СОЭ может оставаться в пределах нормы. При вирусных заболеваниях СОЭ меняется незначительно. Анемия действует как фактор, повышающий СОЭ, а полиглобулия, сердечная недостаточность, кортикостероидная терапия обусловливают ее снижение. В этом отношении показательным может быть изменение СРБ, потому что его повышение быстро отвечает на наличие бактериального воспалительного процесса.
Изменения лейкоцитарной формулы много значат для ДД лихорадочных и воспалительных реакций, но трактовка требует учета общей клинической картины, возраста пациента (табл. 7.1.9).
Таблица 7.1.9
Динамика лейкоцитарной формулы у здоровых людей в разные возрастные периоды*
| Возраст | Лейкоциты | Нейтрофильные гранулоциты | Лимфоциты | Моноциты | Эозинофильные гранулоциты | |||||||
| • 1000/мм3 | Пределы колебаний | • 1000/мм3 | Пределы колебаний (+/-2 сигмы) | % | • 1000/мм3 | Пределы колебаний (+/-2 сигмы) | % | • 1000/мм3 | % | • 1000/мм3 | % | |
| 0 | 18,1 | 9,0–30,0 | 11,0 | 6,0–26,0 | 61 | 5,5 | 2,0–11,0 | 31 | 1,1 | 6 | 0,4 | 2 |
| 12 ч | 22,8 | 13,0–38,0 | 15,5 | 6,0–28,0 | 68 | 5,5 | 2,0–11,0 | 24 | 1,2 | 5 | 0,5 | 2 |
| 24 ч | 18,9 | 9,4–34,0 | 11,5 | 5,0–21,0 | 61 | 5,8 | 2,0–11,5 | 31 | 1,1 | 6 | 0,5 | 2 |
| 1 нед | 12,2 | 5,0–21,0 | 5,5 | 1,5–10,0 | 45 | 5,0 | 2,0–17,0 | 41 | 1,1 | 9 | 0,5 | 4 |
| 2 нед | 11,4 | 5,0–20,0 | 4,5 | 1,0–9,5 | 40 | 5,5 | 2,0–17,0 | 48 | 1,0 | 9 | 0,4 | 3 |
| 1 мес | 10,8 | 5,0–19,5 | 3,8 | 1,0–9,0 | 35 | 6,0 | 2,5–16,5 | 56 | 0,7 | 7 | 0,3 | 3 |
| 6 мес | 11,9 | 6,0–17,5 | 3,8 | 1,0–8,5 | 32 | 7,3 | 4,0–13,5 | 61 | 0.6 | 5 | 0,3 | 3 |
| 1 год | 11,4 | 6,0–17,5 | 3,5 | 1,5–8,5 | 31 | 7,0 | 4,0–10,5 | 61 | 0,6 | 5 | 0,3 | 3 |
| 2 года | 10,6 | 6,0–17,0 | 3,5 | 1,5–8,5 | 33 | 6,3 | 3,0–9,5 | 59 | 0,5 | 5 | 0,3 | 3 |
| 4 года | 9,1 | 5,5–15,5 | 3,8 | 1,5–8,5 | 42 | 4,5 | 2,0–8,0 | 50 | 0,5 | 5 | 0,3 | 3 |
| 6 лет | 8,5 | 5,0–14,5 | 4,3 | 1,5–8,0 | 51 | 3,5 | 1,5–7,0 | 42 | 0,4 | 5 | 0,2 | 3 |
| 8 лет | 8,3 | 4,5–13,5 | 4,4 | 1,5–8,0 | 53 | 3,3 | 1,5–6,8 | 39 | 0,4 | 4 | 0,2 | 2 |
| 10 лет | 8,1 | 4,5–13,5 | 4,4 | 1,8–8.0 | 54 | 3,1 | 1,5–6,5 | 38 | 0,4 | 4 | 0,2 | 2 |
| 16 лет | 7,8 | 4,5–13,0 | 4,4 | 1,8–8,0 | 57 | 2,8 | 1,2–5,2 | 35 | 0,4 | 5 | 0,2 | 3 |
| 21 год | 7,4 | 4.5–11.0 | 4,4 | 1,8–7,7 | 59 | 2,5 | 1,0–4,8 | 34 | 0,3 | 4 | 0,2 | 3 |
*По Е. Б. Владимирской (2002), Р. Dalman (1977). Представленные величины находятся в 95-центильном диапазоне. Процент соответствует общему количеству. Нейтрофильные гранулоциты включают палочкоядерные клетки во всех возрастах и малое количество метамиелоцитов и миелоцитов.
Лейкоцитоз типичен для бактериальных инфекций. Отсутствие увеличения количества лейкоцитов возможно при мало выраженном воспалении или при очень тяжелых процессах. Особенно высокие цифры лейкоцитов типичны для милиарного туберкулеза, скарлатины, пневмонии, диссеминированных грибковых заболеваний, диабетической и уремической комы, при метастазах опухолей в костном мозгу и отравлениях угарным газом. Все эти состояния могут перейти в агранулоцитоз. Высокий лейкоцитоз типичен и для рака бронхов даже без его метастазирования. Появление при этом в периферической крови миелоцитов и миелобластов нельзя трактовать как миелобластную неоплазию. Гиперлейкоцитоз за счет лимфоцитов типичен для коклюша.
Увеличение количества нейтрофильных гранулоцитов (полиморфноядерный лейкоцитоз — нейтрофилия) сочетается с массой состояний. Нейтрофильные гранулоциты в периферической крови делятся на два равных в количественном соотношении пула: циркулирующие и находящиеся в краевом стоянии у стенки сосуда (циркулирующий и краевой пул). Между этими пулами происходит постоянный обмен. Нейтрофильные гранулоциты выходят в ткани путем диапедеза из краевого пула. Время их пребывания в циркуляции составляет 2–3 дня. При подсчете форменных элементов анализу подвергается циркулирующий пул нейтрофильных гранулоцитов. Активация симпатической нервной системы и другие факторы, обусловливающие спазм сосудов, могут вызвать временное увеличение циркулирующего пула и «перераспределительный нейтрофилез». В физиологических условиях нейтрофилез характерен при стрессах (гиперадренал/кортизолемия), физической работе, физиопроцедурах. Глюкокортикоиды тормозят переход нейтрофильных гранулоцитов в ткани и, соответственно, вызывают нейтрофилез без изменения лейкоцитарной формулы. В патологических условиях — это первая и ранняя фаза гуморального ответа в течение многих заболеваний, в том числе и небактериальных: инфаркт миокарда и других тканей, подагра, уремия, острые кровоизлияния, гемолиз и т. п., а также при миелопролиферативных заболеваниях (хронический миелолейкоз, миелофиброз, истинная полицитемия) и других малигномах. Ошибочно диагноз миелопролиферативного заболевания иногда устанавливают при наличии так называемой лейкемоидной реакции. Длительное воздействие факторов, индуцирующих нейтрофилез, вызывает истощение гранулоцитарного резерва в костном мозгу и выход в периферическую кровь молодых клеток. Такое состояние называется лейкемоидной реакцией нейтрофильного ряда. Лейкемоидная реакция развивается при хронической инфекции или воспалении. При лейкемоидной реакции количество нейтрофильных гранулоцитов меньше 50 тыс./мкл, количество молодых форм не превышает 10%. Уровень щелочной фосфатазы нейтрофильных гранулоцитов высокий. Отсутствуют базофилия, эозинофилия, моноцитоз, тромбоцитопения. Количество тромбоцитов менее 600–700 тыс./мкл. Морфологические характеристики эритроцитов не изменены, нормобластов нет. Размеры селезенки остаются в пределах нормы. В пунктате костного мозга — гиперплазия с нормальным кариотипом, поликлоновый гемопоэз. Отсутствует химерный ген bcr-able. При миелопролиферативном заболевании нет хронической инфекции или воспаления. Выражен левый сдвиг в лейкоцитарной формуле. Часто выявляют базофилию, эозинофилию, моноцитоз. Тромбоциты крупные, их агрегация нарушена, а количество может превышать 1 млн/мкл. Возможна тромбоцитопения. Морфология эритроцитов изменена, выявляют уродливые формы, полихроматофилию. В мазке периферической крови часто присутствуют нормобласты. Для 25–75% больных типична спленомегалия. Костный мозг гиперплазирован, увеличено количество мегакариоцитов, возможен фиброз. В зависимости от причины выявляют хромосомные аберрациии (филадельфийская хромосома и химерный ген bcr-able при хроническом миелолейкозе) и клоновый гемопоэз.
Кроме увеличения количества нейтрофильных гранулоцитов, надо учитывать и количество палочкоядерных форм. Значительное увеличение количества палочкоядерных нейтрофильных гранулоцитов считают сдвигом влево. Если ядро всех нейтрофильных гранулоцитов содержит только 2 сегмента, то говорят о семейной аномалии Пельгера, которая может симулировать крайние значения левого сдвига. Для ДД используют определение так называемой токсической зернистости. При ней ядра пикнотичны, гранулы крупные, грубые, в плазме крови появляется базофильная зернистость, плазма крови вакуолизирована.
Лейкопения (гранулоцитопения) — уменьшение количества нейтрофильных гранулоцитов <1,5⋅109/л. Гранулоцитопения может быть врожденной (см. нарушения иммунитета) и приобретенной. Приобретенная нейтропения подразделяется на первичную (болезни крови, аплазия кроветворения) и вторичную (инфекция, побочное действие лекарственных препаратов). Гранулоцитопения возможна при тифе и паратифе, болезни Банга, септикопиемиях, вирусных заболеваниях, Кала-Азар, СКВ, гистоплазмозе, тяжелом милиарном туберкулезе и спленомегалиях. В последнем случае она предшествует тромбоцитопении и анемии. Выраженную гранулоцитопению вплоть до агранулоцитоза (количество лейкоцитов <0,5–1,2⋅109/л при отсутствии гранулоцитов) отмечают при побочном действии лекарственных веществ. Возможны два варианта: 1. Токсические лейкопении развиваются при лечении нитостатиками, ионизирующим излучением, они дозозависимы и мало зависимы от индивидуума. 2. Аллергические лейкопении мало зависят от дозы. Развиваются чаше при применении амидопирина, препаратов золота, тиреостатических препаратов, антидиабетических, противосудорожных, транквиллизаторов, антигистаминных средств. Реже выявляют аутоиммуно-гранулоцитопении, после гемотрансфузий — изо-иммуногранулоцитопении, при наследственных синдромах. С лейкопении может манифестировать волосатоклеточный лейкоз (алейкемическая лейкемия).
О нарушениях количества и функции гранулоцитов следует помнить при каждом случае рецидивирующих гнойных инфекций, гнойной ангине, изъязвлениях слизистой оболочки полости рта или трудно объяснимом лихорадочном состоянии.
Достаточно часто врач сталкивается со случаями так называемой доброкачественной (конституциональной, безвредной) нейтропении, относящейся к группе перераспределительных нейтропений (до 4% всего населения). Эта особенность связана с генетически детерминированным быстрым перемещением нейтрофильных гранулоцитов в ткани, где они осуществляют защитные функции. Люди с таким составом крови обычно меньше болеют интеркурентными инфекциями, быстрее выздоравливают от них. Другой причиной перераспределительной нейтропении может быть повышенный тонус вагосимпатической системы, что сопровождается увеличением краевого пула с уменьшением количества циркулирующих клеток.
Эозинофильные гранулоциты — интереснейшие с точки зрения своей функции и морфологии клетки, традиционные представления о которых не соответствуют их истинному предназначению. 17 января 1879 г. на заседании Берлинского общества физиологов Пауль Эрлих прочитал доклад «О специфической зернистости клеток крови» (Kroegel С., Карр А., 1993). Исследователь применил новую технику окраски клеток крови и костного мозга и выявил клетку, чья цитоплазматическая зернистость была особенно восприимчива к кислому красителю эозину, бромированному производному флюоресциена. На основании этого П. Эрлих определил клетку как «эозинофильный гранулоцит».
Вначале эозинофильные гранулоциты рассматривали в связи с инфекцией. Увеличение их количества в периферической крови у выздоравливающего больного получило романтическое название «розовая заря выздоровления». Достаточно быстро эозинофильные гранулоциты стали связывать с паразитозами, реакцией на инородный белок и воспалительно-аллергическими реакциями. Современные авторы (Kroegel С., Карр А., 1993) убеждают, что эозинофильный гранулоцит — прежде всего потентная цитотоксическая клетка, принимающая участие в базисных патогенетических реакциях воспаления. Но до сих пор эозинофильные гранулоциты остаются одной из наиболее загадочных клеток. В какой-то степени это объясняется тем, что в периферической крови у человека эозинофильных гранулоцитов очень мало. Многие функции изучены на примере клеток животных и априори переносятся на человека.
В норме эозинофильные гранулоциты образуются только в костном мозгу из полипотентной стволовой клетки, которая под влиянием гематопоэтических факторов (например лимфокины) трансформируется в колониеобразующую эозинофильную единицу. Через ряд промежуточных форм она доходит до зрелой клетки, поступающей в периферическую кровь. Ряд авторов выявили циркадный ритм с увеличением количества эозинофильных гранулоцитов ночью и минимальным уровнем в полдень. Суточные колебания количества эозинофильных гранулоцитов пытаются объяснить колебаниями уровня кортикостероидов. Количество эозинофильных гранулоцитов меняется на протяжении менструального цикла. Оно минимально в период овуляции и повышается в период менструации. Эмоциональный стресс обусловливает эозинопению, а умеренная физическая нагрузка сопровождается транзиторной эозинофилией.
В крови эозинофильные гранулоциты содержатся не более 26 ч, после чего переходят в периваскулярное соединительнотканное пространство и живут там до 14 дней. В тканях эозинофильных гранулоцитов в 100 раз больше, чем в крови. Особенно много эозинофильных гранулоцитов концентрируется в слюнных железах, эпителии дыхательных путей, желудка, подвздошной кишки, толстой кишки, матки.
После контакта со специфическим иммунным раздражителем происходит перераспределение пула эозинофильных гранулоцитов с их концентрацией в точке воспаления. Одновременно ускоряется созревание эозинофильных гранулоцитов в костном мозгу.
Зрелый эозинофильный гранулоцит — круглая или овальная клетка диаметром 12–15 мкм с двухлопастным ядром и большими ацидофильными гранулами, которые при световой микроскопии описывают как «красную икру». По данным электронной микроскопии выделяют несколько типов гранул, из них особого внимания заслуживают «вторичные» или «специфические». Они содержат набор энзимов и неэнзимных базисных протеинов, определяющих цитотоксические свойства эозинофильных гранулоцитов. Гранулы в зрелом эозинофильном гранулоците содержат плотное центральное решетчато-кристаллическое ядро, представляющее собой полимеризованный главный основной протеин (major basic protein — МБР). Указанный белок составляет ½ всех белков эозинофильной гранулы. В состоянии полимеризации его активность на 90% ниже, чем у мономера. МБР типичен практически только для эозинофильного гранулоцита, где его содержание достигает 4979 нг/106 клеток. МБР выявлен еще и в базофильных гранулоцитах, но его концентрация там составляет всего 140 нг/106 клеток. Ни в каких других органеллах или клетках МБР нет. Интересно, что в период беременности без всяких признаков эозинофилии в десятки раз увеличивается уровень МБР, достигая максимума перед родами. После родов с периодом полураспада в 13,7 дня МБР снижается до нормы. Поданым метода иммунофлюоресценции установлено, что МБР синтезируется в хориальных ворсинах, плацентарных Х-клетках, гигантских клетках. На наш взгляд, постоянно возрастающий уровень МБР призван подготовить роды через цитокиновый механизм.
Кроме вторичных гранул в цитоплазме эозинофильного гранулоцита содержатся «мелкие» гранулы, митохондрии, аппарат Гольджи, липидные тельца, эндоплазматический ретикулум и тубуло-везикулярные структуры (табл. 7.1.10).
Таблица 7.1.10
Локализация и функция некоторых органелл в эозинофильном гранулоците
| Тип гранул | Локализация | Их содержимое и функция |
| Первичные гранулы | Незрелый эозинофильный гранулоцит (промиелоцит) | Лизофосфатаза |
| Вторичные («специфические») гранулы | Зрелый эозинофильный гранулоцит | Базисные протеины (МБР, ЕСР, ЕРХ)*, гидролазы (коллагеназа, бета-глюкоронидаза), эозинофильная пероксидаза |
| Мелкие гранулы | Зрелый эозинофильный гранулоцит | Арилсульфатаза В кислая фосфатаза |
| Микрогранулы (тубуло-везикулярные структуры) | Зрелый эозинофильный гранулоцит | Транспортная система Дегрануляция |
| Липидные тельца | Зрелый нормальный и, прежде всего, активированный эозинофильный гранулоцит | Накопление ненасыщенных жирных кислот(арахидоновая кислота) |
*Сокращения ниже в тексте.
Эозинофильный гранулоцит — прежде всего секреторная клетка, выделяющая различные белки, перекисные радикалы, липиды. Белки накапливаются в мелких и специфических гранулах, а перекисные соединения и липидные медиаторы образуются de novo при активации (см. ниже).
- Неэнзимные протеины.
- Главный основной протеин (МБР). Мол. м.=10 000. Уровень в крови в целом коррелирует с уровнем эозинофилии. Исключениями являются атопический дерматит и хроническая крапивница, при которых МБР методом иммунофлюоресценции выявлен в коже, но эозинофилии тканевой или в крови нет. Гельминтотоксичный, цитотоксичный для опухолевых и других клеток млекопитающих. Основная задача эозинофильного гранулоцита — связаться с мембраной паразитов и разорвать ее. Эозинофильный гранулоцит прикрепляется к паразиту благодаря рецепторам комплемента и Fc, дегранулируется и освобождает МБР. Токсичность ингибируется антителами к МБР и гепарином, который связывает МБР. МБР стимулирует освобождение других протеинов из эозинофильных гранул (эозинофильный катионный протеин, эозинофильный протеин X, эозинофильная пероксидаза), а также гистамина базофилов (по кальциевому или температурному механизму).
- Эозинофильный катионный протеин (ЕСР). Полипептид 14–21кДа (мол. м.=21 000). Содержит очень много аргинина (11 %) и цинка (2,5 ммоль/моль белка). Коагулопатия (нейтрализует гепарин), гельминтотоксичный (для шистозом в 8–10 раз более опасный, чем МБР), цитотоксичный для различных клеток млекопитающих. Блокирует деление лимфоцитов. Нейротоксичный. Активирует мастоциты. Обладает РНК-азной активностью (по строению и функции напоминает панкреатическую рибонуклеазу). Бактерицидной активности нет.
- Эозинофильный протеин X (ЕРХ). Содержит много аргинина и лизина. Токсичен по отношению к легочным формам шистозом. Обладает РНК-азной активностью. Нейротоксичен у пациентов с синдромом гиперэозинофилии крови и эозинофилии спинномозговой жидкости. До сих пор не решено, является ли ЕРХ полностью идентичным эозинофильно-производному нейротоксину (EDN).
- Энзимные протеины.
- Эозинофильная пероксидаза (ЕР, или ЕРО). Мол. м. — 71–77⋅103. Концентрация в эозинофильном гранулоците — 15 мкг/106 клеток. Отличается от пероксидазы нейтрофильных гранулоцитов и моноцитов тем, что состоит из двух полипептидных цепей массой 15 и 55 кДа. Выявляют почти у всех животных, но у большинства представителей семейства кошачьих ее нет. Поэтому кошки достаточно легко становятся носителями некоторых микроорганизмов, самым известным из которых является Bartonella hensellae. ЕРО токсична для микроорганизмов, опухолевых и других клеток млекопитающих. In vitro вместе с пероксидом водорода и йодом уничтожает бактерии и паразитов, но неизвестно, каким образом это происходит in vivo. Вероятно, присоединение ЕРО к микробам делает их беззащитными к киллингу мононуклеарами. Активирует мастоциты с освобождением гистамина. Сочетание ЕРО + йод + Н2О2 инактивирует лейкотриены и запускает воспаление.
- Коллагеназа. Металлопротеин. Гидролизирует коллаген I и III типа, основной компонент соединительной ткани легких.
- Арилсульфатаза В. Разрушает дисульфидные связи.
- Бета-глюкоронидаза. Гидролизирует гликозиды.
Наряду с вышеуказанными протеазами выявлены катепсин, каталаза, АТФаза, гистаминаза, ацетилхолинестераза. В мелких гранулах зрелых эозинофильных гранулоцитов есть кислая фосфатаза.
Эозинофильны гранулоцит синтезирует лейкотриены, гликозаминогликаны (хондроитины-сульфат) и фактор активации тромбоцитов (PAF).
На мембране эозинофильные гранулоциты экспремируются различные классы поверхностных антигенов. Поверхностные рецепторы (молекулы) включают (значком «+» помечены молекулы, чья экспрессия усиливается при активации, «–» — экспрессия антигена снижается при активации, «!» — экспрессия индуцируется): PAF(+), лейкотриен В4 (LTB4), простагландин Е (PGE), глюкокортикоиды, CD69(!), CD4(!), HLA-DR(!), CD24(+), CD45(+), CD11b(+), CD11c(+), межклеточная адгезионная молекула-1 (ICAM-1;!), CD11a(–), CD29(–), L-ceлектин(–), CD49d, CD18(–), CD35(–), комплемент C5a, C3b/C4b, C3d, Clq, гранулоцит/макрофаг колониестимулирующий фактор (GM-CSF), фактор некроза опухоли (TNF), ИЛ-3 и -5, макрофагальный воспалительный протеин-1-альфа (MIP), поверхностная регуляция активации при нормальной Т-клеточной экспрессии и секреции (Regulated upon Activation in Normal T-cells Expressed and Secreted — RANTES), I1-2R(+), IgG(+), IgM, IgE, IgA (димер) и др. В мембране находится и лизофосфолипаза, более известная как кристаллы белка Шарко — Лейдена и воспринимаемая как символ эозинофильного гранулоцита, хотя этот белок типичен и для базофильных гранулоцитовов. Все указанные соединения относятся к классам рецепторов адгезии, связывания иммуноглобулинов, белков комплемента, липидных медиаторов. В то время как три последние группы рецепторов реализуются в иммунных реакциях, рецепторы адгезии служат для прикрепления эозинофильного гранулоцита к стенке сосуда и его миграции в ткани. Активированный эозинофильный гранулоцит в тканях существенно отличается по экспрессии своих поверхностных антигенов от эозинофильного гранулоцита из крови.
Чтобы попасть в ткани, эозинофильный гранулоцит должен прикрепиться к стенке сосуда. Клетки эндотелия выделяют специфические молекулы адгезии. К ним относятся ELAM-1 (молекула-1 эндотелиальной адгезии лейкоцитов), ICAM-1 (молекула-1 межклеточной адгезии), VCAM-1 (молекула-1 адгезии сосудистой клетки). В ранней фазе миграции эозинофильный гранулоцит покидает центральный поток крови и переходит на его периферию (маргинация), начинает буквально катиться по эндотелию. Скорость движения постепенно уменьшается и эозинофильный гранулоцит вступает в тесный контакт с локально выделяющимися из ткани в кровь медиаторами воспаления. На эозинофильный гранулоцит экспремируются новые молекулы адгезии: MAC-1, LFA-1, VLA-4. Они взаимодействуют с ICAM-1, ICAM-2, VCAM-1 и возникает прочная связь эозинофильного гранулоцита и эндотелиальной клетки. Под действием медиаторов хемотаксиса начинается диапедез эозинофильного гранулоцита в ткани.
Направление миграции определяется градиентом концентрации хемотаксических факторов. В качестве факторов хемотаксиса известны низко молекулярные (мол. м.=360–390) вещества (тетрапептид — фактор хемотаксиса эозинофилов — ЕСР-А; Ala-Gly-Ser-Glu; Val-Glu-Ser-Glu; гистамин), группа молекул средней массы (мол. м.=17 000–25 ООО, например, С5а, гидроксиэйкозотетраноевая кислота). Другие медиаторы — цитокины, белковые и липидные медиаторы — приведены в табл. 7.1.11.
Таблица 7.1.11
Факторы активации эозинофильных гранулоцитов и эффект их действия
| Медиатор | Эффект действия |
| Липидные медиаторы | |
| PAF | Адгезия, хемотаксис, дегрануляция, высвобождение производных арахидоновой кислоты, образование кислородных радикалов |
| LTB4 | Адгезия, дегрануляция, выосвобождение производных арахидоновой кислоты, образование кислородных радикалов |
| Иммуноглобулины | |
| IgG | Дегрануляция, фагоцитоз |
| (IgA)2 = димер | Дегрануляция, фагоцитоз |
| Белки системы комплемента | |
| С5а | Адгезия, дегрануляция, хемотаксис, освобождение производных арахидоновой кислоты, образование кислородных радикалов |
| Цитокины | |
| ИЛ-1 | Усиливает адгезию на эндотелии и дегрануляцию |
| ИЛ-3, -5 | Усиливает проницаемость, цитотоксичность и образование LT, снижает плотность клетки, стимулирует синтез протеогликанов, хемотаксис, образование кислородных радикалов |
| TNF-альфа | Повышает адгезию на эндотелии, образование кислородных радикалов, умеренно усиливает цитотоксичность |
| MIP-1 альфа | Хемотаксис |
| RANTES | Хемотаксис, образование кислородных радикалов |
Селективными хемотаксинами для эозинофильных гранулоцитов являются ИЛ-5 и RANTES. Существуют и другие механизмы, обеспечивающие избирательную фиксацию эозинофильных гранулоцитов и их проникновение в ткани. При определенном типе воспаления прежде всего опознаются и перерабатываются экзо- и эндогенные антигены антигенпрезентирующих клеток. Выброс цитокинов индуцирует дифференцировку Т- и В-клеток. Из С04-хелперов возникают Th-2-лимфоциты, которые также выделяют массу цитокинов. ИЛ-4 индуцирует экспрессию VCAM-1 на эндотелии. Поскольку комплементарную молекулу VLA-4 экспремируют только эозинофильные и базофильные гранулоциты, то и селективная адгезия возникает только с эозинофильными гранулоцитами или базофилами. ИЛ-4 и -13 образуются при аллергических реакциях и известны способностью вызывать «переключение изотипов» В-клетки в IgE-продуцирующую плазматическую клетку. Таким образом, ИЛ-4 и -13 обеспечивают образование IgE и специфического эозинофильного тканевого инфильтрата. Достигнув очага воспаления, эозинофильный гранулоцит некоторое время находится в спокойном, десенсибилизированном состоянии. Затем под влиянием местных цитокинов вновь активируется, начиная выделять перекисные соединения, липидные медиаторы и базисные протеины.
Дегрануляция — один из важнейших показателей активной деятельности эозинофильных гранулоцитов. Благодаря своим гранулам по данным электронной микроскопии «спокойный» эозинофильный гранулоцит характеризуется определенной плотностью, известной как нормальная. Таких эозинофильных гранулоцитов у здорового человека 90%. Активированный (дегранулированный) эозинофильный гранулоцит характеризуется сниженной плотностью и размеры его больше, чем у покоящейся клетки. Гиподенсные эозинофильные гранулоциты преобладают также среди внутритканевых форм, в полостях тела и в третьем пространстве. Дегрануляция вызывается массой факторов. Самый сильный раздражитель — поверхность, покрытая комплементом, и IgG. Именно на этом строится защита от гельминтов. Чуть слабее действуют С5а и PAF. Но высвобождение протеинов из гранул вызывают и свободные IgG и IgA, особенно димерный IgA в секрете слизистой оболочки. Димерный IgA имеет особое значение для дегрануляции эозинофильных гранулоцитов при аллергическом воспалении и рините. Механизм дегрануляции эозинофильных гранулоцитов изучен далеко не полностью. В спокойном состоянии эозинофильный гранулоцит здорового человека содержит большие вторичные гранулы с электронно-плотным ядром и менее плотным матриксом. У пациентов с БА или после стимуляции PAF в эозинофильном гранулоците происходит череда изменений. Начинается растворение ядра гранулы или матрикса вплоть до потери содержимого гранулы. Лизирующиеся гранулы сливаются, образуя большие цитоплазматические пузырьки. Выброс содержимого гранулы происходит при этом не путем разрыва пузырька на поверхности клетки, как это бывает у мастоцитов, а перекачиванием содержимого гранулы по мельчайшим канальцам тубуло-везикулярной системы.
Эозинофильный гранулоцит способен к фагоцитозу, но в «спокойном» состоянии фагоцитарная активность эозинофильного гранулоцита составляет едва ли ¼ фагоцитарной возможности нейтрофильного гранулоцита. Видимо, это объясняется слабой IgG-связывающей способностью эозинофильных гранулоцитов. Кроме того, в эозинофильных гранулоцитов, в отличие от нейтрофильных гранулоцитов, нет лизоцима и фагоцитина. То есть эозинофильный гранулоцит не приспособлен к уничтожению (киллингу) бактерий.
Эозинофильный гранулоцит способен de novo синтезировать целый спектр липидных медиаторов, производных фосфолипидов. Это PAF, LTC4, PGE2 (простагландин), PGD2, PGF2-альфа ТХА (тромбоксан А). Благодаря им эозинофильный гранулоцит и способен вызвать воспаление. ТХА особенно интересен тем, что способен стимулировать ген склероза. Видимо, это один из механизмов реализации фиброзообразования, являющегося логичным завершением повреждения тканей эозинофильными гранулоцитами.
Под действием PAF, С5а, GM-GSF, ИЛ-3 и -5, RANTES эозинофильный гранулоцит резко повышает собственный кислородный обмен, что известно как «кислородный взрыв» и объясняется активацией мембранной НАДФ-оксидазы. Возникают Н2О2, супероксиданион (О2), гидроксильный радикал (ОН). Указанные молекулы благодаря своему высокому окислительному потенциалу разрушают органические соединения, микроорганизмы и ткани. Нейтрофильные гранулоциты тоже способны образовывать кислородные радикалы, но у нейтрофильных гранулоцитов этот эффект очень краткосрочный, а кислородный обмен эозинофильных гранулоцитов остается измененным в течение 3 ч после стимуляции. Образование эозинофильными гранулоцитами свободных радикалов наряду с освобождением базисных протеинов играет основную роль в защите от простейших и в развитии токсического эффекта. То есть эффекторный механизм эозинофильных гранулоцитов реализуется по окислительному и неокислительному пути. Окислительный механизм строится на образовании токсических перекисных радикалов, которые самостоятельно или вместе с ЕР оказывают цитотоксический эффект. Неокислительный путь— действие белков (энзимов), независимых от метаболизма кислорода.
Эффекторный механизм эозинофильных гранулоцитов существенно определяется межклеточными взаимодействиями. Почти все тканевые и циркулирующие клетки (мастоциты, макрофаги, фибробласты, лейкоциты, тромбоциты, эндотелиальные клетки) способны выделять липидные медиаторы и цитокины. Тем самым они модулируют функцию эозинофильных гранулоцитов. В свою очередь, эозинофильный гранулоцит стимулирует воспалительную активность других клеток и, освобождая МБР, побуждает базофильные гранулоциты и мастоциты выделять гистамин (другие белки гранул — ЕРО, ЕСР, EDN — не влияют на выделение гистамина базофильными гранулоцитами). Но однозначности между эозинофильными гранулоцитами и гистамином нет. Доказано, что эозинофильный гранулоцит разрушает гистамин. Экстракт эозинофильных гранулоцитов уменьшает отек, вызванный гистамином, брадикинином или 5-гидрокситриптамином. Вполне вероятно, что одна из важных функций эозинофильных гранулоцитов — локализация эффекта некоторых биохимических медиаторов. Более того, эозинофильный гранулоцит содержит гистаминазу, арилсульфатазу в очень высоких концентрациях (инактивирует хемотаксические пептиды и медленно реагирующую субстанцию анафилаксии), фосфолипазу В и D (инактивирует PAF). То есть важнейшая функция эозинофильных гранулоцитов — демпфирование острых аллергических реакций. В очаге аллергического воспаления он находится не для того, чтобы поддерживать аллергическое воспаление, а чтобы гасить его и своими цитотоксическими продуктами уничтожать чужеродные клетки. Проникновение эозинофильных гранулоцитов в очаг воспаления — ошибочная реакция клетки на чужеродный белок, напоминающий белок гельминта.
Эозинофильный гранулоцит, в противоположность нейтрофильным гранулоцитам, тесно связан с иммунной системой. Эозинофильный гранулоцит выступает как иммуностимулирующая и как иммуносупрессивная клетка. С одной стороны, эозинофильный гранулоцит — это клетка-киллер. Но, в противоположность нейтрофильному гранулоциту, его активность направлена не на бактерии, а на гельминтов. С другой стороны, это иммуномодулирующая клетка, стремящаяся минимизировать иммунный ответ и предотвратить ненужные реакции разрушения. Равновесие между этими двумя функциями эозинофильных гранулоцитов очень неустойчивое.
В целом функцию эозинофильных гранулоцитов можно суммировать следующим образом:
- Защита от гельминтов (ларвальных и зрелых форм):
- прикрепление эозинофильного гранулоцита к поверхности гельминта;
- перекисное окисление оболочки гельминта пероксидазой;
- токсический эффект МБР.
- Подавление реакции гиперчувствительности немедленного типа:
- поглощение гранул мастоцитов;
- синтез PGE1/PGE2 и подавление реакции дегрануляции нейтрофильных гранулоцитов;
- выделение гистаминазы;
- окисление медленно реагирующей субстанции анафилаксии (SRS-A);
- выброс фосфолипазы D и инактивация мастоцитарного фактора активации тромбоцитов;
- освобождение МБР, блокирующего гепарин мастоцитов;
- экскреция плазминогенадля уменьшения местного тромбообразования.
Эозинофильный гранулоцит и его продукты участвуют во многих патологических реакциях от паразитарных инфекций до аллергических и онкологических заболеваний. При этом возможно как уменьшение, так и увеличение их количества.
Эозинопения обычно вызывает у врача меньше вопросов, чем эозинофилия. Еще в конце XIX в. была отмечена связь между инфекцией и эозинопенией. Доказано, что эозинопения возникает при бактериальных и вирусных инфекциях, обострении хронических инфекций (например туберкулез), системной красной волчанке. Чаще эозинопения возникает при стертом течении инфекции. Но кокцидиомикоз и пневмоцистоз сопровождаются эозинофилией. Существовало мнение, что эозинопения при инфекционных заболеваниях обусловлена стимуляцией надпочечников. Однако от этой гипотезы заставило отказаться несоответствие между уровнем глюкокортикоидов крови и количеством эозинофильных гранулоцитов, эозинопения у адреналэктомированных животных на фоне инфекции. Более приемлема гипотеза о депонировании эозинофильных гранулоцитов в области воспаления, их дегрануляции (уровень ЕСР повышен в 1-й день инфекции) и затруднении освобождения эозинофильных гранулоцитов из костного мозга.
Эозинофилия привлекает больше внимания и известна для таких состояний:
- аллергические состояния (астма, крапивница, лекарственная болезнь). Возможна лейкемоидная реакция с количеством эозинофильных гранулоцитов до 20 тыс./мкл. При хроническом аллергическом состоянии количество эозинофильных гранулоцитов редко превышает 2 тыс./мкл;
- высокая лихорадка;
- дерматиты, пузырчатка, синдром Лайела, токсический эпидермолиз, эндокардит Лефлера, эозинофильные инфильтраты;
- паразитозы (гельминтозы, пневмоцистоз, амебиаз, малярия, чесотка);
- кокцидиомикоз, цитомегаловирусная пневмония, болезнь кошачьей царапины;
- хронический гепатит (до 30% случаев);
- болезнь Крона, неспецифический язвенный колит;
- стеноз аорты или легочной артерии;
- лимфома Ходжкина (до 20% больных) и неходжкинская лимфома; опухоли мозга; миелопролиферативный синдром; лучевая терапия интраабдоминальных опухолей (в первые несколько недель после начала лечения), опухоли яичников;
- наследственная эозинофилия. Доброкачественное состояние с нарушением регуляции образования эозинофильных гранулоцитов.
Достаточно давно известна связь между увеличением количества эозинофильных гранулоцитов и паразитозами. В отдельных случаях концентрация эозинофильных гранулоцитов в периферической крови может достигать 80%. Наиболее существенную эозинофилию в наших условиях вызывают нематоды. Но с эозинофилией могут протекать инфекции простейшими и эктопаразитами. Эозинофильный гранулоцит буквально распластывается по поверхности паразита и выделяет свои токсические белки и перекисные радикалы. Эти соединения совместно перфорируют оболочку паразита, нарушая его обмен и давая возможность макрофагам и цитотоксическим лимфоцитам внедриться в гельминта.
Бронхиальная эозинофилия рассматривается как характерный признак БА. В свою очередь, БА известна как эозинофильный бронхит. В тяжелых случаях эозинофильные гранулоциты инфильтрируют всю стенку бронха вплоть до паренхимы легких. Активированный эозинофильный гранулоцит вызывает разрушение тканей. Поэтому количество и объем эозинофильных инфильтратов хорошо коррелируют с тяжестью БА. В крови у больных выявляют МБР. Его концентрация коррелирует с уровнем эозинофилии. В бронхиальном секрете при БА концентрация МБР достаточна для цитотоксического эффекта. PAF активированных эозинофильных гранулоцитов в слизистой оболочке трахеи за 4–14 ч. снижает частоту колебаний ресничек с 12 до 2 Гц. Одновременно происходит слущивание эпителия, что приводит к гиперреактивности бронхов и утере барьерной функции.
Достаточно давно известна связь между атопическим дерматитом и эозинофилией. Через 2–6 ч после контакта с аллергеном в коже концентрируются эозинофильные гранулоциты. В качестве косвенного доказательства роли эозинофильных гранулоцитов в развитии атопического дерматита указывают на периодическую эозинофилию в крови. Эти эозинофильные гранулоциты уже пре- активированы и на стимуляцию цитокинами или PAF реагируют проникновением в ткани или усиленным образованием перекисных соединений. Подтверждением преактивации эозинофильных гранулоцитов служит высокая концентрация в крови базисных белков, например ЕСР. Примечательно, что эозинофильные гранулоциты при атопическом дерматите задействован не только при острой реакции, но и при хроническом течении и ответственен за лихенификацию кожи. Это становится понятным с учетом вышеприведенных сведений о склонности эозинофильных гранулоцитов к стимуляции фиброзообразования.
Из вышесказанного можно сделать вывод, что для ряда патологических состояний уже известен эффект эозинофильного гранулоцита как токсической эффекторной клетки. Решающим для формирования клинической картины является вид пораженной ткани. Инфильтрация стенки бронха обусловливает типичное слущивание эпителия, гиперреактивности. При атопическом дерматите поражаются прежде всего поверхностные слои кожи. Если иммунологический стимул исходит из сосудов или легочного интерстиция, развивается васкулит или интерстициальная пневмония.
Но мы считаем, что эозинофильный гранулоцит как цитотоксическая единица задействован в значительно большем количестве патогенетических реакций, хотя его традиционно связывают с гельминтозами, БА, атопическим дерматитом. Например, эозинофильные инфильтраты в поджелудочной железе известны при аутоиммунных инсулитах, ведущих к сахарному диабету 1-го типа. Именно в этих случаях разыгрывается бурный цитокиновый всплеск, приводящий к повреждению бета-клеток. Мы установили, что эозинофильные инфильтраты в стенке двенадцатиперстной кишки типичны для вялотекущих гастродуоденитов у пациентов с наследственной генерализованной дисплазией соединительной ткани. Системной склеродермии (ССД) иногда свойственно увеличение количества эозинофильных гранулоцитов. Последнее воможно почти у 1/3 больных. В свое время даже указывали на большое значение стернальной пункции в диагностике и оценке прогноза системной ССД. При этом у пациентов с прогрессирующей ССД находили выраженную эозинофилию, снижавшуюся в фазе ремиссии и повышавшуюся в активной фазе. В нашей группе больных (В. М. Делягин) из 173 детей с ССД эозинофилия (6% и более; М±ш=10,4±0,38%) была у 45 (26%). Из них у 19 уровень эозинофилии превышал 10% (максимально — 19%). Из этих 19 детей 12 были младше 7 лет, и заболевание характеризовалось быстро нарастающим и ндуративным отеком, синдромом васкулита, высокой степенью активности. Уровень эозинофилии коррелировал с признаками эндокардита (r=0,6907; р<0,01), миокардоза (r=0,3653; р<0,01), кардиосклероза (r=0,3653; р<0,05), наличием выпота в полости перикарда (r=0,5266; р<0,005). В первые 6 мес заболевания отмечают сильную положительную корреляционную связь между количеством эозинофилов и уровнем IgE (r=0,4257; р<0,05). Через 6 мес эта связь становится отрицательной: при снижении концентрации IgE зафиксировано увеличение количества эозинофильных гранулоцитов и наоборот (р<0,05). Именно в группе больных с ССД и эозинофилией сконцентрировались пациенты с акросклеротическим вариантом ССД, которая формируется на фоне врожденного синдрома дисплазии соединительной ткани — долихостеномелии.
Таким образом, функции эозинофильного гранулоцита оказываются неоднозначными: от защитных до цитотоксических. Он принимает активное участие в патогенезе многих заболеваний, которые далеки от привычных аллергических реакций. Новое понимание функций эозинофильных гранулоцитов как цитотоксической эффекторной клетки открывает перспективы профилактической терапии. Она заключается в модуляции эффекторной активности эозинофильных гранулоцитов. Изучаются действие антител к рецепторам адгезии, нейтрализация эозинофильных гранулоцитов путем антиоксидации, буферирование основных протеинов эозинофильных гранулоцитов отрицательно заряженными белковыми молекулами или положительно заряженным гепарином. Но в практическом плане наиболее перспективны и в ряде случаев уже опробованы методики изменения реактивности эозинофильных гранулоцитов путем применения циклоспорина А или антител к цитокинам.
Моноцитоз — увеличение количества моноцитов выше 0,8⋅109/л. Инфекционный моноцитоз возникает при сифилисе, бруцеллезе, трипаносомозе, подостром инфекционном эндокардите и туберкулезе (хронические инфекции), саркоидозе, миелопролиферативных заболеваниях, моноцитарной лейкемии. Инфекционный моноцитоз, как правило, сочетается с нейтропенией. Моноцитоз возможен при хроническом воспалении (особенно при холецистите и РА). Умеренный моноцитоз у детей может возникать при выздоровлении после пневмонии. Трудно классифицируемый моноцитоз у людей старческого возраста может быть прелейкемическим состоянием. Моноцитоз выявляют после спленэктомии.
Лимфоцитоз — увеличение количества лимфоцитов более 4,0⋅109/л. Типичен для течения многих инфекционных заболеваний. Лимфоцитоз за счет зрелых форм с маленьким пояском цитоплазмы отмечают при выздоровлении после брюшного тифа, пневмонии и многих других заболеваний. При болезни Банга количество лимфоцитов может достигать 60%, и тогда они становятся диагностическим критерием. У детей грудного и младшего возраста возможен инфекционный лимфоцитоз (до 20–30 тыс.⋅109/л) как бессимптомная эпидемическая форма. Хронические инфекции (туберкулез и сифилис) могут протекать с лимфоцитозом. Лимфоцитоз типичен для воспалительных и иммунокомплексных болезней. Лимфоцитарную реакцию с появлением большого количества клеток с широкой слабо окрашенной цитоплазмой выявляют при мононуклеозе, при острой цитомегаловирусной инфекции и в начале СПИДа. В меньшем количестве эти клетки (вироциты) характерны при гепатите и вирусной пневмонии. Плазмоцеллюлярную реакцию отмечают при гепатитах и аллергических состояниях. Среди злокачественных лимфопролиферативных заболеваний с высоким лимфоцитозом чаще выявляют хронический лимфолейкоз, типичный для людей в возрасте старше 45 лет. Отличительной особенностью этого лимфоцитоза является его моноклоновый характер и В-клеточное происхождение.
Лимфоцитопения — уменьшение количества лимфоцитов менее 1,2⋅109/л. Достаточно редко. Может быть при кортикостероидной терапии, типична для лимфогранулемы и СПИДа.
7.2. Лихорадочные состояния бактериальной, вирусной, грибковой и протозойной этиологии
Ранее были рассмотрены общие синдромы и признаки, типичные для многих заболеваний или возбудителей. Например, пневмония может быть результатом стрепто-, стафиллококковой, легионеллезной или другой инфекции. Рожу обусловливают стрептококки, в редких случаях — стафиллококки. Поэтому врач при ДД всегда стремится провести более детальный поиск причин лихорадочных состояний.
Бактериальные инфекции
В пользу бактериальной инфекции свидетельствуют:
- признаки инфекционного заболевания (лихорадка, цикличность, характерные лабораторные сдвиги);
- наличие местного очага гнойной инфекции (пневмония, рожа, менингит, отит и др.);
- лейкоцитоз с нейтрофилезом и омоложением нейтрофильных гранулоцитов («сдвиг влево»);
- повышение СОЭ;
- положительная проба на СРБ;
- высев флоры, которая, с точки зрения клинициста, может быть причиной клинической картины;
- соответствующие клинические находки.
В современных условиях все большее значение приобретает так называемая условно патогенная флора. Центром по контролю заболеваний (CDC — Centers for diseases control and prevention) разработаны критерии диагностической значимости выделенной условно-патогенной флоры из стерильных сред организма. Согласно этим критериям, необходимо выявление хотя бы одного из признаков:
- апноэ;
- брадикардия;
- нарушение терморегуляции (температура тела >38 или <36 °C).
В сочетании с одним из нижеуказанных:
- повторный положительный посев крови в течение 24 ч после первой положительной гемокультуры;
- наличие внутрисосудистого катетера и проведение антибактериальной терапии в течение 96 ч до первого положительного посева крови — подтверждение того, что выделенный условно-патогенный микроорганизм является этиологическим фактором, а не контаминирующим. Особенно подчеркивается необходимость забора крови для повторного исследования гемокультуры не позднее 24 ч после первого исследования и только из периферической вены путем венопункции, поскольку при взятии крови из катетера существует высокий риск контаминации условно-патогенными микроорганизмами, колонизирующими катетер.
Стафилококки. Патогенные стафилококки выявляют повсеместно. У 20% здоровых взрослых людей их выявляют в полости носа и 35% — на коже. У госпитализированных больных они еще чаще и представлены в основном антибиотико-устойчивыми штаммами. К стафилококковой инфекции предрасположены новорожденные и кормящие грудью женщины, а также пациенты с гриппом, хроническими неспецифическими заболеваниями легких, лейкозами, опухолями, трансплантатами и имплантатами, ожогами, после обширных хирургических вмешательств, с хроническими заболеваниями кожи, сахарным диабетом. Наиболее важным с точки зрения клинициста ранее был золотистый стафилококк. Сейчас на 1-е место выдвигается эпидермальный стафилококк. Так, 67–86% всех случаев бактериемий у новорожденных обусловлены грамположительной флорой, причем по итогам каждого второго высева выявляют эпидермальный стафилококк. До 20% неосложненной инфекции мочевыводящих путей у женщин обусловлены эпидермальным стафилококком.
Стафилококки вызывают преимущественно гнойную инфекцию, наиболее вероятные формы — фолликулит, импетиго, пиодермия, фурункул, карбункул, панариций. Глубокая инфекция мягких тканей в 25% протекает с бактериемией. В крайне редких вариантах возможны острейшие случаи с токсическим шоком у женщин с менструальным циклом за счет контаминации стафилококком тампона.
Возможна типизация с помощью фагов, но в практике эта процедура чаще всего бессмысленна и имеет значение только с позиций эпидемиологии (очаг заражения, пути распространения инфекции при нарушении гигиенических норм). В современных условиях благодаря антибиотикам генерализованная стафилококковая инфекция отошла на задний план, ее развитие заставляет искать недостаточность иммунитета пациента. Так, рецидивирующие стафилококковые инфекции у детей протекают при гипер-IgЕ-синдромах, септическом гранулематозе. Сочетание аллергического ринита и рецидивирующих стафиллококковых абсцессов типично для интерметтирующих нарушений хемотаксиса гранулоцитов. Токсический шок характеризуется высокой температурой, потерей сознания, рвотой, диареей, кожной геморрагической сыпью. Типичны шелушение ладоней и подошв после выздоровления, что напоминает постстрептококковые. Стафилококковые менингиты редки, диагностируются у пациентов с иммуносупрессией, у людей с приобретенным или врожденным агранулоцитозом или, преимущественно, у недоношенных и новорожденных. Сравнительно часто развиваются после наложения шунтов по поводу внутричерепной гипертензии.
Абсцедирующие стафилококковые пневмонии — типичное осложение кори, коклюша, муковисцидоза, недостаточности альфа-1-антитрипсина. Стафилококки способны вызвать остеомиелит, артриты.
Особая форма стафиллококковой инфекции — энтерит, развивающиеся через ½–4 ч после употребления недоброкачественной пищи и проявляющийся (иногда массово) выраженной рвотой и водянистой диареей с тенезмами. Возможны шоковые реакции с недостаточностью кровообращения и коллапсом.
Выявлено (Кривоножко А.В., 2000), что при дебюте стафилококковой генерализованной инфекции повышается уровень СРВ (для недоношенных такой реакции не отмечено).
Стрептококковую инфекцию вызывают иммунологические типы А (пиогенный стрептококк, бета-гемолитический), В, С, G и D (энтерококки), а также не типированный зеленящий стрептококк (подострый бактериальный эндокардит). Группы выделяют по характеру роста на кровяном агаре. Бета-гемолитический стрептококк при росте дает колонии, окруженные светлой зоной гемолиза. Альфа-гемолитический стрептококк (зеленящий — Streptococcus viridans) назван так потому, что колонии окружены зеленоватым ободком неполного гемолиза. Гамма-стрептококки — не гемолитические. Менее известна классификация по углеводам клеточной стенки.
Группа А поражает в основном детей и людей молодого возраста (фарингиты, тонзиллиты, импетиго, средний отит, скарлатина, рожа, раневая инфекция, острый гломерулонефрит, реже — пневмония, ревматическая лихорадка. У новорожденных — менингит и сепсис).
Группа В поражает новорожденных и редко высевается у больных пожилого возраста с пиелонефритом, пневмонией, остеомиелитом и эндометритом на фоне сахарного диабета. У лиц с сепсисом, вызванным Str. bovis, часто выявляют карциному толстой кишки. Инфекция Str. milleri часто осложняется абсцессами внутренних органов, мозга и эндокардитом.
Группы С и G бета-гемолитического стрептококка представлены микроорганизмами, напоминающими Str. pyogenes и различающихся по серологии и устойчивости к бацитрацину. У животных и человека колонизируют глотку, кишечник, влагалище, кожу. Могут вызвать тяжелые инфекционные заболевания, в том числе фарингит, пневмонию, пиодермию, рожу, импетиго, раневую инфекцию, пуэрперальный сепсис, неонатальный сепсис, эндокардит, септический артрит, постстрептококковый гломерулонефрит. Инфекция особо опасна для лиц с иммуносупрессией, с имплантированными инородными телами, новорожденных, лиц старческого возраста.
Группа D, обычно альфа или гамма-гемолитические, способна вызвать инфекции мочевых путей, инфекционный эндокардит, перитонит, поражение желчных путей и кишечника.
Зеленящие стрептококки представлены Str. mutans, Str. sanguis, Str. salivarius, Str. mitior и Str. milleri. Последний подразделяется еще на Str. constellatus, Str. intermedius, Str. anginosus. Хотя зеленящий стрептококк относят к альфа-гемолитическим, многие представители являются гамма-гемолитическими, а многие вообще не классифицированы. Колонизирует полость рта, предохраняя тем самым ее от заселения Pseudomonas и кишечными микроорганизмами. Большинство зеленящих стрептококков лизируются сывороткой и не образуют экзотоксина. Тем не менее они являются важным этиологическим фактором инфекционного эндокардита, так как способны прикрепляться к клапанам сердца, особенно предварительно измененным. Представители группы Str. milleri в разной степени гемолитические, микро-аэрофильные или анаэробные и характеризуются способностью вызывать абсцессы или генерализированную инфекцию.
Str. iniaе — патоген рыб. Способен вызвать местную локализованную и распространенную инфекцию у людей с повреждениями кожи и занятых обработкой свежей рыбы.
Заболевания, вызываемые гемолитическим стрептококком группы А, характеризуются коротким инкубационным периодом и острым началом с повышением температуры тела. Тяжелые формы скарлатины обусловливает серотип 10 штамма А, почечные осложнения наиболее вероятны при серотипах 4; 12 или 25. Наиболее опасными в эпидемиологическом отношении являются носители стрептококка в полости носа, а не на миндалинах. Резервуар инфекции создается в ЛОР-отделениях. Через 5 дней пребывания там ребенка с хроническим тонзиллитом его можно считать носителем гемолитического стрептококка. В других отделениях источник — это руки хирурга, плохо обработанные кушетки, мебель, подкладные судна и т. п. Возможны стрептококковые гастроэнтериты.
Скарлатина — классическое заболевание стрептококковой этиологии. Начинается остро с повышения температуры тела, головной боли, однократной рвоты. Типична ангина. Ангина — достаточно характерное проявление скарлатины и может быть настолько мучительной, что послужила основанием для испанского названия этой болезни: Garrota (железный ошейник). Щеки яркие, носогубный треугольник бледный (при тяжелом течении скарлатины изменяется и он). Язык обложен. На 2–5-е сутки происходит постепенное очищение языка, начиная с краев и кончика, с образованием картины «малинового языка». Мелкоточечная сыпь на гиперемированной сухой шершавой коже, излюбленная локализация в естественных складках. Яркая сухая кожа позволила Сиденгаму дать болезни название, применяемое до сих пор: scarlet fever (пурпурная лихорадка). Появление новых экзантем можно спровоцировать пробой Кончаловского — Румпеля — Леде. На 7–10-й день начинается шелушение кожи, преимущественно на ладонях, подошвах, кончиках пальцев, мочках ушей. Чем тяжелее протекало заболевание, тем выраженнее шелушение. Дермографизм белый. На 5–6-й день появляются аритмия, брадикардия. Экстрабуккальная скарлатина (атипичная, не связанная с ротоглоточным кольцом): ожоговая, раневая, пуэрперальная. Отличия: короткий инкубационный период, сыпь первоначально появляется вокруг входных ворот.
В настоящее время повторные случаи скарлатины регистрируют с частотой около 4%, прежде — 1–1,5%. Такая динамика частоты повторных случаев скарлатины объясняется ранним применением антибиотиков с быстрой элиминацией флоры, когда организм не успевает выработать надежный иммунитет. 80% всех повторно болеющих переносят скарлатину более 2 раз. 1/3 из них переболели скарлатиной первый раз в возрасте до 3 лет, то есть речь идет об иммунитете незрелого организма. Иммунитет антитоксический, поэтому переболевший скарлатиной может заболеть другими формами стрептококковой инфекции: рожа, импетиго, отит, мастоидит, синусит, абсцессы, флегмоны, некротизирующий фасциит, миозит.
В современных условиях описывают токсический шок, обусловленный стрептококком. Вызывается Str. aureus группы А бета-гемолитического стрептококка, продуцирующего пирогенный экзотоксин. Развивается у внешне здоровых иммунокомпетентных молодых людей чаще после минимальных травм. Характеризуется острым началом, фульминантным течением по типу стрептококкового молниеносного сепсиса. Летальность составляет около 50%. Объясняется, видимо, предшествующей сенсибилизацией с развитием шоковой реакции разрешения после попадания стрептококкового токсина.
Через 10–21 дней после стрептококковой инфекции возможно развитие острого гломерулонефрита или ревматизма.
Пневмококки (Str. pneumoniae) вызывают лобарные пневмонии, менингиты. В настоящее время известны более 80 типов, различаемых по капсульным антигенам. Часто выявляют у здоровых. Наиболее вероятные типы пневмококков при серьезных инфекционных заболеваниях у взрослых — 1, 3, 4, 7, 8 и 12, у младенцев и детей — 6, 14, 19, 23.
Пневмококки связывают с хроническими бронхитами, отитами, мастоидитами, септическими артритами. Особенно активны у людей с удаленной селезенкой, при нефротическом синдроме, гемоглобинопатиях и серповидноклеточной анемии, с нарушениями иммунитета (СПИД, лимфомы, лейкозы).
Hemophilus influenzae персистирует в верхних дыхательных путях. У детей вызывает эпиглоттиты, менингиты, отиты. Наиболее известен как суперинфекция после вирусных заболеваний. Микроб типичен для хронических бронхитов, синуситов. Особо хорошо размножается у ВИЧ-инфицированных. Для врача важно знать, что микроб крайне неустойчив: не переносит длительной транспортировки, охлаждения, требует только свежих сред. Культуральные исследования часто ложноотрицательны. Если в вашей клинической практике длительно не высевается гемофильная палочка, что-то «гнило в датском королевстве (лаборатории)».
Менингококки. Имеется 4 основных типа (А, В, С, D). Вызывают два самых известных заболевания этой группы: эпидемический менингит (преимущественно у детей) и менингококковый сепсис, в патогенезе которого большая роль принадлежит диссеминированному внутрисосудистому свертыванию. Наряду с катастрофическим течением по типу синдрома Уотерхауза — Фридериксена отмечают менее злокачественные варианты с лихорадкой, артралгиями, геморрагической сыпью, некрозами. Реже вызывает пневмонии, перикардиты, отиты, артриты. Резервуар — назофарингеальное бессимптомное носительство и нелеченые ринофарингиты.
Гонококки у женщин чаще дают аногенитальную бессимптомную инфекцию, у мужчин симптоматика этого варианта выражена ярче. До 3% всех случаев гонококковой инфекции протекают по типу кожно-артритического синдрома с артралгиями, тендосиновитом и высыпаниями, напоминающими варицеллезные и эволюционирующими как ветряночные. Везикула располагается на ярком инфильтрированном основании. Отличия: эпиданамнез, везикул мало, обычно в пределах двух десятков, располагаются на дистальных отделах конечностей, положительные серологические пробы. Гнойные артриты больших суставов — другое типичное проявление гонококковой инфекции.
Псевдомонады (Pseudomonas aeruginosa, maltophilia, sepacia и др.) обычно обитают в воде, водопроводах, увлажнителях, аппаратах искусственного дыхания. Ps. pseudomallei вызывает сапоподобное заболевание (мелиоидоз). Ps. pseudomallei (Burkholderia pseudomallei) выявляют в почве и воде. Человек заболевает мелиоидозом при загрязнении раневых или ожоговых поверхностей, с пищевыми продуктами или ингаляционно, но не в результате непосредственного контакта с больным животным или человеком.
Псевдомонада — типичный возбудитель нозокомиальных инфекций: септикопиемии, менингита, эндокардита после оперативных вмешательств, имплантации эндопротезов, искусственнной вентиляции легких. Вызывает абсцессы легких у больных с муковисцидозом, язвы роговицы после применения контаминированных глазных капель, инфекции мочевых путей после катетеризации и т. п. Возможно поражение любого органа. Характерно зеленое или зелено-желтое окрашивание гноя или мокроты, при сепсисе — гипотермия и некрозы подкожной жировой клетчатки.
Escherichia coli — один из наиболее частых возбудителей менингита у недоношенных и новорожденных детей, инфекций мочеполовой системы у детей и взрослых, сепсиса. Токсигенные и энтеропатогенные штаммы являются этиологической причиной «диареи путешественников». Энтероинвазивные штаммы проникают в слизистую оболочку толстого кишечника и вызывают шигеллезноподобную клиническую картину. Заболевание начинается остро с повышения температуры тела. Затем появляется боль в животе (особенно в левой подвздошной области), усиливающаяся при позывах на дефекацию, и тенезмы. Пальпируется спазмированная болезненная сигмовидная кишка. Частота стула и характер его нарушений (слизь, гной, прожилки крови) зависят от тяжести процесса.
Веротоксинобразующие штаммы способны вызвать гемолитико-уремический синдром.
Клебсиелла — естественный обитатель респираторного и интестинального трактов — возбудитель острой пневмонии (до 5% всех случаев), хронических неспецифических заболеваний легких, синуситов, мастоидита, инфекции мочевых путей, холецистита. При приобретенных или врожденных нарушениях иммунитета способна вызвать сепсис.
Протей (Proteus vulgaris, mirabilis) и другие энтеробактерии (Morganella morgana, Providencia rettgeri) в естественных условиях персистируют в толстой кишке взрослых. Способны вызвать инфекцию мочевых путей, менингит, абсцессы. К этому же семейству относятся Enterobacter, Serratia, Providencia, Citrobacter, приобретшие в последнее время репутацию возбудителей нозокомиальных инфекций, в том числе септикопиемии.
Сальмонеллы (Salmonella enteritidis, typhi, typhimurium и др. (всего известно более 2200 серотипов). Сальмонеллы подразделяют на три группы:
- Высоко адаптированные к хозяину-человеку S. typhi, S. paratyphi А, В (S. schottmulleri), С (S. hirschfeldii). Патогенны только для человека. Вызывают «энтеритическую лихорадку».
- Патогенны для животных. Но 2 вида — S. dublin и S. choleraesuis — патогенны также и для человека.
- Не адаптированные к какому-либо специфическому хозяину. Эта группа, самая многочисленная из трех, представлена S. enteritidis, насчитывающей более 2000 серотипов и ответственна более чем за 85-90% всех случаев сальмонеллеза.
Сальмонеллез протекает обычно как энтерит и гастроэнтерит после употребления инфицированных молока, мяса, яиц и других пищевых продуктов. Инкубационный период — 6–48 ч. Начинается с повышения температуры тела, тошноты, рвоты, водянистого стула, схватокообразной боли в животе. Для новорожденных характерны пневмония и сепсис. Как внутрибольничная инфекция очень опасна, для надежного обеззараживания помещения требуется его двукратная побелка и покраска.
Брюшной тиф начинается после 10-дневного безлихорадочного или протекающего с легким субфебрилитетом инкубационного периода. В дебюте заболевания выражены утомляемость, повышение температуры тела до 40 °C, озноб, головная боль, кашель. Возможен запор, реже — диарея. Не исключено развитие ступора, хотя чаще развивается апатия, заторможенность, дезориентация (греч. «thyphos» — туман). На 7–10-й день болезни на коже появляются розеолы: светло-розовые овальные эффлоресценции, исчезающие при надавливании. Расположены преимущественно на нижних частях грудной клетки, на животе и спине. Клиническую картину дополняют относительная брадикардия, спленомегалия, тромбоцитопения и лейкопения со сдвигом формулы влево при отсутствии эозинофильных гранулоцитов, положительная гемокультура. В 20% случаев развиваются благоприятно текущие рецидивы. Приблизительно у 3% нелеченных пациентов микроорганизмы выявляют в кале более года (хроническое носительство). У ряда носителей не удается получить каких-либо анамнестических сведений о перенесенном заболевании. Большинство хронических носителей — престарелые женщины с заболеваниями желчных путей. Данные, полученные в длительных наблюдениях свидетельствуют, что у хронических носителей S. typhi вероятность заболевания раком желчевыводящих путей выше, чем в популяции. ДД с паратифами А (редок), В и С (крайне редок) строится на их более легком течении и, в основном, на бактериологических исследованиях.
Шигеллез отличается колитическим синдромом, в кале определяют слизь и кровь.
Род Shigella подразделяют на 4 большие подгруппы: А, В, С и D. Распространены по всему миру. 10–12% всех случаев инфекционной диареи обусловлены именно шигеллами. Шигеллы проникают в слизистую оболочку нижних отделов тонкого кишечника, вызывая секрецию слизи, гиперемию, лейкоцитарную инфильтрацию, отек и, достаточно часто, поверхностные язвы слизистой оболочки. Водянистая диарея при шигеллезе может быть обусловлена энтеротоксином, который вызывает избыточную секрецию в тонком кишечнике. Эпидемии возникают в популяциях с плохими санитарными условиями. Шигеллез нередко возникает у детей младшего возраста, живущих в эндемичных очагах. Летальный исход при отсутствии лечения у детей возможен в первые 12 дней. У взрослых шигеллез протекает значительно легче. После 1–4-дневного инкубационного периода заболевание может начаться с диареи, тенезмы не выражены или вообще отсутствуют. Затем присоединяется схваткообразная боль в животе, тенезмы, появляются слизь и кровь в кале. При тяжелых тенезмах возможен пролапс прямой кишки и недержание кала. Возможны такие осложнения, как токсический неврит, артрит, миокардит, очень редко — перфорация кишечника.
Диагноз «шигеллез» (бациллярная дизентерия) при наиболее частом современном варианте — водянистой диарее — клинически требует дифференциации с другими бактериальными, вирусными или протозойными инфекциями. При проктоскопии слизистая оболочка диффузно гиперемирована, с большим количеством мелких язв. Мазок, взятый с поверхности язвы, необходимо тут же подвергнуть микроскопии (простейшая окраска — метиленовым синим) и посеять для культуральных исследований. В мазке под микроскопом удается выявить буквально слои лейкоцитов, что отличает шигеллез от амебиаза (амебы разрушают лейкоциты). Бактерии в мазке не имеют специфических характеристик. У пациентов с острыми формами бациллярной дизентерии ДД следует проводить с инфекциями, вызванными инвазивными формами Escherichia coli, Salmonella, Yersinia, Campylobacter, амебами, вирусами.
Вибрион холеры за счет энтеротоксина через 2–5 дней после инфицирования вызывает повышение температуры тела. Диарея вначале с кашицеобразным коричневым стулом, затем водянистым, в тяжелых случаях по типу «рисового отвара». Объем испражнений может достигать 10 л/сут, что вызывает развитие ацидоза с тошнотой и рвотой, судорог. Обезвоживание в сочетании с артериальной гипотензией обусловливает развитие острой почечной недостаточности по внепочечному механизму. Диагноз устанавливают с учетом данных микроскопических и культуральных исследований.
Campylobacter jejuni, coli — подвижные изогнутые микроаэрофильные грамотрицательные бациллы, передаются через инфицированные жидкости, пищу и от животных. Вызывают развитие острого гастроэнтерита с повышением температуры тела, диареей, схваткообразной болью в животе, тошнотой и рвотой. В испражнениях — слизь, прожилки крови, гранулоциты. Через 2–4 дня в 80% случаев наступает выздоровление, у остальных пациентов заболевание затягивается до 2 нед. У пациентов с HLA В-27 возможно развитие реактивного артрита. Более редкие осложнения — менингит, эндокардит, холецистит. Отмечена корреляция между летними подъемами заболеваемостью диареей, обусловленной С. jejuni, и последующим заболеванием синдромом Гийена — Барре. Helicobacter (Campylobacter) pylori считается доказанной причиной развития гастрита и пептической язвы двенадцатиперстной кишки.
Псевдотуберкулез и иерсиниоз (вызванные Yersinia pseudotuberculosa, entero colitica) — антропозоонозы (телята, свиньи, кошки, собаки). Животные-носители, как правило, клинически здоровы. Манифестируют преимущественно у детей и подростков с лихорадки, аппендицитоподобной боли, лимфаденопатии, кожной сыпи, лейкоцитоза (дальневосточная скарлатиноподобная лихорадка; псевдотуберкулез). До 1/3 больных переносят олиго- или полиартрит, узловатую эритему. Диагноз основывают на результатах культуральных (кровь, кал) и серологических исследований. У алкоголиков, пациентов с иммунодефицитными состояниями, при сахарном диабете и болезнях печени возможен септический вариант течения.
Дифтерия — острое контагиозное заболевание, вызванное Corynebacterium diphtheriae, характеризующееся образованием фибринозных псевдомембран (обычно на слизистой оболочке дыхательного тракта) и вторичным токсическим поражением миокарда и нервной системы. Единственным резервуаром инфекции является человек. Заболевание может возникнуть даже у иммунизированных. Особенно тяжелые формы оно принимает у непривитых или привитых неэффективно. Контагиозность у нелеченных пациентов сохраняется не более 2 нед. При лечении антибиотиками (антибиотики включаются только с целью сократить срок персистенции коринебактерий и уменьшить тем самым срок токсинемии; специфическое лечение — только антитоксин) контагиозность пациента сохраняется не более 4 дней. Но случаи хронического носительства формируются после лечения антибиотиками. С. diphtheriae (в зависимости от степени токсигенности подразделяется на 3 вида) вследствие выделения палочкой-возбудителем цитотоксина вызывает повышение температуры тела, интоксикацию, местный лимфаденит и отек тканей, воспаление миндалин, трахеи или слизистой оболочки полости носа, глаз с образованием грязно-серых налетов. Вначале они снимаются, но быстро становятся плотными, отделясь с трудом, что сопровождается кровотечением. В отдаленный период могут развиться паралич, миокардит, нефрит. Примечательно, что заболевание вызывают штаммы, продуцирующие экзотоксин. Нетоксигенные штаммы способны вызвать «симптоматическую дифтерию» (например ангину), но их клиническое значение невелико. Способность к токсинообразованию передается от бактерии к бактерии вирусом (фагом). ДД проводят с инфекционным мононуклеозом, ангиной Симановского — Плаута — Венсана, кандидозным стоматитом.
Листериоз. Listeria monocytigenes, L. ivanovii вызывают заболевание у людей, а также диких и домашних животных. Заболеваемость составляет в среднем 8–9 случаев на 1 млн человек в год. Пик заболеваемости — июль–август. Заражение происходит обычно при употреблении контаминированных продуктов и сырых овощей (листерии способны сохраняться и размножаться в холодильнике), при забое скота. Дети инфицируются от больной матери внутриутробно или во время родов, особенно при преждевременных родах, которые могут быть спровоцированы листериозом. У новорожденных листериоз протекает как гранулематозный сепсис, менингит с возможным внутриутробным заражением. У взрослых— часто под видом ангины, хотя возможны и септикопиемические формы с развитием абсцессов мозга. К группе риска в плане заболеваемости листериозом относятся лица старческого возраста и пациенты с сахарным диабетом, циррозом печени, опухолями, после трансплантации органов. Заболевание протекает как сепсис или менингит (20% всех больных), начинается остро с потрясающего озноба, развития пневмонии, появления кожной сыпи. Возбудитель может быть выделен из крови, ликвора, биоптатов печени и селезенки.
Сибирская язва (вызывается Bacillus anthracis) — высоко контагиозное заболевание животных, прежде всего жвачных, передающееся человеку при контактах с животными или с продуктами животноводства. Будучи антропозоонозной инфекцией, чаще развивается у пастухов, переработчиков шкур, кож и шерсти, охотников. Путь передачи инфекции контактный, ингаляционный, пищевой (споры). В 95% развивается кожная, реже (4,5%) — легочная, крайне редко — кишечная форма заболевания. Заражение сибирской язвой происходит при нарушении целостности первого естественного барьера — кожи или слизистой оболочки. Ингалированные споры способны вызвать легочную форму заболевания (крайне тяжелую, часто с фатальным исходом) только при наличии одновременно у человека острого респираторного вирусного заболевания. Еще более необычная кишечная форма может развиться при употреблении контаминированного мяса, но только при условии «бреши» в слизистой оболочке глотки или кишечника, через которую палочка может проникнуть в стенку кишки.
Кожная форма начинается с безболезненной зудящей красно-коричневой папулы. Она увеличивается, появляется ободок коричневатой эритемы и желатинозного отека. Папула в центре изъязвляется с появлением черного кратера и серозно-кровянистого отделяемого. Регионарные ЛУ увеличиваются, появляются миалгия, лихорадка, головная боль, тошнота, рвота.
Легочная форма сибирской язвы начинается с гриппоподобных симптомов. Температура тела повышается день ото дня, и через несколько дней развивается тяжелый респираторный дистресс-синдром: цианоз, шок и кома, отек легких, выпотной плеврит, геморрагический некротический лимфаденит средостения. Не исключены геморрагический менингоэнцефалит и/или присоединение кишечной формы сибирской язвы.
В желудочно-кишечном тракте токсин микроорганизма обусловливает развитие геморрагического некроза, восходящего по лимфатическим сосудам до ЛУ брыжейки. Прорыв этого барьера обусловливает септицемию и летальный токсикоз. Возбудитель может быть высеян из карбункула и из крови.
Газовую гангрену вызывают многие формы клостридий. Предрасполагают к развитию заболевания множественные, особенно разможженные обширные ранения мягких тканей, открытые переломы. Типичны выраженная интоксикация с быстро развивающейся гнилостной гангреной, ткани бледные, напряжены, сочатся дурно пахнущей жидкостью, при пальпации — типичная крепитация. У больных с лимфомой, лейкозом, раком толстого кишечника клостридиальная септикопиемия развивается без предшествующих травм и может иметь молниеносное злокачественное течение. Бактериологический диагноз основывается на изучении окрашенных по Граму препаратов, поскольку культуральные методы занимают много времени. Анаэробы редко являются причиной инфекционного эндокардита, инфекции мочевых путей, гнойного артрита.
Псевдомембранозный колит, развивающийся как осложение антибиотикотерапии, обусловлен токсином, выделяемым Cl. difficile, персистирующей на фоне аллергического повреждения стенки кишечника антибиотиком и деконтаминации нормальной микрофлоры. Возможно подтверждение выделения токсина в испражнениях.
Clostridium tetani — возбудитель столбняка. Распространен в почве, пыли, особенно — в конском навозе. Место проникновения в организм — загрязненные раны. Анаэроб. Образует нейротоксин. Инкубационный период — 3–14 дней. Проявляется вначале болезненными тоническими судорогами мышц, локализованными в области инокуляции инфекции или лицевых мышц. Затем судороги приобретают генерализованный характер на фоне сохраненного сознания. Судороги провоцируются прикосновением или любой иной стимуляцией. Тризм надо отличать от напряжения мышц при перитонзиллярных или ретрофарингеальных абсцессах. Тетанусоподобное напряжение мышц может возникать при передозировке фенотиазинов.
Clostridium botulinum (типы А, В, С, D, Е, F, G) вызывает тяжелое инфекционное заболевание за счет выделения токсина (наряду с Сl. botulinum, клостридиальный токсин могут синтезировать и некоторые другие представители клостридий). Патологию у человека вызывают в основном типы А, В, Е, F. Типы С и D обусловливают заболевания преимущественно у животных. Тип G впервые выявлен в 1969 г. в Аргентине. За истекшее время зарегистрированы лишь единичные случаи заболевания этим типом ботулизма. Эпидемиология ботулизма своеобразна и не укладывается в классические представления об эпидемиологии инфекционных заболеваний. Микроб является сапрофитом кишечника животных и человека. Но желудочно-кишечный тракт и ткани живого организма не являются оптимальной средой для размножения палочки ботулизма и токсинообразования. Инфекционный характер заболевания проявляется лишь в случаях ботулизма у грудных детей и в тех редких случаях ботулизма у взрослых, когда инкубационный период превышает 4–5 сут. Процесс размножения и токсинообразования достигает максимума в трупном материале. Отсюда понятна биологическая оправданность высокой токсичности ботулинистического яда, итогом действия которого становится смерть макроорганизма и подготовка этим оптимальной среды для дальнейшего размножения Cl. botulinum.
Сама палочка очень неустойчива, но споры выносливы. После попадания в почву длительно сохраняется. С инфицированными частицами почвы микроб попадает в воду и пищу. В анаэробных условиях размножается, образуя устойчивый токсин. Большинство случаев заражения связано с употреблением домашних консервов (в России 68% всех случаев заболевания приходится на последствия употребления грибов домашнего консервирования), зараженной рыбы, мяса. Инкубационный период — от 2 ч до 10 сут. Заболевание начинается внезапно с боли в животе. Симптомы гастроэнтерита не типичны, рвота и диарея прекращаются тут же, как только становятся значимыми поражения других систем. Больных беспокоит головная боль, общая слабость, затем присоединяются офтальмонейроплегические симптомы, расстройства речи и глотания. Брадикардия, значимая в дебюте болезни, сменяется тахикардией, расширением границ сердца. Температура тела чаще понижена. Летальность — 8,1–5,6%. В отличие от поражения ядовитыми грибами нет расстройств психики и обильной саливации.
Классификации ботулизма по ведущим синдромам (офтальмологическая форма, диспепсически-паралитическая и т. д.) не имеют никакого практического значения. Оправдана классификация болезни по степени тяжести. Легкая форма характеризуется малой выраженностью симптомов. Жизненная емкость легких — 45 см3/кг массы тела и выше (норма 60–70 см3/кг и более). Средняя степень тяжести болезни — неврологическая симптоматика выражена, нет острой дыхательной недостаточности, нет нарушения глотания. Жизненная емкость легких — 30–45 см3/кг. Тяжелая степень — максимальная выраженность всех симптомов. Жизненная емкость легких 30 см3/кг. В условиях практической деятельности определить жизненную емкость легких возможно далеко не всегда или даже не везде. Поэтому единственно реальным критерием тяжелого течения ботулизма является нарушение глотания. Любое нарушение глотания служит основанием для установления диагноза «ботулизм тяжелой степени течения» и требует немедленной госпитализации в отделение интенсивной терапии, минуя приемное отделение.
В целом в пользу диагноза «анаэробная инфекция» свидетельствуют: инфекционный процесс вблизи слизистой оболочки, на которых обычно персистирует анаэробная флора; ишемия; опухоли; проникающие ранения; инородные тела; разрывы внутренних органов; газовая гангрена кожи, подкожных тканей, мышц; гнилостный запах; наличие газа в тканях; септический тромбофлебит; низкая эффективность антибиотикотерапии препаратами, не оказывающими действия на анаэробов. Особенностью анаэробной инфекции является сочетание микрофлоры (клостридии, актиномиицеты, аэробы), что суммировано в табл. 7.2.1.
Таблица 7.2.1
Состояния, часто обусловленные смешанной анаэробной флорой (нередко с аэробами)
|
*Так, люди, желающие себе некоторых поблажек (освобождение от заключения, призыва в армию), вводят под кожу налет с зубов.
Бактероиды — анаэробные эпифиты полых органов человека. Септикопиемия исходит из толстого кишечника, а у женщин также из генитального тракта. Перитонзиллярные абсцессы могут обусловить тромбоз яремных вен. Bacteroides melaninogenicus et fragilis вызывают развитие пневмонии, лимфаденита со стенозами бронхов, в 75% случаев в сочетании с аэробной флорой. Поддиафрагмальные инфекции (абсцесс печени, холецистит, дивертикулит, эндометрит, расхождение швов после вмешательств на толстом кишечнике) обусловлены ассоциацией Bacteroides fragilis и Enterobacteriaceae. Близко к бактероидам стоит Fusobacterium nucleatum, вызывающая в ассоциации с Borrelia Vincenti ангину Симановского — Плаута — Венсана.
Туляремию обусловливает Francisella tularensis. Передается множеством животных (преимущественно грызунами) и клещами. Заболеваемость туляремией, по свидетельству В. И. Покровского, значительно выше зарегистрированной. По данным главного государственного санитарного врача РФ Г. Г. Онищенко (постановление № 33 от 20.12.2005 г.) ежегодно в России регистрировали 50–60 случаев туляремии. Однако в 2004 г. заболеваемость повысилась в 3 раза, зарегистрировано 123 случая туляремии. В 2005 г. за 10 мес заболеваемость продолжала нарастать, повысившись по сравнению с аналогичным периодом 2004 г. в 8,3 раза: заболели 831 человек, в том числе 109 детей в возрасте до 14 лет. Входные ворота инфекции — кожа, слизистая оболочка, пищеварительный и респираторный тракты. Протекает с высокой лихорадкой. На коже в месте инокуляции возбудителя появляется красная папула, позднее некротизирующаяся с образованием глубокой язвы. Выражен регионарный лимфаденит. Возможно развитие атипичной пневмонии. Диагноз подтверждается бактериологически и серологически.
Типы туляремии представлены в табл. 7.2.2.
Таблица 7.2.2
Варианты туляремии
| Тип* | Частота, % | Проявления |
| Язвенно-нодулярный (бубонный) | 85 | Первичное поражение на пальцах и руках |
| Тифоидный | 10 | Общее заболевание с болью в животе и лихорадкой |
| Окулонодулярный | 4 | Воспаление ипсилатерального ЛУ, обусловленное инокуляцией инфекции в глаз из инфицированного пальца |
| Нодулярный | 1 | Регионарный лимфаденит. Часто — увеличение шейных ЛУ, что при отсутствии очевидных входных ворот инфекции заставляет предполагать пищевой путь заражения |
*Fracisella tularensis — мелкая неподвижная плеоморфная аэробная бацилла, не образующая спор. Тип А, наиболее вирулентный для человека серотип, выявляют у крыс. Тип В обычно вызывает средней степени тяжести язвенно-нодулярные поражения. Выявляют в воде и у водяных животных.
Чума (вызывает Yersinia pestis) — высококонтагиозное заболевание. Человек заражается при укусе инфицированными блохами или при контакте с зараженными грызунами. Очагами чумы в России является Астраханская область, Северный Кавказ и некоторые другие регионы. Бубонная чума характеризуется развитием болезненного абсцедирующего лимфаденита. Место вхождения инфекции соответствует укусу насекомого, чаще это паховая область, затем подмышечная область и затылок. Заболевание протекает с высокой лихорадкой, делирием, шоком, возможно развитие абсцедирующей пневмонии (наиболее вероятна при воздушно-капельном пути заражения). Возбудитель может быть высеян из пунктата чумного бубона, мокроты, из крови.
Коклюш и паракоклюш (вызывает соответственно Bordetella pertussis et parapertussis) — высоко контагиозные инфекционные заболевания бактериальной этиологии, клинически неотличимые друг от друга протекают в несколько стадий. I — катарральная — проявляется неспецифическими симптомами: умеренным повышением температуры тела, насморком, постепенно нарастающим сухим кашлем, лейкоцитозом с лимфоцитозом. Во II стадии (длится 2–4 нед) кашель становится определяющим, приступообразным, с репризами, заканчивается рвотой, отхождением стекловидной мокроты. Между приступами кашля состояние больного страдает мало. Тяжелые формы могут обусловить нарушения венозного возврата крови за счет длительного и существенного повышения внутригрудного давления при кашле, и развиваются кровоизлияния в конъюнктиву, казуистично описывают развитие энцефалопатии. ВIII стадии кашель постепенно стихает, но дети контагиозны до 40-го дня. Коклюш приводит к значительному ослаблению иммунитета. Как результат массовых вакцинаций в детском возрасте с развитием относительно нестойкого иммунитета, заболеваемость взрослых возросла.
Бруцеллез (вызывается Brucella melitensis, abortus, suis) передается человеку от инфицированных животных или с продуктами их жизнедеятельности. Очень редко передается от человека к человеку. Входные ворота инфекции — кожа, дыхательный и пищеварительный тракты. Инкубационный период длится 5–60 дней. Заболевание может начинаться остро или постепенно. Проявления болезни — повышение температуры тела различной выраженности, потрясающий озноб, слабость, потливость, головная боль, артралгия, лимфаденопатия, у 10–15% больных — спленомегалия, уменьшение массы тела. Достаточно редко развивается гепатоспленомегалия, артрит, спондилит. В острый лихорадочный период возможен высев возбудителя из крови и костного мозга. Определение специфического IgG оправдано при хроническом течении заболевания.
Гемофильная инфекция. Род Haemophilus — мелкие неподвижные аэробные и факультативно анаэробные грамотрицательные палочки или коккобациллы, которым для роста необходимы специфические факторы X (гематин) и V (никотинамид-динуклеотид фосфат).
Н. influenzae — достаточно частая этиологическая причина менингита, сепсиса, гнойного артрита, трахеобронхита, пневмонии, среднего отита, синусита, конъюнктивита, эпиглоттита у детей. Большинство Н. influenzae, вызывающих серьезные заболевания у детей, относятся к инкапсулированному штамму b. У взрослых возможны те же заболевания, но значительно реже. Н. influenzae серотипа Aegypticus способна вызвать слизисто-гнойный конъюнктивит или бразильскую пурпурную лихорадку.
Другие типы Haemophilus вызывают респираторные заболевания или, реже, эндокардит, Н. parainfluenzae et Н. aphrophilus изредка являются этиологическими факторами бактериемии, эндокардита или абсцесса мозга. Н. ducreyi обусловливает такое венерическое заболевание, как шанкроид.
Сифилис (возбудитель Treponema pallidum) практически всегда передается половым путем. Заболеваемость им выросла по России у взрослых за 4 года в 15,8 раза, а среди детей — в 21, причем 65,6% из них заразились половым путем. Приблизительно через 3 нед после инфицирования развивается первичный аффект (I стадия) — плотная безболезненная язвочка на месте инокуляции возбудителя с регионарным лимфаденитом. Заживление язвы без санации организма происходит самостоятельно. Через 8 нед развивается вторичный сифилис (II стадия). Незначительное преходящее повышение температуры тела, головная боль, общее недомогание, артралгия сопровождают бактеремию. Развиваются макуло-папулезные высыпания, в том числе на ладонях и подошвах, генерализованная лимфаденопатия, гнездная алопеция и сифилитическая лейкодерма. На влажных местах развиваются кондиломы, в которых содержится большое количество бледных трепонем. В 30–50% сифилис может после этой фазы самостоятельно излечиваться, неспецифические тесты и специфический тест с 19S-IgM становятся отрицательными. В остальных случаях развивается латентный сифилис. Этот период, будучи эпидемиологически значимым, может длиться до 20 лет, после чего развивается третичный сифилис (III стадия). Любые сопутствующие инфекции, тем более специфическая суперинфекция, гиповитаминозы, травмы ускоряют переход заболевания в III стадию. При сопутствующем СПИДе весь путь от заражения до III стадии занимает всего несколько месяцев.
Третичный сифилис характеризуется образованием в любых органах гумм (гранулематозных опухолей). Возможно развитие миокардита, мезоаортита, нейросифилиса. Последний может протекать по типу менингоэнцефалита и цероброваскулита, спинной сухотки (атаксия, отсутствие реакции зрачков на свет), прогрессирующего паралича (изменение личности, нарушение речи, эпилептические припадки).
Врожденный сифилис выявляют при трансплацентарной передаче возбудителя от больной матери плоду, что возможно только после 5-го месяца беременности.
Для бактериоскопического исследования возбудитель может быть получен из отделяемого первичного аффекта, во вторичный период — из дефектов слизистой оболочки, пунктата ЛУ. Трепонема находится и в розеолах, но в очень небольшом количестве, что затрудняет ее выделение. Методом выбора остается микроскопия в темном поле. Возбудители сифилиса отличаются от сапрофитных трепонем, обитающих в норме в генитальном тракте и в полости рта, большим количеством изгибов и качатель- ными движениями. Более надежная идентификация достигается реакцией связывания флюоресцирующих антител на трепонеме.
Серологические реакции подразделяются на неспецифические и специфические. Неспецифические тесты основаны на фиксации реагинов, которые не связаны или частично обусловлены наличием бледной трепонемы. Например, они могут быть выявлены как умеренно позитивные при СКВ, васкулите, опухолях и даже в период беременности. Поэтому их целесообразно применять для динамического контроля, но не для первоначальной диагностики. К неспецифическим тестам относят реакцию Вассермана, кардиолипиновый тест и другие. Они появляются только на 5-й неделе после заражения, через 1 год после адекватного лечения становятся отрицательными. Но могут становиться ортицательными и при латентном сифилисе без предшествующего лечения, или длительное время и после полноценного лечения оставаться положительными в низком титре. В целом же их титры достаточно хорошо коррелируют с активностью заболевания. Специфические тесты основаны на реакции с клеточными структурами бледной трепонемы. Высоко специфичны реакции гемагглютинации бледной трепонемы, адсорбции на ней флюоресцирующих антител, реакция иммобилизации трепонем. Они становятся положительными через 4–6 нед после заражения и выявляют антитела группы IgG. Эти пробы часто остаются положительными даже после интенсивного лечения и сохраняются как положительные на всю оставшуюся жизнь («сывороточный рубец»). В этом случае можно провести высокоспецифический тест с 19S-IgM-антителами. Он положительный с 3-й недели инфицирования и проникает к плоду через плацентарный барьер. Это делает его чрезвычайно важным для диагностики врожденного сифилиса.
Лайма болезнь передается клещами, заносящими в ранку при укусе Borrelia burgdorferi. Заболевание начинается с хронической мигрирующей эритемы. Несколькими неделями или даже месяцами позже развиваются такие неврологические поражения, как менингоэнцефалит. В ликворе — плейотропный лимфоцитоз. Позднее присоединяются моно- и полиартрит, нарушения ритма сердца и миоперикардит. В течение ближайших месяцев или лет может сформироваться хронический артрит. Установление диагноза облегчается, если заболевание возникло в эндемической местности, в противном случае недостаточная надежность иммунологических методов может сделать его сложным.
Лептоспироз (инфекционная или спирохетозная желтуха) — заболевание с высокой лихорадкой, передающиеся непосредственно и бесконтактно многими грызунами, дикими и домашними животными. Инфекция может возникать не зависимо от возраста. В 76–80% всех случаев заболевшие — мужчины. В развитых странах болезнь из эндемичной сельскохозяйственной превратилась в «болезнь отдыха (рекреационную)»: большинство пациентов заразились во время плавания в контаминированных бассейнах и прудах. Другой значимый источник инфекции в городах — собаки и крысы (так, в Москве по примерным расчетам приходится по 1 крысе на каждого жителя). Доказанных случаев заболевания в США — 40–100/год (Beers М., Berkow R. (Ed.), 1999). Но все эти сообщения поступили из развитых индустриальных регионов. Поэтому есть все основания говорить, что поскольку яркие клинические признаки могут быть не выражены или стушевываются антибиотиками, а выделение лептоспир или серологическая диагностика в широкой практике, тем более, в так называемой глубинке, явно не рутинные методики, истинная заболеваемость лептоспирозом выше заявленной. Сезонное повышение заболеваемости определяется поздним летом и осенью. Лептоспироз протекает в две фазы. Инкубационный период — 7–12 дней. В первую фазу развивается лептоспиремия. Проявляется высокой лихорадкой, потрясающим ознобом, головной болью, конъюнктивитом, эписклеритом, экзантемой, АГ, относительной брадикардией, менингизмом, болью в икроножных мышцах, реже — в других группах мышц. Через 4–7 дней температура тела нормализуется, после короткого безлихорадочного периода болезнь переходит во вторую фазу: органных проявлений. Вновь повышается температура тела, появляются желтушность, геморрагический диатез, признаки нефрита, менингит, иридоциклит. В первую фазу диагноз может быть подтвержден выделением лептоспир из крови, ликвора и мочи, во вторую — реакцией микроагглютинации.
Болезнь укуса крыс. Заболевают около 10% всех укушенных крысами, мышами, куницами, ласками, горностаями и другими грызунами. Возбудители (Spirillum minus и Streptobacillus moniliformis) обитают в ротоглотке здоровых грызунов. Возможно заражение через непастеризованное молоко, контаминированное указанными возбудителями. То есть не исключены микробиологически подтвержденные случаи заболевания без указаний на укус крысы в анамнезе. Подвержены риску заболевания живущие скученно малоимущие горожане, персонал биомедицинских лабораторий и вивариев. В качестве этиологического фактора чаще выявляют плеоморфные грамнегативные стрептобациллы.
При стрептобациллярной форме первичная ранка быстро заживает, но после инкубационного периода длительностью 1–22 дня (в среднем менее 10 дней) развиваются озноб, лихорадка, тошнота, головная боль, боль в спине, суставах. Через 3 дня на ладонях и подошвах появляется кореподобная сыпь. Полиартралгия и симметричные артриты больших суставов сохраняются от 1 нед до 1 мес. Бактериальный эндокардит или абсцесс мозга развиваются редко. У некоторых больных появляются инфицированные выпоты в перикард или инфицирование амниотической жидкости. Установление диагноза основывается на посевах крови или синовиальной жидкости. Определяемые титры агглютининов появляются на 2–3-й неделе и диагностически значимы только при их нарастании.
При спирохетозной форме болезни укуса крыс (болезнь Содоку) ранка заживает также быстро, инкубационный период составляет 4–28 дней (обычно более 10 дней). Заболевание начинается остро с воспаления со стороны укуса, лимфаденита, высокой лихорадки. Сыпь розеолезная, уртикарная, но выражена меньше, чем при стрептобациллярной форме. Точно так же проявляется и артрит. Лейкоцитоз составляет от 5000 до 30 000/мкл. У нелеченных или неэффективно леченных больных 2–4-дневные циклы лихорадки длятся 4–8 нед, крайне редко — больше 1 года. При адекватной терапии симптоматика исчезает за 2 нед.
Клинически болезнь укуса крыс может напоминать менингококкцемию, малярию, боррелиоз, инфекцию вирусом Коксаки В, лихорадку скалистых гор.
Диагноз основывается на выявлении Spirillum minus в мазках крови или в тканях ЛУ, при изучении в темном поле крови инокулированной мыши.
Легионеллез — системное заболевание бактериальной этиологии, вызываемое Legionella pneumophilla, с преимущественным поражением легких. Передается воздушным путем (болезнь кондиционеров). Через 2–10 дней инкубационного периода появляются гриппоподобные симптомы, позднее температура тела повышается до 39–39,8 °C; возникают сухой кашель, боль в грудной клетке и желудочно-кишечные расстройства. Могут возникать нарушения сознания и острая дыхательная недостаточность. Летальность составляет 15% и более. Рентгенологически в легких выявляются множественные очаги с тенденцией к слиянию. В анализе крови — лейкоцитоз со сдвигом формулы влево, повышение СОЭ. В результате поражения почек выявляют протеинурию, микрогематурию. Возможно культуральное выделение возбудителя, применение серологических методов оправдано только после 3–6-й недели после начала болезни, то есть результаты имеют более эпидемиологическое, чем прикладное клиническое значение.
Риккетсиозы (Ricketsia provaceca, mooseri; Coxiella burnetii). Риккетсиозы подразделяют на 4 большие группы:
- Тиф. Тиф сыпной (эпидемический); болезнь Брилла — Цинссера; эндемический (блошиный, малайский городской) тиф; лихорадка цуцугамуши (тропический клещевой тиф, кустарниковый тиф).
- Пятнистая лихорадка. Лихорадка скалистых гор; восточный клещевой риккетсиоз; везикулярный риккетсиоз, или риккетсиальная оспа (описана в России, Корее, Африке, США).
- Q-лихорадка; окопная лихорадка.
- Эрлихиоз. Вызывается эрлихией (Ehrlichia chaffensis, canis, muris) мелкой облигатной риккетсиоподобной внутриклеточной бактерией, выглядящей как маленькие цитоплазматические включения в лимфоцитах и нейтрофильных гранулоцитах. Передается человеку через укусы клещей, иногда через контакт с собаками — носителями клещей.
В России зарегистрированы первые, пусть единичные, но вспышки сыпного тифа, передаваемого вшами. Сохраняется циркуляция риккетсий, а при наличии 3,5 млн человек — носителей вшей — вспышка инфекции остается вопросом времени. По данным Департамента здравоохранения Москвы в 2005 г. на педикулез и чесотку приходится 55,38% всей инфекционной заболеваемости (без гриппа и ОРВИ). Сыпной тиф протекает со стремительным повышением температуры тела до 40 °C, жестокой головной болью, артралгией. С 4-го дня — полиморфная макулезная сыпь с геморрагическим компонентом, распространяющаяся с боковых поверхностей грудной клетки. Присоединяются конъюнктивит, гиперемия лица, гепатоспленомегалия, сомноленция, апатия, нарушения слуха, речи и зрения. Причина смерти — шок.
Течение эндемического или блошиного тифа более благоприятное. Диагноз может быть подтвержден реакцией Вейля — Феликса (перекрестная агглютинация с гаптеном протея штамма ОХ-19). Оба этих риккетсиоза передаются вшами, что особенно значимо в периоды социальных потрясений и массовой миграции населения.
Coxiella burneti вызывает Q-лихорадку, манифестирующую высокой лихорадкой и симптомами пневмонии, головной болью и тяжелого общего состояния. Типичная для риккетсиозов сыпь отсутствует. Могут присоединиться гепатит (1/3 пациентов с тяжелыми формами Q-лихорадки) и эндокардит.
У некоторых туристов, вернувшихся из Средиземноморского региона, регистрируют редкую форму риккетсиоза, передающегося при укусе собачьего клеща (марсельская лихорадка). Клинически проявляется лихорадкой, макуло-папулезной сыпью, общим недомоганием. Заболевание заканчивается спонтанным выздоровлением.
Персистенцию риккетсий считают также причиной аортита с исходом в аневризму аорты.
ДД риккетсиозов и других острых инфекционных заболеваний очень затруднена в первые несколько дней заболевания до появления сыпи. Помогают сведения о характере жизни и занятиях пациента, выявление вшей, блох, клещей или следов их укусов, анамнестические указания на пребывание в эндемичных по риккетсиозу областях. Каждый тяжело больной с необъяснимой лихорадкой, головной болью, спутанным сознанием должен быть обследован и на наиболее серьезные варианты риккетсиозов вне зависимости от наличия или отсутствия сведений об укусах кровососущими насекомыми.
По тяжести заболевания и неотложности вмешательства на первом месте при ДД стоит менингококцемия.
При менингококцемии сыпь может быть розеолезной, фестончатой, макулярной, макуло-папулезной или петехиальной при подостром течении или сливной петехиальной, экхимотической при фульминантной форме. Менингококковая сыпь развивается очень быстро при остром течении, экхимозы появляются обычно в местах давления. Риккетсиозная сыпь появляется, как правило, на 4-й день лихорадки, петехии появляются еще позже.
Следует помнить и о других бактериальных и вирусных инфекциях, протекающих с лихорадкой и высыпаниями (см. соответствующие разделы).
Серологические тесты, изоляция и идентификация риккетсии из крови, кожи и других тканей, иммунофлюоресценция помогает установить правильный диагноз. Для достоверности серологические исследования следует проводить не менее чем в 3 пробах, взятых на 1; 2; 4–6-й неделе заболевания. Риккетсии пятнистых лихорадок и тифов имеют два типа антигена в реакции связывания комплемента: растворимая фракция соответствует представителям любой группы, другая — специфична. Антитела первичной инфекции выявляют в классе IgM. Комплементсвязывающие антитела появляются на 2–3-й неделе болезни и позже, а у леченных антибиотиками — на 3–5-й день после болезни. При болезни Брилля — Цинссера антитела типа 7S появляются достаточно быстро, через несколько дней после начала болезни. Иммунологические пробы по определению класса иммуноглобинов (IgM; IgG), микроаглютинации, непрямой флюоресценции позволяют идентифицировать возбудителя. Идентифицируемые риккетсии можно выявить в коже и в других тканях пациентов на 4–10-й день болезни; иммунофлуоресцентные методики позволяют выявить их даже в тканях, фиксированных формалином. Для изоляции возбудителя необходимо взять кровь до начала антибиотикотерапии или ткани возможного переносчика и инокулировать их в желточный мешок куриного эмбриона или морской свинки.
В любом случае следует подчеркнуть, что нельзя задерживать лечение до завершения лабораторной диагностики и/или ДД.
Туберкулез. Еще Макиавелли сказал о туберкулезе, что, в сущности, может быть перенесено на многие состояния. Он утверждал (I1 Principe, 1513), что «чахотку вначале легко излечить, но трудно распознать; с течением же времени, если ее сразу не раскрыли и не лечили, болезнь становится легко распознаваемой, но трудно излечимой». Наиболее частым возбудителем туберкулеза в наше время после уменьшения количества ветеринарно неконтролируемых стад и снижения, соответственно, доли М. bovis, остается Mycobacterium tuberculosis. Микобактерия относится к облигатным аэробам, ее капсула требует наличия липидов во внешней среде. Поэтому наиболее удобным местом для ее персистенции являются легкие, где постоянно происходит газообмен и где высока активность жирового обмена.
Заболеваемость туберкулезом (включая мигрантов, в том числе бомжей) в Москве по итогам 2005 г. составляет 38,2 на 100 тыс. населения (по России — 83,1), распространенность — 94,3 на 100 тыс. населения (по России — 218,3), смертность — 8,5 на 10 тыс. населения (по России — 21,3). Среди постоянных жителей Москвы указанные показатели (на 100 тыс. населения) существенно ниже: заболеваемость — 27,7, распространенность — 94,3, смертность — 5,2. Но относительно благополучные показатели заболеваемости, распространенности туберкулеза и смертности от него по Москве не должны успокаивать. Несмотря на снижение общей заболеваемости, заболеваемость детей в возрасте 0–2 года возросла на 28,8%. Заболеваемость детей в возрасте 3–6 лет возросла на 75,0%. Среди впервые выявленных больных туберкулезом — 43,9% подростков с распадом легочной ткани. Доля больных туберкулезом , умерших в первый год наблюдения, составила 22%. Из всех умерших в первый год 69,9% умерли в первый месяц после выявления туберкулезом. Среди всех вскрытий 22,5% туберкулеза диагностированы только при вскрытии.
Первый контакт с возбудителем обычно происходит в детстве. Около 10% всех инфицированных заболевают клинически значимыми формами туберкулеза, из них ½ в течение ближайших полутора лет, остальные переносят туберкулез в более отдаленные сроки. Возникающее непосредственно после контакта заболевание, чаще с поражением легких, носит название первичного аффекта. В большинстве случаев самопроизвольно излечивается, оставляя случайно выявляемые кальцинаты. Гематогенно из первичного очага микобактерии разносятся в другие органы, где по типу остаточной туберкулезной инфекции могут персистировать в течение десятилетий. Риск заболевания туберкулезом таких людей в 64 раза выше чем в среднем в популяции. В том случае, если гематогенный занос инфекции достаточно массивен или развился на неблагоприятном фоне, регистрируют тяжелую картину гематогенно-диссеминированного туберкулеза. При общем тяжелом состоянии больного значительно повышается температура тела, лихорадка становится интермиттирующей, появляется проливной пот, головная боль, сухой кашель. В анализах крови — лейкоцитоз, повышение СОЭ. Токсическая зернистость нейтрофильных гранулоцитов отсутствует. У 1/5 больных отмечают лимфоцитопению. На рентгенограммах по всем легочным полям множественные мелкие очажки. У 1/3 больных удается выделить микобактерии туберкулеза из мочи и мокроты. Диагностика затрудняется тем, что рентгенологическая картина формируется позднее, чем клинически неблагоприятная динамика общего состояния больного.
Такое течение туберкулеза отмечают нечасто. Более распространены медленно развивающиеся формы.
О туберкулезе следует думать при наличии следующих признаков (Миллер Дж. Ф. У.):
- постепенное похудание, апатия на протяжении 2–3 мес, особенно в сочетании с кашлем и отделением мокроты. У младших детей — прекращение прибавки массы тела (кашель не характерен);
- внезапное повышение температуры тела (лихорадка становления), особенно в сочетании с узловатой эритемой или фликтенулезным конъюнктивитом. Лихорадка становления может сохраняться до 3 нед;
- затрудненное хриплое дыхание, упорный кашель;
- внезапная лихорадка с плевральной болью и выпотом в плевру;
- вздутие живота и асцит;
- плотные и безболезненные образования в брюшной полости;
- прихрамывание и болезненная припухлость в области больших суставов;
- затруднение при сгибании и наклоне, ригидная болезненная спина, возможна ее деформация и опоясывающая боль;
- безболезненное увеличение периферических ЛУ, окруженных более мелкими ЛУ;
- любой абсцесс в периферических ЛУ, особенно развившийся постепенно;
- подкожные абсцессы или язвы на коже, возникающие без видимых причин;
- безболезненная гематурия или стерильная пиурия;
- внезапное и необъяснимое изменение настроения, поведения, раздражительность, тошнота и рвота, особенно в сочетании с лихорадкой;
- признаки объемного внутричерепного процесса или диффузного энцефалита;
- длительно затянувшееся выздоровление после кори, коклюша, любой другой интеркурентной инфекции.
Флюорографическая диагностика касается только сравнительно поздних форм, применима в эпидемиологически неблагополучных районах. Каждый вновь выявленный такими методиками случай туберкулеза обходится казне, по расчетам канадских экономистов, в 4400 дол. США. В 100 раз дешевле и, самое главное, на ранних этапах, туберкулез выявляют клиническими и лабораторными методами, в том числе с помощью реакции Манту.
Наряду с микобактерией туберкулеза имеется большая группа так называемых атипичных микобактерий, которые могут вызывать заболевание у ослабленных лиц (дети, ВИЧ-инфицированные, получавшие лечение цитостатиками и кортикостероидами). К предрасполагающим факторам относятся также гастрэктомия, хронические неспецифические заболевания легких или состояние после уже перенесенного туберкулеза, сахарный диабет, алкоголизм, наркомания. В наших условиях наиболее распространены атипичные микобактерии мышиного, птичьего, рыбьего, амфибийного, канзасского типов. Они прежде всего поражают легкие, ЛУ (особенно у детей), реже кожу.
Лепра, или проказа (возбудитель — Mycobacterim leprae), болезнь Хансена — системное хроническое заболевание. Передача от человека к человеку осуществляется аэрогенно, инкубационный срок варьирует от 1 года до 24 лет. Во всем мире лепрой болеют более 10 млн человек. Различают две формы (туберкулоидная и лепроматозная), между которыми существуют переходные формы. Туберкулоидная лепра протекает относительно благоприятно. Депигментированная и красная макулезная сыпь располагается асимметрично, чаще с одной стороны, регионарные нервные стволы пальпируются как болезненные тяжи, определяются очаги сниженной поверхностной чувствительности. При лепроматозной лепре течение прогрессирующее. Наряду с поражением нервов отмечают интенсивное размножение микобактерий в коже, слизистой оболочке, ЛУ, ретикуло-эндотелиальной системе, печени, селезенке, гонадах. Кожа лица, уши, нос инфильтрированы, так что внешний вид больного напоминает морду льва (леонтиазис). В дальнейшем развивается изъязвление кожи и слизистой оболочки, распространяющееся впоследствии симметрично на туловище. В отделяемом язв выявляют множество кислотоустойчивых палочек. Диагноз лепры основывается на клинической картине, прежде всего на типичном поражении кожи и периферической нейропатии, и подтверждается данними биопсии. Биоптаты надо брать у основания лепрозных бугорков, хотя и внешне здоровая кожа может иметь характерные гистологические признаки поражения. При лепроматозной лепре в биоптатах выявляют вакуолизированные макрофаги (пенистые клетки), небольшое количество лимфоцитов и бесчисленное множество кислотоустойчивых палочек, часто сгруппированных в шары или в стопочки («связка сигар»). Пенистые клетки и лимфоциты выявляют даже через годы после исчезновения бацилл. При туберкулоидной форме при исследовании выявляют гранулемы, состоящие из лимфоцитов, эпителиоидных клеток и гигантских клеток инородных тел Пирогова — Лангханса. Гранулемы тяготеют к нервным стволам. Поражение нервов отмечают и при саркоидозе кожи, однако клеточная инвазия нервов с дегенерацией аксонов и, тем более, участками казеозного некроза патогномонична для лепры.
Сывороточные IgM-антитела специфичны для гликолипида М. leprae. Антитела выявляют у всех больных с лепроматозной лепрой, но 30–35% больных с туберкулоидной формой являются серонегативными. То есть диагностическая ценность IgM-антител ограничена. Их определение целесообразно прежде всего для контроля активности заболевания: при эффективной химиотерапии их уровень снижается, при обострении — повышается. Лепромин (инактивированые термически М. leprae) применяют для проведения кожных тестов (по аналогии с туберкулином). В диагностических целях препарат себя не оправдал, поскольку положительная реакция отмечается прежде всего у больных с туберкулоидной формой и у части здоровых, а при лепроматозной лепре она отрицательная.
Актиномикоз (возбудители — Actinomyces israeli, naeslundis, Arachnia propionica) — достаточно редкое подострое инфекционное заболевание с образованием подкожных доскообразных по плотности гранулем (в 90% случаев на шее) и последующим формированием свищей. Остальные 10% составляют случаи легочной, илеоцекальной и генитальной локализации. Вследствие распространения per continuitatem возможны мандибулит, перикардит, спондилит. Гематогенную диссеминацию отмечают очень редко, в этом случае поражаются почки, печень, формируются абсцессы мозга. ДД проводят, прежде всего, с туберкулезом ЛУ и с лимфомами. При наличии свищевых ходов диагноз достаточно быстро подтверждается на основании выявления друз или актиномицетов. Почти всегда присоединяются стрепто- и стафиллококки, бактероиды или другая флора.
Нокардиоз — острое или хроническое, нередко диссеминированное гнойно-гранулематозное инфекционное заболевание, обусловленной аэробной грамположительной бациллой Nocardia asteroides, сапрофитом почвы. Человек обычно заражается ингаляционным путем, менее характерен пищевой путь. Возникает нечасто. Половина всех заболевших — мужчины. Поражает людей с недостаточностью иммунитета (лица старческого возраста, состояния после трансплантации органов, лечение кортикостероидами в высоких дозах, предшествующие заболевания легких, СПИД, лимфоретикулезы). Но более 50% всех заболевших не имеют ни одного предрасполагающего фактора. Пневмонические очаги, как правило, некротизируются, что может привести к развитию эмпиемы плевры. Ночная потливость, лихорадка, продуктивный кашель в совокупности с рентгенологической картиной заставляют думать о туберкулезе. Весьма вероятный гематогенный путь рассеивания инфекции приводит к вовлечению в процесс ЦНС. Изменения ликвора неспецифичны, нокардии из него не высеваются. В мокроте выявляют нежные кислотоустойчивые палочки.
Хламидиоз. Хламидии — неподвижные, облигатные внутриклеточные паразиты. Вначале их на основании множественных внутриклеточных цитоплазматических включений относили к вирусам, но сейчас они определены как бактерии по наличию ДНК и РНК, клеточной стенки по химическому составу аналогичной грамотрицательным бактериям. Ранее хламидиозы были известны практически только как трахома. В современных условиях хламидиозы протекают с полиорганными проявлениями.
Chlamydia psittaci, выявлена у многих животных. Человек инфицируется при тесном контакте с птицами. Вызывает пситтакоз (орнитоз). Заболевание протекает как атипичная пневмония с высокой лихорадкой, тошнотой, спленомегалией, нарушениями сознания.
Chl. pneumoniae, рассматриваемая как серотип Chl. psittaci, может вызывать пневмонию, прежде всего у детей и лиц молодого возраста. Среди всех случаев пневмонии заболевание хламидийной этиологии составляет по данным различных авторов от 6 до 19%. Клинически заболевание может быть неотличимо от микоплазменной пневмонии. У детей в возрасте до 5 лет хламидийная пневмония считается редкой, хотя по другим статистикам она составляет 5–10%. Сезонных колебаний заболеваемости нет.
Сhl. pneumoniae выявлена в атероматозных бляшках. Доказана связь инфекции с повышенным риском поражения коронарных артерий сердца.
Chl. trachomatis имеет 15 серотипов. Серотипы А, В, Ba, С обусловливают трахому и конъюнктивит, D-К — инфекции, передающиеся половым путем, L1 и L2 — венерическую лимфогранулему и L3 — мышиный пневмонит.
В индустриально развитых странах с хорошим контролем гонореи и сифилиса Chl. trachomatis — едва ли не самая частая причина инфекционных заболеваний, передающихся половым путем. Она вызывает негококковый уретрит, эпидидимит, цервицит, воспалительные заболевания таза у женщин, синдром Рейтера, неонатальные конъюнктивит и пневмонию как результат инфицирования в родовых путях матери.
Сhl. trachomatis выявлена у 20% взрослых пациентов с фарингитом.
Mycoplasma pneumoniae вызывает первичную атипичную пневмонию, hominis — пиелонефрит, сальпингит, эндометрит, особенно после абортов и родов. Ureaplasma urealyticum может вызвать неспецифический простатит, уретрит и эпидидимит. С ней же связывают и нарушения фертильности.
Вирусные инфекции
Вирусы — мельчайшие паразиты, размножение которых полностью зависит от растительной, бактериальной или животной клетки. Вирусы состоят из внешней оболочки (белок, иногда — липиды) и нуклеиновой кислоты (ДНК или РНК). Во многих случаях этот «нуклеиновый сердечник» проникает в восприимчивую клетку и запускает инфекционный процесс. Размер вирусов колеблется от 0,02 до 0,3 мкм, что значительно ниже разрешающей способности светового микроскопа. Вирусы идентифицируются биохимически и биофизически, подобно другим паразитам они запускают иммунный ответ хозяина. Человек инфицируется сотнями различных вирусов. Многие из них идентифицированы недавно и их клиническое значение недостаточно изучено. В ряде случаев вирусы инфицируют человека без появления каких-либо симптомов.
Вирусы могут первично инфицировать человека, передаваясь через дыхательную и пищеварительную системы. Эти вирусы распространены по всему миру. Их распространение сдерживается врожденной резистентностью организма-хозяина, первичной иммунизацией инфектом или вакциной, гигиеническими, социальными и другими условиями.
Зоонозные вирусы свой биологический цикл совершают в основном в животных. Человек для них вторичный или дополнительный хозяин. Их распространение ограничивается зоной обитания основного хозяина и/или переносчика (географические, природные условия).
Медленная вирусная инфекция характеризуется резко удлиненным инкубационным периодом с развитием хронических дегенеративных заболеваний (склерозирующий панэнцефалит после кори; прогрессирующий краснушный панэнцефалит; мультифокальная лейкоэнцефалопатия; болезнь Крейцфельда — Якоба — прионовая патология).
Ряд вирусов имеет онкогенные свойства. Человеческий Т-клеточный лимфотропный вирус типа 1 (ретровирус) считают ответственным за некоторые случаи лейкозов и лимфом. Вирус Эпштейна — Барр считают ответственным за развитие лимфом у реципиентов органов с иммунодефицитным состоянием, назофарингиальной карциномы, лимфомы Ходжкина и лимфомы Беркитта.
Существует очень немного вирусных заболеваний, диагноз которых устанавливается клинически и эпидемиологически. Это — корь, краснуха, ветряная оспа, эпидемический паротит, инфекционная эритема = пятая болезнь = инфекция парвовирусом В19, инфекционный мононуклеоз и некоторые другие. Практически все они относятся к так называемым детским инфекциям. В целом этиологическая и нозологическая диагностика вирусных инфекций затруднена и требует полимеразных, серологических, культуральных, патогистологических и других исследований.
Общими признаками вирусных заболеваний являются:
- Отсутствие гнойного воспаления. Это проявляется нередкой лейкопенией, нормальным или нечасто увеличенным количеством лейкоцитов без сдвига влево и токсической зернистости нейтрофильных гранулоцитов.
- Многим вирусным заболеваниям присуща лимфоцитарная реакция, наиболее отчетливая при инфекционном мононуклеозе. Выраженный лимфоцитоз выявляют также при вирусных гепатитах, эпидемическом паротите, краснухе, кори, цитомегалии.
- В клинической картине преобладают такие неспецифические изменения, как разбитость, вялость, тошнота, артралгия. Эти изменения могут появляться задолго до манифестации основных симптомов.
- Преимущественное поражение определенных органов при некоторых вирусных инфекциях (табл. 7.2.3). Так, лихорадочная реакция типична для вируса желтой лихорадка, энцефалита, гриппа А–С, кори, Марбурга — Эбола, ВИЧ-1 и -2, Эпштейна — Барр, герпеса типа 6, парвовируса В19. Экзантема — характерное проявление вируса кори, Эбола, простого герпеса 1–2, опоясывающего лишая, герпеса типа 6, ветряной оспы и вакцинии, парвовируса В19. Диареей проявляется инфекция, вызванная вирусами Норфолк, ротавирусом. Менингоэнцефалит типичен для полиовируса, кардиовируса, вируса энцефалита, парвовируса В19. Лимфаденопатия — типичный симптом инфекции, вызванной вирусом Эпштейна — Барр. Плеврит и кардит отмечают преимущественно при вирусной инфекции Коксаки В. Явления геморрагического диатеза могут быть при инфицировании вирусами желтой лихорадки, лихорадки Лаоса (аренавирусы), Ниара и Ханта (бунавирусы), но особенно типичны для вируса Эбола.
- Определяющее значение в диагностике имеет серологическое исследование. Выделение вирусов — очень трудоемкая процедура, которая в практических целях применяется достаточно редко.
Таблица 7.2.3
Некоторые РНК-содержащие вирусы человека и вызываемые ими поражения
| Симптом | Вирус | |||||||||||||||||||||
| Picorna | Calici | Rheo | Тоgа | Flavi | Orthomyxo | Paramyxo | Rhabdo | Filo | ||||||||||||||
| Polio | Coxsaky | ECHO | Entero | Rhino | Hepatitis А | Cardio | Norwalk | Rheo | Rota | Rubella | Febris flava | Dengue | Encephalitidis | Hepatitis C | Influenzae A, B,C | Parainfluenzae | Parotitis epidemica | Morbilli | RS | Rabies | Marbug/Ebola | |
| Лихорадка | + | + | ++ | ++ | + | (+) | (+) | + | (+) | ++ | + | +++ | ++ | +++ | (+) | +++ | ++ | + | + | (+) | (+) | +++ |
| Экзантема | +А | ++ | ++ | (+) | (+) | ++ | ++ | (+) | (+) | +++ | +++ | |||||||||||
| Цефалгия | + | (+) | (+) | (+) | ++ | + | (+) | + | ++ | +++ | +++ | + | + | + | (+) | ++ | ++ | |||||
| Артралгия/артрит | (+) | (+) | (+) | + | + | + | + | ++ | ++ | + | ++ | + | (+) | + | ||||||||
| Лимфаденопатия | + | + | (+) | ++ | + | ++ | + | ++ | + | |||||||||||||
| Конъюнктивит | + | + | + | + | (+) | + | + | + | (+) | ++ | ||||||||||||
| Ринит | + | + | + | +++ | (+) | (+) | (+) | ++ | ++ | + | + | |||||||||||
| Фаринготонзиллит | + | А++ | ++ | + | ++ | (+) | + | ++ | ++ | + | + | (+) | + | |||||||||
| Трахеобронхит | + | (+) | ++ | + | ++ | (+) | ++ | ++ | + | (+) | + | |||||||||||
| Пневмония | + | + | (+) | (+) | + | + | ||||||||||||||||
| Плеврит | В++ | |||||||||||||||||||||
| Тошнота/диарея | + | ++ | + | +++ | (+) | +++ | (+) | + | ++ | + | + | ++ | ||||||||||
| Гепатит | + | + | (+) | +++ | (+) | ++ | +++ | (+) | + | + | ||||||||||||
| Паротит/панкреатит/орхит | м | (+) | +++ | + | ||||||||||||||||||
| Менингоэнцефалит | +++ | + | + | ++ | +++ | +++ | (+) | (+) | (+) | ++ | + | |||||||||||
| Нейропатия/миопатия | +++ | (+) | + | (+) | (+) | + | ++ | |||||||||||||||
| Миокардит/перикардит | В++ | + | (+) | (+) | + | (+) | ||||||||||||||||
| Геморрагический диатез | (+) | ++ | + | (+) | (+) | +++ | ||||||||||||||||
| Почечная недостаточность | ||||||||||||||||||||||
| Т-клеточная лимфома, иммунодефицит | ||||||||||||||||||||||
| Симптом | Вирус | ||||||||||||||||||||
| Corona | Випуа | Retro | Неклассифицированные | Adeпо | Неpadпа | Herpes | Variolla | Parvo | Papova | ||||||||||||
| LCM* | Lassa | Phlebo | Nairn | Hanta | HTLV I(II) | HIV I/II | Hepatitis D | Hepatitis Е | Hepatitis B | Н. simplex 1+2 | Н. varicella zoster | Cytomegalia | Epstein — Barr | Туре 6 | Vakcinia | Variolla vera | Parvo 16 | JC | |||
| Лихорадка | ++ | +++ | + | ++ | +++ | +++ | +++ | (+) | (+) | ++ | (+) | (+) | + | + | +++ | +++ | (+) | +++ | +++ | ||
| Экзантема | (+) | (+) | ++ | (+) | (+) | (+) | (+) | +++ | +++ | (+) | + | +++ | +++ | +++ | +++ | ||||||
| Цефалгия | ++ | (+) | + | ++ | + | + | + | + | + | ++ | + | ++ | |||||||||
| Артралгия/артрит | ++ | ++ | (+) | + | + | + | + | (+) | (+) | + | + | +++ | + | ||||||||
| Лимфаденопатия | + | + | + | + | ++ | ++ | ++ | (+) | +++ | + | |||||||||||
| Конъюнктивит | + | + | + | + | ++ | + | + | + | ++ | ||||||||||||
| Ринит | ++ | ++ | ++ | + | + | ++ | + | ++ | |||||||||||||
| Фаринготонзиллит | + | ++ | ++ | ++ | (+) | ++ | + | ++ | |||||||||||||
| Трахеобронхит | ++ | ++ | ++ | ++ | (+) | (+) | |||||||||||||||
| Пневмония | (+) | + | (+) | + | + | ||||||||||||||||
| Плеврит | + | ||||||||||||||||||||
| Тошнота/диарея | + | ++ | + | + | + | + | ++ | + | |||||||||||||
| Гепатит | +++ | +++ | +++ | (+) | (+) | ||||||||||||||||
| Паротит/панкреатит/орхит | (+) | ||||||||||||||||||||
| Менингоэнцефалит | + | + | + | ++ | + | (+) | (+) | ++ | (+) | + | + | +++ | |||||||||
| Нейропатия/миопатия | (+) | + | |||||||||||||||||||
| Миокардит/перикардит | + | (+) | (+) | (+) | |||||||||||||||||
| Геморрагический диатез | (+) | ++ | ++ | ++ | |||||||||||||||||
| Почечная недостаточность | |||||||||||||||||||||
| Т-клеточная лимфома, иммунодефицит | + | +++ | |||||||||||||||||||
*LCM — лимфоцитарный менингит; А — прежде всего при Коксаки А; В — прежде всего при Коксаки В.
Среди вирусных заболеваний основное место по распространенности принадлежит, безусловно, инфекциям верхних дыхательных путей или так называемым простудным заболеваниям. Это острая, обычно афебрильная вирусная инфекция респираторного тракта с воспалением какого-то участка или всех воздухоносных путей, включая полость носа, придаточных пазух, глотки, гортани, иногда трахеи и бронхов. В 90% случаев причиной заболевания являются вирусные инфекции (пикорнавирусы, прежде всего риновирусы, ЕСНО-вирусы и вирусы Коксаки), только 10% составляют микоплазмы и хламидии. 40–55% всех случаев инфекций верхних дыхательных путей вызываются одним из более чем 100 серотипов риновирусов. В относительно замкнутом коллективе (школа, казарма) за взрыв заболеваемости ответственен один вирус. Риновирусная инфекция редко возникает в зимние месяцы, когда преобладают грипп и риносинцитиальный вирус. Пребывание на холоде само по себе, состояние верхних дыхательных путей (аденоиды, гиперплазия миндалин) не приводят к заболеванию вирусными инфекциями верхних дыхательных путей. Заболевание тяжелее переносят больные с ожирением, лица в состоянии стресса, с аллергическими назофарингитами, женщины в середине менструального цикла. Важным является наличие специфических нейтрализующих антител в сыворотке крови и в секретах, что свидетельствует о предшествующем контакте с этим или близким вирусом и относительной защите от инфекции.
Клинические симптомы неспецифичны. Через 24–72 ч инкубационного периода остро начинается «жжение» в носу или в глотке, быстро сменяющееся чиханием, ринореей, общим недомоганием. Повышение температуры тела, особенно при инфицировании рино- и коронавирусами, не характерно. Рано развивается фарингит. Вероятность развития ларингита и бронхита варьирует в зависимости от резистентности макроорганизма и этиологического агента. Отделяемое из носа, водянистое и профузное в первые дни, становится слизистым и слизистогнойным. Последний вариант вовсе не обязательно указывает на бактериальную инфекцию. Кашель не слишком сильный и, как правило, проходит в ближайшие 2 нед. При ДД необходимо учитывать аллергические и вазомоторные риниты, бактериальные синуситы. Бактериальное поражение верхних дыхательных путей, легких, других органов следует за вирусным, особенно высока такая вероятность у детей младшего возраста, лиц старческого возраста и пациентов с недостаточностью иммунитета.
Грипп — острое респираторное заболевание с частым последующим наслоением бактериальной инфекции (стрепто-, стафиллококков, пневмококков и др.) вызывается вирусом гриппа (миксовирусом), передающимся воздушно-капельным путем. Типичные пандемии гриппа вызывает вирус гриппа А, эпидемии — тип А и В, эндемичные вспышки — вирус В и С. Для вируса гриппа типично внедрение в эпителиальные клетки слизистой оболочки с их некрозом и геморрагическим синдромом. Тяжело протекающее заболевание начинается через 1–2 дня инкубационного периода с высокой упорной лихорадкой, озноба, интоксикации, головной и заглазничной боли, гиперестезии кожи, миалгии, артралгии. Кашель сухой, болезненный, со скудной вязкой слегка кровянистой мокротой. Больных беспокоит загрудинная боль. Наиболее частое осложнение — бронхиолит, пневмония, менее частое — отит, мастоидит, редко — миокардит, перикардит, менингоэнцефалит.
Парагрипп. Возбудителями являются парамикровирусы типов 1, 2, 3 и 4, вызывающие респираторные заболевания, тяжесть которых варьирует от банального недомогания — «простуды» до гриппоподобных пневмоний. Парагрипп возникает в любое время года. Подвержены в основном дети, у которых эти вирусы, особенно типы 1 и 2, вызывают так называемый ложный круп. Взрослые оказываются естественно иммунизированными, и течение заболевания у них более легкое.
Первый контакт с вирусами парагриппа типов 1 и 3 происходит в раннем детстве и в детстве в яслях, детских садах и школах. Особенно контагиозен вирус типа 3, поражающий детей первого года жизни. Тип 2 вызывает эпидемические вспышки в любых возрастных группах. Тип 4 имеет перекрестные антигены с вирусом эпидемического паротита, инфекция этим типом вируса парагриппа протекает достаточно мягко.
У детей парагрипп протекает как острое лихорадочное респираторное заболевание. Клинически оно неразличимо от гриппа или других респираторных заболеваний этой же возрастной группы. Инкубационный период в какой-то степени зависит от типа вируса: 24–28 ч для вирусов парагриппа 3 и 4–5 дней — для вируса парагриппа 1. Заболевание начинается с лихорадки и умеренного насморка. Общие симптомы зависят от выраженности лихорадки. В большинстве случаев температура не превышает 38 °C, но может достигать и 40 °C. Гипертермия длится 2–3 дня, при поражении нижних дыхательных путей — 1 нед и больше. Бронхит или вирусная пневмония с летучими инфильтратами развиваются во время или тут же после первого острого эпизода вирусного заболевания чаще у детей, реже — у взрослых, инфицированных вирусом типа 3.
Респираторно-синцитиальная вирусная инфекция— острое вирусное заболевание нижних дыхательных путей (в том числе бронхиолит и пневмония) у детей грудного и дошкольного возраста).
Вирус содержит РНК, классифицируется как пневмовирус. Серологически выделяют подгруппы А и В. Напоминают вирусы гриппа и парагриппа. Респираторно-синцитиальный вирус — важнейшая причина заболевания нижних дыхательных путей с возможным летальным исходом. Многие случаи так называемого синдрома внезапной смерти у детей младшего возраста связывают именно с этим вирусом. У подростков и взрослых респираторно-синцитиальная инфекция протекает благоприятно, хотя и способна вызвать бронхопневмонии. Для пациентов старческого возраста и лиц с хроническими бронхолегочными заболеваниями не менее опасна, чем для младенцев.
В возрасте 5 лет у 70% детей уже есть антитела к респираторно-синцитиальному вирусу, но инфекция может повторяться в любом возрасте. Низкий защитный эффект антител подтверждается тем, что у детей до 6-месячного возраста, несмотря на наличие антител в крови за счет трансплацентарной передачи, инфекция протекает очень тяжело, прежде всего — при бронхопульмональной дисплазии.
Клиническая картина зависит от возраста, особенностей вируса, преморбидного фона. У детей первого года жизни может появиться апноэ, опережая иные симптомы. Достаточно специфичными признаками вирусной респираторно-синцитиальной инфекции является резкая одышка, кашель, бронхообструктивный синдром. Бронхиолиты и бронхопневмонии могут быть подтверждены рентгенологически. Количество лейкоцитов обычно не меняется. У детей старшего возраста и взрослых заболевание может протекать без повышения температуры тела по типу вирусных инфекций верхних дыхательных путей, но и у них вирус может симулировать грипп и служить причиной 14–18% всех госпитализаций по поводу обострений хронического бронхита.
Аденовирусная инфекция, вызывающая 4—6% респираторных заболеваний, протекает значительно мягче гриппозной. В настоящее время известно более 40 типов аденовирусов, вызывающих лихорадку, конъюнктивит, выраженный ринит, бронхит, сопровождающийся влажным кашлем. Достаточно часто отмечают болезненный местный лимфаденит. Одновременно с фарингоконъюнктивитом нередко появляется рвота, диарея и увеличение размеров печени. В 10–13% случаев выявляют легочные инфильтраты.
Только некоторые из этих 40 типов вирусов изучены настолько, что можно говорить об их клиническом значении (табл. 7.2.4).
Таблица 7.2.4
Синдромы, обусловленные аденовирусами
| Синдром | Типы аденовирусов | Клинико-эпидемиологические особенности | |
| Наиболее частые | Менее вероятные | ||
| Респираторный: | Наиболее частый клинический вариант аденовирусной инфекции. Типы 1, 2 и 5 — эндемичны. Тип 3 — эпидемические вспышки. Заболевание чаще развивается в холодное время года | ||
|
острое лихорадочное респираторное заболевание у детей |
1, 2, 3, 5, 6 | Другие типы | |
| острое респираторное заболевание у взрослых | 4, 7 | 14, 21 | Эпидемически — в казармах у новобранцев. *Спорадически — у взрослых в гражданских условиях. Типы 4 и 7 редко возникают у детей |
| вирусная пневмония у детей | 7 | 1, 3 | Редко. Возникает у госпитализированных детей младшего возраста. Протекает тяжело, может напоминать синдром Гудпасчера |
| вирусная пневмония у взрослых | 4, 7 | 3, 21 | Как правило, развивается после острого вирусного заболевания взрослых (см. выше). Холодовые агглютинины не появляются |
| Глазной: | |||
| острый фолликулярный конъюнктивит | 3, 7 | 2, 4, 6, 9, 10, 21 | Спорадически. Поражает преимущественно взрослых. У детей протекает с респираторными и системными проявлениями |
| эпидемический кератоконъюнктивит | 8 | 3, 7, 19 | Отмечается в основном у взрослых. Широко распространен в Японии |
| Сочетание глазного и респираторного синдромов | 3, 4, 7 | 1, 2, 5, 6, 14, 21 | Эпидемически у детей. Спорадически — у взрослых. Летние вспышки связаны с купаниями в бассейнах или озерах |
*Вакцина включена в список обязательных в армии США.
Коксаки-вирусы вместе с полио-, ЕСНО-вирусами и вирусом гепатита А принадлежат к энтеровирусам (см. полиомиелит). Сезонное повышение заболеваемости этой инфекцией приходится на весну и осень. Герпетиформная ангина (Коксаки А2, А4–6, А8, А10) развивается преимущественно у детей в летний период. Заболевание начинается остро с высокой температуры тела, общего плохого самочувствия, интенсивной боли в горле. Типично наличие 10–20 папуловезикулярных высыпаний диаметром 1–2 мм с узким венчиком гиперемии в основании мягкого неба, на язычке и передних дужках. ДД проводят с ангиной Симановского — Венсана, афтозным или язвенным стоматитом.
Оро-пальмарно-плантарная эритема (Коксаки А6, А10, А16) — благоприятно протекающее лихорадочное заболевание преимущественно детского возраста. На слизистой оболочке ротоглотки, ладонях и подошвах появляются везикулы, трансформирующиеся в язвочки, отличающиеся от герпетиформной ангины большими размерами и локализацией, кроме слизистой оболочки полости рта, на ладонях и подошвах.
Борнхольмская болезнь, или эпидемическая плевродиния, или эпидемический миозит, или полидения (Коксаки ВЗ, В4), начинается остро с повышения температуры тела до фебрильных цифр, головной боли, интенсивной боли в мышцах, особенно в нижнебоковых отделах грудной клетки и эпигастрии, реже — в мышцах проксимальных отделов конечностей. Боль усиливается при дыхании и движениях, приступообразная. В перерывах между болевыми приступами состояние улучшается. Из осложнений отмечают серозный менингит, серозит, миокардит, орхоэпидидимит.
Основные заболевания и синдромы, вызываемые энтеровирусами, приведены в табл. 7.2.5.
Таблица 7.2.5
Основные состояния, вызываемые энтеровирусами
| Синдром | Тип вируса | Основные проявления |
| Асептический менингит | Вирусы Коксаки А2, 4, 6, 7, 8, 9, 10, 23 и др., В1–6; полиовирусы 1–3; ЕСНО-вирусы 4, 6. Реже — другие | Дети младшего возраста преимущественно. Исход собственно менингита благоприятен |
| Вялые параличи | Полиовирусы 1–3; вирусы Коксаки А7 и другие реже; ЕСНО-вирусы 4, 6 и др., энтеровирусы 71 | Чаще — у детей. Парезы достаточно мозаичны. Асептический менингит |
| Миокардит | Вирусы Коксаки В1–5, А4, 14, 16; ЕСНО-вирусы 1, 6, 9, 19 | Возможен в любом возрасте. Врожденный кардит у новорожденных — фатален и является одним из проявлений внутриутробно перенесенной инфекции |
| Перикардит | Вирусы Коксаки А23, В1–5; ЕСНО-вирусы 1, 6, 8, 16 | Возможен в любом возрасте. Не исключено поражение миокарда. Деление на мио- и перикардит при соответствующей вирусной инфекции обусловлено, скорее, яркостью соответствующего синдрома, а не отсутствием другого |
| Эпидемическая плевродиния (болезнь о. Борнхольм) | Вирусы Коксаки В1–6 | Может поражать представителей всех возрастных групп, но чаще — детей |
| Оро-пальмарно-плантарная эритема | Вирусы Коксаки А6, 10, 16!; энтеровирус 71 | Прежде всего — у детей младшего возраста |
| Герпангина | Вирусы Коксаки А2, 4–6, 8, 10. Не исключен вирус Коксаки АЗ и другие | Чаще — у детей дошкольного и младшего школьного возраста |
| Сыпь и лихорадка | Вирусы Коксаки А23, В2, 3, 5; ЕСНО-вирусы 4. Реже: вирусы Коксаки А4–6, 9, 16; ЕСНО-вирусы 2, 6, 9, 11, 14, 16, 18, 30 | Течение благоприятное |
| Сыпь, лихорадка, асептический менингит | Вирусы Коксаки А16, 23, В4; зховирусы 4, 16; энтеровирус 71 | Чаще — у детей. Течение благоприятное |
| Конъюнктивит | Вирус Коксаки А24; ЕСНО-вирус 7; энтеровирус 70 | У детей течение благоприятное. Геморрагический конъюнктивит — при инфицировании энтеровирусом 70 |
| Респираторное заболевание | Вирусы Коксаки А21, 23, ВТ, 3–5; ЕСНО-вирусы 4, 8, 11, 20, 22–25; полиовирусы 1–3 | У детей дошкольного и младшего школьного возраста чаще, чем у старших |
| Диарея | ЕСНО-вирусы 6, 14, 18. Многочисленные энтеровирусы | Особенно опасны у новорожденных и недоношенных |
Корь (парамиксовирус) — высококонтагиозное лихорадочное заболевание с типичной экзантемой. 90% населения переносят инфекцию в детском возрасте. Продромальная фаза длится 3–5 дней и характеризуется нарастающей интоксикацией, повышением температуры тела, катаральными явлениями (конъюнктивит, ринит), сухим кашлем. После короткого бестемпературного периода появляется коревая сыпь, распространяющаяся с лица, заушных областей на шею, туловище и только потом на конечности. Элементы сыпи вначале выглядят как мелкие папулки розового цвета. Через несколько часов каждая папулка окружается гиперемированным венчиком. Сыпь склонна к слиянию. Типичны так называемые пятна Коплика — Филатова, мелкие белесоватые пятна на слизистой оболочке щек на уровне премоляров. Каждая волна высыпания сопровождается повышением температуры тела, ухудшением общего состояния. После сыпи остается фиолетовая пигментация, затем развивается мелкоотрубевидное шелушение. Болезнь сопровождается выраженным угнетением иммунитета, до полугода сохраняется повышенный риск активации дремлющих микобактериальной или любой другой инфекций.
Кроме бактериальных инфекций возможны следующие осложнения:
- Острая тромбоцитопеническая пурпура. Развивается в острый период болезни.
- Энцефалит. Частота 1:2000 случаев кори. Начинается на 2–3-й неделе после появления сыпи. Часто начинается с высокой температуры тела, судорог, комы. В спинномозговой жидкости лимфоцитов 50–500/мкл, незначительное повышение содержания белка. Отсутствие изменений спинномозговой жидкости в начале заболевания не исключает энцефалит.
- Подострый склерозирующий энцефалит, или синдром Ван-Богарта — Озе (см. главу Синкопальные состояния).
Атипичный коревой синдром (митигированная корь). Существует два варианта: 1) возникает в ответ на вакцинацию живой коревой вакциной. Протекает легче, чем собственно корь, но лихорадка и характер сыпи идентичны кори; 2) корь у людей, ранее вакцинированных инактивированной вакциной.
Краснуха, или немецкая корь, или трехдневная корь (тоговирус). Пик заболеваемости приходится на подростковый возраст. Экзантема, как и при кори, появляется первоначально на шее, лице, но отсутствует катаральный период, самочувствие страдает мало. Сыпь бледно-розовая, быстро исчезает, не оставляя пигментации. Патогномонично увеличение затылочных, заднешейных, заушных ЛУ. Нередко отмечают увеличение селезенки. У взрослых пациентов краснуха часто протекает сочетанно с артритом, а у мужчин — с болью в яичках.
Редким, но фатальным осложнением является энцефалит. Описан практически только у молодых солдат. Вполне вероятно, из-за того, что никто не думает укладывать новобранца в постель и поить теплым чаем при незначительном повышении температуры тела, достаточно эфемерной сыпи и лимфаденопатии.
Эпидемический паротит (парамиксовирус) примечателен увеличением слюнных желез, вначале односторонним, через 1–2 дня появляется паротит и с противоположной стороны. Ушные раковины при этом могут слегка оттопыриваться, на слизистой оболочке щеки видно гиперемированное устье слюнного протока. Это состояние сопровождается головной болью, повышением температуры тела. С возрастом нарастает вероятность развития панкреатита, орхита, менингоэнцефалита. Последний может развиться и без клинически значимого поражения слюнных желез. В крови — лимфомоноцитоз, что не типично для гнойного поражения слюнных желез. ДД проводят с гипертрофией околоушных желез, синдромом Шегрена, опухолями и лимфоэпителиальными кистами, тифом.
Гипертрофию слюнных желез выявляют при алкоголизме, ожирении, СПИДе, применении йодидов или гаунетидинов.
Синдром Шегрена характеризуется лимфоматозной инфильтрацией слюнных желез, увеличением слюнных и слезных желез, сухостью слизистой оболочки. На сиалограмме отмечают деформацию слюнных протоков. Это же исследование необходимо выполнить при подозрении на наличие камней в протоках слюнных желез. Полезным может оказаться эхоГ-сканирование с частотой не ниже 5 МГц. Тератомы слюнных желез характеризуются медленным односторонним ростом, отсутствием признаков воспаления.
Бешенство (рабдовирус) развивается через 1–3 мес после укуса или ослюнения больным животным. Исход развившегося заболевания фатальный. В наших регионах переносчиками и резервуаром вируса являются собаки, кошки, лисы, волки, хомячки, белки, практически любое животное. От входных ворот вирус по периневральным пространствам достигает спинного и головного мозга, где и начинает размножаться. По афферентным нервам он спускается в слюнные железы, а оттуда — в слюну. Инкубационный период составляет от 10 дней до 1 года и более. Чем ближе к голове и глубже укус, тем короче инкубационный период. Через 1–2 дня продромального периода (повышение температуры тела, головная боль, осиплость голоса, затруднение глотания, депрессия) развивается клиника заболевания, которое в 85% случаев манифестирует парестезией в области уже зажившего укуса. Быстро присоединяются психические и вегетативные нарушения, спазмы дыхательных и глотательных мышц (отсюда и водобоязнь), параличи. Если смерть не наступает в период судорожного спазма дыхательных мышц, то наступает 3-я стадия — паралитическая, развивается кома и коллапс.
В манифестный период наличие вируса может быть подтверждено флюоресцентной реакций связывания антител. Микроскопически в цитоплазме клеток головного мозга, обычно в области аммонова рога, выявляют специфические включения (тельца Негри), но не всегда удается их выявить.
Группа вирусов герпеса обусловливает первичную часто бессимптомную инфекцию, переходящую в носительство (латентная инфекция) с обострением в период снижения иммунитета. Реактивация не сопровождается появлением антител группы IgM.
- Ветряная оспа — острое инфекционное заболевание, возникающее преимущественно у детей. После 2–3-недельного инкубационного периода развивается бессистемно расположенная бледнорозовая сыпь, переходящая в папулезную, которая, в свою очередь, быстро трансформируется в везикулы. Дополнительные элементы появляются толчкообразно, что сопровождается повторными повышениями температуры тела. На теле одного больного в результате этапности сыпи существуют разные элементы (ложный полиморфизм). Достаточно часто увеличиваются шейные Л У. Осложнения (присоединение бактериальной инфекции, варицеллезные пневмонии, менингоэнцефалиты) возникают очень редко и прежде всего при иммуносупрессии. В качестве отличия от натуральной оспы описывали отсутствие везикул на ладонях и подошвах, но при тяжелом течении ветряной оспы, особенно у иммуноскомпроментированных пациентов, везикулы появляются повсеместно.
Осложнениями ветряной оспы являются:
- Вторичная стрепто- или стафилококковая инфекция. Рожа, сепсис, некротизирующий фасциит, пиодермия, буллезное импетиго, пневмония.
- Нефрит, миокардит, преходящий артрит, гепатит, тромбоцитопеническая пурпура.
- Энцефалопатия. Частота — 0,5–0,8:1000. Острая постинфекционная мозжечковая атаксия, миелит.
Все осложнения несравненно чаще возникают у иммуноскомпроментированных пациентов.
- Опоясывающий лишай вызывает тот же вирус, что и ветряная оспа, поэтому при наличии в семье больного взрослого в результате контакта ребенок может заболеть ветряной оспой. Опоясывающий лишай — результат реактивации латентной инфекции. Провоцирующими факторами являются ионизирующее облучение области спины и позвоночника, травмы, оперативные вмешательства, злокачественные новообразования, простудные заболевания, психический стресс (любой стресс вызывают новые соотношения гормонов надпочечников, адреналина и минералов в крови). Перед высыпанием появляется интенсивная односторонняя боль по ходу нервных стволов. Затем появляются грозди папулезных высыпаний, трансформирующихся в везикулярные. Часть везикул может быть геморрагическими, при тяжелом течении остаются язвочки, заживающие рубцами. Невралгия ранее пораженных сегментов у ослабленных больных и стариков могут сохраняться в течение месяцев после заживления эффлоресценций. Герпетическое высыпания на глазу и в ухе могут оставить тяжелейшие органные изменения. При лимфомах, лейкозах, СПИДе и многих других состояниях возможна генерализация герпетической инфекции. Из осложнений известны менингит, энцефалит, пневмония, миелит.
- Простой герпес (вирус простого герпеса типов 1, 2) в 98% случаев первично поражает новорожденных, детей грудного возраста и затем сопровождает инфицированных в течение всей жизни. У детей манифестирует как стоматит и гингивит, герпетическая экзема (вирус типа 1). Вирус типа 2 обусловливает герпетический проктит и поражение гениталий, герпетический сепсис новорожденных. Реактивация, как всегда, провоцируется лихорадочными заболеваниями или состояниями иммуносупрессии, в том числе интенсивной инсоляцией, желудочно- кишечными расстройствами. За 1—2 дня до высыпаний, по внешнему виду напоминающих таковые при опоясывающем лишае, появляется ощущение местного жжения, боль, распирание. Присоединяются лимфаденопатия, лихорадка, дизурия.
Инфекционный мононуклеоз, или железистая лихорадка Филатова — Пфейфера (вирус Эпштейна — Барр). Вирус Эпштейна— Барр напоминает вирус герпеса. Паразитирует в В-лимфоцитах и клетках слизистой оболочки назофарингеальной зоны человека и приматов. После первой волны репликации в носоглотке вирус проникает в В-лимфоциты и запускает синтез гетерофильных антител. В-лимфоциты, трансформированные вирусом Эпштейна — Барр, становятся мишенью для иммунного ответа. Клеточный иммунный ответ заключается в активации Т-лимфоцитов с поверхностным фенотипом CD8. Этот механизм играет важнейшую роль в предотвращении перехода пролиферации трансформированных В-лимфоцитов в поликлональную В-клеточную активацию. То естьТ-клеточный CDS-ответ, по сути дела, мешает трансформации инфекционного процесса в назофарингеальную карциному, лимфому Ходжкина и другие лимфомы.
В последние годы многие авторы связывают с хронической инфекцией вирусом Эпштейна — Барр синдром хронической усталости (см. главу Анамнез), проявляющийся разбитостью, вялостью, нередко выраженными когнитивными нарушениями, иногда субфебрилитетом и лимфаденопатией. Но объективных доказательств этой гипотезы нет.
Инфекция чаще протекает бессимптомно. 50% детей в возрасте до 5 лет уже сталкивались с ней. При длительном наблюдении больших групп лиц молодого возраста инфекция вирусом Эпштейна — Барр диагностирована только по результатам сероконверсии у 30–70% студентов и у 90% солдат (но и здесь в ряде случаев, видимо, применим принцип: кто обращается, тот и болеет). Клинически значимое состояние протекает с повышением температуры тела, ангиной с налетами и язвочками и геморрагическими петехиями на границе твердого и мягкого неба. Типично наличие завесы прозрачной слизи по задней стенке глотки. Значительно увеличиваются шейные ЛУ, хорошо отграниченные друг от друга, умеренно болезненные. В меньшей степени увеличиваются ЛУ других групп. Более чем в половине случаев увеличивается селезенка, в 25% — печень с одновременной умеренной гипертрансаминаземией. Желтуха не типична, хотя при исследовании биоптатов выявляют признаки гепатита. Иногда описывают сыпь, напоминающую краснушную, на туловище и проксимальных отделах конечностей. В 1% случаев диагностируют менингит, энцефалит, а также полирадикулоневрит, миокардит, преходящую гематурию с АГ, орхит. В крови — лейкоцитоз, лимфоцитоз за счет мононуклеаров, среди которых выявляют до 10% атипичных клеток с большим поясом цитоплазмы. На 2–3-й неделе заболевания в 80% случаев возможно подтверждение гетерофильных антител реакцией Пауля — Бюннеля. Специфичной реакцией является выявление антител к капсиду вируса Эпштейна — Барр, которые сохраняются затем на протяжении всей жизни. У 70% больных уже на ранних стадиях заболевания методом иммунофлюоресценции можно выявить преходящие антитела к антигену вируса. Очень часто в крови появляются антитела в классе IgM и IgG к ампициллину, что обусловливает частую выраженную экзантему с лихорадочной реакций на этот антибиотик, назначаемый таким больным с целью профилактики вторичной инфекции или при первоначально ошибочной трактовке ангины как бактериальной этиологии.
При ДД ангины и лимфаденопатии при инфекционном мононуклеозе необходимо наряду с другими формами ангин, в том числе дифтеритической, помнить о ВИЧ-ассоциированной лейкоплакии. Последняя выглядит как плотные не отторгаемые налеты, гистологически представленные гипер- и паракератозом, в развитии которых решающее значение также принадлежит вирусу Эпштейна — Барр.
Цитомегаловирусной инфекции принадлежит одно из первых мест среди всей врожденной инфекции новорожденных. У 40–90% населения промышленно развитых стран на протяжении всей жизни выявляют спонтанные колебания титров реакции связывания комплемента. Чем ниже на социальной лестнице стоит человек, тем выше частота носительства цитомегаловируса. Для «свежей» инфекции типично появление IgM против цитомегаловируса. Течение этой инфекции клинически проходит с повышением температуры тела, увеличением размеров печени и селезенки, лимфоцитозом. Возможны энцефалит, полирадикулопатии, ретинит. При реактивации цитомегаловирусной инфекции на фоне массивных гемотрансфузий, операций, новообразований, ВИЧ-инфицирования, она может обусловить развитие пневмонии, ретинита, энцефалита, поражения кишечника и реакции отторжения пересаженных органов. Постперфузионная/посттрансфузионная цитомегаловирусная инфекция напоминает инфекционный мононуклеоз. Выделение вируса возможно из мочи и мазков из ротоглотки. Выявляют типичные гигантские клетки эпителия, напоминающие «птичий глаз».
Арбовирусы (ARthropode BOme VIRUSES — вирусы, передаваемые клещами) — вызывают обычно бессимптомную инфекцию. Заболевание манифестирует с неспецифических признаков: повышение температуры тела, общее недомогание, боль в костях и мышцах. В жарких странах это более яркая инфекция: геморрагические желтая лихорадка и лихорадка Денге, лихорадка Паппатачи (тяжелый конъюнктивит), западнонильская лихорадка с кожной сыпью, клещевой энцефалит, серозный лимфоцитарный менингит.
Вирусные геморрагические лихорадки эндемичны на Юге, Юго-Востоке и Востоке России, в Крыму, а за рубежом в ряде регионов, интенсивно посещаемых нашими туристами: Корея, Юго-Восточная Азия, Индия. Высокая вероятность заболевания вирусными геморрагическими лихорадками существует в Центральной Америке, Центральной и Южной Африке. Печально знаменита лихорадка Марбург — Эбола с летальностью до 80–90%. Резервуар многих геморрагических лихорадок— клещи, крысы и обезьяны. Передача осуществляется при тесном контакте от человека к человеку, при неосторожной обработке крови, выделений.
Клиническая картина всех геморрагических лихорадок достаточно однотипна. Инкубационный период длится 3–16 дней, после чего начинается гриппоподобный продромальный период: лихорадка с экзантемой, диарея, боль в грудной клетке, миалгия, миокардит, гепатоспленомегалия, нарушения сознания. Развивается геморрагический диатез, который может обусловить поражение почек. С учетом того, что вирусы наиболее тяжелых вариантов геморрагических лихорадок уже были занесены в Европу, подозрение на вирусную геморрагическую лихорадку должно автоматически сопровождаться изоляцией больного, тщательнейшим уничтожением всех выделений и материалов, использованных для ухода, самоконтролем медицинского персонала. Нельзя стремиться выделить вирус самостоятельно в общих вирусологических лабораториях.
Гепатиты А–Е также могут проявляться с повышением температуры тела, но основной симптом — желтуха. Их описание см. в соответствующем разделе.
Ящур (эпидемический стоматит). Острое антропозоонозное вирусное заболевание с язвенным поражением слизистой оболочки полости рта, носа и кожи вокруг рта и ногтевого ложа. Взрослые заболевают очень редко, чаще болеют дети. Инкубационный период 2–12 (чаще — 3–4) дней. Начинается остро с высокой (40–41 °C) температуры тела, выраженной миалгии, тахикардии, переходящей в брадикардию. Появляются гиперемия глаз, жидкий стул, боль при мочеиспускании. На отечных губах, слизистой оболочке полости рта, зева, на кистях, стопах появляются пузырьки, заполненные желтоватой жидкостью. Везикулы лопаются с образованием обширных язвенных площадей. Возможно выпадение ногтей. Язвы могут образовываться в желудочно-кишечном тракте (возможен холероподобный синдром с примесью крови в кале), в дыхательном дереве (геморрагический трахеобронхит, пневмония). Могут возникать гепатит, кардит. Через 3–5 дней появляются обнадеживающие признаки (снижение температуры тела, уменьшение интоксикации), хотя выздоровление может затянуться до 2–4 нед. Рубцов после заживления язв не остается. Затяжные хронические формы могут длиться до 1–1,5 года.
В анализах крови в начале эритроцитоз, лейкоцитоз; затем — лейкопения. Почти постоянно — эозинофилия.
Диагноз подтверждается вирусологическими и серологическими исследованиями.
ДД лихорадочных инфекционных состояний по их ключевому признаку — сыпи — приведена в табл. 7.2.6.
Таблица 7.2.6
| Болезнь, причина | Предпочтительный возраст | Сезон | Продромальный период | Тип сыпи | Характер распространения | Сопутствующие проявления | Принципы диагностики | Особые действия |
| Корь | Дошкольный и младший школьный | Зима/весна | Высокая лихорадка, поражение верхних дыхательных путей, конъюнктивит | Эритематозные макулы и папулы, частью сливные | Вначале появляется на лице, затем спускается на туловище и конечности | Энантема на мягком небе; пятна Филатова — Коплика, фотофобия, кашель | Клиника; гемаглютинация | Экстренное извещение в СЭС |
| Краснуха | Подростки/юношеский | Весна | Общее самочувствие страдает мало, лихорадка невысокая или отсутствует | Красные, розовые папулы; не сливаются | Начинается на лице, затем спускается вниз | Увеличение задношейных лимфоузлов, тошнота | Клиника, краснушный IgM | Экстренное извещение в СЭС, исключить контакты с беременными |
| Инфекционная эритема (парвовирус В19) | 5–15 лет | Зима/весна | Практически не бывает | «Пылающие щеки»: сетчатая или макуло- папуллезная эритема | Обычно руки/ноги, но может быть генерализация | Сыпь волнообразно в течение нескольких недель то расцветает, то угасает; головная боль; возможен артрит | Клинически, серологически | |
| Розеола (вирус герпеса 6) | 6 мес–3 года | Конец весны | Высокая лихорадка в течение 3- 5 дней | Макуло-папуллезная сыпь появляется после снижения температуры тела | Туловище, шея; может быть генерализированной; сохраняется от нескольких часов до дней | Увеличение шейных и заушных лимфоузлов | Клинически | |
| Ветряная оспа | 1 год–14 лет | Февраль–весна | Обычно нет | Макулы, папулы, быстро переходящие в везикулы на гиперемированном основании; затем — корочки | Начинается с волосистой части головы, с лица; распространяется на туловище, конечности | Зуд, лихорадка, могут отмечаться высыпания на слизистой оболочке | Клиника — как правило; возможна прямая иммунофлюоресценция, вирусная культура | Экстренное извещение в СЭС; при массивных высыпаниях назначают ацикловир |
| Энтеровирусная экзантема (Коксаки, ECHO и др. энтеровирусы) | <5 лет | Позднее лето | Лихорадка не очень типична | Очень вариабельна: макулы, папулы, петехии, везикулы, пурпура | Обычно генерализированная, может быть только на конечностях | Субфебрильная температура, миокардит, асептический менингит | Обычно — клинически; вирусная культура из глотки; редко — мазок из прямой кишки | При пурпуре и петехиях следует исключить менингококкцемию |
| Аденовирусная экзантема | 5 мес–5 лет | Зима/весна | Лихорадка; симптомы ОРВИ | Розеолоподобная сыпь; коре- или скарлатиноподобная | Генерализированная | Может развиваться пневмония | Серологически | |
| Эпштейна — Барр экзантема (вирус Эпштейна — Барр) | Дети/подростки | Вне зависимости от сезона, но чаще — осенью | Лихорадка, лимфаденопатия, ангина | Макулопапуллезная или кореподобная | Туловище, конечности | Гепатоспленомегалия |
СПИД и ВИЧ-ассоциированные заболевания впервые описаны в 1981 г., хотя в медико-географических публикациях сведения о заболеваниях, позднее отнесенных к критериям диагноза «СПИД», приводились значительно раньше. В настоящее время в мире насчитывается более 18 млн взрослых и 1,5 млн детей, инфицированных ВИЧ, из них не менее 5 млн клинически больны. В 1990 г. в России было зарегистрировано 103 ВИЧ-инфицированных, в 2000 г. выявлено 46 тыс. вирусоносителей. В 2002 г. зарегистрировано 103 тыс. ВИЧ-инфицированных. Но обследована только часть населения страны. Поэтому смело можно утверждать, что в России 500–700 тыс. инфицированных. По прогнозам заболеваемость ВИЧ-инфекцией будет расти еще несколько лет, потом инфицированность остановится на уровне 1–1,5 млн человек, но начнется новое явление: будут регистрировать вначале десятки, а затем и сотни тысяч смертей от СПИДа (Покровский В.И. и соавт., 2003). ВИЧ относится к ретровирусам подгруппе лентивирусов. Известны типы ВИЧ-1 и -2, передающиеся при сексуальных контактах, инъекциях, трансфузиях, ранениях зараженным инструментарием. Первичная инфекция протекает асимптомно или как мононуклеозоподобное состояние, сопровождаясь в этом случае лихорадкой, фарингитом, лимфаденопатией и другими симптомами. При ДД необходимо учитывать герпетическую инфекцию, токсоплазмоз, сифилис, генерализованую гонококковую инфекцию, медикаментозную аллергию (I стадия). Сероконверсия наступает через 3 мес после инфицирования. Большинство инфицированных в течение многих лет не предъявляют жалоб, возникающая в этот период лимфаденопатия является прогностически неблагоприятным фактором (II стадия). В III стадии развивается персистирующая генерализованная лимфаденопатия с увеличением Л У >1 см в течение минимум 3 мес в 2 группах и/или «неясная» спленомегалия. В III стадии через несколько лет постепенно формирующаяся иммунологическая недостаточность проявляется в виде кандидозного стоматита, лейкоплакии. Уменьшение массы тела составляет более 10%. Лихорадка длится непрерывно более 1 мес. Через 10–11 лет после инфицирования развиваются оппортунистические инфекции (типичны пневмоцисты) и опухоли (В-неходжкинские лимфомы, лимфомы ЦНС, саркома Капоши). С течением заболевания повышается вероятность поражения нервной системы (миелопатия, деменция, моторные нарушения).
Для оценки вероятности развития оппортунистических заболеваний и их прогноза служит определение количества СО4-лимфоцитов. Указанные заболевания развиваются при их уровне <0,2⋅109/л.
Грибковые инфекции
Увеличивающееся количество пациентов, применяющих антибиотики, кортикостероиды, имму- носупрессанты, цитостатики, а также увеличение продолжительности жизни больных с сахарным диабетом, лимфомами, лейкозами, другими опухолями, трансплантатами, приобретенными и врожденными нарушениями иммунитета неизбежно сопровождаются распространением грибковых, прежде всего системных поражений. Возникновение генерализо- ваных грибковых инфекций определяется соотношением вирулентностью гриба и состоянием защитных сил самого пациента. В защиту’ против грибковых инфекций вовлечены практически все звенья иммунной системы. Грибковые заболевания, развивающиеся как первичная инфекция, чаще имеют четко очерченный географический район. Например, бластомикоз типичен для Северной Америки и Африки, паракокцидиомикоз — для Южной Америки. Но некоренные жители этих мест, путешественники, могут развернуть клиническую картину заболевания спустя некоторое время после возвращения из эндемичной области. У лиц с нормальным иммунным статусом течение системных микозов проходит как первично хроническое заболевание. Могут пройти месяцы и годы, прежде чем жалобы и симптомы будут расценены как «серьезные» или, тем более, будет установлен диагноз. Первыми проявлениями обычно являются неясное недомогание, слабость, ночная потливость, сыпь, анорексия, уменьшение массы тела, угнетенность.
У пациентов с иммунодефицитными состояниями системные микозы чаще протекают остро или подостро. Быстро прогрессирует пневмония, развивается фунгемия, признаки экстрапульмональной манифестации.
Диагностика системных микозов крайне затруднена, поскольку нет достаточно надежных границ между колонизацией возбудителем и собственно инфекцией. Патогномоничные клинические, лабораторные или рентгенологические признаки не известно. Для диагноза системных микозов важны микроскопические и культуральные исследования мокроты, крови, ликвора, гноя, асцитической или плевральной жидкости, но посевы становятся положительными сравнительно поздно. Серологические методы диагностики требуют дальнейшего совершенствования.
Грибковую инфекцию следует заподозрить в следующих случаях:
- пациенты с лихорадкой на фоне злокачественных новообразований, болезней соединительной ткани, нарушений обмена (особенно сахарный диабет), нарушения иммунной системы и фагоцитоза, хронических инфекций (туберкулез, СПИД);
- травмы, обширные полостные вмешательства, длительное нахождение катетеров, диализ, трансплантация органов и имплантация инородных материалов (шунты, клапаны сердца, водители ритма), операции на сердце, полихимиотерапия, применение кортикостероидов в высоких дозах, длительное применение антибиотиков широкого спектра действия, ожоги, продолжительное пребывание в отделениях реанимации и интенсивной терапии, искусственное дыхание, алиментарная дистрофия, злоупотребление алкоголем, наркотики;
- узловатая эритема в анамнезе с наличием инфильтрата в легких при отрицательных результатах обследования на туберкулез (особенно подозрительно на тропические микозы!);
- наличие разнообразных клинических синдромов с/без лихорадки, которые клинически, бактериологически или вирусологически не соответствуют инфекционному заболеванию;
- септического характера состояния, не реагирующие на проводимую антибиотикотерапию;
- лихорадочные состояния, при которых выделенная флора (Str. albus и другая контаминационная флора, гранулоцитопения) не соответствуют тяжести болезни;
- первично атипичные пневмонии или пневмонии, не соответствующие клинико-диагностическим схемам или не реагирующие на стандартные схемы лечения;
- туберкулезоподобные изменения в легких при отсутствии микобактериальной инфекции;
- инфекции мочевых путей, не реагирующие на антибактериальную терапию;
- атипичный менингит, особенно при сопутствующей легочной патологии;
- наличие (по данным эхоГ, КТ, ЯМР) округлых очагов (эхонегативных) в печени, селезенке;
- наличие (рентгеновское исследование, КТ, ЯМР) округлых очагов в легких, особенно при появлении рентгенпозитивных округлых структур в их центре;
- появление рентгенпозитивного круглого подвижного образования в центре каверны.
Какие же биологические выделения и каким образом должен собрать врач, как часто повторить забор материала и какие задачи ставить перед лабораторией при подозрении на микозы (табл. 7.2.7)?
Таблица 7.2.7
Условия получения материала для микологических исследований (по W. Fegeler и соавт. с изменениями, 1990)
| Вид материала | Частый забор материала* | Плановое исследование** | Объем | Что можно определить | Примечания |
| Кровь на стерильность | Ежедневно | 10 мл без консервантов | Наличие и тип грибов, устойчивость к препаратам | Место инъекции обработать спиртом до забора крови дважды и дважды после удаления иглы. На высоте лихорадки брать кровь 3 раза с интервалом 30 мин. Набранную кровь инъецировать на аэробную среду. До транспортировки в лабораторию сохранять при температуре 37 °С | |
| Кровь на микосерологические исследования | Через день | Еженедельно | 10 мл без консервантов | Грибковые антигены и противогрибковые антитела | До направления в лабораторию сохранять при комнатной температуре |
| Моча | Ежедневно | Дважды в неделю | 10 мл | Грибы количественно. Антигены грибков. Устойчивость к препаратам | Хранить в холодильнике |
| Мокрота, трахеобронхиальный секрет | Ежедневно | Дважды в неделю | Не менее 2 мл | Грибы количественно. Устойчивость к препаратам | Собрать без примесей слюны. Одновременно взять мазок из полости рта. Хранить в холодильнике |
| Ликвор | Раз в неделю | до 10 мл | Грибы, антигены, устойчивость к препаратам | Ни в коем случае не тратить присланный материал на одновременные поиски микробов, вирусов,антител к вирусам | |
| Мазок из полости рта, жидкость от полоскания горла | Ежедневно | Раз в неделю | Грибы, устойчивость к препаратам | Мазок взять с подозрительных участков, из подъязычной области и с корня языка. Полоскание горла проводить 15 мл кипяченой воды в течение 1 мин. Промывную жидкость собрать в посуду с закручивающейся крышкой | |
| Каловые массы | Раз в 2 суток | Раз в неделю | Объем пробы не менее 5 мл | Грибы, устойчивость к препаратам | Хранить в холодильнике |
| Отделяемое из дренажей, пункционный материал, биоптаты | Грибы, устойчивость к препаратам | Биопсийный материал не помещать в формалин! |
*Частота исследований при подозрении на микозы; **частота исследований при достоверных микозах на фоне лечения.
Дрожжевые грибы (кандидоз, или монилиаз). Грибы рода Candida в норме являются комменсалами, колонизируют желудочно-кишечный тракт и реже — кожу. Поэтому, в противоположность другим системным микозам, кандидоз — эндогенная инфекция, не зависящая от окружающей среды. Кандидоз составляет 75–85% всех системных микозов. В настоящее время Candida spl. занимают четвертое место среди всех возбудителей, выявляемых в крови, и являются самой частой грибковой инфекцией у пациентов с иммунодефицитными состояниями.
Поражение полости рта, дыхательных путей (у 80% больных, находившихся на искусственной вентиляции легких более Юсут, развивается грибковая пневмония), пищеварительного тракта (боль в животе, анальный зуд, проктит, наличие более 106 дрожжевых клеток/г стула), кожи типично прежде всего для новорожденных и пациентов с резко ослабленным иммунитетом. Первичная кандидозная инфекция манифестирует как поражение кишечника, мочевых путей (особенно при сахарном диабете) или как бронхопневмония. Предрасполагающими к кандидозу факторами являются также гранулоцитопения (50% таких больных заболевают кандидозом), наличие внутрисосудистых катетеров, значительных по площади ожоговых поверхностей. Оперативные вмешательства с имплантацией могут обусловить кандидозный сепсис. Септикопиемические очаги выявляют в миокарде, почках, на мозговых оболочках. Клиническая картина соответствует бактериальной генерализованной инфекции: потрясающий озноб, проливной пот, гепато- и спленомегалия, дистрофия, анемия, лейкоцитоз. Церебральные и периферические эмболии более присущи грибковому сепсису, в то время как при бактериальных эндокардитах чаще выявляют микроэмболии. Гематогенный грибковый эндофтальмит выглядит как белое пятно на сетчатке, иногда гемморагическое, но с белым центром. Беловатый цвет витреальных помутнений, сбивающихся в комки, подозрителен на микоз. Микотические передний увеит и панувеит могут быть гранулезными или негранулезными, развиваться остро с выраженным раздражением глаза и гипопионом, вторичной глаукомой, либо с самого начала приобретать хронический характер. Иногда при исследовании щелевой лампой с большим увеличением в передней камере глаза удается увидеть густое переплетение коричневых нитей, напоминающих мох. Глубокий локализованный кандидоз выявляют в виде спондилита, артрита, остеомиелита, абсцесса печени. Восходящая грибковая инфекция возникает после пересадки почек и рентгенологически характеризуется образованием фунгусных шаров в лоханке. Изолированная пневмония возникает очень редко. У большинства иммуносупрессивных пациентов с легочным инфильтратом и наличием дрожжевых грибов в мокроте речь идет о банальной колонизации.
Хронический диссеминированный кандидоз известен под названием гепатоспленальный, хотя могут поражаться и почки. Протекает с трудно классифицируемой лихорадкой у пациентов с лейкозом, болью в животе, повышением активности щелочной фосфатазы. Диагноз основывается на результатах эхоГ или КТ, пункционной биопсии. Но даже в последнем случае результаты посевов в большинстве случаев отрицательны.
Криптококкоз (бластомикоз, или торулоз) распространен по всему миру. Протекает как хроническая грибковая инфекция с преимущественным поражением ЦНС и легких, реже — кожи и костей. Мужчины зрелого возраста заболевают чаще, чем женщины. Предрасполагающими факторами являются сахарный диабет, лимфомы, саркоидоз, применение иммуносупрессантов, ВИЧ-инфекция. Криптококкоковый менингит является болезнью-индикатором СПИДа. Базальный менингит и легочная манифестация криптококкоза очень схожи с туберкулезом. Диссеминированный кожный процесс может возникнуть у любого инфицированного и предстает в виде папул, пустул, изъязвлений, узлов, симулируя угри, контагиозный моллюск или базально-клеточную карциному.
Первичная пульмональная инфекция часто протекает бессимптомно, хотя служит источником рецидивов, как и криптококковая инфекция предстательной железы. Диагноз устанавливают на основании микроскопических данных, результатов культуральных исследований, при выявлении К-антигена латекс-агглютинацией и антител непрямой иммунофлюоресценцией. При выявлении крипококков в мокроте обязательно надо исследовать и ликвор.
Торулопсимикоз (Torulopsis glabrata) часто протекает как пиелонефрит. Об этом следует помнить в каждом случае хронической инфекции мочевых путей у лиц пожилого возраста, особенно с сахарным диабетом. Не исключены фунгиемия, пневмония и другие очаговые поражения. Проводить ДД Torulopsis glabrata от других дрожжевых грибов очень важно, поскольку они значительно более устойчивы к противогрибковым азолам (кетоконазол, флуконазол, итраконазол), чем собственно Candida.
Плесневые грибы, вызывающие аспергиллез, чрезвычайно распространены в окружающей среде. Выявляют в кондиционерах, обогревателях, на стенах палат, операционных, на медицинском оборудовании. Аналогично кандидам и криптококкам, поражают предварительно измененные ткани и органы. Чаще всего поражается респираторный тракт. Генерализованный аспергиллез — прогностически очень тяжелое состояние. Развиваются поражение ЦНС (головная боль, очаговая симптоматика, судороги), гематурия и почечная недостаточность, эндокардит. В сущности, могут быть поражены все органы и системы организма, но течение аспергиллезного сепсиса настолько стремительное, что симптоматика в основном ограничивается вышеприведенными признаками. Для диагностики применяют выявление антител методом иммунодиффузии.
Риноцеребральный аспергиллез протекает как тяжелый хронический синусит у пациентов с иммуннодефицитными состояниями на фоне гранулоцитопении. Появляется боль, параорбитальный отек и заглазничная боль, офтальмоплегия. Инфекция может распространяться в мозг, что сопровождается нарушением сознания и эпилептическими припадками. Диагноз основывается на результатах КТ околоносовых пазух и их пункции. Легочная форма аспергиллеза протекает как некротизирующая пневмония и характеризуется лихорадкой, кашлем, кровохарканьем, формированием полостей в легких. Но эти симптомы являются сравнительно поздними, первое проявление — лихорадка, протекающая на фоне неизмененной рентгенологической картины. В этом случае решающим является КТ, выявляющая множественные легочные очаги с ореолами или полости. Аспергиллезная пневмония при стандартной ренгенографии может давать картину инфаркта легкого или диффузной интерстициальной пневмонии. Решающим для этиологического диагноза является исследование промывных вод бронхов. Возможна хроническая некротизирующая аспергилезная пневмония у пациентов с хроническими неспецифическими заболеваниями легких, применяющих кортикостероиды. В отличие от аспергиллезной пневмонии у пациентов с гранулоцитопенией, хроническая аспергиллезная пневмония прогрессирует медленно, отсевы грибов в другие органы возникают редко.
Мукормикозы (Phycomycetes: Rhizopus, Absidia, Мисоr) развиваются только у пациентов с иммунодефицитными состояниями. Различают церебральную, легочную, гастроинтестинальную и диссеминированную формы. Церебральная форма поражает преимущественно лиц с сахарным диабетом, для нее типичны синусит с геморрагическим отделяемым и поражением черепно-мозговых нервов, особенно глазных и глазодвигательных пар. Злокачественные лимфомы и лейкозы предрасполагают к развитию легочного и диссеминированного вариантов. Поражение легких напоминает картину эмболии. Культуральные и микроскопические исследования чаще всего малоинформативны, поэтому основное значение для диагноза имеет биопсия, где гистологически выявляют большие ветвящиеся формы грибов.
Кокцидиоидомикоз, или лихорадка святого Жоакина (Coccidioides immitis), выявляют преимущественно в Америке. Как завозная инфекция кокцидоидомикоз стал появляться и в Европе. Заболевание высококонтагиозно, хотя без предшествующей иммуносупрессии в большинстве случаев протекает бессимптомно. Преимущественно поражается пищеварительный тракт. В 30% случаев развивается узловатая эритема, что существенно затрудняет ДД с туберкулезом. Диссеминированные варианты кокцидоидомикоза развиваются очень редко, протекают с остеолизом, периоститом и подострыми абсцессами и гранулемами, лептоменингитом. Печень и селезенка увеличиваются в размерах. Болезнь может развиться спустя недели — годы после выезда из эндемичного ареала. Диагноз подтверждается реакцией связывания комплемента и преципитацией.
Паракокцидиоидомикоз (Paracoccidioides brasiliensis). Прогрессирующий микоз кожи, слизистой оболочки, ЛУ, внутренних органов. Первоначально описан как четко локализованный микоз у мужчин в возрасте 20–50 лет, сборщиков кофе в Колумбии, Венесуэле и Бразилии. Но иногда стали регистрировать у пациентов с иммунодефицитными состояниями в Европе и США.
Слизисто-кожные очаги появляются первоначально на лице, губах, по краю ноздрей. Узловатые поражения медленно изъявляются. Региональные ЛУ увеличиваются, некротизируются. Висцеральные отсевы инфекции выявляют в виде очагов в печени, селезенке, брыжеечных ЛУ, что проявляется болью в животе.
Гистоплазмоз (вызываемый Histoplasma capsulatum) выявляют повсеместно. Передается воздушным путем. Преимущественно поражает бронхолегочную систему с развитием бронхопневмонии и регионарного лимфаденита. Наиболее вероятный контингент: недоношенные дети, пациенты с иммуносупрессией, в том числе ВИЧ-инфицированные, больные с лимфомами и лейкозами. Клинически доминируют поражение легких, ретикулоэндотелиальной системы, менее часто поражаются почки, ротоглотка (изъязвления), оболочки мозга, эндокард, кожа и желудочно-кишечный тракт. В крови — лейкопения, анемия, тромбоцитопения. Особое значение для диагноза диссеминированных форм имеет микроскопическое исследование биоптатов костного мозга и других пораженых тканей. Культуральные исследования посевов крови, ликвора, мокроты очень длительны. Из серологических методов диагностики наиболее значимы иммунодиффузия и реакция связывания комплемента.
Другие оппортунистические грибковые инфекции
Многие грибы могут выступать как оппортунистическая инфекция у иммуноскомпрометированных пациентов. Но они крайне редко поражают людей с интактной системой защиты. Распространенность грибковой инфекции определяют прежде всего разрушением естественных защитных барьеров и нарушениями иммунитета.
Trichosporon beigelii и Blastoschizomyces capitatus могут вызывать инфекцию у лиц с нейтропенией. У этих же больных Fusarium и Scedosporium обусловливают васкулит, симулирующий инвазивный аспергиллез. Дети и люди старческого возраста, получающие внутривенно липидные растворы для парентерального питания, предрасположены к фунгемии, вызванной Malassezia furfur.
Несмотря на сходную симптоматику многих грибковых инфекций, очень важен специфический культуральный диагноз, определяющий благоприятный исход заболевания путем подбора адекватной противогрибковой терапии. Например, Scedosporium первоначально устойчивы камфотерицину В.
Протозойные заболевания
Паразитарные инфекции широко распространены в странах Африки, Центральной и Южной Америки, Азии. В индустриально развитых странах их выявляют реже и спектр их менее широк. Путешественники заражаются в указанных регионах при укусах насекомыми, купании, употреблении загрязненной пищи или воды и т. д. Приезжие из эндемичных регионов редко становятся источником распространения тропических вариантов паразитов: не позволяют климатические условия, нет переносчика. Тем не менее передача завозной инфекции возможна при переливании крови, пересадке органов, а также фекально-пероральным путем, сохранившимся переносчиком (комара-анофелес выявляют в некоторых регионах Европы и США) или местным насекомым и/или животным, вдруг оказавшимся способным выполнить роль переносчика.
Токсоплазмоз — наиболее распространенный зооноз. Заболеваемость повышается с возрастом, а также у беременных и пациентов с иммунодефицитными состояниями. Toxoplasma gondii — облигатный внутриклеточный паразит. Бесполым путем размножается в любых содержащих ядро клетках. Когда у хозяина формируется достаточный иммунитет, деление тахизоидов прекращается и образуются тканевые цисты, способные переживать годы (рис. 7.3), особенно в мышцах и мозгу. Половое размножение Т. gondii происходит только в кишечнике кошек. Образовавшиеся ооцисты с фекалиями попадают в окружающую среду и способны прожить в почве более 1 года.
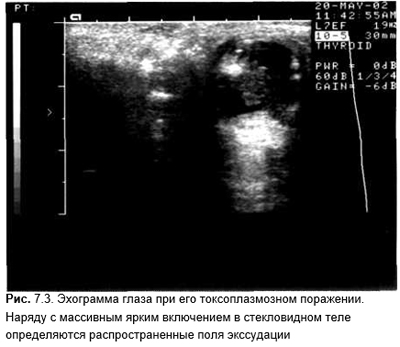
Переносчиками являются собаки, кошки, мыши, крысы и многие другие животные, а также тараканы. Учитывая наличие в квартирах современных городов перечисленных переносчиков, можно не упоминать коров, лошадей, коз и других. Инфекция передается при непосредственном контакте с больным животным, при загрязнении пищи его выделениями (заражение ооцистами от кошек — наиболее частый пероральный тип заражения) или с плохо обработанным мясом и молоком. Наряду с этим возможно трансплацентарное заражение, передача токсоплазм при переливании цельной крови, лейкоцитарной массы или с трансплантатами. Инфицировано не менее половины населения в возрасте 15–50 лет, старше 70 лет инфицированы практически все обследованные. К счастью, из 100 инфицированных женщин только 1 передает инфекцию трансплацентарно своему ребенку. Из 1000 инфицированных детей только у 1 развивается клинически значимое заболевание. Из 1000 больных необратимые изменения (классическая картина водянки головного мозга, ретинита и других органных манифестаций) выявляют не чаще чем у 1. Клиническая картина токсоплазмоза неспецифична и проявляется субфебрильной температурой, лимфаденопатией, ангиной, головной болью и артралгией, симулирует инфекционный мононуклеоз. Достаточно часты атипичный лимфоцитоз, незначительная анемия, лейкопения, изменение со стороны функциональных печеночных проб. Расстройства сохраняются от недель до месяцев, но при остром течении токсоплазмоза обычно самозавершаются. Наиболее вероятная органная локализация — сосудистая и сетчатая оболочки, мозг и мышцы. Тяжелые диссеминированные формы характеризуются высокой лихорадкой, ознобом, макуло-папуллезной сыпью, менингоэнцефалитом, пневмонитом, кардитом, полимиозитом. При недостаточности иммунитета формируются абсцессы мозга. При СПИДе токсоплазмоз, учитывая его распространенность, является наиболее частой причиной объемных образований мозга. Серологическая диагностика основана на реакциях непрямой иммунофлюоресценции (выявление IgM- и IgG-антител), непрямой микрогемагглютинации и реакции связывания комплемента. IgM-антитела появляются в первые недели после инфицирования, исчезая через год. IgG начинают определять через 1–2 мес и персистируют в течение всей жизни. Гемагглютинины и комплементсвязывающие антитела появляются через 2–3 мес после заражения. У больных СПИДом или лимфомами антител класса IgM выявить не удается.
Малярию обусловливают различные виды плазмодия и выявляют в Европе в результате завоза из других регионов или поездок туда без профилактического применения препаратов. При неудачной химиопрофилактике малярия приобретает атипичное течение. После прекращения приема препаратов несколько недель длится «светлый» промежуток. Вместо периодических ознобов с лихорадкой появляется головная боль, колебания температуры тела. Выявить паразитов в крови очень сложно.
Малярия в наших широтах становится все менее экзотической болезнью. В России количество случаев малярии уже приближается к 200–300/год. Если в начале 90-х годов XX ст. мы говорили только о завозной малярии, то сейчас сформировались собственные природные очаги. По Москве и Московской области количество заболевших выросло с 3 человек в 1999 г. до 40 в 2001 г., причем, как правило, эти люди не выезжали за пределы области. А количество случаев завозной малярии, в основном из Азербайджана и Таджикистана, с 30 в 1999 г. увеличилось до 58 в 2001 г. По данным главного государственного санитарного врача РФ Г. Г. Онищенко в России в 2005 г. был зарегистрирован 201 случай малярии, что, однако, на 44% меньше, чем в 2004 г. На долю городских случаев приходится 96%. Среди заболевших зарегистрировано 16 детей в возрасте до 14 лет.
Чаще диагностируют тропическую малярию (Plasmodium falciparum), реже — четырехдневную (Pl. malariae) и трехдневную (Pl. vivax et Pl. ovale). Прогноз при двух последних формах более благоприятен, но при инфицировании Pl. vivax* et Pl. ovale необходимо проводить профилактику рецидивов, направленную на элиминацию внеэритроцитарных (печеночных) форм: гипноцитов. Гипноциты (преэритроцитарные шизонты) могут персистировать в печени 2–3 года. Они не подвержены действию препаратов. Перенос возбудителя, кроме укуса комаров, может быть за счет переливания крови или при инъекциях общим шприцом. Из крови спорозоид попадает в печень, где проходит внеэритроцитарный путь развития и бесполого размножения через стадию шизонтов. Переполненный паразитами гепатоцит гибнет, и они устремляются в кровь, где внедряются в эритроциты. Там они растут как трофозоиды от кольцевидных форм в амебные, размножаются как шизонты до мерозоитов, которые трансформируются в половые формы: микрогаметоцит (мужская форма) и макрогаметоцит (женская форма). Только они способны при попадании в комара инфицировать других людей (табл. 7.2.8).
Таблица 7.2.8
Дифференциальные признаки малярийных паразитов при окраске мазков крови по Романовскому — Гимзе (по Л. П. Шуваловой с изменениями, 1980)
| Показатель | Продолжительность шизогонии | |||
| Р. vivax | Р. malariae | Р. falciparum | Р. ovale | |
| 48 ч | 72 ч | 48 ч | 48 ч | |
| Стадии развития паразитов, выявляемые в крови | Все стадии шизогонии и гаметоциты | Все стадии шизогонии и гамонты | Кольца и гамонты, при тяжелой малярии — все стадии шизогонии | Все стадии шизогонии и гаметоциты |
| Кольцевидные шизонты | Кольца правильной формы размером 1/3–1/2 диаметра эритроцита, нередко 2–3 кольца в одном эритроците | Такие же, как Р. vivax, но не более 1 кольца в эритроците | Кольца мелкие, размером 1/6–1/5 диаметра эритроцита, часто 2–3 кольца в эритроците | Такие же, как Р. vivax, но ядра более крупные |
| Амебовидные шизонты | Неправильной амебовидной формы, крупные, пигмент обильный, палочковидный, нередко 2–3 шизонта в эритроците | Округлой или лентовидной формы, размером не превышает нормальный эритроцит, пигмент в виде грубых зернышек | В периферической крови выявляют только при малярийной коме. Развитие происходит в капиллярах внутренних органов | Округлой формы, сходные с шизонтами Р. malariae, но крупнее. Лентовидные формы не выявляют |
| Морулы | Обычно 12–24 (в среднем 16) мерозоитов, расположенных беспорядочно, пигмент расположен эксцентрично | Обычно 8 мерозоитов, расположенных правильно вокруг центрального скопления пигмента | 8–24 мерозоитов (в среднем 12)* | Обычно 6–9 мерозоитов, беспорядочно расположенных вокруг пигмента |
| Пораженные эритроциты | Заметно увеличены, обесцвечены,выявляется зернистость | В размерах не изменяются, зернистость отсутствует | В размерах не изменяются, присутствует пятнистость Мауэра | Заметно увеличены в размерах, обесцвечены, принимают овальную или фестончатую форму |
| Гамонты или гаметоциты | Круглые крупные женские гамонты с небольшим ядром и интенсивно окрашенной протоплазмой. Мужские гамонты с большим ядром и слабо окрашенной протоплазмой | Такие же, как у Р. vivax, но не превышают размера нормального эритроцита | Полулунной формы. Женские гамонты длинные, с синевато-серой протоплазмой и более компактным ядром. Мужские гамонты короткие с розовато-серой протоплазмой и менее компактным ядром | Такие же, как у Р. vivax |
*Шизонты находятся в органах и их не выявляют в периферической крови.
Тропическая малярия в 1/2 случаев характеризуется неправильной температурной кривой, в 1/4 — интермиттирующей, у остальных больных — постоянным повышением температуры тела. Характерные 3–4-дневные циклы повышения температуры тела выявляют при завозных вариантах реже. Инкубационный период может растягиваться до нескольких недель. После короткого неспецифического продромального периода резко повышается темература, после чего начинается цикл: озноб, гипертермия, кризис с проливным потом. Заболевание характеризуется интенсивной головной болью, миалгией, желудочно-кишечными расстройствами, мягкой увеличенной селезенкой, в меньшей степени — гепатомегалией, желтухой. В анализах крови — легкая анемия, тромбопения, в период лихорадки — умеренный лейкоцитоз, в интервалах — лейкопения. При тропической малярии регулярное повышение температуры тела, чередующиеся с безлихорадочными периодами, отсутствует. Заболевание протекает очень тяжело, с ремиттирующей или интермиттирующей лихорадкой и может окончиться смертью в ближайшие дни. ДД следует проводить с молниеносным сепсисом, сальмонеллезом. Быстрое внутриэритроцитарное размножение паразитов обусловливает стазы, нарушения микроциркуляции и поражение жизненно важных органов. Церебральная симптоматика проявляется нарушениями сознания, судорогами, экстрапирамидными расстройствами и комой. При спинномозговой пункции отмечают только повышение давления и содержания белка в ликворе. Билиарная форма обусловлена внутрисосудистым гемолизом с гемоглобинурией и холестазом. Значительно повышены уровни трансаминаз и ЛДГ. Почечный синдром характеризуется олигоурией, почечной недостаточностью. Кардиальный синдром — расширение границ сердца, нарушения ритма и сердечная недостаточность. Гастроинтестинальная форма— диарея, мелена. Диагноз «малярия» устанавливают на основании изучения мазков крови или «толстой капли», где после окраски по Романовскому — Грюнвальду — Гимзе ищут разнообразные формы плазмодиев. Забор крови следует проводить на высоте лихорадки, и затем — каждые 6–12 ч.
Бабезиоз (вызывается — Babesia microti и др.) — заболевание с лихорадкой и гемолитической анемией, напоминающее малярию. Самые частые постоянные хозяева — мыши-полевки, реже — другие грызуны или коровы. Переносчик — иксодовый клещ, который переносит и спирохеты, вызывающие болезнь Лайма. Бабезиоз может передаваться и при переливаниях крови. Заболевание известно в США, Ирландии, Югославии.
После укуса зараженным клещом бабезия проникает в эритроцит, где начинает размножаться. Переполненный паразитами эритроцит лопается, они попадают в кровь и внедряются в другие эритроциты.
У молодых крепких людей инфекция может персистировать, ничем внешне не проявляясь, в течение месяцев и даже лет. В случае манифестации через 1–2 нед инкубационного периода появляются утомляемость, слабость, озноб, лихорадка, боль в мышцах и суставах, гепатоспленомегалия, желтуха, умеренная или тяжелая гемолитическая анемия, незначительные нейтропения и тромбоцитопения. Жизнеугрожающее течение болезнь приобретает у людей с удаленной селезенкой. Больше того, удаление селезенки приводит к яркой манифестации ранее субклинического процесса.
Многие пациенты об укусе клеща вспомнить не могут. Диагноз основывается на выявлении возбудителя в мазке крови. В эритроцитах они сгруппированы в виде кубиков или во множестве выявляют внеэритроцитарно. Информативны серологические пробы и полимеразная цепная реакция. Возможно введение крови пациента хомячкам и мониторинг грызунов с целью выявления у них паразитемии.
Лейшманиоз (висцеральная форма — кала-азар) — распространен в странах тропического климата. В современных условиях из Средней Азии выдвигается к Волге. Передается москитами и контактным путем при ранениях. Предрасположены дети и люди молодого возраста. Инкубационный период составляет от нескольких месяцев до лет. Развивается интермиттирующая температура. Типично поражение ретикулоэндотелиальной системы с резкой спленогепатомегалией, гиперплазией ЛУ и лейкопенией, вплоть до панцитопении. Резко повышается уровень IgG. Подтверждение диагноза основывается на изучении пунктата костного мозга, лимфоузла или селезенки (окраска по Гимзе), культуральных исследованиях и полимеразной цепной реакции (ПЦР). Из серологических реакций применяют реакции непрямой гемагглютинации, иммунофлюоресценции и связывания комплемента.
Пневмоцистоз вызывается Pneumocystis carinii3. Обусловливает пневмонию преимущественно у лиц с недостаточностью иммунитета. Принадлежит к наиболее частым оппортунистическим инфекциям. В клинической картине доминируют лихорадка, непродуктивный кашель, одышка, что резко контрастирует с минимальными аускультативными и перкуторными данными. В тяжелых случаях рентгенологически выявляют картину двусторонней интерстициальной пневмонии, но отрицательная рентгенологическая картина никак не исключает диагноз пневмоцистной пневмонии. Для его подтверждения приходится проводить провокационную пробу с ингаляцией паров 3% раствора поваренной соли для получения мокроты. Более надежным методом является бронхо-альвеолярный лаваж. Пневмоцисты выявляются маркированием флюоресцирующими моноклональными антителами, окраской по Гимзе или толуидиновым синим.
Трипаносомоз африканский (сонная болезнь). Вызывается Trypanosoma gambiense в Западной и Центральной Африке и Т. brucei rhodesiense в Восточной Африке. Оба варианта трипаносомоза передаются мухой це-це (причем муха це-це легко прокусывает тонкую одежду) и при переливании крови. Через 3–14 дней в месте укуса появляется плотный красный болезненный узел (трипаносомный шанкр), который самостоятельно рассасывается. Такая реакция более свойственна Т. brucei rhodesiense и характерна для неафриканцев. Следующая фаза болезни у африканцев развивается через несколько месяцев, у неафриканцев — остро и значительно раньше. Заболевание характеризуется интермиттирующей лихорадкой, головной болью, ригидностью, преходящими отеками, генерализованной лимфаденопатией. Типичная кольцевидная эфемерная сыпь, более заметная на доступных свету участках тела, появляется на 6–8-й неделе после инфицирования. В анализах крови анемия, моноцитоз, резкое повышение концентрации поликлонального IgM.
Увеличение ЛУ по задней поверхности шеи типично для Tr. gambiensis. Для нее же характерно поражение ЦНС спустя месяцы — годы после начала заболевания. Для родезийской формы инвазия трипаносом в ЦНС, сопровождаемая тяжелой неврологической симптоматикой, типична в ближайшие несколько месяцев.
Поражение ЦНС при трепаносомозе проявляется головной болью, неспособностью концентрировать внимание, прогрессирующей вялостью, безучастностью, сонливостью, гиперфагией, тремором, атаксией, в итоге — комой. При пункции давление спинно-мозговой жидкости повышено, повышено содержание белка, лимфоцитов и IgM. В дополнение к трипаносомам выявляют клетки Мотта: морулоподобные плазматические клетки, заполненные гранулами иммуноглобинов.
Диагноз на ранних этапах основывается на выявлении трипаносом во влажном мазке на предметном стекле или в мазке периферической крови, окрашенном по Романовскому — Гимзе (чаще выявляют родезийский тип), или в аспирате из увеличенного ЛУ (чаще — гамбийский тип). Вероятность выявления трепаносом повышается при центрифугации образцов жидкости или крови. В далеко зашедших случаях трипаносомы сохраняются только в спинно-мозговой жидкости.
Возможно культивирование крови или образцов жидкости, или их инокуляция лабораторным животным.
Информативны иммунофлюоресцентный, иммуносорбентный и аглютинационный методы.
Трипаносомоз американский (болезнь Чагаса). Вызывается Trypanosoma cruzi. Резервуаром являются собаки, кошки, опоссумы, крысы и другие млекопитающие. Инфекция передается определенным видом клопов, который выявлен на всем Американском континенте. Наряду с насекомыми возможна передача при гемотрансфузиях или трансплацентарно4.
Болезнь распространена в основном в Центральной и Южной Америке, где инфицировано более 20 млн человек. В некоторых районах Южной Америки кардиальные проявления болезни Чагаса — основная причина смерти мужчин в возрасте до 45 лет.
При укусе клоп оставляет на коже фекалии, содержащие трипаносомы. Последние могут либо самостоятельно проникать через слизистую оболочку, либо втираются в кожу через место укуса или расчесы. Паразиты проникают в макрофаги, трансформируются в амастиготы, делятся на двое и уже как трипомастиготы попадают в кровь. Оттуда они инфицируют прежде всего ретикуло-эндотелиальную систему, миокард, мышцы и нервную систему.
Клинически на месте внедрения паразита может развиться плотный эритематозный отек (чагома) кожи или, если внедрение прошло через конъюнктиву, односторонний периокулярный отек с конъюнктивитом и увеличением ЛУ околоушной раковины (признак Романьи).
У людей, сформировавших клиническую картину острого заболевания, через 1–2 нед инкубационного периода повышается температура до высоких цифр (и держится недели), появляются гепатоспленомегалия и генерализованная лимфаденопатия. В дальнейшем у 10% больных острой формой развиваются острый миокардит с сердечной недостаточностью или энцефалит с судорогами.
После симптомной или бессимптомной острой фазы развивается латентная фаза, которая длится годы, десятилетия или всю жизнь. Хроническая болезнь Чагаса возникает у 15–45% случаев. Она характеризуется хроническим миокардитом с расширением всех камер сердца, апикальными аневризмами, дегенерацией проводящей системы. Все это проявляется застойной сердечной недостаточностью, желудочковыми аритмиями, нарушением проводимости, периодами Морганьи — Адамса — Стокса, тромбэмболиями, скоропостижной смертью. Патология пищеварительного тракта проявляется мегаэзофагусом (дисфагия, регургитация, аспирационная пневмония), нарушением питания (кахексия), приобретенным мегаколоном (хронический запор, интоксикация).
Диагноз в острой фазе может быть установлен по выявлению паразитов в тонком мазке или в толстой капле периферической крови, потому что уровень паразитемии достаточно высок. Но в латентной фазе или в хронической количество паразитов в крови очень невелико. Применяют:
- Культивирование крови или аспиратов из ЛУ.
- Ксенодиагностику. Позволяют лабораторным клопам напиться крови «неясного» пациента, после чего ищут трипаносомы в фекалиях клопов. Вводят кровь больного лабораторным животным.
- Полимеразную цепная реакция.
- Серологические пробы могут оказаться ложно положительными у пациентов с кожной и висцеральной формами лейшманиоза.
Простейшие, паразитирующие в просвете кишечника (см. главу Диарея).
Глистные инвазии, несмотря на значительно улучшившиеся санитарные условия жизни населения, остаются достаточно распространенным заболеванием. По европейской статистике, 100% детей, посещающих детские сады, переносят энтеробиоз, 80% — гименолипедоз. Его же переносят не менее 40% взрослых. В тропических странах практически все население является носителем гельминтов, а половина — двух и более видов одновременно.
Кривоголовки (Ancylostoma duodenalis, A. caninum; Necator americanus) могут внедряться транскутанно и вызывать тяжелые хронические постгеморрагические анемии за счет потери крови из наносимых травм слизистой оболочки двенадцатиперстной кишки. Группу риска составляют дети, сельскохозяйственные рабочие, шахтеры, занятые на земляных работах. Во всем мире этими видами гельминтов поражено 25% населения. В большинстве случаев инфекция протекает бессимптомно. В месте чрез- кожного внедрения личинки может появиться зудящая папула или везикула. Миграция большого количества ларв через легкие приводит к развитию эозинафильных инфильтратов. В острый период инвазии пациенты могут отмечать эозинофильный энтерит, колики в эпигастральной области, тошноту, вздутие живота, диарею. Хроническая инфекция обусловливает развитие железодефицитной анемии, гипопротеинемии; слабость; тахикардию; импотенцию; отеки. Часто выявляют умеренно выраженную эозинофилию.
Диагноз подтверждается выявлением овальных яиц в кале. Если каловые массы не сохранялись в лаборатории теплыми или исследование выполнено через несколько часов, из яиц могут освободиться ларвы. Последние напоминают угриц (Strongyloides). Непосредственное выявление анкилостом и некатора возможно при эндоскопии.
В некоторых районах развитого скотоводства и бесконтрольного содержания собак большую проблему представляют эхинококкоз и альвеококкоз (см. раздел Солидные образования печени). Заражение гидатидным эхинококком (Echinococcus granulosus) происходит чаще всего в детстве, но поскольку ларвы (кисты) растут очень медленно, то выявляют их спустя многие годы. Гидатидная киста может содержать несколько литров чрезвычайно антигенной жидкости и миллионы сколексов. Иногда формируются дочерние кисты. Клинически длительное время никаких симптомов нет. Разрыв паразитарной кисты приводит к аллергическому шоку, крапивнице, лихорадке.
В менее трагичных случаях симптоматика определяется размерами кисты, вытеснением ею специфической паренхимы органа хозяина, сдавлением протоков, соседних органов. Радиологическими методами отдифференцировать паразитарную кисту от эпителиальной очень сложно. Реакция Кацони (кожная проба) часто положительна, но чувствительность и специфичность ее недостаточны. Наиболее специфична реакция иммуноблотинга.
Альвеококк (Echinococcus multilocularis) растет значительно быстрее. Герминативные ткани быстро разрушают капсулу и растут инвазивно. Возможен их отсев (метастазирование) из печени и легкого в ЛУ, мозг, другие органы. Клиническая картина и диагноз полностью аналогичны поражению гидатидным эхинококком.
Трихинеллез (вызывается Trichinella spiralis) — достаточно частое заболевание, развивающееся в результате употребления плохо обработанного мяса, прежде всего свиного. Первыми симптомами являются боль в животе, тошнота и рвота, диарея. Боль в глазах, субконъюнктивальные петехии, светобоязнь часто предшествует боли в мышцах. Через неделю повышается температура тела до 39 °C, появляются интенсивная боль в мышцах, отек лица. Чаще всего поражаются наиболее работающие мышцы с интенсивным кровоснабжением: диафрагма, межреберные, мышцы рук и ног. Периорбитальный отек и миозит служат иногда причиной первоначального ошибочного диагноза дерматомиозита. В крови — выраженная эозинофилии. У ½ пациентов повышена активность мышечных энзимов (ЛДГ и креатинфосфокиназы — КФК), что хорошо коррелирует с наличием патологических изменений на электромиограмме. Диагноз подтверждается данными кожной аллергической пробы, реакцией латексагглютинации и микроскопическими выявлениями трихинелл в мышечных биоптатах. Следует учитывать, что серологические тесты становятся достоверно положительными через 2–3 нед после начала болезни. Серологические исследования и биопсия мышц — взаимно дополняющие исследования: у 30–35% больных положительно что-либо одно. При благополучном исходе заболевания трихинеллы инкапсулируются и кальцинируются.
Шистозомиазом (бильгарциоз) болеют около 200 млн жителей Земли. Промежуточный хозяин — улитки, обитающие в теплых водоемах. В их теле миразоиды превращаются в церкариев, они проникают через кожу человека в кровоток, через легкие заносятся в печень, где созревают, достигая 1–2 см длины. Зрелые формы устремляются в вены определенных регионов, где они могут существовать не менее 20–30 лет. Каждая самка ежедневно откладывает в кровь сотни яичек, которые и вызывают эозинофильное гранулематозное воспаление, завершающееся фиброзированием органа. Shistosoma mansoni et Sh. japonica персистируют преимущественно в мезентериальных венах, Sh. haematobium — в венах мочевого пузыря. Соответственно два первых вида обусловливают, наряду с гепатомегалией, расстройства желудочно-кишечного тракта. Нарушения венозного кровотока сопровождаются повышением портального давления с развитием коллатерального кровообращения, варикозом вен пищевода, спленомегалией. Выделяющиеся яйца могут попадать в легкие, мозг и сердце, где также вызывают развитие соединительной ткани. Особенно интенсивное выделение яиц происходит при инвазии японской шистозомой, в итоге чего развивающиеся повышение температуры тела, аллергические отеки и выраженная эозинофилия получили название лихорадки Катаяма.
Персистенция Sh. haematobium в венах мочевого пузыря приводит к дизурии и гематурии. Гранулемы могут вызвать стеноз мочеточников с гидронефрозом.
Диагноз подтверждается выявлением яиц гельминтов в стуле, моче, гельминтов — в биоптате слизистой оболочки прямой кишки. Серологические исследования не информативны.
Филяриоз сопровождается выраженными отеками и слоновостью, его описания см. в соответствующем разделе.
Аскаридоз. Аскариды напоминают дождевых червей, широко распространены. Проглоченные яйца через 5–10 дней превращаются в ларвы, они проникают через кишечную стенку в кровь, через легкие попадают в трахею, откуда и заглатываются. Только при повторном попадании в кишечник превращаются в половозрелую форму. Течение часто субклиническое, выявляют обычно случайно. Могут быть неспецифические признаки в виде параумбиликальной боли, подташнивания. Возможен спонтанный выход глистов через рот или анальное отверстие, илеус. Подтверждение диагноза строится обычно на выявлении глистов в каловых массах. Возможно серологическое подтверждение, но чаще это бессмысленная процедура.
Токсокароз (Toxocaracanis, cati) развивается преимущественно у детей после контакта с животными или с их выделениями. Яйца собачьих или кошачьх аскарид, передвигаясь в токе крови, вызывают повышение температуры тела, значительное ухудшение общего состояния, кашель, гепатоспленомегалию, боль в мышцах и в суставах. Нередко отмечают хориоретинит и ирит. Наряду с общеаллергическим характером поражения глаза возможна миграция токсокар непосредственно в глаз (так называем глазной токсокароз). Возникает чаще у детей старшего возраста, значительно реже — у взрослых. Развиваются гранулемы сетчатки. При ДД необходимо исключить ретинобластому.
В крови — лейкоцитоз и выраженная эозинофилия, повышение уровней IgM, IgE и IgG. Диагноз подтверждается внутрикожной аллергической пробой, реакциями иммунофлюоресценции и гемагглютинации.
Энтеробиоз. Выявляют очень часто. Для диагностики важно обратить внимание на ночной анальный зуд, раздражительность, плохой сон. Диагноз подтверждается микроскопией перианального мазка.
Ленточные черви, цестоды [бычий сосальщик — чаще всего; свиной — реже, широкий лентец (рыбий) — очень редко]. Течение цестодозов обычно бессимптомное. Возможна В12-дефицитная анемия.
Наиболее важные особенности лабораторной верификации паразитарных инфекций приведены в табл. 7.2.9.
Таблица 7.2.9
Принципы сбора образцов и их обработки для лабораторной диагностики паразитозов
| Что брать на исследование | Что можно выявить | Как проводить сбор образцов | Особенность | Комментарий |
| Кровь | Plasmodium spp. | Тонкий мазок или толстая капля капиллярной крови или 5–10 мл свежеполученной крови с антикоагулянтом | Взять кровь в острый период. Убедиться, что спиртосодержащий антисептик полностью испарился с места предполагаемой пункции. Приготовить мазок из капиллярной или венозной крови в течение 1 ч после ее взятия. Сушить медленно в закрытой посуде | Убедиться, что предметные стекла идеально чисты. Окрасить по Романовскому — Гимзе. Если возникли малейшие сомнения в возможности приготовления качественных препаратов, набрать кровь в пробирку с антикоагулянтом и доставить в специализированную лабораторию |
| Trypanosoma spp. | Мазок капиллярной крови или 5–6 мл крови с антикоагулянтом | Окрасить по Романовскому — Гимзе | ||
| Filaria | 1 мл крови с антикоагулянтом. Если результат отрицателен, взять 5–10 мл крови с антикоагулянтом, приготовить концентрат центрифугированием или фильтрацией | Wucheria bancrofti и Brugia malayi: взять кровь в интервале с 22.00 до 02.00. Loa-Loa, Dipetalonema perstans, Mansonella ozzardi: взять кровь с 10.00 до 18.00 | Окрасить по Романовскому — Гимзе | |
| Костный мозг | Leishmania spp. | Аспираты из костного мозга, печени, селезенки, ЛУ или кровь | Центрифугировать 5–10 мл крови с антикоагулянтом и приготовить окрашенный мазок | Окрасить по Райту или Романовскому — Гимзе |
| Спинномозговая жидкость | Naegleria
Hartmanella Acanthamoeba |
Свежесобранная спинномозговая жидкость | Собрать в асептических условиях, исследовать как можно быстрее. Не замораживать | Если невозможно немедленное исследование под световым или фазово-контрастным микроскопом, фиксировать образец в поливинил-алкоголе, фиксаторе Шаудина или 5–10% формалине |
| Биоптаты:
двенадцатиперстная кишка тощая кишка прямая кишка |
Giardi
Strongyloides Entamoeba Schistosoma mansoni Schistosoma japonicum Cryptosporidium spp. Isospora Cyclospora |
Биоптаты поместить в стерильную пробирку с небольшим количеством физиологического раствора. Для шистозом: биоптат взять с задней поверхности прямой кишки, у детей — на 5 см, у взрослых — на 9 см выше анального отверстия | Исследовать немедленно | Для достоверного диагноза необходимо исследовать много биоптатов |
| Экскременты | E. histolytica и др. амебы | Три пробы взять сразу после утреннего опорожнения кишечника 3 дня подряд | Неоформленный или жидкий стул исследовать в ближайшие 15 мин. Оформленный стул до исследования можно хранить в холодильнике | Для микроскопии фиксировать поливинил-алкоголем или тримеросолиодин-формалином |
| Giardia | Три пробы взять сразу после утреннего опорожнения кишечника 3 дня подряд | Если первые три дня исследований не принесли положительного ответа, продолжить еще 4 дня. При необходимости исследовать аспират содержимого двенадцатиперстной кишки | — | |
| Cryptosporidium spp. | Три пробы взять сразу после опорожнения кишечника. При отрицательном результате — повторить в другие дни | Концентрировать экскременты, посыпав их сахарным песком. Если результат отрицательный, взять биоптат из тощей кишки. Соблюдать осторожность: и свежий стул, и обработанный бихроматом эпидемиологически опасен | Если немедленное исследование невозможно образцы сохранить с помощью 2,5% бихромата калия или 10% забуференного формалина. Обработать по Романовскому — Гимзе модифицированному для кислото-устойчивых объектов или специфическими моноклональными антителами | |
| Isospora | Аналогично Cryptosporidium spp. | Концентрировать стул | Окрасить модифицированно на кислото-устойчивые объекты | |
| Cyclospora | Ibidium | Ibidium | Ibidium. Ооцисты самофлюоресцируют зеленым светом |
| Tricharis
Ascaris Ancylostoma Nekator Strongyloides Плоские черви Трематоды |
По одной пробе испражнений 3 дня подряд | Если необходимо — заморозить. Немедленное исследование не является критически важным, но ларвы Necator seu Ancylostoma могут напоминать Strongyloides | ||
| Enterobius v. | Можно взять мазок из перианального пространства. Надежнее получить отпечаток на целлофан | Взять анализ утром до опорожнения кишечника или принятия душа. | ||
| Проктоско- пия (сигмо- скопия) | Entamoeba histolytica | Соскоб взять кюреткой или ложечкой Фолькмана. Слизистую оболочку взять эндоскопическими щипцами. Аспират из язвы взять 1 мл пипеткой с резиновой грушей. Мазки-отпечатки на тампон-палочку не информативны | Забор выполнять не ранее 2–3 ч после опорожнения кишечника. Исследовать образец немедленно или сохранить его для последующих исследований | |
| Респираторный тракт Мокрота | Paragonimus spp. | Свежая мокрота | ||
| Промывные воды трахеи бронхов | E. histolytica
Strongyloides Echinococcus Ancylostoma Nekator Ascaris Toxocara |
Любой аспират; дренажный материал | Если подозревается аме- биаз, пробы исследовать неотложно, немедленно | |
| Биопсия легкого | Paragonimus spp. | Открытая биопсия легкого. Чрезкожная биопсия под радиологическим контролем | Собрать и хранить в стерильных условиях. Если выполнена пункционная биопсия, добавить стерильный физиологический раствор | |
| Кожа | Onchocerca | У лиц негроидной расы брать биоптат на уровне гребня подвздошной кости, с бедра и ягодиц. У всех других — с лица, над лопаткой, с ягодиц | Перед биопсией кожу дезинфицируют спиртом. Иглу № 25 ввести строго под эпидермис, приподнять его и вырезать маленький кусочек ткани скальпелем или бритвенным лезвием. Можно использовать склерокорнеальный нож | Нельзя допустить появления крови |
| Leishmania spp.
E. histolytica |
Ободок язвы | При амебиазе и лейшманиозе возбудители концентрируются на стенках язвы, а не в ее содержимом | ||
| Мочеполовая система
Влагалище Уретра Секрет простаты |
Trichomonas spp. | Стерильную ватную палочку поместить в стерильную пробирку | Женщины не должны проводить гигиенические процедуры в течение 3–4 дней перед сбором анализа. Образец доставить в лабораторию следует максимально быстро, пока трихомонады сохранили подвижность | |
| Мочевой пузырь | Schistosoma haematobium | Биоптаты из области вокруг треугольника Льетоди | — | — |
7.3. Лихорадочные состояния при нарушениях иммунитета
Лихорадочные состояния при нарушениях иммунитета обычно рецидивирующие. Иммунная система отвечает за элиминацию эндо- и экзогенных антигенов. Сложные взаимоотношения между Т- и В-клеточными системами, системой комплемента, пропердина и фагоцитарной системы обеспечивают уничтожение микроорганизмов и элиминацию антигенов. Конечным этапом является внутриклеточный лизис возбудителей, обеспечиваемый фагоцитарной системой, хемотаксисом и опсонизацией. Поэтому приобретенные или врожденные нарушения отдельных звеньев иммунного ответа приводят к рецидивирующим инфекциям, к персистенции возбудителей, к аутоиммунным или опухолевым заболеваниям. Нарушения иммунитета могут быть обусловлены патологией его различных звеньев. Выраженность клинической картины зависит от степени нарушения и биологического значения поврежденного звена. Выделяют нарушения клеточного, гуморального звеньев, комплементарной и фагоцитарной систем. Наличие одновременно других аномалий (аплазии тимуса, деформаций костей) свидетельствуют в пользу врожденного генеза иммунодефицита. В нашей стране из-за отсутствия соответствующей настороженности врачей правильный диагноз устанавливают только у 1–2 больных из 1000. Задача врача общей практики — заподозрить иммунодефицитное состояние. Расшифровка синдрома, полный диагноз можно установить при иммунологических, генетических и молекулярных исследованиях. Чем раньше пациент будет направлен в специализированную клинику, тем лучше прогноз. Общая частота клинически значимых форм первичных иммунодефицитов составляет 1:10 тыс, — 12 тыс. населения. 80% из них проявляются в возрасте до 20 лет. Большинство иммунодефицитов передаются Х-сцепленно, поэтому 70% больных — мальчики.
Группа экспертов из Европейского общества по изучению врожденных иммунодефицитов разработала 10 настораживающих признаков первичных иммунодефицитных состояний:
- Наличие у родственников больного первичных иммунодефицитов, ранних смертей от тяжелых инфекций или одного из нижеуказанных состояний.
- Отставание грудного ребенка в набирании массы тела и росте.
- Персистирующая молочница или грибковое поражение кожи в возрасте старше 1 года.
- Частые заболевания отитом (не менее 6–8 раз в течение года).
- Несколько подтвержденных серьезных синуситов (не менее 4–6 раз в течение года).
- Более двух подтвержденных пневмоний.
- Повторные глубокие абсцессы кожи и внутренних органов.
- Потребность в длительной терапии антибиотиками для купирования инфекции (до 2 мес или дольше).
- Потребность во внутривенной антибиотикотерапии для купировании инфекции.
- Не менее двух таких глубоких инфекций, как менингит, остеомиелит, флегмона, сепсис.
Если у пациента выявлено 2 и более вышеуказанных признаков, то диагноз иммунодефицита вероятен. Безусловно, наиболее важными отправными пунктами для диагностики и ДД первичных иммунодефицитов являются рецидивирующие инфекции, их высокая частота, краткие или вообще отсутствующие бессимптомные промежутки, резистентность инфекции к терапии, необычное течение болезни или необычная инфекция, трудно объяснимые или тяжелые осложнения.
Но прежде чем говорить об иммунодефиците, врач должен вспомнить, что есть множество состояний, которые протекают с внешними проявлениями иммунодефицита. Необходимо учесть возраст и пол пациента, его имущественный и культурный статус, характер питания, условия жизни и работы, наличие алкоголизма, наркомании, хронических инфекций, социальных инфекций (туберкулез, инфекции передающиеся половым путем).
Необычное течение инфекций типично для следующих состояний:
- нарушение кровообращения, в том числе на уровне микроциркуляции: врожденные и приобретенные пороки сердца и магистральных сосудов; тяжелые хронические анемии; сахарный диабет;
- обструкции полых органов: стеноз мочеточника или уретры; бронхиальная астма; бронхоэктазы; муковисцидоз; синдром нарушенного мерцания ресничек; нарушение проходимости евстахиевой трубы (анатомические вариации, бурные аденоидные вегетации);
- нарушение питания и состояния с потерей белка, стрессы: мальнутриция любого генеза; нефротический синдром; энтеропатия с потерей белка; экзема; ожоги; переломы больших костей;
- инородные тела: шунты желудочковые при гидроцефалии; внутрисосудистые стенты; искусственные клапаны сердца; водители ритма; катетеры в мочевом пузыре; аспирированные или забытые при операциях инородные тела;
- необычная манифестация собственно микробного фактора: рост необычной флоры после эрадикации типичных возбудителей; хроническая инфекция устойчивыми микроорганизмами; постоянная реинфекция (употребление зараженных продуктов или воды, пребывание в зараженной атмосфере птичников, зооферм, лабораторий и т. п.; постоянный контакт с человеком или животным, носителями инфекции; контаминированные кондиционеры, ингаляторы и медицинский инструментарий).
Не будем спорить, этот список условен и не полон, но он полезен для размышлений и практической работы.
Как результат возрастной динамики наших функций, перенесенных заболеваний, медикаментозных вмешательств или по другим причинам могут развиться приобретенные нарушения иммунитета. В общем и целом вторичные иммунодефициты свойственны недоношенным, в том числе с малой массой тела, здоровым новорожденным, лицам пожилого возраста, пациентам с хромосомными аномалиями, наследственными и обменными заболеваниями, при применении иммуносупрессивных средств, при опухолях, многих инфекционных заболеваниях, тяжелых травмах, побочных эффектах лекарственных препаратов (табл. 7.3.1).
Таблица 7.3.1
Характер приобретенных изменений иммунитета при различных состояниях
| Первичное состояние | Клеточный иммунитет | Гуморальный иммунитет | Количество гранулоцитов |
| СПИД | Снижен | Снижен (вторично к клеточному) | Гранулоцитопения |
| Корь | Снижен | В норме | В норме |
| Краснушная эмбриопатия | В норме | Снижен IgA | В норме |
| Мононуклеоз | Снижен | Снижен | В норме |
| Спленэктомия | В норме | В норме | Уменьшено |
| Аутоиммунные заболевания | Снижен | Гипериммуноглобулинемия | Гранулоцитопения |
| Лейкозы | Снижен | Снижен | Уменьшено за счет вытеснения |
| Уремия | Снижен | Не изменен | Уменьшено |
| Сахарный диабет | Не изменен | Не изменен | Изменено |
| Нефротический синдром | В норме | Снижен за счет потери белка | В норме |
| Ожоги массивные | Снижен | Снижен за счет потери белка | Уменьшено |
| Энтеропатии | Не изменен | Снижен за счет потери белка | Не изменено |
| Дефицит цинка | Снижен | В норме | Уменьшено |
| Дефицит селена и жирорастворимых витаминов (А+Е) | В норме | Снижен за счет нарушения образования иммуноглобулинов | Не изменено |
| Кахексия | Снижен | Снижен | В норме или уменьшено |
| Облучение | Снижен | Снижен | Уменьшено |
| Стероиды | Снижен | Не изменен | В норме или уменьшено |
| Фенитоин | В норме | Блокада синтеза IgA | В норме |
| Метотрексат | Снижен | Не изменен | Уменьшено |
| Циклофосфамид | Снижен | Снижен | Уменьшено |
| Противотуберкулезные препараты | В норме | Снижен за счет нарушения образования иммуноглобулинов | В норме |
| Наркоз | В норме | В норме | Уменьшено |
К сожалению, многими специалистами заключение о так называемом вторичном иммунодефиците воспринимается как самодовлеющее. Особенно охотно к нему прибегают в педиатрии, давая характеристику так называемым часто болеющим детям, не задумываясь над словом «вторичный» и не оценивая реально клиническую значимость синдрома. Но забывают, что дети определенного возраста, в определенных условиях, в некоторых коллективах просто обязаны болеть «простудными», «вирусными» заболеваниями. Во многих языках этот период по основному симптому характеризуется грубо, но точно: сопляк = rotznase (нем.) = snotty (англ.) = moccióso, marmycchio (итал.) = morveux (фр.) = mocoso, mocosuelo (исп.) = snørrunge (норв.) = smarkucz, zasmarkane dziecko (поль.) = usmrkânek (чеш.) = балавац (серб.-хорват.) = semmirekellember (венг.) = sümüklü (тур.). Терапия, как правило, направлена не на вторичные состоянияне, или это лечение малорезультативно. Терапия направлена на первичные состояния. Вторичные состояния, по нашему мнению, важны для врача в следующих аспектах: убежденность, что они действительно вторичные; генез; ДД; перспективы трансформации определяющие и угрожающие.
Итак, когда же врач должен думать о первичном иммунодефиците, как представлять себе общие проявления и что предпринять для диагностики?
Нет единой причины иммунодефицитов, хотя для многих известен дефектный ген. Возникают дефицит фермента (например дефицит нуклеозид фосфорилазы), белка (компоненты комплемента), нарушение дифференциации клеток (пре-В-клеточная блокада при Х-связанной агаммаглобулинемии). Для многих иммунодефицитов определена и локализация гена на хромосоме. Иногда ссылаются на внутриутробные повреждающие факторы (алкоголизм матери при некоторых формах синдрома Ди Джорджи).
Первые проявления иммунодефицита — частые инфекции, обычно начинающиеся как рецидивирующие респираторные5. Далее эти инфекции осложняются бактериальными персистирующими, возвратными, приводящими к осложнениям (хронический синусит; отит; бронхит -> пневмония -> бронхоэктаз; кандидоз). Возникают оппортунистические инфекции. Часты инфекции кожи и слизистой оболочки, упорный афтозный стоматит (Т-клеточные дефициты), периодонтит, гингивит. Для детей более старшего возраста и взрослых типичны конъюнктивит, пиодермия, бородавки, алопеция, экзема, телеангиоэктазия. Часты синдром мальабсорбции, общая вялость, астения, диарея. Диарея обычно неинфекционная, но могут наслаиваться инфекции Giardia lamblia, Cryptosporidium, цитомегаловирус, ротавирусы. Диарея может приобрести экссудативный характер с потерей белка и лимфоцитов. Реже отмечают аутоиммунную гемолитическую анемию, тромбоцито- или лейкопению, васкулит, артрит, эндокринопатию, энцефалит, судороги.
В семейном анамнезе следует обратить внимание на близкородственные браки, раннюю смерть, аутоиммунные заболевания, опухоли у лиц молодого возраста, аллергию, патологические реакции на живые вакцины или вирусные инфекции.
Следует выяснить, проводили ли пациенту тонзилэктомию, аденотомию, удаление селезенки, радиооблучение (особенно ротоглотки и области вилочковой железы). Применяли ли ранее антибиотики, гамма-глобулин, в каких дозах и с какой эффективностью.
Тип инфекции достаточно характерен для определенного вида иммунодефицита. Пневмококки и стрептококки поражают людей с В-клеточным (антительным) дефицитом. Тяжелые вирусные, грибковые и другие оппортунистические инфекции указывают на Т-клеточный дефицит. Возвратные инфекции грамотрицательной флорой и стафилококками нередко сопровождают детей с нарушенным фагоцитозом, a Neisseria — с дефицитом компонентов комплемента.
Врачу следует точно выяснить время начала расстройств. В возрасте до 6 мес проявляется Т-клеточный дефицит. Начало заболевания — в возрасте около 6 мес, когда кончается запас материнских антител, переданных трансплацентарно, характерно для врожденного дефицита антител.
При клиническом обследовании пациенты с иммунодефицитом выглядят как хронически больные: бледные, с недостаточной массой тела, дистрофичными мышцами, со вздутым животом, макулезной и везикулярной сыпью на коже, пиодермией, экземой, петехиями, алопецией,телеангиэктазиями, конъюнктивитом, экскориациями и корочками вокруг ноздрей. Последнее свидетельствует о гнойном рините. Отделяемое из носа стекает и по задней стенке глотки, рвотный рефлекс снижен. Миндалины атрофированы, лимфоузлы не пальпируются, аденоидная ткань не видна ни при осмотре, ни при боковом рентгеновском снимке глотки. Но при некоторых дефектах фагоцитоза ЛУ значительно увеличены. Барабанные перепонки в рубцах или перфорированы.
Пациент с иммунодефицитом — это часто пациент с хроническим кашлем, у лиц старшего возраста прослушиваются хрипы в легких. Печень и селезенка увеличены в размерах. Неврологически могут быть выявлены задержка развития, атаксия.
Сочетание характерных симптомов и типичный внешний вид позволяют иногда достаточно достоверно клинически диагностировать тип иммунодефицита:
- новорожденные со специфическим обликом, судорогами, инфекцией, врожденным пороком сердца — синдром Ди Джорджи;
- мальчики с гнойной инфекцией, экземой, гем- морагическим синдромом — синдром Вискотта — Олдрича;
- девочки рыжеволосые с кожей такой белизны, «что она светится в темноте» (А. Куприн «Суламифь»), но с экземой и возвратными стафилококковыми инфекциями — гипер-IgE-синдром;
- мальчики с атаксией-телеангиоэктазией.
Более подробно общая клиническая симптоматика иммунодефицитов представлена в табл. 7.3.2.
Таблица 7.3.2
Принципиальные клинические признаки отдельных вариантов иммунодефицитов и наиболее вероятный диагноз
| Возраст | Клинические признаки | Наиболее вероятный диагноз |
| Новорожденные, дети до 6 мес | Необычное лицо, пороки сердца, гипокальциемия | Синдром Ди Джорджи |
| Порок сердца, цианоз, смещение печени влево | Аспления | |
| Медленное отторжение пупочного канатика, рецидивирующие инфекции, лейкоцитоз | Нарушение адгезии лейкоцитов | |
| Диарея, пневмония, задержка развития | Тяжелый комбинированный иммунодефицит | |
| Макуло-папулезная сыпь, алопеция, лимфаденопатия, гепато-спленомегалия | Тяжелый комбинированный иммунодефицит, болезнь «трансплантат против хозяина» | |
| Мелена, гноетечение из уха, экзема | Синдром Вискотта — Олдрича | |
| Альбинизм кожи, глаз; рецидивирующие инфекции, нейтропения | Синдром Чедиака — Хигаши | |
| Рецидивирующие гнойные инфекции, сепсис | С3-дефицит | |
| Хронический гингивит, афтозный стоматит, инфекции кожи, тяжелая нейтропения | Тяжелая врожденная нейтропения | |
| Дети от 6 мес до 5 лет | Тяжелый прогрессирующий инфекционный мононуклеоз | Х-связанный лимфо-пролиферативный синдром |
| Острые вялые параличи после вакцинации живой полиомиелитной вакциной | Х-связанная агаммаглобулинемия | |
| Рецидивирующие кожные и системные стафилококковые инфекции, характерный внешний вид | Гипер-IgE-синдром | |
| Персистирующая молочница, дистрофия ногтей, эндокринопатия | Хронический кожно-слизистый кандидоз | |
| Дети старше 5 лет и взрослые | Прогрессирующий дерматит, миозит, хронический эховирусный энцефалит | Х-связанная агаммаглобулинемия |
| Инфекции придаточных пазух носа, легких, неврологические нарушения, телеангиоэктазии | Атаксия-телеангиоэктазия | |
| Дерматит, лимфаденопатия, пневмония, остеомиелит мелких костей | Хроническая гранулематозная болезнь | |
| Повторные случаи менингита, вызванного нейссериями | Дефицит С5, С6, С7 или С8 | |
| Инфекция придаточных пазух носа, пневмония, спленомегалия, мальабсорбция, аутоиммунные расстройства | Общий вариабельный иммунодефицит |
В любом случае клинически выверенное подозрение на иммунодефицит требует серии вспомогательных исследований, позволяющих уточнить его вид. Исследования целесообразно разделить на скринирующие (выполняемые в большинстве лечебных учреждений), дополнительные (уровень крупных лебечно-диагностических центров) и специализированные (учреждения, специально занимающиеся иммунодефицитами) (табл. 7.3.3).
Таблица 7.3.3
Примерные лабораторные признаки иммунодефицитов на этапах диагностики
| Скрининговые тесты | Исследования | |
| дополнительные | специальные | |
| Т-клеточный дефицит
• количество лимфоцитов и их морфология; • рентгенография грудной клетки для определения размеров вилочковой железы;* • кожные пробы с Candida, Trichophyton, столбнячным анатоксином, эпидпаротитным, мультитестовые панели |
• Определение субпопуляций Т-клеток (CD3; CD4; CD8)
• Пролиферативный ответ на митогены, антигены • HLA-типизация • Анализ хромосом |
• Дальнейшее фенотипирование Т-клеток
• Исследование цитокинов и рецепторов (интерлейкин-2; фактор некроза опухоли-альфа и -гамма) • Исследование цитотоксичности: натуральные киллеры; антительно-зависимая клеточная цитотоксичность; цитотоксичные Т-лимфоциты • Ферменты (аденозин-деаминаза; пурин-нуклеозид-фосфорилаза) • По показаниям биопсии кожи, печени, тимуса, ЛУ** • Гормоны тимуса • Анализ активации и мутации клеток |
| В-клеточная недостаточность (нарушения гуморального звена)
• уровень IgA, IgM, IgG • титры изоаглютининов • антительный ответ на вакцины (столбняк, дифтерия, краснуха, Haemophilus influenzae) • рентгеновский снимок глотки в боковой проекции для оценки аденоидной ткани |
• В-клеточные подтипы (CD19 или CD20)
• Подклассы IgG • Уровень IgD и IgE • Титры антител: АСЛ-0; Escherichia coli • Ответ на новые вакцины: пневмококковую, тифоидную |
• В-клеточный фенотип
• Антительный ответ на специальные антигены: фаговый антиген, кейхоле-лимпет-гемоцианиновый антиген • Уровень секреторного Ig • Кривая «выживания» Ig in vivo • Синтез Ig in vitro • Анализ активации клеток • Анализ мутаций |
| Нарушения фагоцитоза:
• количество лейкоцитов, их морфология • тест с нитроголубым тетразолием • уровень IgE |
• Хемолюминисценция
• Специальная морфология • Подвижность и хемотаксис • Фагоцитарная и бактерицидная активность • Мобилизация лейкоцитов в ответ на адреналин, кортикостероиды, эндотоксины |
• Молекулы адгезии (CD116/CD18, лиганды)
• «Кожное окно» • Деформация, агрегация • Метаболизм (оксиданты, миелопероксидаза, глюкоза-6-фосфатдегидрогеназа, NADPH-оксидаза) • Анализ мутаций |
| Дефицит комплемента
• СН50-активность • Уровень С3 • Уровень С4 |
• Исследование опсонинов
• Исследование компонентов • Исследование активаторов: С3а, С4а, C4d, С5а |
• Альтернативный путь
• Исследование функциональных возможностей: фактор хемотаксиса, адгеренции • Степень «выживания» компонентов in vivo • Анализ С-аллотипа |
*Только для детей младшего возраста; **для исключения злокачественного процесса или инфекции.
Целесообразно обсудить обоснования и клиническую значимость проведения лабораторных тестов, наиболее значимых для врача общей практики.
При подозрении на наличие иммунодефицита необходимо прежде всего сделать общий анализ крови с подсчетом тромбоцитов, определить уровень основных классов иммуноглобулинов (IgA, М, G), клиническое и лабораторное исключение инфекций.
По анализу крови можно судить о наличии или отсутствии анемии, тромбоцитопении, лейкоцитоза или нейтропении. Лимфопения <1500/мкл может свидетельствовать о Т-клеточном иммунодефиците. Иногда удается выявить необычные морфологические изменения гранулоцитов (например гранулы при синдроме Чедиака — Хигаши). Необходимо убедиться в отсутствии необычных форм эритроцитов (тельца Жолли и др.), что характерно при асплении.
Хотя определение уровня иммуноглобулинов является неотъемлемой частью скрининговых, отборочных исследований, нет смысла сразу определять уровни IgD и IgE. Результаты надо трактовать очень осторожно, поскольку они зависят от возраста. У детей в возрасте до 6 мес гипогаммаглобулинемия является физиологичной. В любом случае колебания индивидуального показателя в пределах двух стандартных отклонений от возрастной нормы следует признать физиологичными. Общий уровень основных иммуноглобулинов (IgA+IgM+IgG)>600 мг/дл или уровень IgG>400 мг/дл при условии нормального показателя скрининга антител (см. ниже) позволяет исключить дефицит антител (гуморальный иммунодефицит). Общий уровень Ig<200 мг/дл свидетельствует о тяжелом дефиците антител. Промежуточные показатели (общий Ig=400–600 мг/дл; IgG=200–400 мг/дл) самостоятельного диагностического значения не имеют и должны быть сопоставлены с результатами антительного ответа. Функция IgM определяется по титрам изоаглютининов (анти-А и/ или анти-В). Все люди, за исключением младенцев младше 6 мес и обладателей IV группы крови (АВ), имеют естественные антитела в титрах 1:8 (анти-А) или 1:4 (анти-В) или даже выше. Эти антитела и антитела к определенным бактериальным полисахаридам отсутствуют, например при синдромах дефицита IgG2 и Вискотта — Олдрича. У ранее иммунизированных пациентов следует определить титры антител к антигенам возбудителей столбняка, дифтерии, Н. influenzae, эпидемического паротита, гепатита В. Адекватный титр антител (IgG) на один и более антигенов свидетельствует против дефицита антител. Наконец, необходимо выполнить скрининговые исследования по исключению хронической инфекции.
Если результаты вышеуказанных диагностических вмешательств благополучны, то диагноз иммунодефицита можно отвергнуть. Но если итоги тестов сомнительны или тем более патологически изменены, а у пациента есть признаки хронической инфекции, необычных реакций, необходимы дальнейшие поиски.
Этапы диагностики Т-клеточного иммунодефицита. Выраженная и длительная лимфопения — свидетельство Т-клеточного дефицита, хотя этот признак не абсолютный. Отсутствие тени вилочковой железы на рентгенограммах грудной клетки младенцев может быть связано с Т-иммунодефицитом, но при наличии важных условий: исследование выполнено до начала инфекций или тяжелых стрессов, ибо и то, и другое приводит к угнетению тимуса. Для детей старше 2 лет и взрослых информативна реакция кожной гиперчувствительности. Используютследующие антигены: туберкулин, эпидемический паротит, Candida (1:100), столбнячный анатоксин (1:10), Trichophyton. Практически все взрослые и большинство иммунизированных детей реагируют на введение антигена образованием в ближайшие 48 ч эритемы и папулы (индурации) диаметром >5 мм. Наличие положительной кожной пробы на 1 антиген и более предполагает сохранную Т-систему.
Более точные тесты — определение общего количества Т-лимфоцитов (CD2 и CD3), хелперов/индукторов (CD4), супрессоров/цитотоксических клеток (CD8). При T-CD4<500/mici можно говорить о глубоком иммунодефиците. Наряду с этим необходимо определить количество естественных киллеров (CD 16 и CD56), активированных клеток (CD25), тимоцитов (CD1), пролиферацию, ответ на митогены, лимфокины и др. (см. табл. 7.3.3 и текст главы).
Этапы диагностики В-клеточного (антительного) дефицита. Если общий уровень иммуноглобулинов низок (<200 мг/дл) и низок (но не отсутствует) титр антител к ранее поступавшим антигенам (вакцинации по возрасту), следует определить антительный ответ на стандартные антигены. Для этого определяют титр антител до и через 3–4 нед после введения столбнячного анатоксина или вакцины Н. influenzae типа В (ответ на белковый антиген), пневмококковой или менингококковой вакцины (ответ на полисахаридный антиген). Увеличение титров менее чем в 4 раза свидетельствует о В-клеточном дефиците. После этого целесообразно с помощью флюоресцирующих антител методом проточной цитометрии определить общий пул В-клеток (CD19, CD20). Обычно соответствующие антигены несут 10–20% лимфоцитов периферической крови.
Следующий шаг — определение субклассов IgG и глобулинов IgD и IgE. Уровень субклассов IgG зависит от возраста. Для установления диагноза «иммунодефицит» субклассов IgG у лиц в возрасте старше 2 лет необходимо:
уровень IgG 1 <250 мг/дл или
IgG2<50 мг/дл или
IgG3<25 мг/дл или
IgG4 не определяется (в сочетании с низкой концентрацией другого подтипа IgG).
Высокий или низкий уровень IgD или IgE часто выявляют при неполных синдромах дефицита антител. IgE повышен при паразитарных и аутоиммунных заболеваниях, частичных Т-клеточных дефицитах, нарушениях хемотаксиса. Изолированное отсутствие IgG4, IgD и IgE клинического значения не имеет. Более тонкие методики (изучение катаболизма IgG; уровень Ig в секретах; реакция на фаговый или другие антигены с целью определения уровня блокады синтеза) применяют в специализированных учреждениях.
Диагностика нарушения фагоцитоза начинается после исключения иммунодефицитов В и Т. Отправным моментом диагностики нарушения фагоцитоза являются сведения об отсутствии или малом количестве гноя в очаге воспаления, длительное сохранение пупочного канатика и лейкоцитоз. Первичный скрининг включает определение уровня IgE (повышен при многих нарушениях хемотаксиса) и тест с нитрозолием. В норме гранулоциты во время фагоцитоза и лизиса микробов переводят бесцветный реактив в синий (голубой) формазан, что определяют визуально, микроскопически или спектрофотометрически. Далее есть смысл определить активность миелопероксидазы и щелочной фосфатазы, эстеразы в гранулоцитах. Миграция клеток оценивается по «кожному окну». Скальпелем скарифицируют кожу, периодически прикладывают, а потом снимают предметные стекла и окрашивают мазок-отпечаток. В норме полиморфнонуклеары появляются за 2 ч, а затем через 24 ч замещаются моноцитами.
Диагностика нарушений системы комплемента основана на определении общего сывороточного комплемента (СН50) и СЗ, С4. Дефицит классических компонентов сопровождается аутоиммунными расстройствами, сывороточной болезнью. Дальнейшие исследования призваны оценить возможности основного и альтернативного пути, компонентов комплемента и их ингибиторов.
Среди всех групп врожденных иммунодефицитов чаще всего выявляют антительный и В-клеточный дефекты.
Исключая бессимптомные варианты дефицита IgA, можно быть уверенным, что В-клеточные дефекты составляют 50% всех случаев первичных иммунодефицитов, 28% — Т-клеточное звено (клинически, вероятно, наиболее тяжелые формы иммунодефицитов), 20% — нарушения фагоцитоза и около 2% — дефицит компонентов комплемента.
Нарушения клеточного звена иммунитета (Т-клеточный дефект)
Связаны с изменением Т-лимфоцитов и являются определяющими для многих состояний. При неполноценности Т-лимфоцитов неизбежно страдают и В-лимфоциты, что сказывается на гуморальном иммунитете. Т-лимфоциты эмбрионально происходят из полипотентной гематопоэтической стволовой клетки. Далее они созревают под действием тимозина, тимопоэтина и эпителия тимуса. Из тимуса они поступают в паракортикальные слои ЛУ, в интерфолликулярные области интестинальной лимфоидной ткани и параартериально в селезенку. Оттуда они вновь поступают в ток крови. Созревание Т-лимфоцитов контролируется генетически и сопровождается их дифференцировкой. Выделяют Т-киллеры или цитотоксические Т-клетки, Т-супрессоры и Т-хелперы. На поверхности Т-клеток созревают рецепторы, ответственные за реакции на целостные антигенные «ансамбли». Так, хелперы/индукторы несут антиген Т4 и опознают антигены II-го класса HLA. В то время как Т8-антигенпозитивные Т-клетки опознают антигены I-го класса HLA. Для диагностики дефектов клеточного звена иммунитета и лимфопролиферативных заболеваний необходимо определение отдельных субпопуляций лимфоцитов. Возможно уменьшение общего количества Т-лимфоцитов, их активности, что определяется их стимуляцией митогенами. Соотношение Т-хелперов и Т-супрессоров (Т4/Т8) в норме постоянно и >1,2. Изменение коэффициента определяется у больных СПИДом, гемофилией и при некоторых других состояниях. При дефектах Т-клеточного звена иммунитета характерны фульминантные формы многих бактериальных и вирусных инфекций (туберкулеза, листериоза, ветряной оспы, герпеса, цитомегаловирусов, кори), грибковых и протозойных заболеваний (кандидоз, токсоплазмоз). Развиваются генерализованные реакции на живые вакцины (туберкулезный сепсис после планового введения BCG). Очень высока вероятность лимфом и тимом. У детей чаще отмечают первичные нарушения клеточного звена иммунитета, например синдромы Ди Джорджи, хронический мукокутанный кадидоз, Вискота — Олдрича и др.
При синдроме Ди Джорджи нарушена закладка 3 и 4 жаберных дуг. Это обусловливает нарушение формирования тимуса и паращитовидных желез, что и определяет клиническую картину.
Поражаются в основном лица мужского пола. При полном наборе симптомов летальность высока, но пациенты со стертыми формами живут долго. Этиология, вероятней всего, гетерогенна. В ¼ всех случаев выявляют делецию в проксимальной части длинного плеча 22-й хромосомы. Именно у этих пациентов находят дополнительные аномалии развития, а у части из них — моно- или трисомию другого аутосомального сегмента. Но для синдрома Ди Джорджи известна и терминальная делеция короткого плеча 10-й хромосомы.
В качестве диагностических критериев служат: 1) Т-клеточный дефект, 2) гипоплазия или агенезия паращитовидных желез, 3) гипокальциемия, 4) гипоплазия аорты или участок агенезии ее дуги, 5) гипоплазия нижней челюсти, низко расположенные уши, гипертелоризм, укороченный фильтр.
Мукокутанный кандидоз (синдром Незелова). Передается а/p. Тяжелый комбинированный дефект иммунитета с первоначальным нарушением Т-клеточного звена. С детства проявляется склонность к тяжелым рецидивирующим инфекциям легких и кожи, хроническому мукокутанному кандидозу (на поверхности Т-лимфоцитов нет рецепторов, воспринимающих антигены грибов). Нарушения развития, хроническая диарея. При рентгеновском исследовании не видна тень вилочковой железы. В крови — лимфоцитопения и отсутствие Т-лимфоцитов. Концентрация сывороточных иммуноглобулинов не изменена или несколько повышена. Антитела функционально не изменены. Синдром может протекать с гипопаратиреоидизмом и болезнью Аддисона.
ДД синдрома Незелова проводят прежде всего с тяжелым комбинированным иммунодефицитом швейцарского типа.
Синдром гипоплазии волос и хряща (метафизарная хондродисплазия типа МакКьюсика). Передается а/p со значительной вариабельностью экспрессии. Отмечают практически исключительно в небольшой группе жителей Пенсильвании, выходцев из Верхнего Эльзаса, до сих пор живущих замкнуто и сохраняющих особую религию и обычаи. Описано сочетание синдрома с анемией Даймонда — Блекфана.
Т-клеточный дефект проявляется уменьшением количества иммунокомпетентных клеток. Клинически это выражается повышенной восприимчивостью к инфекции, особенно к опоясывающему лишаю. Низкий рост (у взрослых — 105–145 см) с относительно длинным туловищем и короткими конечностями. Волосы мягкие, редкие, истонченные. Гипермобильность суставов.
С дефицитом Т-клеточного звена иммунитета протекает и множественный биотинчувствительный дефект карбоксилазы, передающийся а/p. Он характеризуется тяжелой периодически появляющейся мокнущей экземой с или без алопеции, бронхоэктазами, дисплазией зубов, гепатитом, ацидозом, тошнотой, рвотой, дегидратацией. В тяжелых случаях возможна лейкодистрофия головного мозга с атаксией и судорогами. Некоторые авторы рассматривают это состояние как вариант хронического мукокутанного кандидоза (синдрома Незелова).
К комбинированным иммунодефицитам относят также:
- Синдром Оменна: иммунодефицит с эозинофилией.
- Дефицит аденозиндезаминазы: фермент превращает аденозин и деоксиаденозин в инозин и деоксиинозин (соответственно). При нарушении активности фермента накапливается деоксиаденозин трифосфат (дАТФ), который блокирует синтез ДНК. Дети рождаются здоровыми. По мере накопления дАТФ проявляется и прогрессирует иммунодефицит.
- Х-связанный тяжелый комбинированный иммунодефицит: обусловлен мутацией гамма-цепи рецептора ИЛ-2. Эта цепь— компонент рецепторов других цитокинов (ИЛ-4, -7, -9, -13, -15).
- ИЛ-1-дефицит.
- ИЛ-2-дефицит.
- Множественный дефицит цитокинов.
- Структурный дефект Т-клеточных рецепторов.
У взрослых чаще отмечают вторичные, приобретенные дефекты Т-клеточного звена. Кроме классически известного теперь СПИДа, сложных в патогенезе радиационных и других аналогичных поражениях, они могут быть обусловлены вирусными инфекциями, почечной недостаточностью, лимфопролиферативными и лимфогранулематозными процессами.
Из вирусиндуцированных состояний особого внимания заслуживает синдром Левандовского — Лутца (веррукозная эпидермодисплазия), представляющий собой общепризнанную модель вирусного онкогенеза у человека.
Предрасположенность к синдрому Левандовского — Лутца передается, вероятней всего, а/p путем. Заболевание индуцируется вирусами папилломы типов 3, 5, 8. Реже выявляют вирусы папилломы типов 9, 10, 12, 14, 17, 19–25. Гуморальный иммунитет не изменяется.
Заболевание проявляется чаще всего уже у детей. На коже туловища, конечностей, лица появляются генерализованные разрастания, напоминающие бородавки. Общее состояние не страдает. Т-клеточная неполноценность клинически проявляется мягко. На местах фотоэкспозиции возможна малигнизация.
Нарушения гуморальной системы иммунитета (В-клеточная система)
В-клеточная система характеризуется мембрансвязанными иммуноглобулинами, системой HLA антигенов II-го класса и различными рецепторами, связывающимися с Fc-компонентом Ig, С-3b и C-3d компонентами комплемента, цитокинами — ИЛ-2, -4, -5 и -6, интерфероном гамма и с вирусом Эпштейна — Барр. В результате взаимодействия В- и Т-лимфоцитов, связывания антигенов на поверхности В-лимфоцитов, последние пролиферируют в иммуноглобулинсинтезирующие плазматические клетки. Освобождаемые ими антитела необходимы для защиты от антигенов, выступая как опсонины, обусловливают фагоцитоз бактериальных клеток. Путем связывания комплемента вызывают разрушение клеток, нагруженных антигенами. Секреторная иммунная система продуцирует IgA, что обусловливает бактериальную устойчивость слизистой оболочки дыхательных, пищеварительных и мочевыделительных путей.
При гуморальных дефектах иммунитета в крови отсутствуют или снижены все или определенные группы иммуноглобулинов (дисиммуноглобулинемии).
Наблюдаемая у детей связанная с полом агаммаглобулинемия Брутона обусловлена нарушением созревания пре-В-клеток в В-лимфоциты. В итоге в крови и лимфоузлах отсутствуют как В-лимфоциты, так и происходящие из них плазматические клетки. Передается Х-сцепленно (Xq21.3–q22). Нельзя исключить генетической гетерогенности. Достаточно рано присоединяются рецидивирующие инфекции, вначале кожи, придаточных пазух носа, среднего уха. В качестве дополнительных поражений могут быть карликовость, бронхоэктазы, узловатая эритема, холестеатома с вторичной тугоухостью, анемия, гипокальциемия, артрит, гипертрофическая гастропатия Менетрие, колит, энтерит, рецидивирующая диарея.
Развивающаяся у взрослых агаммагипогаммаглобулинемия может протекать как при уменьшенном числе В-клеток, так и при повышении их концентрации. В этом случае речь идет о недостаточности Т-супрессоров, подавляющих пролиферацию В-клеток, или о недостаточности Т-хелперов, обеспечивающих выполнению функций Т-супрессоров. Гипо- или агаммаглобулинемия (дисиммуноглобулинемия) взрослых также во многом обусловлена наследственно, но может дебютировать в любом возрасте.
Выделяют 7 типов дисиммуноглобулинемий (табл. 7.3.4).
Таблица 7.3.4
Классификация дисиммуноглобулинемий
| Тип дисиммуноглобулинемий | Содержание | ||
| IgG | IgA | IgM | |
| I | В норме | Снижено | Снижено |
| II | Снижено | Снижено | Повышено |
| III | Снижено | В норме | В норме |
| IV | В норме | Снижено | В норме |
| V | В норме | В норме | Снижено |
| VI* | В норме | В норме | В норме |
| VII | Снижено | Повышено | Снижено |
*VI тип дисиммуноглобулинемий характеризуется «нефункционирующими» иммуноглобулинами. Хотя концентрации иммуноглобулинов в сыворотке крови не изменены, регистрируют повторные стафилококковые инфекции и септицемии. В сыворотке крови у этих больных антистафилококковые антитела не выявляют, в том числе и после стимуляции.
Наиболее распространенным дефектом является дефицит IgA (как правило, бессимптомный). Может возникать как последствие лечения фенитоином или быть отражением изменений на 18-й хромосоме. Выявляют у 0,1 % населения. Чаше это спорадические случаи, реже — семейные. В нашей практике дефицит IgA достаточно часто сопутствует генетически детерминированной патологии соединительной ткани.
Недостаток IgA может протекать со снижением уровня IgG2 и IgG4 подклассов. В этих ситуациях дефицит IgA протекает уже не бессимтомно, а сопровождается рецидивирующими инфекциями. Общим в клинической картине нарушения гуморального иммунитета является низкая устойчивость к бактериальным инфекциям, их рецидивирование, особенно стрепто- и стафиллококковых, пневмококковых и Н. influenzae. Прежде всего это рецидивирующие гнойные синусит, отит, бронхопневмония, фурункулез, септикопиемия, остеомиелит и гнойный менингит. Часто развивается бронхиальная астма. У пациентов с дефицитом IgA в ответ на поступление его извне могут появиться антитела к IgA. В последующем, при переливании крови или иммуноглобулинов не исключена анафилактическая реакция.
Гипер-IgM-синдром — врожденное, обычно Х-связанное состояние иммунодефицита с повышением IgM, сниженными уровнями IgA и IgG, периодической нейтропенией, нормальным количеством В-клеток. Идентифицирован мутантный ген Xq27. Проявляется увеличением ЛУ, Кумбс-положительной гемолитической анемией, предрасположенностью к большинству грамположительных и оппортунистических инфекций. У 65–75% больных к 30-летнему возрасту формируется хроническая патология печени.
Гunep-IgE-синдром (Джоба — Бакли синдром) — иммунодефицитное состояние с возвратными стафилококковыми инфекциями и существенным повышением уровня IgE. Основной дефект — нарушение иммунорегуляторной активности Т-лимфоцитов. В ряде случаев доказан а/д вариант наследования. У некоторых больных грубые черты лица, гипертелоризм (рис. 7.4), другие красивы, рыжеволосы, с тонкой нежной кожей. Нередки остеопения и частые переломы. Могут возникать аллергический ринит, астма, экзема, эозинофилия. У многих выявляют дефект хемотаксиса нейтрофильных гранулоцитов. У всех уровень IgE >2400 мкг/л (>1000 JU/мл).
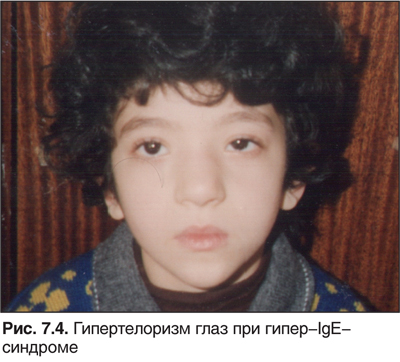
Вторичная недостаточность иммуноглобулинов (см. табл. 7.3.1) развивается при значительных потерях белка (нефротический синдром, экссудативная энтеропатия), при применении противосудорожных препаратов и D-пеницилламина, при вирусных инфекциях, а также при нарушениях созревания В-лимфоцитов вторичного храктера (иммуносупрессивная терапия и тимомы, сопровождающиеся дефектом Т-клеток).
Комбинированные дефекты клеточного и гуморального иммунитета
Достаточно большая группа наследственных состояний. К ним относят синдромы Брутона, Незелова, Вискотта — Олдрича, атаксии-телеангиоэктазии, уже описанные ранее.
Дефекты системы комплемента. Снижение концентрации сывороточного комплемента отмечают при иммунокомплексных заболеваниях, диффузных болезнях соединительной ткани, некоторых формах крапивницы, при печеночной недостаточности и септикопиемии. При врожденном дефекте 19-го компонента комплемента (дефицит С1r и дефект С5–С8) чаще отмечают волчаночноподобные заболевания, особенно при дефектах C1, С2, С4 и гломерулонефриты (при дефицитах С1r и С2). Недостаток ингибитора С1, передающийся по а/д типу, сопровождается ангионевротическими отеками преимущественно лица, кишечника и слизистой оболочки дыхательных путей. Последнее в 25% случаев является причиной смерти от асфиксии. Состояние объясняется тем, что отсутствие ингибитора С1 обусловливает гиперактивность указанной фракции комплемента, что вызывает повышенное потребление С2. Продукты его распада вазоактивны. Таким образом, дефекты системы комплемента сводятся к следующим клиническим вариантам:
- C1q-дефицит. Комбинированные иммунодефициты. Волчаночно-подобный синдром.
- C1rs, C1s, С2, С4. Аутосомно-кодоминантный путь передачи. Гломерулонефрит. Волчаночно-подобный синдром.
- СЗ, С5, С6. Аутосомно-кодоминантный путь передачи. Гнойные инфекции.
- С6, С7, С8. Аутосомно-кодоминантный путь передачи. Инфекция, вызванная нейссериями.
- С9. Не доказано.
- Дефицит С1-ингибитора, а/д. СКВ, ангионевротический отек.
- Дефицит фактора I (С3b-инактиватор), аутосомно-кодоминантно. Гнойные инфекции.
- Дефицит фактора Н. Предается аутосомно-кодоминантно. Гемолитико-уремический синдром, гломерулонефрит.
- Дефицит фактора D. Передается аутосомно-кодоминантно. Гнойная инфекция.
- Дефицит пропердина. Предается Х-связано. Инфекции, вызванные нейссериями.
Приобретенные варианты дефицита ингибитора С1 выявляют при лимфомах, обусловлены выработкой против него антител.
Снижение уровня С3 отмечают при хроническом мезангиально-капиллярном нефрите.
Транзиторное снижение комплемента характерно при вирусных и хронических (туберкулезной) инфекциях. Это может быть условием дебюта аутоиммуного заболевания.
Дефекты фагоцитоза
Гранулоциты и моноциты предназначены для опсонизации и фиксации бактерий и грибов на рецепторах IgG и комплемента. Только тесный контакт фагоцита и антигена обусловливает поступление последнего в клетку. Это ведет к дегрануляции нейтрофильных гранулоцитов, то есть расплавлению нейтрофильных гранул вместе с фагосомой. Одновременно гибнет и клетка. Образование Н2О2 стимулирует гексозомонофосфатный путь, миелопероксидазу, ферменты гидролиза, что и обусловливает гибель микробной клетки. Нарушения хемотаксиса, опсонизации выявляют при врожденных или частично приобретенных дефектах хемотаксических компонентов комплемента (С3а, С5а, С5 и С6, С7) и опсонинов (IgM и IgG в комплексе с C1–С4, С3b, С5).
Врожденное нарушение хемотаксиса клинически проявляется экземой, рецидивирующими кожными бактериальными инфекциями, пневмонией и повышением уровня IgE. Преходящие нарушения хемотаксиса отмечают при кори. Постоянно существующие нарушения формируются у пациентов с сахарным диабетом, хроническим полиартритом и почечной недостаточностью. Циркулирующие в крови ингибиторы хемотаксиса могут как непосредственно действовать на фагоцитирующую клетку (синдром Вискотта — Олдрича, хронический кожно-слизистый кандидоз, IgA-миелома, малигномы), так и инактивировать хемотаксические факторы (саркоидоз, лимфогранулематоз, лепра, цирроз печени).
Уменьшение количества моноцитов отмечают при синдроме множественного биотинчувствительного дефицита карбоксилазы (см. выше), но в практике основное значение имеет дефицит количества или функции нейтрофильных гранулоцитов.
Множественные сочетанные нарушения хемотаксиса, опсонизации и фагоцитоза, количества нейтрофильных гранулоцитов отмечают при многих состояниях, таких как:
- Все гиперспленические состояния.
- Дефицит Г-6-ФД лейкоцитов.
- Синдром «голубых пеленок». Х-связанный рецессивный. Редкое нарушение обмена веществ с нарушением всасывания триптофана, что обусловливает индиканурию, гиперкальциемию и нефрокадьциноз.
- Септический гранулематоз. Гетерогенная группа дефектов иммунитета с нарушением внутриклеточного уничтожения каталаз-позитивных микроорганизмов в фагоцитах. Описаны 4 различных молекулярных дефекта: 1) Х-хромосомный рецессивный (70%) с локусом Хр21 вблизи локуса Дюшена дефект тяжелых цепей электронно-транспортного белка цитохрома b558; 2) а/p на 16-й хромосоме дефект (чуть реже 30%) легкой цепи цитохрома b558;
- дефект 47 кД цитозолфактора (10-я хромосома);
- дефект 65 кД цитозолфактора (1-я хромосома). Патогенез заключается в неспособности нейтрофильных гранулоцитов, моноцитов, эозинофильных гранулоцитов и макрофагов уничтожать фагоцитированных микробов. В результате возбудители персистируют внутриклеточно, разносятся в органы и индуцируют образование гигантоклеточных гранулем с тяжело текущим воспалением. Клиническими критериями являются остро абсцедирующее воспаление, вызванное каталаз-позитивными микроорганизмами (стафилококки и энтеробактерии), а также грибами (главный возбудитель сегодня — fumigatus) в области входных ворот (кожа, легкие, желудочно-кишечный тракт) и в ретикуло-эндотелиальной системе. Очаги гранулематозного воспаления в кишечнике, легких, мочевыводящих путях с возможным стенозированием. Снижение образования О2- и Н2О2.
- Дефект карбамилфосфатсинтетазы. А/p. Проявляется на 1–6-й неделе жизни с картиной гипераммониемии.
- Синдром «ленивых лейкоцитов». А/д. Причина заключается в первичном дефекте целенаправленного движения (хемотаксис) и нецеленаправленной подвижности нейтрофильных гранулоцитов. Обусловлен отсутствием антигенов HLA I и/или II класса. Неспособность к мобилизации нейтрофильных гранулоцитов из костного мозга или маргинального пула ведет к выраженной нейтропении на периферии. Критериями состояния называют выраженную периферическую нейтропению (0,2–0,6⋅109/л) при нормальном количестве нейтрофильных гранулоцитов в костном мозгу, отсутствие мобилизации нейтрофильных гранулоцитов при раздражениях адреналином, пирогенами или воспалении, рецидивирующие инфекции (прежде всего — отит, стоматит, гингивит) при умеренной лихорадке. Несмотря на выраженную нейтропению, клиническое течение синдрома достаточно мягкое. Известен один случай самостоятельного излечения.
- Дефицит миелопероксидазы. А/p тип передачи.
- Циклическая нейтропения. Чаще упоминается а/д вариант передачи. Причина, вероятнее всего — в дефекте стволовой клетки. Клиническая картина заключается в периодически возникающей нейтропении вплоть до агранулоцитоза. Эпизоды нейтропении длятся 4–10 дней с достаточно стабильными для каждого пациента «светлыми» интервалами длительностью от 2 до 6 нед. Картина крови в эти интервалы нормальна, хотя может быть незначительная эозинофилия. В костном мозгу в нейтропенической фазе отмечают задержку созревания нейтрофильных гранулоцитов. Часто поражается эритропоэз и мегакариоцитопоэз, но поскольку средняя продолжительность жизни эритроцитов и тромбоцитов на периферии несравнимо больше, чем нейтрофильных гранулоцитов, то клинических знаков дефицита эритроцитов не возникает. В целом течение заболевания нетяжелое. Через несколько лет возможно самоизлечение.
- Дефект пируватдегидрогеназы. А/p. Возможно нарушение любого из трех внутримитохондриальных энзимов этой группы. Клиника обусловлена лактоацидозом и дефицитом энергии. Часто уже непосредственно после рождения возникают гипотония, нарушения дыхания, нейтропения. Позже проявляются микроцефалия, задержка психомоторного развития, атаксия, атрофия зрительных нервов.
- Пропионацидемия. А/p. Врожденное нарушение обмена веществ с изменениями метаболизма валина, изолейцина, треонина, метионина, жирных кислот и холестерина из-за недостатка пропионил-КоА-карбоксилазы. Описаны 4 генетических варианта синдрома. Уже в раннем детстве появляются метаболический ацидоз, гипогликемия, тошнота, нейтропения, тромбоцитопения, позднее — остеопороз.
- Триметиламинурия. А/p. Редкий дефект N-окисления, при котором не разрушается триметиламин, поступающий из кишечника. Состояние обусловлено дефицитом триметиламинооксидазы в печени и проявляется спленомегалией, нейтропенией, анемией, психической депрессией.
- Синдром Швахмана — Даймонда. А/p. Наследственное мультиорганное заболевание с недостаточностью функции поджелудочной железы, гематопоэза, нарушениями формирования костей и хряща.
- Синдром Чедиака — Хигаши. А/p. Очень редкое наследственное состояние с окулокутанным альбинизмом, рецидивирующими инфекциями и гигантскими гранулами во всех гранулсодержащих клетках. В терминальной стадии заболевания — панцитопения как итог активизации макрофагов.
Приобретенные нарушения фагоцитоза отмечают при агранулоцитозе, сахарном диабете, СКВ, гемолизе, всех гиперспленических состояниях, лейкозах и почечной недостаточности, при терапии кортикостероидами, колхицином, хлорохином. Применение стероидов и сульфаниламидов может осложниться несовершенным фагоцитозом.
7.4. Лихорадка неинфекционного (иммунного) генеза
Иммунная система человека способна отличать структуры, не принадлежащие организму (антигены) и реагировать на них путем образования специфических антител (гуморальный иммунитет) и сенсибилизированных лейкоцитов (клеточный иммунитет).
При бактериальных инфекциях иммунный ответ усиливается активацией системы комплемента и стимуляцией макрофагов, которые образуют цитокины: ИЛ-1 и -6 и фактор некроза опухолей альфа. В качестве антигенов могут восприниматься не только бактерии, их токсины, вирусы, лекарственные препараты, но и структуры самого организма, например ДНК, рибонуклеопротеины и т. п. В норме система элиминирует клоны лимфоцитов, направленные против собственных тканей. Аутоантитела нередко выявляют при заболеваниях, протекающих с разрушением собственных тканей, особенно «забарьерных». Например, после травм мозга с нарушением гематоэнцефалитического барьера, появляются антитела к тканям мозга. После инфаркта миокарда появляются транзиторные антитела к миокарду. Но эти аутоантитела исчезают после восстановления органа и не определяют дальнейшее существование человека.
Нарушение иммунной толерантности приводит к развитию аутоиммунных заболеваний. Возможны локализованные (относительно) аутоиммунные заболевания, при которых сенсибилизированные лимфоциты и антитела направлены на один определенный орган, например на щитовидную или поджелудочную железу, желудок. В качестве генерализованных аутоиммунных заболеваний известны две группы состояний: неинфекционные васкулиты (подразделяемые по типу пораженного сосуда — мелкого, среднего и крупного калибра) и так называемые коллагенозы (диффузные болезни соединительной ткани с аутоиммунным компонентом). Все они протекают с образованием иммунных комплексов, характеризуются распространенным васкулитом с полиморфным поражением многих органов и систем. При дополнительных исследованиях определяют повышение СОЭ, гиперкоагуляцию, наличие антител к нативной ДНК, рибонуклеопротеинам (SS-A, SS-B) и антител к цитоплазме нейтрофильных гранулоцитов (ANCA). Эти антитела направлены на антигены в цитоплазме нейтрофильных гранулоцитов: C-ANCA опознает серинпротеазу, а Р-ANCA — миелопероксидазу. Одновременно часто выявляют криоглобулины и РФ.
Васкулиты с поражением мелких артерий — это гиперсенситивный ангиит и пурпуро-суставно-нефритический синдром.
Ангиит морфологически характеризуется как некротизирующий васкулит мельчайших сосудов. Клиническая картина зависит от нарушения микроциркуляции в тех или иных органах. В качестве разрешающих факторов выступают вирусные инфекции, медикаменты, опухолевые антигены.
Ведущим признаком пурпуро-суставно-нефритического синдрома является хроническая пурпура на ногах, артралгия, миалгия, у ½ больных — диффузный мембранозно-пролиферативный гломерулонефрит. Часто сочетается с гепатитами В и С. В крови выявляют РФ, криоглобулины типов IgMK-IgG и IgM-IgG, низкий уровень С4-комплемента.
Узелковый периартериит — некротизирующий васкулит мелких и небольших артерий. Нелечен- ный высокоактивный периартериит сопровождается образованием клеточных инфильтратов по типу муфт вдоль сосудов (артериит Куссмауля — Майера) (рис. 7.5). Видимо, может вызываться вирусом гепатита В, другими вирусами, лекарственными препаратами, вакцинами и сыворотками. Мужчины болеют в 2–3 раза чаще женщин. Синдром васкулита с подобной клинико-морфологической картиной может возникать при опухолях, особенно при волосатоклеточном лейкозе. Начинается с повышения температуры тела, артралгии, боли в животе и в мышцах, уменьшения массы тела. У мужчин достаточно часто появляется боль в яичках, которая, как правило, предшествует повышению температуры тела и симулирует пере крут яичка и семенного канатика. В крови регистрируются лейкоцитоз, существенное повышение СОЭ. На коже выраженный мраморный рисунок, иногда пальпируются подкожные узелки. Поражение сосудов нервов (vasa nervorum) вызывает развитие полиневрита. Изменения сосудов ЦНС проявляется эпилептиформными припадками, очаговыми изменениями. Особенно опасно поражение сосудов почек. Оно манифестирует высокой АГ, позднее присоединяется азотемия. Поражение легких проявляется как гиперэозинофильная БА. Поражение коронарных артерий обусловливает нарушения ритма сердца, ишемию миокарда, все это усугубляется выраженной АГ. Абдоминальная форма протекает с интенсивной болью в животе, рвотой, кровавой диареей. Нарушение кровообращения приводит и к периферическим некрозам, иногда с самоампутацией. Нами установлено, что прогностически очень неблагоприятным признаком при узелковом периартериите является повышение уровня IgE. Ишемические некрозы в органах, выявляемые при ангиографии, или фибриноидно-некротизирующий васкулит — при биопсии, позволяют верифицировать диагноз.
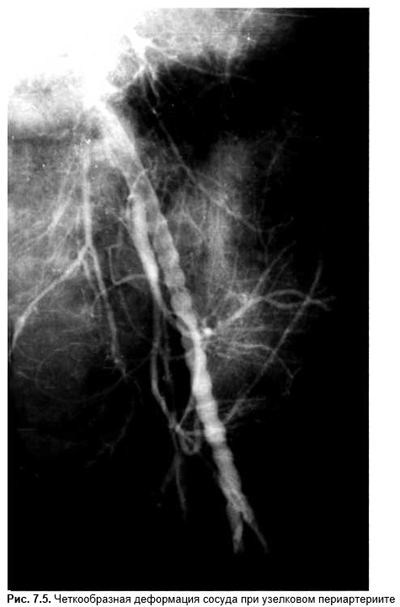
Гранулематоз Вегенера — некротический гранулематозный васкулит верхних и нижних дыхательных путей в сочетании с генерализованным васкулитом и вероятным поражением почек. Гранулемы состоят из лимфоидных, эпителиодных, плазматических, гигантских клеток, гистиоцитов, эозинофильных и нейтрофильных гранулоцитов. Чаще поражает мужчин в возрасте старше 30 лет. Болезнь может начаться остро или постепенно. Неспецифические симптомы начального периода: высокая лихорадка, похудание, артралгия, синусит, средний отит. Выделяют две фазы: локализованную и генерализованную. Известны два варианта локализованной фазы. 1-й — язвенно-некротическое поражение слизистой оболочки полости носа, околоносовых пазух, рта, глотки и уха. Отмечают упорный насморк с гнойным или кровянисто-гнойным отделяемым, боль, затруднения глотания. В дальнейшем развиваются некрозы, деструкция носовой перегородки, раковин, твердого неба, нарастает интоксикация. Лихорадка приобретает септический характер. Назальные симптомы при полиорганном поражении — один из важнейших оснований для диагноза васкулита Вегенера у детей. При 2-м варианте первично поражаются трахея, бронхи, легкие. Появляются надсадный кашель с кровохарканьем, боль в груди, рентгенологически — инфильтраты с нечеткими контурами, в динамике с тенденцией к распаду. Генерализация наступает через несколько недель — месяцев после начала болезни. Полиадения, миалгия, геморрагический диатез, язвенно-некротические поражения кожи, язвы роговицы, увеит, псевдоопухоли орбит, менингеальный синдром и другие неврологические проявления (26% больных), мио- и перикардит (30% пациентов). Гломерулонефрит протекает без АГ и характеризуется быстро прогрессирующей почечной недостаточностью.
ДД на начальных этапах проводится с отитом, синуситом, сепсисом, туберкулезом, опухолью легкого. Диагноз устанавливают на основании клинической картины и по результатам биопсии.
Аллергический гранулематоз Чарг — Штрауса (аллергический ангиит с гранулематозом преимущественно легочной локализации) протекает на фоне длительной атопии с бронхообструктивным синдромом, ринитом, миокардитом. Поражение почек не типично. При дополнительных методах исследования — выраженная эозинофилия, РФ, ANCA и иммунные комплексы, эозинофильные легочные инфильтраты, периваскулярные гранулемы.
ДД проводят с БА, легочным аспергиллезом, лефлеровским эозинофильным легочным инфильтратом. Для всех них не типичны экстрапульмональные нарушения и иммунологические сдвиги ревматического (в широком смысле) характера.
Гигантоклеточный васкулит (височный артериит, гортоновский артериит) — воспалительный некротизирующий гранулематозный панангиит, поражающий преимущественно височную артерию, аа. ophthalmicae и сосуды сетчатки, но может поражать сонные, позвоночные, венечные, подключичные и другие артерии. Гистологические изменения соответствуют панартерииту с очагами некроза, лимфоцитарными инфильтратами и гигантскими клетками в области эластической пластинки. В далеко зашедших случаях выявляют тромбозы. Артериит развивается преимущественно у людей пожилого возраста: 1:1000 у лиц старше 50 лет. При височном артериите артерии плотные, извитые, при пальпации — выраженная болезненность, пульс отсутствует. Беспокоят длительная головная боль в височной области, ощущение напряжения скальпа, боль в жевательных и височных мышцах, мышцах языка, нарушение зрения (диплопия, нечеткость изображения, птоз, скотома, преходящая слепота). Без лечения у каждого пятого больного развивается слепота. Общие симптомы обусловливают повышение температуры тела, необъяснимое уменьшение массы тела, артрит, радикулопатию, запястный туннельный синдром.
При лабораторных исследованиях выявляют резко ускоренную СОЭ, гипохромную анемию, лейкоцитоз со сдвигом влево, диспротеинемию с повышением альфа-2 и гамма-глобулинов. Диагноз подтверждается биопсией височной артерии. Для полноценного исследования и получения достоверных результатов необходим участок длиной около 4–6 см, гистологические срезы проводить не реже чем через 3–5 мм. При ЭМГ выявляют укорочение средней длительности потенциала, типичное для воспалительных изменений. Биопсия мышц не выявляет патогномоничных признаков.
ДД проводится с тромбангиитом Винивартера — Бюргера, узелковым периартериитом.
Близка по клинико-гистологической характеристике к височному артерииту ревматическая полимиалгия. Она характеризуется выраженным болевым синдромом в мышцах затылка, верхнего плечевого пояса, спине. Боль усиливается при движениях и ночью, выражена утренняя ригидность, нет атрофий и уплотнения мышц. Возможен синдром ревматической полимиалгии при миелобластном лейкозе.
Системная красная волчанка (СКВ)— тяжелое аутоиммунное заболевание с распространенным васкулитом мелких артерий, наличием антител к ДНК и ядрам клеток, полиморфной клинической картиной. В качестве возможных этиологических факторов называют совместную персистенцию кореподобного вируса и вируса парагриппа, обладающего обратной транскриптазой, что позволяет переносить геном кореподобного вируса на геном человека. Описаны случаи заражения людей от собак и наоборот. Но объяснить заболевание только гипотетическим инфекционным фактором невозможно. Имеют значение наследственные факторы, в частности, высокая распространенность синдрома гипермобильности среди этих больных, гормональные нарушения. Обсуждается лигандная теория, проблема фотосенсибилизации с образованием порфиринов, разрушением клеток и открытием для иммунной системы ранее недоступных для нее ДНК и ядерных структур. Пациенты с наличием гаплотипа HLA- DR3 и DR2 предрасположены к развитию нефрита, а при гаплотипе DR4 риск нефрита минимальный. Разрешающими факторами выступают вирусные инфекции, инсоляция, лекарственные средства. Возможна медикаментозная СКВ, чаще развивается после применения гидралазина, прокаинамида, изониазада, мезантоина, дифенилгидантоина, блокаторов β-адренорецепторов. В некоторых странах СКВ стали выявлять чаще, чем РА.
Об СКВ следует думать в случаях неуточненной длительной лихорадки, при наличии артритов и гломерулонефрита, признаках поражения ЦНС и гематологических синдромах с признаками воспаления, при неуточненных воспалительных состояниях в случае исключения вирусно-бактериальной этиологии.
Заболевание поражает преимущественно женщин молодого возраста. Начинается, как правило, остро, с высокой температуры тела, артралгии, се- розита, геморрагического диатеза и тромбоваску- лита, экссудативной эритемы преимущественно на лице по типу бабочки (рис. 7.6). Дистрофия, гнездная алопеция, нефрит с очень частым нефротическим компонентом (в 20% случаев дебюта нефротического синдрома он выливается в СКВ). Развивается панкардит с эндокардитом Либмана — Сакса, цереброваскулит, легочный васкулит. Клиническая картина также включает эритему кожи лица, кожную сыпь иной локализации, фотосенсибилизацию, изъязвления слизистой оболочки полости рта или назафарингеальные, артрит без деформации, серозит, нефрит, психоз, судороги, умеренную гепатоспленомегалию, гемолитическую анемию, лейкопению, тромбоцитопению, положительный LE-феномен (люпус эритематодес — волчаночные клетки — клетки Харгревса), антитела к нативной ДНК, антинуклеарный фактор, ложноположительную реакцию Вассермана, снижение уровня С3- и С4-комплемента. Выявляют неспецифический РФ, антитела к тромбоцитам, факторам свертывания, отдельным органам и тканям. Современное лечение значительно смягчает приведенное клиническое описание. Так, в конце 60-х годов XX ст. бородавчатый эндокардит (Либмана — Сакса) отмечали приблизительно у 40% больных детей, в конце 1970-х его отмечали у 20%. Еще у 18–20% выявлен при помощи эхоГ феномен «шершавого клапана» (вальвулит?), а в начале 1990-х годов мы могли диагностировать только единичные случаи. Повышение частоты «мягких» форм СКВ отмечено во всем мире.
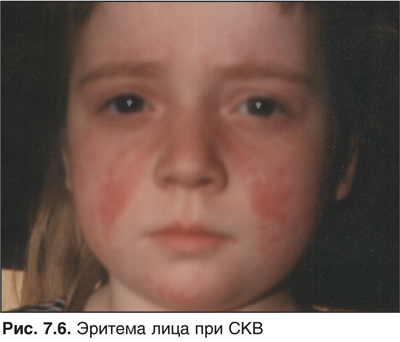
Критериями диагноза являются:
- лихорадка, сепсис, шок;
- лимфаденопатия, спленомегалия;
- бабочкоподобная эритема на лице*;
- фоточувствительность*;
- дискоидные красные шелушащиеся очаги с возможной в последующем центральной атрофией на теле (дискоидная красная волчанка)*;
- язвенные поражения слизистой оболочки полости рта, хейлит*;
- артрит без эрозий и, как правило, без деформаций, более 2 периферических суставов*;
- плеврит, перикардит*;
- перитонит серозный;
- миокардит;
- бородавчатый асептический эндокардит Либмана — Сакса*;
- судороги, психозы*;
- хориоидит, экссудация и геморрагии на глазном дне;
- кумбсположительная гемолитическая анемия*;
- лейкоцитопения с наличием антител к нейтрофильным лейкоцитам*;
- тромбоцитопения с наличием аутоантител*;
- ДВС-синдром;
- гипопластическая анемия (массивная кровопотеря при нефрите, «инфекционная» анемия);
- антинуклеарные антитела тип свечения**:
— краевой +++ (наиболее типичен для СКВ)
— сплошной +/–
— глыбчатый +/––
- антитела к нативной ДНК***;
- антитела к денатурированной ДНК**;
- клетки LE (Харгревса)*.
Примечание: при наличии четырех признаков, отмеченных *, диагноз СКВ может быть установлен с достоверностью 96%. Количество * пропорционально диагностической ценности признака. Редким вариантом презентации СКВ является острый волчаночный гемофагоцитарный синдром. Описан в основном у жителей Азии. На фоне высокой лихорадки развивается фульминантная панцитопения. В костном мозгу выявляют пролиферацию гистиоцитов, активно фагоцитирующих гемопоэтические клетки. Ответ на кортикостероиды быстрый и легкий.
Следует помнить, о дискоидной красной волчанке, протекающей с локальными отложениями антител только в пораженных участках кожи. Вначале это эритематозные круглые шелушащиеся папулы диаметром 5–10 мм. Чаще расположены на скулах, переносице, ушных раковинах. Они могут бледнеть и вновь становиться ярче, персистировать годами. Нередко папулы распространяются на туловище, разгибательной поверхности рук. Возможны афты на слизистой оболочке полости рта. Выражена фотосенсибилизация. Нелеченные кожные очаги распространяются вширь, центр — атрофируется. Органных изменений при ней нет. Но у 8–12% больных отмечают небольшие органные изменения, что сочетается положительным АНФ. Обычно это артралгия, транзиторная лейкопения.
ДД СКВ следует проводить с геморрагическими диатезами, сепсисом, системными формами РА. Необходимо дополнить, что системные формы РА (см. Заболевания суставов) выявляют преимущественно у детей младшего возраста. Взрослым, особенно преклонного возраста, более свойственны олигоартритические по началу формы с явными чертами артроза. В современных руководствах РА рассматривают не как болезнь, а как хронический синдром и определяют его как неспецифическое обычно симметричное воспаление периферических суставов, текущее с их прогрессирующей деструкцией и поражением периартикулярных тканей с или без системной манифестации. Пусковые механизмы могут быть самыми разнообразными. В качестве генетического предрасполагающего фактора у взрослых представителей европеоидной расы называют пентапептид в локусе HLA-DR-бета-1 II класса генов гистосовместимости. Во всем мире РА болеют около 1% населения, женщины — в 2–3 раза чаще. Типичный возраст начала заболеваний — 20–50 лет.
Признаками системной формы РА являются:
- гектическая лихорадка;
- эфемерная пятнистая сыпь на высоте лихорадки преимущественно в утренние часы;
- деформирующий артрит с ригидностью (особое внимание обращать на ригидность шейного отдела позвоночника);
- гепатоспленомегалия и лимфаденопатия;
- миалгия;
- тендосиновит;
- перикардит и миокардит;
- плеврит и легочные инфильтраты;
- боль в животе;
- менингизм;
- анемия, лейкоцитоз, тромбоцитоз, резко повышенная СОЭ и содержание ИЛ-6.
Варианты ювенильного РА на субтипы приведены в табл. 7.4.1.
Таблица 7.4.1
Варианты ювенильного РА (по J. Jacobs, 1992)
| Показатель | Асимметричный артрит. Олигоартрит I типа | Асимметричный артрит. Олигоартрит II типа | Симметричный артрит. Полиартикулярная форма. Серонегативный полиартрит | Симметричный артрит. Полиартикулярная форма. Серопозитивный полиартрит | Системная форма. Болезнь Стилла |
| Возраст в дебюте, лет | 2 | 10 | 3 | 12 | 5 |
| РФ | Нет | Нет | Нет | Есть | Нет |
| Пол | Жен.>>>>Муж. | Жен.>>Муж. | Жен.>>Муж. | Жен.>>>Муж. | Жен.=Муж. |
| Антинуклеарный фактор | Да — 50% | (+) | Да — 25% | Да — 75% | Не типична |
| Гаплотип HLA | DR 5(6,8) | В 27 | DPw3 | DR4 | ? |
| Увеит | Да — 40%. Слепота в 18% | Да-25% | Не типичен | Не типичен | Не типична |
| Пораженные суставы | Коленный (+++), голеностопный (++), тазобедренный (++) | Коленный (+++), илеосакральный (++), голеностопный, лучезапястный и межфаланговые кисти и стопы (+). Поражение ахиллова сухожилия, пяточного бугра. Переход в анкилозирующий спондилит | Все мелкие, средние и крупные. Шейный отдел позвоночника, височно-челюстной | Все мелкие, средние и крупные | Системные проявления процесса превалируют над суставным синдромом |
| Количество пораженных суставов в дебюте | 1,3 | 2,5 | Полиартрит | Полиартрит | |
| Тип течения суставного синдрома | Деструкция суставов, хроническое течение | Ремиттирующее, быстрая деструкция тазобедренного сустава, кальцификация связок | Ремиттирующее | Хроническое персистирующее, деструкция | При наличии суставного синдрома угасают системные проявления |
В отличие от РА у взрослых, у детей редко выявляют узелки, РФ, но очень типичен увеит.
Склеродермия генерализованная (системная) или прогрессирующий системный склероз — аутоиммунное заболевание с нарушением микроциркуляции и с выраженной склонностью соединительной ткани к фиброзированию. Возникновение склеродермии связывают с хронической вирусной инфекцией фибробластов с последующим синтезом ими неполноценного коллагена, с нестабильностью клеточных мембран, с вазомоторными расстройствами первично измененных сосудов, с генетически обусловленными нарушениями триптофанового обмена, с травмами позвоночника, с имплантацией силиконовых протезов. Среди больных с акросклеротическим вариантом склеродермии преобладают пациенты с врожденным синдромом долихостеномелии. Возможны ограниченная склеродермия (только с поражением кожи) и системная. При ней поражается кожа, подкожная клетчатка, кости, мышцы, сердечно-сосудистая система, легкие, желудочно-кишечный тракт. Провоцирующими факторами являются введение антибиотиков, вакцин, влажный холод. Крайне неблагоприятно протекает поражение почек. Изменения кожи доминируют в развернутой клинической картине, но в дебюте могут быть мало выраженными. До 40–50% всех случаев системной склеродермии начинается с сосудистой и висцеральной симптоматики. Поражение кожи проявляется плотным индуративным отеком, атрофией, склерозом. Очаги склеродермии на коже могут быть в виде пятен гипер- и депигментированных, бляшек, линейных рубцов. Прогностически неблагоприятным является наличие вокруг пятна синюшно-розового венчика, что указывает на распространенный сосудистый процесс. Изменяется подкожная клетчатка, она истончается, склерозируется. Развивается остеолиз, особенно отчетливый при акросклеротическом варианте. На кончиках пальцев могут появиться мелкие болезненные язвочки: «крысиные укусы». Суставной синдром представлен артралгией, артритом и периартритом. В мышцах — фиброзно-интерстициальный миозит или первично-некротический процесс. В клинической картине доминирует синдром Рейно, с которого часто и дебютирует системная склеродермия. Синдром Рейно может быть не только периферический, но и висцеральный с периодами выпадения полей зрения или его временной потери, резкого спазма легочных сосудов с развитием критической легочной гипертензии (провоцируется вдыханием холодного воздуха). В сердце — клинически малоактивный миокардит, обусловливающий склерозирование миокарда с развитием в тяжелых случаях маленького ригидного сердца. Ранними признаками системности процесса при склеродермии являются снижение потребления кислорода миокардом (определяется по эндомиокардиальному напряжению в систолу), удлинению фазы быстрого наполнения и, соответственно, торможению притока. Поражение пищеварительного тракта проявляется сухостью слизистой оболочки, нарушением глотания, атонией пищевода (симптом «воздушного столба») (рис. 7.7), мальабсорбцией. При рентгено-изотопных исследованиях выявляют пневмосклероз.
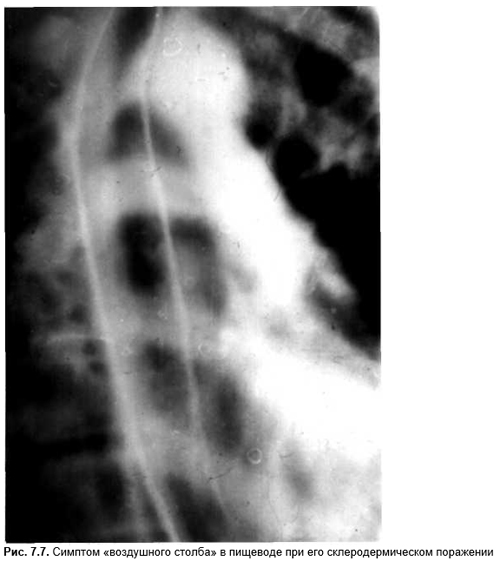
Поражение почек протекает по типу стремительно формирующейся сморщенной почки (склеродермическая почка). И в этом случаев первичным является интерстициальный сосудистый процесс.
Неблагоприятным в течение склеродермии является эозинофилия, обычно умеренная, и повышение уровня IgE (авторское свидетельство — 1631432).
Вариантом течения склеродермии является синдром Тибьержа — Вайсенбаха (CREST-синдром/Calcinosis, Raynaud phenomenon, Esophageal dysmotility, Sclerodactyly, Teleangioectasy), проявления которого видны из его названия. Следует добавить, что отложения кальция мелкие, располагаются прежде всего на фалангах, реже — по ходу сухожилий. ДД следует проводить с очаговыми (локализованными) формами склеродермии, с синдромом Рейно как идиопатическим, так и при других состояниях, со склеродемой Бушке, с эозинофильным фисциитом, синдромом эозинофилии-миалгии, синдромом Шарпа, хроническим полиартритом, синдромом Сьегрена, болезнью «трансплантат против хозяина» (особенно после пересадки костного мозга), с дерматомиозитом, СКВ. Склеродермоподобные состояния развиваются при циррозе печени и карциноидном синдроме.
Склередема Бушке поражает в основном детей, из взрослых — преимущественно женщин. За 1–6 нед до заболевания в анамнезе выявить респираторную инфекцию. Особенно часто ссылаются на бета-гемолитический стрептококк группы А, известный своей способностью разрушать коллаген.
На лице, верхнем плечевом поясе, очень редко — по всему телу, развивается плотный отек. При системной склеродермии превалирует распространение кожного процесса от периферии (руки) на лицо, а при склередеме стремительно поражается лицо и верхний плечевой пояс, а руки и ноги остаются, как правило, не измененными. При склередеме не бывает атрофии, пигментации и телеангиоэктазии. Внутренние органы изменяются на субклиническом уровне. Прогноз благоприятный, при адекватном лечении изменения исчезают бесследно через 1–6 мес.
Эозинофильный фасцит (синдром Шульмана) характеризуется субэпидермальной эозинофильной индурацией кожи, преимущественно на конечностях, с ограничением подвижности суставов. Шульман (1974) обратил внимание на связь резко болезненных отеков кисти и стопы с интенсивными физическими упражнениями у лиц, которые ранее вели сидячий образ жизни. В некоторых случаях поражаются лицо и туловище. Чаще заболевают мужчины зрелого возраста. Болезнь, как правило, начинается остро с боли, отека, апельсиновой яркости индурации кожи, карпального синдрома. Контрактуры вторичны по отношению к индурации и утолщению фасции. Возможны миалгия и артрит. Крайне редко выявляют апластическую анемию и тромбоцитопению. В противоположность склеродермии, у взрослых с синдромом Шульмана отсутствуют синдром Рейно и поражение внутренних органов, не выявляют антинуклеарный фактор. Но у детей возможны изменения кожи по типу кольцевидной склеродермии и/или «удара саблей».
В крови — эозинофилия (9–30%), поликлональная IgG-гипергаммаглобулинемия, повышение СОЭ.
Глюкокортикоидная терапия в ближайшие 2 года обусловливает выздоровление.
Синдром эозинофилии-миалгии развивается при лечении L-триптофаном, используемым как пищевую добавку (синдром токсического растительного масла). Проявляется лихорадкой, разнообразной сыпью, миалгией, болью в животе, интерстициальной пневмонией, афтозным стоматитом, гепатитом. Возможны эпидемические вспышки (по испанским данным — до 17 тыс. пораженных одновременно). Отмена триптофансодержащих препаратов и пищевых добавок часто, но не всегда, сопровождается регрессией симптоматики. Не представляется возможным проследить четкую корреляцию с дозой препарата. Случаи эозинофилии-миалгии возникали при использовании L-триптофана в различных дозах от 0,02 г 1 раз в день до 2 г и выше в сутки. Среди оставшихся в живых (летальность — до 1%) у части пациентов выявляют склеродермоподобную картину с синдромами Шегрена, Рейно, поражений кожи, дисфагией.
Эффект глюкокортикоидной терапии очень сомнителен.
Ятрогенные склеродермоподобные состояния и миофиброз возможны при инъекциях антибиотиков, терапии блеомицином, а также при применении всех препаратов, способствующих повышению в плазме крови уровня серотонина и кинуренинов (изониазид, сочетание L-5-гидрокситриптофана и карбидопы). Из химических веществ, вызывающих склеродермоподобные состояния, бесспорно известны винилхлорид, парафин, силикон.
Синдром Шарпа характеризуется наличием симптомов склеродермии, СКВ и дерматомиозита. Проявляется артралгией, опуханием суставов кистей, синдромом Рейно, миозитом. Типичны высокие титры антирибонуклеарных антител.
Дерматомиозит (болезнь Унферрихта) поражает поперечно-полосатую мышцу преимущественно конечностей. В более тяжелых случаях появляются клинические признаки поражения межреберных мышц, мышц глотки, любой другой группы. На лице по типу очков, на конечностях над суставами определяется лиловатая эритема. Одновременно умеренно повышается температура тела, появляются миалгия и артралгия, миопатический синдром затрудняет передвижения, глотания. Миозит заканчивается атрофией и фиброзом мышц, их кальцинозом. Кальциноз при дерматомиозите следует рассматривать как субклинически текущий активный процесс. Кальцинаты располагаются в мышцах конечностей, шеи. Возможно их отхождение в виде крошковидных масс с образованием свищевых ходов. Определяющим может оказаться поражение желудочно-кишечного тракта (отмечается склонность к язвообразованию с кровотечением). Необходимо ежедневно измерять экскурсию грудной клетки для раннего выявления поражения межреберных мышц.
Критериями диагноза дерматомиозита являются (Исаева Л.А., Жвания М.А., 1978):
- основные: эритема лиловая, параорбитальная с отеком и без, над разгибательными поверхностями суставов, иногда с атрофическими рубчиками. Поражение мышц симметричное, преимущественно проксимальных групп (слабость, отеки, боль, гипотрофия, кальциноз ограниченный и диффузный, дисфагия, нарушение дыхания).
- дополнительные: температура неправильного типа, слабость, анорексия. Пойкилодермия, распространенный отек кожи и подкожной клетчатки, сосудистый стаз, некрозы, пролежни, капилляриты на ладонях. Сухожильно-мышечные контрактуры. Поражение слизистой оболочки. Артралгия, артрит. Интерстициальные и аспирационные пневмония, миокардит, серозит (чаще — сухой). Повышение уровня мышечных ферментов, типичная электромиография и результаты кожно-мышечной биопсии.
У взрослых 17% всех случаев дерматомиозита являются опухолевыми, то есть отмечают паранеопластическую реакцию за счет перекрестно реагирующих опухолевых и мышечных антигенов. У детей эту форму дерматомиозита выявляют менее чем в 1% (в нашей группе больных опухолевый дерматомиозит был в 1 случае на 135 детей с истинным дерматомиозитом).
ДД проводят с миопатиями (отсутствует воспалительная реакция, нет кожных изменений), с РА (отсутствие доминирующего миопатического синдрома, лиловой эритемы, превалирование суставных изменений), с СКВ (иной характер эритемы, минимальный мышечный синдром), с узелковым периартериитом (сближают некрозы мягких тканей и сосудистый стаз, различают — миопатический синдром, лиловая эритема, миограмма).
1Классический пример — запрет работать натощак с культурой холерного вибриона. Ахлогидрия предрасполагает к заболеванию сальмонеллезом и туберкулезом.
2При заражении некоторыми штаммами Pl. vivax и возвращении вскоре после этого в холодный климат, болезнь может проявиться через год.
3Многие современные исследователи склонны считать их грибами, а не простейшими.
4Трансплацентарно передают инфекцию 1–5% беременных с хронической болезнью Чагаса. Заражение плода обусловливает самопроизвольный аборт, мертворождение, хроническое заболевание новорожденного с очень высокой летальностью.
5Еще раз обращаем внимание, что многие дети с практически нормальным иммунным статусом переносят 7–8 респираторных инфекций в год. Это особенно справедливо для посещающих детские сады, контактирующих со многими другими детьми, со старшими сиблингами.