Структура и физиологическое значение липидов и липопротеидов в плазме крови
Содержание
Дефиниция
Липиды идентифицируются как биологические субстанции, включающие в себя молекулы с широким спектром химических свойств, такие как жирные кислоты, фосфолипиды, стеролы, сфинголипиды, терпены и т.п., для которых характерны преимущественно гидрофобные качества и способность растворяться в органических растворителях (Smith A., 2000; Christie W.W., 2003). Важнейшей биологической ролью липидов является их участие в образовании клеточных мембран, внутриклеточных структур и органелл, а также в энергетическом метаболизме и синтезе ряда биологически активных соединений, таких как простагландины, стероидные гормоны, жирорастворимые витамины и некоторые коферменты (убихинон).
Современная классификация системы липидов
К настоящему времени создана и унифицирована современная классификация системы липидов, основанная на уникальных особенностях их строения и молекулярной структуры, а также их гидрофильных или гидрофобных свойствах. В соответствии с номенклатурой IUPAC-IUB (International Union of Pure and Applied Chemistry — International Union of Biochemistry) Commission on Biochemical Nomenclature выделяют восемь классов липидов, включающих жирные кислоты, глицеролипиды, глицерофосфолипиды, сфинголипиды, стеролы, пренолы, сахаролипиды и поликетиды (IUPAC-IUB Commission on Biochemical Nomenclature, 1977–2000). Химическая структура каждого из классов липидов представлена на рис. 1.1.
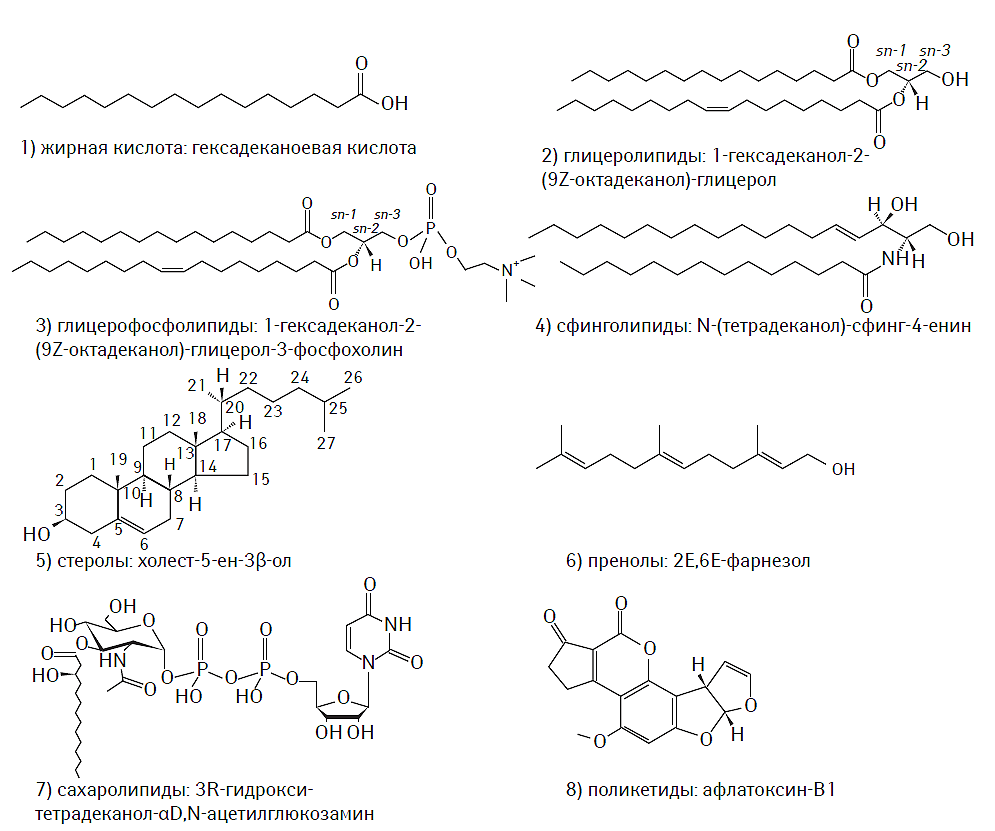
Рис. 1.1. Химическая структура основных классов липидов в соответствии с номенклатурой IUPAC-IUB Commission on Biochemical Nomenclature
Классы и подклассы липидов
Свободные жирные кислоты
Свободные жирные кислоты (СЖК) относятся к наиболее распространенным в организме человека классам липидов. Они имеют длинную неразветвленную цепь, состоящую из атомов углерода, и завершающуюся карбоксильным остатком (Caffrey M., Hogan J., 1992). Эти соединения обладают гидрофобными качествами благодаря наличию в составе молекулы СЖК повторяющейся серии из метиленовых групп. В зависимости от наличия или отсутствия в структуре СЖК двойных связей различают насыщенные (пальмитиновая, стеариновая и др.) и ненасыщенные (олеиновая, линолевая, линоленовая, арахидоновая) жирные кислоты соответственно (Small D.M., 1986).
Кроме того, существуют и другие классы СЖК: СЖК с прямой цепью (гексадеканоиды), метилсодержащие октадеканоиды, гидроксижирные кислоты, оксожирные кислоты (оксо-деканоиды), эпоксижирные кислоты (окстадеканоиды), метоксижирные кислоты, липокси-жирные кислоты (пентакоиды), гидропероксижирные кислоты, карбоциклические и гетероциклические производные, аминосодержащие жирные кислоты, нитрожирные кислоты (нитроокстадеканоиды), галогенированные и декарбоксилированные производные (Vance D.E., Vance J.E., 2002).
Ненасыщенные жирные кислоты, содержащие в структуре молекулы от 2 до 4 двойных связей, относят к незаменимым соединениям, поскольку в организме человека они не синтезируются и должны поступать с пищей, преимущественно с растительными маслами (Small D.M., 1986). Наиболее распространенные полиненасыщенные жирные кислоты (ПНЖК) — линолевая, линоленовая и арахидоновая, имеющие, соответственно, 2, 3 и 4 двойные связи. Биологическая роль полиненасыщенных жирных кислот в организме заключается в регуляции амфифильного состояния липидов клеточных мембран и в предотвращении депонирования холестерина (ХС) и других липидов в субинтиме стенки артерий. Кроме того, ПНЖК являются предшественниками простагландинов, лейкотриенов и других дериватов, а их w-3 производные принимают участие в метаболизме зрительных пигментов (Bazan N.G., 1989). СЖК с прямой цепью (гексадеканоиды) содержат терминальный карбоксильный остаток и часто являются конечным продуктом деградации поликетидов. Метилсодержащие октадеканоиды, а также циклические и гетероциклические СЖК широко представлены в природе (Ohlrogge J.B., 1997). Подклассы серосодержащих СЖК входят в состав биотина. Тиолы и их дериваты участвуют в синтезе и метаболизме полиненасыщенных жирных кислот. Многие подклассы СЖК, такие как гидроксижирные, оксожирные кислоты, а также окстадеканоиды являются прекурсорами критических этапов биологического синтеза ряда важнейших соединений, растительных эстрогенов, простагландинов и лейкотриенов (Murphy R.C., Smith W.L., 2002; Agrawal G.K. et al., 2004). Кроме того, многие эстерифицированные СЖК, такие как моно- и диэстерифицированные производные, а также лактоны, играют важную роль в обмене медиаторов, коэнзимов и карнитина. Липокси- и метоксижирные кислоты (пентакоиды), а также аминосодержащие СЖК занимают важное место в стабилизации клеточных мембран в организме человека и формировании устойчивости бактериальной стенки к антибиотикам (Roche D.M. et al., 2004). Химическая структура различных подклассов СЖК представлена на рис. 1.2.
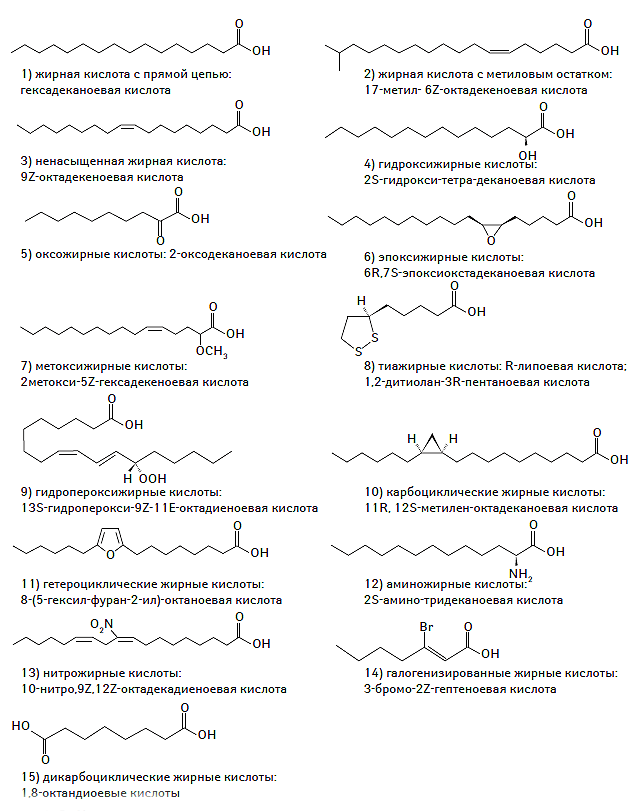
Рис. 1.2. Химическая структура различных подклассов СЖК
Глицеролипиды
Несмотря на то что в структуре глицеролипидов и глицерофосфолипидов содержатся остатки молекулы глицерина, последние выделены в отдельную группу, поскольку часто выступают в роли биологических регуляторов синтеза триглицеридов (ТГ) в различных органах и тканях, а также в качестве сигнальных молекул. Среди глицеролипидов доминируют моно-, ди- и тризамещенные глицеролы, хорошо известные как ацилглицерины (так называемые нейтральные жиры) (Stam H. et al., 1987; Coleman R.A., Lee D.P., 2004). Другие подклассы представлены глицерогликанами, которые содержат один или несколько остатков гликолизированного глицерина (Pahlsson P. et al., 1998). Химическая структуры глицеролипидов представлена на рис. 1.3.
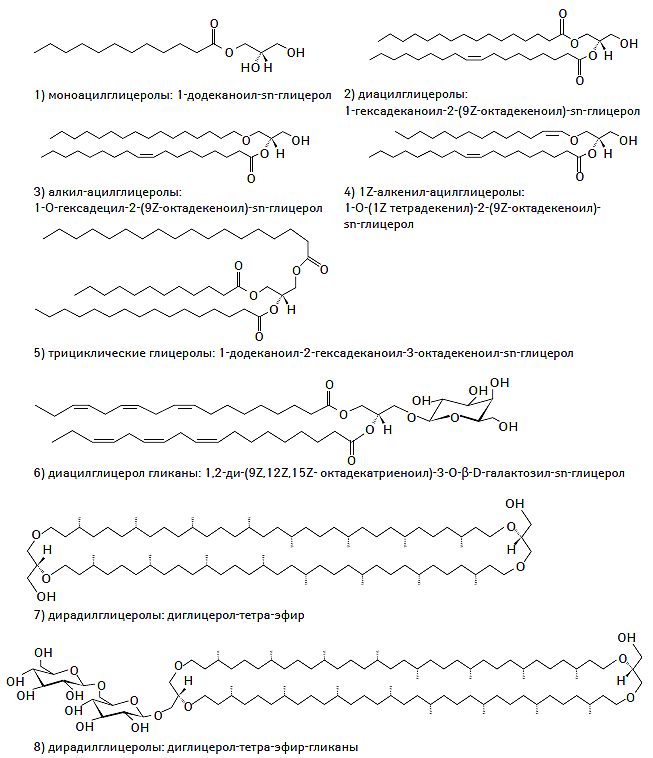
Рис. 1.3. Химическая структура глицеролипидов
Глицерофосфолипиды
Глицерофосфолипиды образуются в результате связывания одной из гидроксильных групп глицерина с фосфатной группой, а двух других — с СЖК (Ivanova P.T. et al., 2004). Этот класс липидов является ключевым компонентом желчных кислот, предшественником кардиолипина, внутриклеточных мессенджеров, сигнальных молекул, факторов свертывания крови, а также входит в состав биологических мембран и цитоскелета (Kennedy E.P., 1962; Cevc G., 1993; Forrester J.S. et al., 2004; Ivanova P.T. et al., 2004; Pereto J. et al., 2004). Большая часть глицерофосфолипидов представлена фосфатидилхолинами (лецитином) и фосфатидилэтаноламинами. Химическая структура глицерофосфолипидов представлена на рис. 1.4.
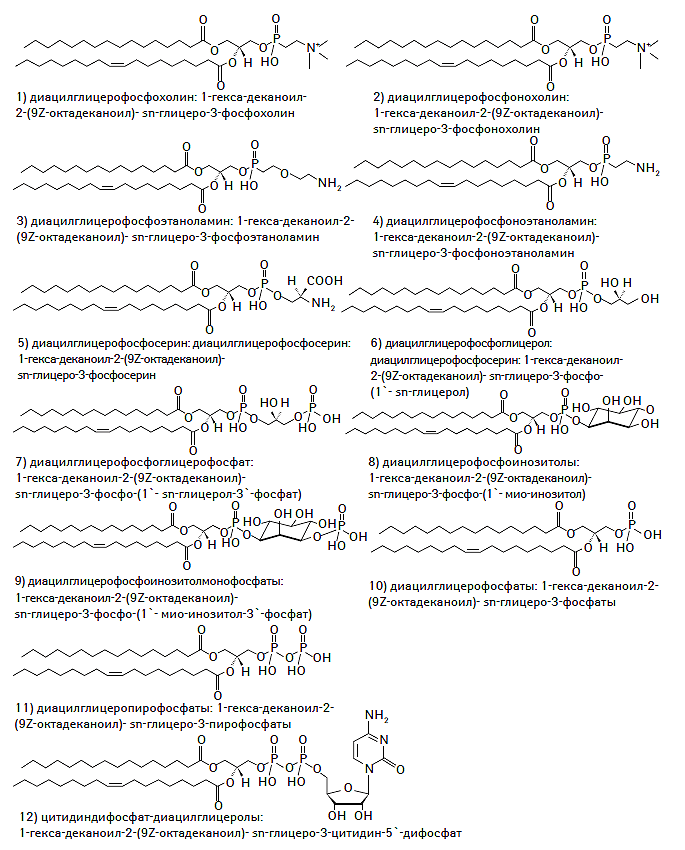
Рис. 1.4. Химическая структура глицерофосфолипидов
Сфинголипиды
Сфинголипиды — одно из наиболее широко представленных в природе семейств липидов, синтезирующихся de novo из серина и длинноцепочечного ацил-коэнзима А (ацил-КoA), а затем конвертирующегося в различные дериваты, такие как керамиды, фосфосфинголипиды, гликосфинголипиды и другие продукты (Taniguchi N. et al., 2002). Сфинголипиды входят в состав миелиновых оболочек и биологических мембран различных клеток, особенно эпидермальных. Химическая структура сфинголипидов представлена на рис. 1.5.
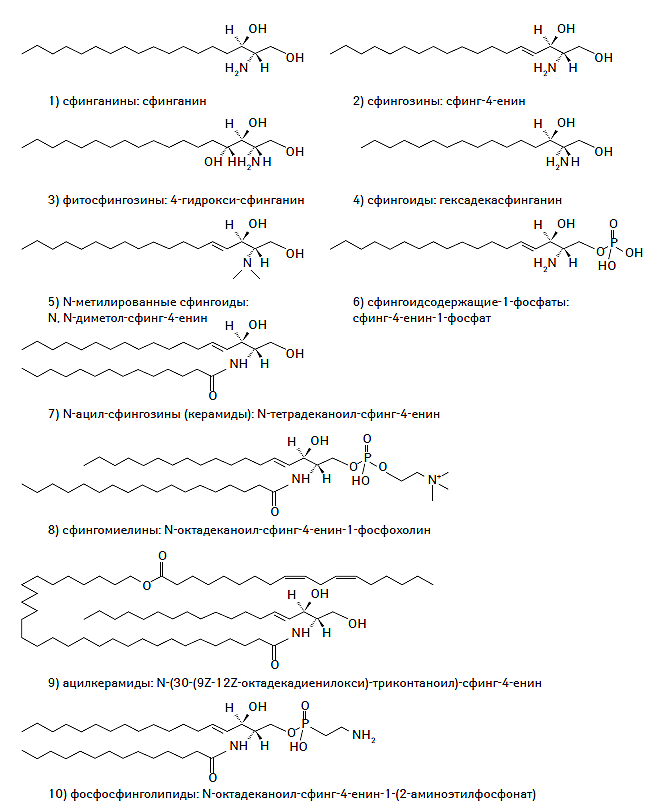
Рис. 1.5. Химическая структура сфинголипидов
Стеролы
Стеролы представляют собой производные восстановленных конденсированных циклических систем — циклопентанпергидрофенантренов. К числу производных C21-стеролов относятся прогестерон, кортикостерон, минералкортикоиды, к дериватам C18-стеролов — кортизол, тестостерон, андростерон, эстрогены, а также многие сигнальные молекулы. Кроме того, производными стеролов являются желчные кислоты, ХС, витамин D, таурин, глицин, глюкуроновая кислота и др. (Jones G. et al., 1998; Taniguchi N. et al., 2008). Стеролы входят в состав биологических мембран и цитоскелета вместе с глицеролипидами, лизофосфатидами, сфингомиелином (Merrill A.H. Jr., Sandhoff K., 2002; Bach D., Wachtel E., 2003; Russell D.W., 2003). Химическая структура стеролов представлена на рис. 1.6.

Рис. 1.6. Химическая структура стеролов
Пренолы
Пренолы синтезируются из пяти углеродных предшественников изопентилдифосфата и диметилалилдифосфата, которые являются промежуточными продуктами метаболизма мевалоната (Kuzuyama T., Seto H., 2003). Необходимо отметить, что дериватами пренолов являются многие жирорастворимые витамины, такие как витамин А, Е и К, а также природные антиоксиданты и коэнзимы (убихинон) (Porter J.W., Spurgeon S.L., 1981; Meganathan R., 2001; Ricciarelli R. et al., 2001; Demming-Adams B., Adams W.W., 2002). Полипренолы (долихолы) играют важную роль в обеспечении транспорта олигосахаридов через биологические мембраны, модулировании гликации белков и липидов, а также синтезе полисахаридов (Lazar K., Walker S., 2002; Raetz C.R.H., Whitfield C., 2002). Химическая структура пренолов представлена на рис. 1.7.
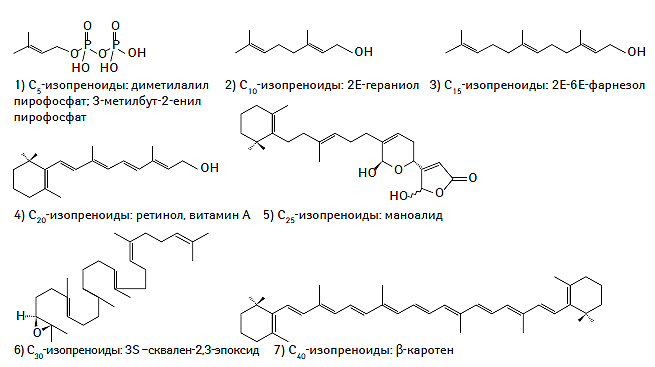
Рис. 1.7. Химическая структура пренолов
Сахаролипиды
В соответствии с современной номенклатурой термин «гликолипиды» заменен на «сахаролипиды», поскольку все восемь основных классов липидов имеют гликолипидные и фосфогликолипидные дериваты. Сахаролипиды входят в состав биологических мембран, а также являются компонентом бактериальной стенки грамотрицательных бактерий, обладающей чрезвычайно высокой иммунно- и анафилактогенностью (Spaink H.P., 2000; Lazar K., Walker S., 2002; Raetz C.R.H., Whitfield C., 2002). Химическая структура сахаролипидов представлена на рис. 1.8.
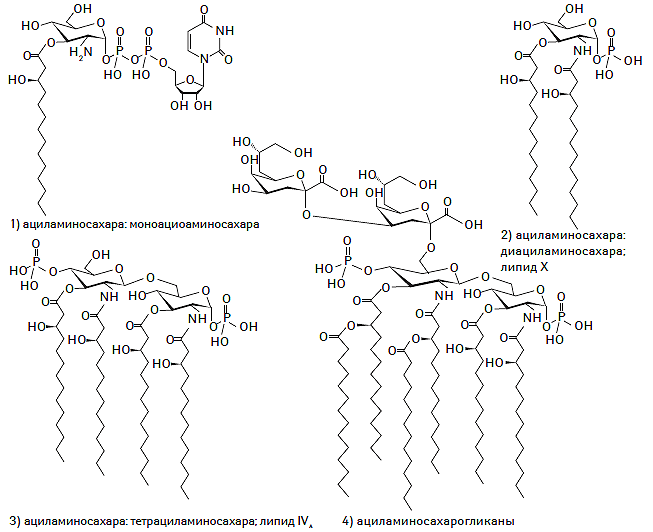
Рис. 1.8. Химическая структура сахаролипидов
Поликетиды
Поликетиды представлены ароматическими, макролидными и гибридными производными, основной биологической ролью которых является непосредственное участие в синтезе липидов различных классов (Walsh C.T., 2004). Структура поликетидов подвергается модификации в ходе реакций гликолизации, окисления, гидроксилирования и метилирования и некоторых других (Khosla C. et al., 1999). Сами поликетиды часто вовлекаются в процессы рибосомального протеинсинтеза. Кроме того, большинство эпитопов различных антибиотиков и антифунгицидов являются поликетидами или их дериватами. С другой стороны, многие поликетиды являются потенциальными токсинами (Moore B.S., Hartweck C., 2002; Reeves C.D., 2003). Химическая структура поликетидов представлена на рис. 1.9.

Рис. 1.9. Химическая структура поликетидов
Липопротеиды
Липопротеиды являются транспортными формами липидов, имеют глобулярную структуру в виде радиально расположенных вокруг молекул ТГ и ХС полярных молекул фосфолипидов, направленных гидрофильным полюсом центрально. Они состоят из апопротеина и липидного компонента. Основные свойства липопротеидов определяются преимущественно протеиновыми компонентами, тогда как их липидная часть обладает значительно меньшей специфичностью. Большинство клеточных рецепторов способны распознавать именно молекулу апопротеина, благодаря которой осуществляются кооперация, поглощение, деградация и клиренс липопротеида, а также обмен ХС и ТГ между липопротеидами различных классов.
Основные классы липопротеидов отличаются по своим физико-химическим свойствам: размеру частиц, их плотности и соотношению входящих в их состав апопротеина, ТГ, ХС и фосфолипидов (табл. 1.1).
В физиологических условиях у человека ХС и ТГ распределены в различных липопротеидах в определенных взаимоотношениях (рис. 1.10). Причем последние не являются «жесткими» и могут существенно модифицироваться при различных состояниях, таких как голодание, прием пищи, обогащенной экзогенными жирами, вегетарианском питании, после физических нагрузок высокой интенсивности и т.п.
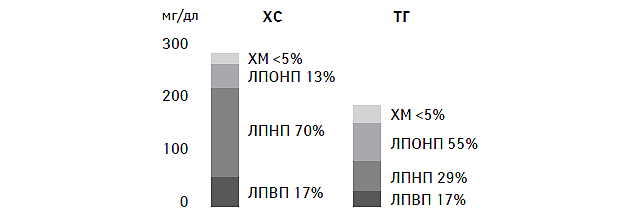
Рис. 1.10. Удельное распределение ХС и ТГ в липопротеидах у здоровых лиц натощак ХМ — хиломикроны.
Основные апопротеины, входящие в состав липопротеидов, указаны в табл. 1.2. Так, хиломикроны и липопротеиды очень низкой плотности (ЛПОНП) состоят главным образом из ТГ и содержат апо-В48-, апо-С- и апо-Е-протеины. Они отличаются очень низкой плотностью и достаточно крупными размерами частиц (от 30–80 нм до 100–150 нм). Липопротеиды низкой плотности (ЛПНП) относятся к апо-В100-содержащим липопротеидам, имеют менее крупные частицы (20 нм) и обогащены ХС. Удельное содержание в них апо-В100-протеина не превышает 25%. Наиболее мелкими частицами являются липопротеиды высокой плотности (ЛПВП), состоящие преимущественно из апо-А-I-, апо-А-II- и апо-С-липопротеина, а также фосфолипидов. Апо-В-содержащие липопротеиды являются основной транспортной формой эндогенного ХС, обеспечивая его транспорт в клетки периферических тканей, и обладают потенциально атерогенными качествами, тогда как ЛПВП участвуют в процессах обратного транспорта ХС в гепатоциты и проявляют антиатерогенные качества (рис. 1.11). Более подробно о процессах эндогенного синтеза ХС и взаимоотношениях различных вне- и внутриклеточных липидных транспортных систем изложено в главе 2.
Кроме ТГ, ХС и фосфолипидов в плазме крови присутствуют так называемые неэстерифицированные жирные кислоты (НЭЖК), адсорбированные на альбумине, и хиломикроны, хотя период их полужизни чрезвычайно ограничен. НЭЖК освобождаются из липоцитов и транспортируются к различным органам и тканям. Хиломикроны являются основной транспортной формой экзогенных ТГ.
Таблица 1.1 Физико-химические характеристики липопротеидов
| Липопротеиды | Плотность, г/мл | Содержание липидов, % | ||
| ТГ | ХС | Фосфолипиды | ||
| ХМ | 0,95 | 80–95 | 2–7 | 3–9 |
| ЛПОНП | 0,95–1,006 | 55–80 | 5–15 | 10–20 |
| ЛППП | 1,006–1,019 | 20–50 | 20–40 | 15–25 |
| ЛПНП | 1,019–1,063 | 5–15 | 40–50 | 20–25 |
| ЛПВП | 1,063–1,21 | 5–10 | 15–25 | 20–30 |
В табл. 1 и 2: ХМ — хиломикроны, ЛПОНП — липопротеиды очень низкой плотности, ЛППП — липопротеиды промежуточной плотности, ЛПНП — липопротеиды низкой плотности, ЛПВП — липопротеиды высокой плотности.
Таблица 1.2 Основные апопротеины, входящие в состав липопротеидов
| Липопротеиды | Апопротеины |
| ХМ | Апо-В48, апо-С, апо-Е |
| ЛПОНП | Апо-В100, апо-С, апо-Е |
| ЛПНП | Апо-В100 |
| ЛППП | Апо-В100, апо-Е |
| ЛПВП | – |
| Субфракция 2 | Апо-А-I, апо-А-II, апо-С |
| Субфракция 3 | Апо-А-II, апо-А-I, апо-С |
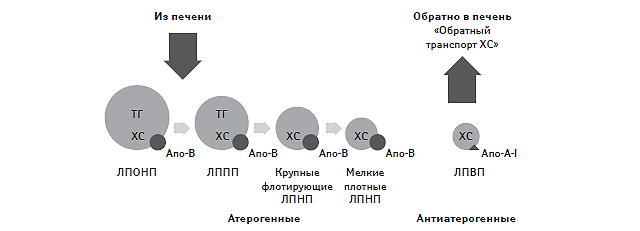
Рис. 1.11. Потенциально про- и антиатерогенные липопротеиды
Таким образом, биологическая роль липидов в организме человека многообразна и не сводится только к выполнению пластической функции и участию в энергетическом метаболизме. Многие коферменты, энзимы, сигнальные молекулы и рецепторные субъединицы либо сами являются дериватами липидов, либо инкорпорируют последние в свою структуру. Если клинические значения для многих компонентов системы экзогенного и эндогенного путей метаболизма липидов уже установлены (общий ХС, хиломикроны, фракции липопротеидов, ТГ, НЭЖК, мицеллы, содержащие СЖК, субклассы СЖК, апопротеины, липопротеиды (a) — ЛП (a), фосфолипиды), то для регуляторных субъединиц, сигнальных молекул и многих других соединений такую роль еще придется документировать.
Литература
- Agrawal G.K., Tamogami S., Han O. et al. (2004) Rice octadecanoid pathway. Biochem. Biophys. Res. Commun., 317: 1–15.
- Bach D., Wachtel E. (2003) Phospholipid/cholesterol model membranes: formation of cholesterol crystallites. Biochim. Biophys. Acta., 1610: 187–197.
- Bazan N.G. (1989) The metabolism of omega-3 polyunsaturated fatty acids in the eye: the possible role of docosahexaenoic acid and docosanoids in retinal physiology and ocular pathology. Prog. Clin. Biol. Res., 312: 95–112.
- Caffrey M., Hogan J. (1992) LIPIDAT: a database of lipid phase transition temperatures and enthalpy changes. Chem. Phys. Lipids., 61: 1–109.
- Cevc G. (1993) Phospholipids Handbook. Marcel Dekker Inc., New York.
- Christie W.W. (2003) Lipid Analysis. 3rd edition. Oily Press, Bridgewater, UK.
- Coleman R.A., Lee D.P. (2004) Enzymes of triacylglycerol synthesis and their regulation. Prog. Lipid Res., 43: 134–176.
- Demming-Adams B., Adams W.W. (2002) Antioxidants in photosynthesis and human nutrition. Science, 298: 2149–2153.
- Forrester J.S., Milne S.B., Ivanova P.T. et al. (2004) Computational lipidomics: a multiplexed analysis of dynamic changes in membrane lipid composition during signal transduction. Mol. Pharmacol., 65: 813–821.
- IUPAC-IUB Commission on Biochemical Nomenclature (1977) The nomenclature of lipids (recommendations 1976). Eur. J. Biochem., 79: 11–21; (1977) Hoppe-Seylers Z. Physiol. Chem., 358: 617–631; (1977) Lipids., 12: 455–468; (1977) Mol. Cell. Biochem., 17: 157–171; (1978) Chem. Phys. Lipids., 21: 159–173; (1978) J. Lipid Res., 19: 114–128; (1978) Biochem. J., 171: 21–35 (http://www.chem.qmul.ac.uk/iupac/lipid/).
- IUPAC-IUB Commission on Biochemical Nomenclature (1987) Nomenclature of prenols (recommendations 1986). Eur. J. Biochem., 167: 181–184 (http://www.chem.qmul.ac.uk/iupac/misc/prenol.html).
- IUPAC-IUB Commission on Biochemical Nomenclature (1989) Nomenclature of steroids (recommendations 1989). Eur. J. Biochem., 186: 429–458 (http://www.chem.qmul.ac.uk/iupac/steroid/).
- IUPAC-IUB Commission on Biochemical Nomenclature (1997) Nomenclature of glycolipids (recommendations 1997). Pure Appl. Chem., 69: 2475–2487; (1998) Carbohydr. Res., 312: 167–175; (1998) Eur. J. Biochem., 257: 293–298; (1999) Glycoconjugate J., 16: 1–6; (1999) J. Mol. Biol., 286: 963–970; (2000) Adv. Carbohydr. Chem. Biochem., 55: 311–326 (http://www.chem.qmul.ac.uk/iupac/misc/glylp.html).
- Ivanova P.T., Milne S.B., Forrester J.S. et al. (2004) Lipid arrays: new tools in the understanding of membrane dynamics and lipid signaling. Mol. Interventions, 4: 86–96.
- Jones G., Strugnell S.A., DeLuca H.F. (1998) Current understanding of the molecular actions of vitamin D. Physiol. Rev., 78: 1193–1231.
- Kennedy E.P. (1962) The metabolism and function of complex lipids. Harvey Lecture Series, 57: 143–171.
- Khosla C., Gokhale R., Jacobsen J.R. et al. (1999) Tolerance and specificity of polyketide synthases. Annu. Rev. Biochem., 68: 219–253.
- Kuzuyama T., Seto H. (2003) Diversity of the biosynthesis of the isoprene units. Nat. Prod. Rep., 20: 171–183.
- Lazar K., Walker S. (2002) Substrate analogues to study cell-wall biosynthesis and its inhibition. Curr. Opin. Chem. Biol., 6: 786–793.
- Meganathan R. (2001) Biosynthesis of menaquinone (vitamin K2) and ubiquinone (coenzyme Q): a perspective on enzymatic mechanisms. Vitam. Horm., 61: 173–218.
- Merrill A.H. Jr., Sandhoff K. (2002) Sphingolipids: metabolism and cell signaling. In: D.E. Vance, J.E. Vance (Eds.) Biochemistry of Lipids, Lipoproteins, and Membranes. 4th edition. Elsevier Science, New York, pp. 373–407.
- Moore B.S., Hartweck C. (2002) Biosynthesis and attachment of novel bacterial polyketide synthase starter units. Nat. Prod. Rep., 19: 70–99.
- Murphy R.C., Smith W.L. (2002) The eicosanoids: cyclooxygenase, lipoxygenase, and epoxygenase pathways. In: D.E. Vance, J.E. Vance (Eds.) Biochemistry of Lipids, Lipoproteins, and Membranes. 4th edition. Elsevier Science, New York, pp. 341–371.
- Ohlrogge J.B. (1997) Regulation of fatty acid synthesis. Annu. Rev. Plant Physiol. Plant Mol. Biol., 48: 109–136.
- Pahlsson P., Spitalnik S.L., Spitalnik P.F. et al. (1998) Characterization of galactosyl glycerolipids in the HT29 human colon carcinoma cell line. Arch. Biochem. Biophys., 396: 187–198.
- Pereto J., Lopez-Garcia P., Moreira D. (2004) Ancestral lipid biosynthesis and early membrane evolution. Trends Biochem. Sci., 29: 469–477.
- Porter J.W., Spurgeon S.L. (1981) Biosynthesis of Isoprenoid Compounds., Vol. 1. John Wiley&Sons, New York.
- Raetz C.R.H., Whitfield C. (2002) Lipopolysaccharide endotoxins. Annu. Rev. Biochem., 71: 635–700.
- Reeves C.D. (2003) The enzymology of combinatorial biosynthesis. Crit. Rev. Biotechnol., 23: 95–147.
- Ricciarelli R., Zingg J.M., AzziI A. (2001) Vitamin E: protective role of a Janus molecule. FASEB J., 15: 2314–2325.
- Roche D.M., Byers J.T., Smith D.S. et al. (2004) Communications blackout? Do N-acylhomoserine-lactone-degrading enzymes have any role in quorum sensing? Microbiology, 150: 2023–2028.
- Russell D.W. (2003) The enzymes, regulation, and genetics of bile acid synthesis. Annu. Rev. Biochem., 72: 137–174.
- Small M. (1986) Physical Chemistry of Lipids. In: D.J. Hanahan (Ed.) Handbook of Lipid Research. Vol. 4. Plenum Press, New York, pp. 21–41.
- Smith A. (2000) Oxford Dictionary of Biochemistry and Molecular Biology. 2nd edition. Oxford University Press, Oxford, UK.
- Spaink H.P. (2000) Root nodulation and infection factors produced by rhizobial bacteria. Annu. Rev. Microbiol., 54: 257–288.
- Stam H., Schoonderwoerd K., Hulsmann W.C. (1987) Synthesis, storage and degradation of myocardial triglycerides. Basic Res. Cardiol., 82 (Suppl. 1): 19–28.
- Taniguchi N., Honke K., Fukuda M. (2002) Handbook of Glycosyltransferases and Related Genes. Springer-Verlag, Tokyo.
- Vance D.E., Vance J.E. (Eds.) (2002) Biochemistry of Lipids, Lipoproteins and Membranes. 4th edition. Elsevier Science, New York.
- Walsh C.T. (2004) Polyketide and nonribosomal peptide antibiotics: modularity and versatility. Science, 303: 1805–1810.
- Watanabe K., Yasugi E., Ohshima M. (2000) How to search the glycolipid data in «Lipidbank for web» the newly-developed lipid database in Japan. Trends Gycosci. Glycotechnol., 12: 175–184.