Диагностика и лечение фибрилляции предсердий
Содержание
- КЛАССИФИКАЦИЯ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ
- КЛИНИЧЕСКАЯ ОЦЕНКА ПАЦИЕНТОВ С ФИБРИЛЛЯЦИЕЙ ПРЕДСЕРДИЙ
- Минимально необходимые исследования
- Дополнительные методы исследования
- Инструментальные исследования
- Дополнительные методы исследования
- ТАКТИКА ВЕДЕНИЯ ПАЦИЕНТОВ С ФП
- Алгоритмы ведения пациентов с фибрилляцией предсердий
- Контроль частоты желудочковых сокращений
- ПРОФИЛАКТИКА ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ У БОЛЬНЫХ С ФП
- Стратификация риска тромбоэмболических осложнений
- АНТИТРОМБОТИЧЕСКАЯ ТЕРАПИЯ ДЛЯ ПРОФИЛАКТИКИ ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ
- ПРОФИЛАКТИКА ТРОМБОЭМБОЛИИ ПРИ ВОССТАНОВЛЕНИИ СИНУСОВОГО РИТМА
- РЕКОМЕНДАЦИИ
- Контроль ЧСС при ФП с помощью лекарственных средств
- Профилактика тромбоэмболий
- Кардиоверсия при ФП
- Поддержание синусового ритма
- Послеоперационная ФП
- Острый ИМ
- Ведение пациентов с ФП, ассоциированной с WPW-синдромом
- Гипертиреоз
- Ведение пациенток с ФП в период беременности
- Ведение пациентов с ФП и ГКМП
- Ведение пациентов с ФП и заболеванием легких
- ЛИТЕРАТУРА
Фибрилляция предсердий (ФП) — разновидность наджелудочковой тахиаритмии, характеризующаяся некоординированной электрической активностью предсердий с последующим ухудшением их сократительной функции. ФП является наиболее распространенным устойчивым нарушением сердечного ритма, частота которого повышается с возрастом. На долю ФП приходится около И госпитализаций по поводу нарушений сердечного ритма. ФП часто сопровождается заболеванием сердца с наличием структурных изменений. У части пациентов ФП возникает без признаков сердечно-сосудистого заболевания, однако гемодинамические нарушения и тромбоэмболические осложнения, связанные с ФП, обусловливают высокую заболеваемость, двукратное повышение смертности при ФП и требуют значительных расходов на ее лечение.
КЛАССИФИКАЦИЯ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ
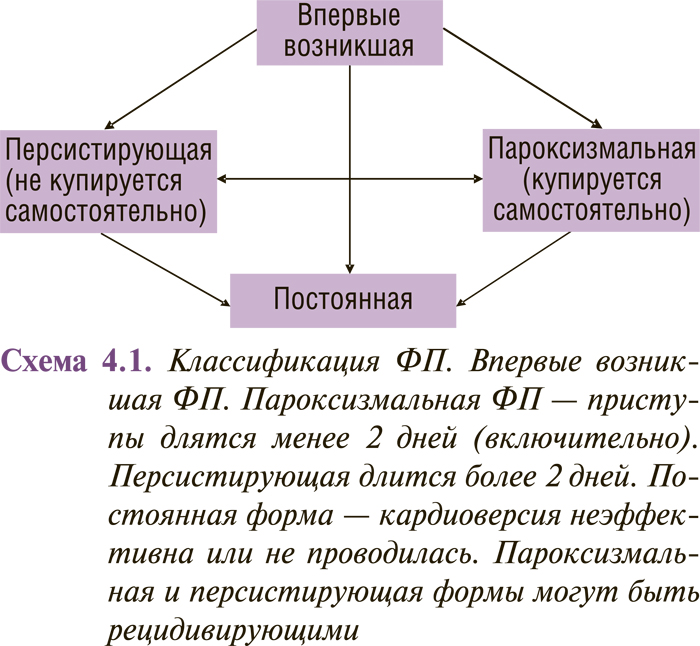
Впервые возникший эпизод ФП выделяют независимо от того, сопровождался он какими-либо клиническими симптомами или купировался самостоятельно. При этом следует учитывать, что длительность приступа ФП может быть неопределенной, а предыдущие эпизоды — нераспознанными.
Если у пациента было два или более приступов, то ФП считается рецидивирующей. При этом она может быть: а) пароксизмальной — если аритмия купируется самостоятельно и эпизоды длятся менее 2 сут; б) персистирующей — если аритмия не заканчивается самостоятельно и длится более 2 сут. Если эпизод ФП длится более 48 ч, необходимо назначение антикоагулянтной терапии, так как возрастает риск возникновения тромбоэмболических осложнений. К постоянной ФП относятся случаи длительно существующей ФП (например более 1 года), при которых кардиоверсия была неэффективной или ее проведение сочли нецелесообразным (схема 4.1). Вышеприведенные термины относятся к эпизодам более 30 сут, не связанным с обратимой причиной ФП.
В зависимости от частоты желудочковых сокращений выделяют брадисистолический вариант — частота желудочковых сокращений менее 60 уд./мин, а также тахисистолический вариант — частота желудочковых сокращений более 90 уд./мин.
Вторичная ФП, возникающая во время острого ИМ, операций на сердце, при перикардите, миокардите, гипертиреозе, ТЭЛА, пневмонии или другом остром заболевании легких, рассматривается отдельно. Это связано с тем, что при исчезновении этиологического фактора существует малая вероятность развития повторного эпизода аритмии. В этой ситуации ФП не является основной проблемой и одновременное лечение этиологического фактора и приступа ФП обычно завершается купированием аритмии без ее рецидивов в дальнейшем.
Термин «идиопатическая ФП» имеет много определений, но обычно используется при ФП, возникающей у лиц в возрасте младше 60 лет, у которых отсутствуют клинические или эхокардиографические признаки сердечно-легочного заболевания, включая АГ.
Не претерпел существенных изменений раздел «Диагностика ФП». В числе обязательных методов обследования пациентов с ФП сохранены опрос и осмотр, ЭКГ и трансторакальная эхокардиография (ТэхоКГ). Некоторых изменений претерпело исследование крови. Для пациентов с впервые выявленной ФП, а также в тех случаях, когда контроль ЧСС вызывает затруднения, предлагается исследовать кровь не только для оценки функции щитовидной железы, но и оценки функции почек и печени. Рентгенографическое исследование грудной клетки в связи с невысокой его информативностью перешло в разряд дополнительных исследований. В числе дополнительных исследований по-прежнему выделяют использование холтеровского мониторирования (или регистратора событий) и ЭФИ. Для оценки эффективности контроля ЧСС, помимо теста с физической нагрузкой, предлагается проведение теста с 6-минутной ходьбой.
КЛИНИЧЕСКАЯ ОЦЕНКА ПАЦИЕНТОВ С ФИБРИЛЛЯЦИЕЙ ПРЕДСЕРДИЙ
При общении с пациентом с подозрением на ФП или ее наличием необходимо уточнить: характер заболевания, его классификацию, определить причину ФП и наличие ассоциированных сердечных и внесердечных факторов. Внимательный сбор анамнеза и осмотр больного помогут разработать рациональный, конкретный план обследования, который будет служить эффективным руководством к лечению.
Минимально необходимые исследования
1. Анамнез заболевания и данные объективного осмотра для определения:
- наличия и природы симптомов, связанных с ФП;
- клинической формы ФП (впервые выявленная, пароксизмальная, персистирующая или постоянная);
- начала первого приступа, сопровождающегося симптоматикой, или даты обнаружения ФП;
- частоты, длительности, провоцирующих факторов и способов купирования ФП;
- эффективности любых лекарственных средств, назначенных ранее;
- наличия заболеваний сердца или других обратимых состояний (например гипертиреоза или употребления алкогольных напитков).
2. ЭКГ для определения:
- ритма (подтверждение ФП);
- частоты желудочковых сокращений;
- ГЛЖ;
- длительности и морфологии зубца Р или наличия волн фибрилляции;
- предвозбуждения желудочков;
- блокады ветвей пучка Гиса;
- ИМ в прошлом;
- других аритмий;
- длительности интервалов R–R, Q–T, комплекса QRS в динамике для оценки действия антиаритмических препаратов.
3. ТэхоКГ для выявления:
- заболеваний клапанов сердца;
- размеров левого и правого предсердий;
- размеров и функции ЛЖ;
- максимального давления в ПЖ (при легочной гипертензии);
- ГЛЖ;
- тромба в левом предсердии (низкая чувствительность метода);
- заболевания перикарда.
4. Анализ крови для определения функции щитовидной железы, почек и печени:
- при всех клинических формах ФП, а также при трудности контроля частоты желудочковых сокращений.
Дополнительные методы исследования
(может потребоваться проведение одного или нескольких исследований)
1. Проба с 6-минутной ходьбой:
- при сомнении в адекватности контроля частоты желудочковых сокращений.
2. Пробы с физической нагрузкой:
- при сомнении в адекватности контроля желудочкового ритма (при постоянной ФП);
- для воспроизведения ФП, провоцируемой физической нагрузкой;
- для исключения наличия ишемии миокарда перед началом лечения антиаритмическими препаратами группы IC по классификации V. Williams.
3. Холтеровское мониторирование или регистрация событий:
- при сомнении в определении формы ФП;
- как способ оценки контроля желудочкового ритма.
4. Чреспищеводная эхоКГ (ЧПэхоКГ):
- для выявления тромба в левом предсердии (в ушке левого предсердия);
- при решении вопроса о возможной кардиоверсии.
5. ЭФИ:
- для уточнения механизма развития тахикардии с широкими комплексами QRS;
- для выявления аритмии, предрасполагающей к ФП, например трепетания предсердий или пароксизмальной наджелудочковой тахикардии;
- для определения участков абляции или блокады AV-проведения.
6. Рентгенография грудной клетки для оценки:
- состояния легочной паренхимы и легочного сосудистого русла.
Инструментальные исследования
Для диагностики ФП необходимо наличие признаков ФП хотя бы в одном отведении ЭКГ во время приступа. Если приступы происходят часто, можно применить 24-часовое холтеровское мониторирование. На рентгенограмме грудной клетки можно обнаружить увеличение камер сердца и признаки СН, однако наибольшую ценность это исследование представляет для выявления патологии легких и оценки состояния легочных сосудов. Двухмерную ТэхоКГ следует назначать всем пациентам с ФП при начальном обследовании для определения размеров левого предсердия и ЛЖ, толщины стенки и функции ЛЖ, а также для исключения бессимптомного поражения клапанов, заболевания перикарда, ГКМП. Оценка систолической и диастолической функции ЛЖ помогает принять решение о необходимости антикоагулянтной и антиагрегантной терапии. Тромб следует искать в левом предсердии, однако его редко можно выявить без ЧПэхоКГ.
Дополнительные методы исследования
Холтеровское мониторирование и определение толерантности к физической нагрузке. Помимо установления диагноза ФП, холтеровское мониторирование и тредмил-тест способствуют лучшей оценке адекватности контроля, чем ЭКГ в покое. Тест с функциональной нагрузкой следует назначать при подозрении на ишемию миокарда или планировании тактики лечения с использованием антиаритмических препаратов группы ІС.
ЧПэхоКГ является наиболее чувствительной и специфичной, когда речь идет об источниках и возможных механизмах сердечной эмболии, и используется для стратификации больных с ФП по риску развития инсульта, а также для подготовки к кардиоверсии.
ЭФИ у больных с пароксизмальной формой ФП помогает определить механизм развития ФП, что важно при намерении применить катетерную абляцию. Причиной ФП может быть фокус с быстрой импульсацией, часто находящийся в области легочных вен, наджелудочковой тахикардии с правильным ритмом, АV-узловое re-entry или трепетание предсердий, переходящее в ФП. ЭФИ используется при подозрении на дисфункцию синусного узла, а также для определения механизма образования широких комплексов QRS при ФП, особенно при быстром желудочковом ритме. Для контроля ритма путем катетерной абляции или изменения АУ-проведения, а также для отбора больных с целью профилактической имплантации искусственного водителя ритма, необходимо ЭФИ.
ТАКТИКА ВЕДЕНИЯ ПАЦИЕНТОВ С ФП
На начальном этапе ведение пациентов с ФП включает преимущественно применение тактики контроля частоты желудочковых сокращений и синусового ритма. При тактике контроля частоты желудочковых сокращений желудочковый ритм контролируют без намерения восстановить и поддерживать синусовый ритм. При тактике контроля синусового ритма стараются его восстановить и/или поддерживать. При применении последней тактики необходимо уделять внимание и контролю желудочкового ритма. Если первоначально избранная тактика оказалась неэффективной из-за особенностей течения аритмии у данного пациента, прибегают к альтернативной тактике. Независимо от применения тактики (контроля частоты желудочковых сокращений или синусового ритма) необходимо уделять внимание антитромботической терапии для профилактики тромбоэмболии.
Алгоритмы ведения пациентов с фибрилляцией предсердий
Ведение больных с ФП требует от врача знания ее формы (впервые выявленная, пароксизмальная, персистирующая или постоянная), факторов, провоцирующих ее появление, мер, направленных на восстановление и поддержание синусового ритма, а также антитромботической терапии. Алгоритмы использования лекарственных средств составлены путем консенсуса экспертов из-за недостаточности данных рандомизированных клинических исследований применения антиаритмических препаратов для лечения пациентов с ФП. Они будут пересматриваться по мере получения новых данных.
Медикаментозная терапия пациентов с различными формами ФП (впервые выявленной, пароксизмальной, персистирующей и постоянной) представлена в схемах 4.2, 4.3 и 4.4.
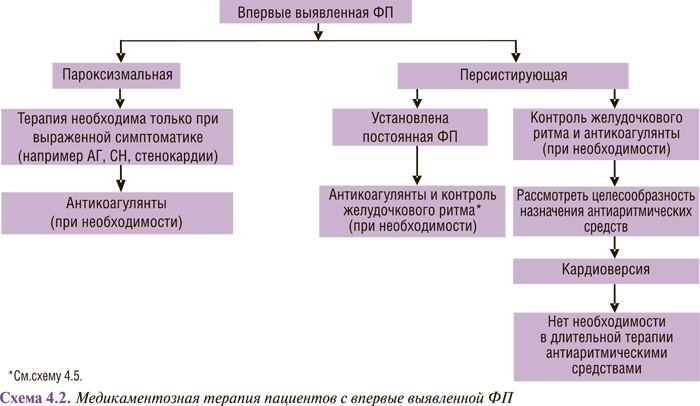
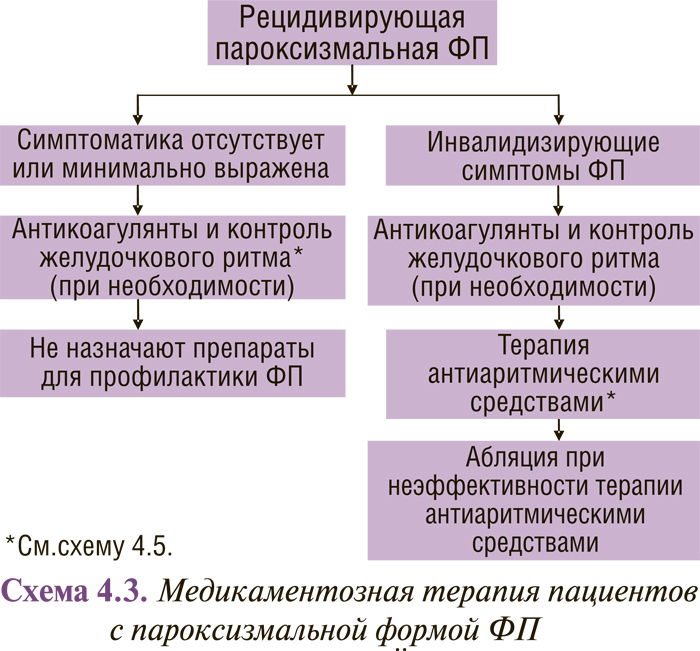
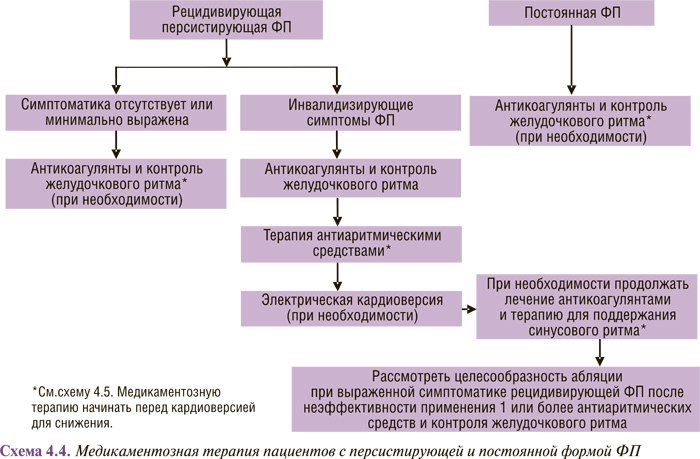
В схемах 4.3 и 4.4 суммированы современные представления о тактике лечения больных с рецидивирующей пароксизмальной и персистирующей ФП. Очевидно, что по сравнению с рекомендациями 2001 г. они дополнены катетерной абляцией: в первую очередь изоляцией легочных вен и радиочастотной модификацией операции «лабиринт».
Весьма важные изменения появились в определении тактики сохранения синусового ритма у пациентов с пароксизмальной и персистирующей ФП (схема 4.5).
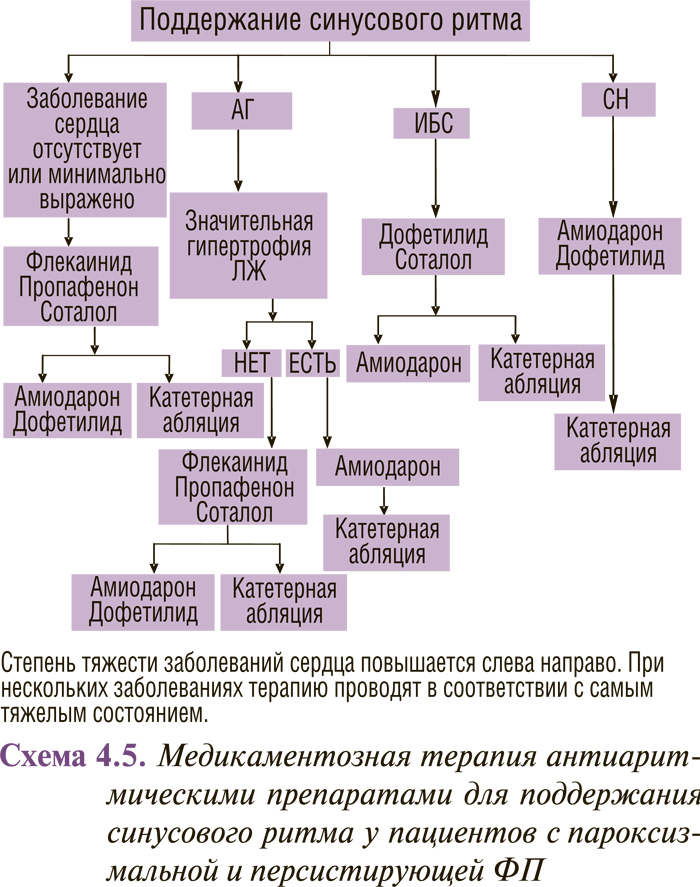
Отметим сразу, что существенных изменений в первой линии антиаритмической терапии не произошло. Для больных без структурных изменений сердца или с минимальными структурными изменениями из зарегистрированных в Украине препаратов это по-прежнему пропафенон и соталол (из незарегистрированных — флекаинид). Те же препараты являются первой линией терапии для пациентов с АГ без выраженной ГЛЖ. Однако нужно отметить, что в рекомендациях 2001 г. соталол для этих больных относили ко второй линии терапии. Как и прежде, для пациентов с АГ и существенной ГЛЖ, а также для больных с ХСН препаратом выбора является амиодарон, а для больных с ИБС — соталол. А вот со второй линией произошли радикальные изменения, обусловленные тем, что свое достойное место заняли катетерные методы лечения. Теперь для пациентов с минимальными структурными изменениями сердца или их отсутствием, пациентов с АГ и невыраженной ГЛЖ, больных с ИБС вторая линия представляет собой альтернативу между назначением амиодарона и катетерной абляцией. Для больных с ХСН, а также с АГ и существенной ГЛЖ (то есть для тех, у кого амиодарон является первой линией) вторая линия — это катетерная абляция. Таким образом, третья линия лечения для сохранения синусового ритма прекратила свое существование; вместе с ней мы расстаемся с рекомендованными ранее препаратами IА подкласса по классификации V. Williams хинидином, прокаинамидом и дизопирамидом. За рамками обсуждения мы оставили имеющиеся в рекомендациях, но не зарегистрированные в Украине препараты дофетилид и флекаинид. Следует обратить внимание на следующее обстоятельство: в рекомендациях 2001 г. в части, касающейся сохранения синусового ритма у больных с АГ, выделены группы пациентов с ГЛЖ в пределах 1,4 см и более. В новых рекомендациях выделяют соответственно менее выраженную и выраженную ГЛЖ.
Небольшие изменения касаются фармакологической кардиоверсии при ФП (табл. 4.1).
Таблица 4.1
Рекомендации по фармакологической кардиоверсии ФП
| Лекарственное средство | Способ применения | Класс рекомендации |
| При ФП длительностью не более 7 дней | ||
| Средства с доказанной эффективностью | ||
| Дофетилид | Пероральный | Высокоэффективно |
| Ибутилид | Внутривенный | Высокоэффективно |
| Пропафенон | Пероральный или внутривенный | Высокоэффективно |
| Флекаинид | Пероральный или внутривенный | Высокоэффективно |
| Амиодарон | Пероральный или внутривенный | Эффективно |
| Средства менее эффективные или не полностью изученные | ||
| Дизопирамид | Внуртивенный | Малоэффективно |
| Прокаинамид | Внуртивенный | Малоэффективно |
| Хинидин | Пероральный | Малоэффективно |
| Не рекомендуется применять | ||
| Дигоксин | Пероральный или внутривенный | Не показано |
| Соталол | Пероральный или внутривенный | Не показано |
| При ФП длительностью более 7 дней | ||
| Средства с доказанной эффективностью | ||
| Дофетилид | Пероральный | Высокоэффективно |
| Амиодарон | Пероральный или внутривенный | Эффективно |
| Ибутилид | Внутривенный | Эффективно |
| Средства менее эффективные или неполностью изученные | ||
| Дизопирамид | Внутривенный | Малоэффективно |
| Прокаинамид | Внутривенный | Малоэффективно |
| Пропафенон | Пероральный или внутривенный | Малоэффективно |
| Флекаинид | Пероральный | Малоэффективно |
| Хинидин | Пероральный | Малоэффективно |
| Не рекомендуется применять | ||
| Дигоксин | Пероральный или внутривенный | Не показано |
| Соталол | Пероральный или внутривенный | Не показано |
Стоит, пожалуй, обратить внимание на следующие различия. Так, для купирования ФП продолжительностью до 7 дней наиболее актуальным для нас остается использование пропафенона (остальными препаратами с типом рекомендаций I мы просто не располагаем), в меньшей степени — амиодарона. Хинидин, столь популярный ранее, «разжалован» в менее эффективные или менее изученные препараты, составив в этом разделе компанию прокаинамиду, а также дизопирамиду. Соталол с дигоксином включены в новый по сравнению с 2001 г. раздел: препараты, которые не рекомендуется применять.
Таким же образом изменена таблица, касающаяся восстановления синусового ритма при ФП продолжительностью более 7 дней. И здесь в новый раздел — препараты, которые не рекомендуется применять, — включены соталол и дигоксин. Препаратом с доказанной эффективностью (то есть препаратом выбора) из числа зарегистрированных в Украине является амиодарон.
А вот пропафенон и хинидин оказались теперь среди менее эффективных или менее изученных препаратов, составив в этом разделе компанию прокаинамиду, который занимал там место и ранее, а также дизопирамиду, которого в списке препаратов не было.
Рекомендуемые дозы лекарственных средств с доказанной эффективностью при фармакологической кардиоверсии у пациентов с ФП представлены в табл. 4.2.
Таблица 4.2
Рекомендуемые дозы лекарственных средств с доказанной эффективностью при фармакологической кардиоверсии у пациентов с ФП
| Лекарственное средство | Способ применения | Схема дозирования | Возможные побочные эффекты | |
| Амиодарон | Перорально | В стационаре: 1,2–1,8 г/сут, разделенные на несколько приемов, до достижения суммарной дозы 10 г; затем в поддерживающей дозе 200–400 мг/сут или однократно из расчета 30 мг/кг массы тела
Амбулаторно: 600–800 мг/сут, разделенные на несколько приемов, до достижения суммарной дозы 10 г; затем в поддерживающей дозе 200–400 мг/сут |
Артериальная гипотензия, брадикардия, удлинение интервала Q–T, torsade de pointes (редко), расстройства со стороны ЖКТ, запор, флебит (при внутривенном введении) | |
| Внутривенно или перорально | 5–7 мг/кг в течение 30–60 мин; затем по 1,2–1,8 г/сут в виде непрерывного внутривенного введения или разделенные на несколько приемов внутрь до достижения суммарной дозы 10 г; затем в поддерживающей дозе 200–400 мг/сут | |||
| Дофетилид | Перорально | Клиренс креатинина, мл/мин | Доза, мкг 2 раза в сутки | Удлинение интервала Q–T, torsade de pointes; коррекция дозы в зависимости от функции почек, массы тела и возраста |
| >60 | 500 | |||
| 40–60 | 250 | |||
| 20–40 | 125 | |||
| <20 | Противопоказан | |||
| Ибутилид | Внутривенно | 1 мг в течение 10 мин; при необходимости вводят повторно 1 мг | Удлинение интервала Q–T, torsade de pointes | |
| Пропафенон | Перорально | 600 мг | Артериальная гипотензия, трепетание предсердий с частым желудочковым ритмом | |
| Внутривенно | 1,5–2,0 мг/кг в течение 10–20 мин* | |||
| Флекаинид | Перорально | 200–300 мг* | Артериальная гипотензия, трепетание предсердий с частым желудочковым ритмом | |
| Внутривенно | 1,5–3,0 мг/кг в течение 10–20 мин* | |||
| Хинидин** | Перорально | 0,75–1,5 г, разделенные на несколько приемов, в течение 6–12 ч, обычно в сочетании с препаратом, снижающим ЧСС | Удлинение интервала Q–T, torsade de pointes, расстройства со стороны ЖКТ, артериальная гипотензия | |
*Недостаточно данных, на основании которых можно дать конкретные рекомендации по применению той или иной насыщающей дозы у пациентов с ИБС или дисфункцией ЛЖ, поэтому у таких больных данные препараты следует применять с осторожностью или не применять вообще;
**противоречивы данные о применении насыщающей дозы хинидина для достижения фармакологической кардиоверсии при ФП; в таблице приведены более безопасные альтернативные методы медикаментозной терапии; хинидин следует применять с осторожностью.
Интересно, что если для восстановления синусового ритма в 2001 г. рекомендовалось применять одномоментно внутрь 450–600 мг пропафенона, то в 2006 г. предлагается использовать только одну дозу — 600 мг.
Перед электрической кардиоверсией для каждого пациента следует рассмотреть возможность назначения медикаментозной терапии для профилактики рецидивов ФП. Медикаментозная терапия перед электрической кардиоверсией у пациентов с персистирующей ФП представлена в табл. 4.3.
Таблица 4.3
Медикаментозная терапия перед кардиоверсией у пациентов с персистирующей ФП: влияние различных антиаритмических средств на острые и подострые рецидивы ФП при трансторакальной электрической кардиоверсии постоянным током
| Усиление кардиоверсии при электрошоке с ПТ и предотвращение НРФП | Предотвращение ПРФП и поддерживающая терапия, класс средств | Класс рекомендаций | |
| Эффективны | Амиодарон
Ибутилид Пропафенон Соталол Флекаинид Хинидин |
Все лекарственные средства по рекомендации класса I (за исключением ибутилида) плюс блокаторы β-адренорецепторов | Высокоэффективно |
| Эффективность не определена/неизвестна | Блокаторы β-адренорецепторов
Верапамил Дизопирамид Дилтиазем Дофетилид Прокаинамид |
Верапамил
Дилтиазем Дофетилид |
Малоэффективно |
Все лекарственные средства (за исключением блокаторов β-адренорецепторов и амиодарона) следует начинать применять в условиях стационара.
ПТ — постоянный ток; НРФП — немедленный рецидив ФП; ПРФП — подострый рецидив ФП.
Основной целью применения антиаритмических средств в сочетании с электрической кардиоверсией является повышение вероятности успеха последней и предотвращение раннего рецидива ФП. Риск такой медикаментозной терапии включает возможность индукции желудочковой аритмии.
В табл. 4.4 представлены типичные дозы антиаритмических препаратов, применяемых для поддержания синусового ритма у пациентов с ФП.
Таблица 4.4
Типичные дозы лекарственных средств, применяемых для поддержания синусового ритма у пациентов с ФП
| Лекарственное средство | Суточная доза | Возможные побочные эффекты |
| Амиодарон* | 100–400 мг | Светочувствительность, легочная токсичность, полинейропатия, расстройства со стороны ЖКТ, брадикардия, torsade de pointes (редко), гепатотоксичность, дисфункция щитовидной железы, осложнения со стороны органа зрения |
| Дизопирамид | 400–750 мг | Torsade de pointes, СН, глаукома, задержка мочи, сухость во рту |
| Дофетилид** | 500–1000 мкг | Torsades de pointes |
| Пропафенон | 450–900 мг | Желудочковая тахикардия, СН, переход к трепетанию предсердий с быстрым проведением через AV-узел |
| Соталол** | 160–320 мг | Torsade de pointes, СН, брадикардия, обострение ХОБЛ |
| Флекаинид | 200–300 мг | Желудочковая тахикардия, СН, переход к трепетанию предсердий с быстрым проведением через AV-узел |
*Обычно применяют насыщающую дозу 600 мг/сут в течение 1 мес или 1000 мг/сут в течение 1 нед;
**необходима коррекция дозы с учетом функции почек и удлинения интервала Q–T в ответ на лечение во время начальной его фазы в условиях стационарного отделения.
Контроль частоты желудочковых сокращений
Частота желудочковых сокращений считается контролируемой, когда она варьирует в пределах 60–80 уд./мин в покое и 90–120 уд./мин при умеренной физической нагрузке.
Фармакологические препараты для контроля частоты желудочковых сокращений в ургентной ситуации и при постоянной ФП представлены в табл. 4.5.
Таблица 4.5
Внутривенное и пероральное применение лекарственных средств для контроля частоты желудочковых сокращений у пациентов с ФП
| Лекарственное средство | Класс рекомендации | Насыщающая доза | Начало действия | Поддерживающая доза | Основные побочные эффекты |
| При неотложной ситуации | |||||
| Контроль ЧСС у пациентов без дополнительного пути проведения | |||||
| Метопролол† | Высокоэффективно | 2,5–5 мг внутривенно болюсно в течение 2 мин; не более 3 доз | 5 мин | Не применимо | ↓ АД, блокада сердца, ↓ ЧСС, астма, СН |
| Пропранолол† | Высокоэффективно | 0,15 мг/кг внутривенно | 5 мин | Не применимо | ↓ АД, блокада сердца, ↓ ЧСС, астма, СН |
| Эсмолол† | Высокоэффективно | 500 мкг/кг внутривенно в течение 1 мин | 5 мин | 60–200 мкг/кг/мин внутривенно | ↓ АД, блокада сердца, ↓ ЧСС, астма, СН |
| Верапамил | Высокоэффективно | 0,075–0,15 мг/кг внутривенно в течение 2 мин | 35 мин | Не применимо | ↓ АД, блокада сердца, СН |
| Дилтиазем | Высокоэффективно | 0,25 мг/кг внутривенно в течение 2 мин | 27 мин | 5–15 мг/ч внутривенно | ↓ АД, блокада сердца, СН |
| Контроль ЧСС у пациентов c дополнительным путем проведения§ | |||||
| Амиодарон‡# | Эффективно | 150 мг в течение 10 мин | Несколько дней | 0,5–1,0 мг/мин внутривенно | ↓ АД, блокада сердца, легочная токсичность, депигментация кожи, гипотиреоз, гипертиреоз, отложения в роговице, нейропатия зрительного нерва, взаимодействие с варфарином, синусовая брадикардия |
| Контроль ЧСС у пациентов c СН и без дополнительного пути проведения | |||||
| Дигоксин | Высокоэффективно | 0,25 мг внутривенно через каждые 2 ч, не более 1,5 мг | 60 мин или более§ | 0,125–0,375 мг/сут внутривенно или внутрь | Гликозидная интоксикация, блокада сердца, ↓ ЧСС |
| Амиодарон‡ | Эффективно | 150 мг в течение 10 мин | Несколько дней | 0,5–1,0 мг/мин внутривенно | ↓ АД, блокада сердца, легочная токсичность, депигментация кожи, гипотиреоз, гипертиреоз, отложения в роговице, нейропатия зрительного нерва, взаимодействие с варфарином, синусовая брадикардия |
| При отсутствии неотложной ситуации и для длительной поддерживающей терапии¶ | |||||
| Контроль ЧСС | |||||
| Метопролол† | Высокоэффективно | В поддерживающей дозе | 4–6 ч | 25–100 мг 2 раза в сутки внутрь | ↓ АД, блокада сердца, ↓ ЧСС, астма, СН |
| Пропранолол† | Высокоэффективно | В поддерживающей дозе | 60–90 мин | 80–240 мг/сут внутрь, разделенные на несколько приемов | ↓ АД, блокада сердца, ↓ ЧСС, астма, СН |
| Верапамил | Высокоэффективно | В поддерживающей дозе | 1–2 ч | 120–360 мг/сут внутрь, разделенные на несколько приемов; есть формы ретард | ↓ АД, блокада сердца, СН |
| Дилтиазем | Высокоэффективно | В поддерживающей дозе | 2–4 ч | 120–360 мг/сут внутрь, разделенные на несколько приемов; есть формы ретард | ↓ АД, блокада сердца, СН |
| Контроль ЧСС у пациентов c СН и без дополнительного пути проведения | |||||
| Дигоксин | Высокоэффективно | 0,5 мг/сут внутрь | 2 дня | 0,125–0,375 мг/сут внутрь | Гликозидная интоксикация, блокада сердца, 1 ЧСС |
| Амиодарон‡ | Малоэффективно | 800 мг/сут в течение 1 нед внутрь 600 мг мг/сут в течение 1 нед внутрь 400 мг/сут в течение 4–6 нед внутрь |
1–3 нед | 200 мг/сут внутрь | ↓ АД, блокада сердца, легочная токсичность, депигментация кожи, гипотиреоз, гипертиреоз, отложения в роговице, нейропатия зрительного нерва, взаимодействие с варфарином, синусовая брадикардия |
†Включены только представители группы блокаторов β-адренорецепторов, по данному показанию можно применять в соответствующих дозах и другие сходные средства этой группы. Блокаторы β-адренорецепторов предшествуют алфавитному перечню лекарственных средств;
‡амиодарон может быть эффективен в контроле ЧСС у пациентов с ФП, если другие меры были неэффективны или противопоказаны;
§обычно рекомендуются переход к синусовому ритму и катетерная абляция дополнительного пути проведения; отдельным пациентам можно назначить фармакотерапию для контроля ЧСС;
#если невозможно изменить ритм кардиоверсией или абляцией и необходим контроль ЧСС, рекомендуется внутривенное введение амиодарона;
¶адекватность контроля ЧСС следует оценивать у пациента во время физической активности и в состоянии покоя.
Для регуляции желудочкового ритма при ФП может использоваться их электрическая стимуляция с частотой, приближающейся к средней частоте желудочковых сокращений при спонтанном АV-проведении. Электрическую стимуляцию желудочков используют для уменьшения степени нерегулярности желудочкового ритма. Ее можно применить у пациентов с выраженной вариабельностью желудочкового ритма, а также у больных с брадикардией в покое при лечении препаратами для контроля ускорения частоты желудочковых сокращений при физической нагрузке.
Абляция АV-узла и имплантация постоянного искусственного водителя ритма являются высокоэффективными способами лечения у некоторых пациентов с ФП. Наибольшую пользу от такого лечения получают больные, у которых выраженная симптоматика появляется на фоне ускорения частоты желудочковых сокращений, не подверженной адекватному медикаментозному контролю. Несмотря на то что преимущества абляции AV-узла несомненны, среди ограничений этого метода нужно указать постоянную необходимость антикоагулянтной терапии, потерю AV-синхронности и пожизненную зависимость от искусственного водителя ритма.
Довольно интересными представляются изменения, касающиеся антитромботической терапии. Рекомендации 2006 г. предусматривают иной принцип антитромботической терапии. В балльной шкале оценки степени риска инсульта CHADS2 (Cardiac Failure, Hypertension, Ade, Diabetes, Stroke [×2]) интегрированы элементы нескольких систем определения риска инсульта. Показатель основан на балльной системе, согласно которой 2 балла дают при наличии перенесенного инсульта или транзиторной ишемической атаки и по 1 баллу — при наличии каждого из следующих критериев риска: возраст старше 75 лет, АГ в анамнезе, сахарный диабет, недавно развившаяся СН. Все факторы риска распределены на три группы. Факторы более низкого риска или менее подтвержденные: женский пол, возраст от 65 до 74 лет, ИБС и тиреотоксикоз. Факторы умеренного риска: возраст 75 лет и более, АГ, СН, ФВ 35% и менее, сахарный диабет. Факторы высокого риска: предшествующие инсульты, транзиторная ишемическая атака или эмболия, митральный стеноз, протезы клапанов сердца.
У пациентов с неклапанной формой ФП перенесенный инсульт или транзиторная ишемическая атака являются самыми сильными независимыми предикторами инсульта. Всем пациентам с перенесенным инсультом или транзиторной ишемической атакой необходимо проведение антикоагулянтной терапии, если отсутствуют противопоказания. Пожилой возраст также является независимым предиктором инсульта, но у пациентов этого возраста повышен и риск кровотечения при применении антикоагулянтов. В связи с этим тщательная оценка состояния пациентов пожилого возраста крайне важна для эффективной профилактики инсульта.
В табл. 4.6 приведены рекомендации по применению антитромботических средств у пациентов с ФП.
Таблица 4.6
Антитромботическая терапия у пациентов с ФП на основании оценки факторов риска
| Категория риска | Рекомендуемая терапия | ||
| Отсутствуют факторы риска | АСК 81–325 мг/сут | ||
| Есть 1 фактор умеренного риска | АСК 81–325 мг/сут или варфарин (МНО 2,0–3,0; целевая величина 2,5) | ||
| Есть 1 из факторов высокого риска или несколько факторов умеренного риска | Варфарин (МНО 2,0–3,0; целевая величина 2,5) | ||
| Факторы риска | |||
| Более низкого или менее подтвержденные | Умеренного | Высокого | |
| Женский пол | Возраст ≥75 лет | Ранее перенесенный инсульт, транзиторная ишемическая атака и тромбоэмболия | |
| Возраст 65–74 года | АГ | Митральный стеноз | |
| ИБС | СН | Искусственный клапан сердца* | |
| Тиреотоксикоз | ФВ ЛЖ ≤35% | ||
| Сахарный диабет | |||
АСК — ацетилсалициловая кислота; МНО — международное нормализованное отношение.
*Если имеется механический клапан сердца, то целевая величина МНО >2,5.
Независимо от формы ФП при отсутствии факторов риска необходимо назначать ацетилсалициловую кислоту в суточной дозе 81–325 мг, при наличии одного умеренного риск-фактора — ацетилсалициловую кислоту в суточной дозе 81–325 мг или варфарин (МНО 2,0–3,0; целевое МНО 2,5), при наличии какого-либо высокого риск-фактора — варфарин (МНО 2,0–3,0; целевое МНО 2,5). При наличии механического протеза клапана целевое МНО >2,5. Целесообразно обратить внимание на более «либеральный» подход к выбору дозы ацетилсалициловой кислоты: 81–325 мг, а не 325 мг, как было ранее.
У пациентов с ФП неустановленной длительности или с ФП, продолжающейся более 48 ч, рекомендуется проведение антикоагулянтной терапии в течение 3 нед до кардиоверсии и 4 нед после нее. Несмотря на то что у пациентов с менее продолжительной ФП зарегистрированы случаи образования тромба в левом предсердии и системной тромбоэмболии, недостаточно точно установлена необходимость проведения антикоагулянтной терапии у таких больных. В случаях когда остро возникшая ФП приводит к нестабильности гемодинамики, проявляющейся в форме стенокардии, ИМ, шока или отека легких, не следует откладывать немедленное проведение кардиоверсии из-за лечения антикоагулянтными средствами. Однако перед кардиоверсией посредством противошоковой терапии постоянным током или внутривенным введением антиаритмических средств необходимо начать внутривенное введение нефракционированного гепарина или подкожное введение низкомолекулярного гепарина.
Еще одним изменением по сравнению с рекомендациями 2001 г. следует считать появление раздела «Первичная профилактика ФП». Наряду с предсердной и предсердно-желудочковой синхронизированной стимуляцией, использующимися для профилактики ФП у больных с брадикардией, появилось еще одно направление первичной профилактики. Со ссылкой на результаты ретроспективного анализа целого ряда многоцентровых исследований говорится о целесообразности использования ингибиторов АПФ и антагонистов рецепторов ангиотензина II для первичной профилактики ФП у больных со структурными изменениями сердца (АГ, СН, сахарный диабет, ИБС, ИМ в анамнезе). Менее убедительно пока выглядят доказательства целесообразности назначения с этой целью статинов, а также диетотерапии.
Таким образом, наиболее значимыми представляются следующие изменения, важные для лечения пациентов с ФП: препаратом выбора для восстановления синусового ритма при ФП продолжительностью до 7 сут является пропафенон, более 7 сут — амиодарон; для сохранения синусового ритма препаратами выбора являются амиодарон, пропафенон и соталол, а препараты 1А подкласса утрачивают свое значение.
Учитывая, что одна таблетка амиодарона содержит годовую норму йода, целесообразно, особенно при сложившейся эпидемиологической обстановке в Украине, строго контролировать назначение данного препарата, структурные изменения и функцию щитовидной железы. Следует контролировать гормоны щитовидной железы до назначения амиодарона, каждые 3 мес на фоне его приема в течение первого года использования препарата, а далее каждые 6 мес с исследованием структуры щитовидной железы от момента начала лечения.
Одним из основных методов сохранения синусового ритма становится катетерная радиочастотная абляция. Выделяют три группы риск-факторов тромбоэмболических осложнений; в соответствии с их наличием и сочетанием назначается антитромботическая терапия, выбор которой становится более осторожным. Это особенно важно в нашей стране, где приверженность терапии, а также возможность контролировать МНО желают лучшего. Наконец, у нас появляется возможность первичной профилактики ФП, в основном с помощью ингибиторов АПФ и рецепторов ангиотензина.
ПРОФИЛАКТИКА ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ У БОЛЬНЫХ С ФП
ФП — наиболее распространенное в клинической практике нарушение ритма сердца, которое по данным Фремингемского исследования составляет в общей популяции 0,4% и в значительной степени зависит от возраста. Так, ФП встречается у 0,5% населения в возрасте 40–50 лет, у 1% — 50–60 лет, 4% — 60–70 лет, 9% — 70–80 лет, у 15% — старше 80 лет. Следует также отметить, что ФП у мужчин встречается в 1,5–3,4 раза чаще, чем у женщин. За последние десятилетия распространенность этой формы аритмии значительно выросла и достигла 1–1,5% в общей популяции. Частота госпитализаций по поводу ФП составляет не менее 40% всего количества госпитализаций по поводу нарушений сердечного ритма. По данным 5-летнего исследования SPRINT, госпитальная смертность у пациентов с ФП была в 1,6 раз выше, а годовая и 5-летняя смертность при пароксизмальний форме ФП в 2,4 и 1,7 раз выше, чем у больных без нее.
Клиническое значение ФП заключается не только в ухудшении гемодинамических показателей работы сердца — прежде всего, опасность связана с возможностью развития тромбоэмболических осложнений, в первую очередь ишемических инсультов, частота которых также с возрастом повышается от 1,5% в 50–59 лет до 23,5% в год в 80–89 лет. У пациентов старше 80 лет не менее 35% ишемических инсультов обусловлены ФП. При ревматическом поражении сердца и наличии ФП годовая частота развития инсульта составляет 17%, при его отсутствии — 4–5%. Вместе с тем, при хронической форме ФП у лиц без поражения клапанов сердца риск инсульта и эмболии в 6 раз (5,6–7,1) выше, чем у больных с синусовым ритмом. Таким образом, установлена высокая частота кардиогенной эмболии сосудов мозга в общей структуре нарушений кровообращения головного мозга. По данным J.L. Halperin и соавторов, 15–20% случаев развития ишемического инсульта обусловлены наличием у больных ФП. Итак, приблизительно 1 из 6 всех ишемических инсультов приходится на часть кардиогенных тромбоэмболий у пациентов с ФП, а главным источником эмболов является ушко левого предсердия, где локализуется до 90% всех внутрипредсердных тромбов. Треть пациентов с ФП переносят инсульт, и в это число не входят больные с так называемыми немыми инфарктами мозга, которые определяются при КТ по данным разных авторов от 14,7 до 37% случаев. У пациентов с инсультом или транзиторной ишемической атакой в анамнезе частота повторного инсульта составляет 10–12% в год, даже при приеме ацетилсалициловой кислоты.
Несомненно, причиной инсульта у пациентов с ФП могут быть не только кардиогенная тромбоэмболия: до 25–30% ишемических инсультов при ФП имеют атеротромботическую природу, связанную с атеросклерозом сосудов головного мозга или атероматозом дуги аорты. Приблизительно у половины всех больных с ФП отмечают АГ, значение которой в патогенезе цереброваскулярных заболеваний чрезвычайно велико, а около 12% пациентов имеют атеросклеротическое поражение брахиоцефальных артерий. По результатам эпидемиологических исследований установлено, что АГ повышает риск кардиоэмболического инсульта при ФП, но, с другой стороны, АГ тесно связана с риском ишемического инсульта атеротромботической природы. У пациентов с инсультом АГ выявляют в 91% случаев в группе ФП и у 78% больных с синусовым ритмом. Кроме того, упомянутая выше зависимость частоты инсульта при ФП от возраста обусловлена его связью со многими факторами. У людей пожилого возраста увеличиваются размеры левого предсердия, снижается сократимость и скорость кровотока в его ушке, чаще наблюдается феномен спонтанного эхоконтрастирования. Также известно, что возраст — фактор риска атеросклероза, в том числе и развития атером дуги аорты, которые могут быть причиной инсульта независимо от ФП. Относительно высокая частота синусового ритма во время возникновения инсульта у пациентов, установленная в наибольшем исследовании AFFIRM, позволила некоторым авторам сделать предположение о некардиогенном источнике церебральных инфарктов у этой группы больных, хотя, безусловно, невозможно полностью исключить высказанное другими авторами предположение об асимптоматичных эпизодах ФП.
Результаты исследований по сравнению двух подходов к лечению пациентов с ФП — контроль ритма сердца и контроль ЧСС, — проведенных в разных странах и континентах (AFFIRM, PIAF, RACE, STAF), продемонстрировали, что частота ишемических инсультов по статистическим данным не отличалась в обеих группах больных. Подобные результаты получены в исследованиях SPAF I–III: ежегодная частота ишемических инсультов у больных с рецидивирующей и постоянной формой ФП почти одинакова (3,2 и 3,3% соответственно).
Частота инсульта у больных с ФП связана с наличием сопутствующих сердечно-сосудистых заболеваний. Она ниже при изолированной ФП, под которой понимают отсутствие любых других клинических признаков первичного поражения сердца, и составляет всего 0,5% в год, а по данным исследования в округе Олмстед (штат Миннесота) — 1,3%. Заболевания сердца являются одним из ведущих факторов риска возникновения инсульта, играющих важную роль в течении и исходе острого нарушения мозгового кровообращения. По мнению некоторых ученых, сам факт ФП не имеет прогностического значения для оценки риска развития осложнений, так как не является основным фактором, а только удостоверяет наличие сопутствующей патологии, которая ведет к резкому повышению противокоагулянтной активности крови и возникновению инсульта. Поэтому для предотвращения тромбоэмболических осоложнений необходимо учитывать все факторы риска у каждого больного с ФП и исходя из этого принимать решение о проведении антитромботической терапии.
Стратификация риска тромбоэмболических осложнений
Ежегодный риск инсульта у пациентов с ФП 3–8%, что связано с факторами риска. К наиболее распространенным факторам риска при неклапанной ФП относят возраст старше 65 лет, сахарный диабет, АГ (САД >160 мм рт. ст.), ИБС, ХСН с ФВ ЛЖ меньше 40%, перенесенные ранее инсульт или транзиторные ишемические атаки, наличие тромба в левом предсердии или ушке левого предсердия при ТэхоКГ или ЧПэхоКГ. Другие авторы к факторам риска также относят женский пол, злоупотребление алкоголем, заместительную гормонотерапию и увеличение левого предсердия до 4,5 см и более.
Относительный риск ишемического инсульта, связанного с отдельными клиническими состояниями, по данным объединенного анализа участников 5 рандомизованных исследований, имеющих неклапанную ФП и не получавших антитромботическую терапию, такой: перенесенный инсульт или транзиторная ишемическая атака (относительный риск 2,5), сахарный диабет (1,7), преклонный возраст (1,4), АГ в анамнезе (1,6), застойная СН (1,4).
Ранее упоминалось, что при ревматическом поражении сердца и ФП процент развития инсультов чрезвычайно высок и составляет 17% в год. Причем при митральном стенозе эмболию отмечают в 1,5 раза чаще, чем при недостаточности митрального клапана. Возможно это связано с тем, что недостаточность способствует возникновению турбулентного регургитационного потока крови, что уменьшает стаз крови в левом предсердии.
Определение риска инсульта у отдельных пациентов с ФП является основным фактором, влияющим на решение о начале проведения индивидуальной антикоагулянтной терапии. Согласно рекомендациям АСС/АНА/ESC 2006 г. пациентов с ФП стратифицировали на группы низкого, среднего и высокого риска развития тромбоэмболических осложенений (см. табл. 4.6).
Пороговый риск инсульта, при котором следует назначать антикоагулянтную терапию, остается неопределенным. Больные с низким риском, принимающие ацетилсалициловую кислоту, мало выиграют от перехода на альтернативный режим антикоагулянтной терапии, но у них увеличивается количество геморрагических осложнений. Для предупреждения одного инсульта в год необходимо проведение антикоагулянтной терапии более чем у 100 пациентов. Количество больных с ФП групп высокого риска, которым необходимо проведение антикоагулянтной терапии для предупреждения одного инсульта в год, при приеме ацетилсалициловой кислоты составляет <25%, что подтверждает эффективность использования антикоагулянтов в откорректированной дозе. Остается нерешенным вопрос относительно профилактического назначения антикоагулянтов больным со средним риском инсульта.
Каков же риск инсульта у больных с трепетанием предсердий? В недалеком прошлом трепетание предсердий считалось «доброкачественной» аритмией в плане развития тромбоэмболических осложнений, однако по данным недавно проведенных исследований отмечено, что трепетание предсердий обусловливает такой же риск тромбоэмболических осложнений, как и ФП. В нерандомизированных исследованиях риск тромбоэмболических осложнений был в пределах 1,7–7%. В ретроспективном исследовании с участием 100 больных с трепетанием предсердий, которые не получали антикоагулянты, тромбоэмболические осложнения возникли в 6 случаях. В работе D. Wood сообщается о 1–6% риске тромбоэмболических осложнений у больных с хроническим трепетанием предсердий, что, по его мнению, приблизительно в 3 раза меньше, чем у больных с ФП. Эпидемиологические и нерандомизованные исследования, проведенные в течение последних 10 лет в группах больных с трепетанием предсердий, позволяют сделать вывод, что трепетание предсердий связано с умеренным риском тромбоэмболических осложнений, превышающим таковой в сравнительной популяции пациентов с синусовым ритмом и более низким, чем у больных с ФП.
Среди пациентов высокого риска с ФП предикторами тромбоэмболических осложнений являются следующие эхокардиографические особенности: нарушение систолической функции ЛЖ при эхоКГ; спонтанное эхоконтрастирование или снижение скорости кровотока в ушке левого предсердия, сложные атероматозные бляшки в грудной аорте, выявленные с помощью ЧПэхоКГ. Другие признаки, такие как диаметр ЛЖ и фиброкальцифицирующие эндокардиальные изменения, вариабельно ассоциируются с тромбоэмболиями и могут взаимодействовать с другими факторами. Указывает ли отсутствие этих изменений на группу пациентов низкого риска, которые могут избежать приема антикоагулянтов, не установлено, и это не нашло пока отображения в схемах риск-стратификации.
АНТИТРОМБОТИЧЕСКАЯ ТЕРАПИЯ ДЛЯ ПРОФИЛАКТИКИ ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ
С целью тестирования разных типов и комбинаций антитромботической терапии для профилактики инсульта при ФП проведены 24 рандомизованных исследования с участием 20 012 пациентов с неклапанной ФП, изменивших тактику антитромботической терапии у миллионов пациентов с ФП.
Эффективность антикоагулянтной терапии per os при первичной профилактике тромбоэмболических осложнений оценивалась в пяти проспективных плацебо-контролируемых исследованиях (AFASAK, SPAF, BAATAF, CAFA, SPINAF). В целом по данным метаанализа длительное использование непрямых антикоагулянтов у больных с ФП неревматического генеза позволяет снизить риск инсульта и периферических тромбоэмболических осложнений по сравнению с использованием плацебо с 4,52 до 1,4%, или на 69% (р<0,001). Это равноценно предупреждению 31-го случая этих осложнений на каждые 1000 больных, лечившихся на протяжении года. При исключении пациентов, не получающих антикоагулянты к моменту развития инсульта, профилактическая эффективность этих средствper os превысила 80%. Прием варфарина позволил снизить общую смертность на 26%. Продолжительность наблюдения в этих исследованиях составляла 1–2 года, наибольший срок — 2,2 года, тогда как в клинической практике необходимость антикоагулянтной терапии у больных с ФП обычно значительно дольше.
Антикоагулянтная терапия еще более эффективна в плане вторичной профилактики инсульта у больных с ФП, перенесших транзиторную ишемическую атаку или малый инсульт. Как показали результаты многоцентрового исследования EAFT с участием 1007 таких больных, прием варфарина способствовал снижению частоты инсульта до 4% в год по сравнению с 12% в группе больных, получавших плацебо, то есть на 66% (p<0,001). Это равнозначно предупреждению приблизительно 90 таких сосудистых катастроф при лечении 1000 больных на протяжении одного года.
Хотя в настоящее время после проведения контролируемых исследований эффективность профилактической терапии непрямыми антикоагулянтами при ФП не вызывает сомнений, ее обратной стороной являются повышения риска возникновения тяжелых кровотечений — внутричерепных и/или таких, при которых возникает необходимость в переливании крови. По данным исследования CAFA, их частота составила 2,5% в год (при приеме плацебо — 0,5%).
Риск кровотечений возрастает с увеличением степени гипокоагуляции и продолжительности антикоагулянтной терапии, что особенно выражено у больных пожилого и старческого возраста. Целевой уровень определяется достижением равновесия между профилактикой ишемического инсульта и недопущением геморрагических осложнений. Максимальная защита от ишемического инсульта при ФП достигается при значении МНО 2,0–3,0. Для первичной профилактики у большинства больных с ФП в возрасте до 75 лет и для вторичной профилактики необходимо стремиться к МНО 2,5 (в пределах 2,0–3,0). Целевое МНО 2,0 (1,6–2,5) рекомендовано для первичной профилактики у пациентов в возрасте старше 75 лет с высоким риском возникновения кровотечений, которым не противопоказана антикоагулянтная терапия, и больным со средней степенью риска тромбоэмболии, которым гипокоагуляция с МНО 2,0–3,0 опасна. В клинических исследованиях чаще встречались МНО ниже целевых значений. В связи с осложнениями антикоагулянтной терапии возникли вопросы о возможности замены непрямых антикоагулянтов ацетилсалициловой кислотой, а также об использовании антикоагулянтов в низких дозах.
Сравнение эффективности антитромбоцитарных препаратов (в качестве изучаемого препарата в 90% случаев применяли ацетилсалициловую кислоту) с плацебо-контролем проводили в 6 исследованиях (AFASAK, SPAF-I, EAFT, ESPS, LASAF, UK-TIA). Метаанализ всех исследований показал, что прием ацетилсалициловой кислоты достоверно снижает риск развития инсульта на 22%. При этом отмечено, что ацетилсалициловая кислота в большей степени предупреждает развитие инсультов, которые не приводят к инвалидизации (как в исследовании SPAF-I ). Для этой группы инсультов снижение риска составило 62%, в то время как для инсультов, сопровождающихся инвалидизацией, снижение риска составило 17% и было недостоверным. Таким образом, чем больше риск развития инсульта, приводящего к инвалидизации, тем менее эффективна для его профилактики ацетилсалициловая кислота. Частота развития внутричерепных кровотечений на фоне использования ацетилсалициловой кислоты и плацебо составляла 0,2%, а прием ацетилсалициловой кислоты оказывал несущественное влияние на общую смертность (снижение риска — 16%).
Для определения места ацетилсалициловой кислоты в профилактике тромбоэмболических осложнений при ФП решающее значение имеют данные прямых сравнительных исследований эффективности ацетилсалициловой кислоты и непрямых антикоагулянтов (AFASAK, SPAF-II, EAFT, AFASAK-II, PATAF). Как свидетельствуют результаты исследования SPAF-II с участием 715 больных, среди пациентов в возрасте до 75 лет частота ишемического инсульта при лечении ацетилсалициловой кислотой (325 мг/сут) и варфарином в полной дозе была практически одинаковой — 1,9 и 1,3% в год соответственно. Но у больных более старшего возраста отмечали усиление тенденции (p<0,05) к более выраженному снижению частоты ишемического инсульта на фоне терапии варфарином по сравнению с применением ацетилсалициловой кислоты (3,6 и 4,8% соответственно). Вместе с тем за счет увеличения количества случаев геморрагических инсультов общая частота инсультов со стойкими остаточными явлениями у больных этой возрастной группы при лечении обоими препаратами оказалась одинаковой — 4,3 и 4,6% соответственно. Нужно отметить и значительное повышение риска тяжелых кровотечений в целом, частота которых при приеме непрямых антикоагулянтов составила 4,2% по сравнению с 1,6% при приеме ацетилсалициловой кислоты (р=0,004). Этого не отмечали у больных в возрасте до 75 лет.
Возможность использования комбинации варфарина и ацетилсалициловой кислоты для профилактики инсульта проведена в исследованиях AFASAK II, SPAF III, MIWAF и РATAГ. При комбинированной терапии варфарин использовался в низких фиксированных дозах, а в качестве монотерапии варфарин применяли в индивидуально подобранных дозах. В исследовании SPAF III, в которое были включены больные с высоким риском, доказана неэффективность низких доз варфарина (2 мг), комбинированной терапии низкими дозами (2 мг) и ультранизкими дозами (1 мг) варфарина с ацетилсалициловой кислотой (300 мг) и показана целесообразность и эффективность подобранных доз варфарина (МНО 2,0–3,0). При низких дозах частота инсульта повысилась до 7,9% по сравнению с 1,9% в год при применении полных доз этого препарата. Таким образом, при проведении антикоагулянтной терапии для предупреждения тромбоэмболических осложнений у больных с ФП следует использовать общепринятые дозы этих препаратов, которые обеспечивают терапевтический уровень гипокоагуляции.
Исходя из представленных результатов контролируемых исследований при профилактике тромбоэмболических осложнений у больных с ФП неревматической этиологии целесообразно придерживаться следующей тактики (см. табл. 4.6).
Интересным и перспективным в плане профилактики тромбоэмболических осложнений у больных с ФП является использование синтетических прямых ингибиторов активного центра тромбина. В двух самых больших исследованиях SPORTIF III и V изучался первый представитель этой группы ксимелагатран, результаты применения которого в фиксированной дозе 36 мг 2 раза в сутки сравнивали с применением варфарина (МНО 2,0–3,0). В исследовании участвовали более 7000 больных с ФП неклапанного генеза и хотя бы одним фактором риска инсульта. Ксимелагатран, применяемый без контроля коагуляции и подбора дозы, оказался настолько же эффективным для профилактики инсульта и системной эмболии, как и терапия подобранными, постоянно контролируемыми дозами варфарина, и значительно снижал частоту общих кровотечений (32% при применении ксимелагатрана и 39% — варфарина). Но у 6,1% больных, получающих прямой ингибитор тромбина, в первые 6 мес лечения повышался уровень АлАТ в 3 раза выше нормы. В связи с жизненно опасными побочными эффектами ксимелагатрана, несмотря на определенные его преимущества перед варфарином, этот препарат был снят с регистрации. В исследовании PETRO использовали другой препарат этой группы — дабигатран у больных с ФП в дозе 50–300 мг. Сделан вывод, что дабигатран в дозе 150 мг подобен по эффективности и безопасности варфарину, но в комбинации с ацетилсалициловой кислотой повышает риск кровотечений. Для дальнейшего изучения препарата дабигатран был выбран для включения в ІІІ фазу начатой программы RE-LY. Планируется провести сравнение эффективности дабигатрана с варфарином у 15 000 больных, лечение которых будет проводиться на протяжении 3 лет.
В последнее время большое внимание уделяют новым антикоагулянтам — синтетическим селективным ингибиторам фактора свертывания крови Ха. По химической природе данные вещества — искусственно синтезированные олигосахариды. В отличие от низкомолекулярных гепаринов, влияющих и на факторы Ха и ІІа, эта группа препаратов изолированно блокирует фактор Ха. Такой механизм действия позволяет более эффективно блокировать тромбин, поскольку блокада одной молекулы Ха-фактора блокирует 50 молекул фактора ІІа. Кроме того, после инактивации одной молекулы фактора Ха молекула ингибитора фактора Ха освобождается в кровоток и последовательно связывается с новыми молекулами фактора Ха.
Фондапаринукс натрия является первым препаратом из новой группы антикоагулянтов. Описанный выше механизм действия обеспечивает возможность вводить 1 раз в сутки фиксированную, единую для всех больных небольшую дозу препарата (2,5 мг) и достигать прогнозируемого действия на систему коагуляции. Такое лечение не нуждается в контроле показателей коагуляции. Эффективность фондапаринукса натрия для предупреждения тромбоэмболических осложнений исследована в четырех больших рандомизованных исследованиях (EPHESUS, PENTATHLON 2000, PENTAMAKS, PENTIFRA) у больных после обширных ортопедических операций, а также в двух исследованиях PENTUA и OASIS-5, включающих больных с острым коронарным синдромом.
В 2006 г. в Барселоне на конгрессе Европейского кардиологического общества канадский ученый Alexander G.G. Turpie обратил внимание на внедрение новых парентеральных и пероральных ингибиторов Ха-фактора, действие которых не зависит от приема пищевых продуктов и лекарственных средств и не нуждается в проведении постоянного лабораторного контроля. В исследовании AMADEUS (IІІ фаза исследования PERSIST) изучали применение представителя этой группы идрапаринукса — пентасахарида продолжительного действия, который вводится подкожно в дозе 2,5 мг 1 раз в неделю, — по сравнению с варфарином для профилактики тромбоэмболических осложнений у больных с ФП. В связи с развитием тяжелых кровотечений при использовании идрапаринукса исследование было досрочно завершено. В двух японских исследованиях проводится изучение перорального прямого ингибитора фактора Ха — ривароксабана у пациентов с ФП. В одном исследовании сравнивают действие разных доз препарата: 5, 10, 20 мг на протяжении 30 дней приема, а в другом — действие ривароксабана в дозе 5, 10, 15 и 20 мг с варфарином (МНО 1,6–2,6). Эти исследования позволят выявить этнические различия влияния на безопасность, фармакокинетику и фармакодинамику ривароксабана у пациентов с ФП, а также выбрать оптимальную дозу препарата для проведения III фазы японского исследования.
Кроме медикаментозной профилактики тромбоэмболических осложнений у больных с ФП используют и хирургические методы. Одной из новых хирургических методик, пока недостаточно исследованной для широкого применения в клинике, является облитерация ушка левого предсердия для ликвидации основного источника тромбообразования у больных с ФП с большой вероятностью развития осложнений антикоагулянтной терапии. Кроме прямого хирургического удаления или отсечения части ушка, разрабатывается несколько методик с внутрисосудистой катетеризацией или трансперикардиальным доступом. Показания для вышеупомянутых методик, остающихся экспериментальными, пока не определены.
ПРОФИЛАКТИКА ТРОМБОЭМБОЛИИ ПРИ ВОССТАНОВЛЕНИИ СИНУСОВОГО РИТМА
Рекомендации АСС/AHA/ESC 2006 г. по проведению антикоагулянтной терапии у больных с ФП при восстановлении ритма представлены в виде схемы (схема 4.6).
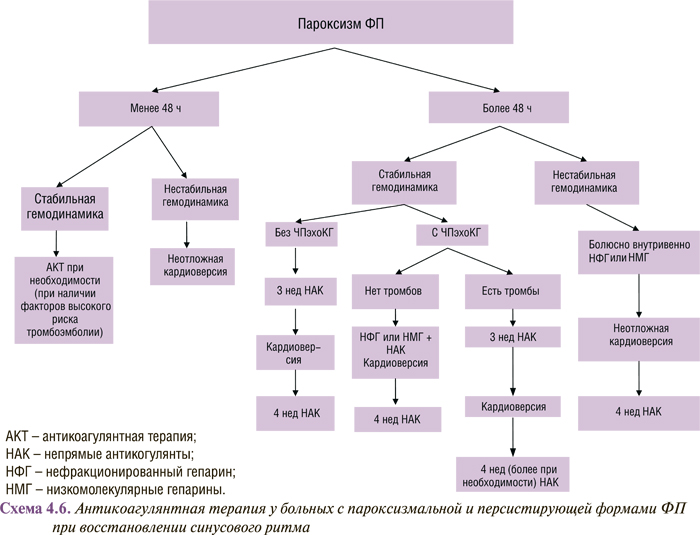
Кратковременный пароксизм ФП до 48 ч не связан с повышением риска тромбоэмболии. Согласно опубликованным данным, если продолжительность ФП менее 2 сут, риск возникновения тромбоэмболических осложнений находится в пределах 0,8–1,1%, а при использовании гепаринина — 0,8%. Польза от антикоагулянтов при этом не установлена, поэтому и профилактическую антикоагулянтную терапию можно не проводить. Но некоторые авторы рекомендуют использовать антикоагулянты (нефракционированные гепарины с поддержанием АЧТВ в пределах терапевтического диапазона или низкомолекулярные гепарины) до, во время и после кардиоверсии (перикардиоверсионный период). В частности, M.J. Weigner и соавторы (1997) рекомендуют проводить антикоагулянтную терапию, назначая парентерально гепарин всем пациентам с ФП, даже если ее продолжительность была менее 48 ч. По их мнению, терапия гепарином после кардиоверсии должна длиться не менее 24 ч. Авторы считают, что такая стратегия имеет преимущества перед отсрочкой гепаринотерапии в ожидании, пока продолжительность ФП превысит 48 ч, и отмечают, что преимущества этого подхода, по имеющимся в настоящее время данным, неубедительны и нуждаются в дальнейшем исследовании.
Но уже через 48 ч существования аритмии повышается вероятность формирования внутрипредсердных тромбов и тромбоэмболических осложнений. Возрастает она в ранние сроки после успешной кардиоверсии (так называемые нормализационные тромбоэмболии). Учитывая это, больным с персистирующей ФП (более 2 сут или длительность неизвестна), которым запланирована медикаментозная или электрическая кардиоверсия, показана профилактическая терапия непрямыми антикоагулянтами (варфарином) на протяжении 3–4 нед до и после кардиоверсии под контролем МНО в пределах 2,0–3,0. Имеются ограниченные данные, свидетельствующие об эффективности низкомолекулярных гепаринов при подготовке пациентов к кардиоверсии.
Проведены сравнительные исследования эффективности и безопасности низкомолекулярных гепаринов и стандартного гепарина и доказано преимущество первых в ортопедической, хирургической, онкологической практике. Проведены также 4 больших рандомизованных исследования у больных с острым коронарным синдромом, в которых сравнивали эффективность одного из низкомолекулярных гепаринов и стандартного гепарина: FRIC (дальтепарин), FRAXIS (надропарин), ТIМI IIB и ESSENCE (эноксапарин). Несмотря на то что все низкомолекулярные гепарины имеют преимущества, только эноксапарин оказался достоверно более эффективным по сравнению с низкомолекулярными гепаринами при лечении больных с острым коронарным синдромом. Но четко не определена оптимальная продолжительность лечения низкомолекулярным гепарином. По данным метаанализа во всех исследованиях, где эффективность низкомолекулярных гепаринов сравнивали с таковой плацебо после активной терапии на протяжении 3–5 сут, дополнительный эффект при увеличении продолжительности антикоагулянтной терапии не отмечен. Следовательно, продолжительность терапии окончательно не установлена, но она не должна быть меньше 3 сут. Несмотря на значительные различия стоимости эноксапарина и гепарина, общие затраты на лечение при назначении эноксапарина ниже. Эти результаты отмечены как в странах Западной Европы, так и СНГ.
Низкомолекулярные гепарины имеют ряд безоговорочных преимуществ перед нефракционированным гепарином: высокая биодоступность (до 90% после глубокой подкожной инъекции) с минимальным связыванием с белками плазмы крови, предвиденный антикоагулянтный эффект, который не нуждается в контроле АЧТВ, преобладающая активность относительно фактора Ха, более продолжительная антитромботическая активность (период полувыведения более 4,5 ч после внутривенного введения по сравнению с 50–60 мин для обычного гепарина) с частотой назначения 1–2 раза в сутки. Эти параметры являются реальной основой для предвиденной постоянно высокоэффективной терапии.
Другими недавно доказанными преимуществами низкомолекулярных гепаринов являются меньшее влияние на IV фактор тромбоцитов и соответственно низкая частота возникновения аутоиммунной тромбоцитопении, угнетение раннего роста фактора фон Виллебранда, что обусловливает уменьшение дальнейшего образования активного тромбина в кровотоке.
С участием больных с ФП проведены небольшие исследования, указывающие на возможность использования у них низкомолекулярных гепаринов для профилактики тромбоэмболических осложнений. В исследовании D. Stellbrink и соавторов предложен интересный подход к подкожному использованию низкомолекулярных гепаринов в амбулаторной практике. В работе A. Royer использовался дальтепарин натрия 1 раз в сутки для профилактики тромбоэмболических осложнений у больных с ФП и противопоказаниями к назначению варфарина. На фоне лечения низкомолекулярными гепаринами тромбоэмболических осложнений не отмечали. В исследовании Harenberg (1993) установлено снижение частоты развития тромбоэмболических осложнений у пациентов с ФП при применении надропарина. Поэтому при противопоказаниях к проведению пероральной антикоагулянтной терапии применение надропарина можно рассматривать как альтернативный терапевтический метод. Многоцентровое исследование АСС показало, что назначение эноксапарина натрия за 3 нед до и 4 нед после кардиоверсии оказалось более эффективным, чем лечение нефракционированными гепаринами с последующим переходом на непрямые антикоагулянты. В исследовании POSTEC доказана эффективность кратковременной антикоагулянтной терапии эноксапарином натрия под контролем ЧПэхоКГ, что вероятно является наиболее приемлемым методом профилактики тромбоэмболических осложнений у больных с ФП, учитывая наиболее высокую анти-Ха-активность эноксапарина по сравнению с другими низкомолекулярными гепаринами. Но достаточной информации о применении низкомолекулярных гепаринов у больных с ФП нет, поэтому необходимо проведение дальнейших исследований.
Риск системной тромбоэмболии при восстановлении ритма составляет 1–5%, а при проведении 4-недельной антикоагулянтной терапии до и после кардиоверсии риск тромбоэмболических осложнений снижается и составляет около 1%.
Использование ЧПэхоКГ в клинической практике разрешает оценить гемодинамические показатели ушка левого предсердия и визуализировать тромб в нем, но не дает оснований не использовать антикоагулянтную терапию при отсутствии тромба, так как он может сформироваться спустя некоторое время после успешного восстановления синусового ритма. При переходе ФП в синусовый ритм спонтанно или с помощью электрической и фармакологической кардиоверсии, чреспищеводной электрокардиостимуляции или радиочастотной катетерной абляции при трепетании предсердий отмечают преходящую механическую дисфункцию левого предсердия и ушка левого предсердия, которая получила название stunning, или оглушение, и характеризуется значительным снижением сократительной способности левого предсердия и скорости опорожнения систолы ушка левого предсердия. При этом часто отмечают появление спонтанного эхоконтрастирования разной степени проявления и даже тромбов в левом предсердии и ушке левого предсердия. На восстановление механической функции левого предсердия нужно несколько недель. По мнению Manning и соавторов (1995), Grimm и соавторов (1995), продолжительность этого периода связана с длительностью существования ФП до кардиоверсии. Обратимость феномена оглушения и его взаимосвязь с продолжительностью аритмии позволяют предположить, что главным механизмом данного феномена является кардиопатия, индуцированная высокой ЧСС. Максимальное угнетение сократительной способности предсердий отмечают непосредственно после кардиоверсии. В большинстве случаев даже у больных с продолжительностью аритмии более 1 мес полное восстановление сократительной способности предсердий наблюдают на протяжении 2–3 сут после кардиоверсии. Это коррелирует с клиническими наблюдениями, которые свидетельствуют о максимальном количестве тромбоэмболических осложнений именно в этот период. По данным Berger и Schweitzer, базирующимся на результатах объединенного анализа 32 исследований, около 9% всех тромбоэмболических осложнений отмечают в первые 10 дней после кардиоверсии, а более 80% из них — на протяжении первых 3 дней. Считают, что тромб может сформироваться в период оглушения предсердия и может выталкиваться из него при восстановлении механической функции левого предсердия, что и является причиной нормализационных тромбоэмболических осложнений. Возможность возникновения поздних тромбоэмболических осложнений обусловливает необходимость удлинения периода антикоагулянтной терапии после кардиоверсии, что определяется двумя причинами: частотой возникновения повторных пароксизмов ФП и риском развития тромбоэмболических осложнений у конкретного больного в зависимости от возраста и наличия вышеупомянутых факторов риска тромбоэмболических осложнений.
Наличие тромба в ушке левого предсердия повышает риск тромбоэмболических осложнений при кардиоверсии, поэтому таким больным необходимо проводить адекватную антикоагулянтную терапию на протяжении 3–4 нед до и после кардиоверсии. Отсутствие тромба в ушке левого предсердия с помощью ЧПэхоКГ может приблизить сроки проведения кардиоверсии, но не исключает полностью антикоагулянтную терапию после ее проведения. При метаанализе 7 исследований по проведению кардиоверсии под контролем ЧПэхоКГ у пациентов, не получающих антикоагулянты, опубликованном Могеуга и соавторами, тромбоэмболические осложнения возникали в 4 раза чаще, чем при традиционном применении антикоагулянтов на протяжении 3 нед (1,34 и 0,33% соответственно). В таких случаях гипокоагуляция перед процедурой кардиоверсии может быть достигнута введением гепарина (с увеличением АЧТВ в 1,5–2 раза от начального) с одновременным назначением непрямых антикоагулянтов и последующим их приемом в течение 1 мес после восстановления ритма. Альтернативой назначения гепарина могут быть низкомолекулярные гепарины.
В многоцентровом исследовании АСиТЕ с участием 1222 больных с персистирующей ФП (продолжительностью более 2 сут) или трепетанием предсердий и ФП в анамнезе пациенты были рандомизованы по ЧПэхоКГ и обычной методикой. Больные одной группы получали антикоагулянтную терапию гепарином перед проведением кардиоверсии и варфарином на протяжении 4 нед после нее. При выявлении тромба назначали варфарин в течение 3 нед, а затем повторяли ЧПэхоКГ. Больные другой группы получали антикоагулянты на протяжении 3 нед до и 4 нед после кардиоверсии. Обе тактики были связаны со сравнительно низким риском инсульта (0,81% под контролем ЧПэхоКГ и 0,5% — при стандартном подходе) на протяжении 8 нед наблюдения, и риск развития значительных кровотечений был приблизительно одинаковым. Разницы в количественном соотношении пациентов с восстановлением синусового ритма не отмечали, но выявлены клинические преимущества проведения ЧПэхоКГ по уменьшению подготовительного периода к кардиоверсии. При этом уменьшение продолжительности ФП способствует предупреждению электрического и морфологического ремоделирования предсердий, чем снижает вероятность возобновления ФП после кардиоверсии и возникновение тромбоэмболических осложнений.
Проведено исследование POSTEC с оценкой функции ушка левого предсердия до кардиоверсии и через 7 дней после восстановления ритма методом ЧПэхоКГ. В него были включены 206 пациентов, которых распределили на две группы. Больные первой группы получали эноксапарин натрий кратковременно до и в течение 7 дней после кардиоверсии, а после проведения посткардиоверсионной ЧПэхоКГ и исключения признаков тромбообразования антикоагулянтная терапия у них на 8-й день после кардиоверсии была заменена назначением ацетилсалициловой кислоты. Больные второй группы кратковременно принимали нефракционированные гепарины и непрямые антикоагулянты, а после проведения докардиоверсионной ЧПэхоКГ и кардиоверсии продолжили прием непрямых антикоагулянтов на протяжении 4 нед. В каждой группе зафиксировано одно тромбоэмболическое осложнение и одно незначительное геморрагическое осложнение, а также одно большое кровотечение у больного первой группы, который получал варфарин в связи с тромбозом ушка левого предсердия. Итак, в исследовании POSTEC уменьшены сроки антикоагулянтной терапии как до, так и после кардиоверсии благодаря проведенной дважды ЧПэхоКГ и использованию прямых антикоагулянтов.
Есть небольшие исследования ранней отмены антикоагулянтной терапии после электрической кардиоверсии под контролем ЧПэхоКГ. Так, С.Г. Канорский и соавторы исследовали восстановление механической функции левого предсердия после успешной кардиоверсии, определяя максимальную скорость предсердного наполнения ЛЖ. При повышении этого показателя до 50 см/с и более механическую функцию левого предсердия считали восстановленной, а антикоагулянтную терапию отменяли. Исследования проводили в течение 1 мес. Результаты демонстрируют положительное влияние короткой продолжительности ФП, нормального размера левого предсердия и отсутствия основной сердечно-сосудистой патологии на темп восстановления функции левого предсердия. Наличие этих факторов ассоциируется с достаточно быстрой (в пределах 3–7 дней) нормализацией функции левого предсердия, что можно подтвердить с помощью допплер-эхоКГ трансмитрального кровотока и позволяет отменять антикоагулянтную терапию в более ранние сроки без развития тромбоэмболических осложнений. Хотя эти результаты нуждаются в подтверждении в специально организованных исследованиях.
При необходимости экстренного проведения кардиоверсии при ФП, сопровождающейся нестабильностью гемодинамики, возможно применение прямых антикоагулянтов — нефракционированного гепарина или низкомолекулярного гепарина. Сначала осуществляется болюсная внутривенная инфузия, затем — медленная инфузия до увеличения АЧТВ в 1,5–2 раза выше изначального показателя с дальнейшим назначением непрямых антикоагулянтов на 4 нед, как при плановой кардиоверсии.
Приведенные данные показывают, что наиболее исследованным и рекомендованным ACC/ AHA/ESC методом антикоагулянтной терапии является использование непрямых антикоагулянтов (варфарина). При этом частые осложнения такой терапии, связанные с трудностями контроля ее эффективности в связи с несовершенством лабораторной системы нашей страны и индивидуальной чувствительностью к препарату, не дают возможности использовать ее в полном объеме. Поэтому на сегодня проводятся поиски путей усовершенствования проведения профилактики тромбоэмболических осложнений у больных с ФП, что обусловлено ограничением существующих методик. Современные рекомендации АСС/AHA/ESC, при всей их многогранности и объемности, оставляют открытыми некоторые вопросы, требующие нашего внимания. В настоящее время четко определены рекомендации относительно сроков антикоагулянтной терапии для тех случаев ФП, когда продолжительность пароксизма не определена или выявлены тромбы в ушке левого предсердия и левом предсердии при проведении ЧПэхоКГ. Для больных, у которых известно начало пароксизма и ФП непродолжительная, а также не выявлены тромбы в ушке левого предсердия и левом предсердии, общепринятых схем лечения как в отношении антитромботического препарата, так и по срокам его назначения нет. Возникает вопрос, как вести себя с больными, у которых ФП длится от 2 сут до 1 мес? Должны ли они получать антикоагулянтную терапию на протяжении 3–4 нед до и после кардиоверсии или, возможно, им достаточно короткого курса использования низкомолекулярных гепаринов? Какая доза этих препаратов и продолжительность их применения для профилактики тромбоэмболических осложнений необходима? Поэтому есть все основания надеяться, что ответы на эти вопросы спустя некоторое время будут получены в больших контролируемых исследованиях, также будет разработана тактика использования низкомолекулярных гепаринов в практической деятельности, учитывая их прогнозируемое антитромботическое действие и отсутствие потребности в тщательном лабораторном контроле.
РЕКОМЕНДАЦИИ
Контроль ЧСС при ФП с помощью лекарственных средств
Высокоэффективно
- Измерение ЧСС в покое и контроль ЧСС с помощью лекарственных средств рекомендуются всем пациентам с персистирующей и постоянной формой ФП.
- При отсутствии предвозбуждения желудочков рекомендуется внутривенное введение блокаторов β-адренорецепторов (эсмолол, метопролол или пропранолол) или дилтиазема (верапамила) для снижения частоты желудочковых сокращений при остро возникшей ФП; при этом следует соблюдать осторожность у пациентов с артериальной гипотензией или СН.
- Внутривенное введение дигоксина или амиодарона рекомендуется для контроля ЧСС у пациентов с ФП и СН, у которых отсутствует дополнительный путь проведения.
- У пациентов с развитием при физической нагрузке симптомов, обусловленных ФП, следует оценить адекватность ЧСС во время физической нагрузки, при необходимости провести коррекцию медикаментозной терапии для поддержания ЧСС в пределах целевых значений.
- Дигоксин эффективен при пероральном приеме у пациентов с ФП для контроля ЧСС в покое; он показан пациентам с СН или дисфункцией ЛЖ, а также пациентам, ведущим малоподвижный образ жизни.
Эффективно
- Комбинация дигоксина с блокатором β-адренорецепторов или с дилтиаземом (верапамилом) целесообразна для контроля ЧСС как в покое, так и при физической нагрузке у пациентов с ФП.
- Целесообразно применять абляцию AV-узла или дополнительный путь проведения для контроля ЧСС в случаях, когда медикаментозная терапия недостаточно эффективна или сопровождается развитием побочных эффектов.
- Внутривенное введение амиодарона может быть полезным для контроля ЧСС у пациентов с ФП в случаях, когда другие меры неэффективны или противопоказаны.
- Если отсутствует необходимость в кардиоверсии у пациентов с ФП и дополнительным путем проведения, обоснованной альтернативой может быть внутривенное введение прокаинамида или ибутилида.
Малоэффективно
- Если частоту желудочковых сокращений при ФП не удается адекватно контролировать с помощью блокатора β-адренорецепторов, дилтиазема, верапамила или дигоксина (в виде монотерапии или комбинации этих средств), для снижения ЧСС можно назначить амиодарон внутрь.
- У пациентов со стабильной гемодинамикой, у которых в ФП участвует дополнительный путь проведения, можно рассмотреть возможность внутривенного введения прокаинамида, дизопирамида, ибутилида или амиодарона.
- Если частоту желудочковых сокращений при ФП не удается контролировать с помощью лекарственных средств или есть подозрение на кардиомиопатию, вызванную тахикардией, следует рассмотреть целесообразность катетерной абляции AV-узла.
Профилактика тромбоэмболий
Высокоэффективно
- Антитромботическая терапия для профилактики тромбоэмболий рекомендуется всем пациентам с ФП, за исключением лиц с изолированной ФП или при наличии противопоказаний.
- Выбор антитромботического средства для конкретного пациента должен базироваться на сопоставлении абсолютного риска инсульта и кровотечения, а также относительного риска и пользы.
- Пациентам с высоким риском инсульта рекомендуется при отсутствии противопоказаний проведение длительной антикоагулянтной терапии антагонистом витамина К (целевая величина МНО: 2,0–3,0). К числу факторов, ассоциированных с высоким риском инсульта у пациентов с ФП, относятся ранее перенесенный инсульт, транзиторная ишемическая атака или системная тромбоэмболия, а также ревматический стеноз митрального клапана или наличие механического искусственного клапана сердца.
- Антикоагулянтная терапия антагонистом витамина К рекомендуется пациентам с несколькими факторами умеренного риска тромбоэмболических осложнений (возраст старше 75 лет, АГ, сахарный диабет, СН, нарушение систолической функции ЛЖ (ФВ <35% или фракция укорочения <25%).
- На начальном этапе терапии МНО следует определять не реже 1 раза в нед, а после стабилизации его целевой величины — 1 раз в мес.
- Применение ацетилсалициловой кислоты в дозе 81–325 мг/сут рекомендуется пациентам с низким риском тромбоэмболических осложнений или лицам, которым противопоказан пероральный прием антикоагулянтов.
- У пациентов с ФП и механическими клапанами сердца определение целевого уровня для антикоагулятной терапии должно базироваться на типе искусственного клапана; при этом поддерживают величину МНО не менее 2,5.
- Пациентам с трепетанием предсердий рекомендуется такая же антитромботическая терапия, как и лицам с ФП.
Эффективно
- В целях первичной профилактики тромбоэмболии у пациентов с ФП неклапанной этиологии, у которых установлен хотя бы один из факторов риска (возраст старше 75 лет, особенно для женщин, АГ, сахарный диабет, СН или дисфукция ЛЖ), целесообразно проведение антитромботической терапии ацетилсалициловой кислотой или антагонистом витамина К с учетом оценки риска кровотечения, возможности безопасного проведения длительной антикоагулянтной терапии и предпочтений пациента при выборе лечения.
- У пациентов с неклапанной ФП, у которых имеется 1 или несколько менее подтвержденных факторов риска (возраст 65–74 года, женский пол или ИБС), целесообразно лечение ацетилсалициловой кислотой или антагонистом витамина К.
- Выбор антитромботической терапии на основе вышеописанных критериев обоснован независимо от формы ФП (пароксизмальной, персистирующей или постоянной).
- Пациентам с ФП, не имеющим механического клапана сердца, целесообразно прервать антикоагулянтную терапию (не более чем на 1 нед) для проведения процедур с повышенным риском кровотечения.
- Целесообразно регулярно проводить повторную оценку необходимости в антикоагулянтной терапии.
Малоэффективно
- У пациентов в возрасте 75 лет и старше с повышенным риском кровотечения, но при отсутствии противопоказаний к проведению антикоагулянтной терапии, а также у пациентов, которые не могут перенести без осложнений стандартную антикоагулянтную терапию (с целевым МНО 2,0–3,0), можно рассмотреть вопрос о более низкой целевой величине МНО (1,6–2,5) для первичной профилактики инсульта и системной тромбоэмболии.
- В случаях когда пациентам группы высокого риска необходимо прервать антикоагулянтную терапию пероральными средствами на время более чем 1 нед, можно вводить парентерально нефракционированный или низкомолекулярный гепарин, хотя эффективность такого лечения недостаточно хорошо установлена.
- После реваскуляризации миокарда пациентам с ФП можно назначить одновременно с непрямыми антикоагулятами ацетилсалициловую кислоту в низких дозах (менее 100 мг/сут) и/или клопидогрел (75 мг/сут), но такая тактика ассоциируется с повышенным риском кровотечений.
- Пациентам, которым проводят реваскуляризацию миокарда, можно прервать проведение антикоагулянтной терапии для предотвращения развития кровотечений, однако после вмешательства ее следует возобновить как можно быстрее и провести коррекцию дозы препаратов для достижения терапевтических значений МНО. Во время такого перерыва в лечении можно назначить ацетилсалициловую кислоту. Пациентам, которым проводят чрескожное коронарное вмешательство, в качестве поддерживающей терапии следует назначить клопидогрел в дозе 75 мг/сут и варфарин (МНО 2,0–3,0). Клопидогрел следует применять после введения непокрытого металлического стента в течение минимум 1 мес, после имплантации стента, элютирующего сиролимус, — 3 мес, после стента, элютирующего паклитаксел, — 6 мес, у отдельных пациентов, принимающих только варфарин, — 12 мес и дольше.
- У пациентов с ФП, перенесших ишемический инсульт или системную тромбоэмболию во время терапии антикоагулянтами (МНО 2,0–3,0), может быть обоснованным проведение более интенсивной антикоагулянтной терапии до целевого значения МНО 3,0–3,5.
Кардиоверсия при ФП
Фармакологическая кардиоверсия
Высокоэффективно
- В целях фармакологической кардиоверсии при ФП рекомендуется применение флекаинида, дофетилида, пропафенона или ибутилида.
Эффективно
- Обосновано применение амиодарона для фармакологической кардиоверсии при ФП.
- У отдельных пациентов можно прибегать к однократному приему внутрь пропафенона или флекаинида («таблетка в кармане») для купирования приступа ФП в амбулаторных условиях, если в клинике установлено, что такое лечение безопасно. Перед началом терапии антиаритмическими препаратами пациенту следует назначить блокатор β-адренорецепторов или дилтиазем (верапамил) для предотвращения возможного быстрого проведения импульсов по AV-узлу.
- В амбулаторных условиях оправдано назначение амиодарона у пациентов с пароксизмальной или персистирующей формой ФП в случаях, когда необходимо быстро восстановить синусовый ритм.
Малоэффективно
- Можно рассмотреть возможность применения хинидина или прокаинамида для кардиоверсии при ФП, но эффект их применения в таких случаях недостаточно хорошо установлен.
Электрическая кардиоверсия постоянным током
Высокоэффективно
- В случае отсутствия быстрой реакции желудочков на проведение медикаментозной терапии при ФП пациентам с ишемией миокарда, симптомами АГ, стенокардией или СН рекомендуется немедленная кардиоверсия постоянным током.
- Немедленное проведение кардиоверсии постоянным током рекомендуется для пациентов с предвозбуждением желудочков в случаях, когда ФП сопровождается высокой частотой желудочковых сокращений или нестабильной гемодинамикой.
- Кардиоверсия рекомендуется в случаях, когда пациент плохо переносит симптомы ФП. В случае рецидива ФП можно провести повторную кардиоверсию постоянным током после применения антиаритмических препаратов.
Эффективно
- Кардиоверсия постоянным током может быть эффективна в восстановлении синусового ритма в качестве составной части долгосрочной тактики ведения пациентов с ФП.
- При выборе редко повторяемых кардиоверсий для лечения симптоматической или рецидивирующей ФП целесообразно учитывать пожелания пациента в отношении лечения.
Медикаментозное усиление кардиоверсии постоянным током
Эффективно
- Предварительная терапия амиодароном, флекаинидом, ибутилидом, пропафеноном или соталолом может быть полезной для усиления кардиоверсии постояным током и предотвращения рецидивов ФП.
- У пациентов с рецидивом ФП после успешной кардиоверсии может быть целесообразным повторное проведение этой процедуры после применения антиаритмических препаратов.
Малоэффективно
- У пациентов с персистирующей формой ФП можно рассмотреть возможность применения блокаторов β-адренорецепторов, дизопирамида, дилтиазема, дофетилида, прокаинамида или верапамила, хотя эффективность указанных средств в повышении вероятности успешной кардиоверсии постоянным током или в предотвращении ранних рецидивов ФП точно не установлена.
- У пациентов, не имеющих заболевания сердца, можно рассмотреть целесообразность начала лечения антиаритмическими препаратами в амбулаторных условиях для повышения вероятности успешной кардиоверсии при ФП.
- Можно рассмотреть возможность амбулаторного применения антиаритмических препаратов для повышения вероятности успешной кардиоверсии при ФП у пациентов с определенными заболеваниями сердца, если у пациента уже установлена безопасность применения данного антиаритмического средства.
Профилактика тромбоэмболии у пациентов с ФП при проведении кардиоверсии
Высокоэффективно
- У пациентов с ФП длительностью 48 ч и более, или если ее длительность неизвестна, рекомендуется проведение антикоагулянтной терапии с целевыми значениями МНО 2,0–3,0 в течение минимум 3 нед перед кардиоверсией и в течение 4 нед после нее независимо от метода, используемого для восстановления синусового ритма.
- Пациентам с ФП длительностью более 48 ч, которым необходимо немедленное проведение кардиоверсии в связи с нестабильной гемодинамикой, следует ввести внутривенно болюсно гепарин с последующей непрерывной внутривенной инфузией гепарина до увеличения АЧТВ в 1,5–2,0 раза по сравнению с контрольным значением. После этого необходимо проводить терапию пероральными антикоагулянтами (МНО 2,0–3,0) в течение минимум 4 нед, так же как при плановой кардиоверсии. Недостаточно данных об эффективности подкожного введения в этих целях низкомолекулярного гепарина.
- Пациентам с ФП длительностью менее 48 ч, сопровождаемой нестабильной гемодинамикой, кардиоверсию следует проводить немедленно без предварительной антикоагулянтной терапии.
Эффективно
- В течение 48 ч после начала ФП вопрос о необходимости проведения антикоагулянтной терапии перед кардиоверсией или после нее может решаться на основании оценки риска развития тромбоэмболии у пациента.
- В качестве альтернативы применения антикоагулянтов перед кардиоверсией при ФП целесообразно провести ЧПэхоКГ для выявления тромба:
2a) пациентам, у которых тромб не выявлен, целесообразно немедленно провести кардиоверсию после введения антикоагулянта.
После этого рекомендуется продолжить лечение пероральным антикоагулянтом (МНО 2,0–3,0) в течение минимум 4 нед, как при плановой кардиоверсии.
Недостаточно данных, свидетельствующих об эффективности применения в данном случае низкомолекулярного гепарина.
2б) пациентам, у которых выявлен тромб, целесообразно провести антикоагулянтную терапию (МНО 2,0–3,0) в течение минимум 3 нед перед восстановлением синусового ритма и в течение 4 нед после него; более длительная терапия антикоагулянтами может быть обоснованной после успешной кардиоверсии, поскольку в таких случаях сохраняется повышенный риск тромбоэмболии.
- При кардиоверсии у пациентов с трепетанием предсердий может оказать благоприятный эффект проведение антикоагулянтной терапии в соответствии с рекомендациями для пациентов с ФП.
Поддержание синусового ритма
Высокоэффективно
- Перед началом терапии антиаритмическими препаратами рекомендуется лечение, направленное на устранение обратимых причин ФП, вызывающих развитие повторных приступов.
Эффективно
- У пациентов с ФП может применяться медикаментозная терапия для поддержания синусового ритма и предотвращения кардиомиопатии, вызываемой тахикардией.
- Обоснованно рассматривать редкие, хорошо переносимые пациентом рецидивы ФП в качестве успешного результата терапии антиаритмическими препаратами.
- Целесообразно проводить медикаментозную терапию амбулаторно у пациентов с ФП, не имеющих сопутствующих заболеваний сердца и хорошо переносящих прием антиаритмических препаратов.
- При идиопатической ФП без структурных изменений сердца можно назначить прием пропафенона или флекаинида амбулаторным пациентам, у которых на момент начала терапии отмечается синусовый ритм.
- Благоприятный эффект может оказать применение соталола у амбулаторных пациентов с наличием синусового ритма, отсутствием или минимальной выраженностью заболевания сердца и пароксизмальной ФП в случае, если исходная длительность интервала Q–T менее 460 мс, отмечен нормальный уровень электролитов и отсутствуют факторы риска, ассоциированные с проаритмией.
- Катетерная абляция является обоснованной альтернативой медикаментозному лечению для предотвращения рецидивирующей ФП у пациентов с аритмией, сопровождающейся выраженной симптоматикой, при отсутствии увеличения или незначительном увеличении левого предсердия.
Послеоперационная ФП
Высокоэффективно
- При отсутствии противопоказаний рекомендуется применение блокаторов β-адренорецепторов для предотвращения развития послеоперационной ФП у пациентов, которым проведено оперативное вмешательство на сердце.
- Рекомендуется применение средств, замедляющих проведение по AV-узлу, для контроля ЧСС у пациентов с развившейся послеоперационной ФП.
Эффективно
- Применение амиодарона в предоперационный период у пациентов, которым запланировано оперативное вмешательство на сердце, снижает частоту случаев ФП и является адекватной профилактической терапией у пациентов с высоким риском развития послеоперационной ФП.
- Пациентам, у которых развилась послеоперационная ФП, целесообразно проводить фармакологическую кардиоверсию ибутилидом или кардиоверсию постоянным током для восстановления синусового ритма.
- Рекомендуется применение антиаритмических препаратов для поддержания синусового ритма у пациентов с рецидивирующей или рефрактерной послеоперационной ФП.
- Рекомендуется применение антитромботических средств у пациентов с развившейся послеоперационной ФП.
Малоэффективно
- У пациентов с повышенным риском развития ФП после оперативного вмешательства на сердце можно рассмотреть возможность применения соталола в профилактических целях.
Острый ИМ
Высокоэффективно
- Кардиоверсия постоянным током рекомендуется пациентам с тяжелыми нарушениями гемодинамики, стойкой ишемией или в случае невозможности достижения адекватного контроля ЧСС с помощью медикаментозной терапии у пациентов с острым ИМ и ФП.
- Рекомендуется внутривенное введение амиодарона для снижения частоты желудочковых сокращений в ответ на ФП и улучшения функции ЛЖ у пациентов с острым ИМ.
- Рекомендуется внутривенное введение блокаторов β-адренорецепторов и недигидропиридиновых блокаторов кальциевых каналов для снижения частоты желудочковых сокращений в ответ на ФП у пациентов с острым ИМ, у которых отсутствует дисфункция ЛЖ, бронхоспазм или AV-блокада.
- Пациентам с ФП и острым ИМ рекомендуется при отсутствии противопоказаний введение нефракционированного гепарина (до достижения АЧТВ в 1,5–2,0 раза больше по сравнению с контрольным значением).
Эффективно
- Целесообразно внутривенное введение препаратов наперстянки для снижения частоты желудочковых сокращений и улучшения функции ЛЖ у пациентов с острым ИМ и ФП, ассоциированной с выраженной дисфункцией ЛЖ и СН.
Ведение пациентов с ФП, ассоциированной с WPW-синдромом
Высокоэффективно
- Катетерная абляция дополнительных путей проведения рекомендуется пациентам с наличием симптомов ФП с WPW-синдромом, особенно пациентам с синкопальными состояниями, обусловленными высокой ЧСС и коротким рефрактерным периодом дополнительных путей проведения.
- Немедленное проведение кардиоверсии постоянным током рекомендуется для предотвращения фибрилляции желудочков у пациентов с коротким рефрактерным периодом антероградного пути, у которых отмечают ФП с высокой частотой желудочковых сокращений, сопровождаемую нестабильной гемодинамикой.
- Рекомендуется внутривенное введение прокаинамида или ибутилида для восстановления синусового ритма у пациентов с WPW-синдромом, у которых ФП сопровождается стабильной гемодинамикой при наличии широких комплексов QRS ≥120 мс) на ЭКГ или высокой частоты желудочковых сокращений вследствие их предвозбуждения.
Эффективно
- Целесообразно внутривенное введение флекаинида или проведение кардиоверсии постоянным током в случаях, когда у пациентов с ФП с участием дополнительных путей проведения отмечается высокая частота желудочковых сокращений.
Малоэффективно
- Целесообразно внутривенное введение прокаинамида, дизопирамида, ибутилида или амиодарона при стабильной гемодинамике у пациентов с ФП с вовлечением дополнительных путей проведения.
Гипертиреоз
Высокоэффективно
- Рекомендуется применение блокаторов β-адренорецепторов при отсутствии противопоказаний для контроля ЧСС у пациентов с ФП, осложненной тиреотоксикозом.
- Если нельзя назначить блокатор β-адренорецепторов, рекомендуется применение недигидропиридинового блокатора кальциевых каналов для контроля частоты желудочковых сокращений у пациентов с ФП и тиреотоксикозом.
- Пациентам с ФП и тиреотоксикозом рекомендуется пероральное применение антикоагулянтов (МНО 2,0–3,0).
- После достижения эутиреоидного состояния проводят такую же профилактику антитромботическими средствами, как и у пациентов с ФП без гипертиреоза.
Ведение пациенток с ФП в период беременности
Высокоэффективно
- Рекомендуется применение дигоксина, блокатора β-адренорецепторов или недигидропиридиновых блокаторов кальциевых каналов для контроля частоты желудочковых сокращений у беременных с ФП.
- Рекомендуется кардиоверсия постоянным током беременным, у которых ФП сопровождается нестабильной гемодинамикой.
- Профилактику тромбоэмболии рекомендуется проводить в течение всего периода беременности пациенткам с ФП, за исключением лиц с низким риском развития тромбозов. При выборе антикоагулянтов или ацетилсалициловой кислоты должен учитываться период беременности.
Малоэффективно
- Во время I триместра и последнего месяца беременности у пациенток с ФП и факторами риска развития тромбоэмболии следует рассмотреть возможность введения нефракционированного гепарина посредством непрерывной внутривенной инфузии (до достижения АЧТВ, в 1,5–2 раза превышающего контрольные значения) или подкожных инъекций по 10 000–20 000 ЕД через каждые 12 ч с коррекцией дозы через 6 ч после инъекции для увеличения АЧТВ в 1,5 раза по сравнению с контрольным значением.
- Во время I триместра и последнего месяца беременности можно рассмотреть возможность подкожного введения низкомолекулярного гепарина пациенткам с ФП и факторами риска развития тромбоэмболии, хотя недостаточно данных об эффективности такого метода.
- Во время II триместра беременности следует рассмотреть возможность перорального применения антикоагулянтов у беременных с ФП и высоким риском развития тромбоэмболий.
- Можно рассмотреть возможность применения хинидина или прокаинамида для фармакологической кардиоверсии у пациенток со стабильной гемодинамикой, у которых ФП развилась во время беременности.
Ведение пациентов с ФП и ГКМП
Высокоэффективно
- Рекомендуется пероральное применение антикоагулянтов (МНО 2,0–3,0) у пациентов с ГКМП, у которых развилась ФП.
Эффективно
- Можно применять антиаритмические препараты для предотвращения рецидива ФП у пациентов с ГКМП. Предпочтительно применять дизопирамид в комбинации с блокатором β-адренорецепторов или недигидропиридиновый блокатор кальциевых каналов, или проводить монотерапию амиодароном.
Ведение пациентов с ФП и заболеванием легких
Высокоэффективно
1. В первую очередь рекомендуется провести коррекцию гипоксемии и ацидоза пациентам, у которых ФП развилась во время острого легочного заболевания, его обострения или при хроническом заболевании легких.
2. Рекомендуется применение дилтиазема или верапамила для контроля частоты желудочковых сокращений у пациентов с бронхообструктивным заболеванием легких, у которых развилась ФП.
3. Следует провести кардиоверсию постоянным током у пациентов с заболеванием легких с нестабильной гемодинамикой в результате ФП.
ЛИТЕРАТУРА
- Де Фритас Г.Р., Богусславский Д. (2001) Первичная профилактика инсульта. Инсульт, 1: 7-31.
- Дзяк Г.В., Клигуненко О.М., Снигар В.И. и соавт. (2004) Фракционированные и нефракционированные гепарины в интенсивной терапии. Здоровье, 192 с.
- Дзяк Г.В., Лапшей С.Л. (1997) Мерцательная аритмия: современное состояние проблемы. Междунар. мед. журнал, 3: 6-9.
- Канорский С.Г., Медведева И.В., Мельник М.Г. и соавт. (2004) Стратегия лечения фибрилляции предсердий. Леч. врач, 3: 60-65.
- Комарова В.П. (2000) Фармакоэкономические исследования низкомолекулярного гепарина эноксапарина в клинической практике. Клин. фармакология и терапия, 1: 79-81.
- Кушаковский М.С. (1999) Фибрилляция предсердий. Фолиант, Спб.,176 c.
- Панченко Э.П. (2003) Профилактика кардиоэмболического инсульта у больных мерцательной аритмией. Кардиоваскуляр. терапия и профилактика, Т. 2, 3: 64-69.
- ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation — executive summary (2006) Eur. Heart J., 27: 1979-2030.
- A comparison of rate control and rhythm control in patients with atrial fibrillation. The Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) Investigators (2002) New Engl. J. Med., 347 ( 23): 1825-1833.
- Albers G.W., Dalen J.E., Laupacis A. et al. (2001) Antithrombotic therapy in atrial fibrillation. In: Sixth ACCP Consensus Conference on Antithrombotic Therapy, Chest., 119 (1 Suppl): 194-206.
- Berger M., Schweitzer P. (1998) Timing of thromboembolic events after electrical cardioversion of atrial fibrillation or flutter: a retrospective analysis.Amer. J. Cardiology, 82: 1545-1547.
- Blackshear J.L., Johnson W.D., Odell J.A. et al. (2003) Thoracoscopic extracardiac obliteration of left atrial appendage for stroke risk reduction in atrial fibrillation. J. Am. Coll. Cardiol., 42: 1249-1252.
- Carlsson J. (2001) Mortality and stroke rates in a trial of Rhythm Control versus Rate Control in atrial fibrillation: results from the STAF Pilot Phase (Strategies of Treatment of Atrial Fibrillation). J. Amer. Coll. Cardiol., 38 (3): 603-604.
- Chung S., Blackshear J., Shen W.K. et al. (2001) Epidemiology and atrial fibrillation: clinical implications. JACC, 37: 371-378.
- Deplanque D., Corea F., Arquizan C. et al. (1999) Stroke and atrial fibrillation: is stroke revention treatment appropriate beforehand? Heart, 92: 563-569.
- Design of a clinical trial for the assessment of cardioversion using transesophageal echocardiography (the ACUTE Multicenter Study) (1998) Am. J. Cardiol., 81: 877-883.
- Dunn M. (1998) Thromboembolism with atrial flutte. Am. J. Cardiol., 82: 638.
- Ezekowitz M.D., Verheugt F.W. (2000) Should patients with paroxysmal atrial fibrillation be treated with chronic antiplatelet drugs? Abstracts of the XXIInd Congress of ESC: 26.
- Falk R.H. (2002) Management of Atrial fibrillation — radical reform or modest modification? N. Engl. J. Med., 347(23): 1883-1884.
- Fukazawa H., Yamamoto K., Ikeda U. et al. (1998) Effect of mitral regurgitation on coagulation activity in atrial fibrillation. Am. J. Cardiol., 81: 93-96.
- Go A.S., Hylek E.M., Phillips K.A. et al. (2001) Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study, 285: 2370-2375.
- Halperin J.L., Gomberg-Maitland M. (2003) Obliteration of the left atrial appendage for prevention of thromboembolism. J. Am. Coll. Cardiol., 42: 1259-1261.
- Hart R.G., Benavente O., McBride R. et al. (1999) Antithrombotic therapy to prevent stroke in patients with atrial fibrillation: a meta-analysis. Ann. Intern. Med., 131: 492-501.
- Hart R., Halperin J.L. (2001) Atrial fibrillation and Stroke. Concepts and controversies, 32: 803-808.
- Hart R.G., Palacio S., Pearce L.A. (2002) Atrial fibrillation, Stroke, and acute Antithrombotic Therapy. Analysis of randomized clinical trials. Stroke, 33: 2722-2727.
- Hart R.G., Pearce L.A., Miller V.T. et al. (2000) Cardioembolic vs. Noncardioembolic strokes in atrial fibrillation: frequency and effect of antithrombotic agents in the Stroke Prevention in Atrial Fibrillation studies, Cardiovascular Dis., 10: 39-43.
- Hart R.G., Pearce L.A., Rothbart R.M. et al. (2000) Stroke with intermittent atrial fibrillation: incidence and predictors during aspirin therapy. Stroke Prevention in Atrial Fibrillation Investigators. J. Amer. Coll. Cardiol., 35 (1): 183-187.
- Hirsh J., Anand S.S., Halperin J.L. et al. (2001) Guide to Anticoagulant Therapy: Heparin. A Statement for Healthcare professionals From the American Heart Association. Arterioscler. Thromb. Vasc. Biol., 21: 9-33.
- Hirsh J., Fuster V., Ansell J. et al. (2003) American Heart Association/American College of Cardiology Foundation Guide to Warfarin Therapy. Circulation: 1692-1711.
- Klein A.L., Grimm R.A., Murray R.D. et al. (2001) Assessment of Cardioversion Using Transesophageal Echocardiography Investigators. Use of transesophageal echocardiography to guide cardioversion in patients with atrial fibrillation. N. Engl. J. Med., 344(19): 1411-1420.
- Mark D., Cowper P., Bercowitz S. et al. (1998) Economic assessment of low-molecular-weight heparin (enoxaparin) versus unfractionated heparin in acute coronary syndrome patients: results from the ESSENSE randomized trial, Circulation, 97: 1702-1707.
- Nacarelli G.V., Dell’Orfano J.T., Wolbrette D.L. et al. (2000) Cost-effective management of acute atrial fibrillation: role of rate control, spontaneous conversion, medical and direct current cardioversion, transesophageal echocardiography, and antiembolic therapy. Amer. J. Cardiology, 85: 36-45.
- Ostermayer S.H., Reisman M., Kramer P.H. et al. (2005) Percutaneous left atrial appendage transcatheter occlusion (PLAATO system) to prevent stroke in high-risk patients with non-rheumatic atrial fibrillation: results from the international multi-center feasibility trials. J. Am. Coll. Cardiol., 46: 9-14.
- Page R.L. (2000) Atrial Fibrillation takes the spotlight in the Arrhythmia Sessions at this year’s AHA. Annual Scientific Sessions of the American Heart Association, November, New Orleans, USA.
- Reiter M., Bucek R.A., Koca N. et al. (2003) PERSIST. Idraparinux and liver enzymes: observations from the PERSIST trial. Blood Coagul. Fibrinol., 14(1): 61-65.
- Royer A., Eskilsson J., Olsson B. (2000) Transesophageal echocardiography-guided cardioversion atrial fibrillation and flutter. Eur. Heart J., 21: 837-847.
- Sievert H., Lech M., Treples T. et al. (2002) Percutaneous left atrial appendage transcatheter occlucion to prevent stroke high risk patients with atrial fibrillation.Circulation, 105: 1887-1889.
- Stellbrink D., Hanrath P. (2000) Optimal management cardio version atrial fibrillation and flutter: still a stunning problem. Eur. Heart J., 21: 793-798.
- Stellbrink D., Nixdorff U., Hofmann T. et al. (2004) ACE (Anticoagulation in Cardioversion using Enoxaparin) Study Group. Safety and efficacy of enoxaparin compared with unfractionated heparin and oral anticoagulants for prevention of thromboembolic complications in cardioversion of nonvalvular atrial fibrillation: the Anticoagulation in Cardioversion using Enoxaparin (ACE) trial. Circulation, 109: 997-1003.
- Stroke Prevention in Atrial Fibrillation Investigators: Transesophageal echocardiographic correlates of thromboembolism in high-risk patients with nonvalvular atrial fibrillation: The Stroke Prevention in Atrial Fibrillation Investigators Committee on Echocardiography (1998) Ann. Intern. Med., 128: 639-647.
- Thibault B., Talajic M., Dubuc M. et al. (2000) Thromboembolic events occur in patients with atrial fibrillation despite maintenance of sinus rhythm or use of anticoagulations. Circulation, 102: 627.
- Turpie A.G., Gallus A.S., Hoek J.A. for the Pentasaccharide Investigators (2001) A synthetic pentasaccharide for the prevention of deep-vein thrombosis after total hip replacement. N Engl J Med, 344: 619-25.
- Van Gelder I.C., Hagens V.E., Bosker H.A. (2002) A comparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation. New Engl. J. Med., 347 ( 23): 1834-1840.