Миокардит
Содержание
Миокардит — это воспалительное заболевание мышцы сердца, обусловленное непосредственным или опосредованным через иммунные механизмы воздействием инфекции, паразитарной или протозойной инвазии, химических и физических факторов, а также возникающее при аллергических, аутоиммунных заболеваниях и трансплантации сердца.
Эпидемиология
Распространенность миокардита по данным разных авторов составляет от 4 до 11% всех заболеваний сердечно-сосудистой системы и 20% некоронарогенных заболеваний сердца. В многоцентровых исследованиях установлено, что распространенность миокардита широко варьирует. В исследовании Myocarditis Treatment Trial (MTT) признаки воспаления при биопсии определили только у 10% из 2233 скринированных пациентов. В эпидемиологическом исследовании ESETCID (European Study of Epidemiology and Treatment of Cardiac Inflammatory Diseases) выявляли положительные результаты биопсии у 17,2% из первых 3055 больных. Доказательства миокардита выявляют по результатам 1–9% рутинных аутопсий и до 20% случаев необъяснимой внезапной смерти в молодом возрасте. Истинную распространенность легких форм миокардита трудно установить, поскольку большинство случаев разрешается без длительной клинической картины.
Классификация
В Украине принята классификация миокардитов, принятая на VI Конгрессе кардиологов Украины (2000), которая включает следующие рубрики:
I. Острый
а) с установленной этиологией (инфекционный — I40, бактериальный — I41.0, вирусный — I41.1, паразитарный — I41.2, при других болезнях — I41.8)
б) неуточненный I40.9
II. Хронический, неуточненный I51.4
III. Миокардиофиброз I51.4
IV. Распространенность:
а) изолированный (очаговый) — I40.1
б) другой (диффузный) — I40.8
V. Течение: легкое, средней тяжести, тяжелое
VI. Клинические варианты: аритмия, нарушения реполяризации, кардиалгия и т.д.
VII. СН (0–III стадия, I–IV ФК).
Этиология
В настоящее время считается общепризнанным, что воспалительные поражения миокарда могут возникать при любых инфекционных заболеваниях. Этиологическими факторами могут быть вирусы, бактерии, грибы, простейшие, гельминты, риккетсии и спирохеты.
Ведущая роль в развитии миокардита принадлежит вирусам (50%), среди которых наиболее важное значение имеют энтеровирусы, в частности вирусы Коксаки группы В, а также аденовирусы, вирусы гриппа A и B, гепатита C, парвовирус В19. Недавно в кардиомиоцитах обнаружены специфические так называемые Коксаки аденовирусные рецепторы (CAR), которые служат мишенью для вирусов Коксаки группы В и 2 и 5-серотипов из семейства аденовирусов.
Из возбудителей невирусных инфекционных заболеваний в последние годы важное значение приобрела дифтерийная палочка, повышается частота миокардита грибковой этиологии. Миокардит также может возникать при бруцеллезе, лептоспирозе, сальмонеллезе, трипаносомозе, скарлатине, сыпном тифе.
Из неинфекционных этиологических факторов миокардита известны различные иммунопатогенные агенты: некоторые лекарственные средства (антибиотики (доксорубицин), сульфаниламиды, НПВП (метамизол натрий), трициклические антидепрессанты, добутамин и др.), лечебные сыворотки и вакцины, токсические химические вещества, а также голодание, интоксикация при ожоговой болезни, некоторые физические факторы (перегревание, воздействие больших доз ионизирующего излучения).
Миокардит может развиваться после укусов пауков и змей. Миокардит может сопровождать системные воспалительные заболевания: саркоидоз, болезнь Крона, тиреотоксикоз, системную красную волчанку, склеродермию, ревматоидный артрит. Воспалительные изменения миокарда могут возникать после трансплантации сердца.
Патологическая анатомия
Макроскопически отмечается локальная дилатация или гипертрофия, полость ЛЖ может быть нормальных размеров. Отмечается дряблость миокарда, пестрота рисунка на разрезе вследствие воспалительного инфильтрата. При хроническом течении миокардита характерны заместительный интерстициальный фиброз, гипертрофия с участками деструкции мышечных волокон, очагами интерстициальной инфильтрации мононуклеарными клетками, наличие тяжей грануляционной и фиброзной ткани.
Микроскопически выявляют нарушение структуры и взаимного расположения кардиомиоцитов, характерно наличие лимфогистиоцитарных инфильтратов с небольшим количеством плазматических клеток в интерстициальной ткани, деструкция мышечных волокон различной степени и интерстициальный отек, депозиты иммуноглобулинов и комплемента в сарколемме и интерстиции с повреждением эндотелия капилляров. Наблюдается полнокровие сосудов микроциркуляторного русла, спазм артериол, парез капилляров и вен, эритроцитарные стазы и фибриновые микротромбы, нарушается сосудистая проницаемость и развивается отек стромы.
Электронно-микроскопические и гистохимические исследования выявляют нарушение ультраструктуры миокарда, повреждение митохондрий, уменьшение количества гранул гликогена в мышечных клетках, нарушение процессов утилизации глюкозы и β-окисления жирных кислот.
Морфологический вариант миокардита связан с вызвавшим его этиологическим фактором. Преобладающим типом клеток в воспалительном инфильтрате при вирусном миокардите являются лимфоциты, при бактериальных инфекциях — нейтрофильные гранулоциты, при аллергическом лекарственном миокардите, паразитарной инвазии — эозинофильные гранулоциты.
При гигантоклеточном или гранулематозном миокардите в мышце сердца выявляют многоядерные гигантские клетки, локализующиеся главным образом по краям больших участков некроза и состоящие преимущественно из макрофагов. В очаге некроза выявляется воспалительный инфильтрат, который состоит из эозинофильных гранулоцитов, гистиоцитов и других клеток. Фиброз отсутствует.
При некротизирующем эозинофильном миокардите определяется диффузный воспалительный инфильтрат с превалированием эозинофилов, обширный некроз миоцитов.
Характерны патологические изменения в миокарде, связанные с вирусом гепатита, — небольшие очаги некроза изолированных мышечных пучков, окруженные лимфоцитами и диффузным серозным воспалением. Желудочки могут быть дилатированы с петехиальными кровоизлияниями в межжелудочковую перегородку, включая область проводящей системы сердца.
При дифтерийном миокардите при патоморфологическом исследовании выявляют дилатированное сердце с обширной внутриклеточной жировой инфильтрацией кардиомиоцитов, часто с интерстициальным воспалительным инфильтратом, миоцитолизом и гиалиновым некрозом мышечных волокон, истощение гликогена. Со временем развиваются фиброз и гипертрофия оставшихся клеток миокарда. Часто вовлекается проводящая система сердца.
При менингококковом миокардите патоморфологические находки включают геморрагические повреждения миокарда, часто отмечают интерстициальный миокардит с инфильтрацией, состоящей из лимфоцитов, плазматических клеток и полиморфноядерных лейкоцитов, изредка с некрозом миокарда. При внезапно и быстро развивающейся менингококцемии возможен фокальный некроз миокарда, выраженное жировое перерождение и зернистая дистрофия кардиомиоцитов.
При лептоспирозе отмечают петехиальные или более обширные очаги геморрагий, часто локализованные в эпикарде. Возможна интерстициальная миокардиальная инфильтрация в субэндокардиальных слоях с вовлечением сосочковых мышц.
При грибковом миокардите в посмертных исследованиях определяли диффузные миокардиальные абсцессы, а также окклюзию коронарных сосудов грибковым мицелием и тромбами.
Патогенез
Поражение миокарда при инфекционном миокардите может быть следствием прямой инфильтрации инфекционного агента в миокард, воздействия токсинов, которые выделяются возбудителями непосредственно в сердце или достигают его гематогенным путем, поражения эндотелия мелких венечных артерий с развитием коронарита, а также результатом развития иммунопатологических реакций.
Специфичность этиологического фактора имеет значение лишь в острой стадии заболевания, в дальнейшем течение миокардита в значительно большей мере обусловлено иммунными и аутоиммунными реакциями и непосредственно процессами воспаления/заживления миокарда.
Особенности миокардита вирусной этиологии обусловлены возможным прямым проникновением вируса в кардиомиоциты с последующей его репликацией и цитотоксическим эффектом вплоть до лизиса клетки или опосредованным действием через гуморальные и клеточные иммунные реакции в миокарде. Достигая поверхности миокардиальной клетки, вирусы проникают внутрь нее путем связывания со специфическими молекулами CAR (Coxackie adenovirus receptor) и DAF (decay accelerating factor) и взаимодействуют со структурными элементами, повреждают ее генетический аппарат, глубоко нарушают внутриклеточный метаболизм. Еще одним патогенетическим механизмом является воздействие энтеровирусной протеазы на деградацию дистрофина и саркогликанового комплекса, что приводит к изменению архитектоники клеток миокарда, нарушению координации сократительной функции сердца, некрозу или индукции апоптоза кардиомиоцитов, развитию иммунных и аутоиммунных реакций. Образование новых вирусных частиц происходит за счет использования белковых молекул клетки, которая при этом может погибнуть. При разрушении мышечной клетки вновь образовавшиеся вирусные частицы (вирионы) высвобождаются и могут внедряться в соседние кардиомиоциты. В клинических исследованиях установлено, что кардиотропный вирус как триггерный фактор индуцирует активацию клеточного и гуморального иммунитета и воспалительное повреждение ткани миокарда, опосредуемое реакциями иммунитета в виде реакции гиперчувствительности замедленного типа.
Большинство вирусов фагоцитируется и выводится из организма в течение 10–14 дней. При этом в поврежденных клетках миокарда сохраняются нарушения нуклеинового обмена, что приводит к образованию антител класса IgG, которые вступают в реакцию с неповрежденными кардиомиоцитами, запуская аутоиммунные процессы. После первичной инфекции миокардит развивается через несколько недель и повреждение миокарда носит инфекционно-аллергический характер.
Считается, что в случаях молниеносного миокардита прямое вирусопосредованное воздействие может быть первичным механизмом повреждения миокарда. При остром и хроническом активном миокардите вирусная фаза может быть под контролем иммунных реакций, при персистирующей реакции вследствие глубокого нарушения вирусами внутриклеточного белкового обмена клоны иммунных клеток активируются против собственных протеинов. Быстрому выздоровлению, вероятно, способствует генетически наследуемый фактор, обеспечивающий быстрый ответ в виде образования вируснейтрализующих антител классов IgM и IgG, которые препятствуют репликации вирусов и способствуют их элиминации. Если не происходит элиминации вируса из организма, миокардиальное повреждение переходит во вторую (аутоимунную) стадию вследствие нарушения структуры вновь синтезированных полипептидов как результат вирусозависимых изменений в генетическом аппарате клетки.
В патогенезе миокардита также имеет значение активация ферментных систем и высвобождение биологически активных субстанций (гистамина, серотонина, брадикинина, ацетилхолина и др.), что вызывает повреждение сосудов микроциркуляторного русла сердечной мышцы, развитие гипоксии и повреждение кардиомиоцитов с образованием микронекрозов.
При переходе заболевания в хроническую стадию признаки воспаления в миокарде могут не выявляться, при этом сохраняются миокардиальная дисфункция и кардиомегалия.
Бактерии могут непосредственно вызывать развитие воспаления в миокарде, а также являться инфекционно-токсическим и сенсибилизирующим фактором. При возникновении миокардита на фоне туберкулеза, сифилиса, брюшного тифа иммунный компонент воспаления особенно выражен.
Миокардит на фоне дифтерии, скарлатины отличается особой тяжестью течения, что обусловлено прямым воздействием микробных токсинов, которые повреждают ферментные системы мышечной клетки, ингибируют синтез белка, а также вызывают аутоиммунное повреждение различных отделов миокарда.
При дифтерии дисфункция миокарда, вероятно, обусловлена нарушением метаболизма жиров, поскольку дифтерийный токсин вызывает значительное истощение резервов миокардиального карнитина — кофактора, необходимого для их бета-окисления.
Клиническая картина
Кардиальная патология в большинстве случаев проявляется в конце 1-й или на 2-й неделе от начала инфекционного заболевания. Жалобы разнообразны и неспецифичны. Классическая манифестация миокардита — тахикардия, боль в груди или одышка на фоне острой фебрильной лихорадки. Боль в области сердца является наиболее частым и одним из ранних симптомов миокардита, может быть разной интенсивности и продолжительности, не связанной с физической нагрузкой. Одышка нередко предшествует болевому синдрому, характерны ощущение сердцебиения и перебоев в работе сердца.
Миокардит с незначительной или без дисфункции ЛЖ может протекать вообще без кардиальных симптомов. Иногда первыми проявлениями миокардита бывают быстрая утомляемость, повышенная потливость, артралгия, астенизация.
При гигантоклеточном миокардите и некротизирующем эозинофильном миокардите начало заболевания может быть острое с быстрым прогрессированием гемодинамических нарушений. При эозинофильном миокардите заболевание обычно начинается с бивентрикулярной СН, возникновение аритмий может приводить к внезапной смерти. Обычно гиперэозинофилия предшествует или совпадает с появлением симптомов поражения сердца, но может появляться позднее.
У пациентов с признаками дисфункции ЛЖ наиболее частыми симптомами являются проявления застойной (чаще левожелудочковой) СН (одышка, усталость, дискомфорт в области сердца). Повышение венозного давления, периферические отеки свидетельствуют о поражении ПЖ.
Клиническая картина хронического миокардита складывается из последовательного ряда обострений, которые наступают через неопределенные промежутки времени.
При физикальном обследовании может определяться приглушенность (глухость) тонов сердца, появление III и IV тонов сердца, систолический шум на верхушке, не связанный с I тоном, его интенсивность не изменяется при перемене положения тела.
Диагностика
Существенное значение в установлении диагноза имеет ЭКГ-исследование. Наиболее часто на фоне синусовой тахикардии отмечаются неспецифические изменения зубца Т и сегмента ST, а также снижение амплитуды всех зубцов, смещение интервала S–T вниз или вверх от изолинии в одном или нескольких отведениях, увеличение длительности интервала P–Q. Могут регистрироваться различные нарушения ритма и проводимости: предсердные и желудочковые экстрасистолы, фибрилляция и трепетание предсердий, AV-блокады различной степени, вплоть до полной, блокады ножек пучка Гиса. Изменения ЭКГ в острый период характеризуются быстрой сменой патологических признаков, часто их совокупностью и полной нормализацией картины ЭКГ при выздоровлении. Холтеровское мониторирование ЭКГ позволяет выявить предсердные и желудочковые аритмии, не выявляемые при обычной регистрации ЭКГ.
При эхоКГ-исследовании возможно определить увеличение размеров полостей сердца, снижение сократительной функции миокарда ЛЖ (ПЖ), гипо- или акинез различных участков миокарда, сопутствующий экссудативный перикардит, внутрижелудочковые тромбы (15%).
При катетеризации полостей сердца у больных миокардитом пик систолического давления смещен в сторону фазы редуцированного изгнания крови из желудочка, что указывает на уменьшение скорости сокращения миофибрилл в период изгнания, фаза напряжения уменьшена в основном за счет асинхронного сокращения, в то время как фаза изометрического сокращения укорочена, резко удлинено время изометрического расслабления миокарда, характеризуя нарушение диастолической податливости миокарда.
Рентгенологическое исследование оказывается информативным лишь у больных с диффузным миокардитом, когда можно выявить дилатацию сердца, изменения амплитуды и формы зубцов на рентгенокимограмме. Рентгенография органов грудной клетки иногда выявляет увеличение размеров сердца от незначительных до кардиомегалии и/или признаки застоя в легких.
Существенную помощь в диагностике миокардита (особенно хронического) оказывает радиоизотопная сцинтиграфия с использованием технеция-99, цитрата галлия-67 (имеет аффинность к клеткам, способным мигрировать к очагам воспаления — моноцитам, нейтрофилам, активированным Т-лимфоцитам), индий-111-оксима (используется для маркировки моноклональных антител к миозину).
В последние годы используют КТ и МРТ как чувствительные методы в обнаружении острого миокардита. Однако методы недостаточно специфичны, так как выявляют активное воспаление независимо от его этиологии, в том числе после ИМ и при других патологических процессах в миокарде. Использование этих методов при проведении эндомиокардиальной биопсии помогает осуществить прицельное взятие биоптатов и существенно повысить ее диагностическую ценность.
У больных с симптомами острой фебрильной лихорадки необходимо проводить исследование сыворотки крови на наличие наиболее частых вирусных патогенов: вируса Коксаки В, гриппа А и В, цитомегаловируса и соответствующих аденовирусных форм. Для верификации диагноза используют определение вируснейтрализующих антител (иммуноглобулинов классов G и М (IgM, IgG)) в плазме, а также полимеразную цепную реакцию (ПЦР) и гибридизацию in situ, которые являются достаточно специфическими при вирусном миокардите и позволяют быстро подтвердить или исключить наличие вирусной репликации и дифференцировать вирусный и аутоиммунный миокардит. На недавно перенесенную вирусную инфекцию указывает четырехкратное повышение титра противовирусного IgG в период выздоровления по сравнению с острым периодом.
При миокардите с большей, чем при другой патологии сердца, частотой выявляют антитела к миозину, актину, миолемме. Органоспецифичным для миокардита считают определение аутоантител к адениннуклеотидному транслокатору — ферменту внутренней мембраны митохондрий.
Результаты лабораторных исследований выявляют признаки иммунологической перестройки, в том числе повышение уровня циркулирующих иммунных комплексов, титра антител к мембранам кардиомиоцитов, белкам миокарда, снижение абсолютного и относительного количества Т-лимфоцитов (в том числе и активных) и изменение соотношения их субпопуляций (хелперы, супрессоры), изменение состояния нейтрофилов и моноцитов, процентного содержания дегранулированных форм базофилов в периферической крови (в норме 10%), повышение экспрессии маркеров ранней активации воспаления (антигенов CD25-рецепторов для интерлейкина-2 и CD71-рецепторов трансферрина).
Миокардит обычно диагностируется как «подозреваемое» воспаление миокарда, Диагностика миокардита основывается на динамике патологических изменений ЭКГ, наличии кардиомегалии, остро начавшейся и прогрессирующей застойной СН. Серологический анализ для больных с подозреваемым миокардитом должен включать исследование уровня кардиоспецифичных ферментов — КФК, МВ-фракции КФК, ЛДГ и кардиальных фракций с соотношением ЛДГ1/ЛДГ2 >1, а также тропонинов. Недавние исследования показали, что определение тропонина I и тропонина Т является более чувствительным методом диагностики миокардиального повреждения у больных миокардитом по сравнению с обнаружением в крови кардиоспецифичных ферментов. Повышение этих показателей свидетельствует о повреждении сердца.
Для установления диагноза «миокардит» общепризнанных критериев не существует. В соответствии с рекомендациями NYHA к большим диагностическим критериям относят перенесенную инфекцию и появление в течение 10 дней после нее застойной СН/кардиогенного шока, полной AV-блокады с синдромом Морганьи — Адамса — Стокса, патологических изменений ЭКГ, повышения активности миокардиальных ферментов в сыворотке крови.
К малым критериям относят лабораторные подтверждения перенесенного вирусного заболевания (положительные реакция нейтрализации, реакция торможения гемагглютинации и реакция связывания комплемента), тахикардия, ослабление I тона, ритм галопа, результаты эндомиокардиальной биопсии.
Для диагностики легкого течения миокардита достаточно наличия в анамнезе предшествующей инфекции и сочетания двух больших критериев или одного из них с двумя малыми. Наличие же в числе критериев одного из трех первых позволяет констатировать среднетяжелое или тяжелое течение миокардита.
Данные лабораторных исследований в диагностике миокардита неспецифичны и противоречивы. Выявление в сыворотке крови противокардиальных антител служит серьезным доводом в пользу диагноза «миокардит», однако эти изменения выявляют преимущественно при тяжелых его формах.
Использование эндомиокардиальной биопсии при лечении больных после трансплантации повысило ее значение при заболеваниях нативного миокарда, гистологические доказательства воспаления стали «золотым стандартом» в диагностике миокардита. Однако чувствительность эндомиокардиальной биопсии исторически была ограничена ошибками анализа образцов и посмертные исследования больных, у которых был подтвержденный миокардит, показали чувствительность эндомиокардиальной биопсии в пределах 60–70%.
В 1984 г. группой ведущих американских морфологов были разработаны так называемые «далласские» критерии диагноза миокардита, в соответствии с которыми по результатам первичной эндомиокардиальной биопсии выделяли определенный миокардит, пограничный (вероятный) миокардит или отсутствие миокардита.
При повторных биопсиях определяли продолжающийся (персистирующий) миокардит, разрешающийся (заживающий) миокардит и разрешившийся (заживший) миокардит.
Строгим диагностическим критерием острого миокардита признавалось наличие воспалительной клеточной инфильтрации миокарда с некрозом и/или дегенерацией кардиомиоцитов, нетипичной для ишемического повреждения. Термин «пограничный миокардит» использовали в случаях выявления клеточной инфильтрации и неповрежденных кардиомиоцитов. Данные повторных биопсий позволяли определить динамику или исход процесса и говорить о персистирующем разрешающемся или разрешившемся процессе.
В 1998 г. Всемирной кардиологической федерацией был принят Консенсус по определению воспалительной кардиомиопатии (миокардита). Острый миокардит рассматривается как активный миокардит, хронический — как пограничный или заживающий миокардит.
При первичной биопсии можно диагностировать:
- Острый (активный) миокардит: наличие инфильтрата (диффузного или локального) с определением не менее 14 инфильтрирующих лимфоцитов на 1 мм2 (преимущественно Т-лимфоцитов (CD45ro) или активированных Т-лимфоцитов и до 4 макрофагов). Количественно инфильтрат должен быть подсчитан иммуногистохимическим методом. Определяется некроз или дегенерация, необходимо учитывать также фиброз, наличие которого не обязательно.
- Хронический миокардит: наличие инфильтрата, содержащего не менее 14 инфильтрирующих лимфоцитов на 1 мм2 (преимущественно Т-лимфоцитов (CD45ro) или активированных Т-лимфоцитов и до 4 макрофагов). Количественно инфильтрат следует подсчитывать иммуногистохимическим методом. Некроз и дегенерация обычно не выражены, необходимо учитывать фиброз.
- Отсутствие миокардита: не выявляются инфильтрирующие клетки или их количество менее 14 на 1 мм2.
Для оценки фиброза разработаны критерии: отсутствие фиброза — 0-я степень, начальный фиброз — 1-я степень, умеренный фиброз — 2-я степень, выраженный фиброз — 3-я степень.
При повторных биопсиях можно диагностировать:
- Продолжающийся (персистирующий) миокардит: критерии 1 или 2;
- Разрешающийся (заживающий) миокардит: критерии 1 или 2, но иммунологический процесс более вялый, чем при первичной биопсии.
- Разрешившийся (заживший) миокардит соответствует «далласским» критериям. Всем категориям может сопутствовать или не сопутствовать фиброз.
В настоящее время используются результаты гистоморфологических, иммуногистохимических методов и молекулярно-биологических технологий (полимеразная цепная реакция, гибридизация in situ), с помощью которых можно верифицировать диагноз миокардита (схема 6.1). Вирусный миокардит характеризуется интракардиальным присутствием вируса с признаками воспаления. Хронический аутоиммунный миокардит подтверждается иммунологически активным воспалением, при этом вирус в молекулярных биологических средах не определяется. Критериями излеченного миокардита либо перехода его в ДКМП является исчезновение признаков воспаления в миокарде, а также отрицательные результаты полимеразной цепной реакции и гибридизации in situ.
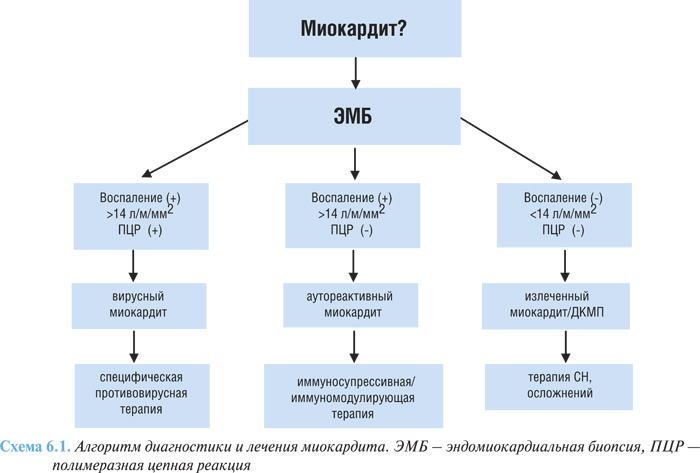
При хроническом миокардите эндомиокардиальная биопсия не позволяет выявить патогномоничные признаки уже через 1–2 мес от начала заболевания после проведения адекватной терапии.
В соответствии с объединенными рекомендациями АНА, Американского колледжа кардиологов и Европейского общества кардиологов (2007), эндомиокардиальная биопсия в настоящее время показана при следующих клинических ситуациях:
- необъяснимая вновь возникшая СН в течение менее 2 нед при нормальном или дилатированном ЛЖ и нарушениях гемодинамики (может определяться лимфоцитарный миокардит, гигантоклеточный миокардит и некротизирующий эозинофильный миокардит);
- необъяснимая вновь возникшая СН в течение от 2 нед до 3 мес при дилатированном ЛЖ и с вновь возникшими желудочковыми аритмиями, блокадой типа Мобитц II 2–3 степени или недостаточной эффективностью обычной терапии в течение 1–2 нед (может определяться гигантоклеточный миокардит);
- необъяснимая СН в течение более 3 мес при дилатированном ЛЖ и с вновь возникшими желудочковыми аритмиями, блокадой типа Мобитц II 2–3 степени или недостаточной эффективностью обычной терапии в течение 1–2 нед (может определяться идиопатический грануломатозный миокардит);
- необъяснимая СН, связанная с ДКМП любой продолжительности, которая ассоциируется с подозрением на аллергическую реакцию с эозинофилией (гиперсенситивный миокардит, некротизирующий эозинофильный миокардит);
- в исключительных случаях при необъяснимой желудочковой аритмии (лимфоцитарный миокардит, грануломатозный миокардит).
Среди пациентов с доказанным по эндомиокардиальной биопсии воспалением у большинства выявляют лимфоцитарный миокардит с преобладанием лимфоцитов в миокардиальном клеточном инфильтрате. Превалирование эозинофильных гранулоцитов выявляется при миокардите, связанном с аллергической реакцией или периферической эозинофилией. Лимфоцитарный миокардит определяют приблизительно у 10% пациентов, прошедших биопсию, а у 1–2% — гигантоклеточный миокардит, определяемый по наличию многоядерных гигантских клеток. Гиперсенситивный миокардит выявляют в основном при аутопсии в 2,4–7% случаев.
Эндомиокардиальная биопсия в настоящее время для большинства случаев не рекомендована из-за отсутствия специфических, основанных на этом методе рекомендаций по терапии.
Достоверный диагноз «миокардит» установить очень трудно, поскольку заболевание может быть совершенно бессимптомным или проявляться различными неспецифическими симптомами. Все инструментальные и лабораторные методы исследования позволяют подтвердить наличие миокардита, однако отрицательные результаты не являются критерием исключения диагноза, даже отрицательные результаты эндомиокардиальной биопсии. В острую фазу миокардита активность сердечных ферментов обычно повышена, что может повлечь ошибочный диагноз ИМ. Диагноз «миокардит» почти всегда является в определенной степени предположительным, но становится весьма убедительным, если к нему присоединяются признаки сопутствующего перикардита.
Лечение
Пациенты с легким течением очагового миокардита могут проходить лечение в амбулаторных условиях. Больные с миокардитом средней степени тяжести и тяжелым течением подлежат госпитализации. Принципы лечения больных с миокардитом включают применение немедикаментозных подходов, медикаментозного и хирургического методов лечения (схема 6.2).
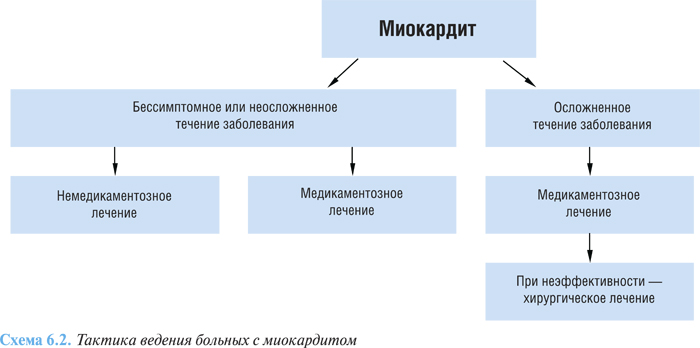
К немедикаментозному лечению можно отнести ограничение физической активности, полноценное рациональное питание с ограничением потребления поваренной соли, отказ от курения, ограничение употребления алкоголя.
Медикаментозное лечение миокардита предусматривает несколько направлений:
- воздействие на воспалительные, аутоиммунные и аллергические процессы, в том числе на уменьшение повреждающего действия антимиокардиальных антител;
- сокращение продукции биологически активных веществ;
- восстановление и поддержание гемодинамики;
- воздействие на метаболизм миокарда;
- активную санацию очагов инфекции.
Специфического лечения миокардита в настоящее время не существует, основными направлениями лечебной тактики могут быть:
- этиотропная терапия при установленном возбудителе:
- противовирусные средства,
- антибактериальные средства,
- противопаразитарные средства;
- неспецифическая противовоспалительная терапия:
- НПВП
- ГКС;
- воздействие на аутоиммунный процесс:
- симптоматическая терапия осложнений.
Значение специфической антивирусной терапии не установлено. При выявлении вируса гриппа (А и В) применяют римантадин в течение 7 сут (лечение начинают не позднее 48 ч с момента появления симптомов). При идентификации вируса Varicella zoster, вируса простого герпеса, вируса Эпштейна — Барр назначают ацикловир, цитомегаловируса — ганцикловир или фоскарнет натрий, зидовудин.
В случаях вирусной этиологии миокардита в первые 2–3 нед противопоказано назначение НПВП, ГКС, поскольку под их влиянием в острой фазе возможно значительное ускорение репликации вирусов, увеличение повреждения миокарда, уменьшение выработки интерферона.
При инфицировании Mycoplasma pneumoniae эффективен эритромицин. При инфицировании S. aureus (до определения чувствительности к антибиотикам) назначают ванкомицин, при заражении грибами — амфотерицин В. Если возбудителем является Cryptococcus neoformans (самый частый возбудитель), применяют комбинацию амфотерицина В и флуцитозида.
При идентификации Toxoplasma gondii комбинируют пириметамин + сульфадиазин, а также фолиевую кислоту для профилактики миелосупрессии.
При дифтерийном миокардите лечение малоэффективно. Для улучшения исхода заболевания необходимо экстренно ввести противодифтерийный антитоксин, терапия антибиотиками менее неотложна.
НПВП оказывают активное противовоспалительное действие. Наиболее часто используют диклофенак или ингибиторы ЦОГ-2 — группу препаратов, влияющих на метаболизм арахидоновой кислоты и уменьшающих синтез эндогенных простагландинов вследствие блокады изоформы фермента ЦОГ (ЦОГ-2), ингибирование которого имеет большое значение в устранении воспаления. Назначение НПВП оправдано при наличии признаков сопутствующего перикардита.
Нет единого мнения относительно применения иммуносупрессивной терапии у пациентов с острым миокардитом вирусной этиологии. В многоцентровом исследовании Myocarditis Treatment Trial (MTT) оценивали применение преднизолона и циклоспорина в лечении доказанного при биопсии лимфоцитарного миокардита. Терапевтический эффект иммуносупрессии не был достигнут, поскольку увеличение ФВ ЛЖ составляло 10% в группе с иммуносупрессивной терапией и 7% — в контрольной группе. Не получено разницы в долговременном выживании (p = 0,96), при общей смертности 20% за 1 год и 56% — за 4,3 года. Назначение иммуносупресивной терапии на ранних стадиях заболевания не оправдано, поскольку подавление иммунного ответа может приводить к пролонгации персистирования вируса или его фрагментов в организме и хронизации воспалительного процесса в миокарде.
Иммуносупресивная терапия, включающая ГКС, может быть эффективной у пациентов с аутоиммунной фазой миокардита. При тяжелом течении миокардита — выраженной прогрессирующей СН или тяжелых нарушениях ритма, рефрактерных к антиаритмической терапии, назначают ГКС в сочетании с цитостатиками (в случае тяжелого течения диффузного миокардита, рецидивирующего течения, сопутствующих аллергозах или выраженных признаках активности воспалительного процесса, сохраняющихся при лечении НПВП). Чаще всего применяют преднизолон 70–80 мг/сут и азатиоприн 150–200 мг/сут. Лечение продолжают в большинстве случаев 6 мес и более (дозу преднизолона постепенно снижают).
Назначение иммуносупресивной терапии показано в случае подтвержденного при эндомиокардиальной биопсии гигантоклеточного миокардита.
В настоящее время изучаются возможности применения иммуномодуляторов, в 2002 г. начато Европейское рандомизированное исследование BICC (Betaferon in Chronic Viral Cardiomyopathy Trial).
Эффективность иммуноглобулина для внутривенного введения у взрослых с миокардитом была оценена в многоцентровом исследовании Intervention in Myocarditis and Acute Cardiomyopathy (IMAC), в котором рандомизировано 62 пациента для инфузии иммуноглобулина в дозе 2 г/кг массы тела или плацебо. Не выявлено никаких преимуществ внутривенного введения иммуноглобулина, поскольку за 6 мес прирост ФВ составил 14% в обеих группах и через 12 мес — 16% в группе лечения по сравнению с 15% — в группе плацебо. Общая выживаемость (события определены как смерть, проведение трансплантации сердца или необходимость использования вспомогательных устройств для поддержания функции ЛЖ) составила 91% через 1 год и 88% за 2 года; никаких существенных отличий между группами не выявлено.
В комплексной терапии миокардита возможно использование препаратов системной энзимотерапии.
Лечение и исход миокардита значительно отличаются в зависимости от функции ЛЖ.
При легком течении миокардита (подозрении на миокардит) и отсутствии дисфункции ЛЖ медикаментозная терапия не требуется, рекомендовано избегать аэробных физических нагрузок или подъема тяжестей в течение как минимум 6–8 нед. Обследование, включающее ЭКГ и эхоКГ, следует повторить через 6–8 нед после начала заболевания для оценки прогрессирования вовлечения миокарда.
При дисфункции ЛЖ пациентам с СН терапия проводится по общим правилам. Всем больным рекомендовано применение ингибиторов АПФ (при непереносимости антагонистов рецепторов ангиотензина II) и блокаторов β-адренорецепторов. Застой в легких или симптомы перегрузки жидкостью необходимо устранять применением петлевых диуретиков в минимальной эффективной дозе. Дигоксин добавляют к схеме лечения у больных с III ФК NYHA, однако следует учитывать его потенциальные проаритмогенные и провоспалительные эффекты, назначая в минимальных эффективных поддерживающих дозах или не назначая вовсе у больных с минимально выраженной симптоматикой (I или II ФК). Даже на фоне применения сердечных гликозидов в обычных дозах появляется высокий риск гликозидной интоксикации. СН при миокардите отличается резистентностью к сердечным гликозидам и диуретикам. Важно устранить гипокалиемию и ацидоз. Для лечения рефрактерной СН оправдано применение периферических вазодилататоров. Нитраты уменьшают венозный возврат крови к сердцу, давление в сосудах малого круга кровообращения, то есть преднагрузку ЛЖ, что проявляется клиническим улучшением. Применение сердечных гликозидов на фоне периферических вазодилататоров позволяет достичь адекватной дигитализации при отсутствии токсического эффекта.
У пациентов с молниеносным течением миокардита могут использоваться механические устройства для поддержки функции желудочков, в случаях когда их состояние не улучшается, несмотря на максимальную инотропную терапию.
У больных, размер и систолическая функция ЛЖ которых полностью нормализовались, терапия ингибиторами АПФ и блокаторами β-адренорецепторов в принципе может быть прекращена при условии тщательного контроля функции ЛЖ и хронических заболеваний. У многих выздоровевших пациентов субъективные ограничения в функциональной способности и объективные ограничения при нагрузочных пробах могут присутствовать, возможно, благодаря более медленному восстановлению диастолической функции ЛЖ.
Непрямые антикоагулянты назначают больным с тромбоэмболическими осложнениями (в том числе и в анамнезе), наличием тромбов в полостях сердца и фибрилляцией предсердий на фоне кардиомегалии.
При нарушениях ритма назначают антиаритмические препараты или вживляют кардиовертер-дефибрилятор, электрокардиостимулятор.
Трансплантацию сердца следует планировать только на поздних стадиях заболевания, особенно с учетом высокой ранней послеоперационной смертности в результате отторжения трасплантата у пациентов, чья иммунная система исходно активирована против антигенов миоцитов. При отторжении трансплантата, которое чаще развивается в первые 3 мес после трансплантации сердца, назначают ГКС в высоких дозах (пульс-терапия).
В терминальной стадии используют двухкамерную стимуляцию, аппаратное поддержание сокращения желудочков.
Прогноз
Прогноз значительно зависит от степени восстановления функции ЛЖ. В большинстве случаев (до 90%) миокардит протекает бессимптомно и в течение 1–2 мес заканчивается полным выздоровлением, исчезают все субъективные симптомы, нормализуется ЭКГ в покое и при проведении ВЭМ. У 30–50% пациентов с дисфункцией ЛЖ происходит существенное ее улучшение в течение первого года после заболевания. У многих больных сохраняются остаточные изменения ЭКГ, свидетельствующие о развитии очагового миокардитического кардиосклероза (миокардиофиброза), что подтверждается при эхоКГ-исследовании. При наличии клинических проявлений дисфункции ЛЖ прогноз хуже: у 10–33% больных развивается ДКМП.
Гигантоклеточный миокардит и некротизирующий эозинофильный миокардит могут иметь молниеносное развитие симптомов с неблагоприятным прогнозом. При гигантоклеточном миокардите продолжительность жизни без трансплантации сердца в среднем составляет 5,5 мес, через 4 года остаются живыми только 11%, при лимфоцитарном миокардите — 44% больных.
Неблагоприятными факторами, отягощающими прогноз миокардита, считают повышение давления в левом предсердии, низкий сердечный индекс, диастолическую дисфункцию ПЖ, развитие застойной СН, тромбоэмболии, нарушения проводимости и аритмии высоких градаций.
ЛИТЕРАТУРА
- Амосова Е.Н. (2000) Миокардиты. Междунар. мед. журн., 1: 22-25.
- Дерюгин М.В., Бойцов С.А. (2005) Хронические миокардиты. ЭЛБИ-СПб, Санкт-Петербург, 288 с.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практ. руководство. Морион, Киев, 480 с.
- Коваленко В.Н., Рябенко Д.В. (2005) Современные представления о миокардите. Мистецтво лікування, 9: 12-20.
- Наказ № 436 Міністерства охорони здоров’я України від 03.07.2006 р. «Про затвердження протоколів надання медичної допомоги за спеціальністю «Кардіологія» (2006) Укр. кардіол. журн.,6: 89-115.
- Badorff C., Knowlton K.U. (2004) Dystrophin disruption in enterovirus-induced myocarditis and dilated cardiomyopathy: from bench to bedside. Med. Microbiol. Immunol, 193: 121-126.
- Bowles N.E., Ni J., Kearney D.L. et al. (2003) Detection of viruses in myocardial tissues by polymerase chain reaction: evidence of adenovirus as a common cause of myocarditis in children and adults. J. Amer. Coll. Cardiol., 42: 466472.
- Chimenti C., Russo A., Pieroni M. et al. (2004) Intramyocyte detection of Epstein-Barr virus genome by laser capture microdissection in patients with inflammatory cardiomyopathy. Circulation, 110: 3534-3539.
- Cooper L.T., Baughman K.L., Feldman A.M. et al. (2007) The role of endomyocardial biopsy in the management of cardiovascular disease. Eur. Heart J., 28: 3076-3093.
- Daliento L., Calabrese F., Tona F. et al. (2003) Successful treatment of enterovirus-induced myocarditis with interferon-a. J. Heart Lung Transplant., 22: 214-217.
- D’Ambrosio A., Patti G., Manzoli A. et al. (2001) The fate of acute myocarditis between spontaneous improvement and evolution to dilated cardiomyopathy: a review. Heart, 85: 499-504.
- Deonarain R., Cerullo D., Fuse K. et al. (2004) Protective role for Interferon-β in coxsackie virus B3 infection. Circulation, 1 10: 3540-3543.
- Dill T., Ekinci O., Hansel J. et al. (2005) Delayed contrast-enhanced magnetic resonance imaging for the detection of autoimmune myocarditis and long-term follow-up. J. Cardiovasc. Magn. Reson., 7: 521-523.
- Elliott P., Andersson B., Arbustini E. et al. (2008) Classification of the cardiomyopathies: a position statement from the european society of cardiology working group on myocardial and pericardial diseases. Eur. Heart J., 29: 270-276.
- Eckart R.E., Scoville S.L., Campbell C.L. et al. (2004) Sudden death in young adults: a 25-year review of autopsies in military recruits. Ann. Intern. Med., 141: 829-834.
- Galderisi M., Mondillo S. (2007) Echocardiography in clinical practice .One Way S.r.l., 120 p.
- Huber S.A., Sartini D. (2005) Roles of tumor necrosis factor alpha and the p55 receptor in CD1d induction and Coxsackie virus B3-induced myocarditis. J. Virol., 79: 2659-2665.
- Hufnagal G., Pankuweit S., Schonian U. et al. (2000) The European Study of Epidemiology and Treatment of Cardiac Inflammatory Diseases (ESETCID). First epidemiology results. Herz, 25: 279-285.
- Kittleson M.M., Minhas K.M., Irizarry R.A. et al.(2005) Gene expression in giant cell myocarditis: altered expression of immune response genes. Intl. J. Cardiol., 102: 333-340.
- Kuhl U., Pauschinger M., Schwimmbeck P.L. et al. (2003) Interferon-β treatment eliminates cardiotropic viruses and improves left ventricular function in patients with myocardial persistence of viral genomes and left ventricular dysfunction. Circulation, 107: 2793-2798.
- Liu P.P., Mason J.W. (2001) Advances in understanding of myocarditis. Circulation, 104: 1076.
- Liu P.P., Yan A.T. (2005) Cardiovascular magnetic resonance for the diagnosis of acute myocarditis. J. Amer. Coll. Cardiol., 45: 1823-1825.
- Maisch B., Portig I., Ristic A.et al. (2000) Definition of inflammatory cardiomyopathy (myocarditis): on the way to Consensus. A status report. Herz, 25(issue 3): 200-209.
- Mason J.W., O’Connell J.B., Herskowitz A. et al. (1995) A clinical trial of immunosuppressive therapy for myocarditis. The Myocarditis Treatment Trial Investigators. N. Engl. J. Med., 333: 269-313.
- McCarthy R.E., Bochmer J.P., Hruban R.H. et al.(2000) Long-term outcome of fulminant myocarditis as compared with acute (nonfulminant) myocarditis. New Engl. J. Med., 342: 690-694.
- McNamara D.M., Rosenblum W.D., Janosko K.M. et al. (1997) Intravenous immune globulin in the therapy of myocarditis and acute cardiomyopathy. Circulation, 95: 2476-2478.
- Pauschinger M., Chandrasekharan K., Noutsias M. et al. (2004) Viral heart disease: molecular diagnosis, clinical prognosis, and treatment strategies. Med. Microbiol. Immunol., 193: 65-69.
- Smith S.C., Ladenson J.H., Mason J.W. et al. (1997) Elevations of cardiac troponin I associated with myocarditis. Circulation, 95: 163-168.
- Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Lippincott Williams&Wilkins, 1628 p.
- Wojnicz R., Nowalany-Kozielska E., Wojciechowska C. et al. (2001) Randomized, placebo-controlled study for immunosuppressive treatment of inflammatory dilated cardiomyopathy: two-year follow-up results. Circulation, 104: 39-45.