Врожденные пороки сердца
Содержание
- Эпидемиология
- Этиология
- Патогенез
- Классификация
- Лечение
- АНОМАЛИИ РАСПОЛОЖЕНИЯ СЕРДЦА
- Эпидемиология
- Клиническая картина и диагностика
- Лечение
- АНОМАЛИИ МЕЖПРЕДСЕРДНОЙ ПЕРЕГОРОДКИ
- ДЕФЕКТ МЕЖПРЕДСЕРДНОЙ ПЕРЕГОРОДКИ
- Определение
- Эпидемиология
- Патологическая анатомия
- Нарушения гемодинамики
- Клиническая картина
- Диагностика
- Лечение
- Прогноз
- АНОМАЛИИ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ
- ДЕФЕКТ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ
- Определение
- Эпидемиология
- Патологическая анатомия
- Нарушения гемодинамики
- Клиническая картина
- Диагностика
- Лечение
- Прогноз
- КОМПЛЕКС ЭЙЗЕНМЕНГЕРА
- Определение
- Эпидемиология
- Нарушения гемодинамики
- Клиническая картина
- Диагностика
- Лечение
- Прогноз
- ИЗОЛИРОВАННЫЙ СТЕНОЗ ЛА
- Определение
- Эпидемиология
- Патологическая анатомия
- Нарушения гемодинамики
- Клиническая картина
- Диагностика
- Лечение
- Прогноз
- ТЕТРАДА ФАЛЛО
- Определение
- Эпидемиология
- Патологическая анатомия
- Нарушения гемодинамики
- Клиническая картина
- Диагностика
- Лечение
- Прогноз
- ОТКРЫТЫЙ АРТЕРИАЛЬНЫЙ ПРОТОК
- Определение
- Эпидемиология
- Патологическая анатомия
- Нарушения гемодинамики
- Клиническая картина
- Диагностика
- Лечение
- Прогноз
- КОАРКТАЦИЯ АОРТЫ
- Определение
- Эпидемиология
- Патологическая анатомия
- Нарушения гемодинамики
- Клиническая картина
- Диагностика
- Лечение
- Прогноз
- АНОМАЛИЯ ЭБШТЕЙНА
- Определение
- Эпидемиология
- Патологическая анатомия
- Нарушения гемодинамики
- Клиническая картина
- Диагностика
- Лечение
- Прогноз
- ЛИТЕРАТУРА
Врожденные пороки сердца представляют собой структурные аномалии и деформации клапанов, отверстий или перегородок между камерами сердца или отходящих от него сосудов, нарушающие внутрисердечную и системную гемодинамику, предрасполагающие к развитию острой или хронической недостаточности кровообращения.
Эпидемиология
Частота врожденных пороков сердца составляет до 1% всех заболеваний сердца.
Этиология
Возникновение пороков эмбрионального развития может быть обусловлено генными мутациями, различными инфекционными процессами и интоксикациями (эндогенными и экзогенными) в период беременности.
С врожденными пороками сердца связаны определенные хромосомные нарушения, наиболее частая — трисомия 21 (синдром Дауна), а также трисомии 13, 14, 15 и 18. У более чем 50% пациентов с синдромом Дауна отмечают врожденный порок сердца (наиболее часто атриовентрикулярные или желудочковые септальные дефекты).
Мутации в нескольких специфических генах идентифицированы в некоторых случаях врожденных пороков сердца. Мутации в TBX5 выявляют у большинства пациентов с синдромом Хольт — Орама, аутосомным заболеванием с септальными дефектами. Мутации в гене эластина были идентифицированы как причина надклапанного аортального стеноза, мутации в NKX2.5 связаны с аутосомным доминантным фенотипом дефекта предсердной перегородки при тетраде Фалло.
Патогенез
Врожденный порок сердца является следствием нарушения нормального процесса развития первичной и вторичной межпредсердных перегородок и эндокардиальных подушек в период его эмбрионального формирования. При нарушении развития мышечной части межжелудочковой перегородки в ней образуются единичные или множественные отверстия, чаще в мембранозной ее части, при этом могут образоваться высокие или низкие ее дефекты, нередко захватывающие нижележащую часть мышечной перегородки. Нарушение развития аортолегочной перегородки может быть локальным, на небольшом протяжении, тогда формируется порок типа аортолегочного свища. Иногда разделения артериального ствола на аорту и ЛА вообще не происходит и формируется порок, называемый общим артериальным стволом. В процессе формирования этой перегородки направление ее роста может нарушиться и идти не по спирали, как обычно, а прямо — в таких случаях формируется порок, называемый транспозицией аорты и ЛА. В ряде случаев нарушения развития перегородки артериального конуса приводят к ее отклонению в ту или иную сторону, вследствие чего возникает сужение аорты или ЛА. К сужению последней часто присоединяется нарушение развития складок конуса в месте, где они участвуют в формировании мембранозной части перегородки, — образуется дефект в ней, расширенная аорта сдвигается вправо и оказывается расположенной прямо над дефектом — развивается порок, получивший название «тетрада Фалло».
Возникновение ряда врожденных пороков сердца и магистральных сосудов связано с нарушениями в постнатальный период. Нарушение в процессе нормального закрытия артериального протока приводит к формированию открытого артериального протока. При сочетании незаращения овального отверстия с недоразвитием вторичной перегородки формируется дефект межпредсердной перегородки в области овального окна.
Классификация
По этиологии врожденные пороки подразделяются на две группы:
- Пороки, обусловленные нарушением формообразования, являющиеся патологией эмбрионального развития сердечно-сосудистой системы;
- Пороки, развившиеся вследствие заболеваний эндокарда, перенесенных во внутриутробный период.
С учетом морфологии поражения среди врожденных пороков сердца выделяют:
- аномалии расположения сердца;
- аномалии предсердной, межжелудочковой перегородки;
- аномалии ЛА, артериального протока, аорты;
- перемещение больших сосудов;
- аномалии клапанного аппарата сердца.
Систематизация врожденных пороков сердца
Общие:
- врожденная корригированная транспозиция магистральных артерий;
- аномалии расположения сердца;
- врожденная полная блокада сердца.
Пороки сердца «белые» с шунтированием крови слева направо:
1. Шунт крови на уровне предсердий:
1) дефект межпредсердной перегородки;
2) дефект межпредсердной перегородки в сочетании с митральным стенозом (синдром Лютамбаше);
3) частичное аномальное присоединение легочных вен.
2. Шунт крови на уровне желудочков:
1) дефект межжелудочковой перегородки;
2) дефект межжелудочковой перегородки в сочетании с недостаточностью клапана аорты;
3) дефект межжелудочковой перегородки со сбросом крови из ЛЖ в правое предсердие.
3. Шунт крови из устья аорты в правую часть сердца:
1) разрыв аневризмы синуса Вальсальвы;
2) коронарная артериовенозная фистула;
3) аномальное отхождение выхода левой коронарной артерии из ствола ЛА.
4. Шунт крови между аортой и ЛА:
1) аортопульмональное окно;
2) открытый артериальный проток.
5. Многоуровневые шунты крови:
1) полный общий предсердно-желудочковый канал;
2) сочетание дефекта межжелудочковой перегородки с дефектом межпредсердной перегородки;
3) сочетание дефекта межжелудочковой перегородки с открытым артериальным протоком.
Пороки сердца «белые» без шунтирования крови:
1. Пороки левых отделов сердца:
1) врожденная обструкция притоку крови в левое предсердие;
2) митральная недостаточность;
3) первичный дилатирующий фиброэластоз эндокарда;
4) стеноз устья аорты;
5) недостаточность аортального клапана;
6) коарктация аорты.
2. Пороки правых отделов сердца:
1) аномалия трехстворчатого клапана (Эбштейна) без цианоза;
2) стеноз ЛА;
3) врожденная недостаточность клапана ЛА;
4) идиопатическое расширение ствола ЛА.
Пороки сердца «синие»:
С усиленным легочным кровотоком:
- Полная транспозиция магистральных артерий;
- Синдром Тауссиг — Бинга;
- Артериальный ствол;
- Полная аномалия присоединения легочных вен;
- Единственный желудочек без стеноза легочного ствола;
- Общее предсердие;
- Тетрада Фалло с атрезией легочного ствола и усилением коллатерального артериального кровотока;
- Атрезия трехстворчатого клапана с большим дефектом межжелудочковой перегородки, без стеноза легочного ствола;
- Гипоплазия левых отделов сердца (атрезия аорты и митрального клапана).
С нормальным или уменьшенным легочным кровотоком:
- Атрезия трехстворчатого клапана;
- Аномалия Эбштейна с шунтированием крови из правого предсердия в левое;
- Атрезия легочного ствола с интактной межжелудочковой перегородкой;
- Стеноз или атрезия легочного ствола с дефектом межжелудочковой перегородки (тетрада Фалло);
- Стеноз легочного ствола с шунтированием крови из правого предсердия в левое;
- Полная транспозиция магистральных сосудов в сочетании со стенозом легочного ствола;
- Отхождение обоих выносящих сосудов из ПЖ в сочетании со стенозом легочного ствола;
- Единственный желудочек со стенозом легочного ствола;
- Артериовенозные свищи легких;
- Сообщение между полыми венами и левым предсердием.
Лечение
В соответствии с протоколом оказания медицинской помощи пациентам с врожденными пороками сердца лечебная программа предусматривает перечень и объем обязательных медицинских услуг, куда включены оперативное лечение порока сердца и лечение СН и ее осложнений (приказ МЗ Украины № 436 от 03.07.2006 г.).
АНОМАЛИИ РАСПОЛОЖЕНИЯ СЕРДЦА
К аномалиям внутригрудного расположения сердца относят нарушения расположения верхушки сердца, ее соответствия с характером расположения органов брюшной полости и такие случаи неправильного формирования сердца, как обратное или неопределенное расположение эмбриональных закладок правого и левого предсердий.
Эпидемиология
Частота этих аномалий составляет 1,5% среди всех врожденных пороков сердца, наиболее частыми среди них являются правосформированное праворасположенное сердце — изолированная декстрокардия (рис. 3.1) и левосформированное праворасположенное сердце (рис. 3.2) — «зеркальная декстрокардия» (соответственно у 54 и 33% больных с правосторонним расположением сердца). В первом случае расположение других органов грудной клетки и топография органов брюшной полости соответствуют физиологической норме, во втором случае отмечают полное обратное расположение внутренних органов.
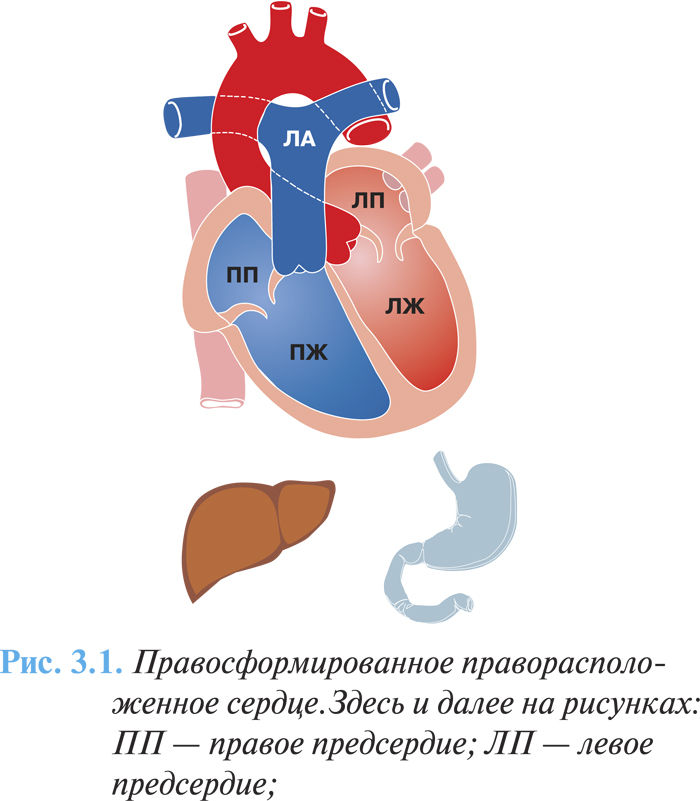
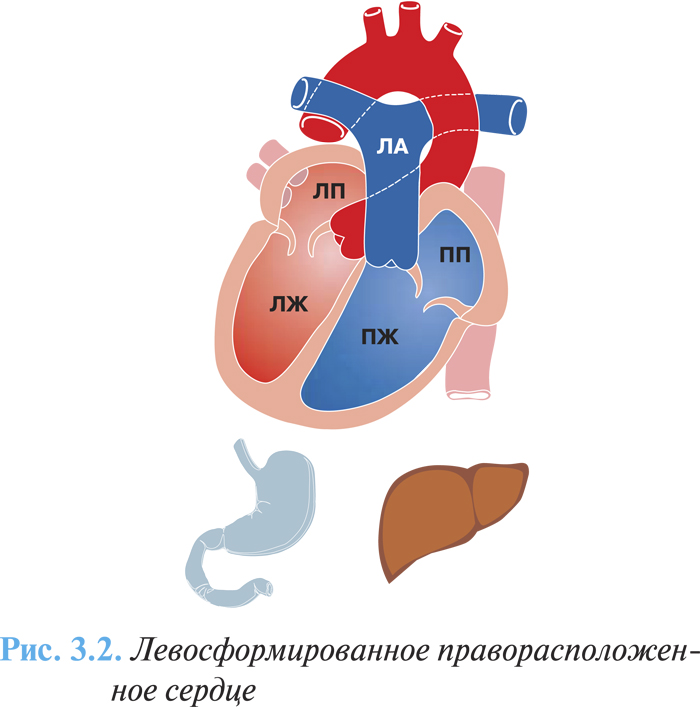
Клиническая картина и диагностика
Если строение сердца и сосудов не нарушено, оно в целом функционирует нормально, нарушения кровообращения не происходит.
При пальпации сердечный толчок располагается в пятом межреберье справа по среднеключичной линии. Аускультативно тоны сердца лучше всего прослушиваются справа соответственно общепринятым аускультативным точкам, симметрично смещенным на правую половину грудной клетки.
На ЭКГ при изолированной декстрокардии характерен положительный зубец Р в I, aVL, a VF, V1–4-отведениях. В грудных отведениях вольтаж комплексов QRS прогрессивно увеличивается от V6R до V1–2 и далее снижается к V6, указывая на правостороннее расположение сердца. При этом потенциалы ПЖ в форме комплексов rS или RS регистрируют в отведениях от V6R до V2–3, левого — в виде qR или qRS — в V3–6.
На ЭКГ при истинной декстрокардии характерен отрицательный зубец Р в I, aVL, V5–6-отведениях, положительный Р в II, III, V1-отведениях, отрицательные комплексы QRS в I, aVR, повышение их вольтажа от V1 до V6R и снижение — от V1 до V6, отрицательные Т в I, aVL, V5–6. В I стандартном отведении регистрируют зубцы, имеющие противоположное обычному направление: II стандартное отведение соответствует нормальному III и, наоборот, III стандартное отведение — II, отведение aVL отражает отведение aVR и, наоборот, aVR-aVL, отведение V1 равноценно V2R, V3–V3R, V4–V4R, V5–V5R, V6–V6R. Отведение aVF не изменяется. Если поменять местами электроды правой и левой руки и наложить грудные электроды зеркально к нормальному сердцу, то ЭКГ можно анализировать как при нормальном расположении сердца.
Рентгенологическое исследование выявляет тень сердца преимущественно в правой половине грудной клетки, верхушка сердца ориентирована вправо.
Аномальное расположение сердца подтверждается при эхоКГ-иследовании.
Лечение
Аномальное расположение сердца само по себе не сопровождается расстройствами гемодинамики. Хирургическому лечению подлежат лишь больные с сопутствующими пороками сердца.
АНОМАЛИИ МЕЖПРЕДСЕРДНОЙ ПЕРЕГОРОДКИ
ДЕФЕКТ МЕЖПРЕДСЕРДНОЙ ПЕРЕГОРОДКИ
Определение
Дефект межпредсердной перегородки — врожденный порок сердца, при котором есть сообщение между двумя предсердиями, развивающееся в результате аномального развития первичной и вторичной межпредсердных перегородок и эндокардиальных подушек.
Дефект межпредсердной перегородки в сочетании со стенозом левого атриовентрикулярного отверстия носит название синдрома Лютамбаше.
Эпидемиология
Распространенность дефекта межпредсердной перегородки составляет 5–10% всех врожденных пороков, является наиболее частым пороком сердца у взрослых (30%), у женщин отмечают чаще, чем у мужчин (2:1).
Патологическая анатомия
Существует несколько морфологических типов дефекта межпредсердной перегородки. Наиболее частый вариант — высокий дефект межпредсердной перегородки типа ostium secundum (75% случаев), возникающий вследствие нарушения развития вторичной перегородки, локализуется в центральной части межпредсердной перегородки в области овальной ямки (рис. 3.3).
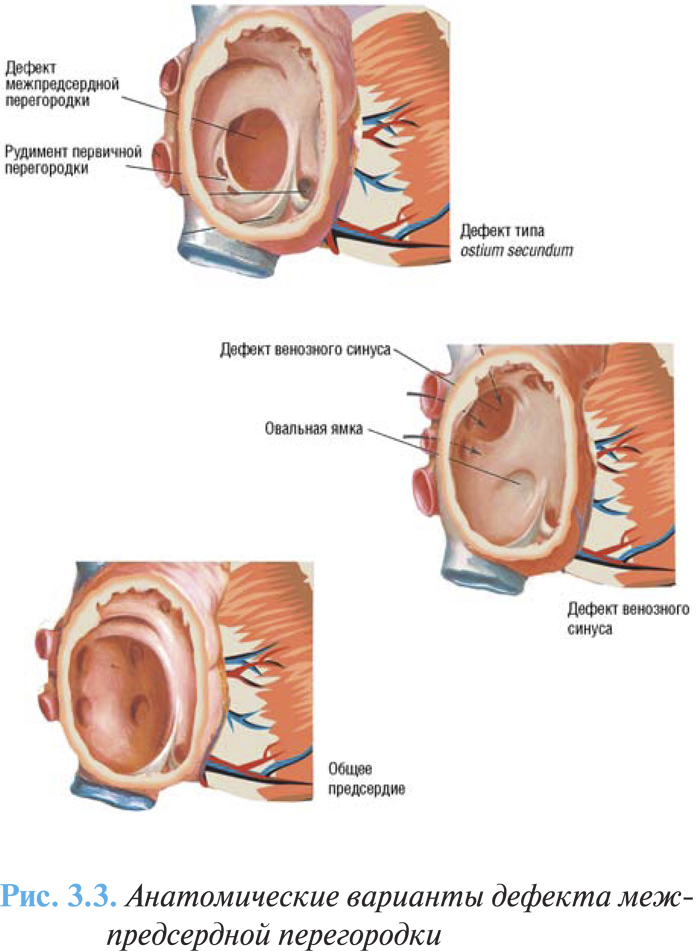
Дефект типа ostium primum (15%) представляет собой вариант дефекта эндокарда, возникает вследствие неполного развития первичной перегородки, располагается в нижнем отделе перегородки непосредственно над уровнем предсердно-желудочковых отверстий, сочетается с расщеплением створок митрального и реже трехстворчатого клапанов.
Сочетание нарушения развития перегородок предсердия с неправильным расположением венозного синуса приводит к образованию сложных дефектов.
Дефекты венозного синуса (10%) чаще отмечают высоко в межпредсердной перегородке вблизи от впадения верхней полой вены, связаны с атипичным впадением легочных вен в правое предсердие или верхнюю полую вену. Намного реже дефекты венозного синуса могут локализоваться в нижней части перегородки над устьем нижней полой вены.
В некоторых случаях отмечают общее предсердие — отсутствие большей части межпредсердной перегородки или наличие только рудиментарных ее элементов, часто сочетается с расщеплением атриовентрикулярных клапанов.
Открытое овальное отверстие, которое не закрывается у 20% взрослых, не следует рассматривать как разновидность дефекта межпредсердной перегородки, поскольку при истинном дефекте имеется недостаточность ткани, а при открытом овальном окне сообщение осуществляется за счет клапана, который открывается при особых обстоятельствах.
Синдром Лютамбаше морфологически характеризуется наличием дефекта межпредсердной перегородки (чаще вторичного) и сужения левого атриовентрикулярного отверстия (врожденного или приобретенного). Характерным является расширение ЛА, которая иногда вдвое превышает размер аорты.
Нарушения гемодинамики
Наличие дефекта межпредсердной перегородки приводит к сбросу артериальной крови из левого предсердия в правое вследствие наличия градиента давления между ними. В результате возникает перегрузка объемом правой половины сердца, дилатация ПЖ и увеличение ОЦК в малом круге. При больших дефектах это может приводить к легочной гипертензии, однако выраженная гипертензия в малом круге в первые 20 лет возникает у около 2% больных.
Основную роль в компенсации нарушения кровообращения играет ПЖ, работа которого увеличивается в несколько раз. Недостаточность ПЖ развивается после 10 лет существования порока, в более старшем возрасте присоединяется недостаточность ЛЖ. Последняя, вызывая уменьшение его податливости, может приводить к увеличению объема шунта слева направо.
При синдроме Лютамбаше величина шунта увеличивается пропорционально возрастанию стенозирующего дефекта митрального отверстия, помимо этого происходит нарушение оттока крови из малого круга и возникновение легочной гипертензии.
Клиническая картина
Клинические проявления порока зависят от степени нарушения гемодинамики и изменяются с возрастом. При относительно небольшом дефекте в молодом возрасте больные могут не предъявлять жалоб и порок выявляют при случайном обследовании. Жалобы на одышку и приступы сердцебиений при физической нагрузке возникают в возрасте старше 40 лет, затем нарастают слабость и утомляемость, появляются различные аритмии, СН, которая обусловлена выраженной легочной гипертензией.
При больших дефектах межпредсердной перегородки одышка является одним из симптомов заболевания уже в молодом возрасте. У больных часто возникают приступы сердцебиения.
При перкуссии отмечают расширение границ сердца преимущественно вправо, а при больших дефектах — влево. В отдельных случаях описаны наличие сердечного горба (за счет увеличения правых отделов сердца), а также систолическое дрожание у левого края грудины.
Характерна аускультативная картина: над ЛА слева у грудины выслушивается систолический шум умеренной интенсивности, возникающий вследствие увеличенного кровотока через клапан ЛА. Второй тон над ЛА усилен и раздвоен. Реже определяют диастолический шум над нижней частью грудины, связанный с относительным стенозом отверстия трехстворчатого клапана при увеличенном количестве крови, проходящей через него. После того как возросшее легочное сосудистое сопротивление приводит к понижению величины сброса крови слева направо, интенсивность шумов снижается, появляется диастолический шум, вызванный недостаточностью клапана ЛА.
Диагностика
На ЭКГ электрическая ось сердца у больных со вторичным дефектом отклонена вправо, с первичным — влево. При каждом из дефектов выявляют различную степень перегрузки и гипертрофии ПЖ и правого предсердия, выраженность которой зависит от величины давления в легочном стволе. Выявляют признаки частичной блокады правой ножки пучка Гиса (феномен rSR» или rsR’ в правых грудных отведениях), могут определять предсердную экстрасистолическую аритмию, пароксизмальную суправентрикулярную тахикардию. У больных с синдромом Лютамбаше нередко выявляют фибрилляцию предсердий.
На рентгенограмме сердце увеличено в поперечнике, в косых проекциях определяется увеличение правых отделов сердца. Дуга ЛА выбухает, дуга аорты уменьшена, усилен сосудистый рисунок легких, корни легких расширены, характерна их пульсация.
Диагноз устанавливают методом трансторакальной и допплеровской эхоКГ, с помощью которой можно установить локализацию, размер дефекта (хорошо визуализируются оstium secundum и primum), а также направление сброса крови.
При эхоКГ-исследовании выявляют следующие признаки:
- увеличение полости правого предсердия и ПЖ;
- парадоксальное движение межжелудочковой перегородки;
- гипердинамичное движение стенок левого предсердия;
- признаки легочной гипертензии;
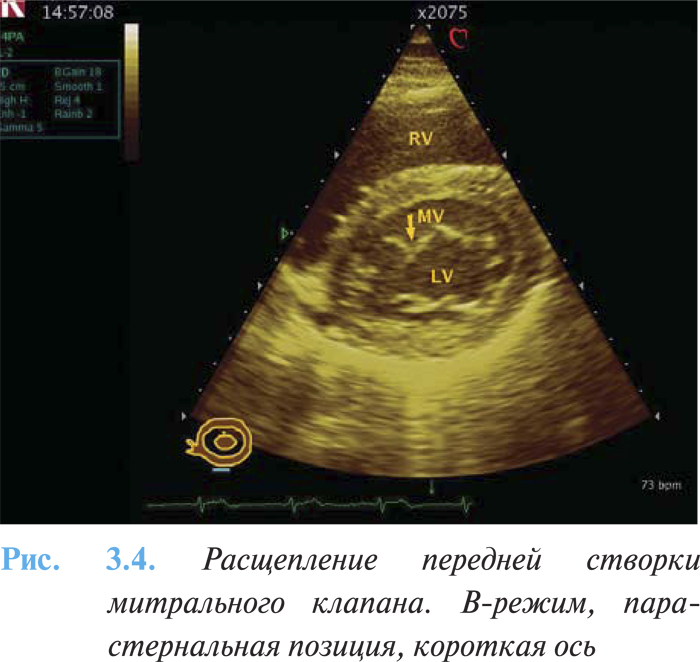
- признаки расщепления митрального и трехстворчатого клапанов с проявлениями их недостаточности при первичном дефекте (рис. 3.4);
- пролапс митрального клапана при вторичном дефекте;
- стеноз митрального отверстия при синдроме Лютамбаше;
- шунтирование крови между предсердиями слева направо или справа налево (рис. 3.5а, б).
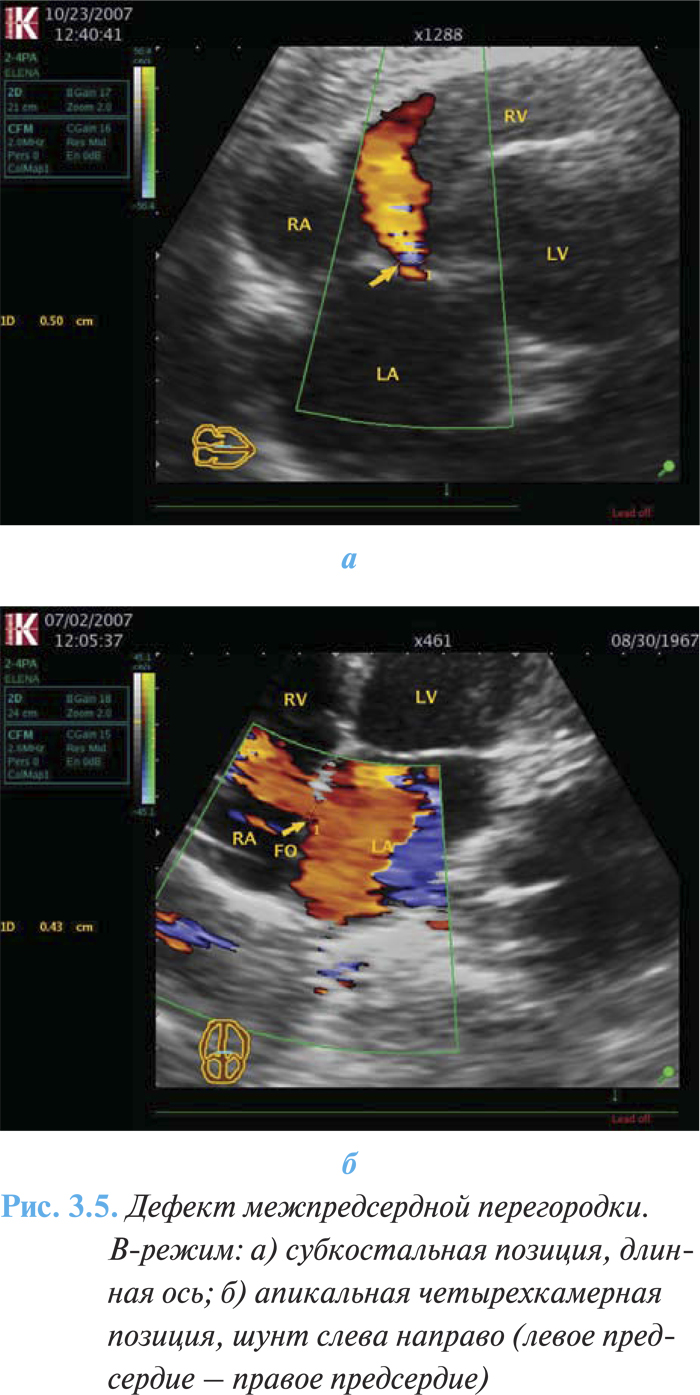
Дефекты венозного синуса требуют дополнительных диагностических подходов — чреспищеводная эхоКГ обеспечивает наилучшую визуализацию межпредсердной перегородки, легочных вен, особенно у взрослых пациентов с недостаточными «акустическими окнами».
Катетеризации полостей сердца обычно не требуется, кроме случаев сопутствующей легочной гипертензии или когда неинвазивное исследование неполноценно. Наличие дефекта межпредсердной перегородки подтверждается проведением катетера из правого предсердия через перегородку в левое и повышением насыщения крови кислородом в полости правого предсердия по сравнению с пробами крови, взятой у устья полых вен. Разница в 2 об.% и более (или 8–10%) рассматривается как абсолютный признак шунтирования крови.
Коронароангиографию обычно проводят пациентам в возрасте старше 40 лет перед планируемой хирургической коррекцией порока.
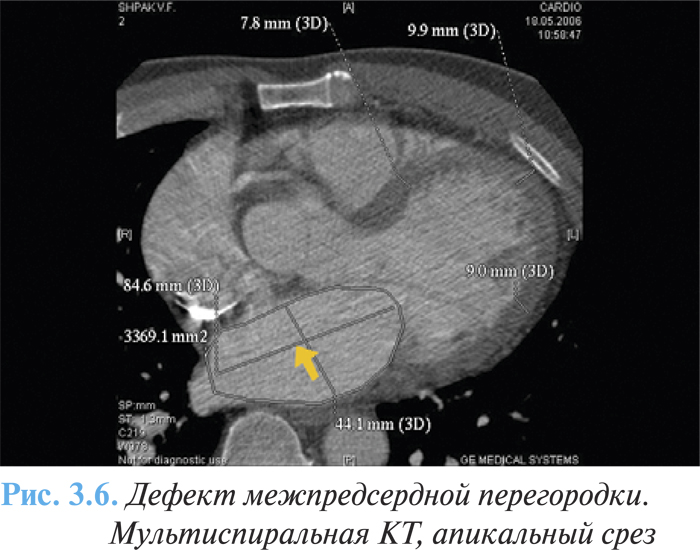
Дефект межпредсердной перегородки также может быть диагностирован с помощью КТ (рис. 3.6) или МРТ, которая является методом выбора для оценки внесердечной анатомии, в том числе больших сосудов, ветвей ЛА, также как и системных и легочных венозных соединений.
Лечение
Хирургическое закрытие дефекта рекомендовано, если соотношение легочного к системному кровотоку более чем 1,5:1 и отношение легочного к системному сосудистому сопротивлению менее 0,7. Нет единого мнения относительно хирургического лечения асимптомных больных в возрасте 25–40 лет, однако оно оправдано для предупреждения прогрессирования симптомов. Вследствие возможности увеличения сброса крови слева направо, появления фибрилляции предсердий и развития легочной гипертензии с возрастом желательно выполнение хирургической коррекции порока до появления признаков ухудшения функции сердца. У симптомных больных в возрасте старше 40 лет хирургическое закрытие дефекта улучшает толерантность к физической нагрузке и выживаемость по сравнению с медикаментозной терапией и предотвращает дальнейшее ухудшение функционального состояния, хотя не снижает риск развития суправентрикулярной аритмии, СН и цереброваскулярных событий. Хирургическое вмешательство у 80% больных старше 60 лет со значительным сбросом крови приводит к улучшению симптомов.
У 70% больных старшего возраста после операции сохраняются нарушения ритма, у 10–25% они возникают впервые, повышается риск системной АГ неясной этиологии.
Показания к хирургическому лечению:
- неэффективная медикаментозная терапия СН;
- значительный артериовенозный сброс;
- отставание в физическом развитии;
- повышение давления в малом круге кровообращения.
Противопоказания к оперативному вмешательству:
- Веноартериальный (справа налево) сброс, поскольку это признак выраженной гипертензии и часто необратимых изменений в малом круге кровообращения;
- Выраженная левожелудочковая недостаточность.
Хирургическое лечение заключается в ушивании или пластике заплатой дефекта межпредсердной перегородки. Мелкие дефекты зашивают, большие закрывают гомотрансплантатами или протезами из пластмассовой губки. При первичном дефекте со значительной митральной недостаточностью дополнительно ушивают расщепленную створку или проводят протезирование митрального клапана. В результате хирургического лечения улучшается состояние больного: уменьшаются одышка, сердцебиение, размеры сердца.
В последние годы возрастает роль устройств для закрытия дефекта (впервые применены в 1976 г.), выбор типа устройства зависит от локализации дефекта. В настоящий момент нет сравнительных исследований между внедрением устройств и хирургическими методами операции, не существует консенсуса по длительному наблюдению после установки устройств и долговременные исходы неизвестны, включая риск развития предсердной аритмии, СН и инсульта, предполагается, что исход будет сопоставим.
При синдроме Лютамбаше хирургическое лечение заключается в одномоментной коррекции — устранении дефекта межпредсердной перегородки и митральной комиссуротомии. Противопоказаниями к операции служат лишь тяжелая стадия легочной гипертензии и резко выраженная дистрофия миокарда, обусловливающая терминальную стадию СН.
Медикаментозная терапия включает симптоматические средства: антиаритмические препараты при фибрилляции предсердий и пароксизмальной суправентрикулярной тахикардии, лечение СН.
Прогноз
Вторичный дефект имеет благоприятное естественное течение в первые 20–30 лет жизни. Причиной смерти при отсутствии оперативной коррекции является правожелудочковая СН, реже — тромбоз ЛА, аритмия. При первичном дефекте течение менее благоприятное, прогноз хуже, раньше возникают клиническая симптоматика и осложнения, основным отягощающим фактором является легочная гипертензия.
АНОМАЛИИ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ
ДЕФЕКТ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ
Определение
Дефект межжелудочковой перегородки — врожденный порок сердца, при котором имеется патологическое сообщение между ПЖ и ЛЖ сердца.
Эпидемиология
Выявляется в 25–30% случаев всех врожденных пороков сердца, одинаково часто у мужчин и женщин.
Патологическая анатомия
Дефекты могут располагаться выше или ниже наджелудочкового гребня, в мембранозной или мышечной части межжелудочковой перегородки, наиболее часты перимембранозные дефекты (75–80%). Мышечные дефекты или дефекты трабекулярной перегородки отмечают в 20% всех дефектов межжелудочковой перегородки.
Приблизительно у половины дефектов небольшие размеры, но они могут варьировать от 1 до 30 мм и более, иметь различную форму: круглую, эллипсовидную, с мягкими или фиброзно измененными краями. При пороке также выявляют гипертрофию миокарда и дилатацию полостей обоих желудочков, предсердий, расширение ствола ЛА, иногда значительное.
Нарушения гемодинамики
Функциональные расстройства зависят прежде всего от размеров отверстия и от состояния легочного сосудистого русла. При небольших дефектах (до 10 мм) возникает значительный градиент давления в ПЖ и ЛЖ, и в систолу происходит незначительный артериовенозный сброс крови через дефект. Из-за низкого сопротивления крови в малом круге кровообращения давление в ПЖ и ЛА либо повышается незначительно, либо остается нормальным. В диастолу в результате повышения конечного диастолического давления в ПЖ часть крови из его полости может возвращаться в левые отделы, вызывая объемную перегрузку левого предсердия и особенно ЛЖ.
Умеренные или большие дефекты вызывают застой в легких и перегрузку объемом ЛЖ, что может приводить к возникновению легочной гипертензии.
Большие дефекты межжелудочковой перегородки не создают препятствия сбросу крови слева направо, оба желудочка функционируют как единая насосная камера с двумя выходами, уравнивая давление в системном и легочном круге кровообращения. Величина сброса крови обратно пропорциональна отношению легочного и системного сосудистого сопротивления. Если общелегочное сопротивление нормальное или повышено, но составляет менее половины от сопротивления в большом круге кровообращения, происходит большой сброс крови, легочный кровоток в 2 раза и более превышает системный, наблюдаются значительное повышение давления в малом круге кровообращения, объемные и систолические перегрузки ЛЖ и ПЖ, что обусловливает развитие выраженной декомпенсации кровообращения. У этих больных очень рано отмечают развитие структурных изменений в легких, а также вторичной легочной гипертензии. Если общелегочное сопротивление составляет половину и больше ОПСС, то объем сброса уменьшается.
Клиническая картина
Клиническая картина зависит от возраста больного, размеров дефекта, величины сосудистого сопротивления легких. При небольших дефектах клинические проявления порока отсутствуют, одышка при физическом напряжении чаще всего является первым проявлением декомпенсации.
При дефектах больших размеров (диаметром >10 мм или более половины диаметра устья аорты) больные жалуются на одышку по типу тахипноэ с участием вспомогательных мышц, ощущение сердцебиения, боль в области сердца, упорный кашель, усиливающийся при перемене положения тела.
При пальпации грудной клетки часто определяют систолическое дрожание в четвертом межреберье слева и в области мечевидного отростка.
Основным клиническим признаком порока является характерный громкий связанный с I тоном голосистолический шум Роже, выслушиваемый у третьего–четвертого межреберья слева от грудины, проводящийся к верхушке сердца.
Диагностика
При небольших дефектах ЭКГ в пределах физиологической нормы. При больших дефектах выявляют неспецифические признаки комбинированной гипертрофии обоих желудочков и предсердий, изменения ST–T, фибрилляцию предсердий, нарушение внутрижелудочковой проводимости.
На рентгенограмме при небольших дефектах сердце нормальных размеров, при больших — кардиомегалия, усиление легочного рисунка за счет переполнения артериального русла. При выраженной легочной гипертензии усилены прикорневые зоны, а сосудистый рисунок периферических отделов легких выглядит «обедненным». Дуга легочного ствола выбухает по левому контуру, при рентгеноскопии отмечают усиление ее пульсации.
ЭхоКГ-исследование с цветовым допплеровским картированием позволяет верифицировать диагноз — непосредственно определить размеры и расположение дефекта, наличие и направление сброса крови. Градиент давления между ЛЖ и ПЖ можно оценить с помощью постоянно-волновой допплерографии.
При эхоКГ-исследовании можно выявить:
- увеличение размеров всех камер сердца;
- гиперкинез стенок ЛЖ;
- визуализирующийся дефект межжелудочковой перегородки (>10 мм);
- турбулентный поток через перегородку слева направо (рис. 3.7).
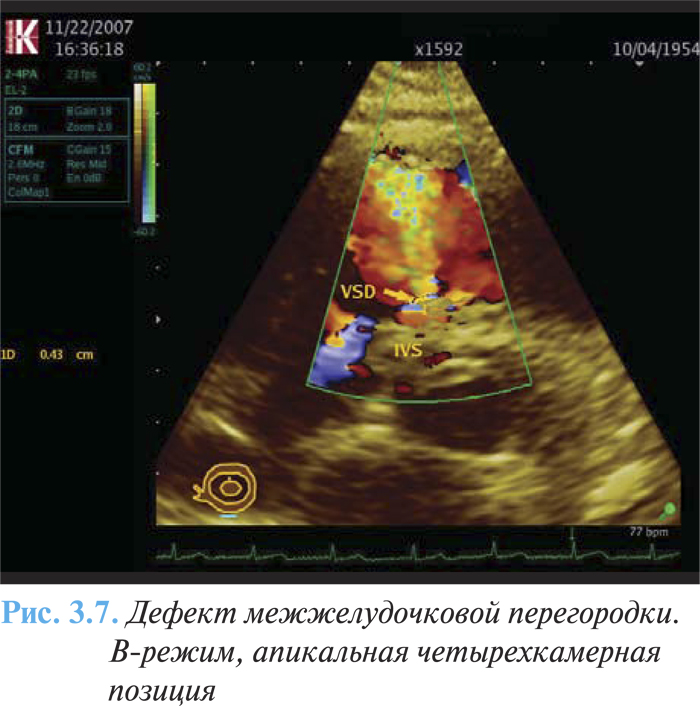
При катетеризации правых отделов сердца отмечают значительное повышение давления в ПЖ и ЛА, а также повышение насыщения крови кислородом, начинающееся на уровне ПЖ и увеличивающееся в легочном стволе.
Селективную ангиокардиографию обычно проводят пациентам в возрасте старше 40 лет при планируемом хирургическом вмешательстве, метод позволяет судить о локализации дефекта, его размерах, а также исключить сопутствующую патологию.
Лечение
Больным с симптомами СН назначают медикаментозную терапию для стабилизации состояния перед проведением хирургической коррекции.
Абсолютными показаниями к операции являются критическое состояние или СН, не поддающаяся консервативной терапии, а также подозрение на развивающиеся необратимые изменения в сосудах легких.
Относительными показаниями для хирургического вмешательства являются большой дефект с признаками значительного сброса крови, частые респираторные заболевания, отставание в физическом развитии.
Хирургическое лечение противопоказано, если систолическое давление в ЛА равно системному и артериовенозный сброс крови составляет менее 40% минутного объема малого круга кровообращения и имеется шунт справа налево.
Прогноз
Спонтанное закрытие дефекта происходит в 15–60% случаев. Требуется диспансерное наблюдение больных из-за возможности возникновения в дальнейшем различных осложнений (поражение проводящей системы сердца, недостаточность трехстворчатого клапана, фибрилляция предсердий). В целом, 25-летняя выживаемость для всех пациентов составляет 87%, смертность повышается с размером дефекта.
У неоперированных больных с изолированным небольшим дефектом и нормальным давлением в ПЖ прогноз благоприятный, хотя у них сохраняется высокий риск развития инфекционного эндокардита. При умеренных и больших дефектах высок риск развития различных осложнений, включая инфекционный эндокардит, аортальную недостаточность, нарушения ритма и проводимости, дисфункцию ЛЖ, внезапную смерть.
КОМПЛЕКС ЭЙЗЕНМЕНГЕРА
Определение
Комплекс Эйзенменгера — высокий дефект межжелудочковой перегородки, смещение аорты вправо и отхождение ее одновременно от обоих желудочков сердца («сидящая верхом аорта»), расширение ЛА.
Эпидемиология
Распространенность порока составляет 4% среди врожденных пороков сердца у взрослых и определяется у 10% больных с дефектами межжелудочковой перегородки.
Нарушения гемодинамики
При этом пороке происходит сброс крови из ЛЖ в правый (через дефект межжелудочковой перегородки) и выброс крови из ПЖ одновременно в аорту и ЛА. Патологические изменения в легочном сосудистом бассейне коррелируют с состоянием гемодинамики и могут быть разделены по степени тяжести. Первая степень характеризуется увеличением легочного кровотока с нормальным средним давлением в ЛА. Вторая степень характеризуется увеличением среднего давления в ЛА, умеренную гипертрофию выявляют в проксимальных сосудах как результат гипертрофии и пролиферации гладких мышц, а также увеличения элементов соединительной ткани. Третья степень характеризуется повышением легочного сосудистого сопротивления, что коррелирует с уменьшенным количеством дистальных легочных сосудов.
Клиническая картина
Клиническая картина во многом сходна с дефектом межжелудочковой перегородки, однако более отчетливо проявляются нарушения гемодинамики. Наиболее частыми клиническими симптомами являются синюшность кожных покровов вследствие смешивания артериальной и венозной крови, одышка, сердцебиение при физической нагрузке, кровохарканье.
Аускультативно слева у грудины у места прикрепления III–IV ребра, а также в проекции аорты выслушивается грубый систолический шум. Диастолический шум обусловлен аортальной недостаточностью.
Диагностика
На ЭКГ нередко отмечают признаки внутрижелудочковой блокады, гипертрофии ПЖ, фибрилляцию и трепетание предсердий. При холтеровском мониторировании ЭКГ у 36% больных выявляют суправентрикулярную аритмию, что является предвестником клинического ухудшения и смерти.
ЭхоКГ и допплеровская эхоКГ в режиме цветового картирования и постоянно-волновом режиме позвляют определить наличие дефекта, направление сброса крови, повышение давления в ПЖ и ЛА.
На рентгенограмме в переднезадней проекции резко выступает дуга ЛА. Сосудистый пучок усилен, корни легких сильно пульсируют («пляска корней»). Размеры сердца увеличены за счет обоих желудочков.
При катетеризации сердца отмечают повышение давления в ПЖ и ЛА. Насыщение венозной крови кислородом может быть равномерно снижено в правых отделах сердца и ЛА или незначительно повышено в ПЖ. При введении контрастного вещества в полость ЛЖ выявляют его переход в полость ПЖ в систолу и дальнейшее одновременное поступление в аорту и ЛА.
Лечение
Медикаментозное лечение симптоматическое, включая лечение СН. Терапия не должна уменьшать постнагрузку из-за увеличения сброса справа налево. Следует назначать антигипертензивные препараты, поскольку некорригированная АГ может повышать риск развития легочных кровотечений. Обычно пациенты хорошо переносят блокаторы β-адренорецепторов.
Назначение антагонистов эндотелина (бозентан) уменьшает функциональный класс СН и улучшает переносимость физических нагрузок. Предварительные результаты рандомизированного плацебо-контролируемого исследования BREATHE-5 свидетельствуют, что бозентан у пациентов с комплексом Эйзенменгера, помимо улучшения переносимости физических нагрузок, снижает легочное сосудистое сопротивление без ухудшения насыщения кислородом крови.
В отличие от первичной легочной гипертензии, где доказана эффективность антикоагулянтов для предотвращения тромбоза ЛА, нет аргументов для их применения у больных с комплексом Эйзенменгера и их не следует назначать из-за повышенного риска возникновения кровотечений. Антикоагулянты показаны при наличии фибрилляции и трепетания предсердий, рецидивирующих тромбоэмболиях, механических протезах клапанов.
Необходимо исключить потенциально нефротоксичные препараты (включая НПВП).
Хирургическое лечение — операция наложения анастомоза — противопоказано, поскольку повышенное давление в системе ЛА сделало бы невозможным правильное функционирование искусственного протока. Нет единого мнения о роли трансплантации у этих больных.
Прогноз
Пациенты могут доживать до среднего возраста. К осложнениям комплекса Эйзенменгера относят легочные кровотечения и эмболии, обусловленные аневризматическими расширениями ЛА в их более мелких ответвлениях.
ИЗОЛИРОВАННЫЙ СТЕНОЗ ЛА
Определение
Изолированный стеноз ЛА характеризуется наличием препятствия на пути поступления крови на уровне клапана легочного ствола.
Эпидемиология
Довольно распространен (9% всех врожденных пороков сердца).
Патологическая анатомия
Морфологически порок неоднороден, обструкция выброса крови из ПЖ может локализоваться на надклапанном, клапанном и/или подклапанном уровнях, выделяют несколько его форм:
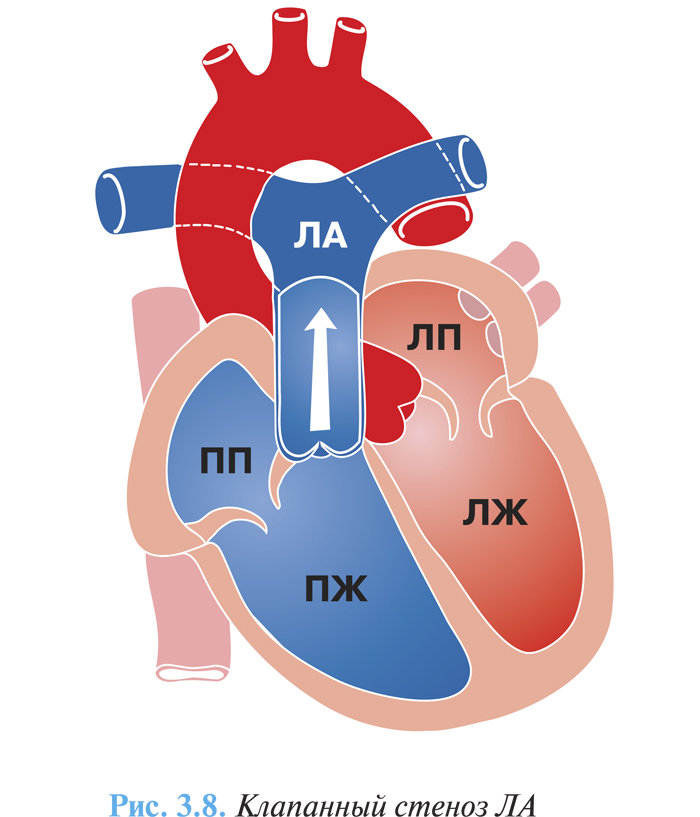
- клапанный стеноз ЛА — наиболее частая форма, порок образуется в результате сращения створок по комиссурам, и клапан получает вид диафрагмы с отверстием округлой или слегка овальной формы диаметром от 1 до 10 мм и более (рис. 3.8);
- инфундибулярный (подклапанный) стеноз образуется за счет фиброзно-мышечной полосы у места соединения полости ПЖ и артериального конуса или за счет гипертрофированных мышц, формирующих суженный выход из ПЖ и располагающихся под клапанами ЛА или ниже в выводном тракте;
- наиболее редкая форма — сужение просвета ЛА, обусловленное неравномерным делением артериального ствола.
Морфологически определяют концентрическую гипертрофию мышц выходного отдела, эндокард утолщается и в выходном отделе нередко отмечают формирование выраженного фиброза.
В стенке ЛА происходят дегенеративные изменения, она истончается, возникает характерное постстенотическое расширение ЛА, которое нередко распространяется и на левую ветвь. Трехстворчатый клапан часто имеет признаки дисплазии.
Нарушения гемодинамики
Препятствие оттоку крови создает перегрузку ПЖ, систолическое давление в нем значительно возрастает (до 200 мм рт. ст. и более), в результате чего образуется систолический градиент давления между ПЖ и ЛА, возникает гипертрофия ПЖ. Систолическое давление в ЛА в большинстве случаев в пределах нормы или слегка понижено. По мере развития гипертрофии миокарда возрастает диастолическое давление в ПЖ, что ведет к повышению давления в правом предсердии, его гипертрофии и дилатации. Степень стеноза с возрастом повышается, поскольку измененный поток крови через суженное отверстие усугубляет клапанную деформацию.
Клиническая картина
Клинические признаки целиком зависят от степени стеноза, часто выявляется физическое недоразвитие. Жалобы на выраженную одышку, особенно после физического напряжения в связи с недостаточной артериализацией легких, боль в сердце, перебои в работе сердца, головокружение, обмороки.
При осмотре выявляют наличие сердечного горба, усиление сердечного толчка, систолическое дрожание передней части грудной стенки во втором–третьем межреберье слева от грудины, перкуторно расширение границ сердца вправо.
Аускультативно определяется интенсивный грубый систолический шум над ЛА, который хорошо проводится к верхней части левой половины грудной клетки и на область спины, усиливается на вдохе, II тон над ЛА при клапанном и подклапанном (инфундибулярном) стенозе ослаблен или отсутствует, при надклапанном стенозе может быть усилен.
Диагностика
На ЭКГ электрическая ось отклонена вправо, часто определяют признаки гипертрофии и перегрузки ПЖ и правого предсердия, которые коррелируют со степенью стеноза.Смещение интервала S–Т вниз и отрицательный зубец Т в правых грудных отведениях свидетельствуют о крайней степени перегрузки.
На рентгенограмме в переднезаднем положении выявляется расширение контура ПЖ. ЛА при подклапанном поражении уменьшена, при надклапанном сужении — расширена с выступающей дугой. Характерно различие между пульсирующим основным стволом ЛА и неподвижными ЛА среднего калибра в области корней легких. Аорта часто бывает недоразвита, ЛЖ небольших размеров, легкие повышенной прозрачности вследствие сниженного кровоснабжения.
ЭхоКГ-исследование позволяет выявить порок и детализировать его анатомическое строение, хотя иногда могут возникать затруднения с визуализацией клапана ЛА. Определяют утолщение створок клапана с неполным открытием их в систолу, уменьшением отверстия из-за сращения створок по комиссурам, а также гипоплазию клапанного кольца. С помощью допплеровского исследования выявляют турбулентный систолический поток в легочном стволе, можно рассчитать градиент давления в месте препятствия между ПЖ и стволом ЛА.
Катетеризация является верифицирующим методом диагностики в неясных случаях: пато-гномоничным признаком служит градиент САД между ПЖ и ЛА. Давление в полостях сердца характерно изменено: в ПЖ повышается до 100–200 мм рт. ст. и выше, в ЛА остается нормальным или несколько сниженным, при выраженном стенозе это снижение значительно (<8 мм рт. ст.). По характеру изменения давления от ЛА к ПЖ можно судить о локализации стеноза, что важно для выбора тактики хирургического лечения: при клапанном стенозе (благоприятном для операции) перепад давления происходит резко, в момент прохождения клапана может регистрироваться отрицательное давление — эффект Вентури; при инфундибулярном (подклапанном) стенозе давление изменяется более постепенно, в полости ЛЖ давление не изменено.
Лечение
Единственным эффективным методом лечения является хирургическая коррекция порока, показаниями к которой являются выраженная клиническая картина порока и наличие градиента давления между ПЖ и ЛА >40 мм рт. ст.
Хирургическое лечение противопоказано при выраженной правожелудочковой недостаточности.
Летальность после хирургического устранения порока не превышает 3%, однако резко повышается при выраженной кардиомегалии, обусловленной гипертрофией и дилатацией правых отделов сердца. Отдаленные результаты лечения хорошие и прямо зависят от возраста больного, в котором сделана операция, и исходной тяжести стеноза.
Прогноз
Зависит от степени стеноза и выраженности клинических проявлений. При незначительном стенозе ЛА пациенты доживают до старости. При более выраженном стенозе и прогрессировании заболевания может развиваться недостаточность ПЖ, являющаяся основной причиной внезапной смерти в молодом возрасте. Частыми осложнениями порока являются туберкулез легких и инфекционный эндокардит.
ТЕТРАДА ФАЛЛО
Определение
В комплекс тетрады Фалло входят четыре аномалии: высокий дефект межжелудочковой перегородки, декстрапозиция аорты (одновременное отхождение аорты от ПЖ и ЛЖ), стеноз или атрезия ЛА с обструкцией выносящего тракта ПЖ, гипертрофия ПЖ.
Эпидемиология
Тетрада Фалло относится к наиболее распространенным «синим» порокам сердца, частота его составляет в старшем возрасте 12–14% всех врожденных пороков сердца, несколько чаще у мужчин.
У 15% больных с тетрадой Фалло выявляют делецию хромосомы 22q11.
Патологическая анатомия
Основу порока составляет недоразвитие выходного отдела ПЖ и смещение конусной перегородки кпереди и влево, что обусловливает стеноз выходного отдела ПЖ, как правило, с нарушением развития фиброзного кольца легочного ствола, клапанного аппарата и очень часто ствола и ветвей (рис. 3.9). Нередко отмечают двустворчатый клапан ЛА.
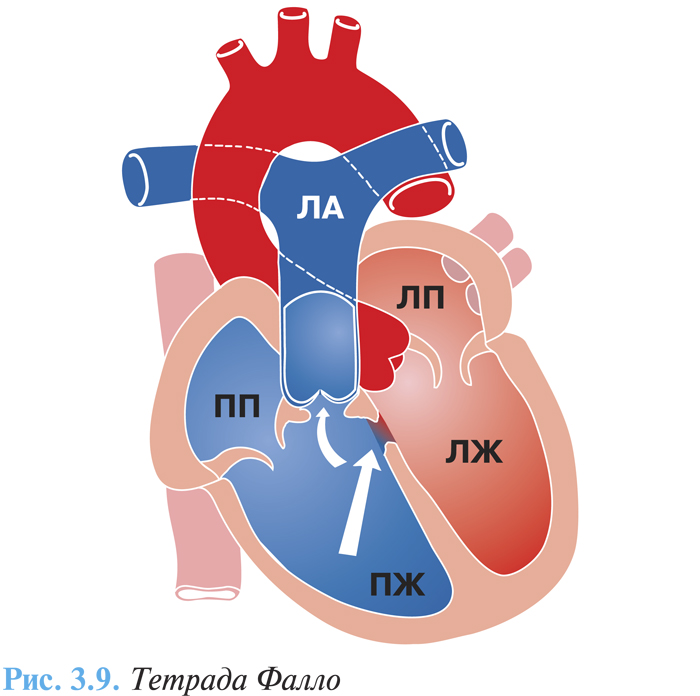
Характерно развитие коллатерального кровообращения в сосудах малого круга кровообращения, изменение сосудов легких, которые претерпевают значительную перестройку: некоторые сосуды склерозируются, облитерируются, в просвете иногда образуются многоствольные сосуды.
Нарушения гемодинамики
Сужение ЛА приводит к перегрузке ПЖ давлением, кроме того, увеличенный возврат крови к ПЖ вызывает одновременно и перегрузку объемом. Сброс крови из ЛЖ в ПЖ не имеет большого значения вследствие значительного повышения давления в ПЖ, поэтому градиент давления между желудочками оказывается незначительным.
В случаях умеренного стеноза ЛА, когда сопротивление выбросу крови в легкие ниже, чем в аорту, сброс крови через дефект межжелудочковой перегородки происходит слева направо и легочный кровоток оказывается увеличенным, что клинически проявляется так называемой бледной (ацианотичной) формой тетрады Фалло. По мере увеличения выраженности стеноза возникает перекрестный, а затем стабильный сброс крови справа налево (веноартериальный), что клинически обозначается переходом в цианотичную («синюю») форму порока.
Клиническая картина
Клинические проявления зависят от степени сужения выходного отдела ПЖ и ЛА и степени гипоксемии. Уже с раннего детства у больных отмечают диффузный цианоз (в аорту одновременно поступает кровь из ПЖ и ЛЖ, происходит смешивание артериальной и венозной крови, что вызывает синюшность кожных покровов), полицитемию и сгущение крови. Могут возникать обильные легочные кровотечения.
Наиболее характерным симптомом являются приступы одышки с появлением цианоза, которые возникают вследствие спазма мышц в выходном отделе ПЖ, в результате чего кровь из него поступает в аорту, при этом увеличивается кислородное голодание и может наступить потеря сознания (гипоксическая кома). Приступ начинается внезапно, с усиления одышки, цианоза, возможны апноэ, судороги с последующим появлением гемипареза, может закончиться летально.
Больные не в состоянии переносить физическую нагрузку, поскольку при напряжении увеличивается сброс венозной крови, усиливается гипоксемия, что ведет к усугублению гипоксии тканей. Типичны одышка при небольшом напряжении, резкая слабость после нагрузки, головокружение, тахикардия, усиление цианоза.
Наиболее частыми клиническими симптомами являются:
- изменение формы ногтей («часовые стекла»);
- деформация пальцев в виде барабанных палочек (как реакция на длительную гипоксемию);
- отставание в физическом развитии;
- дети предпочитают положение «на корточках», при котором создаются особенно благоприятные условия для кровообращения в легких (уменьшается объем венозного сброса крови в аорту);
- судорожный синдром вследствие гипоксии мозга;
- видимые слизистые оболочки и кожные покровы цианотичны;
- АД обычно снижено;
- систолическое дрожание во втором–третьем межреберье, вызванное стенозом устья ЛА.
При аускультации характерными признаками являются ослабление II тона над ЛА, грубый «сухой» систолический шум во втором–третьем межреберье слева у грудины.
Диагностика
На ЭКГ выявляют значительное отклонение электрической оси вправо, признаки выраженной гипертрофии ПЖ и правого предсердия, может регистрироваться нарушение проводимости по правой ножке пучка Гиса.
На рентгенограмме в переднезадней проекции в большинстве случаев отмечается нерезкое выпячивание нижней части правого контура за счет гипертрофии ПЖ. Аорта чаще смещена вправо, пищевод отклонен влево. Легочные поля повышенной прозрачности, в более поздних стадиях может быть усиление рисунка корней легких вследствие развившихся коллатералей.
При эхоКГ-исследовании хорошо выявляют все признаки порока, возможно непосредственное определение величины смещения аорты, дефекта межжелудочковой перегородки, степени легочного стеноза и гипертрофии ПЖ. Наиболее характерными эхоКГ-признаками являются:
- разрыв между межжелудочковой перегородкой и передней стенкой аорты;
- локализация аорты над межжелудочковой перегородкой;
- расширение устья аорты;
- гипертрофия ПЖ;
- клапанный и субклапанный стеноз ЛА;
- гипоплазия кольца клапана ЛА, легочного ствола и проксимальных отделов ЛА;
- заброс контрастного вещества из ПЖ в выходной отдел ЛЖ и аорту;
- при допплеровском исследовании турбулентный систолический поток в ПЖ (шунт слева направо), возможен турбулентный поток в выходной отдел ЛЖ (шунт справа налево);
- дополнительный турбулентный диастолический поток в случае функционирующего аортолегочного анастомоза в легочном стволе;
- наличие градиента давления между ПЖ и ЛА.
Катетеризация полостей сердца и ангиокардиография — наиболее информативные методы диагностики тетрады Фалло. При катетеризации полостей выявляют значительное повышение давления в ПЖ, равное системному градиенту давления между ПЖ и ЛА. Характерным гемодинамическим признаком порока является одинаковое систолическое давление в ПЖ и аорте, куда нередко удается провести катетер через дефект межжелудочковой перегородки. Давление в правом предсердии чаще нормальное, в ЛА умеренно снижено. При введении контрастного вещества в полость ПЖ отмечается одновременное его поступление в ЛА и аорту. Определяется также дефект наполнения в инфундибулярной части ПЖ или клапана ЛА, что позволяет определить степень ее стеноза.
Лечение
Консервативная терапия неэффективна. Хирургическое лечение показано всем больным с тетрадой Фалло и может быть радикальным или паллиативным. Радикальная коррекция порока включает устранение легочного стеноза и закрытие дефекта межжелудочковой перегородки в условиях искусственного кровообращения. При тяжелых формах цианотические приступы, высокий уровень гемоглобина (>200 г/л), быстро ухудшающееся состояние больного может быть показанием к проведению паллиативной операции — наложения аортолегочных анастомозов с целью увеличения легочного кровотока и уменьшения гипоксии. Эти операции позволяют пациентам дожить до 5–6-летнего возраста, когда возможно проведение радикальной коррекции порока с меньшей степенью риска.
Прогноз
Отдаленные результаты радикального хирургического лечения неосложненных форм тетрады Фалло, как правило, хорошие. Ухудшение состояния в отдаленные сроки может быть обусловлено оставшимся в той или иной степени стенозом ЛА, легочной недостаточностью, реканализацией межжелудочковой перегородки, нарушениями ритма сердца. Последние обычно обусловлены травмированием проводящих путей во время оперативного вмешательства, остаточным высоким давлением в ПЖ, выраженной кардиомегалией из-за реканализации межжелудочковой перегородки или развития аневризмы ПЖ. Именно аритмия является причиной внезапной смерти больных в различные сроки после оперативной коррекции порока.
ОТКРЫТЫЙ АРТЕРИАЛЬНЫЙ ПРОТОК
Определение
Открытый артериальный проток (ductus arteriosus, боталлов проток) — незаращение артериального протока плода, соединяющего аорту и ЛА.
Эпидемиология
Отмечают в 5–10% врожденных пороков сердца. У женщин порок выявляют чаще, чем у мужчин (3:1).
Патологическая анатомия
В зависимости от формы протока существуют различные анатомические его типы: цилиндрический, воронкообразный, окончатый, аневризматический. При длительном существовании протока возникает его кальциноз, захватывающий и аорту. Ствол и ветви ЛА расширены. В мелких ЛА и артериолах по мере развития легочной гипертензии происходят характерные морфологические изменения — мышечно-фиброзное перерождение стенок и уменьшение их просвета.
Нарушения гемодинамики
При незаращении артериального протока вследствие разности давления между аортой и ЛА происходит сброс оксигенированной крови в ЛА и далее в легкие, затем через сосуды малого круга кровообращения она возвращается обратно в левую половину сердца и аорту, то есть увеличивается кровоток в малом круге кровообращения и гипертензия в системе ЛА, кровенаполнение левого предсердия и ЛЖ увеличено. При малых размерах протока объем шунта небольшой и давление в ЛА остается нормальным. При большом диаметре протока значительное количество крови поступает в ЛА, затем в левые отделы, вызывая их объемную перегрузку. Давление в аорте передается непосредственно через проток в ЛА, что обусловливает раннее развитие легочной гипертензии, при этом степень последней может быть достаточно высокой.
Клиническая картина
Клиническая симптоматика и течение заболевания варьируют в зависимости от степени нарушения гемодинамики. При небольших и средних размерах протока течение порока длительно может быть бессимптомным и порок обнаруживают случайно. В большинстве случаев в течение долгого времени больные не предъявляют жалоб; в фазе декомпенсации на первый план выступают одышка и сердцебиение. Обычно отмечается бледность кожных покровов. Появляющийся цианоз не является прямым следствием порока, а возникает только при значительном повышении давления в ЛА, обусловленном застоем в легких. Позднему цианозу, как правило, предшествует цианоз при нагрузке (увеличение потребления кислорода периферическими тканями). При большей выраженности шунтов у больных выявляют отставание в физическом развитии, быструю утомляемость, одышку и сердцебиение при физической нагрузке.
САД нормальное или слегка повышено, ДАД — резко снижено и при физической нагрузке может снижаться до нуля, что обусловливает типичное высокое пульсовое давление.
При пальпации определяется усиление верхушечного толчка, парастернальный сердечный горб, увеличение печени и селезенки.
Важным диагностическим признаком является шум над ЛА — грубый протяжный систоло-диастолический «машинный шум», «шум поезда в тоннеле», который сопровождается систоло-диастолическим или систолическим дрожанием («кошачье мурлыканье») в проекции основания сердца. С развитием легочной гипертензии диастолический компонент шума уменьшается, а затем вовсе исчезает. При выравнивании давления в большом и малом круге кровообращения, когда давление крови в ЛА становится выше, чем в аорте, направление кровотока через шунт изменяется и порок становится практически «афоничным».
Диагностика
На ЭКГ при выраженном пороке выявляется отклонение электрической оси вправо (при выраженной легочной гипертензии) или влево, признаки гипертрофии обоих желудочков, иногда регистрируется неполная блокада левой ножки пучка Гиса, предсердные аритмии.
При рентгенологическом исследовании отмечается усиление сосудистого рисунка, соответствующее величине артериовенозного сброса крови, расширение или выбухание ствола ЛА с увеличением диаметра долевых и сегментарных сосудов легкого (кардиоторакальный индекс составляет 55–60%) за счет вначале левого, а затем обоих желудочков и левого предсердия. С возрастом отмечается расширение восходящей части аорты. При отсутствии легочной гипертензии изменения на рентгенограмме могут отсутствовать.
На эхоКГ специфических признаков нет, однако характерно увеличение полости ЛЖ и изменение отношения размера левого предсердия к диаметру аорты (1:2 и более). Как проявление объемной перегрузки ЛЖ отмечено увеличение скорости движения передней створки митрального клапана в диастолу. При проведении допплеровского исследования часто удается визуализировать проток, определить постоянный поток крови из аорты в ЛА и измерить градиент давления. При контрастной эхоКГ определяется заброс контрастного вещества из ЛА в аорту.
Диагноз может быть установлен и/или подтвержден катетеризацией полостей сердца при наличии сатурации кислорода на уровне ЛА и визуализацией протока при аортографии. При катетеризации правых отделов сердца выявляется повышение давления в ПЖ (около 45 мм рт. ст.) и в ЛА (до 100 мм рт. ст). При введении контрастного вещества в полость желудочка определяют его дальнейшее поступление не только в аорту, но и систему ЛА. Наиболее достоверным признаком является проведение катетера из ЛА в аорту, когда он описывает своеобразную характерную кривую. Во время удаления катетера регистрируется кривая аортального, затем легочного давления.
Лечение
Показания к хирургическому лечению зависят от размеров протока, степени легочной гипертензии и клинической картины сердечной декомпенсации.
Отдаленные результаты хирургической коррекции порока показывают, что своевременное оперативное вмешательство позволяет достичь полного выздоровления. У больных с выраженной легочной гипертензией результат оперативного вмешательства зависит от исходного состояния и обратимости структурных и функциональных изменений легочных сосудов и миокарда. Наиболее частыми осложнениями после оперативного вмешательства являются возникновение легочной гипертензии, дисфункции ЛЖ, аритмии.
Наиболее сложным является вопрос об оперативном вмешательстве у больных с высокой легочной гипертензией, поскольку известно, что у них проток часто склерозирован, попытки его перевязки могут привести к тяжелейшему кровотечению вследствие разрыва протока, прорезывания лигатуры и т.д. Абсолютно противопоказано хирургическое лечение больным со сбросом крови справа налево.
Прогноз
Открытый артериальный проток даже небольших размеров ведет к преждевременной смерти, что обусловлено снижением компенсаторных возможностей миокарда и сосудов малого круга кровообращения, присоединением различных осложнений (пневмония, легочная гипертензия, инфекционный эндокардит, СН, разрыв аневризмы и др.) чаще в возрасте старше 40 лет. При большом диаметре протока развивается типичная картина с цианозом и одышкой. При неосложненном течении средняя продолжительность жизни — 50–60 лет, хотя описаны единичные случаи, когда больные доживали до 70–79 лет (диаметр протока у них не превышал 3 мм).
КОАРКТАЦИЯ АОРТЫ
Определение
Коарктация аорты — врожденное сегментарное сужение аорты, располагающееся в области ее перешейка.
Эпидемиология
Является одним из наиболее распространенных — до 15% всех врожденных пороков сердца, у мужчин выявляют в 2–2,5 раза чаще, чем у женщин.
Патологическая анатомия
Коарктация чаще локализуется в области дуги аорты дистальнее места отхождения левой подключичной артерии вблизи от артериального протока или соответствующей ему связки.
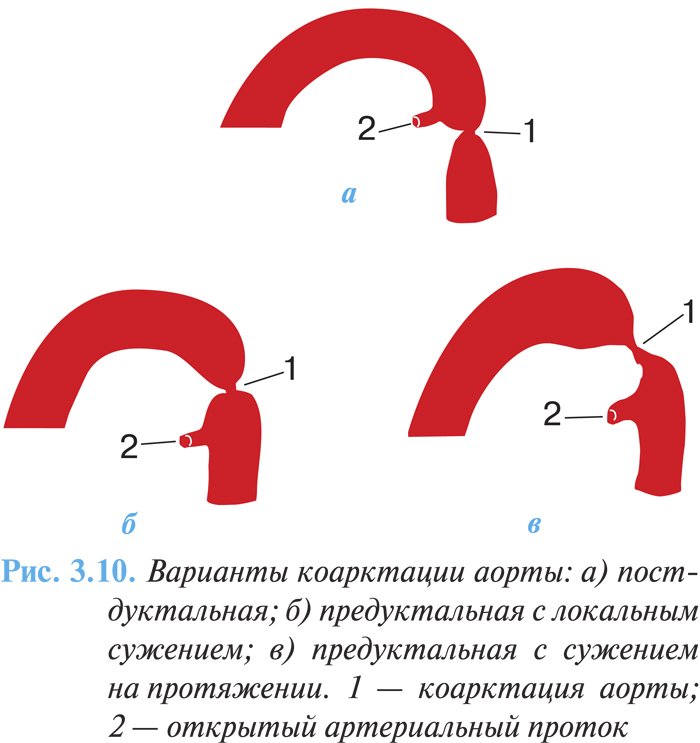
По анатомическим особенностям выделяют три варианта порока:
1) изолированная коарктация аорты;
2) коарктация в сочетании с открытым артериальным протоком:
- постдуктальная (расположенная ниже отхождения открытого артериального протока) (рис. 3.10а);
- юкстадуктальная (проток открывается на уровне сужения);
- предуктальная (артериальный проток отходит ниже уровня коарктации) (рис. 3.10б, в);
3) коарктация аорты в сочетании с другими врожденными пороками сердца (дефектом межжелудочковой, межпредсердной перегородки, стенозом аорты, аневризмой синуса Вальсальвы, транспозицией магистральных сосудов).
В стенке аорты в области коарктации нарастает склеротический процесс, приводящий к утолщению интимы, ее значительным изменениям. Дистально от коарктации стенка истончается, просвет аорты расширяется, иногда аневризматически (вследствие воздействия турбулентного потока крови после прохода места сужения). Характерны склеротические изменения в сосудах верхней половины тела, усиленное развитие коллатералей, по которым кровь переходит из верхней части аорты в постстенотический ее участок, дистрофические изменения миокарда. Особенно значительно расширены подключичные артерии, ветви подмышечной артерии. ЛЖ сердца значительно гипертрофирован, в том числе его мышечный и трабекулярный аппарат, что может вызвать сужение пути оттока.
Нарушения гемодинамики
Механическое препятствие на пути кровотока в аорте вызывает перегрузку ЛЖ и ведет к развитию двух режимов кровообращения: гипертонического (верхняя половина туловища) и гипотонического (брюшная полость, нижние конечности). Проксимальнее места сужения АД повышено, что сопровождается увеличением МОК и работы ЛЖ. Дистальнее препятствия АД (особенно пульсовое) снижено, кровоснабжение частично, а иногда и полностью осуществляется за счет коллатералей.
При постдуктальной коарктации кровь из аорты под высоким давлением сбрасывается через открытый артериальный проток в ЛА, при этом может рано развиться легочная гипертензия. При предуктальном варианте направление сброса через артериальный проток будет определяться разницей давлений между ЛА и нисходящей аортой ниже места коарктации, сброс может быть артериовенозным и веноартериальным. Последний объясняет дифференцированный цианоз (есть на ногах и отсутствует на руках) как клинический признак предуктальной коарктации.
Патогенез АГ при коарктации аорты сложен и до конца не выяснен. Предполагается, что механическая обструкция, активация РААС на фоне недостаточной перфузии почек и органические изменения в сосудистой стенке приводят к увеличению ОПСС.
Клиническая картина
Клиническая картина порока определяется возрастом, анатомическими изменениями, уровнем АД. У детей старшего возраста и взрослых при отсутствии жалоб повышенное АД выявляют случайно. Пациенты жалуются на головную боль, головокружение, повышенную утомляемость, слабость и боль в ногах, судороги мышц ног, зябкость стоп, носовые кровотечения.
При осмотре отмечают:
- диспропорциональное развитие скелетных мышц: мышцы верхней половины гипертрофированы при относительной гипотрофии мышц таза и нижних конечностей;
- повышенную пульсацию при пальпации межреберных артерий (при наклоне вперед с опущенными руками);
- усиленную пульсацию сонных и подключичных артерий, артерий верхних конечностей;
- пульсацию аорты в яремной ямке;
- пульсацию в межлопаточном пространстве, в подмышечной впадине;
- резко ослабленную пульсацию на бедренной артерии и сосудах нижних конечностей, АД на последних нередко снижено или вообще не определяется;
- выраженную АГ (преимущественно систолическую — до 220 мм рт. ст.);
- небольшое пульсовое давление на ногах: САД на ногах на 50–60 мм рт. ст. ниже, чем на руках, при нормальном ДАД;
- верхушечный толчок усилен;
- границы сердечной тупости обычно расширены влево, аорта расширена;
- кожа верхней половины тела теплая, нижней — более холодная, бледная.
Данные аускультации неспецифичны, I тон приглушен, акцент II тона на аорте вследствие повышения АД в начальном отделе аорты, систолический шум средней интенсивности во втором межреберье слева, хорошо проводится в межлопаточное пространство.
Диагностика
На ЭКГ часто выявляют отклонение электрической оси влево, определяют признаки выраженной гипертрофии миокарда ЛЖ.
При рентгенографическом исследовании в переднезадней проекции определяется увеличение ЛЖ, расширение восходящей аорты. Определяется узурация нижних краев ребер вследствие давления резко расширенных и извитых межреберных артерий. В передней косой проекции отчетливо заметна разность в диаметре восходящей и нисходящей частей аорты (тень аорты приобретает вид цифры «3»). Легочный рисунок обычно выражен, сосудистый пучок выбухает справа за счет расширения восходящей части аорты, левый контур его сглажен. Усилена пульсация ЛЖ, восходящей части аорты и плечеголовных сосудов.
С помощью эхоКГ возможна визуализация места сужения аорты, его диаметр и протяженность, а также соотношение с ветвями дуги аорты и открытым артериальным протоком. С помощью допплеровской эхоКГ можно определить систолический турбулентный поток и градиент давления в месте коарктации (рис. 3.11), точно оценить степень обструкции.
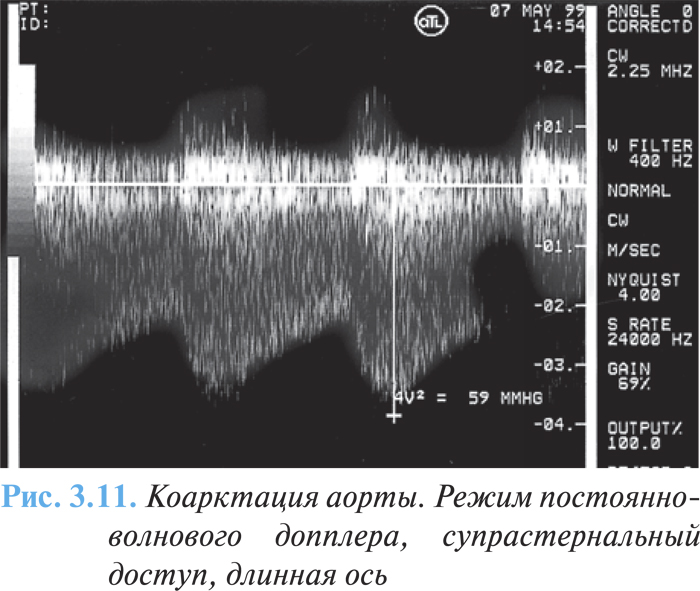
Проведение МРТ имеет преимущества во взрослой популяции для визуализации анатомических особенностей аорты и особенно показано в том случае, если эхоКГ затруднительна.
При катетеризации аорты диагноз порока подтверждается при определении величины градиента систолического давления между восходящей и нисходящей аортой, места сужения, выраженности аневризматических изменений аорты. В полости ЛЖ и аорте выявляется значительное повышение систолического давления. При предуктальном варианте катетер из ЛА беспрепятственно проходит через открытый артериальный проток в нисходящую аорту, где определяется снижение насыщения крови кислородом.
Лечение
Наличие коарктации аорты является абсолютным показанием к хирургическому вмешательству, риск которого неодинаков в различные возрастные периоды и зависит от тяжести состояния больных, анатомии порока и нарушений кровообращения. Показания для оперативной коррекции порока у взрослых включают застойную СН, гипертензию в сосудах верхних конечностей и/или градиент >20 мм рт. ст. Консервативное лечение осложнений (СН, АГ), как правило, малоэффективно.
У больных в возрасте старше 20 лет вопрос о показаниях к оперативному вмешательству следует решать индивидуально: операция необходима пациентам, у которых отсутствуют склеротическая форма легочной гипертензии и тяжелый кальциноз аорты. При наличии выраженной декомпенсации кровообращения хирургическое лечение связано с высоким риском, поэтому показания к операции определяют с осторожностью, оценив сократительную способность миокарда и причину СН.
У взрослых больных восстановление проходимости аорты обычно легко осуществляется путем резекции суженного участка аорты и наложения анастомоза конец в конец или же замещения суженного участка сосудистым протезом. Реже используют операцию прямой или непрямой истмопластики аорты.
Из постоперационных осложнений следует отметить артериальную гипотензию, которая может развиться сразу же после восстановления кровотока по аорте, абдоминальный синдром и кровотечение, возникающие в ближайший послеоперационный период. Специфическим осложнением после успешного устранения коарктации аорты является развитие послеоперационной или так называемой парадоксальной гипертензии, которую отмечают у 50–80% больных, чаще у лиц старшего возраста. Наличие АГ является риском преждевременного развития ИБС, дисфункции ЛЖ, разрыва аневризм аорты или мозговых сосудов, внезапной смерти. Несмотря на отсутствие рандомизированных исследований, блокаторы β-адренорецепторов обычно рекомендуются в качестве препаратов первого выбора.
Прогноз
Порок при отсутствии лечения характеризуется крайне неблагоприятным течением, средняя продолжительность жизни без хирургического лечения — 35 лет. Большинство пациентов умирают от прогрессирующей СН, инфекционного эндокардита, иногда от разрыва аорты или ее аневризмы, инсульта.
Летальность в отдаленные сроки у больных, прооперированных в возрасте старше 25 лет, достигает 35%, у 20% больных нормализации уровня АД не происходит, возможно образование аневризмы аорты и рестеноза. Общая 30-летняя выживаемость после хирургической коррекции порока составляет всего 72%. Основные причины смерти в отдаленный послеоперационный период — СН и ИМ.
АНОМАЛИЯ ЭБШТЕЙНА
Определение
Аномалия развития трехстворчатого клапана, характеризующаяся различной степенью дисплазии и смещением створок клапана в полость ПЖ.
Эпидемиология
Распространенность порока составляет менее 1% всех врожденных пороков сердца, в 1,5 раза чаще у девочек.
Патологическая анатомия
Основная анатомическая особенность порока заключается в смещении трехстворчатого клапана в полость ПЖ по направлению к верхушке сердца, обычно до места соединения приточной и трабекулярной его частей (рис. 3.12). Степень дисплазии, деформации створок, их структур варьируют в широких пределах. Во всех случаях в полость желудочка смещена задняя створка и довольно часто — перегородочная, местом наибольшего смещения является комиссура между ними. Смещенные створки часто резко деформированы, истончены, хорды их укорочены, сосочковые мышцы гипоплазированы. К фиброзному кольцу прикрепляется только малоизмененная передняя створка, являющаяся чаще всего единственной функционирующей створкой трехстворчатого клапана, она значительно увеличена в размерах, нередко является парусообразной, иногда свободный ее край прикрепляется в выводном отделе ПЖ и вызывает стенозирование путей оттока. Патология трехстворчатого клапана сопровождается расширением фиброзного кольца, что приводит к выраженной недостаточности клапана.
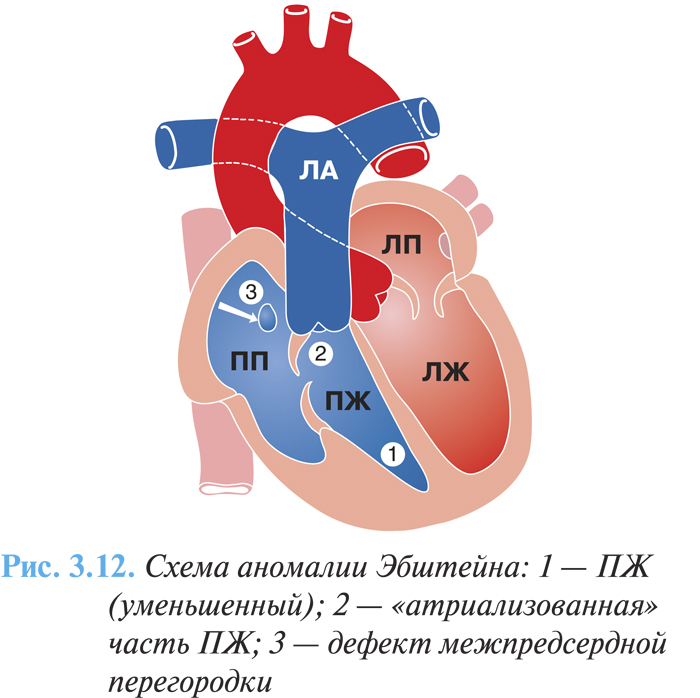
Смещенные створки делят полость ПЖ на две функциональные части: большая (верхняя) часть, расположенная над смещенным клапаном, является «атриализованной» частью ПЖ и образует с правым предсердием общую, большую по объему полость. Меньшая (нижняя) часть располагается под смещенным клапаном и вместе с трабекулярным и выходным отделом функционирует собственно как ПЖ. Стенка правого предсердия гипертрофирована, в то время как стенка предсердной части ПЖ истончена, аневризматически выбухает, толщина ее составляет 1–3 мм, миокард дистальной камеры нормальный или несколько утолщенный.
Нарушения гемодинамики
Изменения гемодинамики определяются степенью смещения и дисплазии трехстворчатого клапана, наличием или отсутствием межпредсердного сообщения. Анатомические изменения приводят к дефициту легочного кровотока, недостаточности трехстворчатого клапана, сбросу крови справа налево через межпредсердное сообщение. Уменьшение легочного кровотока обусловлено меньшим, чем в норме, УОК ПЖ. Кроме этого, отмечают ограничение притока крови в дистальный отдел ПЖ и в диастолу: в систолу правого предсердия «атриализованная» камера ПЖ находится в фазе диастолы, из-за чего продвижение крови в дистальную камеру ПЖ задерживается и эффективность систолы предсердия снижается. В результате давление в правом предсердии повышается, что обусловливает его дилатацию и гипертрофию. При выраженных изменениях возникает неспособность правого предсердия к дальнейшему расширению, что создает препятствие оттоку крови из полых вен.
Клиническая картина
Клинические симптомы разнообразны и зависят от выраженности анатомических нарушений, среди них наиболее часто отмечают одышку, низкую толерантность к физическим нагрузкам, приступы пароксизмальной тахикардии, приводящие к потере сознания.
При осмотре выявляют различную степень цианоза, набухание шейных вен, границы сердечной тупости значительно расширены влево и вправо, определяется «сердечный горб», обусловленный гигантскими размерами правого предсердия и верхней частью ПЖ.
Аускультативно тоны сердца ослаблены, раздвоение I тона, расщепление, ослабление II тона, наличие III и IV тонов, создающих ритм галопа, систолический шум недостаточности трехстворчатого клапана и диастолический шум трикуспидального стеноза у мечевидного отростка справа у грудины.
Диагностика
На ЭКГ электрическая ось чаще отклонена вправо. Зубцы Р в I и II и правых грудных отведениях высокие и остроконечные (гипертрофия и дилатация правого предсердия), амплитуда желудочковых зубцов низкая. Нередко отмечают WPW-синдром (25%) с проявлениями пароксизмальной желудочковой и предсердной тахикардии, экстрасистолии, трепетание и фибрилляцию предсердий. Часто выявляют полную или неполную блокаду правой ножки пучка Гиса, первую степень атриовентрикулярной блокады (40–50%), увеличение интервала P–Q.
На рентгенограмме в переднезадней проекции отмечают повышенную прозрачность легочных полей (за счет обеднения легочного рисунка), резкое увеличение размеров сердца за счет расширенных правых отделов. Тень сердца может иметь шаровидную форму, сосудистый пучок остается узким. Левые отделы не изменены.
ЭхоКГ позволяет установить правильный диагноз у большинства пациентов. При эхоКГ-исследовании выявляют следующие наиболее характерные признаки:
- смещение книзу от фиброзного кольца одной, двух или всех створок трехстворчатого клапана (более чем на 8 мм);
- запаздывание закрытия трехстворчатого клапана по сравнению с митральным (>0,065 с);
- увеличение амплитуды открытия и снижение скорости раннего диастолического закрытия передней створки трехстворчатого клапана;
- деформация эхосигнала от створок;
- объемное увеличение размеров правого предсердия, идентификация «атриализованной» части ПЖ (рис. 3.13).
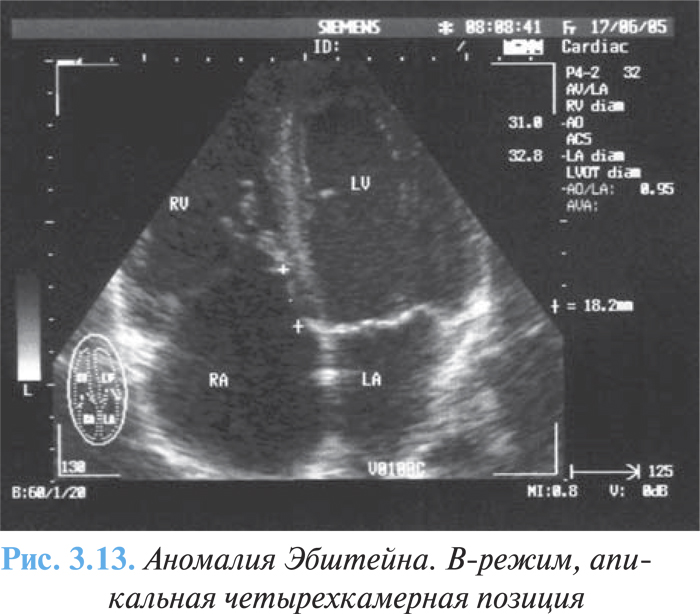
С помощью допплеровской эхоКГ возможна оценка степени недостаточности трехстворчатого клапана, шунтирующего потока справа налево через дефект межпредсердной перегородки.
Катетеризацию полостей сердца необходимо проводить с большой осторожностью, поскольку нередко развиваются опасные для жизни нарушения сердечного ритма. При катетеризации определяется повышение давления в правом предсердии, при проведении катетера в выходной отдел ПЖ нередко регистрируют диастолический градиент, который связан со смещением и дисплазией трехстворчатого клапана или обусловлен относительным стенозированием правого атриовентрикулярного отверстия по сравнению с резко расширенным правым предсердием. Систолическое давление в ПЖ и ЛА обычно нормальное или несколько снижено. Введение контрастного вещества в полость ПЖ помогает выявить резкое расширение пути притока и снижение пути оттока. Важные диагностические признаки можно получить при одновременной регистрации давления и проведении внутриполостной ЭКГ.
Лечение
При бессимптомном течении заболевания хирургическое лечение не проводят. Оперативное вмешательство показано при наличии цианоза, признаков недостаточности кровообращения и тяжелых нарушений ритма сердца, рефрактерных к медикаментозному лечению. Радикальная операция состоит в пластической реконструкции трехстворчатого клапана, при невозможности ее выполнения производят протезирование клапана.
При сочетании аномалии Эбштейна с WPW-синдромом одномоментно выполняют пластику трехстворчатого клапана и деструкцию дополнительных путей проведения импульса. Абляция дополнительных путей часто сопровождается осложнениями и менее результативна (75%), чем у больных без порока (95%).
Не установлено влияния оперативного лечения на возникновение внезапной смерти.
Медикаментозная терапия направлена на лечение СН и устранение нарушений ритма сердца.
Прогноз
Заболевание характеризуется прогрессирующим течением. У неоперированных больных старшего возраста прогностически неблагоприятными факторами и причиной смерти обычно являются кардиомегалия, прогрессирующая СН и нарушения ритма, которые приводят к внезапной смерти (3–4%).
ЛИТЕРАТУРА
- Белоконь Н.А., Подзолков В.П. (1991) Врожденные пороки сердца. Медицина, Москва, 352 с.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практ. руководство. МОРИОН, Киев, 480 с.
- Наказ № 436 Міністерства охорони здоров’я України від 03.07.2006 р. «Про затвердження протоколів надання медичної допомоги за спеціальністю «Кардіологія» (2006). Укр. кардіол. журн., 6: 89-115.
- Оганов Р.Г., Фомина И.Г. (ред.) (2006) Болезни сердца. Руководство для врачей. Литтерра, Москва, 1328 с.
- Шиллер Н., Осипов М.А. (2005) Клиническая эхокардиография. 2-е изд. Практика, Москва, 344 с.
- Apostolopoulou S.C., Magninas A., Cokkinos D.V. et al.(2005) Effect of the oral endothelin antagonist bosentan on the clinical, exercise, and haemodynamic status of patients with pulmonary arterial hypertension related to congenital heart disease. Heart, 91: 1447-1452.
- Book W.M. (2005) Heart failure in the adult patient with congenital heart disease. J. Card. Fail., 11: 306-312.
- Brickner M.E., Hillis L.D., Lange R.A. (2000) Congenital Heart Disease in Adults. N. Engl. J. Med., 342: 256-263.
- Carr J.A., Amaato J.J., Higgins R.S. (2005) Long-term results of surgical coarctectomy in the adolescent and adult with 18-year follow-up. Ann. Thorac. Surg., 79: 1950-1955.
- Celermajer D.S., Greaves K. (2002) Survivors of coarctation repair: fixed but not cured. Heart, 88: 113-114.
- Cho J.M., Puga F.J., Danielson G.K. et al. (2002) Early and long-term results of the surgical treatment of tetralogy of Fallot with pulmonary atresia, with or without major aortopulmonary collaterals. J. Thorac. Cardiovasc. Surg., 124: 70-81.
- Christensen D.D., McConnel M.E., Book W.M. et al. (2005) Initial experience with bosentan therapy in patients with Eisenmenger syndrome. Amer. J. Cardiol., 95: 435-436.
- de Divitis M., Pilla C., Kattenhorn M. et al. (2003) Ambulatory blood pressure, left ventricular mass, and conduit artery function late after successful repair of coarctation of the aorta. J. Amer. Coll. Cardiol., 41: 2259-2265.
- Gatzoulis M.A., Freeman M.A., Siu S.C. et al. (1999) Atrial arrhythmia after surgical closure of atrial septal defects in adults. N. Engl. J. Med., 340: 839-846.
- Gatzoulis M.A., Rogers P., Li W. et al. (2005) Safety and tolerability of bosentan in adults with Eisenmenger physiology. Int. J. Cardiol., 98: 147-151.
- Geva T., Sahn D.J., Powell A.J. (2003) Magnetic resonance imaging of congenital heart disease in adults. Prog. Pediatr. Cardiol., 17: 21-39.
- Goon H.W., Park I.S., Ko J.K. et al. (2005) Computed tomography for the diagnosis of congenital heart disease in pediatric and adult patients. Int. J. Cardiovasc. Imaging., 21: 347-365.
- Ho S.Y., McCarthy K.P., Josen M. et al. (2001) Anatomic-echocardiographic correlates: an introduction to normal and congenitally malformed hearts. Heart, 86(II): 3-11.
- Hoffman J.E., Kaplan S. (2002) The incidence of congenital heart disease. J. Amer. Coll. Cardiol., 39: 1890-1900.
- Holzer R., Cao Q.L., Hijazi Z.M. (2004) State of the art catheter interventions in adults with congenital heart disease. Expert. Rev. Cardiovasc. Ther., 2: 699-711.
- Kreutzer C., DeVive J., Oppido G. et al. (2000) Twenty-five year experience with Rastelli repair foe the transposition of great arteries. J. Thorac. Cardio-vasc.Surg., 120: 211-223.
- Metcalfe K., .Rucka A.K., Smoot L. et al. (2000) Elastin: mutational spectrum in supravalvular aortic stenosis. Eur. J. Hum. Genet., 8: 955-963.
- Moore J.D., Doyle T.P. (2003) Interventional catheter therapy in adults with congenital heart disease. Progr. Pediatr. Cardiol, 17: 61-71.
- Niwa K., Perfloff J.K., Kaplan S. et al. (1999) Eisenmenger syndrome in adults: ventricular septal defect, truncus arteriosus, univentricular heart. J. Amer. Coll. Cardiol., 34: 223-232.
- Perloff J.K. (2003) Clinical recognition of congenital heart disease. 5th ed. W.B. Saunders, Philadelphia, p. 1-5.
- Rigby M. (1999) The era of transcatheter closure of atrial septal defects. Heart, 81: 227-228.
- Therrien J., Dore A., Gersony W. et al. (2001) CCS Consensus conference 2001 update: recommendations for the management of adults with congenital heart disease. Part I. Can. J. Cardiol., 17: 940-959.
- Therrien J., Warnes C., Daliento L. et al. (2001) CCS Consensus conference 2001 update: recommendations for the management of adults with congenital heart disease. Part III. Can. J. Cardiol., 17: 1138-1158.
- Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Williams &Wilkins, Lippincott, 1628 p.
- Warnes C.A. (2003) Bicuspid aortic valve and coarctation: two villains part of a diffuse problem. Heart, 89: 965-966.
- Warnes C.A. (2005) The adult with congenital heart disease: born to be bad? J. Amer. Coll. Cardiol., 46: 18.