Пролапс митрального клапана
Содержание
Определение
Пролапс митрального клапана — провисание (пролабирование) одной или обеих створок митрального клапана в полость левого предсердия в систолу ЛЖ. Термин предложен J.M. Criley и соавторами в 1966 г.
Эпидемиология
Частота регистрации пролапса митрального клапана в различных популяциях составляет от 5 до 20%, эхоКГ-методом — у 10%, методом ангиографии — у 43%. Синдром пролапса возможен у совершенно здоровых людей (5–15% в различных популяциях), у спортсменов, имевших высокие спортивные достижения. Во Фремингемском исследовании частота пролабирования створок митрального клапана была несколько выше у женщин (2,7%), чем у мужчин (2,1%). При изучении различных этнических групп частота выявления пролапса митрального клапана была наибольшей у лиц европеоидной расы — 3,1%, у народов Ближнего Востока — 2,7%, у китайцев — 2,2%.
Этиология и патогенез
Этиология первичного пролапса митрального клапана до настоящего времени окончательно не установлена, хотя частое сочетание его с врожденными метаболическими и структурными нарушениями соединительной ткани свидетельствует в пользу его генетической детерминированности. Первичный пролапс представляет собой обычно доброкачественное наследственное заболевание, при котором патология обусловлена своеобразной «избыточностью» митрального клапана или более длинными, чем в норме, сухожильными хордами.
Пролапс митрального клапана может развиваться в результате миксоматозного поражения клапанного аппарата, вследствие врожденной аномалии развития сердца и сосудов (объемная избыточность, фестончатость и утолщение створок) или генетически обусловленной слабости соединительной ткани.
Наиболее важная миксоматозная дегенерация митрального клапана, характерным признаком которой является накопление кислых мукополисахаридов, что приводит к значительному повышению гидрофильности створки и более рыхлой ее структуре. Миксоматозная дегенерация клапана ассоциирована с повышением активности матриксных металлопротеиназ, синтезом аномального фибриллина, что приводит к утрате нормальной плотности коллагеновой структуры и фрагментации коллагеновых волокон, она может распространяться не только на клапан, но также на сухожильные нити и AV-кольцо. В настоящее время расшифрован один из хромосомных локусов (Xq28), ответственных за развитие миксоматозной дегенерации.
Первичный пролапс митрального клапана может наследоваться по аутосомно-доминантному типу; выявлен локус MMVP1 в хромосоме 16p11.2-p12.1 и локус MMVP2 в хромосоме 11p15.4. Однако более убедительно выглядит концепция полигенной модели наследования, поскольку возможно появление пролапса митрального клапана при наследственных заболеваниях, в развитии которых принимают участие мутации различных генов.
Некоторые авторы рассматривают пролапс митрального клапана в рамках феномена дисплазии соединительной ткани, считая, что особенности строения структур митрального клапана могут быть обусловлены генетически детерминированными дефектами соединительной ткани. У больных с синдромами Элерса — Данло, Марфана, доброкачественной гипермобильности установлена связь между генетически детерминированными особенностями соединительной ткани и пролапсом митрального клапана, в настоящее время идентифицированы точное расположение и варианты мутаций на хромосомах у больных с синдромом Элерса — Данло.
Недавно установлено, что полиморфизм экзона 31-го гена коллагена типа III — альфа 1 (COL3A1) влияет на вероятность возникновения пролапса митрального клапана: при наличии аллеля G риск его возникновения возрастал в 2,3 раза, а у лиц гомозиготных по данному аллелю — в 7,4 раза, полиморфизм экзона 52-го гена COL3А1 такого влияния не оказывал (Chou H.T. et al., 2004).
Вторичный пролапс митрального клапана возникает при различных системных, воспалительных заболеваниях, ИБС (табл. 2.1).
Таблица 2.1
Основные причины и состояния, сочетающиеся с пролапсом митрального клапана
| Установленная или вероятная причина | Возможная причина |
Общее поражение соединительной ткани:
Ревматизм Инфекционный эндокардит ИБС ГКМП Миокардит Перикардит Операции на митральном клапане Травма Миксома левого предсердия Системные заболевания соединительной ткани WPW-синдром |
Врожденные пороки сердца:
«Спортивное» сердце Врожденный синдром удлиненного интервала Q–Т |
Классификация
Классификация пролапса митрального клапана основывается на выраженности провисания створки митрального клапана в левое предсердие по данным трансторакальной эхоКГ:
- I степень — пролабирование створки на 3–6 мм;
- II степень — пролабирование створки на 7–9 мм;
- III степень — пролабирование створки свыше 9 мм;
- отдельно описывается степень выраженности сопутствующей митральной регургитации.
Различают первичный (идиопатический) и вторичный (приобретенный) пролапс митрального клапана.
Клиническая картина
У большинства пациентов клинические признаки могут отсутствовать даже при пролабировании клапана I–II степени, не сопровождающегося гемодинамически значимой митральной регургитацией. К общим жалобам относят астеноневротические: раздражительность, эмоциональную лабильность, нарушение сна, головную боль, снижение работоспособности, быструю утомляемость.
Частым признаком является боль в области сердца (50–65%), которая носит разнообразный характер и локализуется обычно в зоне проекции верхушки сердца или за грудиной, длится от нескольких секунд до суток, не связана с физической нагрузкой, не купируется нитроглицерином.
В происхождении болевого синдрома при пролапсе митрального клапана ведущую роль отводят вегетативной нервной системе, полиморфизм боли свидетельствует о существовании различных механизмов вегетативных нарушений у этих больных.
Ощущение сердцебиения и перебои в работе сердца отмечают у 25–79% больных.
В отдельных случаях пациенты периодически слышат «писк» или шум в груди, который усиливается при физической и психоэмоциональной нагрузке, что нередко сопровождается кардиальным и психоэмоциональным дискомфортом. При аускультации определяется громкий «музыкальный» систолический шум над верхушкой, который чаще бывает изолированным, но может наслаиваться на определенную часть систолического шума, его звучание зависит от положения больного.
У 15–32% пациентов возникает одышка в покое или при незначительной физической нагрузке, неудовлетворенность вдохом, а также ощущение нехватки воздуха и препятствия на пути вдыхаемого воздуха, потребность периодически делать глубокий вдох.
Нередко единственными жалобами больных являются липотимия (комплекс ощущений, предшествующих потере сознания) и синкопальное состояние (4–86%). Ведущая роль в патогенезе синкопальных состояний отводится пароксизмальным нарушениям сердечного ритма (пароксизмальной желудочковой, суправентрикулярной тахикардии и экстрасистолии), ортостатическую гипотензию выявляют у 14% больных. У пациентов с пролапсом митрального клапана наличие обмороков не влияет неблагоприятно на прогноз, также нет доказательств относительно их роли в качестве предвестников внезапной смерти.
У больных выявляют большое разнообразие проявлений дисфункции вегетативной нервной системы, включая эпизоды повышения АД и ортостатической гипотензии, жалобы на повышенное потоотделение, немотивированное ощущение жара, гиперемию отдельных частей тела. Различного рода парестезии, расстройства терморегуляции, сосудистые проявления на коже конечностей (бледность, мраморный рисунок, синюшность), нарушения по типу феномена Рейно (похолодение и онемение пальцев кистей и стоп), повышенную утомляемость со снижением толерантности к физической нагрузке отмечают в 9–60% случаев. Вследствие эмоционально-аффективных и вегетативных расстройств могут возникать вегетативные кризы или «панические атаки», в ряде случаев они лежат в основе предобморочных состояний.
У 30% больных с первичным пролабированием митрального клапана удается выявить внешние признаки дисплазии соединительнотканных структур, которые укладываются в полные или неполные синдромы Марфана или Элерса — Данло.
Гемодинамические нарушения зависят от наличия и степени митральной регургитации, которая существенно влияет на прогноз и повышает риск различных осложнений — фибрилляции предсердий, СН, ишемического инсульта, инфекционного эндокардита.
Диагностика
При аускультации наиболее характерными признаками являются дополнительный тон (щелчок) в середину систолы и/или возникающий после него нарастающий систолический шум, продолжающийся до аортального компонента II тона. У многих больных специфическая звуковая картина отсутствует и не отражает выраженности пролабирования створки.
К достоверным аускультативным проявлениям пролапса митрального клапана относят:
- изолированный мезосистолический щелчок (50–54%);
- изолированный поздний систолический щелчок/шум;
- множественные систолические щелчки;
- пансистолический (голосистолический) шум.
Изменения ЭКГ неспецифичны, у большинства пациентов в покое не имеют отклонений от нормы. Наибольшей чувствительностью для выявления нарушений ритма и проводимости у больных с пролапсом митрального клапана является 24-часовое (холтеровское) мониторирование, на ЭКГ могут определять:
- уплощенные, двугорбые или отрицательные зубцы Т в отведениях II, III и aVF, реже в V5–6 и высокие зубцы Т в отведениях V1–2;
- снижение интервала S–Т в сочетании с инверсией зубца Т в тех же отведениях;
- удлинение интервала Q–T;
- различные нарушения ритма и проводимости: наиболее часто желудочковая и предсердная экстрасистолическая аритмия, пароксизмальная предсердная и желудочковая тахикардия, фибрилляция предсердий.
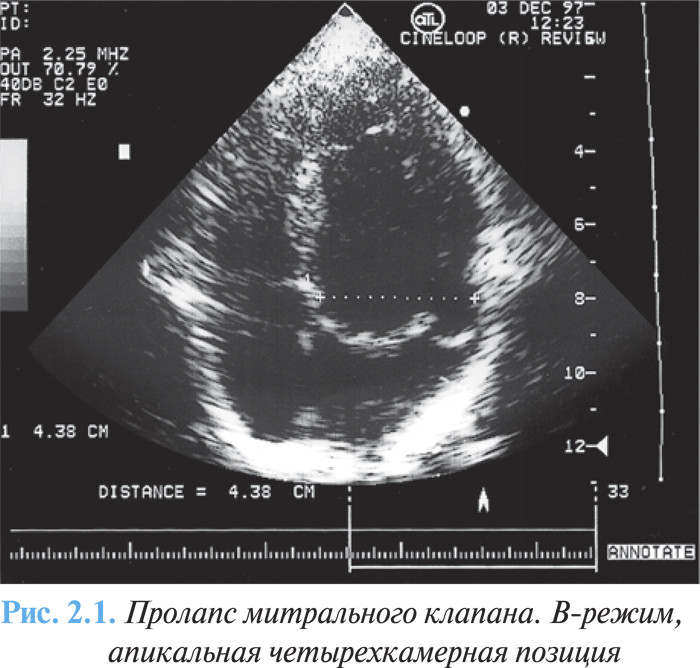
ЭхоКГ и допплеровская эхоКГ являются ключевыми исследованиями в диагностике пролапса митрального клапана. К его специфическим эхоКГ-признакам относят мезосистолическое, позднее и голосистолическое «гамачное» провисание задней или обеих створок митрального клапана в полость левого предсердия (рис. 2.1). Мезосистолическое провисание определяется наиболее часто, довольно стабильно коррелирует с аускультативными и ангиографическими проявлениями.
На эхоКГ в М-режиме пролабирование имеет вид «вопросительного знака, повернутого приблизительно на 90° по часовой стрелке» (рис. 2.2).

Неспецифическими, но высокочувствительными являются следующие эхоКГ-признаки:
- дилатация митрального кольца;
- увеличение экскурсии митрального клапана, диастолический контакт створок с межжелудочковой перегородкой;
- увеличение амплитуды диастолического расхождения створок и скорости открытия передней створки клапана;
- систолическое смещение передней и задней створок митрального клапана (>3 мм) в левое предсердие ниже закрытия митральной линии;
- утолщение створок митрального клапана;
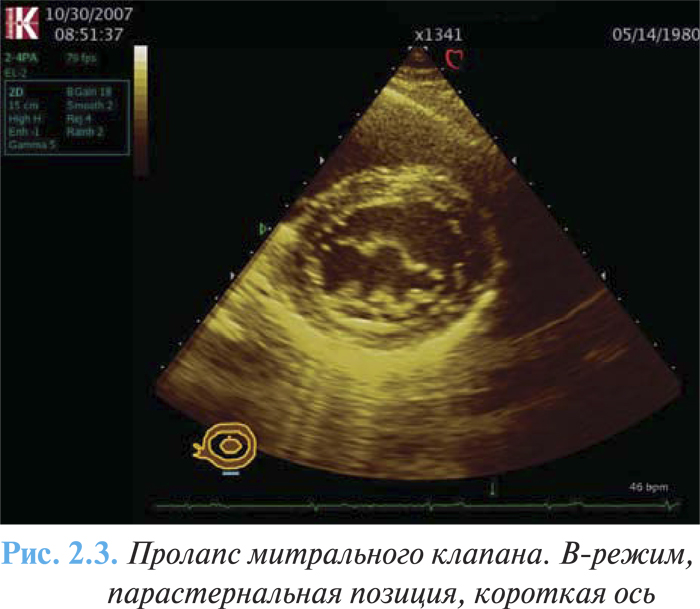
- признаки миксоматозной дегенерации клапана (рис. 2.3);
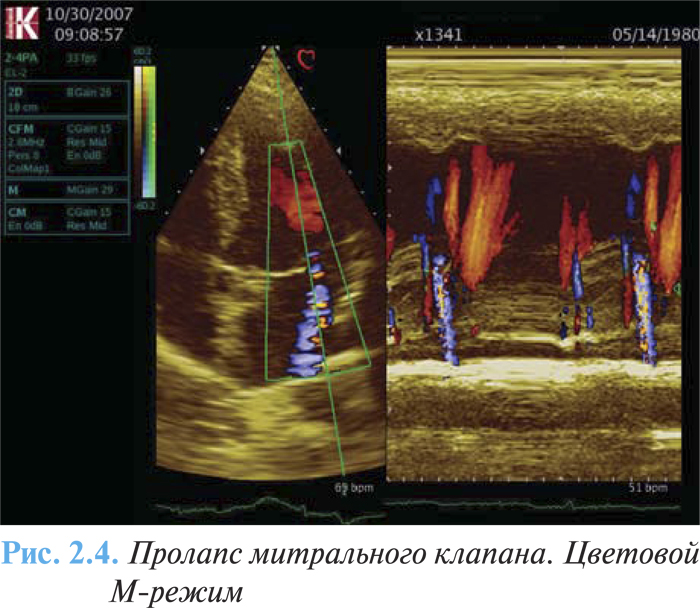
- различная степень митральной регургитации (рис. 2.4).
Разновидностью пансистолического пролапса является так называемый болтающийся клапан (floppy mitral valve), отмечаемый обычно при разрыве хордальных нитей или отрыве папиллярной мышцы. При В-сканировании отчетливо видно нефиксированную папиллярную мышцу, нефиксированную створку митрального клапана, совершающую неправильные, произвольные движения в диастолу и «проваливающуюся» в полость левого предсердия в систолу желудочков. В М-режиме отличительными эхоКГ-особенностями такого клапана является наличие дополнительных эхо-сигналов от створки митрального клапана в полости левого предсердия в систолу желудочка, диастолического дрожания передней створки или парадоксального движения задней митральной створки в систолу и диастолу.
У больных с выраженной митральной регургитацией, наличием миксоматозной дегенерации, увеличения створок, удлинения хорд необходимо не реже чем один раз в полгода проводить ЭКГ и эхоКГ-исследование с целью своевременного предупреждения осложнений.
Радионуклидный метод исследования дает возможность неинвазивным путем количественно рассчитать объем регургитации и объективно оценить степень недостаточности митрального клапана.
Ангиокардиография в большинстве случаев дополняет клинические и эхоКГ-результаты и показана в следующих случаях:
- наличие факторов риска болезней сердца и сосудов;
- выраженная боль в области сердца (при ИБС);
- наличие тяжелой митральной регургитации (объем регургитации >60 мл/сокращение, фракция регургитации >50%, эффективная площадь отверстия регургитации >0,40 см2);
- необходимость проведения дифференциальной диагностики с недостаточностью митрального клапана ревматической или дегенеративной этиологии с ГКМП;
- наличие пролапса митрального клапана в сочетании с дефектом межпредсердной перегородки;
- наличие афоничного («немого») пролапса митрального клапана.
Левосторонняя вентрикулография считается наиболее надежным и точным методом диагностики пролапса митрального клапана, ее конфигурация в систолу при ангиографии помогает диагностировать патологию. Также можно определить сниженную сократимость, дилатацию, кальцификацию митрального отверстия и плохую сократимость базального отрезка ЛЖ.
У 15% больных (у мужчин чаще, чем у женщин) развиваются серьезные осложнения, к которым относят внезапную смерть, инфекционный эндокардит, тромбоэмболии, в том числе церебральных артерий, приводящие к возникновению ишемического инсульта.
В рекомендациях рабочей группы по внезапной смерти Европейского кардиологического общества (2006) приведены основные маркеры риска внезапной смерти у больных с пролапсом митрального клапана:
- остановка сердца или желудочковая тахиаритмия в анамнезе;
- миксоматозные изменения и увеличение размеров створок;
- внезапная смерть близких родственников.
Пролапс митрального клапана выявляют у 10–30% взрослых больных с инфекционным эндокардитом, риск его развития при пролапсе митрального клапана в 3,5–8,2 раза выше, чем в общей популяции, и повышается при наличии миксоматозной дегенерации створок, их увеличении и утолщении, а также наличии митральной регургитации.
Лечение
При желудочковой и наджелудочковой аритмии препаратами выбора являются блокаторы β-адренорецепторов. У многих больных антиаритмическая терапия не оправдана, поскольку проявления нарушений сердечного ритма и проводимости являются незначительными.
Абсолютными показаниями для назначения антиаритмической терапии являются:
- клинически выраженная аритмия, проявляющаяся сердцебиением, головокружением, синкопе, синдромом Морганьи — Адамса — Стокса;
- частые суправентрикулярные и желудочковые экстрасистолы (более 10–12 в 1 мин), особенно если они ранние, групповые или политопные при суправентрикулярной или желудочковой тахикардии, синоаурикулярных, AV и внутрижелудочковых (моно- и бифасцикулярных) блокадах.
Широкое распространение получили хирургические методы лечения опасных нарушений ритма сердца, эффективна радиочастотная абляция дополнительных проводящих путей. У пациентов, перенесших эпизод остановки сердца, с целью вторичной профилактики внезапной смерти рекомендуется имплантация кардиовертера-дефибриллятора.
Некоторыми авторами показана эффективность ингибиторов АПФ у больных с пролапсом митрального клапана и выраженной митральной регургитацией с целью предотвращения прогрессирования снижения сократимости ЛЖ.
Ацетилсалициловую кислоту и дипиридамол можно применять профилактически для предотвращения эмболии мозговых сосудов у больных, имевших даже один необъяснимый церебральный эпизод.
Методом выбора у пациентов с митральной регургитацией является хирургическое лечение (вальвулопластика, протезирование митрального клапана), которое улучшает прогноз, обусловливает снижение риска инфекционного эндокардита, устраняет нарушения ритма сердца.
Больные без клинических симптомов пролапса митрального клапана подлежат профилактическим осмотрам каждые 2–3 года.
Пациентов с пролапсом митрального клапана относят к группе риска развития инфекционного эндокардита, перед проведением различных хирургических вмешательств, в том числе на дыхательных путях, при стоматологических манипуляциях (экстракции зуба, установке имплантатов), урологических вмешательствах (операциях на предстательной железе, цистоскопии) у них рекомендуется проводить антибиотикопрофилактику по следующим показаниям:
- наличие систолического щелчка в сочетании с систолическим шумом;
- наличие изолированного систолического щелчка в сочетании с эхоКГ-признаками пролапса митрального клапана и митральной регургитацией;
- наличие изолированного систолического щелчка в сочетании с эхоКГ-признаками высокого риска: утолщением створок, удлинением хорд, увеличением левого предсердия или ЛЖ.
Тактика первичной профилактики тромбоэмболических осложнений пролапса митрального клапана не разработана.
ЛИТЕРАТУРА
- Дядык А.И., Багрий А.Э., Онищенко А.В. и др. (1999) Пролапс митрального клапана: современные представления о номенклатуре, эпидемиологии, диагностике, прогнозе и тактике ведения. Метод. рекомендации. Донецк, 28 с.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практ. руководство. Морион, Киев, 480 с.
- Мартынов А.И., Степура О.Б., Остроумова О.Д. и др. (1998) Пролапс митрального клапана. Кардиология, 2: 74-81.
- Оганов Р.Г., Фомина И.Г. (ред.) (2006) Болезни сердца: руководство для врачей. Литтерра, Москва,1328 с.
- Фомин В.В., Моисеев С.В., Саркисова И.А. (2001) Клинические особенности и диагностика пролапса митрального клапана. Клин. мед., 79: 65-69.
- Шиллер Н., Осипов М.А.(2005) Клиническая эхокардиография. 2-е изд. Практика, Москва, 344 с.
- Alpert J.S., Dalen J.E., Rahimtoola S.H. (2000) Valvular Heart Disease. Lippincott Williams & Wilkins, USA. 3rd ed., 478 p.
- Avierinos J.F., Gersh B.J., Melton L.J. et al.(2002) Natural history of asymptomatic mitral valve prolapse in the community. Circulation, 106: 1355-1361.
- Barber J.E., Ratliff N.B., Cosgrove D.M. (2001) Myxomatous mitral valve chordae. Mechanical properties. J. Heart Valve Dis, 10: 320-324.
- Braunwald E., Zipes D.P., Libby P. (Eds.) (2001) Heart disease: a textbook of cardiovascular medicine. W.B. Saunders Company, 6th ed., 1: 1-1231.
- Chou H.T., Hung J.S., Chen Y.T. et al. (2004) Association between COL3A1 collagen gene exon 31 polymorphism and risk of floppy mitral valve/mitral valve prolapse. Int. J. Cardiol., 95: 299-305.
- Disse S., Abergel E. Berrebi A. et al. (1999) Mapping of a first locus for autosomal dominant myxomatous mitral-valve prolapse to chromosome 16p11.2-p12.1. Amer. J. Hum. Genet., 65: 1242-1251.
- Fauchier J.P., Babuty D., Fauchier L. et al. (2000) Mitral valve prolapse, arrhythmias and sudden death. Arch. Mal. Coeur. Vaiss., 93: 1541-1547.
- Freed L.A., Acierno Jr. J.S., Dai D. et al. (2003) A locus for autosomal dominant mitral valve prolapse on chromosome 11p15.4. Amer. J. Hum. Genet., 72: 1551-1559.
- Freed L.A., Benjamin E.J., Levy D. et al. (2002) Mitral valve prolapse in general population. The benign nature of echocardiographic features in the Framingham Heart Study. J. Amer. Coll. Cardiol., 40: 1298-1304.
- Hayek E., Gring C.N., Griffin B.P. (2005) Mitral valve prolapse. Lancet, 365: 507-518.
- Iung B., Gohlke-Barwolf C., Tornos P. et al. (2002) Recommendations on the management of the asymptomatic patient with valvular heart disease. Eur. Heart J., 23: 1253-1266.
- Jowan J., Tapia M., Cook R. et al. (2004) Ischemic mitral valve prolapse: mechanisms and implications for valve repair. Eur. J. Cardiothorac. Surg., 26: 1112-1117.
- Kyndt F., Schott J.J., Trochu J.N. et al. (1998) Mapping of X-linked myxomatous valvular dystrophy to chromosome Xq28. Amer. J. Hum. Genet., 62: 627-632.
- Mills W.R., Barber E., Skiles J.A. et al. (2002) Clinical, echocardiographic and biomechanical differences in mitral valve prolapse affecting one or both leaflets. Amer. J. Cardiol., 89: 1394-1399.
- Nasuti J.F., Zhang P.J., Feldman M.D. et al. (2004) Fibrillin and other matrix proteins in mitral valve prolapse syndrome. Ann. Thorac. Surg., 77: 532536.
- Otto C.M. (2001) Evaluation and management of chronic mitral regurgitation. N. Engl. J. Med., 345: 740-746.
- Pellerin D., Brecker S., Veyrat C. et al.(2002) Degenerative mitral valve disease with emphasis on mitral valve prolapse. Heart, 88(IV): 20-28.
- Pepin M., Schwarze U., Superti-Furga A. et al. (2000) Clinical and genetic features of Ehlers-Danlos syndrome type IV, the vascular type. N. Engl. J. Med., 342: 673-680.
- Playford D., Weyman A.E. (2001) Mitral valve prolapse: time for a fresh look. Rev. Cardiovasc. Med., 2: 73-81.
- Porciani M.C., Attanasio M., Lepri V. et al. (2004) Prevalence of cardiovascular manifestations in Marfan syndrome. Ital. Heart J., 5: 647-652.
- Stefanaidas C., Toutouzas P. (2000) Mitral valve prolapse: the merchant of Venice or much ado about nothing? Eur. Heart J., 21: 255-258.
- Theal M., Sleik K., Anand S. et al. (2004) Prevalence of mitral valve prolapse in ethnic groups. Can. J. Cardiol., 20: 511-515.
- Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Lippincott Williams&Wilkins, 1628 p.
- Zoghbi W.A., Enriquez-Sarano M., Foster E. et al. (2003) Recommendations for evaluation of the severity of native valvular regurgitation with two dimensional and Doppler echocardiography. J. Am. Soc. Echocardiogr., 16: 777-802.