Форма выпуска
Состав и формула
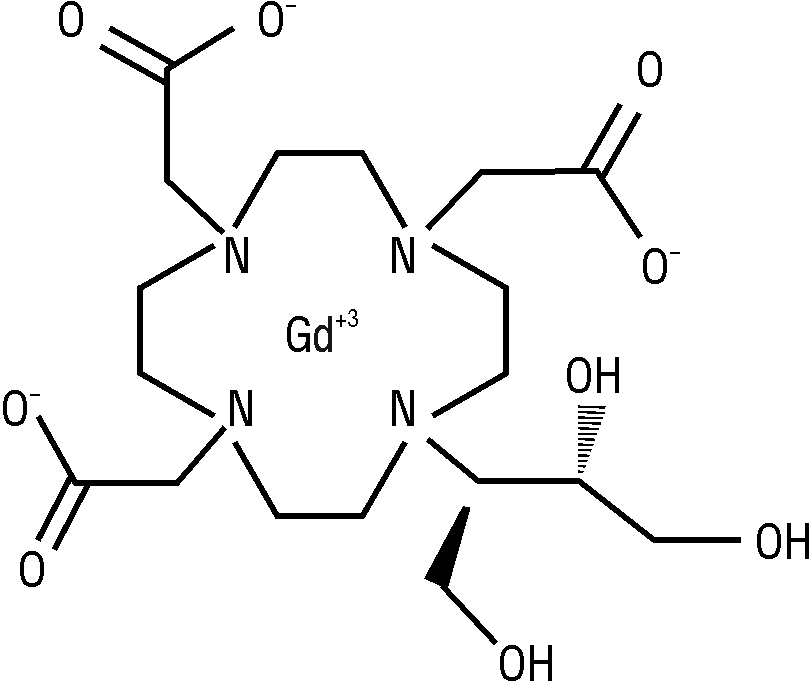
NLM: гадолиний, (10-(2,3-дигидрокси-1-(гидроксиметил)пропил)-1,4,7,10-тетраазациклододекан-1,4,7-триацетато(3-)-N1,N4,N7,N10,O1,O4,O7)-.
Фармакологические свойства
парамагнитное контрастное средство для магнитно-резонансной томографии (МРТ). Повышение контрастности обусловлено активным компонентом гадобутролом, который представляет собой нейтральный комплекс парамагнитного иона гадолиния (III) с макроциклическим лигандом — дигидрокси-гидроксиметилпропилтетраазациклододекан-триуксусной кислотой (бутролом). Индукция локальных колебаний магнитного поля под влиянием сильного магнитного момента гидолиния при Т2-взвешенных импульсных последовательностях приводит к изменению сигнала от тканей (контрастирующему эффекту). Гадобутрол даже в невысоких концентрациях вызывает значительное сокращение времени релаксации. Способность изменять времена релаксации Т1 и Т2, определяемая по влиянию на время спин-решеточной и спин-спиновой релаксации протонов в плазме при рН 7 и 40 °C, составляет количественно примерно 5,6 и 6,5 л/ммоль·с соответственно. Способность влиять на время релаксации лишь в небольшой степени зависит от напряженности магнитного поля. Введение гадобутрола позволяет получить более точную диагностическую информацию по сравнению с данными, получаемыми при обычной МРТ, в областях с высокой проницаемостью ГЭБ или с его отсутствием, обусловливающих нарушение перфузии или увеличение объема внеклеточного пространства, например в случаях первичных опухолей, воспалительных и демиелинизирующих заболеваний. Гадобутрол не активирует систему комплемента, и поэтому вероятность развития анафилактоидных реакций крайне низка. Не ингибирует активные ферменты. Результаты клинических испытаний свидетельствуют об отсутствии отрицательного влияния гадобутрола на общее самочувствие, а также на функции печени, почек и сердечно-сосудистой системы.
Фармакокинетика гадобутрола сходна с фармакокинетикой других высокогидрофильных биологически инертных веществ, выделяемых почками (например маннитола или инулина). Введенный в/в гадобутрол быстро распределяется во внеклеточном пространстве и в неизмененной форме выводится почками путем клубочковой фильтрации. Не связывается с белками плазмы крови. Экстраренальное выведение препарата настолько незначительно, что может не учитываться. Показатели фармакокинетики у человека пропорциональны вводимой дозе гадобутрола. Если доза гадобутрола не превышает 0,4 ммоль/кг массы тела, после начальной фазы распределения наступает фаза элиминации и его уровень в плазме крови уменьшается с периодом полужизни 1,81 ч (1,33–2,13 ч), что соответствует скорости выведения почками. При дозе гадобутрола 0,1 ммоль/кг массы тела через 2 мин после инъекции его уровень в плазме крови составлял 0,59 ммоль/л, а через 60 мин после инъекции — 0,3 ммоль/л. В течение 2 ч с мочой выводится более 50% введенной дозы, а в течение 12 ч — более 90%. Если введенная доза гадобутрола равна 0,1 ммоль/кг массы тела, то 100±2,6% этой дозы выводится из организма за 72 ч. Почечный клиренс гадобутрола у здоровых лиц составляет от 1,1 до 1,7 мл/мин·кг; таким образом, он сравним с клиренсом инулина, что свидетельствует о преимущественном выведении гадобутрола путем клубочковой фильтрации. Менее 0,1% введенного вещества выводится из организма с калом. Метаболиты в плазме крови и моче не выявляют. Период полужизни гадобутрола у больных с нарушенной функцией почек увеличивается пропорционально степени снижения клубочковой фильтрации. У больных с легкими или умеренными нарушениями функции почек гадобутрол полностью выводится с мочой в течение 72 ч. У больных с тяжелыми нарушениями функции почек 80% введенной дозы выводится с мочой в течение 120 ч.
Показания
повышение контрастности при проведении МРТ области головы и позвоночника (краниальной и спинальной томографии). Введение гадобутрола увеличивает возможности получения диагностической информации в областях, где ГЭБ проницаем или отсутствует, с измененной перфузией или повышенным размером внеклеточного пространства, например, в случае первичных или вторичных опухолей, воспалительных и демиелинизирующих заболеваний. Для спинальной МРТ: проведение дифференциального диагноза между интра- и экстрамедуллярными опухолями; выявление границ солидных опухолей в спинномозговом канале и определение распространенности интрамедуллярной опухоли. Гадобутрол обладает особыми преимуществами при наличии показаний к применению магнитно-резонансных контрастных средств в высоких дозах, например в случаях, когда выявление или исключение дополнительных очагов поражения может повлиять на проводимое лечение или врачебную тактику, а также при выявлении мелких повреждений и для визуализации поражений, трудно контрастируемых обычными средствами. Гадобутрол показан также для перфузионных исследований (при диагностике инсульта, распознавании очаговой ишемии мозга и оценке кровоснабжения опухоли).
Применение
необходимую дозу вводят в/в в виде болюса. Проведение МРТ с повышенной контрастностью можно начинать вскоре после инъекции (в зависимости от применяемой импульсной последовательности и схемы исследования). Оптимальное контрастирование обычно наблюдается примерно в течение 15 мин после введения гадобутрола (это время зависит от особенностей повреждения и характера ткани). Обычно повышенная контрастность сохраняется до 45 мин после введения гадобутрола.
При использовании всех МРТ-контрастных средств могут наблюдаться такие побочные эффекты, как тошнота и рвота. Поэтому, чтобы свести к минимуму риск рвоты и возможной аспирации, больной должен воздерживаться от приема пищи в течение 2 ч до исследования. При в/в введении контрастного средства больной (по возможности) должен находиться в положении лежа на спине. После введения гадобутрола больной должен оставаться под наблюдением врача как минимум 30 мин, поскольку, как показывает опыт использования контрастных средств, большинство нежелательных побочных явлений наблюдается в этот период. Для исследований с повышенной контрастностью наиболее пригодны при сканировании Т1-взвешенные импульсные последовательности. Для перфузионных исследований головного мозга рекомендуют применять Т2-взвешенные импульсные последовательности. Набирать гадобутрол в обычный шприц следует только непосредственно перед проведением исследования. Неиспользованная в ходе одного исследования часть препарата должна быть уничтожена. Выбирая режим дозирования для взрослых, следует руководствоваться следующими правилами. При МРТ области головы и позвоночника (краниальная и спинальная томография), как правило, достаточным является в/в введение гадобутрола (1,0 ммоль/мл) в дозе 0,1 мл/кг массы тела (что эквивалентно 0,1 ммоль/кг массы тела).
Если несмотря на нормальную МРТ с повышенной контрастностью остаются подозрения о наличии патологии или если необходима более точная информация о числе, размере и распространенности поражений для выработки врачебной тактики и лечения, то диагностическую эффективность исследования можно повысить, введя дополнительно р-р гадобутрола (1,0 ммоль/мл) в дозе 0,1–0,2 мл/кг массы тела в течение 30 мин после предыдущей инъекции. Чтобы исключить метастазы или рецидив опухоли, вводят р-р гадобутрола в дозе 0,3 мл/кг массы тела, что часто способствует повышению диагностической эффективности исследования. Это относится к поражениям со слабой выраженностью сети кровеносных сосудов, с малым внеклеточным пространством или сочетанием этих факторов, а также к использованию при сканировании относительно менее интенсивных Т1-взвешенных импульсных последовательностей. Для перфузионных исследований головного мозга рекомендуется применять Т2-взвешенные импульсные последовательности в комбинации с МРТ головного и спинного мозга для выявления объемных поражений или локальной ишемии при отсутствии предположений об объемных поражениях.
Для проведения данного исследования рекомендуется использовать инжектор; р-р гадобутрола (1,0 ммоль/мл) вводят в дозе 0,3 мл на 1 кг массы тела со скоростью 3–5 мл/сек.
При необходимости дозу можно повысить до 0,5 мл/кг массы тела.
При почечной недостаточности доза р-ра гадобутрола должна быть не выше 0,1 мл/кг массы тела. Клинический опыт применения гадобутрола у больных младше 18 лет отсутствует.
Противопоказания
повышенная чувствительность к гадобутролу.
Побочные эффекты
со стороны организма в целом: во время болюсного введения или сразу после него может возникать преходящее ощущение необычного вкуса или запаха; иногда — тошнота и рвота; отмечены случаи вазодилатации и артериальной гипотензии. Сообщалось также о случаях преходящих головных болей и головокружения. Имеются сообщения о возникновении судорог, озноба и обмороков после введения подобных препаратов, однако причинная связь с их введением пока не доказана. Аллергические реакции: реакции гиперчувствительности на введение гадобутрола чаще развиваются у больных, предрасположенных к аллергии. В редких случаях анафилактоидные реакции сопровождаются нарушениями дыхания и другими симптомами, достигающими степени анафилактического шока. Иногда после введения гадобутрола наблюдаются кожные реакции (сыпь, крапивница). Местные реакции: в месте инъекции вследствие венопункции или введения контрастного препарата возможно кратковременное слабое или умеренное ощущение холода, тепла или боли. Прочие: случайное введение гадобутрола в околососудистые ткани может вызвать боль продолжительностью до нескольких минут. Других тканевых реакций не наблюдалось. Применение гадобутрола в ряде случаев может вызывать отсроченные (через несколько часов или дней) реакции.
Особые указания
с осторожностью назначают гадобутрол больным с тяжелыми нарушениями функции почек, поскольку в данной ситуации выведение контрастного вещества замедленно. В особо тяжелых случаях следует удалить гадобутрол из организма с помощью гемодиализа. После 3 курсов диализа из организма выводится примерно 98% контрастного вещества. До настоящего времени нарушений функции почек при введении препарата отмечено не было. С осторожностью назначают гадобутрол больным с тяжелыми сердечно-сосудистыми заболеваниями, хотя соответствующая информация пока носит ограниченный характер. При использовании гадолинийсодержащих магнитно-резонансных контрастных средств сообщалось о возникновении в ряде случаев анафилактоидных реакций. Подобные реакции могут развиться и при применении гадобутрола. Решение о применении гадобутрола у больных с предрасположенностью к аллергии должно быть особенно тщательно взвешенным, при этом необходимо учитывать соотношение риска и пользы. При проведении исследования необходимо иметь инструменты и препараты для проведения реанимационных мероприятий. Гадобутрол, подобно другим магнитно-резонансным контрастным средствам, содержащим хелат гадолиния, требует особых предосторожностей при назначении больным с низким порогом судорожной активности. Выраженные состояния возбуждения, беспокойства и боли могут повысить риск развития побочных реакций или усилить побочные реакции, обусловленные введением контрастного средства.
Гадобутрол не рекомендуется применять в период беременности за исключением случаев крайней необходимости, поскольку данные о его применении в этот период отсутствуют (экспериментальные исследования не выявили эмбриотоксического или тератогенного действия препарата). В экспериментальных исследованиях установлено, что гадобутрол в минимальных количествах (менее 0,01% введенной дозы) попадает в грудное молоко. Поэтому после введения гадобутрола кормление грудью должно быть прервано по меньшей мере на 24 ч.
Взаимодействия
не описаны.
Передозировка
до настоящего времени не отмечалась. Риск развития острой токсичности в связи с применением гадобутрола маловероятен. При случайной передозировке гадобутрол может быть выведен из организма с помощью экстракорпорального диализа.




